一种乳腺癌靶向的壳聚糖接枝聚合物载药复合材料的制备方法与流程
本发明属于纳米材料领域,特别涉及一种乳腺癌靶向的壳聚糖接枝聚合物载药复合材料的制备方法。
背景技术:
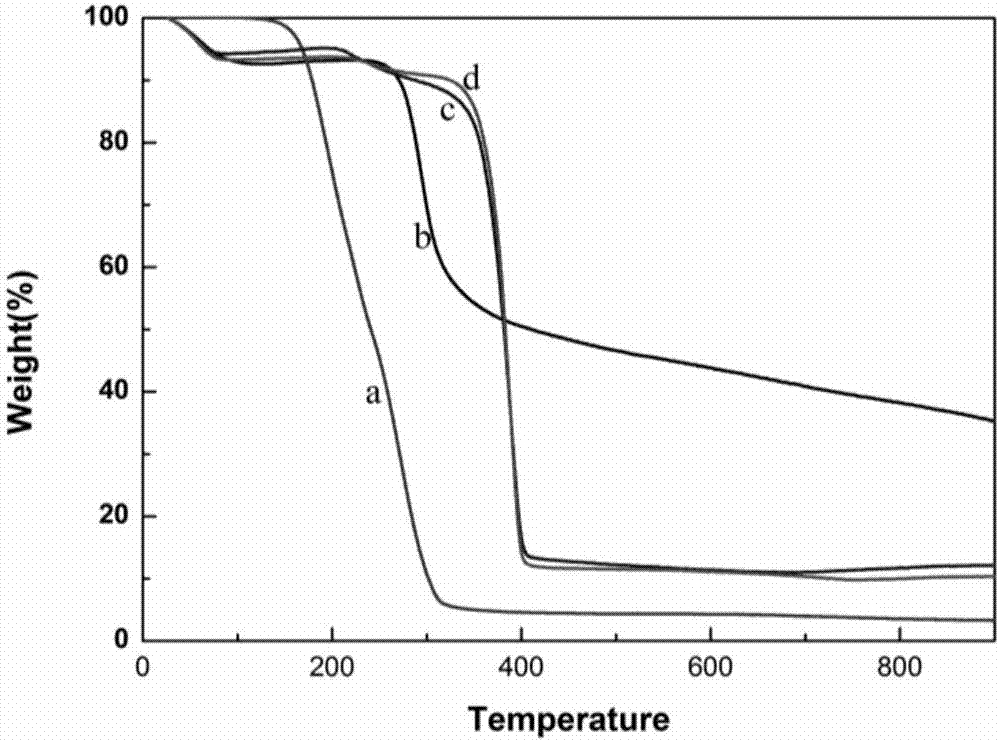
:壳聚糖作为一种天然的阳离子多糖,来源广泛并且价格比较便宜、没有毒害,具有良好的生物相容性和生物可降解性等优点,可广泛应用于医药、食品及还有化工等领域。但壳聚糖也存在很多的不足,壳聚糖分子间存在氢键使得壳聚糖结晶度高,因此它不溶于一般的有机溶剂,从而大大限制了壳聚糖的应用。所以壳聚糖的改性研究应运而生,并取得了许多进展。目前,伴随着可控/活性自由基聚合在合成结构明确、分子量可控高分子方面的发展,壳聚糖的可控接枝改性也取得了十分不错的成绩。在壳聚糖分子中键合、亲水性的或具有某种特殊功能的合成高分子,可以改善壳聚糖的某些性能,提高壳聚糖的应用范围。另外,CS也被认为是具有pH敏感性质的天然聚合物。壳聚糖的接枝聚合物不仅具有壳聚糖的特点,而且具有合成聚合物的优点。由于其在药物递送系统开发中的潜力已经广泛应用于制药工业。紫杉醇是从红豆杉属植物紫杉的树干、树皮中提取的一种天然抗肿瘤药物,对许多癌症均具有明显的疗效。紫杉醇的水溶性极低,为增加其溶解度,通常采用聚氧乙烯蓖麻油和乙醇溶解后给药,但给药后存在严重过敏反应、中性粒细胞减少等毒副作用,使其临床应用受限。为消除毒副作用,提高紫杉醇在水中的分散性,相关学者探索了很多给药技术,如制作成脂质体、环糊精包埋、制备成乳液、制作成微球和聚合物纳米粒等,从而改善紫杉醇的给药方式和疗效。K237肽(HTMYYHHYQHHL-NH2)是一种从噬菌体展示文库中分离得到的12-mer多肽,能够结合KDR/Flk-1酪氨酸激酶(在肿瘤新生血管上过度表达的血管内皮生长因子的两种受体之一)具有高的亲和力和特异性。纳米技术的优异特性有望遏制肿瘤转移性传播,特别是可以将不同的治疗策略结合在一个平台上,通过EDC-NHS技术将肿瘤新蛋白靶向K237肽缀合到纳米颗粒的表面,经过K237肽修饰后的壳聚糖接枝聚合物在乳腺癌细胞的靶向治疗中具有良好的研究前景。技术实现要素:本发明所要解决的技术问题是提供一种乳腺癌靶向的壳聚糖接枝聚合物载药复合材料的制备方法,该方法操作简单、反应条件温和。壳聚糖接枝聚合物纳米颗粒粒径小于100nm能最大程度到达乳腺癌被特定组织或细胞选择性代谢,且具有pH敏感型释放及乳腺癌靶向的特性。本发明的一种乳腺癌靶向的壳聚糖接枝聚合物载药复合材料的制备方法,包括:(1)将CS-g-PNIPAM溶于HAc溶液中,搅拌至溶解,调节pH为4-6,加入活化的K237肽溶液,搅拌反应,透析,冷冻干燥,得到壳聚糖接枝聚合物K237-CS-g-PNIPAM;其中K237肽与CS-g-PNIPAM的质量比为1:1~2;(2)将步骤(1)得到的K237-CS-g-PNIPAM溶于DMF中,加入紫杉醇PTX,搅拌反应,透析,冷冻干燥,得到乳腺癌靶向的壳聚糖接枝聚合物载药复合材料K237-CS-g-PNIPAM/PTX;其中PTX与K237-CS-g-PNIPAM的质量比为1:2~5。所述步骤(1)中CS-g-PNIPAM是通过将壳聚糖CS溶解于浓度为1%的醋酸溶液中,加入甲醇搅拌至澄清,再滴加入乙酸酐溶液,室温搅拌反应,然后用浓度为10%的NaOH溶液析出沉淀,经过滤、烘干得到乙酰化壳聚糖,溶于二甲基甲酰胺DMF搅拌溶解,加入链转移剂2-(十二烷基三硫代碳酸酯基)-2-甲基丙酸DDACT、催化剂4-(N,N-二甲基氨基)吡啶DMAP、脱水剂二环己基碳二亚胺DCC,室温搅拌反应,经提纯、冻干得到壳聚糖的RAFT试剂溶于二甲基甲酰胺DMF中,氮气保护下,加入NIPAm和引发剂偶氮二异丁腈AIBN,油浴反应,经提纯制得。所述步骤(1)中HAc溶液的浓度为1%。所述步骤(1)中调节pH值采用浓度为1%的NaOH溶液。所述步骤(1)中透析采用MWCO=3500的透析袋。所述步骤(1)中活化的K237肽溶液是通过将K237肽溶于浓度为1%的HAc-NaAc溶液中,加入EDC和NHS,磁力搅拌8~12h制得;其中K237肽、EDC和NHS的质量比为20~22:40~110:20~70。所述步骤(1)中搅拌均为磁力搅拌,搅拌活化时间为8~12h,继续搅拌反应的时间为22~26h。所述步骤(2)中搅拌反应的时间为22~26h。所述步骤(2)中冷冻干燥的时间为2~4天。有益效果(1)本发明利用壳聚糖与紫杉醇之间的物理吸附作用,纳米颗粒的疏水核可负载大量治疗药物,合成含紫杉醇的乳腺癌靶向的壳聚糖接枝聚合物载药复合材料,制备方法操作简单、实验条件温和。(2)本发明中壳聚糖接枝聚合物纳米颗粒粒径小于100nm能最大程度到达乳腺癌被特定组织或细胞选择性代谢。(3)本发明的紫杉醇的乳腺癌靶向的壳聚糖接枝聚合物载药复合材料,能够长效缓释。且具有pH敏感型输送,在较低pH值环境下释放率高,适合肿瘤组织的微环境,具有应用其做后续相关实验分析的潜力。(4)本发明乳腺癌靶向的壳聚糖接枝聚合物中的K237肽可以实现其对乳腺癌癌细胞的主动靶向作用,并能进一步研究其体内循行和代谢分布。附图说明图1为实施例1中CS-g-PNIPAM、K237-CS-g-PNIPAM的DLS结果。图2为实施例1中CS-RAFT(a)、CS(b)、CS-g-PNIPAM(c)、K237-CS-g-PNIPAM(d)的TGA结果。图3为实施例1中CS-g-PNIPAM(左)、K237-CS-g-PNIPAM(右)的TEM图。图4A为实施例3中K237-CS-g-PNIPAM/PTX在不同pH环境下的药物释放曲线。图4B为实施例4中K237-CS-g-PNIPAM/PTX在不同温度环境下的药物释放曲线。图5为实施例5中不同浓度的PTX、K237-CS-g-PNIPAM和K237-CS-g-PNIPAM/PTX对L929细胞的MTT细胞毒性结果。图6为实施例5中不同浓度的PTX、K237-CS-g-PNIPAM和K237-CS-g-PNIPAM/PTX对MCF-7细胞的MTT细胞毒性结果。图7为实施例6中K237-CS-g-PNIPAM、K237-CS-g-PNIPAM/PTX对MBA-MD-231及L929细胞的激光共聚焦显微镜结果。具体实施方式下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。此外应理解,在阅读了本发明讲授的内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。实施例1(1)将5g壳聚糖CS溶解于250mL1%醋酸溶液中,搅拌使其完全溶解,缓慢加入250mL甲醇搅拌至澄清,再滴加入1mL乙酸酐溶液,室温搅拌反应3.5h,加入10%NaOH溶液析出溶液中的壳聚糖,经过滤、烘干得到乙酰化壳聚糖,研磨成细细的粉末备用。将0.298g得到的乙酰化壳聚糖溶于5mLDMF中搅拌溶解,加入0.370gDDACT、0.015gDMAP、0.205gDCC,室温搅拌反应48h,倒入冰水,冰水浴过夜,用MWCO=3500的透析袋透析三天,然后冻干得到壳聚糖的RAFT试剂。将0.047g得到的壳聚糖RAFT试剂溶于5mLDMF中,在氮气氛下磁力搅拌4.5h使其完全溶解,加入0.0016gAIBN作为引发剂、0.5gNIPAm氮气保护下60℃油浴反应24h,加入50ml乙醚沉淀3次,纯化后得到壳聚糖温敏嵌段共聚物CS-g-NIPAM。(2)将20mgK237肽溶于2ml1%HAc-NaAc溶液中,加入40mgEDC和20mgNHS磁力搅拌活化8h,得到活化的K237溶液;将25mgCS-g-PNIPAM溶于1%HAc缓冲溶液中,搅拌至溶解,加入1%NaOH调节pH为6,缓慢加入上述活化的K237溶液继续搅拌反应24h,采用MWCO=3500的透析袋透析,冷冻干燥,得到壳聚糖接枝聚合物K237-CS-g-PNIPAM。(3)将25mgK237-CS-g-PNIPAM溶于5mlDMF中,加入10mg紫杉醇PTX,搅拌反应24h,透析除去未连接上的PTX,冷冻干燥3天,得到乳腺癌靶向的壳聚糖接枝聚合物载药复合材料K237-CS-g-PNIPAM/PTX。本实施例中CS、N-acetyl、CS-RAFT、CS-g-PNIPAM、K237-CS-g-PNIPAM的Zeta电位如表1所示。表1实施例1中各部分化合物的Zeta电位值化合物CSN-acetylCSCS-RAFTCS-g-PNIPAMK237-CS-g-PNIPAMZeta电位(mv)-2.2±1.6-22.7±2.4-27.4±1.3-8.1±2.1-12.0±2.5本实施例中CS-g-PNIPAM、K237-CS-g-PNIPAM的DLS结果如图1所示,可知两种纳米颗粒粒径约为70nm。本实施例中CS、CS-RAFT、CS-g-PNIPAM、K237-CS-g-PNIPAM的TGA结果如图2所示,可知当温度达到900℃,CS、CS-RAFT、CS-g-PNIPAM和K237-CS-g-PNIPAM剩余40%、5%、12%和10%的重量。本实施例中CS-g-PNIPAM(左)、K237-CS-g-PNIPAM(右)的TEM图如图3所示,可知壳聚糖接枝聚合物纳米颗粒粒径小于100nm,并且加上靶向肽纳米颗粒粒径变小。实施例2(1)将5g壳聚糖CS溶解于250mL1%醋酸溶液中,搅拌使其完全溶解,缓慢加入250mL甲醇搅拌至澄清,再滴加入1mL乙酸酐溶液,室温搅拌反应3.5h,加入10%NaOH溶液析出溶液中的壳聚糖,经过滤、烘干得到乙酰化壳聚糖,研磨成细细的粉末备用。将0.298g得到的乙酰化壳聚糖溶于5mLDMF中搅拌溶解,加入0.370gDDACT、0.015gDMAP、0.205gDCC,室温搅拌反应48h,倒入冰水,冰水浴过夜,用MWCO=3500的透析袋透析三天,然后冻干得到壳聚糖的RAFT试剂。将0.047g得到的壳聚糖RAFT试剂溶于5mLDMF中,在氮气氛下磁力搅拌4.5h使其完全溶解,加入0.0032gAIBN作为引发剂、1gNIPAm氮气保护下60℃油浴反应24h,加入50ml乙醚沉淀3次,纯化后得到壳聚糖温敏嵌段共聚物CS-g-NIPAM。(2)将21.42mgK237肽溶于2ml1%HAc-NaAc溶液中,加入104mgEDC和68mgNHS磁力搅拌活化12h,得到活化的K237溶液;将25mgCS-g-PNIPAM溶于1%HAc缓冲溶液中,搅拌至溶解,加入1%NaOH调节pH为6,缓慢加入上述活化的K237溶液继续搅拌反应24h,采用MWCO=3500的透析袋透析,冷冻干燥,得到壳聚糖接枝聚合物K237-CS-g-PNIPAM。(2)将60mgK237-CS-g-PNIPAM溶于10mlDMF中,加入30mg紫杉醇PTX,搅拌反应24h,透析除去未连接上的PTX,冷冻干燥3天,得到乳腺癌靶向的壳聚糖接枝聚合物载药复合材料K237-CS-g-PNIPAM/PTX。实施例3对实施例1制得的载药复合材料K237-CS-g-PNIPAM/PTX在不同pH条件下进行药物释放试验:称取2mg载药复合物K237-CS-g-PNIPAM/PTX于纯水中充分溶解,分别放入两个透析袋(MW=3500)中,并放置在溶出仪,分别补加20ml的PBS溶液(pH=7.4)及醋酸溶液(pH=5.0),溶出仪温度设为37℃,转速90转/分,分别于0.5h、1h、2h、3h、4h、6h、8h、20h、32h、44h、56h、75h取出1ml透析液,并回补1ml相应的PBS缓冲溶液和醋酸缓冲溶液。对收集的透析液进行紫外检测,吸收波长设为227nm,收集数据并计算药物释放情况。PTX在两种pH环境下的释放曲线如图4A所示,可知在75h后,PTX在pH=5.0的醋酸缓释液中约释放91%;而在pH=7.4的PBS环境中仅释放62%,两者释放存在显著差异。由于肿瘤组织较正常组织细胞相比其pH要低,故该载药复合材料的释放正好符合这一特性,表明该载药复合材料是一种可以用于肿瘤治疗的pH敏感型材料。实施例4对实施例2制得的载药复合材料K237-CS-g-PNIPAM/PTX在不同温度条件下进行药物释放试验:称取2mg载药复合物K237-CS-g-PNIPAM/PTX于纯水中充分溶解,分别放入两个透析袋(MW=3500)中,并放置在溶出仪,补加20ml的PBS溶液(pH=7.4),溶出仪温度设为37℃和25℃,转速90转/分,分别于0.5h、1h、2h、3h、4h、6h、8h、20h、32h、44h、56h、75h取出1ml透析液,并回补1ml相应的PBS缓冲溶液。对收集的透析液进行紫外检测,吸收波长设为227nm,收集数据并计算药物释放情况。PTX在两种温度环境下的释放曲线如图4B所示,可知在75h后,PTX在37℃的缓释液中约释放70%。而在25℃环境中仅释放46%,两者释放存在显著差异。由于肿瘤组织较正常组织细胞相比其温度大约高于正常细胞组织0.5℃以上,故该载药符合材料的释放正好符合这一特性,表明该载药复合材料是一种可以用于肿瘤治疗的温度敏感型材料。实施例5对本发明制得的载药复合材料K237-CS-g-PNIPAM/PTX进行细胞毒性试验:分别在96孔细胞培养板中种入L929和MCF-7细胞,每孔细胞密度大约为10,000个,并补足每孔200μL的培养液,在5%CO2,的条件下于培养箱中培养24h。第二天倒掉旧培养基,加入含有不同浓度的PTX、K237-CS-g-PNIPAM和K237-CS-g-PNIPAM/PTX的20μL的PBS溶液,并补足180μL新鲜培养基,使每孔总体积仍为200μL。孵育24h后,每孔加20μL的0.5%的MTT溶液,置37℃恒温箱中静止4h,吸去孔内培养液,并添加200μLDMSO,置摇床上避光低速振荡15-20min,使用酶联免疫检测仪450nm处各孔的紫外吸收值。不同浓度的PTX、K237-CS-g-PNIPAM和K237-CS-g-PNIPAM/PTX对L929细胞的MTT细胞毒性结果如图5所示,对MCF-7细胞的MTT细胞毒性结果如图6所示,可知K237-CS-g-PNIPAM/PTX中PTX浓度在0.001-10μM的情况下均对L929和MCF-7细胞产生了较大的毒性,进一步验证复合载药材料对细胞的杀伤作用仅与其中的PTX有关,同时对药物载体K237-CS-g-PNIPAM进行了MTT检测,与载药复合物中K237-CS-g-PNIPAM浓度相同的载体材料均不产生细胞毒性,也验证了载药复合物对细胞的杀伤仅与其中的PTX有关。实施例6对本发明制得的载药复合材料K237-CS-g-PNIPAM/PTX进行靶向性验证试验:在24孔细胞培养板中放入盖玻片,并种入MBA-MD-231细胞,每孔细胞密度大约为30,000个,并补足每孔1mL的培养液,在5%CO2,的条件下于培养箱中培养24h。第二天倒掉旧培养基,加入含5μMPTX的K237-CS-g-PNIPAM/PTX的100μL的PBS溶液,并补足900μL新鲜培养基,孵育2h。吸去含材料的培养液,并用PBS冲洗,加1ml2.5%的戊二醛固定15min。吸去戊二醛,并用PBS冲洗,加1mlHoescht33342染色15min。吸去Hoescht33342,并用PBS冲洗,将盖玻片取出,滴一滴荧光封闭剂,置于载玻片上,进行激光共聚焦显微镜检测。为了对材料靶向性进行检测,选取非靶向细胞L929细胞,操作过程与MBA-MD-231相同。K237-CS-g-PNIPAM、K237-CS-g-PNIPAM/PTX对MBA-MD-231及L929细胞的激光共聚焦显微镜结果如图7所示,可以发现,经过材料孵化后的MBA-MD-231细胞的FITC荧光强度均比L929细胞高,说明材料对乳腺癌癌细胞均有一定的靶向性。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1