一种基于单宁酸的载药纳米颗粒及其制备方法和应用与流程
本发明属于生物医药技术领域,更具体地,涉及一种基于单宁酸的载药纳米颗粒及其制备方法和应用。
背景技术:
口服给药具有简单便利、病人依顺性高等特点,患者可以自行服用,大大节省时间和医护资源。药物经口服给药通过胃肠道吸收逐渐进入体内,可以避免体内血药浓度过高,延长药物半衰期,提高药物治疗效果。但是很多疏水性小分子药物如紫杉醇、姜黄素等,它们跨小肠上皮细胞效率低,口服生物利用度小。
为了解决上述问题,利用载体材料将疏水性药物制备成口服纳米给药体系引起了人们广泛的兴趣。纳米颗粒具有特殊物理化学性质,利用纳米体系输送药物可以改善稳定性、增强靶向性、提高生物利用度等,基于此,人们开发了聚合物纳米粒、脂质体、胶束、无机颗粒等不同纳米输送体系用于药物传递。其中阿霉素脂质体(Doxil)、紫杉醇-白蛋白结合纳米粒(Abraxane)等一些纳米药物已被FDA批准成功地进入临床应用于癌症治疗。然而,目前临床使用的抗肿瘤药物多为静脉注射给药,这种给药方式会引起体内血液药物浓度急剧上升,大大超过药物治疗窗口浓度,对人体造成严重副作用。而且癌症患者在慢性治疗期间,需要频繁地注射给药,给病人带来了极大不便和感染风险。因此开发基于口服给药系统的抗肿瘤纳米药物具有应用前景。
纳米颗粒的制备技术对于纳米药物的临床转化至关重要。传统地利用乳液/溶剂蒸发、本体混合、逐步滴加等间歇性制备方法得到的纳米颗粒通常其粒径及分散性不可控、批次重复性不好。近年来利用发展的快速纳米沉淀技术制备纳米颗粒具有粒径可控、尺寸均匀、批次可重复性等优点。它的主要机制是依靠高湍流混合器装置(例如,同轴湍流混合器,四通道涡流混合器等)实现溶剂(含药物)与非溶剂(含稳定剂)的快速交换,通过调控溶质成核与增长速率控制纳米颗粒的粒径及分散性。
单宁酸是一种FDA公认安全的天然多酚,pKa值约8.5,它具有许多生物活性,例如抗氧化、抗细菌、抗肿瘤、自由基捕获、抑制Pgp活性等。食物中高含量单宁酸和其他植物多酚还可以起到降低心血管疾病功效。聚乙烯吡咯烷酮和维生素E聚乙二醇琥珀酸酯也是一类生物相容性聚合物材料,通常作为药用辅料使用。目前,还未见有以单宁酸和聚乙烯吡咯烷酮或维生素E聚乙二醇琥珀酸酯作为载体制备载药纳米颗粒用于口服递送系统的报道。
技术实现要素:
本发明所要解决的技术问题是克服现有疏水性小分子药物的口服给药方面存在的缺陷和不足,提供一种以单宁酸和聚乙烯吡咯烷酮或维生素E聚乙二醇琥珀酸酯为载体材料负载疏水性药物的载药纳米颗粒制剂,所述载药纳米颗粒具有小粒径、窄分散、pH响应性药物释放等性能,在药物输送,尤其是在口服给药方面具有较大的应用前景。
本发明的第一个目的是提供一种基于单宁酸的载药纳米颗粒的制备方法。
本发明的第二个目的是提供一种上述制备方法制备得到的载药纳米颗粒。
本发明的第三个目的是提供所述载药纳米颗粒的应用。
本发明的上述目的是通过以下技术方案给予实现的:
一种基于单宁酸的载药纳米颗粒的制备方法,所述方法为在搅拌条件下,将疏水性小分子药物与单宁酸的有机混合溶液与聚乙烯吡咯烷酮或维生素E聚乙二醇琥珀酸酯水溶液混匀形成纳米颗粒溶液,再除去有机溶剂,制得载药纳米颗粒水溶液。
单宁酸是一种强氢键给体材料,可利用它与聚乙烯吡咯烷酮之间的多重氢键作用-形成多层状膜、胶囊与微球等。本发明通过疏水性小分子药物与单宁酸、聚乙烯吡咯烷酮或维生素E聚乙二醇琥珀酸酯之间的疏水和/或氢键等相互作用,利用逐步滴加法、倾倒法或快速纳米沉淀法制备负载不同药物的纳米颗粒。
优选地,所述混匀的方法为快速纳米沉淀法,具体为将疏水性小分子药物与单宁酸有机混合溶液与聚乙烯吡咯烷酮或维生素E聚乙二醇琥珀酸酯水溶液分别通过四通道涡流混合器的第1、2通道和第3、4通道实现高湍流混合快速形成纳米颗粒溶液;
更优选地,所述疏水性小分子药物与单宁酸有机混合溶液的流速为1~100mL/min(优选为20mL/min)。
更优选地,所述聚乙烯吡咯烷酮或维生素E聚乙二醇琥珀酸酯水溶液的流速为1~100mL/min(优选为50mL/min)。
优选地,所述有机溶剂为乙醇、丙酮、甲醇、乙腈等(优选为乙醇或丙酮)。
优选地,所述除去有机溶剂的方法为对水透析或旋转蒸发法。
优选地,所述单宁酸浓度为0.1~10mg/mL(优选为0.5mg/mL)。
优选地,所述聚乙烯吡咯烷酮浓度为0.1~20mg/mL(优选为0.7mg/mL)。
优选地,所述维生素E聚乙二醇琥珀酸酯浓度为0.1~10mg/mL(优选为1.0mg/mL)。
优选地,所述聚乙烯吡咯烷酮的分子量(Mw)为1kDa~400kDa。
更优选地,所述聚乙烯吡咯烷酮的重均分子量为1kDa~10kDa,10kDa~40kDa(优选10kDa或40kDa),40kDa~100kDa,100kDa~400kDa。
优选地,所述疏水性小分子药物为紫杉醇、姜黄素、睾酮或多西他赛。
更优先地,所述紫杉醇浓度为0.1~6mg/mL(优选为0.5mg/mL)。
更优先地,所述姜黄素浓度为0.1~10mg/mL(优选为0.5mg/mL)。
更优先地,所述睾酮浓度为0.1~8mg/mL(优选为1.5mg/mL)。
更优选地,所述多西他赛浓度为0.1~5mg/mL(优选为0.5mg/mL)。
本发明还请求保护上述任一方法制备得到的基于单宁酸的载药纳米颗粒。
优选地,所述载药纳米颗粒为紫杉醇纳米颗粒,其粒径为30~150nm(优选为55nm),分散度为0.04~0.3,包封率为70~85%,载药量为14~18%。
优选地,所述载药纳米颗粒为姜黄素纳米颗粒,其粒径为50~70nm,分散度为0.09~0.3,包封率为90~96%,载药量为16~22%。
优选地,所述载药纳米颗粒为睾酮纳米颗粒,其粒径为40~100nm,分散度为0.07~0.11,包封率为38~48%,载药量为13~18%。
优选地,所述载药纳米颗粒为多西他赛纳米颗粒,其粒径为50~100nm,分散度为0.1~0.3,包封率约79%,载药量为9%。
另外,本发明还请求保护所述基于单宁酸的载药纳米颗粒在制备口服疏水性小分子药物制剂中的应用。
一种口服疏水性小分子药物制剂,所述药物制剂包含上述基于单宁酸的载药纳米颗粒。
优选地,所述药物制剂为冻干制剂,具体为向本发明制备的纳米颗粒溶液中加入冻干保护剂,经冷冻、干燥得到冻干的纳米制剂。
优选地,所述冻干保护剂为甘露醇、木糖醇、海藻糖、山梨醇或其组合物。
更优先地,所述冻干保护剂为甘露醇/木糖醇组合物,其中,甘露醇质量/木糖醇质量/载药纳米颗粒水溶液体积的比例为0~5g/0.5~5g/100mL。
与现有技术相比,本发明具有以下有益效果:
本发明通过疏水性小分子药物与单宁酸、聚乙烯吡咯烷酮或维生素E聚乙二醇琥珀酸酯之间的疏水和/或氢键等相互作用,利用逐步滴加法、倾倒法或快速纳米沉淀法制备负载不同药物的纳米颗粒。本发明获得的载药纳米颗粒不仅具有小粒径、窄分散、pH响应性药物释放等性能,而且具有药物保护功能,在胃酸介质(pH 2)中仅释放少量药物,可以避免口服给药过程中由于药物自身引起的胃损伤,而在小肠环境(pH 6.8)或生理环境(pH 7.4)下,纳米颗粒可以缓释药物,有利于药物进一步吸收。与传统的注射液相比,本发明的载药纳米颗粒具有更好的生物相容性且治疗效果与注射液相当甚至更好;本发明制备得到的基于单宁酸的载药纳米颗粒在药物输送,尤其是在口服给药方面具有较大的应用前景。
附图说明
图1为四通道涡流混合器制备紫杉醇纳米颗粒的示意图。
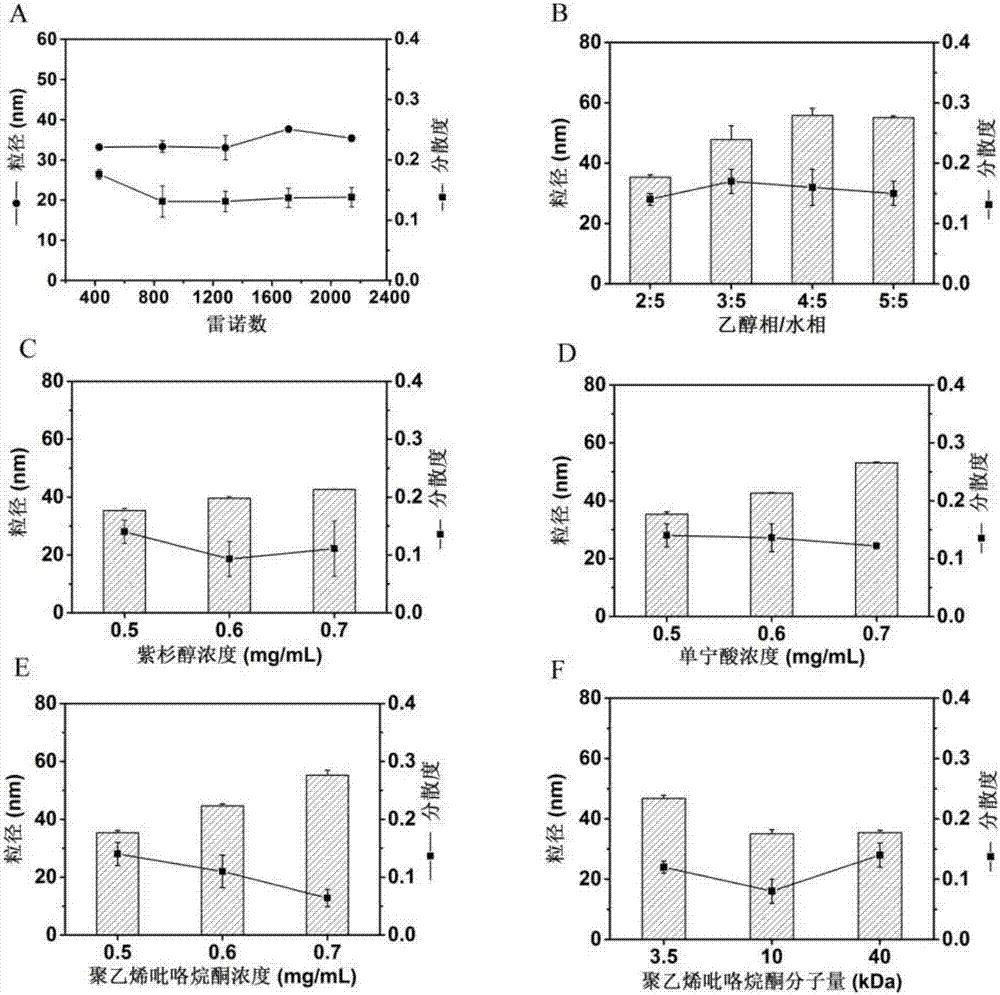
图2为影响紫杉醇纳米颗粒粒径和分散度的相关参数。(A)流体流动速率(雷诺数),(B)乙醇/水相比例,(C)紫杉醇药物浓度,(D)载体单宁酸浓度,(E)载体聚乙烯吡咯烷酮浓度,(F)载体聚乙烯吡咯烷酮分子量。
图3为影响姜黄素纳米颗粒粒径和分散度的相关参数。(A)乙醇/水相比例,(B)姜黄素浓度,(C)载体单宁酸浓度,(D)载体聚乙烯吡咯烷酮浓度。
图4为紫杉醇纳米颗粒的体外稳定性。(A)纳米颗粒1和纳米颗粒2在室温避光条件下静置一周,(B)纳米颗粒2在pH 7.4的PBS缓冲溶液中静置12小时。
图5为紫杉醇纳米颗粒的pH敏感性。(A)不同pH条件下紫杉醇纳米颗粒的粒径和透射率随时间变化;(B)不同pH条件下紫杉醇纳米颗粒的粒径分布。(C)初始制备的纳米颗粒2的透射电子显微镜图,(D)pH 2.0条件下纳米颗粒2的透射电子显微镜图,(E)pH 6.8条件下纳米颗粒2的透射电子显微镜图,(F)pH 7.4条件下纳米颗粒2的透射电子显微镜图。
图6为紫杉醇纳米颗粒在模拟胃肠道pH条件下的药物累积释放曲线。
图7为聚乙烯吡咯烷酮、单宁酸、紫杉醇注射液(Taxol)和紫杉醇纳米颗粒对MCF-7(A)、HeLa(B)和HepG2细胞(C)的体外毒性。以及对应紫杉醇含量的聚氧乙烯蓖麻油/乙醇溶剂对MCF-7细胞(D)的体外毒性。
图8为紫杉醇纳米颗粒的Caco2(A)和MCF-7细胞(B)体外摄取情况。
图9为紫杉醇注射液(Taxol)和紫杉醇纳米颗粒的紫杉醇累积渗透量(A)和表观渗透系数(B)比较结果。
图10为大鼠口服紫杉醇注射液(Taxol)和紫杉醇纳米颗粒的药代动力学曲线对比。
图11为裸鼠肿瘤抑制试验。
具体实施方式
以下结合说明书附图和具体实施例来进一步说明本发明,但实施例并不对本发明做任何形式的限定。除非特别说明,本发明采用的试剂、方法和设备为本技术领域常规试剂、方法和设备。
除非特别说明,以下实施例所用试剂和材料均为市购。
实施例1制备负载紫杉醇的单宁酸/聚乙烯吡咯烷酮纳米颗粒(紫杉醇纳米颗粒)
1、方法
(1)称取10mg紫杉醇(PTX)和10mg单宁酸(TA)共溶解于20mL乙醇中,25mg聚乙烯吡咯烷酮(PVP)溶解于50mL去离子水中。在搅拌条件下将紫杉醇/单宁酸乙醇溶液通过逐步滴加或倾倒方法加入到聚乙烯吡咯烷酮水溶液中,搅拌30min后,制得的纳米颗粒溶液利用透析袋(截留分子量,3.5kDa)对水透析得到紫杉醇纳米颗粒水溶液。
(2)通过马尔文粒度仪表征了纳米颗粒的粒径和分散度;通过高效液相色谱仪(HPLC)检测了紫杉醇包封率和载药量:检测波长为227nm,流动相为乙腈/水(体积比:40/60),流速为1mL/min。载药纳米颗粒的包封率和载药量计算公式如下:包封率(%)=载药纳米颗粒所含药物质量/总共投入的药物质量×100%;载药量(%)=载药纳米颗粒所含药物质量/载药纳米颗粒的质量×100%。
2、结果
如表1所示,利用逐步滴加法制备的紫杉醇纳米颗粒的粒径39nm,包封率66.8%,载药量14.8%。利用倾倒法制备的紫杉醇纳米颗粒的粒径47nm,包封率73.9%,载药量16.4%。正如表1结果所示,通过逐步滴加或倾倒方法制备的紫杉醇纳米颗粒的分散度通常较大。
表1利用逐步滴加和倾倒方法制备紫杉醇纳米颗粒的比较
实施例2制备负载紫杉醇的单宁酸/聚乙烯吡咯烷酮纳米颗粒
图1展示了利用快速纳米沉淀法制备载药单宁酸/聚乙烯吡咯烷酮纳米颗粒的四通道涡流混合器结构,其中,设备详细参数记载在本发明人前期申请号为PCT/US2017/014080的专利中。
1、方法
(1)称取10mg紫杉醇和10mg单宁酸共溶解于20mL乙醇中,25mg聚乙烯吡咯烷酮溶解于50mL去离子水中。把紫杉醇/单宁酸乙醇溶液分别注入第1、2通道,把聚乙烯吡咯烷酮水溶液注入第3、4通道。利用注射泵的推力控制各通道流体的流动速率,其中第1、2通道的流体速率为20mL/min,第3、4通道的流体速率为50mL/min。收集制得的载药纳米颗粒溶液并利用透析袋对水透析(截留分子量,3.5kDa)得到紫杉醇纳米颗粒水溶液。
2、结果
如表2所示,单宁酸和聚乙烯吡咯烷酮浓度分别为0.5mg/mL时,空白纳米颗粒的粒径为36nm。利用它负载初始浓度为0.5mg/mL的紫杉醇时,得到的紫杉醇纳米颗粒的粒径为35nm,包封率和载药量分别为74.5%和16.6%。当提高聚乙烯吡咯烷酮浓度至0.7mg/mL时,得到的紫杉醇纳米颗粒的粒径为55nm,包封率和载药量分别为80.0%和14.7%。另外,改变流体流动速率(雷诺数)、乙醇/水相比例、药物浓度、载体单宁酸浓度、载体聚乙烯吡咯烷酮浓度或分子量等参数可以调控紫杉醇纳米颗粒的粒径和分散度。
图2A显示流体流速(雷诺数)对于载药纳米颗粒的粒径影响较小,但是在高雷诺数时,载药纳米颗粒具有更小分散度。
图2B显示乙醇/水相比例由5:5调至2:5时,得到的紫杉醇纳米颗粒的粒径略有减小,但分散度无明显变化。
图2C、D和E分别考察了紫杉醇药物浓度,载体单宁酸和聚乙烯吡咯烷酮浓度对于紫杉醇纳米颗粒粒径和分散度的影响,结果显示提高紫杉醇、单宁酸、聚乙烯吡咯烷酮浓度,紫杉醇纳米颗粒的粒径均会增加,但分散度均较小。
图2F考察了聚乙烯吡咯烷酮分子量对于紫杉醇纳米颗粒的影响。结果表明聚乙烯吡咯烷酮分子量为10kDa或40kDa时,紫杉醇纳米颗粒具有更小的粒径和分散度。
表2利用快速纳米沉淀法制备不同组分的紫杉醇纳米颗粒
实施例3制备负载姜黄素的单宁酸/聚乙烯吡咯烷酮纳米颗粒
1、方法
称取10mg姜黄素(Cur)和10mg单宁酸(TA)共溶解于20mL乙醇中,25mg聚乙烯吡咯烷酮(PVP)溶解于50mL去离子水中。图1所示四通道涡流混合器的第1、2通道注入姜黄素/单宁酸乙醇溶液,第3、4通道注入聚乙烯吡咯烷酮水溶液。控制第1、2通道的流体速率为20mL/min,第3、4通道的流体速率为50mL/min。收集的载药纳米颗粒溶液通过透析袋(截留分子量,3.5kDa)对水透析得到姜黄素纳米颗粒水溶液。
2、结果
如表3所示,姜黄素药物与载体单宁酸、聚乙烯吡咯烷酮通过快速纳米沉淀法可以形成姜黄素纳米颗粒,载药纳米颗粒的粒径在50~70nm,分散度低于0.17,包封率高于90%,载药量高于16%。
图3结果表明在颗粒制备过程中改变乙醇/水相比例、姜黄素浓度、载体单宁酸和聚乙烯吡咯烷酮浓度可以调控姜黄素纳米颗粒的粒径和分散度。
表3利用快速纳米沉淀法制备不同组成的姜黄素纳米颗粒
实施例4制备负载睾酮的单宁酸/聚乙烯吡咯烷酮纳米颗粒(载睾酮纳米颗粒)
1、方法
30mg睾酮(Tes)和30mg单宁酸(TA)共溶解于20mL乙醇中,35mg聚乙烯吡咯烷酮(PVP)溶解于50mL去离子水中。图1所示的四通道涡流混合器的第1通道为睾酮/单宁酸乙醇溶液,第2、3和4通道为聚乙烯吡咯烷酮水溶液,调节第1通道的流体速率为10mL/min,第2、3和4通道的流体速率为10mL/min。收集制得的载药纳米颗粒溶液利用透析袋(截留分子量,3.5kDa)对水透析得到睾酮纳米颗粒水溶液。
2、结果
表4的结果显示固定睾酮浓度为1.5mg/mL,改变载体单宁酸浓度为1.5~2.5mg/mL,载体聚乙烯吡咯烷酮浓度为0.7~1.0mg/mL,制得的睾酮纳米颗粒的粒径范围在40~53nm,分散度低于0.11,载药纳米颗粒的包封率为38~48%,载药量为13~18%。
表4利用快速纳米沉淀法制备不同组分的睾酮纳米颗粒
实施例5制备负载多西他赛的单宁酸/维生素E聚乙二醇琥珀酸酯纳米颗粒
1、方法
称取10mg多西他赛(DTX)和20mg单宁酸(TA)共溶解于20mL乙醇中,50mg维生素E聚乙二醇琥珀酸酯(TPGS)溶解于50mL去离子水中。图1所示四通道涡流混合器的第1通道注入多西他赛/单宁酸乙醇溶液,第2、3、4通道注入维生素E聚乙二醇琥珀酸酯水溶液。控制第1、2、3和4通道的流体速率为20mL/min。收集的纳米颗粒溶液通过透析袋(截留分子量,3.5kDa)对水透析得到多西他赛纳米颗粒水溶液。
2、结果
如表5所示,多西他赛药物与载体单宁酸、维生素E聚乙二醇琥珀酸酯(TPGS)通过快速纳米沉淀法可以形成多西他赛纳米颗粒,载药纳米颗粒的粒径约72nm,分散度低于0.1,包封率约79%,载药量为9%。
表5利用快速纳米沉淀法制备的多西他赛纳米颗粒
实施例6紫杉醇纳米颗粒的冻干制剂
1、方法
将甘露醇、木糖醇、海藻糖、山梨醇或其不同组合物加入到紫杉醇纳米颗粒水溶液中,经搅拌混合均匀后,利用液氮冷冻10min,然后在-30℃温度,0.37bar真空条件下干燥48小时得到冻干纳米制剂。
2、结果
经过实验筛选,紫杉醇纳米颗粒水溶液的最佳冻干保护剂为甘露醇/木糖醇组合物。其中甘露醇质量/木糖醇质量/载药纳米颗粒水溶液体积的最佳比例为2g/2g/100mL。表6显示了表2中的纳米颗粒1或纳米颗粒2在以上最佳冻干条件下制得冻干制剂复溶前后的性能对比结果,相比于冻干前载药纳米颗粒,冻干复溶后的纳米颗粒1或纳米颗粒2的粒径和分散度均略有增加。表6冻干条件为甘露醇质量/木糖醇质量/载药纳米颗粒水溶液体积的比例为2
g/2g/100mL,所得紫杉醇纳米颗粒冻干前后的粒径与分散度对比
实施例7紫杉醇纳米颗粒的体外稳定性
1、方法
将表2中制备的纳米颗粒1和纳米颗粒2分别在室温避光环境下静置一周,或将表2中制备的纳米颗粒2置于pH 7.4的PBS缓冲溶液中静置12小时,在预设时间内,研究了紫杉醇纳米颗粒的粒径变化情况。
2、结果
图4A和B结果显示紫杉醇纳米颗粒在体外室温避光或pH7.4的PBS缓冲溶液中静置一段时间后其粒径无明显变化,因此紫杉醇纳米颗粒具有良好的体外稳定性。
实施例8紫杉醇纳米颗粒的pH敏感性
1、方法
考察表2中制备的纳米颗粒2在不同pH条件下粒径和透射率(紫外可见分光光谱仪,500nm)随时间变化的情况。10mL紫杉醇纳米颗粒利用盐酸溶液调节pH至2.0后,观察载药纳米颗粒在2小时内粒径和透射率变化。随后利用NaOH溶液调节pH至6.8,进一步观察载药纳米颗粒在5小时内粒径和透射率变化。最后利用NaOH溶液调节pH至7.4,进一步观察载药纳米颗粒在5小时内粒径和透射率随时间变化。并且通过透射电子显微镜观察了不同pH条件的紫杉醇纳米颗粒的形貌。
2、结果
如图5A所示,紫杉醇纳米颗粒(表2中制备的纳米颗粒2)初始粒径为55nm,当pH=2.0时,紫杉醇纳米颗粒溶液透射率减小,粒径增大至约2μm。当pH=6.8时,紫杉醇纳米颗粒溶液透射率急剧增加,颗粒粒径降至约80nm。进一步升高pH值至7.4时,紫杉醇纳米颗粒溶液透射率略有增加,颗粒粒径降至约65nm。以上结果表明制备的紫杉醇纳米颗粒具有pH敏感的颗粒尺寸变化行为。动态光散射(图5B)和透射电子显微镜(图5C~F)结果也进一步证实了紫杉醇纳米颗粒粒径的pH敏感。
实施例9紫杉醇纳米颗粒的体外药物释放
1、方法
1mL紫杉醇纳米颗粒加入到截留分子量为14kDa的透析袋中并对40mL不同介质透析,振荡速率100rpm,温度37℃。其中,模拟胃酸的介质为pH 2.0(7mL HCl,2.5g SDS,2g NaCl体积定容至1L)。模拟小肠的介质为pH6.8PBS(含0.1%吐温80)。模拟生理环境的介质为pH7.4PBS(含0.1%吐温80)。在预设时间内,取出5mL释放液并加入等量新鲜介质。利用HPLC检测释放液中紫杉醇药物的含量。
2、结果
图6显示紫杉醇纳米颗粒在pH 2条件时只释放出少量药物。在pH 7.4时载药纳米颗粒可以较快地释放紫杉醇药物,其中2小时内释放约30%,24小时内释放约70%。我们也对比研究了紫杉醇注射液(Taxol)和紫杉醇纳米颗粒的体外释放。在pH 2条件下,紫杉醇注射液2小时内释放高达55%,而紫杉醇纳米颗粒释放低于10%。随后改变至pH 6.8时,相比于紫杉醇注射液,紫杉醇纳米颗粒可以更加缓慢地释放药物。以上表明紫杉醇纳米颗粒在胃酸模拟介质中(pH2)仅释放少量药物,纳米颗粒具有药物保护功能,可以避免口服给药过程中由于药物自身引起的胃损伤。而在小肠模拟环境(pH 6.8)或生理环境(pH 7.4)下,紫杉醇纳米颗粒可以缓释药物,有利于药物进一步吸收。
实施例10紫杉醇纳米颗粒的体外细胞毒性
1、方法
采用MTT评价了载药纳米颗粒的体外细胞毒性。MCF-7,HepG2和HeLa细胞分别加入96孔板内,细胞密度为5×103个/孔,细胞培养24h后,取200μL包含不同紫杉醇量的紫杉醇注射液(Taxol)、紫杉醇纳米颗粒、对应紫杉醇量的单宁酸和聚乙烯吡咯烷酮浓度、50%聚氧乙烯蓖麻油/乙醇溶剂的完全培养基替换原有介质。共同孵育48h后,利用MTT试剂检测相应细胞的活力。
2、结果
图7分别显示了载体聚乙烯吡咯烷酮和单宁酸、紫杉醇注射液(Taxol)和紫杉醇纳米颗粒对MCF-7(A)、HeLa(B)和HepG2细胞(C)的体外毒性,以及对应紫杉醇量的聚氧乙烯蓖麻油/乙醇溶剂对MCF-7细胞(D)的毒性。结果表明相对于紫杉醇注射液(Taxol)中包含的聚氧乙烯蓖麻油/乙醇,载体聚乙烯吡咯烷酮和单宁酸具有更好的生物相容性。而且紫杉醇纳米颗粒与紫杉醇注射液(Taxol)具有相类的杀伤肿瘤细胞能力。
实施例11紫杉醇纳米颗粒的体外细胞摄取情况
1、方法
MCF-7和Caco2细胞分别培养在12孔板内,细胞密度为1×105个/孔,37℃条件培养24h后,取1mL包含10μg/mL紫杉醇量的紫杉醇注射液(Taxol)和紫杉醇纳米颗粒的完全培养基替换原来培养介质,分别孵育1、2和4h后,利用PBS清洗3次除去残留药物,然后加入胰蛋白酶消化5分钟,加入0.8mL PBS分散细胞,利用细胞计数器计算细胞密度后,取0.5mL分散液加入到2mL甲醇中,超声2分钟后10000rpm转速下离心10分钟,取20μL上清液利用HPLC检测紫杉醇的药物浓度。
2、结果
图8显示了紫杉醇注射液(Taxol)和紫杉醇纳米颗粒与Caco2(A)和MCF-7细胞(B)共同孵育不同时间的药物摄取情况。结果显示在相同时间内不管是Caco2还是MCF-7细胞,紫杉醇纳米颗粒被细胞摄取的能力均高于紫杉醇注射液(Taxol)。表明纳米颗粒更有利于MCF-7和Caco2细胞摄取紫杉醇药物。
实施例12紫杉醇纳米颗粒的累积渗透量和表观渗透系数
1、方法
Caco2细胞培养在12孔Transwell内室(孔径:0.4μm,内室面积:1.14cm2),细胞密度为1×105个/孔。第一个星期每两天更换一次培养介质,随后每天更换一次培养介质,跨膜电阻(TEER)使用MillicellERS-2测量,培养2~3周后,当Caco2单层细胞膜TEER值超过800Ωcm2时进行后续实验。Transwell内室和基底培养介质分别更换为0.5和1.5mL HBSS平衡盐溶液,培养30min后分别更换新鲜HBSS平衡盐溶液并包含10μg/mL紫杉醇量的紫杉醇注射液(Taxol)和紫杉醇纳米颗粒。培养0.5、1、1.5、2和3小时后,分别从底基取出0.5mL介质并补充等量新鲜介质。取出的介质中加入0.5mL甲醇,涡流1分钟后在10000rpm转速下离心10分钟,取20μL上清液利用HPLC检测紫杉醇浓度。表观渗透系数(Papp)根据以下公式计算:Papp=Q/AC0t,Q为累计渗透的紫杉醇总量,t为渗透时间,A为细胞培养内室渗透膜面积,C0为加入紫杉醇的初始浓度。
2、结果
图9A显示在相同时间内紫杉醇纳米颗粒的累计渗透量高于紫杉醇注射液(Taxol),图9B的显示表明紫杉醇纳米颗粒的表观渗透系数高于紫杉醇注射液(Taxol)。以上结果表明纳米颗粒更有利于紫杉醇渗透穿过Caco2单层细胞膜。
实施例13SD大鼠口服紫杉醇纳米颗粒的药代动力学评价
1、方法
雄性SD大鼠(180~200g)禁食12小时后随机分为两组,每组5只,第一组灌胃紫杉醇注射液(Taxol),第二组灌胃紫杉醇纳米颗粒,口服紫杉醇剂量为10mg/kg。在灌胃后的0.25、0.5、1、2、4、6、12、24和36小时于大鼠眼眶静脉取血0.5mL,放置在含有肝素钠(10μL,10mg/mL)离心管内,3000rpm转速离心10分钟得到血浆。取125μL血浆,加入25μL内标多西他赛(13μg/mL)涡流1分钟,加入500μL甲醇涡流5分钟沉淀蛋白质,然后12000rpm转速离心10分钟,取20μL上清液利用HPLC检测血浆中紫杉醇药物浓度。
2、结果
如图10所示,紫杉醇口服剂量为10mg/kg时,紫杉醇纳米颗粒比紫杉醇注射液(Taxol)具有更高的血液浓度。表7统计结果显示紫杉醇纳米颗粒最高血药浓度约为紫杉醇注射液2倍,紫杉醇纳米颗粒的口服生物利用度是紫杉醇注射液(Taxol)的5.8倍。
表7对比SD大鼠口服紫杉醇注射液(Taxol)和紫杉醇纳米颗粒的药代动力学相关指数
实施例14裸鼠肿瘤抑制试验
1、方法
接种MCF-7细胞的裸鼠用于评估紫杉醇纳米颗粒的体内抗肿瘤实验。当裸鼠肿瘤达到100mm3时随机分为6组,每组6只,分别口服生理盐水,口服Taxol(10mg/kg),口服紫杉醇纳米颗粒(10mg/kg),口服紫杉醇纳米颗粒(20mg/kg),静脉Taxol(10mg/kg)和静脉紫杉醇纳米颗粒(10mg/kg)。每组裸鼠两天给一次药,试验周期内共给药6次,并记录每只裸鼠肿瘤体积。
2、结果
如图11所示,口服紫杉醇纳米颗粒(10mg/kg)展现出了和静脉Taxol(10mg/kg)相当的肿瘤抑制效果,并与对照组和口服Taxol(10mg/kg)产生了显著性差异。当紫杉醇纳米颗粒的口服给药量提升至20mg/kg时能起到更强的肿瘤抑制效果。
- 还没有人留言评论。精彩留言会获得点赞!