一种产气荚膜梭菌α毒素重组亚单位疫苗及其生产方法与流程
本发明涉及一种产气荚膜梭菌α毒素重组亚单位疫苗及其生产方法。属于兽用生物制品领域。
背景技术
产气荚膜梭菌(clostridiumperfringeris)是一种重要的人畜共患菌,能引起人类以及多种家畜家禽发病,不仅威胁着人类的健康,而且对畜牧业造成了巨大的经济损失。产气荚膜梭菌主要的致病因素是其分泌的外毒素,该菌可产生至少20种外毒素,并通过其发挥致病作用。根据产生4种主要致死性外毒素α(cpa)、β(cpb)、ε(etx)和ι(cpi)的种类,可将该菌分为a、b、c、d、e五个毒素型。其中,对养牛业危害最大的是a、c和d型。在国外,牛的产气荚膜梭菌病以c、d型菌引起的牛坏死性肠炎或肠毒血症较多,而在国内,牛的产气荚膜梭菌病则以a型菌引起的牛“猝死症”为主。病牛往往无任何前驱症状,而突然发病死亡。因此,疫苗免疫是防治该病的有效手段,然而国内还没有商品化的疫苗来预防牛的a型产气荚膜梭菌病。虽然灭活疫苗在预防羊的产气荚膜梭菌方面起到了一定的效果,但该类疫苗是通过灭活细菌培养物上清而制备的天然类毒素,制备过程繁琐,抗原成分复杂,有效抗原量较低。如大剂量的肌肉注射会严重破坏牛肉的品质。因此,筛选安全、纯净、有效的抗原对预防该菌感染具有重要意义。
cpa是由产气荚膜梭菌染色体基因plc编码,plc存在于五个毒素型的菌株,但在a型毒株中表达水平最高。成熟的cpa由370个氨基酸构成,分为n-末端(1-246,cpan)和c-末端(247-370,cpac)两个结构域。其中,cpan是cpa发挥酶活性的主要区域,而cpac是毒素与细胞结合的主要区域。研究表明,重组cpa仍存在一定的毒力,而通过甲醛灭活后的天然毒素抗原性会明显降低。为此,研制无毒力的重组毒素具有重要的意义。已有的研究表明,无毒力的cpac能够对天然cpa起到良好的免疫保护作用。由于cpac蛋白分子量较小,研究者通常选择将cpac与gst等大分子量标签蛋白融合表达,从而引入了过多无关的抗原成分。
本发明专利制备的产气荚膜梭菌α毒素重组亚单位疫苗,系采用经过密码子优化、经3次重复后进行串联表达,不仅增加了有效抗原量,也增加抗原蛋白整体的分子量,更有利于增强分子的抗原性。同时,该疫苗还具有制备工艺简单、免疫剂量低、免疫效力好等优点,是a产气荚膜梭菌毒素疫苗的理想候选抗原。
技术实现要素:
本发明目的在于制备出产气荚膜梭菌α毒素重组亚单位疫苗,用于预防由a型产气荚膜梭菌感染引起的疾病。
本发明技术方案
1.一种产气荚膜梭菌α毒素重组亚单位疫苗,其特征在于所述疫苗含有采用大肠埃希氏菌表达的重组产气荚膜梭菌α毒素蛋白;制苗用菌种为重组表达产气荚膜梭菌α毒素蛋白的大肠埃希氏菌被命名为大肠埃希氏菌(escherichiacoli)blcpa3株,该菌株已于2018年01月18日送交北京市朝阳区北辰西路1号院3号中国科学院微生物研究所中国微生物菌种保藏管理委员会普通微生物中心保藏,保藏编号为:cgmccno.15239。
2.本发明所述产气荚膜梭菌α毒素重组亚单位疫苗,其特征在于所述重组产气荚膜梭菌α毒素蛋白,与野生型产气荚膜梭菌α毒素成熟毒素相比,其特征在于所述重组产气荚膜梭菌梭菌α毒素蛋白,与野生型产气荚膜梭菌梭菌α毒素成熟毒素相比,只含有c末端的三拷贝。同时,在该蛋白的c端加上6组氨酸标签。
3.本发明所述产气荚膜梭菌α毒素重组亚单位疫苗,其特征在于所述重组产气荚膜梭菌α毒素蛋白,其重组表达载体的基因序列经过密码子优化,更易于在大肠杆菌中实现高表达。
4.本发明所述产气荚膜梭菌α毒素重组亚单位疫苗,其特征在于所述重组产气荚膜梭菌α毒素蛋白为无毒突变体,大大降低了疫苗生产过程中的生物安全风险。
5.本发明所述产气荚膜梭菌α毒素重组亚单位疫苗,其特征在于所述重组产气荚膜梭菌梭菌α毒素蛋白为无毒区域,大大降低了疫苗生产过程中的生物安全风险。
6.本发明所述产气荚膜梭菌α毒素重组亚单位疫苗的制备方法,其特征在于用所述表达产气荚膜梭菌α毒素重组蛋白的大肠埃希氏菌blcpa3株作为疫苗生产菌株,经发酵培养、诱导表达、菌体破碎、包涵体分离纯化后,加双相油乳佐剂混合制成。
本发明具体实施方式
1.产气荚膜梭菌α毒素重组亚单位疫苗的制备
(1)菌种:制苗用菌种为重组表达产气荚膜梭菌α毒素蛋白的大肠埃希氏菌(escherichiacoli)blcpa3株,该菌种表达的产气荚膜梭菌α毒素蛋白含有c末端的3个拷贝,且重组蛋白的c端添加了6组氨酸标签。该菌株已于2018年01月18日送交北京市朝阳区北辰西路1号院3号中国科学院微生物研究所中国微生物菌种保藏管理委员会普通微生物中心保藏,保藏编号为:cgmccno.15239;由中国兽医药品监察所鉴定、保管和供应。
(2)一级种子繁殖及鉴定:将冻干菌种用少量lb液体培养基融解,划线接种于含卡那霉素的lb固体平板,置37℃培养12~16小时,选取符合标准的单个菌落,接种含卡那霉素的lb液体培养基,置37℃培养8~12小时,与50%甘油等比例混合后分装,经纯粹检验合格后,作为制苗用一级种子。
(3)二级种子繁殖及鉴定:取一级种子,按1%的量接种含卡那霉素的lb液体培养基,置37℃振荡培养8~12小时,即为二级种子。
(4)制苗用抗原制备:取合格的二级种子,按培养基总量的2%接种含卡那霉素的lb液体培养基,发酵罐内培养。设置培养参数为:培养温度37℃,ph值7.0,溶氧40%。当培养物od600值为10~15时,加入终浓度为0.6mmol/l的iptg诱导培养4h。
(5)破菌:离心收集菌体,按每克菌体湿重加10ml裂解液(ph值7.20.02mol/ltris缓冲液,0.3mol/lnacl)的比例重悬菌体,4℃条件下用低温高压均质机以800bar的压力破碎菌体3次。裂解液经4℃10000r/min离心30min,弃去上清液,收集沉淀的包涵体。
(6)纯化:按每克包涵体用5ml溶解液(6mol/l盐酸胍,20mmol/ltris-hcl,ph值8.0)的比例在室温下以200r/min振荡溶解2小时后,4℃10000r/min离心30min,收集上清液
(7)蛋白含量检测:用bca法检测蛋白含量。应不低于0.5mg/ml。经sds-page检测并对条带进行灰度扫描,蛋白纯度应不低于70%。
(8)无菌检验:按现行《中国兽药典》(中国兽药典委员会,中华人民共和国兽药典,二〇一五年版三部,中国农业出版社,2011,以下称《中国兽药典》)附录进行。应无菌生长。
(7)疫苗配制:将双相油佐剂(如201佐剂)导入油相罐内,以至少121℃高压灭菌30分钟,冷却至室温备用。根据蛋白含量测定结果,用pbs(ph值7.20.01mol/l)将检验合格的纯化蛋白适当稀释后混匀。将水相加入乳化罐内,以80~100r/min搅拌,同时按1:1(v/v)的比例,缓慢加入油相,加完后搅拌20~30min。乳化后取样进行检验,合格后分装。
2.产气荚膜梭菌α毒素重组亚单位疫苗的检验
(1)性状
外观乳白色乳剂。
剂型呈水包油包水型(w/o/w)。取一清洁吸管,吸取少量疫苗滴于清洁冷水表面,应呈云雾状扩散。
稳定性吸取疫苗10ml加入离心管中,以3000r/min离心15min,应不破乳,并且管底析出的水相应不多于0.5ml。
黏度按《中国兽药典》(中国兽药典委员会编,中华人民共和国兽药典,2015年版三部,中国农业出版社,2011,以下称《中国兽药典》)附录进行测定,应符合规定。
(2)装量检查按《中国兽药典》附录进行检查,应符合规定。
(3)无菌检验按《中国兽药典》附录进行检验,应无菌生长。
(4)安全检验用体重1.5~2.0kg健康家兔4只,各肌肉或皮下注射疫苗4.0ml,观察10日。应全部健活。
(5)效力检验用体重1.5~2.0kg健康家兔4只,各颈部皮下或肌肉注射疫苗2.0ml。接种后14~21日,采血,分离血清。将4只免疫家兔的血清等量混合,取混合血清0.4ml与0.8ml产气荚膜梭菌毒素(含4个小鼠mld),混合后置37合作用40min,然后静脉注射16~20g小鼠2只,0.3ml/只。同时各用同批小鼠2只,分别注射1mld与毒素血清混合物相同的毒素作对照。观察1日,判定结果。
对照鼠全部死亡,血清中和效价对产气荚膜梭菌毒素达到1(0.1ml免疫动物血清中和1mld毒素),即判为合格。
附图说明
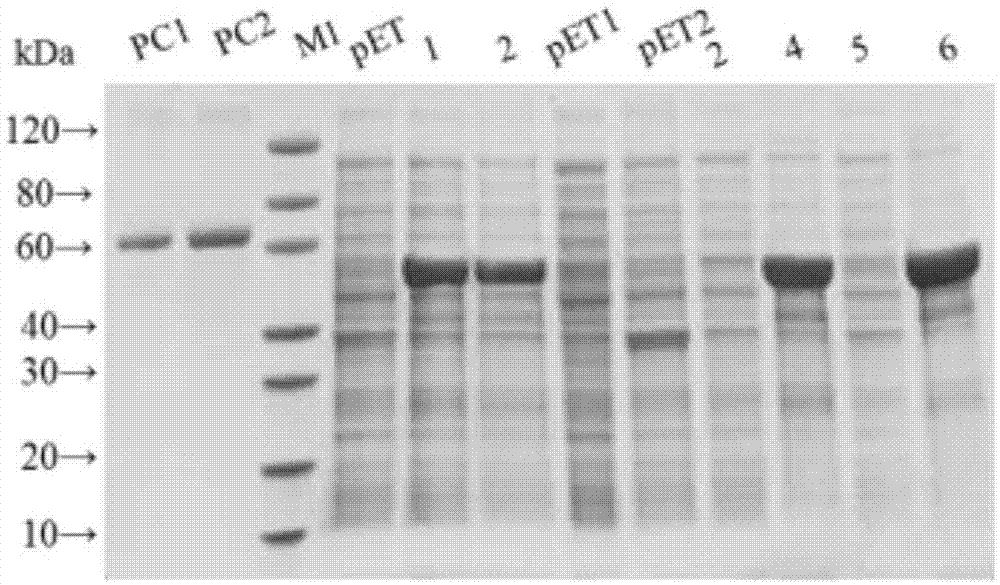
图1:基因工程重组大肠埃希氏菌(escherichiacoli)blcpa3株的sds-page鉴定结果,图中:m1:proteinmarker;pc1:bsa(1μg);pc2:bsa(2μg);pet:空载体细胞裂解物;1:15℃、16h诱导的细胞裂解物;2:37℃、4h诱导的细胞裂解物;pet1:空载体细胞裂解上清;pet2:空载体细胞裂解沉淀;3:15℃、16h诱导的细胞裂解上清;4:15℃、16h诱导的细胞裂解沉淀;5:37℃、4h诱导的细胞裂解上清;6:37℃、4h诱导的细胞裂解沉淀。
图2:基因工程重组大肠埃希氏菌(escherichiacoli)blcpa3株的westernblot(采用抗his抗体)鉴定结果图中:m2:westernblotmarker;pet:空载体细胞裂解物;1:15℃、16h诱导的细胞裂解物;2:37℃、4h诱导的细胞裂解物;3:15℃、16h诱导的细胞裂解上清;4:15℃、16h诱导的细胞裂解沉淀;5:37℃、4h诱导的细胞裂解上清;6:37℃、4h诱导的细胞裂解沉淀。
图3:目的蛋白的westernblot(采用抗a型产气荚膜梭菌血清)鉴定结果图中m2:westernblotmarker;1:空载体细胞裂解物;2:纯化后的目的蛋白。
图4:基因工程重组大肠埃希氏菌(escherichiacoli)blcpa2株的sds-page鉴定结果,图中:m1:proteinmarker;pc1:bsa(1μg);pc2:bsa(2μg);pet:空载体细胞裂解物;1:15℃、16h诱导的细胞裂解物;2:37℃、4h诱导的细胞裂解物;pet1:空载体细胞裂解上清;pet2:空载体细胞裂解沉淀;3:15℃、16h诱导的细胞裂解上清;4:15℃、16h诱导的细胞裂解沉淀;5:37℃、4h诱导的细胞裂解上清;6:37℃、4h诱导的细胞裂解沉淀。
图5:基因工程重组大肠埃希氏菌(escherichiacoli)blcpa2株的westernblot(采用抗his抗体)鉴定结果图中:m2:westernblotmarker;pet:空载体细胞裂解物;1:15℃、16h诱导的细胞裂解物;2:37℃、4h诱导的细胞裂解物;3:15℃、16h诱导的细胞裂解上清;4:15℃、16h诱导的细胞裂解沉淀;5:37℃、4h诱导的细胞裂解上清;6:37℃、4h诱导的细胞裂解沉淀。
本发明涉及生物材料资源信息
本发明涉及的微生物为:含有3个cpa的c末端拷贝,且重组蛋白的c端添加了6组氨酸标签的重组表达产气荚膜梭菌α毒素蛋白的大肠埃希氏菌(escherichiacoli)blcpa3株。该菌株已于2018年01月18日送交北京市朝阳区北辰西路1号院3号中国科学院微生物研究所中国微生物菌种保藏管理委员会普通微生物中心保藏,保藏编号为:cgmccno.15239。
本发明的积极意义
本发明涉及一种产气荚膜梭菌α毒素重组亚单位疫苗及其生产方法。本发明将野生型产气荚膜梭菌α毒素的无毒区域c末端进行3次重复串联,获得了对于动物体无毒的α毒素c末端3拷贝重组蛋白,同时,在突变蛋白的c端加上6组氨酸标签,作为制苗用抗原。本发明进一步公开了含有所述产气荚膜梭菌α毒素编码基因的重组表达载体和重组宿主细胞。本发明重组表达的产气荚膜梭菌α毒素在小鼠体内完全无毒,且在家兔模型中呈现良好的免疫原性和免疫保护性。本发明的产气荚膜梭菌α毒素或其编码基因能够应用于制备预防产气荚膜梭菌α毒素亚单位疫苗。采用本发明提出的产气荚膜梭菌α毒素重组亚单位疫苗,较我国目前商品化的产气荚膜梭菌毒素灭活疫苗具有明显的优势,不但大大降低了疫苗生产过程中的生物安全风险,而且所制备的疫苗效力远高于现有疫苗。此外,凭借疫苗半成品蛋白浓度高的优势,在与其它抗原共同制备联苗时,无需增大联苗的使用剂量,即可制备联苗,极大方便了联苗的开发。
实施例
以下实施例为更好说明本发明的技术方案,但不对本发明技术方案构成限制。
实施例1
——产气荚膜梭菌α毒素c末端3拷贝重组蛋白的构建、表达及鉴定
1.基因合成
本申请根据产气荚膜梭菌α毒素天然蛋白基因的序列,经密码子优化后,设计了α毒素c末端的三次同向串联,从而获得了对于动物体无毒的产气荚膜梭菌α毒素c末端三拷贝重组蛋白。同时,重组蛋白的c端加上6组氨酸标签。用化学合成的方法,合成了该段基因序列,共包含1137个核苷酸。具体的核酸序列如seqidno.1所示:
具体的氨基酸序列如seqidno.2所示:
2.非融合表达载体的构建
以人工合成的产气荚膜梭菌α毒素c末端3拷贝基因为模板,采用引物对cpa-f/cpa-r(序列3/序列4)进行pcr扩增。
其中上游引物cpa-f序列为:
5’-gccggatccgttggtaagaacgtaaagg-3’28(序列3),其5’端引入限制性内切酶bamhⅰ位点及保护性碱基;
下游引物cpa-r序列为:
5’-ccgctcgagttagtggtgatggtgatgatg-3’30(序列4),其5’端引入限制性内切酶xhoⅰ位点及保护性碱基。
pcr体系为:10×extaqbuffer5μlμl,dntps4μl,上、下游引物各2μl,extaq酶0.5μl,全长基因dna模板2μl,补充ddh2o至50μl体系。pcr反应条件为:94℃预变性10min;94℃变性30s,53℃退火30s,72℃延伸90s,共33个循环;最后72℃环延伸10min。
扩增得到的目的dna条带,经回收后,采用bamhⅰ/xhoⅰ双酶切消化,与经过相同酶切消化的pet30a载体连接,得到插入产气荚膜梭菌α毒素c末端三拷贝基因的阳性克隆pet30-cpac3。将连接好的质粒转化dh5α感受态细胞,挑取单克隆至含有卡那霉素的lb液体培养基中,37℃振荡培养过夜,提取质粒备用。
3.重组表达产气荚膜梭菌α毒素c末端3拷贝基因的基因工程菌株的构建
将提取得到的质粒,转化大肠杆菌bl21(de3)感受态细胞,挑取单克隆至含有卡那霉素的lb液体培养基中,37℃振荡培养过夜,经pcr鉴定含有目的dna片段后,命名为大肠埃希氏菌(e.coli)blcpa3株,并加入等体积的50%甘油lb,-70℃冻存,该菌株已于2018年01月18日送交北京市朝阳区北辰西路1号院3号中国科学院微生物研究所中国微生物菌种保藏管理委员会普通微生物中心保藏,保藏编号为:cgmccno.15239(本发明中该菌株又称为:产气荚膜梭菌α毒素c末端3拷贝氨基酸突变体)。
4.目的蛋白的表达与鉴定
将重组表达产气荚膜梭菌α毒素c末端3拷贝重组蛋白基因的基因工程菌大肠埃希氏菌(e.coli)blcpa3株接种于100ml含有卡那霉素的lb液体培养基中,37℃振荡培养4h后,将温度降至28℃,加入终浓度为0.3mmol/l的iptg溶液诱导培养4h。菌液培养完成后离心收集菌体,按每克菌体加10ml裂解液[0.02mol/ltris缓冲液(ph值7.2),0.3mol/lnacl]的比例重悬菌体,在冰水浴中超声破碎菌体30min,破碎条件为:工作9s,间歇9s,超声功率为400w。将破碎后的菌液于4℃,以12000r/min离心30min,弃去上清液,收集沉淀的包涵体。按每克包涵体用5ml溶解液(6mol/l盐酸胍,20mmol/ltris-hcl,ph值8.0)的比例在室温下以200r/min振荡溶解2小时后,4℃10000r/min离心30min,收集上清液。取30μl上清加入10μl的×sds-page上样缓冲液,70℃作用10min,进行12%sds-page电泳,结果见图1。从图1可以看出,目的蛋白大量存在于菌体裂解液的沉淀中,呈包涵体表达,表达量良好,表达量可达0.42mg/ml。目的蛋白的最适诱导表达条件为37℃,诱导表达4h。
5.目的蛋白的westernblot鉴定
采用上述步骤中不同诱导条件下的目的蛋白表达产物,采用抗his抗体,对目的蛋白进行westernblot鉴定,结果见图2。从图2可知,37℃、4h诱导的细胞裂解沉淀中,目的蛋白的表达最高。综合sds-page和westernblot鉴定结果,进一步确定目的蛋白的最适诱导表达条件为37℃,诱导表达4h。
实施例2
——产气荚膜梭菌α毒素c末端3拷贝重组蛋白的免疫原性试验
(1)菌液培养:将重组表达产气荚膜梭菌α毒素c末端3拷贝重组蛋白的大肠埃希氏菌blcpa3株培养菌液,按培养基总量的2%接种含卡那霉素的lb液体培养基,发酵罐内培养。设置培养参数为:培养温度37℃,ph值7.0,溶氧40%。当培养物od600值为10~15时,加入终浓度为0.3mmol/l的iptg诱导培养4h。
(2)破菌:离心收集菌体,按每克菌体湿重加10ml裂解液(ph值7.20.02mol/ltris缓冲液,0.3mol/lnacl)的比例重悬菌体,4的条件下用低温高压均质机以800bar的压力破碎菌体3次。裂解液经4。裂解液经4℃10000r/min离心30min,弃去上清液,收集沉淀的包涵体。
(3)纯化:按每克包涵体用5ml溶解液(6mol/l盐酸胍,20mmol/ltris-hcl,ph值8.0)的比例在室温下以200r/min振荡溶解2小时后,4℃10000r/min离心30min,收集上清液
(4)蛋白含量检测:用bca法检测蛋白含量。结果蛋白含量为0.78mg/ml。经sds-page检测并对条带进行灰度扫描,蛋白纯度为82%。
(5)无菌检验:按现行《中国兽药典》附录进行。结果均无菌生长。
(6)疫苗配制:将双相油佐剂(如201佐剂)导入油相罐内,以至少121℃高压灭菌30分钟,冷却至室温备用。根据蛋白含量测定结果,用pbs(ph值7.20.01mol/l)将检验合格的纯化蛋白稀释至终浓度为100μg/ml后混匀。将水相加入乳化罐内,以80~100r/min搅拌,同时按1:1(v/v)的比例,缓慢加入油相,加完后搅拌20~30min。乳化后取样进行检验,合格后分装。
(7)免疫原性试验:按照《中国兽药典》规定的方法进行。具体试验方法为:用体重1.5~2.0kg健康家兔4只,各颈部皮下或肌肉注射疫苗2.0ml。接种后14日,采血,分离血清。同时,以相同剂量、相同途径对家兔进行二次免疫。二免后21日,采血,分离血清。采用下述方法,分别对一次免疫和二次免疫后,家兔血清中的毒素抗体效价进行测定:
将4只免疫家兔的血清等量混合,取混合血清0.4ml与0.8ml产气荚膜梭菌α毒素(含4个小鼠mld),混合后置37合作用40min,然后静脉注射16~20g小鼠2只,0.3ml/只。同时各用同批小鼠2只,分别注射1mld与毒素血清混合物相同的毒素作对照。观察1日,判定结果。若对照鼠全部死亡,血清中和效价对产气荚膜梭菌α毒素达到1(0.1ml免疫动物血清中和1mld毒素),即判为合格。
经测定,一次免疫后,家兔血清中的毒抗体效价为4(即0.1ml家兔血清可中和4mld的产气荚膜梭菌α毒素);二次免疫后,家兔血清中的毒抗体效价为8(即0.1ml家兔血清可中和8mld的产气荚膜梭菌α毒素),证明该疫苗具有良好的免疫原性。
鉴于我国现有商品化梭菌毒素疫苗须采用甲醛灭活脱毒,存在生物安全隐患,也影响了疫苗在田间使用的安全性;同时现行商品化疫苗在生产过程中,还存在产毒不稳定,导致疫苗效力不稳定的问题。因此,本申请生产的疫苗是我国现行产气荚膜梭菌灭活疫苗升级换代的理想候选疫苗。
实施例3
——产气荚膜梭菌α毒素c末端2拷贝重组蛋白的构建、表达及鉴定
1.基因合成
本申请根据产气荚膜梭菌α毒素天然蛋白基因的序列,经密码子优化后,设计了α毒素c末端的2次同向串联,从而获得了对于动物体无毒的产气荚膜梭菌α毒素c末端2拷贝重组蛋白。同时,重组蛋白的c端加上6组氨酸标签。用化学合成的方法,合成了该段基因序列,共包含765个核苷酸。具体的核酸序列如seqidno.5所示:
氨基酸序列见seqidno.6所示:
2.非融合表达载体的构建
以人工合成的产气荚膜梭菌α毒素c末端2拷贝基因为模板,采用引物对cpa-f/cpa-r(序列3/序列4)进行pcr扩增。
5’-gccggatccgttggtaagaacgtaaagg-3’28(序列3),
5’-ccgctcgagttagtggtgatggtgatgatg-3’30(序列4)。
pcr体系为:10×extaqbuffer5μlμl,dntps4μl,上、下游引物各2μl,extaq酶0.5μl,全长基因dna模板2μl,补充ddh2o至50μl体系。pcr反应条件为:94℃预变性10min;94℃变性30s,53℃退火30s,72℃延伸1min,共33个循环;最后72℃环延伸10min。
扩增得到的目的dna条带,经回收后,采用bamhⅰ/xhoⅰ双酶切消化,与经过相同酶切消化的pet30a载体连接,得到插入产气荚膜梭菌α毒素c末端两拷贝基因的阳性克隆pet30-cpac2。将连接好的质粒转化dh5α感受态细胞,挑取单克隆至含有卡那霉素的lb液体培养基中,37℃振荡培养过夜,提取质粒备用。
3.重组表达产气荚膜梭菌α毒素c末端2拷贝基因的基因工程菌株的构建
将提取得到的质粒,转化大肠杆菌bl21(de3)感受态细胞,挑取单克隆至含有卡那霉素的lb液体培养基中,37℃振荡培养过夜,经pcr鉴定含有目的dna片段后,命名为大肠埃希氏菌(e.coli)blcpa2株,并加入等体积的50%甘油lb,-70℃冻存。
4.目的蛋白的表达与鉴定
将重组表达产气荚膜梭菌α毒素c末端2拷贝重组蛋白基因的基因工程菌大肠埃希氏菌(e.coli)blcpa2株接种于100ml含有卡那霉素的lb液体培养基中,37℃振荡培养4h后,将温度降至28℃,加入终浓度为0.3mmol/l的iptg溶液诱导培养4h。菌液培养完成后离心收集菌体,按每克菌体加10ml裂解液[0.02mol/ltris缓冲液(ph值7.2),0.3mol/lnacl]的比例重悬菌体,在冰水浴中超声破碎菌体30min,破碎条件为:工作9s,间歇9s,超声功率为400w。将破碎后的菌液于4℃,以12000r/min离心30min,弃去上清液,收集沉淀的包涵体。按每克包涵体用5ml溶解液(6mol/l盐酸胍,20mmol/ltris-hcl,ph值8.0)的比例在室温下以200r/min振荡溶解2小时后,4℃10000r/min离心30min,收集上清液。取30μl上清加入10μl的×sds-page上样缓冲液,70℃作用10min,进行12%sds-page电泳,结果见图1。从图1可以看出,目的蛋白大量存在于菌体裂解液的沉淀中,呈包涵体表达,表达量良好,表达量可达0.31mg/ml。目的蛋白的最适诱导表达条件为37℃,诱导表达4h。
5.目的蛋白的westernblot鉴定
采用上述步骤中不同诱导条件下的目的蛋白表达产物,采用抗his抗体,对目的蛋白进行westernblot鉴定,结果见图2。从图2可知,37℃、4h诱导的细胞裂解沉淀中,目的蛋白的表达最高。综合sds-page和westernblot鉴定结果,进一步确定目的蛋白的最适诱导表达条件为37℃,诱导表达4h。
实施例4
——产气荚膜梭菌α毒素c末端2拷贝重组蛋白的免疫原性试验
(1)菌液培养:将重组表达产气荚膜梭菌α毒素c末端2拷贝重组蛋白的大肠埃希氏菌blcpa2株培养菌液,按培养基总量的2%接种含卡那霉素的lb液体培养基,发酵罐内培养。设置培养参数为:培养温度37℃,ph值7.0,溶氧40%。当培养物od600值为10~15时,加入终浓度为0.3mmol/l的iptg诱导培养4h。
(2)破菌:离心收集菌体,按每克菌体湿重加10ml裂解液(ph值7.20.02mol/ltris缓冲液,0.3mol/lnacl)的比例重悬菌体,4的条件下用低温高压均质机以800bar的压力破碎菌体3次。裂解液经4。裂解液经4℃10000r/min离心30min,弃去上清液,收集沉淀的包涵体。
(3)纯化:按每克包涵体用5ml溶解液(6mol/l盐酸胍,20mmol/ltris-hcl,ph值8.0)的比例在室温下以200r/min振荡溶解2小时后,4℃10000r/min离心30min,收集上清液
(4)蛋白含量检测:用bca法检测蛋白含量。结果蛋白含量为0.57mg/ml。经sds-page检测并对条带进行灰度扫描,蛋白纯度为76%。
(5)无菌检验:按现行《中国兽药典》附录进行。结果均无菌生长。
(6)疫苗配制:将双相油佐剂(如201佐剂)导入油相罐内,以至少121℃高压灭菌30分钟,冷却至室温备用。根据蛋白含量测定结果,用pbs(ph值7.20.01mol/l)将检验合格的纯化蛋白稀释至终浓度为100μg/ml后混匀。将水相加入乳化罐内,以80~100r/min搅拌,同时按1:1(v/v)的比例,缓慢加入油相,加完后搅拌20~30min。乳化后取样进行检验,合格后分装。
(7)免疫原性试验:按照《中国兽药典》规定的方法进行。具体试验方法为:用体重1.5~2.0kg健康家兔4只,各颈部皮下或肌肉注射疫苗2.0ml。接种后14日,采血,分离血清。同时,以相同剂量、相同途径对家兔进行二次免疫。二免后21日,采血,分离血清。采用下述方法,分别对一次免疫和二次免疫后,家兔血清中的毒素抗体效价进行测定:
将4只免疫家兔的血清等量混合,取混合血清0.4ml与0.8ml产气荚膜梭菌α毒素(含4个小鼠mld),混合后置37合作用40min,然后静脉注射16~20g小鼠2只,0.3ml/只。同时各用同批小鼠2只,分别注射1mld与毒素血清混合物相同的毒素作对照。观察1日,判定结果。若对照鼠全部死亡,血清中和效价对产气荚膜梭菌α毒素达到1(0.1ml免疫动物血清中和1mld毒素),即判为合格。
经测定,一次免疫后,家兔血清中的毒抗体效价为3(即0.1ml家兔血清可中和3mld的产气荚膜梭菌α毒素);二次免疫后,家兔血清中的毒抗体效价为8(即0.1ml家兔血清可中和8mld的产气荚膜梭菌α毒素),证明该疫苗具有良好的免疫原性。
序列表
<110>中国兽医药品监察所
<120>一种产气荚膜梭菌α毒素重组亚单位疫苗及其生产方法
<160>6
<170>siposequencelisting1.0
<210>1
<211>1137
<212>dna
<213>人工合成()
<220>
- 还没有人留言评论。精彩留言会获得点赞!