羟苯水杨胺羟基化物在制备抗肿瘤药物中的应用的制作方法
本发明属于制药领域,涉及一种羟苯水杨胺羟基化物在制备抗肿瘤药物中的应用。
背景技术:
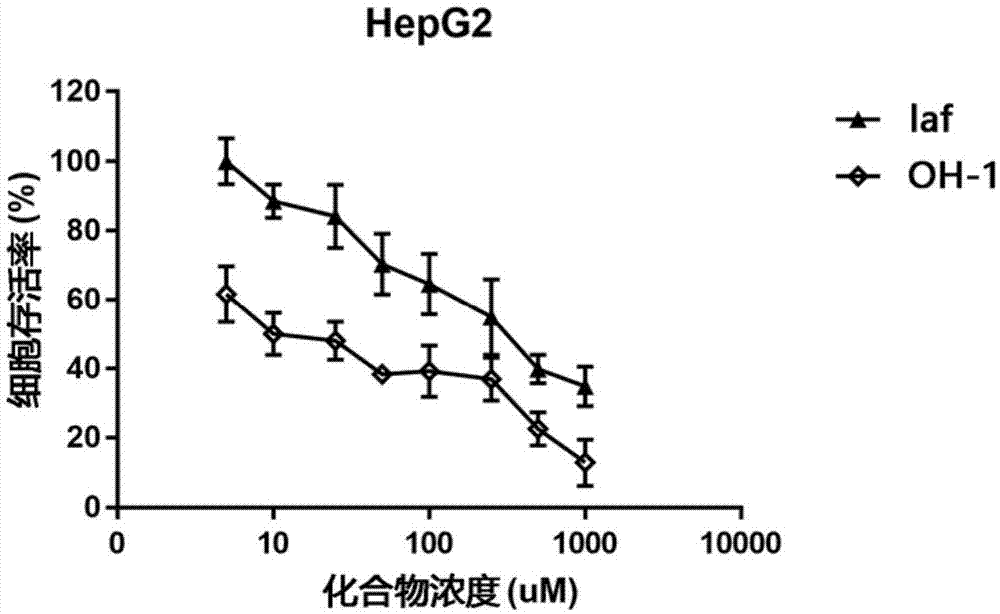
:核糖核苷酸还原酶(ribonucleotidereductase,rr)是人体细胞dna合成和修复的关键酶,其功能是将核糖核苷酸(ribonucleotidetriphosphates,ndps)还原为脱氧核糖核苷酸(deoxyribonucleotidetriphosphates,dndps),后者进一步被激酶磷酸化为dntps,为dna合成提供原料。rr酶的结构包括两个相同的大亚基(ribonuclotidereductaselargesubunitm1,rrm1)和两个相同的小亚基(ribonuclotidereductasesmallsubunitm2orm2b,rrm2或rrm2b)。rrm1包含催化位点和两个别构调节位点,rrm2和rrm2b包含一个双铁酪氨酰自由基中心。rr三种亚基分别组成两类rr酶,即rrm1-rrm2和rrm1-rrm2b。rrm1-rrm2主要为增殖细胞的基因组dna复制提供dndps。rrm1-rrm2b主要参与dna修复和线粒体dna合成,受p53介导的dna损伤应答通路调控。rrm2高表达以及rr酶活性升高促进细胞快速增殖与肿瘤发生发展有密切关系,因而rr酶抑制剂已经成为临床抗肿瘤治疗的重要药物之一。但因现有rr酶抑制剂活性低或者有明显不良反应,新型rr酶抑制剂的研发具有重要意义。rr是抗肿瘤药物的重要靶标之一,其作为药物靶点早有研究,并且已有多种小分子化合物上市或已进行临床试验,目前临床常用的rr酶抑制剂主要有吉西他滨(gemcitabine,gem)和羟基脲(hydroxyurea,hu)等。gem是核苷类药物,在细胞内经激酶磷酸化为dndp和dntp类似物后,分别抑制rrm1和dna聚合酶而发挥抗肿瘤作用,是非小细胞肺癌和胰腺癌等治疗的主要药物。hu通过灭活rrm2的酪氨酰自由基和铁中心而抑制rr酶活性,主要用于白血病等的治疗。除此之外,还有目前正在临床试验的triapine(3ap),其临床试验证明在白血病的治疗中有较好效果,但因其毒性较大,其应用也有一定限制。但对rr酶具有抑制作用的药物分子仍然比较少见。技术实现要素:本发明的目的是提供一种羟苯水杨胺羟基化物在制备抗肿瘤药物中的应用。所述羟苯水杨胺羟基化物的结构式为:本发明所述肿瘤为人肝癌、人结肠癌、人乳腺癌、人前列腺癌、人胃癌、人肺癌。本发明提供的羟苯水杨胺羟基化物是一种对rr酶具有抑制作用的药物分子,并具有一定的抗肿瘤活性。基于我们解析的rrm2晶体结构和计算机辅助虚拟筛选,发现该化合物羟苯水杨胺羟基化物可以抑制rr酶。附图说明图1是羟苯水杨胺(laf)及羟苯水杨胺羟基化物(oh-1)针对人肝癌细胞(hepg2细胞)的杀伤活性。图2是羟苯水杨胺(laf)及羟苯水杨胺羟基化物(oh-1)针对人肝癌细胞(bel-7402细胞)的杀伤活性。图3是羟苯水杨胺(laf)及羟苯水杨胺羟基化物(oh-1)针对人肝癌细胞(huh-7细胞)的杀伤活性。图4是羟苯水杨胺(laf)及羟苯水杨胺羟基化物(oh-1)针对人结肠癌细胞(lovo细胞)的杀伤活性。图5是羟苯水杨胺(laf)及羟苯水杨胺羟基化物(oh-1)针对人乳腺癌细胞(mcf-7细胞)的杀伤活性。图6是羟苯水杨胺(laf)及羟苯水杨胺羟基化物(oh-1)针对人乳腺癌细胞(t-47d细胞)的杀伤活性。图7是羟苯水杨胺(laf)及羟苯水杨胺羟基化物(oh-1)针对人乳腺癌细胞(mda-mb-231细胞)的杀伤活性。图8是羟苯水杨胺(laf)及羟苯水杨胺羟基化物(oh-1)针对人前列腺癌细胞(pc-3细胞)的杀伤活性。图9是羟苯水杨胺(laf)及羟苯水杨胺羟基化物(oh-1)针对人胃癌细胞(sgc-7901细胞)的杀伤活性;图10是羟苯水杨胺(laf)及羟苯水杨胺羟基化物(oh-1)针对人胃癌细胞(hgc-27细胞)的杀伤活性。图11是羟苯水杨胺(laf)及羟苯水杨胺羟基化物(oh-1)针对人肺癌细胞(a549细胞)的杀伤活性。具体实施方式本发明结合附图和实施例作进一步的说明。一、羟苯水杨胺羟基化物在抑制rr酶方面的作用实施例1羟苯水杨胺及其衍生物分子对接计算1.通过simbiosys公司的分子对接软件ehits(version12.0,simbiosysinc.,canada),预测4个化合物与靶标rrm2结合能力大小。所述4个化合物为:2.分子对接方法小分子的准备:使用openbabel2.3.0将2d小分子转换3d结构,以进行分子对接研究。靶标及活性口袋定义:rrm2的晶体结构是从pdb库中获得(pdbcode:3olj),其活性口袋的定义参照xialiu等发表在biochemicalpharmacology上的文章,即将f244,d271,r330和e334所在区域定义为活性位点。分子对接方法:使用来自wiley的ehits软件进行分子对接研究。ehits一款精确、快速的柔性分子对接软件。ehits会对靶标进行自动预处理;并且对接的小分子只需是3d结构即可,不必是能量最低构象。对接时的精确度参数-accuracy设为6,即最高精确度进行分子对接。分别将羟苯水杨胺及其衍生物对接到此位点以评估以其与rrm2结合能力的强弱。3.化合物的结合能力打分4个小分子的对接打分如下表1,并依据结合能力强弱进行了排序。表1nameehits-scoreoh-1.mol-3.807laf.mol-2.885oh-2.mol-2.424hu.mol-2.289注:ehits软件通过ehits_score来评价小分子化合物与靶标的结合能力大小。ehits_score对应是的log(kd)(解离常数取对数),值越负代表小分子化合物的结合能力越强,如-6相当于μm、-9相当于nm;数值相差为1,结合能力相差10倍。二、羟苯水杨胺羟基化物在抗肿瘤方面的作用实施例2.针对人肝癌细胞的杀伤活性1.实验材料:(1)细胞株:人肝癌细胞(hepg2细胞)(美国atcc,本实验室传代保存),培养于dmem培养基(含10%胎牛血清)。(2)主要试剂:dmem培养基(美国corning公司),胎牛血清(美国corning公司),cck-8试剂(日本同仁化学研究所),柳胺酚(laf,加拿大torontoresearchchemical公司),羟苯水杨胺羟基化物(oh-1,杭州和素化学)。(3)主要仪器:生物安全柜(美国thermofisher公司),二氧化碳培养箱(美国thermoforma公司),全自动酶标仪(美国bio-tek公司)。2.实验方法:(1)细胞培养细胞培养于dmem培养基(含10%胎牛血清,ph7.2),培养基加2mmol/l谷氨酰胺,置于细胞培养箱中在37℃、5%co2环境下培养。(2)cck8试剂盒测定各药物的细胞毒性取hepg2细胞用胰酶消化后制备成单细胞悬液,计数后调整细胞浓度至5×104个/ml。取96孔培养板每孔加入100μl上述细胞悬液,置co2孵箱37℃培养24h后,细胞贴壁且生长良好,加不同浓度的用培养基配制的药物100μl,对照组加入相应体积的空白培养基,每组设置3个平行孔。连续培养72h,培养结束前2h,每孔加入cck8试剂10μl,于co2孵箱中继续培养。2h后自动酶标仪检测450nm各孔od值。计算细胞存活率:细胞抑制率(%)=[1-(实验孔od均值/对照孔od均值)]×100%。拟合函数求出抑制细胞生长达50%时药物浓度ic50。实验重复三次。3.实验结果实验结果见图1。结论:羟苯水杨胺羟基化物对hepg2细胞的杀伤活性大于柳胺酚,两者的ic50分别是89um和278um,即羟苯水杨胺羟基化物对hepg2细胞的杀伤活性约是柳胺酚的3.1倍。实施例3.针对人肝癌细胞的杀伤活性1.实验材料:人肝癌细胞(bel-7402细胞)(美国atcc,本实验室传代保存),培养于rpmi-1640培养基(含10%胎牛血清)。其他同实施例1。2.实验方法:参见实施例1。3.实验结果:实验结果见图2。结论:羟苯水杨胺羟基化物对bel-7402细胞的杀伤活性大于柳胺酚,两者的ic50分别是47um和104um,即羟苯水杨胺羟基化物对bel-7402细胞的杀伤活性约是柳胺酚的2.2倍。实施例4.针对人肝癌细胞的杀伤活性1.实验材料:人肝癌细胞(huh-7细胞)(美国atcc,本实验室传代保存),培养于dmem培养基(含10%胎牛血清)。其他同实施例1。2.实验方法:参见实施例1。3.实验结果:实验结果见图3。结论羟苯水杨胺羟基化物对huh-7细胞的杀伤活性大于柳胺酚,两者的ic50分别是43um和174um,即羟苯水杨胺羟基化物对huh-7细胞的杀伤活性约是柳胺酚的4倍。实施例5.针对人结肠癌细胞的杀伤活性1.实验材料:人结肠癌细胞(lovo细胞)(美国atcc,本实验室传代保存),培养于rpmi-1640培养基(含10%胎牛血清)。其他同实施例1。2.实验方法:参见实施例1。3.实验结果:实验结果见图4。结论羟苯水杨胺羟基化物对lovo细胞的杀伤活性大于柳胺酚,两者的ic50分别是137um和200um,即羟苯水杨胺羟基化物对lovo细胞的杀伤活性约是柳胺酚的1.5倍。实施例6.针对人乳腺癌细胞的杀伤活性1.实验材料:人乳腺癌细胞(mcf-7细胞)(美国atcc,本实验室传代保存),培养于rpmi-1640培养基(含10%胎牛血清)。其他同实施例1。2.实验方法:参见实施例1。3.实验结果实验结果见图5。结论:羟苯水杨胺羟基化物对mcf-7细胞的杀伤活性大于柳胺酚,两者的ic50分别是276um和1262um,即羟苯水杨胺羟基化物对mcf-7细胞的杀伤活性约是柳胺酚的4.6倍。实施例7.针对人乳腺癌细胞的杀伤活性1.实验材料:人乳腺癌细胞(t-47d细胞)(美国atcc,本实验室传代保存),培养于rpmi-1640培养基(含10%胎牛血清)。其他同实施例1。2.实验方法:参见实施例1。3.实验结果实验结果见图6。结论:羟苯水杨胺羟基化物对t-47d细胞的杀伤活性与柳胺酚相当,两者的ic50分别是163um和166um。实施例8.针对人乳腺癌细胞的杀伤活性1.实验材料:人乳腺癌细胞(mda-mb-231细胞)(美国atcc,本实验室传代保存),培养于rpmi-1640培养基(含10%胎牛血清)。其他同实施例1。2.实验方法:参见实施例1。3.实验结果实验结果见图7。结论:羟苯水杨胺羟基化物对mda-mb-231细胞的杀伤活性大于柳胺酚,两者的ic50分别是108um和132um,即羟苯水杨胺羟基化物对mda-mb-231细胞的杀伤活性约是柳胺酚的1.2倍。实施例9.针对人前列腺癌细胞的杀伤活性1.实验材料:人前列腺癌细胞(pc-3细胞)(美国atcc,本实验室传代保存),培养于dmem培养基(含10%胎牛血清)。其他同实施例1。2.实验方法:参见实施例1。3.实验结果实验结果见图8。结论:羟苯水杨胺羟基化物对pc-3细胞的杀伤活性大于柳胺酚,两者的ic50分别是322um和408um,即羟苯水杨胺羟基化物对pc-3细胞的杀伤活性约是柳胺酚的1.3倍。实施例10.针对人胃癌细胞的杀伤活性1.实验材料:人胃癌细胞(sgc-7901细胞)(美国atcc,本实验室传代保存),培养于rpmi-1640培养基(含10%胎牛血清)。其他同实施例1。2.实验方法:参见实施例1。3.实验结果实验结果见图9。结论:羟苯水杨胺羟基化物对sgc-7901细胞的杀伤活性大于柳胺酚,两者的ic50分别是354um和412um,即羟苯水杨胺羟基化物对sgc-7901细胞的杀伤活性约是柳胺酚的1.2倍。实施例11.针对人胃癌细胞的杀伤活性1.实验材料:人胃癌细胞(hgc-27细胞)(美国atcc,本实验室传代保存),培养于rpmi-1640培养基(含10%胎牛血清)。其他同实施例1。2.实验方法:参见实施例1。3.实验结果实验结果见图10。结论:羟苯水杨胺羟基化物对hgc-27细胞的杀伤活性大于柳胺酚,两者的ic50分别是237um和316um,即羟苯水杨胺羟基化物对hgc-27细胞的杀伤活性约是柳胺酚的1.3倍。实施例12.针对人肺癌细胞的杀伤活性1.实验材料:人肺癌细胞(a549细胞)(美国atcc,本实验室传代保存),培养于dmem培养基(含10%胎牛血清)。其他同实施例1。2.实验方法:参见实施例1。3.实验结果实验结果见图11。结论:羟苯水杨胺羟基化物对a549细胞的杀伤活性与柳胺酚相当,两者的ic50分别是206um和190um。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1