8-羟基喹啉类药物或其盐在制备用于治疗与BRD4相关的疾病的药物中的应用的制作方法
本发明属于医药
技术领域:
。具体涉及8-羟基喹啉(8-oh-quinoline)类化合物或其盐在制备用于治疗与brd4相关的疾病的药物的应用,更具体而言,涉及8-羟基喹啉(8-oh-quinoline)类化合物或其盐在制备用于治疗包括nut-中线癌、急性淋巴白血病、混合谱系白血病、多发性骨髓瘤、burkitt’s淋巴瘤、肝细胞癌、三阴性乳腺癌、非小细胞肺癌、前列腺癌、胰腺癌、成神经细胞瘤等多种肿瘤类型以及心脏衰竭的药物中的应用。
背景技术:
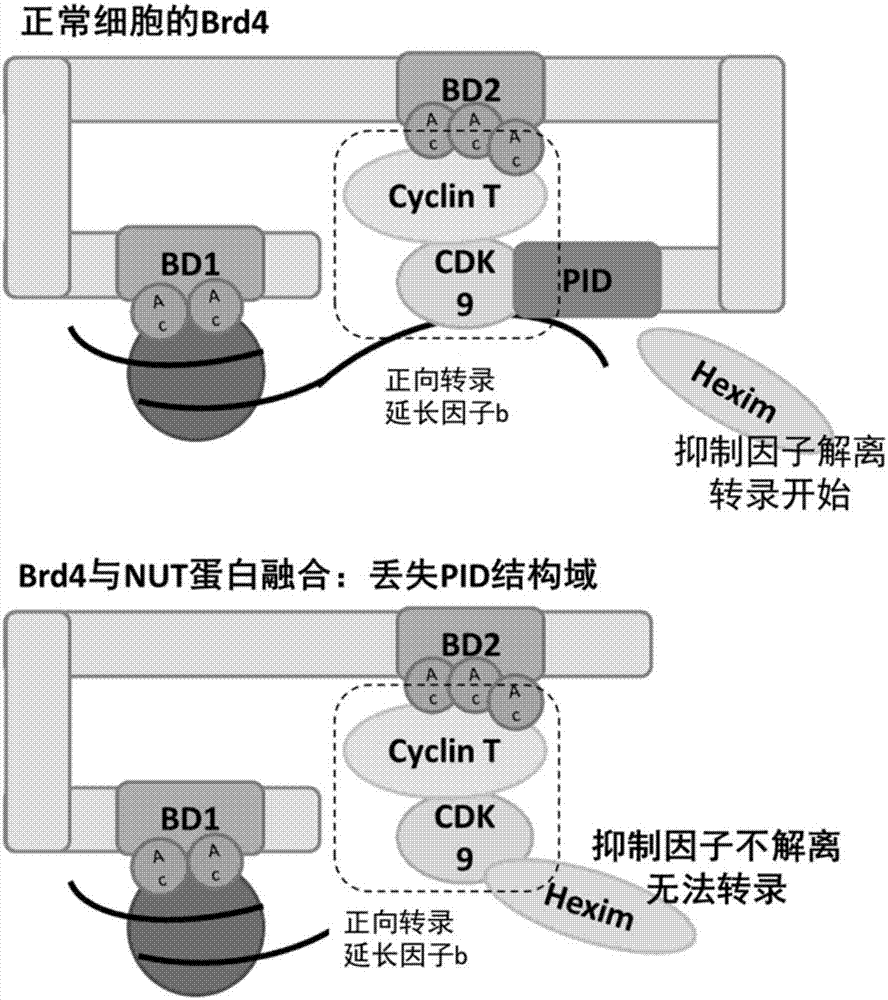
:近年来,含有溴结构域的蛋白4(bromodomain-containingprotein4,brd4)被发现与心脏衰竭密切相关,brd4抑制剂通过减少过度肥厚基因的表达,缓解心肌细胞肥大症状,这为研发治疗心脏衰竭的药物提供了新的方向。此外,brd4已被确证为多种癌症(包括nut-中线癌、多发性骨髓瘤、急性淋巴白血病等)的靶标,主要机制是:在中线癌中,染色体易位导致形成brd4蛋白与nut融合蛋白,促使细胞产生分化障碍并恶性增殖,从而导致相关癌症发生。在c-myc依赖的肿瘤中,brd4识别组蛋白上乙酰化的赖氨酸,启动下游c-myc的转录,导致相关癌症。心脏肥大包括原发性心肌肥大和其他因素(如高血压等)引起的为抵抗高负荷的代偿性心肌肥厚,是心脏衰竭的主要原因。患者出现水肿、不能平卧等症状,严重影响生活质量。心脏衰竭多发生于中老年人,但近年来由于生活压力大,很多年轻人也出现了心脏衰竭的症状。目前的治疗方法是使用强心药增加心肌收缩力,但是这类药物存在治疗窗窄或选择性差等问题,并且忽略了对肥大心肌细胞的处理。而8-羟基喹啉类药物通过抑制brd4,减轻心肌肥厚,配合其他药物减轻心脏负荷,可能成为心脏衰竭的新疗法。nut-中线癌(nut-midlinecarcinoma)是一种少见的高侵袭性高死亡率的恶性肿瘤,好发于儿童、青年,由发现到死亡通常不到一年。发病机制是由于染色体异位导致睾丸核蛋白(nut)与brd4蛋白融合,使brd4丢失结合转录因子的pid结构域而无法激活转录,细胞分化无法完成,进而演化为癌变。nut-中线癌目前尚无特异性的有效药物,对患者生命带来严重威胁。另外,brd4已被确证为许多与c-myc过表达相关的癌症的靶标,这些癌症包括急性淋巴白血病、混合谱系白血病、多发性骨髓瘤、burkitt’s淋巴瘤、肝细胞癌、三阴性乳腺癌、非小细胞肺癌、前列腺癌、胰腺癌、成神经细胞瘤等,目前没有特效的治疗指南或现有药物毒性大、易复发。因此需要研发新母核结构的抗癌药。对于已知疾病靶标和靶标蛋白的三维高分辨率结构的情况,基于结构的药物设计(structure-baseddrugdesign,sbdd)由于具有机制明确、针对性强、发现活性化合物效率高等优点而被广泛应用。虚拟筛选(virtualscreening)通过计算方法筛选出可能有治疗作用的化学分子,通常能够有效降低基于结构药物设计的成本。药物虚拟筛选成功的必要条件有两个:(1)足够大的化学空间(chemicalspace),即所用的化学数据库中涵盖分子的结构母核要多样,并且软件可以高效产生配体和受体较可能存在的构象(conformation);(2)准确的打分函数(scoringfunction),主要是从基于力场、基于经验和基于知识三种原理发展的,运用一些能量计算和统计学习方法,用于快速有效地评价未知配体对给定的受体是否可稳定结合甚至预测结合强度(bindingaffinity)或结合自由能(bindingfreeenergy)。本发明通过虚拟筛选与实验验证相结合的方式,发现了新母核brd4抑制剂可能用于治疗相关疾病。迄今为止,尚未见有关针对brd4结合机制设计的生物学或化学治疗药物的报道。因此,本领域迫切需要开发能够有效治疗上述疾病、副作用小的药物。技术实现要素:本发明在对靶标brd4生物功能研究基础上,通过虚拟筛选已上市小分子药物数据库并结合体外活性评价等,发现了几种8-羟基喹啉(8-oh-quinoline)类药物或其盐为靶向brd4的抑制剂,在治疗某些肿瘤、心脏衰竭等疾病中的新用途。根据本发明的第一方面,通过虚拟筛选与实验验证相结合的方式,筛选得到具有新结构实体的靶向人brd4蛋白的活性化合物。所述的活性化合物为表1所列的8-羟基喹啉类化合物,所述活性化合物的结合位点是brd4的两个溴结构域bd1和bd2。表1:8-羟基喹啉类化合物本发明采用计算机虚拟筛选,通过基于brd4bd1蛋白结构域的结构(http://www.rcsb.org/pdb/explore/explore.do?structureid=4gpj)的药物分子设计和虚拟筛选的方法,经glide5.6分子对接软件对已上市小分子药物数据库进行虚拟筛选,通过打分排序和专家经验判断挑选出部分化合物进行生物实验验证,最终筛选出表1所列8个活性化合物。根据本发明的第二方面,提供了所述8-羟基喹啉类化合物或其盐在制备用于治疗与brd4相关的疾病的药物中的用途,优选地,所述与brd4相关的疾病包括心脏衰竭、nut-中线癌、急性淋巴白血病、混合谱系白血病、多发性骨髓瘤、burkitt’s淋巴瘤、肝细胞癌、三阴性乳腺癌、非小细胞肺癌、前列腺癌、胰腺癌和成神经细胞瘤。在另一优选例中,所述的心脏衰竭包括心脏肥大、心肌细胞肥大。根据本发明的第三方面,提供了一种体外抑制brd4表达和/或活性的方法,其特征在于,用表1所列化合物的一种或几种竞争性抑制乙酰化赖氨酸与brd4结合。在另一优选例中,brd4结合的底物包括组蛋白乙酰化赖氨酸、正向转录延长因子b(p-tefb)、pdid结构域等。在另一优选例中,所述方法使用的化合物作用在brd4的结构域包括bd1和bd2。根据本发明的第四方面,提供了诱导多种肿瘤细胞凋亡、抑制心肌细胞肥大的方法,其特征在于,在所述8-羟基喹啉类化合物中的一种或几种存在下培养相关肿瘤细胞或心肌细胞,从而诱导相关肿瘤细胞凋亡或减轻心肌细胞肥厚;或抑制brd4表达和/或活性;或抑制c-myc基因转录。在另一优选例中,所述的肿瘤细胞典型细胞系为中线癌细胞株797、per403,白血病细胞mv4.11、thp-1,胰腺癌细胞株capan-1、aspc-1、panc-1,多发性骨髓瘤细胞kms11、kms12、u266、h929、mm.1s、mm.1r,三阴性乳腺癌细胞mda-mb-231、bt-549,肝癌细胞株hepg2、smmc7721、hepb3、bel-7402等。根据本发明的第五方面,提供了治疗肿瘤、心脏衰竭等疾病的方法,即向所需要的对象施用安全有效量的一种或几种所述8-羟基喹啉类化合物或其盐。优选地,所述肿瘤包括nut-中线癌、多发性骨髓瘤、肝细胞癌、三阴性乳腺癌,所述心脏衰竭包括心脏肥大疾病和心肌细胞肥大疾病。在另一优选例中,所述需要的对象包括人或非人哺乳动物,优选地,为人、小鼠或大鼠。附图说明图1显示了nut-中线癌的分子生物学机制,即brd4与nut蛋白融合,导致pid结构域丢失,无法激活转录。图2显示了放大化学发光亲和均相检测(alpha)技术测定本发明所述的8-羟基喹啉类化合物对brd4的分子水平抑制的ic50曲线。图3显示了蛋白质热迁移实验验证化合物nitroxoline与bd1蛋白结合曲线。图4显示了本发明所述的8-羟基喹啉类化合物nitroxoline对nut-中线癌细胞增殖的抑制、分化相关靶基因的激活及对凋亡的诱导作用。图5显示了本发明所述的8-羟基喹啉类化合物nitroxoline对c-myc原癌蛋白依赖的aml白血病细胞增殖的抑制、c-myc转录及表达的抑制及对周期阻滞和凋亡的诱导作用。图6显示了本发明所述的8-羟基喹啉类化合物nitroxoline对c-myc原癌蛋白依赖的胰腺癌细胞增殖的抑制、c-myc转录及表达的抑制、在动物模型上对胰腺癌肿瘤生长的抑制。图7显示了本发明所述的8-羟基喹啉类化合物nitroxoline对心肌细胞肥大相关基因的抑制作用。具体实施方式本发明人经过广泛而深入的研究,通过虚拟筛选与实验验证相结合的方式,首次发现了几种用于其他疾病的8-羟基喹啉(8-oh-quinoline)类药物通过抑制brd4蛋白的活性,对某些肿瘤和心脏衰竭有良好的治疗前景。实验证明,8-羟基喹啉类化合物能够抑制brd4,并减少c-myc基因或肥大基因的转录,对相关肿瘤细胞具有诱导凋亡和/或抑制其增殖的作用,对心肌细胞有防止肥大的作用,从而对上述疾病有治疗作用。此外,细胞毒性实验也证实了作为已知上市的药物,治疗剂量下的8-羟基喹啉药物用于治疗相关肿瘤和心脏衰竭时,也无明显的毒性。在此基础上,完成了本发明。如本文所用,术语“8-羟基喹啉类药物”、“8-羟基喹啉类化合物”、“本发明活性成分”、“此类药物”、“表1所列化合物”均指具有如表1所列化学结构式的化合物。所述8-羟基喹啉类药物已批准的用途如表2所示。表2:8-羟基喹啉类药物已批准的用途本发明人发现,上述8-羟基喹啉类药物除了具有上述已批准的治疗作用外,还对brd4的活性有抑制作用。在分子水平实验中,所述8-羟基喹啉类化合物能够与乙酰化赖氨酸竞争结合brd4蛋白的溴结构域。同时,体外细胞水平实验证实了此类药物对多种brd4相关肿瘤细胞和心肌肥大细胞有抑制效果。体内动物实验表明,此类药物能够诱导相关肿瘤体积减小或消失,或改善心脏肥大症状。此外,由于brd4抑制剂目前尚无上市药物,而已进入临床试验的brd4抑制剂结构类型复杂、单一,因此本发明所提出的8-羟基喹啉母核结构简单、新颖,可能具有较好的疗效和安全性。当然,作为已经上市的药物,所述8-羟基喹啉类化合物的毒理性质已经非常清晰,安全性得到证实,这为其作为治疗与brd4相关的疾病的药物而言带来极大的方便。本发明所述的8-羟基喹啉类化合物具有如下优点:1、效果确切,适用于与brd4相关疾病,包括nut-中线癌、多发性骨髓瘤、肝细胞癌、三阴性乳腺癌、心脏衰竭:本发明体外和体内实验表明,8-羟基喹啉类药物能够竞争性抑制brd4的活性,诱导相关肿瘤细胞凋亡和/或抑制增殖,使相关肿瘤减小或消失;或抑制心肌细胞肥大,改善心脏衰竭症状。2、药物来源可靠、稳定,且安全性高:作为已知上市的药物,所述8-羟基喹啉类化合物的毒理已经得到广泛证实,且细胞毒性实验也证实了治疗剂量下的此类药物用于治疗相关肿瘤和心脏衰竭时,无明显的毒性。下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法、软件参数,通常按照常规条件,或按照制造厂商所建议的条件、默认参数。实施例1虚拟筛选流程(1)蛋白模型准备。从proteindatabank下载brd4bd1和抑制剂复合物晶体结构,使用pymol软件删除晶体结构中非水溶剂分子。然后用薛定谔软件中的“蛋白准备”(proteinpreparationwizard)模块来完成一系列的蛋白准备工作,包括加氢、修补缺失残基以及能量优化等。蛋白准备好之后,去掉非保守的水分子。最后选取复合物中的抑制剂作为“参考配体”(referenceligand),利用glide5.6软件中的受体格点生成程序(receptorgridgeneration)生成对接口袋格点文件。(2)配体准备。从已上市小分子药物数据库中得到大约1600个化合物的结构,然后利用薛定谔软件中的“配体准备”模块产生每个小分子的三维结构、互变异构体等。(3)分子对接。利用glide软件的sp精度对准备好的小分子库进行对接打分。对打分前10000个构象去重、结构聚类,然后依据专家经验,肉眼挑选200个化合物准备测试生物活性。(4)类似物搜索。第一轮生物活性测试发现了8-羟基喹啉类化合物可能对brd4有较好的抑制作用,因此从各大药物数据库中查询了其他含有8-羟基喹啉子结构的已上市药物小分子并进行分子对接打分,挑选出打分较好、结合模式较合理的结构进行购买和生物活性测试。表3:8-羟基喹啉类药物对接brd4bd1的glide打分序号药物名称glide打分1nitroxoline-8.2222chloroxine-7.8323broxyquinoline-7.1584cloxyquin-7.6675clioquinol-7.1336procaterol-6.8467indacaterol-6.5828iodoquinol-6.37398-hydroxyquinoline-6.512实施例2靶向brd4分子水平的化合物筛选以及实验验证。通过构建原核表达系统,我们成功的表达纯化了包含有bd1结构域的brd4蛋白,利用5位,8位,12位,16位的乙酰化修饰的h4多肽为底物,借助放大化学发光亲和均相检测(alpha)技术,成功建立了靶向brd4bd1结构域的筛选平台。当无化合物影响brd4_bd1与底物多肽的结合时,alpha能检测到最大信号值,当小分子抑制brd4_bd1与底物多肽的结合时,信号值将变弱。因此当化合物浓度从高到低逐渐降低时,信号值将逐渐由低变高,呈现出s型曲线,以此拟合计算ic50值。同时,我们采用蛋白质热迁移的生化实验验证了化合物nitroxoline与bd1蛋白的结合。蛋白质热迁移实验是一种基于温度的,通过荧光染料结合疏水氨基酸来检测蛋白质去折叠的生物化学方法。随着温度的不断上升,蛋白的疏水氨基酸逐渐暴露出来,与其结合的荧光信号也越来越强。这样通过玻尔兹曼方程能够拟合出溶解温度。当蛋白中加入小分子后,如果小分子能与蛋白结合增加蛋白的稳定性,蛋白随着温度升高去折叠过程将变慢,表现出半数解链温度的升高。在试验中我们观测到brd4_bd1随着化合物浓度的升高,半数解链温度呈现出浓度依赖的升高,表明化合物结合brd4_bd1并使其稳定,如图3所示。表4:8-羟基喹啉类药物对brd4的分子水平抑制活性序号名称casic50(μm)1nitroxoline4008-48-40.272chloroxine773-76-212.23broxyquinoline521-74-42.744cloxyquin130-16-51.625clioquinol130-26-710.06procaterol72332-33-31197indacaterol312753-06-371.98iodoquinol83-73-84.9398-hydroxyquinoline148-24-32.81上述8-羟基喹啉类化合物对brd4的分子水平抑制的ic50曲线请参见图2。实施例3nitroxoline对nut-中线癌细胞增殖的抑制、分化相关靶基因的激活及对凋亡的诱导作用。首先,以两株nut-中线癌细胞株797和per433为细胞模型,考查化合物nitroxoline对两株细胞增殖抑制的ic50。采用dmem/f12培养基加入10%胎牛血清,加入双抗培养,胰酶消化传代。至细胞融合70%左右后胰酶消化,制成细胞悬液后显微镜下细胞计数,然后接种于96孔板中,每孔6板中,每孔个细胞。细胞贴壁后给予nitroxoline处理,浓度梯度以100μm为起始浓度,两倍梯度稀释。通过alrmablue法检测给药72小时后细胞增殖的变化。以细胞存活率为纵坐标,药物浓度为纵坐标做图,并计算nitroxoline对两种细胞株的增殖抑制的ic50,具体抑制率见图4a。细胞存活率(%)计算方法为:存活率(%)=(给药孔od-空白孔od)/(对照孔od-空白孔od)×100%。其次,考查化合物nitroxoline对中线癌分化相关靶基因的转录的影响。797细胞经消化后种板至6孔板,贴壁后给药(包括对照组和化合物组),药物处理48小时后,细胞经pbs漂洗后,加trizol收样,并进行rna抽提、反转录。以反转录的到的cdna为模板,用内参b2mg基因、分化相关基因krt14、krt10的引物进行realtimepcr对反转录得到的cdna样品进行定量,得到扩增的ct值。用δδct法对对照dmso组的基因表达丰度标化为1:δδct=δct(gene-b2mg)dmso-δct(gene-b2mg)dmso组=0。对照组基因表达丰度=1/2δδct=1。同样,用δδct法计算基因在实验组中相对对照dmso组的表达:δδct=δct(gene-b2mg)dmso-δct(gene-b2mg)实验组。+1表示上调两倍,-1表示下调至1/2。relativeexpressionofgene==1/2-δδct结果表明,如图4b,nitroxoline显著促进中线癌细胞分化相关基因的表达。再次,考查化合物nitroxoline对中线癌凋亡的影响。797细胞经消化后种板至6孔板,贴壁后给药(包括对照组和化合物组),药物处理72小时。上清中的细胞与经胰酶消化下来的贴壁细胞合并,离心收集。收集的细胞用冷的pbs洗涤后离心收集。弃上清,加入1×结合缓冲液,并调整细胞浓度。annexinv和pi,室温下避光孵育染色15分钟后,以结合缓冲液稀释样品,冰上保存,用流式细胞仪测定并计算样品中正常细胞、早期凋亡及晚期凋亡细胞的比例,结果见图4c。实验结果表明,化合物nitroxoline有效诱导中线癌细胞凋亡。实施例4nitroxoline对c-myc原癌蛋白依赖的aml白血病细胞增殖的抑制、c-myc转录及表达的抑制,及对周期阻滞和凋亡的诱导作用。首先,以两株aml白血病细胞株mv4.11、thp1为细胞模型,考查化合物nitroxoline对两株细胞增殖抑制的ic50。采用1640培养基加入10%胎牛血清。细胞计数后,以每孔104个/100ul接种于96孔板中,同时给予nitroxoline处理,浓度梯度以100μm为起始浓度,两倍梯度稀释。通过alrmablue法检测给药72小时后细胞增殖的变化。以细胞存活率为纵坐标,药物浓度为纵坐标做图,并计算nitroxoline对两种细胞株的增殖抑制的ic50。细胞存活率(%)计算方法为:存活率(%)=(给药孔od-空白孔od)/(对照孔od-空白孔od)×100。结果表明,化合物nitroxoline有效抑制白血病细胞增殖,具体抑制率及ic50值,参见图5a。其次,考查化合物nitroxoline对细胞增殖的抑制作用是否通过影响白血病细胞周期和凋亡所导致的。mv4.11细胞以2.5×105/ml密度接种至六孔板,2ml每孔,种板当天给药。于48、72小时分别检测化合物对细胞周期和凋亡的影响。细胞周期检测中,细胞经离心收集、pbs洗涤后,以-20度预冷的乙醇固定过夜。固定好的细胞经离心收集、pbs洗涤后用pi染色,染色后的细胞用流式细胞仪检测,分析处于细胞周期不同时象(g1、g2/m,s期)的细胞比例。细胞凋亡检测中,细胞经离心收集、pbs洗涤后,用annexinv和pi室温下避光染色,用流式细胞仪测定并计算样品中正常细胞、早期凋亡及晚期凋亡细胞的比例。实验结果表明,化合物nitroxoline促使mv4.11白血病细胞周期g1期阻滞(图5b)并有效诱导细胞凋亡(图5c),且其对周期阻滞和凋亡的诱导具有浓度依赖梯度。最后,考查化合物对c-myc原癌基因转录及表达的影响。mv4.11细胞以1×106/ml密度接种至六孔板,2ml每孔。药物处理6小时、24小时后,分别检测化合物对c-myc基因转录及对其蛋白表达量的影响。结果表明,化合物nitroxoline处理抑制brd4调控靶基因c-myc的转录(图5e)和蛋白表达(图5d)。实施例5nitroxoline对c-myc原癌蛋白依赖的胰腺癌细胞增殖的抑制、c-myc转录及表达的抑制作用,及其在动物模型上对胰腺癌肿瘤生长的抑制。首先,以三株胰腺癌细胞株aspc-1、capan-1、panc-1为细胞模型,考查化合物nitroxoline对胰腺癌细胞增殖抑制的ic50。以dmem培养基(含10%胎牛血清)培养,胰酶消化传代。细胞经胰酶消化后以3000~6000个/孔的密度接种于96孔3d培养板(低吸附板、细胞不贴壁),并给予nitroxoline处理。alrmablue法检测给药72小时后细胞增殖的变化。nitroxoline对细胞增殖抑制的ic50计算方法与前面描述的方法一致。结果表明,化合物nitroxoline有效抑制胰腺癌细胞增殖(图6a)其次,考查化合物对c-myc原癌基因转录及表达的影响。capan-1细胞接种至六孔板,2ml每孔。药物处理24小时、48小时后,分别检测化合物对c-myc基因转录及对其蛋白表达量的影响。结果表明,在胰腺癌细胞中,化合物nitroxoline处理抑制brd4靶基因c-myc的转录(图6b)和蛋白表达(图6c)。最后,在capan-1皮下移植瘤模型上考查化合物对胰腺癌瘤体生长的抑制作用。capan-1细胞以2×106细胞/200ul接种至4周龄的裸鼠腋下,一周后成瘤,以瘤体大小均匀分组(8只/组),分别进行溶剂、nitroxoline(50mg/kg)和胰腺癌一线药物gemcitabine(吉西他滨)(50mg/kg)给药,隔天给药,并测量瘤体大小和小鼠体重。连续给药3周后,处死小鼠,取瘤体称重,并观察小鼠脏器的颜色变化。动物实验结果显示,在capan-1胰腺癌动物模型上,化合物nitroxoline有效抑制瘤体生长(图6d),其抑制效果与胰腺癌临床一线药物效果相近,且化合物对小鼠体重(图6e)和各器官颜色质地没有明显影响,提示其毒副作用小。实施例6化合物nitroxoline对c-myc依赖其他肿瘤细胞(如,多发性骨髓瘤细胞、肝癌细胞、三阴性乳腺癌细胞)的增殖抑制作用。表5nitroxline对c-myc依赖其他肿瘤细胞的增殖抑制作用实施例7化合物对心肌细胞肥大相关基因的抑制作用首先,构建心肌肥大的细胞模型。原代分离培养的新生大鼠心肌细胞neonatalratventricularmyocytes(nrvms)在phenylephrine(pe)诱导下,发生心肌肥大病变,其特征是心肌肥大相关蛋白标志物的表达变化:如标志物anf(atrialnatriureticfactor)、bnp(brainnatriureticpeptide)显著上调表达,serca2a(sarcoendoplasmicreticulumcalciumatpase)显著下调。在此心肌肥大病变的诱导模型上,我们考查化合物niroxoline对心肌肥大病变相关标志物基因表达的调控作用。结果如图7所示,pe诱导下病变标志物anf、bnp显著上调,化合物nitroxoline能够有效抑制其表达;pe诱导标志物serca2a的上调,而化合物则显著抑制其上调。因此,在心肌肥大诱导模型上,化合物niroxoline显著逆转了pe对心肌肥大病变标志物的表达调控,从而可能有效改善心肌肥大。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1