一种注射用猪胎盘转移因子及其制备方法和应用与流程
本发明涉及生物医药
技术领域:
,具体涉及一种注射用猪胎盘转移因子及其制备方法和应用。
背景技术:
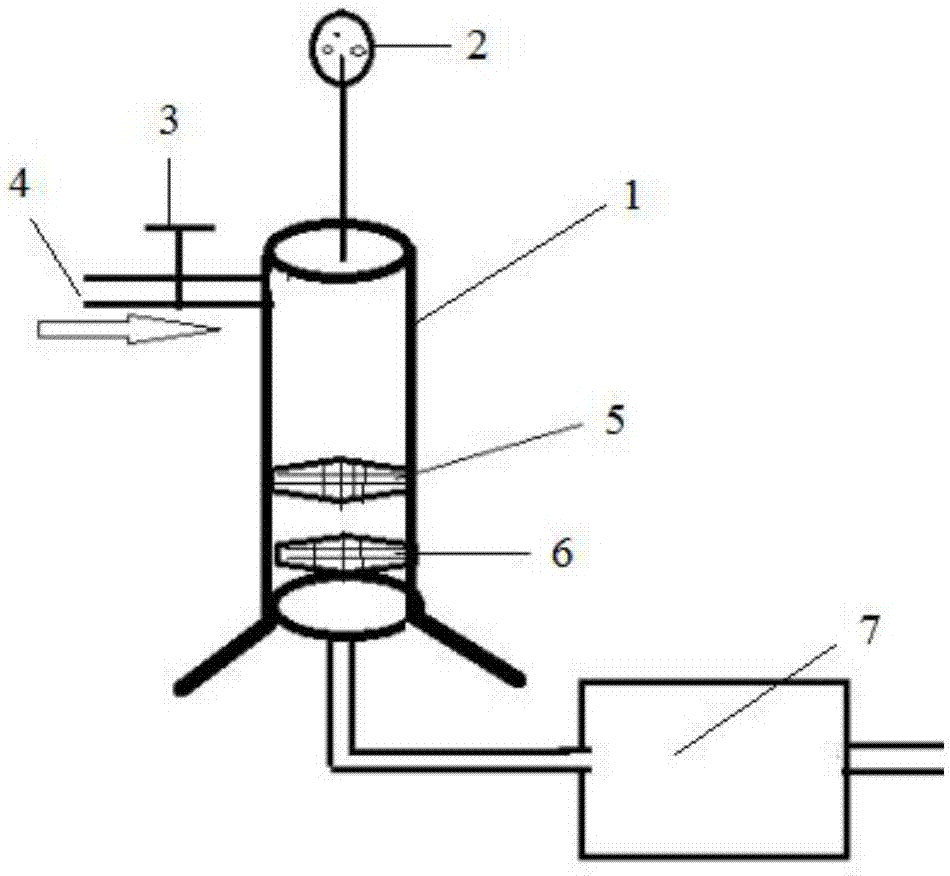
:转移因子是由动物蛋白细胞中具有免疫获悉的t淋巴细胞所释放的一类小分子可透析物质,可溶于水,能诱导机体免疫细胞活化,增强机体免疫力,能转移包括病毒、细菌、真菌、寄生虫、组织相容性抗原和肿瘤抗原等多种抗原的细胞免疫。由于转移因子使用安全、作用迅速、无抗原性同时作为免疫激发剂和辅助制剂可显著提高对动物疾病的预防和控制效果。目前市场上存在很多猪、牛等诸多动物脾脏转移因子,但对于动物胎盘中提取转移因子较少。陈灵等研究了一种以猪胎盘为原料的提取方法,但是其提取产物的纯度不高,无法满足市场需求(陈灵,张利萍,罗永海,等.猪胎盘肽(胎盘转移因子)的提取制备及其性质研究[c]//上海市动物学会1999年年会.1999.)。技术实现要素:有鉴于此,本发明为了解决以猪胎盘为原料无法得到高纯度、高产量转移因子的问题,本发明提供了一种注射用猪胎盘转移因子的制备方法,时间短、质量可控,产量高,适宜大规模工业化生产。为了解决上述问题,本发明提供了以下技术方案:本发明提供了一种注射用猪胎盘转移因子的制备方法,包括如下步骤:(1)将猪胎盘匀浆,得到猪胎盘匀浆液;(2)将猪胎盘匀浆液反复冻融5~7次,得到冻融液;(3)将冻融液与ph值为2~4的盐酸溶液混合,3~5℃下搅拌浸提,得到浸提液;(4)将浸提液进行双层过滤,得到分离液和沉淀;(5)将分离液与壳聚糖混合后,依次进行微滤、超滤,得到超滤液;所述壳聚糖的质量与分离液的体积之比为0.5~2:100;(6)将超滤液的ph值调节至6.8~7.2、渗透压调节至280~320mosm/kg,除菌,得到注射用猪胎盘转移因子。优选的,所述步骤(1)中,将洗净后猪胎盘在60~80℃的水中浸泡3~5s再进行匀浆。优选的,所述反复冻融中,冷冻温度独立的不高于-20℃,融解时间独立的不超过50min。优选的,所述步骤(3)中,冻融液与ph值2~4的盐酸溶液体积比为1:1~2。优选的,所述步骤(3)中,浸提时间为10~15h,搅拌速率为60~80r/min。优选的,所述步骤(4)中,在得到沉淀后还包括将所得沉淀与水混合再次匀浆,反复冻融1~2次后进行双层过滤,所得滤液合并至分离液中。优选的,所述双层过滤为依次以200目和300目滤网进行过滤。优选的,所述步骤(5)中,微滤的滤网规格为0.22μm,超滤的超滤膜规格为6kd。本发明上述技术方案所述注射用猪胎盘转移因子的制备方法得到的注射用猪胎盘转移因子,其中多肽含量不低于2mg/ml,核糖含量不低于45μg/ml。本发明上述技术方案所述注射用猪胎盘转移因子在制备免疫增强剂或疫苗佐剂中的应用。本发明提供了一种注射用猪胎盘转移因子的制备方法,将新鲜猪胎盘洗净,匀浆,得到猪胎盘匀浆液;猪胎盘匀浆液反复冻融5~7后,与ph值2~4的盐酸溶液混合,3~5℃下搅拌浸提,得到浸提液;浸提液经过双层过滤得到分离液,分离液加入壳聚糖作为絮凝剂,依次进行微滤和超滤,得到超滤液;调节超滤液的ph至和渗透压,除菌,即得注射用猪胎盘转移因子。本发明提供的注射用猪胎盘转移因子制备方法能够更好的完整保留注射用猪胎盘转移因子的活性,还可以缩短生长周期,提高转移因子的提取量,降低生产成本,适合大规模工业化生产。附图说明图1为单罐多层气压过滤机的结构示意图;图2为装有0.22μm滤芯的立式过滤套筒;图3为装有6kd超滤芯的立式过滤套筒;图4为注射用猪胎盘转移因子提取装置。具体实施方式本发明提供了一种注射用猪胎盘转移因子的制备方法,包括如下步骤:(1)将猪胎盘匀浆,得到猪胎盘匀浆液;(2)将猪胎盘匀浆液反复冻融5~7次,得到冻融液;(3)将冻融液与ph值为2~4的盐酸溶液混合,3~5℃下搅拌浸提,得到浸提液;(4)将浸提液进行双层过滤,得到分离液和沉淀;(5)将分离液与壳聚糖混合后,依次进行微滤、超滤,得到超滤液;所述壳聚糖的质量与分离液的体积之比为0.5~2:100;(6)将超滤液的ph值调节至6.8~7.2、渗透压调节至280~320mosm/kg,除菌,得到注射用猪胎盘转移因子。本发明将猪胎盘匀浆,得到猪胎盘匀浆液。本发明优选的在匀浆前对猪胎盘进行洗净,以去除血浆和浆膜,得到主要包括胎盘子叶和肉埠的洗净后猪胎盘,将洗净后猪胎盘捣碎并匀浆,得到猪胎盘匀浆液。在本发明中,所述猪胎盘优选的采用新鲜猪胎盘。所述新鲜猪胎盘是指离体6h以内的猪胎盘,本发明所述新鲜猪胎盘优选的来源于市售。本发明优选的将洗净后猪胎盘在60~80℃的水中浸泡3~5s,再进行匀浆。以60~80℃水处理能够使猪胎盘变硬,便于捣碎。在本发明中,优选的将洗净后猪胎盘捣碎至7~9μm后再进行匀浆。本发明优选的采用捣碎机捣碎,所述捣碎转速优选为4000~6000r/min,更优选为5000r/min。在本发明中,所述匀浆优选的以匀浆机进行。得到猪胎盘匀浆液后,本发明将猪胎盘匀浆液反复冻融5~7次,得到冻融液。本发明将猪胎盘匀浆液反复冻融是为了使细胞破碎,反复冻融5~7次能够提高细胞破碎程度,使小分子的转移因子更多的渗出,以提高转移因子的提取率。在本发明中,所述冻融次数更优选为6次。在本发明中,所述反复冻融中,冷冻至猪胎盘匀浆液冻实,融解则以猪胎盘匀浆液处于无冰状态为止。在本发明中,冷冻温度独立的优选为-20℃以下,更优选为-35~-30℃。本发明优选地采用液氮进行冷冻,液氮冷冻的速度更快,有利于提高细胞破碎程度。在本发明中,融解时间独立地不超过50min,更优选为30~50min。本发明优选的采用微波进行融解,微波功率优选为500~700w,更优选为600w。利用液氮和微波的速冻速溶能够进一步破坏细胞结构,提高转移因子的含量。得到冻融液后,本发明将冻融液与ph值2~4的盐酸溶液混合,3~5℃下搅拌浸提,得到浸提液。在本发明中,所述冻融液与ph值2~4的盐酸溶液体积比优选为1:1~2,更优选为1:1.5。本发明以ph值2~4的盐酸溶液作为提取溶剂,ph值2~4的酸性环境有利于提高注射用猪胎盘转移因子中的多肽提取率,转移因子中的多肽含量可提高20~30%;还有利于粗蛋白的絮凝。在本发明中,所述浸提温度更优选为4℃。本发明采用3~5℃的低温浸提是因浸提时间较长,为了防止在浸提过程中减少因过热导致料液核糖多肽物质减少、造成产品质量下降。在本发明中,所述浸提时间优选为10~15h,更优选为12h。在本发明中,所述浸提同时伴随搅拌,所述搅拌转速优选为60~80r/min,更优选为70r/min。得到浸提液后,本发明将浸提液进行双层过滤,得到分离液和沉淀。本发明对浸提液进行双层过滤主要是为了去除脂肪颗粒等漂浮物,本发明所述双层过滤优选的依次以200目和300目滤网对浸提液进行过滤。本发明优选的将所得沉淀与水混合进行再次匀浆,反复冻融1~2次后进行双层过滤,得到再分离液,将再分离液合并到分离液中。本发明将沉淀再次匀浆、反复冻融以及双层过滤的目的是为了进一步提取转移因子。在本发明中,所述沉淀质量与水的体积之比优选为1:0.5~1,更优选为1:0.6~0.8。本发明所述再次匀浆的操作同前述步骤中对洗净后猪胎盘的匀浆操作,再次不再赘述。本发明所述反复冻融与前述步骤中反复冻融匀浆液的操作相同,在此不再赘述。在本发明中,所述双层过滤优选的采用本发明自制的单罐多层气压过滤机进行,所述单罐多层气压过滤机如图1所示:1为罐体,2为压力表,3为阀门,4为高压空气入口,5为200目过滤网,6为300目过滤网,7为分离液收集罐。所述过滤网材质为不锈钢。本发明采用所述单罐多层气压过滤机进行双层过滤时,将待过滤的液体装入到罐体1中,打开阀门3,通过高压空气入口4向罐体内通入压缩空气以提高罐体内压力。罐体1内的待过滤液体受到压力压迫从上到下依次通过200目过滤网5和300目过滤网6,所得分离液流入下方分离液收集罐7中,沉淀从200目过滤网和300目过滤网上收集。采用本发明提供的单罐多层气压过滤机进行双层过滤能够有效提高过滤速度,减少双层过滤时间,更为经济。得到分离液或合并了再分离液的分离液后,本发明将所述分离液与壳聚糖混合后,依次进行微滤、超滤,得到超滤液;所述壳聚糖质量与分离液体积之比为0.5~2:100。超滤液中含有注射用猪胎盘转移因子的粗制品。在本发明中,壳聚糖质量与分离液体积之比优选为0.8~1.5:100。本发明所述壳聚糖起到絮凝剂作用,用以沉降分离液中的大分子物质,使蛋白质等杂质絮凝沉淀。在本发明中,所述微滤优选的以0.22μm规格的滤网过滤。在本发明中,所述微滤优选的采用立式过滤套筒进行过滤。具体的如图2所示,装有0.22μm滤芯的立式过滤套筒,2为压力表,3为进口阀,9为排气阀,10为0.22μm规格的滤芯,11为排液阀。本发明优选的利用如图2所示的立式过滤套筒对分离液和壳聚糖的混合液进行微滤,分离液和壳聚糖的混合液进入如图2所示的立式过滤套筒进行微滤,当收集的透过液体积为原体积的2/3~3/4时停止收集,所得透过液即为微滤液。在本发明中,所述超滤优选的以6kd规格的超滤膜进行超滤。在在本发明中,所述超滤优选的采用立式过滤套筒进行超滤。具体的如图3所示,装有6kd超滤芯的立式过滤套筒,2为压力表,3为进口阀,9为排气阀,13为6kd规格的超滤芯,11为排液阀。本发明优选的利用如图3所示的立式过滤套筒对微滤液进行超滤,微滤液进入如图3所示的立式过滤套筒进行超滤,当收集的透过液体积为原体积的4/5~5/6时,对超滤截留物进行恒体积透析,所述恒体积透析至透析液体积达到超滤截留体积0.5~1倍时停止,合并透过液即得超滤液。本发明优选的在用于收集分离液、微滤液以及超滤液的容器中设置可实时监测温度的温度计,即在图4所示的分离液收集罐7、微滤液收集罐12和超滤液收集罐14中设置温度计。设置所述温度计是用以记录溶液因过滤而产生的温度的变化情况,因转移因子不耐热,为保证产品质量,依据实时监测温度变化情况,进而调节透过液的收集体积。本发明采用微滤、超滤逐级过滤的方式,方便从小试优化、中试放大到生成规模化转化,为研发到投产、再到扩大生产提供方便,有利于降低产品的研发成本,实现注射用猪胎盘转移因子提取的规模化、标准化生成。本发明依次采用0.22μm、6kd立式过滤套筒进行过滤,截留体积小,便于清洗。得到超滤液后,本发明将超滤液的ph值调节至6.8~7.2、渗透压调节至280~320mosm/kg,除菌,得到注射用猪胎盘转移因子。在本发明中,所述ph值调节与渗透压调节没有先后顺序限制。本发明将超滤液调节至与血浆渗透压一致,为等渗溶液,使得本发明所述方法得到的注射用猪胎盘转移因子进入动物体内后不会产生应激反应。在本发明中,所述除菌优选的以0.1μm的微孔滤膜进行过滤除菌,从而去除支原体等微生物。本发明所述注射用猪胎盘转移因子的提取方法能够更为完整的保留注射用猪胎盘转移因子的活性,可有效提高注射用猪胎盘转移因子中的多肽含量,缩短提取时间,降低生产成本。本发明上述技术方案所述注射用猪胎盘转移因子的制备方法得到的注射用猪胎盘转移因子,其中多肽含量不低于2mg/ml,核糖含量不低于45μg/ml。在本发明中,所述注射用猪胎盘转移因子中多肽含量更优选为2.0~2.5mg/ml;核糖含量更优选为48~60mg/ml。本发明还提供了上述技术方案所述注射用猪胎盘转移因子在制备免疫增强剂或疫苗佐剂中的应用。本发明优选的,将所述注射用猪胎盘转移因子与辅料或其他具有免疫增强作用的原料复配,得到免疫增强剂;本发明优选的,将所述注射用猪胎盘转移因子与疫苗复配,作为疫苗的辅料。以上所述仅是本发明的优选实施方式,应当指出,对于本
技术领域:
的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围实施例1第一步:将新鲜健康的猪胎盘5kg,去除血液和浆膜,以纯水清洗3次干净,再用灭菌注射用清洗2次,得到胎盘子叶和肉埠4kg。第二步:将第一步待用的4kg猪胎盘在60℃的去离子热水中处理3~5秒。第三步:将第二步得到的猪胎盘捣碎机以5000r/min转速捣碎至7~9μm粒径,然后将捣碎物在胶体磨匀浆,得到匀浆液3.8kg。第四步:用500毫升无热源塑料瓶分装储匀浆液,共8瓶,置于液氮中冷冻24h,将液氮冷冻后的匀浆液以500w的功率进行微波解冻30min。第五步:重复第四步的步骤,反复冻融5次。第六步:将反复冻融液与ph值为3的盐酸溶液按照体积比1:2的比例混合,得到混合液11.4kg,置于4℃冷库浸提12h,并搅拌机搅拌,60r/min,时间设定12h,得到浸提液。第七步:将以图1所示的单罐多层气压过滤机对浸提液进行双层过滤,在分离液收集罐中设置可实时监测温度的温度计,记录料液因过滤温度变化情况,收集得到分离液8l,沉淀3.4kg。第八步:将第七步的沉淀3.4kg与灭菌注射用水按照质量体积比1:0.5混合,再次匀浆,按照第四步的方式冻融1次,以图1所示的单罐多层气压过滤机对冻融后的再次匀浆液进行双层过滤,得到再分离液1.5l。第九步:将合并分离液和再分离液,加入壳聚糖至终浓度为体积浓度1%,得到混合液9.6l。第十步:将混合液在如图2所示的0.22μm的立式过滤套筒进行过滤,在微滤液收集罐中设置可实时监测温度的温度计,记录料液因过滤温度变化情况,当收集的滤液达到原体积的3/4时停止收集,得到微滤液7.2l。第十一步:将微滤液用图3所示的6kd立式过滤套筒进行超滤,在超滤液收集罐中设置可实时监测温度的温度计,记录料液因过滤温度变化情况,当超滤透过液体积达到微滤液原液体积的5/6时,对超滤截留物进行恒体积透析,至超滤液增加了超滤截留体积的0.5倍为止,收集的超滤透过液即为超滤液6.6l。第十二步:将超滤液的ph值调节到6.8~7.2。第十三步:将超滤液的渗透压调到280~320mosm/kg。第十四步:将调好ph和渗透压的超滤液采用0.22μm的除菌过滤器除菌,即得注射用猪胎盘转移因子,其中多肽含量为2.1mg/ml,核糖含量为50μg/ml。实施例2以图4所示的猪胎盘提取装置进行猪胎盘转移因子的提取,图4中,1为罐体,2为压力表,3为阀门,4为高压空气入口,5为200目过滤网,6为300目过滤网,7为分离液收集罐,8为调速泵,9为排气阀、10为0.22μm规格的滤芯,11为排液阀,12为微滤液收集罐,13为6kd规格的超滤芯,14为超滤液收集罐。第一步:将新鲜健康的猪胎盘7kg,去除血液和浆膜,以纯水清洗5次干净,再用灭菌注射用清洗2次,得到胎盘子叶和肉埠5.5kg。第二步:将第一步待用的5.5kg猪胎盘在80℃的去离子热水中处理3~5秒。第三步:将第二步得到的猪胎盘捣碎机以5000r/min转速捣碎至7~9μm粒径,然后将捣碎物在胶体磨匀浆,得到匀浆液5kg。第四步:用500毫升无热源塑料瓶分装储匀浆液,共10瓶,置于液氮中冷冻24h,将液氮冷冻后的匀浆液以600w的功率进行微波解冻35min。第五步:重复第四步的步骤,反复冻融6次。第六步:将反复冻融液与ph值为6的盐酸溶液按照体积比1:2的比例混合,得到混合液15kg,置于4℃冷库浸提12h,并搅拌机搅拌,80r/min,时间设定12h,得到浸提液。第七步:浸提液进入罐体1中,依次通过200目过滤网5和300目过滤网6,对浸提液进行双层过滤,在分离液收集罐7中设置可实时监测温度的温度计,记录料液因过滤温度变化情况,分离液进入分离液收集罐7中,共10.5l。第九步:分离液收集罐7中的分离液,加入壳聚糖至终浓度为体积浓度1%,得到混合液10.7l。第十步:将混合液通入装有0.22μm滤芯的立式过滤套筒,在微滤液收集罐12中设置可实时监测温度的温度计,记录料液因过滤温度变化情况,微滤的透过液进入微滤液收集罐12中,当收集的滤液达到原体积的3/4时停止收集,得到微滤液8l。第十一步:将微滤液收集罐12中的微滤液通入装有6kd超滤芯13的立式过滤套筒中进行超滤,在超滤液收集罐14中设置可实时监测温度的温度计,记录料液因过滤温度变化情况,超滤的透过液进入超滤收集罐14,当超滤透过液体积达到微滤液原液体积的5/6时,对超滤截留物进行恒体积透析,至超滤液增加了超滤截留体积的0.6倍为止,收集的超滤透过液即为超滤液7.5l。第十二步:将超滤液的ph值调节到6.8~7.2。第十三步:将超滤液的渗透压调到280~320mosm/kg。第十四步:将调好ph和渗透压的超滤液采用0.1μm的除菌过滤器除菌,即得注射用猪胎盘转移因子,其中多肽含量为1.7mg/ml,核糖含量为41μg/ml。实施例3第一步:将新鲜健康的猪胎盘5.5kg,去除血液和浆膜,以纯水清洗4次干净,再用灭菌注射用清洗2次,得到胎盘子叶和肉埠4.7kg。第二步:将第一步清洗后得到的猪胎盘捣碎机以6000r/min转速捣碎至7~9μm粒径,然后将捣碎物在胶体磨匀浆,得到匀浆液4.5kg。第三步:用500毫升无热源塑料瓶分装储匀浆液,共9瓶,置于液氮中冷冻12h,将液氮冷冻后的匀浆液以600w的功率进行微波解冻30min。第四步:重复第三步的步骤,反复冻融6次。第五步:将反复冻融液与ph值为4的盐酸溶液按照体积比1:1.5的比例混合,得到混合液11.2kg,置于4℃冷库浸提12h,并搅拌机搅拌,70r/min,时间设定12h,得到浸提液。第六步:将以图1所示的单罐多层气压过滤机对浸提液进行双层过滤,在分离液收集罐中设置可实时监测温度的温度计,记录料液因过滤温度变化情况,收集得到分离液6.8l,沉淀4.4kg。第七步:将第六步的沉淀4.4kg与灭菌注射用水按照质量体积比1:0.6混合,再次匀浆,按照第四步的方式冻融1次,以图1所示的单罐多层气压过滤机对冻融后的再次匀浆液进行双层过滤,得到再分离液2.2l。第九步:将合并分离液和再分离液,加入壳聚糖至终浓度为体积浓度1%,得到混合液9l。第十步:将混合液在如图2所示的0.22μm的立式过滤套筒进行过滤,在微滤液收集罐中设置可实时监测温度的温度计,记录料液因过滤温度变化情况,当收集的滤液达到原体积的3/4时停止收集,得到微滤液6.8l。第十一步:将微滤液用图3所示的6kd立式过滤套筒进行超滤,在超滤液收集罐中设置可实时监测温度的温度计,记录料液因过滤温度变化情况,当超滤透过液体积达到微滤液原液体积的5/6时,对超滤截留物进行恒体积透析,至超滤液增加了超滤截留体积的0.5倍为止,收集的超滤透过液即为超滤液6.2l。第十二步:将超滤液的ph值调节到6.8~7.2。第十三步:将超滤液的渗透压调到280~320mosm/kg。第十四步:将调好ph和渗透压的超滤液采用0.22μm的除菌过滤器除菌,即得注射用猪胎盘转移因子,其中多肽含量为2.4mg/ml,核糖含量为53μg/ml。实施例4不同ph值的盐酸溶液制备得到的注射用猪胎盘转移因子的活性试验1、试验方法胸腺t细胞悬液及脱e受体胸腺t细胞悬液的制备:取新鲜猪胸腺,去除脂肪并剪碎,加适量hank’s液使成细胞悬液,经100目筛过滤,1500r/min离心3~5min,弃去上清液,加入少量hank’s液打匀,将此溶液加入已具有1/3滤液量的分离液的离心管中,以2000r/min离心20min,小心吸出中间层的胸腺细胞,放入另一离心管中,加适量hank’s液洗涤,摇匀,以1500r/min离心3~5min,弃去上清液,洗涤一次后,在沉淀物中加入适量hank’s液,混匀,分成两份,一份在45℃恒温水浴保温30min(每隔5min振摇一次),以1500r/min离心3~5min,弃去上清液,再加入适量hank’s液,混匀后,置45℃恒温水浴保温30min,取出后以1500r/min转离心3~5min,弃去上清液。用hank’s液洗涤三次(操作同前),再用hank’s液适当稀释并计数,使最终浓度为每1.0ml中(3×106)个细胞,为脱e受体胸腺t细胞悬液。另一份用hank’s液洗涤三次(操作同前),用hank’s液适当稀释并计数,使最终浓度为每1.0ml中(3×106)个细胞,为胸腺t细胞悬液。绵羊红血球悬液的制备:取适量羊血,用适量hank’s液洗三次(同前)。弃去上清液,加适量hank’s液稀释并计数,使最终浓度为脱e受体胸腺t细胞悬液浓度的9倍。待检样品溶液的制备:取实施例1~3制备得到的注射用猪胎盘转移因子,分别用hank’s液配制成每1.0ml中含1.0mg多肽的待检样品溶液。2、测定取小试管9支,其中6支各加hank’s液0.1ml作为对照管,另3支各加待检样品溶液0.1ml作测定管,对照管中3支加胸腺t细胞悬液0.2ml,3支加脱e受体胸腺t细胞悬液0.2ml,测定管中各加脱e受体胸腺t细胞悬液0.2ml,37℃保温1.0h后,加入绵羊红血球悬液0.2ml,摇匀,以500r/min离心3min,放入4℃冰箱过夜,次日取出,弃去上清液,每管中各加入固定液一滴,轻轻摇匀,静置10min,加入染色液2滴并摇匀,静置15min后开始计数,显微镜视野中淡蓝色的较大的细胞为淋巴细胞,共数计数板64个大方格上所有淋巴细胞的个数(不少于200个),统计其中的e玫瑰花结形成的细胞数(结合3个以上绵羊红细胞的淋巴细胞),求得e玫瑰花结百分率,取平均值,即为待检样品管或对照管的平均值。胸腺t细胞对照管的e玫瑰花结率平均值应不低于55%,并且与脱e受体胸腺t细胞对照管的e玫瑰花结率平均值的差应不低于20%,否则测定结果无效,应重取猪胸腺再测。活力=待检样品测定管e玫瑰花结百分率-脱e受体胸腺t细胞对照管e玫瑰花结百分率。结果显示(如表1)表1本发明制备的猪胎盘转移因子活力试验组法定标准(%)检测结果(%)结果实施例1不低于1012.20符合规定实施例2不低于1010.35符合规定实施例3不低于1013.59符合规定本试验参照国家食品药品监督管理总局发布的《转移因子溶液国家药品标准》中的活力测定方法-t细胞活性测定法(脱e受体法)。结果显示,实验室制备的3批注射用猪胎盘转移因子溶液的活力分别为12.20%、10.35%、13.59%,均明显高于国家标准(10%)。本发明生产制备的注射用猪胎盘转移因子能明显提高胸腺t细胞e玫瑰花结百分率,具有明显免疫调节作用。实施例5不同ph值的盐酸溶液制备得到的注射用猪胎盘转移因子的多肽试验,多肽属于注射用猪胎盘转移因子的主要有效成分,多肽含量测定是注射用猪胎盘转移因子质量标准检查项目之一。1、操作方法精密量取牛血清白蛋白(对照品溶液)0.0ml、0.2ml、0.4ml、0.6ml、0.8ml、1.0ml,分别置具塞试管中,各加水至1.0ml,再分别加入碱性铜试液1.0ml,摇匀,各加入福林酚试液4.0ml,立即混匀,置55℃水浴中准确反应5分钟,置冷水浴10分钟,照紫外-可见分光光度法(现行《中国药典》附录),在650nm的波长处测定吸光度;同时以0号管作为空白。以对照品溶液浓度与其相对应的吸光度计算线性回归方程。另精密量取待检样品溶液适量,同法测定。从线性回归方程计算待检样品溶液中的多肽浓度,并乘以稀释倍数,即得。分别取以实施例1~3按照上述方法进行检测,测定的样品吸光度代入标准曲线,计算出稀释后的多肽浓度,将其乘以稀释倍数,即得到待测样品的多肽含量,如表2。表2实施例1~3得到的注射用猪胎盘转移因子中多肽含量试验组法定标准mg/ml检测结果mg/ml结果实施例1不低于1.02.1符合规定实施例2不低于1.01.7符合规定实施例3不低于1.02.4符合规定本试验按照《中国药典》附录“蛋白质含量测定法”中“福林酚法(lowry法)”测定了实验室制备的3批注射用猪胎盘转移因子的多肽含量。本试验结果表明,应用福林酚法(lowry法)测得本发明3批注射用猪胎盘转移因子的多肽含量为1.7~2.4mg/ml,显著高于国家规定(1.0mg/ml)。还可以看出,实施例2中采用ph值为6的盐酸溶液进行提取,最终制备得到的猪胎盘转移因子中多肽含量虽然符合法定标准,但是与本申请采用ph值2~4的盐酸溶液提取制成的猪胎盘转移因子相比,多肽含量有显著差异,表明本发明提供的制备方法能够有效提高猪胎盘转移因子的有效物质提取率。多肽是转移因子的主要有效成分之一,其含量在一定程度上可反映转移因子的效力,而本发明生产的猪脾转移因子多肽含量显著高于国家规定,说明本发明的生产工艺稳定,可生产出高于国家标准的转移因子产品。实施例6不同ph值的盐酸溶液制备得到的注射用猪胎盘转移因子的核糖试验。核糖是注射用猪胎盘转移因子的主要有效成分之一。1、操作方法精密量取d-核糖(对照品溶液)0.0ml、0.1ml、0.2ml、0.4ml、0.6ml、0.8ml、1.0ml,分别置带塞刻度试管中,各加入5%三氯醋酸溶液至2.0ml,再分别加入1%3,5-二羟基甲苯溶液2.0ml,摇匀,置沸水浴中准确加热30min,迅速冷却至室温,以0号管为空白,照分光光度法(现行《中国兽药典》附录)在650nm的波长处测定吸光度,以浓度为横坐标,吸光度为纵坐标,绘制标准曲线并进行线性回归,相关系数不低于0.995。精密量取待检样品溶液2.0ml,同法测定吸光度,根据吸光度从回归方程中求得待检样品溶液的浓度,并乘以稀释倍数,求出待检样品核糖含量。将测得的样品吸光度代入标准曲线,计算出稀释后的核糖含量,将其乘以稀释倍数,即得到成品的核糖含量,如表3。表3实施例1~3得到的注射用猪胎盘转移因子中核糖含量试验组法定标准μg/ml检测结果μg/ml结果实施例1不低于3050符合规定实施例2不低于3041符合规定实施例3不低于3053符合规定本试验结果表明,应用分光光度法测得本公司3批注射用猪胎盘转移因子的核糖含量为41~53μg/ml,显著高于国家规定(30μg/ml)。还可以看出,实施例2中采用ph值为6的盐酸溶液进行提取,最终制备得到的猪胎盘转移因子中核糖含量虽然符合法定标准,但是与本申请采用ph值2~4的盐酸溶液提取制成的猪胎盘转移因子相比,核糖含量有显著差异,表明本发明提供的制备方法能够有效提高猪胎盘转移因子的有效物质提取率。转移因子的主要有效成分是多肽和核糖,核糖含量在一定程度上与转移因子的效力相关,而效力的大小直接反应了猪胎盘转移因子能否有效的增强机体免疫或与疫苗联合免疫时的作用,而本发明生产的转移因子核糖含量显著高于国家规定,说明本发明的生产工艺可以提高机体免疫作用,可生产出高于国家标准的转移因子产品。对比例1除将超滤液的ph值调节为4、渗透压调节为153mosm/kg外,其他均与实施例1相同,得到对照转移因子。实施例7除将超滤液的ph值调节为6.8、渗透压调节为285mosm/kg外,其他均与实施例1相同,得到注射用猪胎盘转移因子。实施例8取绵羊血适量,用hank's制成含有3.6*107个/ml绵羊红血球悬液。以对比例1制备的对照转移因子和实施例7制备的注射用猪胎盘转移因子作为待测样品。取1ml绵羊红血球悬液与0.5ml待测样品混合,观察5~10min。观察发现,对照转移因子与绵羊红血球悬液的混合物发生溶血,而注射用猪胎盘转移因子与绵阳红血球悬液的混合物未发现溶血。可见,本发明将超滤液的ph值调节至6.8~7.2、渗透压调节至280~320mosm/kg,能更好保护动物机体,进入动物体内后不会产生应激反应。综合上述实施例可以看出,本发明所述猪胎盘转移因子的提取方法操作简便,仅需3~4h即可完成,有效缩短了提取时间。本发明提取得到的注射用猪胎盘转移因子中多肽含量在2.0~2.5mg/ml、核糖含量在48~60mg/ml,所得有效物质浓度更高;本发明所述提取方法在制备过程中能够有效保持转移因子的活性。以上所述仅是本发明的优选实施方式,应当指出对于本
技术领域:
的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1