一种建立小鼠重型再生障碍性贫血模型的方法与流程
本发明属于小鼠模型制备方法领域,具体涉及一种通过免疫机制介导来建立小鼠重型再生障碍性贫血模型的方法。
背景技术:
目前国内外绝大多数的研究者使用小鼠来建立小鼠重型再生障碍性贫血模型进行再生障碍性贫血发病机制研究[chenj.animalmodelsforacquiredbonemarrowfailuresyndromes.clinmedres2005;3:102-108.]。诱导再生障碍性贫血小鼠模型的方法主要有以下几种:1.化学方法:由马利兰、苯、环磷酰胺、氯霉素等化学药物或毒物诱导的aa模型[molyneuxg,gibsonfm,whaymanmetal.serumflt-3ligandinabusulphan-inducedmodelofchronicbonemarrowhypoplasiainthefemalecd-1mouse.intjexppathol2008;89:159-170.turtonja,soneswr,andrewscmetal.furtherdevelopmentofamodelofchronicbonemarrowaplasiainthebusulphan-treatedmouse.intjexppathol2006;87:49-63.];2.物理和化学混合方法:如联合使用马利兰、放射线等来联合建立再生障碍性贫血小鼠模型[menga,wangy,vanzantgetal.ionizingradiationandbusulfaninduceprematuresenescenceinmurinebonemarrowhematopoieticcells.cancerres2003;63:5414-5419.];3.由免疫机制介导机制诱导的再生障碍性贫血小鼠模型:如病毒感染和外源性淋巴细胞输入等诱导的再生障碍性贫血小鼠模型[fengx,linz,sunwetal.rapamycinishighlyeffectiveinmurinemodelsofimmune-mediatedbonemarrowfailure.haematologica2017;102:1691-1703.tangy,desiertomj,chenjetal.theroleoftheth1transcriptionfactort-betinamousemodelofimmune-mediatedbone-marrowfailure.blood2010;115:541-548.bloomml,wolkag,simon-stooskletal.amousemodeloflymphocyteinfusion-inducedbonemarrowfailure.exphematol2004;32:1163-1172.]。以上各种模型各有其优缺点,化学方法的缺点是造模时间周期长,容易造成骨髓永久性损伤;物理和化学混合的方法操作相对简单,造模周期短,成功率高且死亡率低,但第25天左右模型小鼠的造血功能会自行恢复正常。随着再生障碍性贫血免疫学发病机制的进一步明朗,研究人员发现用单纯的物理或(和)化学因素诱导的模型不符合再生障碍性贫血的病理生理学发病过程,并不适合用于再生障碍性贫血发病机制的研究,且目前也很少有学者以此为模型用于研究[chenj.animalmodelsforacquiredbonemarrowfailuresyndromes.clinmedres2005;3:102-108.]。我们应用干扰素γ腹腔注射联合白消安灌胃的方法成功建立了稳定的balb/c小重型再生障碍性贫血小鼠模型[宁方颖,林赠华,刘红等.干扰素-γ与白消安合用诱导建立小鼠重型再生障碍性贫血模型的研究.中华血液学杂志2011;32:779-784.],并证实了该小鼠模型可能更接近并模拟了人类重型再生障碍性贫血的免疫学的发病特点[宁方颖,林赠华,刘红等.干扰素-γ与白消安合用诱导建立小鼠重型再生障碍性贫血模型的研究.中华血液学杂志2011;32:779-784.刘海燕,林赠华,刘红等.调节性t细胞和th17细胞在新型小鼠重型再生障碍性贫血模型中的变化.中华血液学杂志,2012,33:653-656.]。但该模型操作也相对繁琐,死亡率>20%,不适合用于需要大批量再障小鼠模型的试验。美国nealyoung博士实验室于2004年起使用异体淋巴细胞尾静脉注射方法诱导再生障碍性贫血小鼠模型获得成功,但模型死亡率极高且小鼠所需供者淋巴结数量较多[bloomml,wolkag,simon-stooskletal.amousemodeloflymphocyteinfusion-inducedbonemarrowfailure.exphematol2004;32:1163-1172.]。后续该研究团队对造模方法进行了改进,使用全身辐照(tbi)加供者淋巴结细胞输注方法建立再生障碍性贫血小鼠模型,目前国际比较公认的是使用该实验室所建立的f1再生障碍性贫血小鼠模型和c.b10再生障碍性贫血小鼠模型[chenj,brandtjs,ellisonfmetal.defectivestromalcellfunctioninamousemodelofinfusion-inducedbonemarrowfailure.exphematol2005;33:901-908.chenj,ellisonfm,eckhausmaetal.minorantigenh60-mediatedaplasticanemiaisamelioratedbyimmunosuppressionandtheinfusionofregulatorytcells.jimmunol2007;178:4159-4168.]。两种造模方法都是使用tbi+b6小鼠淋巴结单个核细胞方案诱导,造模后模型稳定,死亡率低,骨髓衰竭的特点和再障患者相似。f1模型是使用balb/cby母鼠和b6公鼠、或者b6母鼠和dba/2公鼠配种后的子一代小鼠作为造模用小鼠(f1),使用5gy的γ射线tbi后从尾静脉输注b6小鼠的淋巴结单个核细胞建立再障小鼠模型,一般供者淋巴细胞在注射后3-7天起可以归巢到模型小鼠骨髓,在7天起开始显著扩增并导致模型小鼠出现骨髓衰竭[chenj,brandtjs,ellisonfmetal.defectivestromalcellfunctioninamousemodelofinfusion-inducedbonemarrowfailure.exphematol2005;33:901-908.]。该模型稳定且符合再障的临床特点,但需要专门的γ射线的放射源,限制了其应用。国外也有学者使用balb/c母鼠和c57bl/6公鼠配种的子一代f1小鼠作为受鼠,在使用3gy的γ射线tbi4-6小时后从腹腔输注5×107b6小鼠的脾脏单个核细胞建立再生障碍性贫血小鼠模型[therapeutictargetingofnotchsignalingamelioratesimmune-mediatedbonemarrowfailureofaplasticanemia.jexpmed,2013,210(7):1311-1329]。我国黄丽芳等人用balb/c小鼠(受鼠)经5.0gy60coγ射线照射后,输入5×106个dba/2小鼠(供鼠)的淋巴结细胞来建立免疫介导的骨髓衰竭动物模型。[免疫损伤介导的骨髓衰竭小鼠模型的建立.中华血液学杂志,2009,30(10):683-688.],而尹利明等人则通过使用balb/c小鼠(受鼠)经5.0gy60coγ射线照射后,在辐照后4小时内通过小鼠尾静脉输入2×106个dba/2小鼠(供鼠)的淋巴结细胞来建立免疫介导的再生障碍性贫血小鼠模型[effectsofsodiumcopperchlorophyllinonmesenchymalstemcellfunctioninaplasticanemiamice.chinjintegrmed.2013,19(5):360-366.],而杨等人则用dba/2小鼠(供鼠)的淋巴结细胞和胸腺细胞的混合物通过尾静脉注入到5.0gy的60coγ射线照射后的balb/c小鼠(受鼠)来建立再生障碍性贫血小鼠模型[effectofdangguibuxuetangonimmune-mediatedaplasticanemiabonemarrowproliferationmice,2013,19(5):360-366.]。
因此,现有的技术在技术上存在如下问题:(1)、目前国内大多数医疗研究机构没有60co或者铯137γ射线的辐照装置,无法通过该辐照方法建立免疫介导的再生障碍性贫血小鼠模型,限制了其广泛的应用;(2)目前国内无法订购到balb/cby小鼠和c.b10小鼠,无法使用balb/cby小鼠与其他小鼠杂交后的子一代f1小鼠或c.b10小鼠作为受鼠建立再生障碍性贫血小鼠模型;(3)小鼠尾静脉注射技术的难度较高,容易失败;(4)用脾脏单个核细胞腹腔注射建立的小鼠再生障碍性贫血小鼠模型所需脾脏的单个核细胞计数细胞数多,且从注射异体淋巴细胞到模型制备成功的所需时间需要等待17天左右,耗时长。
技术实现要素:
本发明要解决的技术问题是提供一种建立小鼠重型再生障碍性贫血模型的方法,以解决背景技术中所提出的问题。
为解决上述技术问题,本发明的实施例提供一种建立小鼠重型再生障碍性贫血模型的方法,其特征在于,包括以下步骤:(1)、制备b6d2f1雌性小鼠,并选取同周龄的b6雌性小鼠作为淋巴结单个核细胞供鼠;(2)、对步骤(1)制备的b6d2f1雌性小鼠全身辐照;(3)、使用步骤(1)选取的b6雌性小鼠制备淋巴结单个核细胞悬液;(4)、向步骤(2)辐射后的b6d2f1雌性小鼠腹腔内注射供鼠的淋巴结单个核细胞;(5)、将注射单个核细胞的b6d2f1雌性小鼠放回原处饲养,注射当天为第0天,等待11-13天,模型制备完成。
进一步的,所述步骤(1)中制备f1雌性小鼠的过程,具体包括以下步骤:选取b6雌性小鼠与dba/2雄性小鼠配种,繁育后的子一代雌性b6d2f1小鼠,选取8-12周龄b6d2f1雌性小鼠作为实验用小鼠。
进一步的,所述步骤(2)中对b6d2f1雌性小鼠全身辐照的过程,具体包括以下步骤:将步骤(1)所制备的10-12只b6df1雌性小鼠分别放入小鼠固定装置中,各小鼠之间相互分隔;将装有b6d2f1雌性小鼠的小鼠固定装置放置在varian直线加速器设备中,并按照标准操作流程对b6df1雌性小鼠进行全身辐照,辐射过程的具体参数如下:照射野为40×40cm2;剂量为0°角2.5gy,18°角2.5gy;辐照能量为6mvx线;辐照方法为等中心照射。
进一步的,所述步骤(3)中制备b6雌性小鼠的淋巴结单个核细胞悬液的过程,具体包括以下步骤:用颈椎脱臼法处死步骤(1)所选取的作为供鼠的b6雌性小鼠,酒精喷洒后,无菌条件下在超净台中解剖b6雌性小鼠,采集两侧颈部、腋下及腹股沟处的淋巴结,置于含有2mlrpmi1640培养基的无菌试管中,冰上保存;在进行步骤(4)中对b6d2f1雌性小鼠开始腹腔注射淋巴结细胞前的1-2小时,将采集的b6雌性小鼠淋巴结转移至无菌的小型组织研磨器中研磨,予90μm尼龙滤网过滤后转移到15ml的无菌试管中,加入10mlrpmi1640洗涤,4°c低温离心,1500rpm×5min,弃上清,用2mlimdm重悬单个核细胞,取10μl进行分别稀释50倍和100倍后在光镜下观察计数,取均值计算细胞浓度,调整细胞浓度为1.9×107-2.1×107/ml,放置冰上备用。
进一步的,所述步骤(4)中辐射后的b6d2f1雌性小鼠腹腔内注射供鼠的淋巴结单个核细胞的过程,具体包括以下步骤:在b6d2f1雌性小鼠全身照射后4-6小时,用1ml无菌注射器抽取步骤(3)中所制备的b6雌性小鼠淋巴结单个核细胞悬液0.4ml,其中细胞的个数为7.6×106-8.4×106个细胞;左手抓取b6d2f1雌性小鼠,使其腹部朝上头部略向下垂;抓紧背部皮肤使使腹部皮肤紧绷,于两大腿根连线与腹中线交叉点一侧1厘米位置将装有b6雌性小鼠淋巴结单个核细胞悬液的注射器的针尖刺入b6d2f1雌性小鼠的皮下,在皮下平行腹中线推进针头3-5mm,再以45°角向腹腔内刺入;针尖通过腹肌后,抵抗力消失,回抽无回流物,缓慢推入b6雌性小鼠淋巴结单个核细胞悬液。
进一步的,所述步骤(5)后还包括步骤(6)、重型再生障碍性贫血模型小鼠的验证。
其中,所述步骤(6)中重型再生障碍性贫血模型小鼠的验证过程,具体包括以下步骤:
s1、建立b6d2f1模型组小鼠和tbi对照组小鼠:在第12天时,分别取出注射有供鼠的淋巴结单个核细胞的b6d2f1雌性小鼠作为b6d2f1模型组小鼠,取出经全身辐照且未注射供鼠淋巴结细胞的b6d2f1雌性小鼠作为tbi对照组;
s2、从内眦静脉用一次性毛细吸管分别采集b6d2f1模型组小鼠和tbi对照组小鼠的小鼠眼眶静脉血,采集0.5ml至含有2uledta的2ml冻存管中,边采集边混匀;其中,edta预先离心至冻存管底部;
s3、颈椎脱臼法处死小鼠,无菌条件下解剖采集取得每只小鼠的右侧股骨于含2mlrpmi-1640的无菌试管中;采集的右侧股骨标本均于冰上保存;将右侧股骨与肌肉软组织分离,分别切除右侧股骨的两端,用1ml注射器抽取rpmi1640快速冲出骨髓内有核细胞,反复冲洗直至髓腔完全变白为止,予90μm尼龙滤网过滤后转移到15ml的无菌试管中,加入10mlrpmi1640洗涤,4°c低温离心,1500rpm×5min,弃上清,1mlack红细胞裂解液冰上裂解5分钟,期间在震荡器上震荡1次,加入10mlrpmi1640洗涤2次,离心速度1500rpm,×5min,用1mlrpmi1640重悬单个核细胞并通过70μmfalcon细胞滤网过滤收集每只小鼠骨髓单个核细胞,并制备成股骨骨髓单个核细胞的悬浊液,以上所有操作均在冰上进行;
s4、无菌条件下分离小鼠的左侧股骨,放入bouin固定液中60min后,将左侧股骨的标本在不同浓度乙醇中进行脱水,再将左侧股骨的标本放入含2mlhemapun865甲液的聚乙烯模具中浸泡2h,将乙液1ml滴入模具,静置20min;将包埋好的活检组织切至厚度为4μm的切片,放在载玻片上置于甲醇3min后,在jenner工作液内染6min,再放置giemsa工作液1h,用蒸馏水冲洗后,分别在醋酸水、95%乙醇中浸渍5~6次,乙醇快速脱水,二甲苯透明后晾干,再用中性树胶封固,最后通过光学显微镜进行观察;其中,bouin固定液采用饱和苦味酸75ml、40%甲醇20ml、冰醋酸5ml配制而成;所述乙液设置为聚乙二醇10ml与n,n二甲基苯甲胺2ml的混合液;其中,甲液采用甲基丙烯酸-2-羟基乙基酯单体100ml、聚乙二醇10ml、过氧化苯甲酰0.4g制备而成;
s5、将步骤s2的采集b6d2f1模型组小鼠和tbi对照组小鼠并置于冻存管中的静脉血置于血液混匀器上,按标准操作流程将外周血标本逐个测定分析每只小鼠的血常规结果;取10μl步骤s3中制备的股骨骨髓单个核细胞悬液分别稀释50倍和100倍后在光镜下通过计数板计数,取均值计算每只小鼠每支股骨骨髓的单个核细胞计数;将塑料包埋的左侧股骨切片放于光学显微镜下观察并进行拍照分析造血细胞比例。
本发明的上述技术方案的有益效果如下:本发明的建立小鼠重型再生障碍性贫血模型的方法,采用制备b6d2f1雌性小鼠,并选取同周龄的b6雌性小鼠作为淋巴结单个核细胞供鼠;制备的b6d2f1雌性小鼠全身辐照;b6雌性小鼠制备淋巴结单个核细胞悬液;向辐射后的b6d2f1雌性小鼠腹腔内注射供鼠的淋巴结单个核细胞;将注射单个核细胞的b6d2f1雌性小鼠放回原处饲养,12天,模型制备完成;由于国内大部分大型医疗机构配备有直线加速器的辐照设备,可以使用该装置产生的x射线来对实验小鼠进行全身辐照,节省了另外购买设备所产生的费用;国内容易订购到b6小鼠和dba/2小鼠,b6雌小鼠与dba/2雄小鼠杂交后子一代b6df1小鼠可以作为实验用小鼠;供鼠的淋巴结单个核细胞诱导再生障碍性贫血小鼠时所需细胞数量少,通过腹腔注射方法成功率高,也可成功诱导再生障碍性贫血小鼠模型,且在注射供鼠淋巴结细胞后的制备过程所需的时间仅为12天左右,制备时间较短,制备方法简单,通过本发明中制备方法可扩大该再生障碍性贫血模型的应用。
附图说明
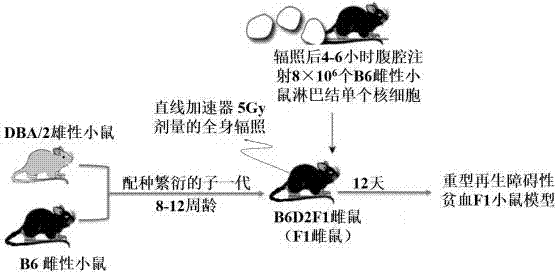
图1为本发明中建立小鼠重型再生障碍性贫血模型的方法过程示意图;
图2为本发明的b6df1模型组小鼠与tbi对照组小鼠的血常规结果中白细胞的数量统计图;
图3为本发明的b6df1模型组小鼠与tbi对照组小鼠的血常规结果中血红蛋白的数量统计图;
图4为本发明的b6df1模型组小鼠与tbi对照组小鼠的血常规结果中血小板的数量统计图;
图5为本发明的b6df1模型组小鼠与tbi对照组小鼠的右侧股骨骨髓细胞计数结果中单个核细胞的数量统计图;
图6a为本发明的tbi对照组小鼠左侧股骨骨髓活检低倍镜(100倍)的观察结果图;
图6b为本发明的tbi对照组小鼠左侧股骨骨髓活检高倍镜(400倍)的观察结果图;
图7a为本发明的b6df1模型组小鼠左侧股骨骨髓活检低倍镜(100倍)的观察结果图;
图7b为本发明的b6df1模型组小鼠左侧股骨骨髓活检高倍镜(400倍)的观察结果图。
具体实施方式
为使本发明要解决的技术问题、技术方案和优点更加清楚,下面将结合附图及具体实施例进行详细描述。
在本发明的描述中,需要说明的是,术语“中心”、“上”“下”、“左”、“右”、“竖直”、“水平”、“内”、“外”、“前”、“后”等指示的方位或位置关系为基于附图所示的方位或位置关系,仅是为了便于描述本发明和简化描述,而不是指示或暗示所指的装置或元件必须具有特定的方位、以特定的方位构造和操作,因此不能理解为对本发明的限制。此外,术语“第一”、“第二”、“第三”仅用于描述目的,而不能理解为指示或暗示相对重要性。
在本发明的描述中,需要说明的是,除非另有明确的规定和限定,术语“安装”、“相连”、“连接”应作为广义理解,例如,可以是固定连接,也可以是可拆卸连接,或一体地连接;可以是机械连接,也可以是电连接;可以是直接相连,也可以通过中间媒介间接相连,可以是两个元件内部的连通。对于本领域的普通技术人员而言,可以具体情况理解上述术语在本发明中的具体含义。
如图1所示,一种建立小鼠重型再生障碍性贫血模型的方法,包括以下步骤:
(1)、制备b6d2f1雌性小鼠,并选取同周龄的b6雌性小鼠作为淋巴结单个核细胞供鼠;在本实施例中,制备f1雌性小鼠的过程,具体包括以下步骤:选取b6雌性小鼠与dba/2雄性小鼠配种,繁育后的子一代雌性b6d2f1小鼠,选取8-12周龄b6d2f1雌性小鼠作为实验用小鼠。
(2)、对步骤(1)制备的b6d2f1雌性小鼠全身辐照;在本实施例中,对b6d2f1雌性小鼠全身辐照(tbi)的过程,具体包括以下步骤:将步骤(1)所制备的10-12只b6df1雌性小鼠分别放入小鼠固定装置中,各小鼠之间相互分隔;将装有b6d2f1雌性小鼠的小鼠固定装置放置在varian直线加速器设备中,varian直线加速器的型号为clinac-trilogy,并按照标准操作流程对b6df1雌性小鼠进行全身辐照,辐射过程的具体参数如下:照射野为40×40cm2;剂量为0°角2.5gy,18°角2.5gy;辐照能量为6mvx线;辐照方法为等中心照射(辐射源到照射中心的距离为100cm)。其中,所采用的小鼠固定装置采用专用于全身辐射用的小鼠固定装置,该小鼠固定装置包括底端封闭上端敞口的圆筒状壳体;盖合在圆筒状壳体上端口上并可拆卸式固定连接的圆形盖板;放置在圆筒状壳体中用于容纳实验鼠的、形状与实验鼠形体配合的8-12个水滴状容纳腔,各小鼠分别装在不同的容纳腔;装鼠腔体均尖端向心、圆端向外呈花瓣状辐射排列,且圆端与壳体管壁相切,在每个相切线的下部开有贯通壳体管壁和装鼠腔体管壁的通孔,通孔大小能使实验鼠尾巴通过,其中,圆形盖板为对辐射射线吸收剂量较小,可采用几乎可以忽略不计的热塑网状的材质。这种小鼠固定装置能够实现均匀辐射作用,但本发明中所采用的小鼠固定装置不仅限于上述这种结构,可实现均匀辐射即可。
(3)、使用步骤(1)选取的b6雌性小鼠制备淋巴结单个核细胞悬液;在本实施例中,制备b6雌性小鼠的淋巴结单个核细胞悬液的过程,具体包括以下步骤:用颈椎脱臼法处死步骤(1)所选取的作为供鼠的b6雌性小鼠,酒精喷洒后,无菌条件下在超净台中解剖b6雌性小鼠,采集两侧颈部、腋下及腹股沟处的淋巴结,置于含有2mlrpmi1640培养基的无菌试管中,冰上保存;在进行步骤(4)中对b6d2f1雌性小鼠开始腹腔注射淋巴结细胞前的1-2小时,将采集的b6雌性小鼠淋巴结转移至无菌的小型组织研磨器中研磨,予90μm尼龙滤网过滤后转移到15ml的无菌试管中,加入10mlrpmi1640洗涤,4°c低温离心,1500rpm×5min,弃上清,用2mlimdm重悬单个核细胞,取10μl进行分别稀释50倍和100倍后在光镜下观察计数,取均值计算细胞浓度,调整细胞浓度为1.9×107-2.1×107/ml,优选的,调整细胞浓度为2.0×107/ml,放置冰上备用。
(4)、向步骤(2)辐射后的b6d2f1雌性小鼠腹腔内注射供鼠的淋巴结单个核细胞;在本实施例中,辐射后的b6d2f1雌性小鼠腹腔内注射供鼠的淋巴结单个核细胞的过程,具体包括以下步骤:在b6d2f1雌性小鼠全身照射后4-6小时,用1ml无菌注射器抽取步骤(3)中所制备的b6雌性小鼠淋巴结单个核细胞悬液0.4ml,其中细胞的个数为7.6×106-8.4×106个细胞,优选的,细胞的个数为8.0×106个细胞;左手抓取b6d2f1雌性小鼠,使其腹部朝上头部略向下垂;抓紧背部皮肤使使腹部皮肤紧绷,于两大腿根连线与腹中线交叉点一侧1厘米(实际操作中可在0.8-1.2cm)位置将装有b6雌性小鼠淋巴结单个核细胞悬液的注射器的针尖刺入b6d2f1雌性小鼠的皮下,在皮下平行腹中线推进针头3-5mm,再以45°角向腹腔内刺入;针尖通过腹肌后,抵抗力消失,回抽无回流物,缓慢推入b6雌性小鼠淋巴结单个核细胞悬液。
(5)、将注射单个核细胞的b6d2f1雌性小鼠放回原处饲养,注射当天为第0天,等待11-13天,模型制备完成。
(6)、重型再生障碍性贫血模型小鼠的验证。在本实施例中重型再生障碍性贫血模型小鼠的验证过程,具体包括以下步骤:
s1、建立b6d2f1模型组小鼠和tbi对照组小鼠:在第12天时,分别取出注射有供鼠的淋巴结单个核细胞的b6d2f1雌性小鼠作为b6d2f1模型组小鼠,取出经全身辐照且未注射供鼠淋巴结细胞的b6d2f1雌性小鼠作为tbi对照组。
s2、从内眦静脉用一次性毛细吸管分别采集b6d2f1模型组小鼠和tbi对照组小鼠的小鼠眼眶静脉血,采集0.5ml至含有2uledta的2ml冻存管中,边采集边混匀;其中,edta预先离心至冻存管底部。
s3、颈椎脱臼法处死小鼠,无菌条件下解剖采集取得每只小鼠的右侧股骨于含2mlrpmi-1640的无菌试管中;采集的右侧股骨标本均于冰上保存;将右侧股骨与肌肉软组织分离,分别切除右侧股骨的两端,用1ml注射器抽取rpmi1640快速冲出骨髓内有核细胞,反复冲洗直至髓腔完全变白为止,予90μm尼龙滤网过滤后转移到15ml的无菌试管中,加入10mlrpmi1640洗涤,4°c低温离心,1500rpm×5min,弃上清,1mlack红细胞裂解液冰上裂解5分钟,期间在震荡器上震荡1次,加入10mlrpmi1640洗涤2次,离心速度1500rpm,×5min,用1mlrpmi1640重悬单个核细胞并通过70μmfalcon细胞滤网过滤收集每只小鼠骨髓单个核细胞,并制备成股骨骨髓单个核细胞的悬浊液,以上所有操作均在冰上进行。
s4、无菌条件下分离小鼠的左侧股骨,放入bouin固定液中60min后,将左侧股骨的标本在不同浓度乙醇中进行脱水,再将左侧股骨的标本放入含2mlhemapun865甲液的聚乙烯模具中浸泡2h,将乙液1ml滴入模具,静置20min;将包埋好的活检组织切至厚度为4μm的切片,放在载玻片上置于甲醇3min后,在jenner工作液内染6min,再放置giemsa工作液1h,用蒸馏水冲洗后,分别在醋酸水、95%乙醇中浸渍5~6次,乙醇快速脱水,二甲苯透明后晾干,再用中性树胶封固,最后通过光学显微镜进行观察;其中,bouin固定液采用饱和苦味酸75ml、40%甲醇20ml、冰醋酸5ml配制而成;所述乙液设置为聚乙二醇10ml与n,n二甲基苯甲胺2ml的混合液;其中,甲液采用甲基丙烯酸-2-羟基乙基酯单体100ml、聚乙二醇10ml、过氧化苯甲酰0.4g制备而成。
s5、将采集b6d2f1模型组小鼠和tbi对照组小鼠的外周血(即步骤s2中所采集的采集b6d2f1模型组小鼠和tbi对照组小鼠的小鼠眼眶静脉血)置于血液混匀器上,按标准操作流程将外周血标本逐个测定分析每只小鼠的血常规结果;取10μl步骤s3制备的股骨骨髓单个核细胞悬液分别稀释50倍和100倍后在光镜下通过计数板计数,取均值计算每只小鼠每支股骨骨髓的单个核细胞计数;将塑料包埋的左侧股骨切片放于光学显微镜下观察并进行拍照分析造血细胞比例。
数据通过spss统计软件分析,结果发现:
①b6d2f1模型组小鼠的白细胞、血红蛋白和血小板值均低于对照组小鼠的血常规相关参数,如图2、图3、图4所示,结果又统计学意义(p均<0.01);
②b6d2f1模型组小鼠每个股骨的骨髓单个核细胞计数也显著低于对照组小鼠(p<0.01)(图5),而对照图6a-b与图7a-b可见,骨髓活检结果提示b6d2f1模型组的骨髓造血组织显著减少,呈典型的骨髓衰竭表现(图7a-b)。(图中英文释义:wbc=白细胞,hb=血红蛋白,plt=血小板,control=tbi对照组,bmf=b6d2f1模型组,mnc=单个核细胞,bm=骨髓,femur=股骨)
上述结果证实该方法可以诱导重型再生障碍性贫血小鼠模型。
本发明的建立小鼠重型再生障碍性贫血模型的方法,采用制备b6d2f1雌性小鼠,并选取同周龄的b6雌性小鼠作为淋巴结单个核细胞供鼠;制备的b6d2f1雌性小鼠全身辐照;b6雌性小鼠制备淋巴结单个核细胞悬液;向辐射后的b6d2f1雌性小鼠腹腔内注射供鼠的淋巴结单个核细胞;将注射单个核细胞的b6d2f1雌性小鼠放回原处饲养,12天,模型制备完成;(1)由于国内大部分大型医疗机构配备有直线加速器的辐照设备,可以使用该装置产生的x射线来对实验小鼠进行全身辐照,制备过程不需要60co或者铯137γ射线的辐照特殊装置,使用国内大部分大型医疗机构配备的直线加速器的辐照设备,节省了另外购买设备所产生的费用;(2)国内可以订购到b6小鼠和dba/2小鼠,b6雌小鼠与dba/2雄小鼠杂交后子一代b6df1小鼠可以作为实验用小鼠;供鼠的淋巴结单个核细胞诱导再生障碍性贫血小鼠时所需细胞数量少(所注射的供鼠的淋巴结单个核细胞为8×106个细胞),通过腹腔注射方法成功率高,也可成功诱导再生障碍性贫血小鼠模型,且在注射供鼠淋巴结细胞后的制备过程所需的时间仅为12天左右,制备时间较短,制备方法简单,通过本发明中制备方法可扩大该再生障碍性贫血模型的应用,本模型通过步骤(6)重型再生障碍性贫血模型小鼠的验证过程,验证了模型符合再生障碍性贫血小鼠特点,适合推广应用。
以上所述是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明所述原理的前提下,还可以作出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!