一种用于体内靶向肿瘤成像与治疗的纳米基因载体及其制备方法和应用与流程
本发明属于可降解生物医用材料技术领域,具体涉及一种用于体内靶向肿瘤成像与治疗的纳米基因载体及其制备方法和应用。
背景技术:
随着基因治疗研究的不断深入,开发具有目的基因靶向、可控并有效表达的载体是基因治疗成功的关键。但是在目前基因治疗过程中,广泛使用的非病毒载体却由于其自身免疫原性高且存在潜在的致癌性,导致其临床使用存在很多的安全问题,相比之下,非病毒基因载体由于其独特的优点受到人们越来越多的关注。此外,随着各种科学技术的快速发展,细胞内精细结构、细胞间的相互作用、细胞信号转导以及大分子蛋白的作用等可以通过荧光显微镜得到观测,但是细胞在可见光区的自发荧光对荧光材料所发信号的遮掩和荧光有机染料分子易发生光漂白的问题却阻碍了荧光成像技术和荧光探针的开发和研究,因此,开发具有光稳定性、多功能化以及易调控等优点的荧光纳米材料会得到很好的应用前景。
聚合物是一种新型的荧光纳米材料,由于其具有优良的光学特性、稳定性好及修饰方便等优点,使其在生物成像,疾病治疗等邻域有着广阔的应用前景。目前,聚酯类生物材料是最具发展潜力的一类合成型生物可降解高分子材料,其具有可控的力学及降解性能和优异的生物相容性的特点。聚酯类生物材料可分为聚ε-己内酯(pcl)、聚丙交酯(pla)等线性聚酯生物材料和聚癸二酸-甘油酯(pgs)、聚柠檬酸-1,8-辛二醇酯(poc)等网络型聚酯生物材料。其中poc由柠檬酸和1,8-辛二醇通过缩合反应形成的,其合成单体无毒、生物相容性良好、反应条件简单、反应过程中无杂质引入且价格便宜,此外,柠檬酸还是人体三羧酸代谢产物,且其上三个羧酸基团通过聚乙二醇(peg)和聚乙烯亚胺(pei)进行修饰后,所得到的聚柠檬酸-1,8-辛二醇酯-聚乙二醇-聚乙烯亚胺(pp)预聚物具有良好的生物相容性,但是其缺乏体内靶向肿瘤成像的能力,使其作为基因载体在机体内的应用受到了很大的局限,如果能够通过进一步修饰pp预聚物,使其自身荧光特性、对基因的转染能力以及对肿瘤的靶向能力得到提高,在机体中的应用将会得到很大的提高。
技术实现要素:
针对目前基因治疗过程中使用具有高自身免疫原性和存在潜在致癌性的非病毒载体,以及传统的荧光分子较差的亲水性、光稳定性及在机体内稳定性等缺点,本发明的目的在于提供一种用于体内靶向肿瘤成像与治疗的纳米基因载体及其制备方法和应用,该方法工艺简单,制得的材料具有良好的体内靶向肿瘤成像与治疗能力。
为达到上述目的,本发明采用以下技术方案予以实现:
一种用于体内靶向肿瘤成像与治疗的纳米基因载体的制备方法,包括以下步骤:
1)ppf聚合物的制备:将pp预聚物和肿瘤主动靶向受体分子加入到mes缓冲液中,以edc和nhs作为催化剂进行反应,得到ppf聚合物;
2)ppr聚合物制备:将pp预聚物和细胞荧光分子加入到mes缓冲液中,以edc和nhs作为催化剂进行反应,得到ppr聚合物;
3)纳米基因载体的制备:将上述合成的ppf聚合物和ppr聚合物溶解在去离子水中,得到ppfr聚合物溶液;
4)将ppfr聚合物和基因加入到hepes缓冲液中,再在水浴中温育形成稳定的纳米复合物,得到用于体内靶向肿瘤成像与治疗的纳米基因载体。
作为本发明的进一步改进,步骤1)中的肿瘤主动靶向受体分子为叶酸;pp预聚物为聚柠檬酸酯预聚物。
作为本发明的进一步改进,步骤1)中pp预聚物和肿瘤主动靶向受体分子的反应摩尔比为1:(0.2~1.0);反应体系用naoh溶液调节溶液ph值至8.0~9.0室温搅拌反应。
作为本发明的进一步改进,步骤2)中的细胞荧光分子为罗丹明b。
作为本发明的进一步改进,步骤2)中pp预聚物和细胞荧光分子的反应摩尔比为1:(0.2~1.0);反应体系用naoh溶液调节溶液ph值至8.0~9.0室温搅拌反应。
作为本发明的进一步改进,步骤3)中ppf聚合物和ppr聚合物的质量比是1:(0.5~2)。
作为本发明的进一步改进,步骤4)中的基因为dna、sirna或mirna。
作为本发明的进一步改进,步骤4)中ppfr聚合物和基因均是以(0.3~20):1的氮磷摩尔比溶解到hepes缓冲液中;缓冲液为ph为7~8的hepes缓冲液;纳米复合物是在36℃~38℃水浴中温育10~50分钟形成。
一种由所述方法制得的用于体内靶向肿瘤成像与治疗的纳米基因载体。
所述的用于体内靶向肿瘤成像与治疗的纳米基因载体在活细胞成像、体内靶向肿瘤成像及治疗中的应用。
与现有技术相比,本发明具有以下有益效果:
本发明针对目前基因治疗过程中使用具有高自身免疫原性和存在潜在致癌性的非病毒载体,以及传统的荧光分子较差的亲水性、光稳定性及在机体内稳定性等缺点提供了一种用于体内靶向肿瘤成像与治疗的纳米基因载体的制备方法,该方法将聚柠檬酸酯预聚物(pp)与某些肿瘤主动靶向受体分子或细胞荧光分子通过催化反应,得到ppf和ppr聚合物,最后通过ppf和ppr聚合物以不同质量比溶解在去离子水中,得到ppfr聚合物溶液。通过向pp中引入某些肿瘤主动靶向受体分子如叶酸可以显著提高聚合物对肿瘤的靶向能力,引入细胞荧光分子如罗丹明b可以显著提高聚合物的生物成像能力。本发明制备方法简单方便,所使用热聚合反应和催化反应的合成方法环保、操作简单而且原料成本便宜。通过实验结果证明:该方法制备的纳米基因载体ppfr聚合物具有很好的生物相容性、基因转染效率以及体内靶向肿瘤成像与治疗的能力。
进一步,本发明所使用的聚柠檬酸酯预聚物(pp)是一种可降解脂肪族聚酯高分子,其生物相容性良好,亲水性好,制备方法简单且单体廉价易得。本发明通过两步化学反应制备的pp预聚物虽然具有很好的生物相容性、亲水性以及一定的荧光和基因转染能力,但是该聚合物缺乏体内靶向肿瘤成像的能力。因此,通过引入某些肿瘤主动靶向受体分子如叶酸可以显著提高聚合物对肿瘤的靶向能力,引入细胞荧光分子如罗丹明b可以显著提高聚合物的生物成像能力。
进一步,本发明利用叶酸对聚柠檬酸酯预聚物(pp)进行改性,改善了聚柠檬酸酯预聚物的肿瘤靶向能力,使其具有体内靶向肿瘤治疗能力,在基因治疗中的应用将会得到很大的提高。
进一步,本发明利用罗丹明b对聚柠檬酸酯预聚物(pp)进行改性,改善了聚柠檬酸酯预聚物的荧光特性,使其具有长波长荧光发射能力,在生物成像中的应用将会得到很大的提高。
本发明中制备的纳米基因载体具有良好的基因转染、肿瘤靶向及荧光能力,因此用于体内靶向肿瘤成像与治疗。
附图说明
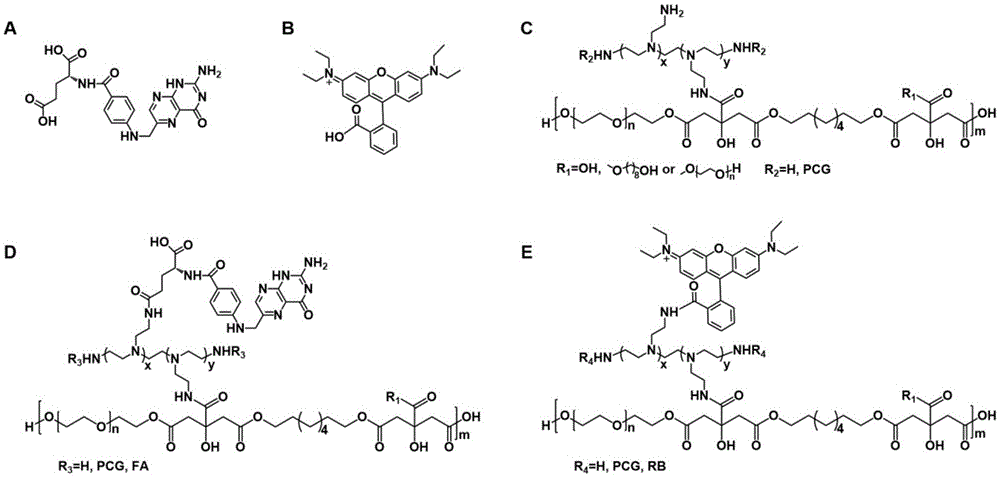
图1是本发明合成的用于体内靶向肿瘤成像与治疗的纳米基因载体中各种单体以及聚合物的结构式;其中a为叶酸的结构式,b为罗丹明b的结构式,c为聚柠檬酸酯预聚物(pp)的结构式,d为ppf聚合物的结构式,e为ppr聚合物的结构式。
图2是本发明合成的用于体内靶向肿瘤成像与治疗的纳米基因载体中各单体、ppf和ppr聚合物的ft-ir图谱。
图3是本发明合成的用于体内靶向肿瘤成像与治疗的纳米基因载体中ppr聚合物的光学特性;其中a为激发波长下表现出较强的荧光强度,b为荧光特性图。
图4是本发明合成的用于体内靶向肿瘤成像与治疗的纳米基因载体中聚合物的基因负载能力的测定。
图5是本发明合成的用于体内靶向肿瘤成像与治疗的纳米基因载体中聚合物的细胞毒性的测定,a和b是材料在不同天数对成肌细胞毒性的测定图。
图6是本发明合成的用于体内靶向肿瘤成像与治疗的纳米基因载体中聚合物的靶向肿瘤成像的测定,其中a和b是通过尾静脉注射材料24h后,材料在肿瘤处的荧光照片和荧光强度的结果图。
图7是本发明合成的用于体内靶向肿瘤成像与治疗的纳米基因载体中聚合物的肿瘤抑制和基因沉默的测定,其中a和b是每两天尾静脉注射一次材料,12天后肿瘤的重量以及p65基因的相对表达量。
具体实施方式
下面结合附图对本发明做进一步详细描述:
本发明致力于制备一种具有良好生物相容性和良好的基因转染、肿瘤靶向及荧光能力,使其可用于体内靶向肿瘤成像与治疗。制备方法包括以下步骤:
1)ppf聚合物的制备:将摩尔比为1:(0.2~1.0)的pp预聚物和肿瘤主动靶向受体分子在mes缓冲液中(ph4-6),以edc和nhs作为催化剂进行反应,;反应体系用naoh溶液调节溶液ph值至8.0~9.0后室温搅拌反应。得到ppf聚合物。肿瘤主动靶向受体分子是叶酸。结构式如下:
2)ppr聚合物制备:将摩尔比为1:(0.2~1.0)的pp预聚物和细胞荧光分子在mes缓冲液中(ph4-6),以edc和nhs作为催化剂进行反应,;反应体系用naoh溶液调节溶液ph值至8.0~9.0后室温搅拌反应。得到ppr聚合物。细胞荧光分子是罗丹明b。结构式如下:
3)纳米基因载体的制备:将上述合成的ppf聚合物和ppr聚合物以质量比1:(0.5~2)溶解在去离子水中,得到ppfr聚合物溶液。
4)将ppfr聚合物和基因按照(0.3~20):1的氮磷摩尔比加入到50mm,ph为7~8的hepes缓冲液中,在36℃~38℃水浴中温育10~50分钟形成稳定的纳米复合物,得到一种用于体内靶向肿瘤成像与治疗的纳米基因载体。基因为dna、sirna或mirna。
其中,该方法首先将摩尔比1:0.7:0.3的柠檬酸、1,8-辛二醇和聚乙二醇在140℃条件下进行热聚合反应生成一种预聚物,随后在edc和nhs的催化下,该预聚物和聚乙烯亚胺以摩尔比1:1通过化学催化反应得到聚柠檬酸酯预聚物(pp)。
其中,聚柠檬酸酯预聚物(pp)虽然具有很好的生物相容性、亲水性以及一定的荧光和基因转染能力,但是该聚合物缺乏体内靶向肿瘤成像的能力,导致其在生物成像以及肿瘤治疗中的应用受到极大的限制。肿瘤细胞和正常的细胞在基因表达上存在明显的差异,某些肿瘤细胞表面有一些特异过度表达的受体,因此,我们将能与这些受体发生特异性结合的高效靶头如叶酸接枝到pp预聚物上,在特定靶头的作用下聚合物向肿瘤组织进行高效的靶向蓄积,改善其对肿瘤组织的主动靶向能力。此外,由于细胞在可见光区的自发荧光对荧光材料所发信号的遮掩和荧光有机染料分子易发生光漂白的问题很大程度的限制了细胞荧光分子如罗丹明b的使用,通过将荧光分子接枝到pp预聚物上,可以有效的克服其荧光稳定性差、易污染及组织非特异性染色等缺点。因此,在本发明中,通过两步化学反应制备的pp预聚物,随后通过引入某些肿瘤主动靶向受体分子和细胞荧光分子提高聚合物对肿瘤的靶向能力和生物成像能力,该制备方法简单方便,所使用热聚合反应和催化反应的合成方法环保、操作简单而且原料成本便宜,而且制备的纳米基因载体ppfr聚合物具有很好的生物相容性、基因转染效率以及体内靶向肿瘤成像与治疗的能力。
为了更好的理解本发明,下面结合具体实施方式对本发明进行详细说明,但本发明的内容不仅仅局限于下面的实施例。
实施例1
1)ppf0.2聚合物的制备:将0.2mmol叶酸完全溶解在50mm,ph4-6mes缓冲液中,加入3mmoledc室温搅拌30min后,加入3mmolnhs室温搅拌12h,随后加入1mmolpp预聚物,并用naoh溶液调节溶液ph值至8.0,室温搅拌24h,最终产物经透析纯化后,冷冻干燥得到ppf0.2聚合物;
2)ppr0.2聚合物制备:将0.2mmol罗丹明b完全溶解在50mm,ph4-6mes缓冲液中,加入3mmoledc室温搅拌30min后,加入3mmolnhs室温搅拌12h,随后加入1mmolpp预聚物,并用naoh溶液调节溶液ph值至9.0,室温搅拌24h,最终产物经透析纯化后,冷冻干燥得到ppr0.2聚合物;
3)纳米基因载体的制备:将上述合成的ppf0.2聚合物和ppr0.2聚合物以质量比1:0.5溶解在去离子水中,得到ppfr-1聚合物溶液。
4)将ppfr-1聚合物和sirna按照20:1的氮磷摩尔比加入到50mm,ph为7.4的hepes缓冲液中,在37℃水浴中温育30分钟形成稳定的纳米复合物,得到一种用于体内靶向肿瘤成像与治疗的纳米基因载体。
实施例2
1)ppf0.2聚合物的制备:将0.2mmol叶酸完全溶解在50mm,ph4-6mes缓冲液中,加入3mmoledc室温搅拌30min后,加入3mmolnhs室温搅拌12h,随后加入1mmolpp预聚物,并用naoh溶液调节溶液ph值至9.0,室温搅拌24h,最终产物经透析纯化后,冷冻干燥得到ppf0.2聚合物;
2)ppr0.2聚合物制备:将0.2mmol罗丹明b完全溶解在50mm,ph4-6mes缓冲液中,加入3mmoledc室温搅拌30min后,加入3mmolnhs室温搅拌12h,随后加入1mmolpp预聚物,并用naoh溶液调节溶液ph值至8.0,室温搅拌24h,最终产物经透析纯化后,冷冻干燥得到ppr0.2聚合物;
3)纳米基因载体的制备:将上述合成的ppf0.2聚合物和ppr0.2聚合物以质量比1:1溶解在去离子水中,得到ppfr-2聚合物溶液。
4)将ppfr-2聚合物和sirna按照10:1的氮磷摩尔比加入到50mm,ph为7.4的hepes缓冲液中,在37℃水浴中温育30分钟形成稳定的纳米复合物,得到一种用于体内靶向肿瘤成像与治疗的纳米基因载体。
实施例3
1)ppf0.2聚合物的制备:将0.2mmol叶酸完全溶解在50mm,ph4-6mes缓冲液中,加入3mmoledc室温搅拌30min后,加入3mmolnhs室温搅拌12h,随后加入1mmolpp预聚物,并用naoh溶液调节溶液ph值至8.5,室温搅拌24h,最终产物经透析纯化后,冷冻干燥得到ppf0.2聚合物;
2)ppr0.2聚合物制备:将0.2mmol罗丹明b完全溶解在50mm,ph4-6mes缓冲液中,加入3mmoledc室温搅拌30min后,加入3mmolnhs室温搅拌12h,随后加入1mmolpp预聚物,并用naoh溶液调节溶液ph值至8.0,室温搅拌24h,最终产物经透析纯化后,冷冻干燥得到ppr0.2聚合物;
3)纳米基因载体的制备:将上述合成的ppf0.2聚合物和ppr0.2聚合物以质量比1:2溶解在去离子水中,得到ppfr-3聚合物溶液。
4)将ppfr-3聚合物和sirna按照20:1的氮磷摩尔比加入到50mm,ph为7.4的hepes缓冲液中,在37℃水浴中温育30分钟形成稳定的纳米复合物,得到一种用于体内靶向肿瘤成像与治疗的纳米基因载体。
实施例4
1)ppf0.5聚合物的制备:将0.5mmol叶酸完全溶解在50mm,ph4-6mes缓冲液中,加入3mmoledc室温搅拌30min后,加入3mmolnhs室温搅拌12h,随后加入1mmolpp预聚物,并用naoh溶液调节溶液ph值至8.0,室温搅拌24h,最终产物经透析纯化后,冷冻干燥得到ppf0.5聚合物;
2)ppr0.5聚合物制备:将0.5mmol罗丹明b完全溶解在50mm,ph4-6mes缓冲液中,加入3mmoledc室温搅拌30min后,加入3mmolnhs室温搅拌12h,随后加入1mmolpp预聚物,并用naoh溶液调节溶液ph值至8.0,室温搅拌24h,最终产物经透析纯化后,冷冻干燥得到ppr0.5聚合物;
3)纳米基因载体的制备:将上述合成的ppf0.5聚合物和ppr0.5聚合物以质量比1:0.5溶解在去离子水中,得到ppfr-4聚合物溶液。
4)将ppfr-4聚合物和sirna按照20:1的氮磷摩尔比加入到50mm,ph为7.4的hepes缓冲液中,在37℃水浴中温育30分钟形成稳定的纳米复合物,得到一种用于体内靶向肿瘤成像与治疗的纳米基因载体。
实施例5
1)ppf0.5聚合物的制备:将0.5mmol叶酸完全溶解在50mm,ph4-6mes缓冲液中,加入3mmoledc室温搅拌30min后,加入3mmolnhs室温搅拌12h,随后加入1mmolpp预聚物,并用naoh溶液调节溶液ph值至8.0,室温搅拌24h,最终产物经透析纯化后,冷冻干燥得到ppf0.5聚合物;
2)ppr0.5聚合物制备:将0.5mmol罗丹明b完全溶解在50mm,ph4-6mes缓冲液中,加入3mmoledc室温搅拌30min后,加入3mmolnhs室温搅拌12h,随后加入1mmolpp预聚物,并用naoh溶液调节溶液ph值至8.5,室温搅拌24h,最终产物经透析纯化后,冷冻干燥得到ppr0.5聚合物;
3)纳米基因载体的制备:将上述合成的ppf0.5聚合物和ppr0.5聚合物以质量比1:1溶解在去离子水中,得到ppfr-5聚合物溶液。
4)将ppfr-5聚合物和sirna按照1.3:1的氮磷摩尔比加入到50mm,ph为7.4的hepes缓冲液中,在37℃水浴中温育30分钟形成稳定的纳米复合物,得到一种用于体内靶向肿瘤成像与治疗的纳米基因载体。
实施例6
1)ppf0.5聚合物的制备:将0.5mmol叶酸完全溶解在50mm,ph4-6mes缓冲液中,加入3mmoledc室温搅拌30min后,加入3mmolnhs室温搅拌12h,随后加入1mmolpp预聚物,并用naoh溶液调节溶液ph值至8.0,室温搅拌24h,最终产物经透析纯化后,冷冻干燥得到ppf0.5聚合物;
2)ppr0.5聚合物制备:将0.5mmol罗丹明b完全溶解在50mm,ph4-6mes缓冲液中,加入3mmoledc室温搅拌30min后,加入3mmolnhs室温搅拌12h,随后加入1mmolpp预聚物,并用naoh溶液调节溶液ph值至8.0,室温搅拌24h,最终产物经透析纯化后,冷冻干燥得到ppr0.5聚合物;
3)纳米基因载体的制备:将上述合成的ppf0.5聚合物和ppr0.5聚合物以质量比1:2溶解在去离子水中,得到ppfr-6聚合物溶液。
4)将ppfr-6聚合物和sirna按照1:1的氮磷摩尔比加入到50mm,ph为7.4的hepes缓冲液中,在37℃水浴中温育30分钟形成稳定的纳米复合物,得到一种用于体内靶向肿瘤成像与治疗的纳米基因载体。
实施例7
1)ppf1.0聚合物的制备:将1mmol叶酸完全溶解在50mm,ph4-6mes缓冲液中,加入3mmoledc室温搅拌30min后,加入3mmolnhs室温搅拌12h,随后加入1mmolpp预聚物,并用naoh溶液调节溶液ph值至8.0,室温搅拌24h,最终产物经透析纯化后,冷冻干燥得到ppf1.0聚合物;
2)ppr1.0聚合物制备:将1mmol罗丹明b完全溶解在50mm,ph4-6mes缓冲液中,加入3mmoledc室温搅拌30min后,加入3mmolnhs室温搅拌12h,随后加入1mmolpp预聚物,并用naoh溶液调节溶液ph值至8.0,室温搅拌24h,最终产物经透析纯化后,冷冻干燥得到ppr1.0聚合物;
3)纳米基因载体的制备:将上述合成的ppf1.0聚合物和ppr1.0聚合物以质量比1:0.5溶解在去离子水中,得到ppfr-7聚合物溶液。
4)将ppfr-7聚合物和sirna按照2.5:1的氮磷摩尔比加入到50mm,ph为7.4的hepes缓冲液中,在37℃水浴中温育30分钟形成稳定的纳米复合物,得到一种用于体内靶向肿瘤成像与治疗的纳米基因载体。
实施例8
1)ppf1.0聚合物的制备:将1mmol叶酸完全溶解在50mm,ph4-6mes缓冲液中,加入3mmoledc室温搅拌30min后,加入3mmolnhs室温搅拌12h,随后加入1mmolpp预聚物,并用naoh溶液调节溶液ph值至8.0,室温搅拌24h,最终产物经透析纯化后,冷冻干燥得到ppf1.0聚合物;
2)ppr1.0聚合物制备:将1mmol罗丹明b完全溶解在50mm,ph4-6mes缓冲液中,加入3mmoledc室温搅拌30min后,加入3mmolnhs室温搅拌12h,随后加入1mmolpp预聚物,并用naoh溶液调节溶液ph值至8.0,室温搅拌24h,最终产物经透析纯化后,冷冻干燥得到ppr1.0聚合物;
3)纳米基因载体的制备:将上述合成的ppf1.0聚合物和ppr1.0聚合物以质量比1:1溶解在去离子水中,得到ppfr-8聚合物溶液。
4)将ppfr-8聚合物和sirna按照5:1的氮磷摩尔比加入到50mm,ph为7.4的hepes缓冲液中,在37℃水浴中温育30分钟形成稳定的纳米复合物,得到一种用于体内靶向肿瘤成像与治疗的纳米基因载体。
实施例9
1)ppf1.0聚合物的制备:将1mmol叶酸完全溶解在50mm,ph4-6mes缓冲液中,加入3mmoledc室温搅拌30min后,加入3mmolnhs室温搅拌12h,随后加入1mmolpp预聚物,并用naoh溶液调节溶液ph值至8.0,室温搅拌24h,最终产物经透析纯化后,冷冻干燥得到ppf1.0聚合物;
2)ppr1.0聚合物制备:将1mmol罗丹明b完全溶解在50mm,ph4-6mes缓冲液中,加入3mmoledc室温搅拌30min后,加入3mmolnhs室温搅拌12h,随后加入1mmolpp预聚物,并用naoh溶液调节溶液ph值至8.0,室温搅拌24h,最终产物经透析纯化后,冷冻干燥得到ppr1.0聚合物;
3)纳米基因载体的制备:将上述合成的ppf1.0聚合物和ppr1.0聚合物以质量比1:2溶解在去离子水中,得到ppfr-9聚合物溶液。
4)将ppfr-9聚合物和sirna按照0.3:1的氮磷摩尔比加入到50mm,ph为7.0的hepes缓冲液中,在37℃水浴中温育30分钟形成稳定的纳米复合物,得到一种用于体内靶向肿瘤成像与治疗的纳米基因载体。
实施例10
1)ppf1.0聚合物的制备:将1mmol叶酸完全溶解在50mm,ph4-6mes缓冲液中,加入3mmoledc室温搅拌30min后,加入3mmolnhs室温搅拌12h,随后加入1mmolpp预聚物,并用naoh溶液调节溶液ph值至8.0,室温搅拌24h,最终产物经透析纯化后,冷冻干燥得到ppf1.0聚合物;
2)ppr1.0聚合物制备:将1mmol罗丹明b完全溶解在50mm,ph4-6mes缓冲液中,加入3mmoledc室温搅拌30min后,加入3mmolnhs室温搅拌12h,随后加入1mmolpp预聚物,并用naoh溶液调节溶液ph值至8.0,室温搅拌24h,最终产物经透析纯化后,冷冻干燥得到ppr1.0聚合物;
3)纳米基因载体的制备:将上述合成的ppf1.0聚合物和ppr1.0聚合物以质量比1:1溶解在去离子水中,得到ppfr-8聚合物溶液。
4)将ppfr-8聚合物和sirna按照0.6:1的氮磷摩尔比加入到50mm,ph为8.0的hepes缓冲液中,在36℃水浴中温育10分钟形成稳定的纳米复合物,得到一种用于体内靶向肿瘤成像与治疗的纳米基因载体。
对比例
sirna加入到50mm,ph为7.8的hepes缓冲液中,在38℃水浴中温育50分钟形成稳定的纳米复合物,得到纳米基因载体。
本发明制备的用于体内靶向肿瘤成像与治疗的纳米基因载体ppfr聚合物具有很好的生物相容性,亲水性好,所使用热聚合反应和催化反应的合成方法环保、操作简单而且原料成本便宜。由于引入某些肿瘤主动靶向受体分子和细胞荧光分子提高聚合物对肿瘤的靶向能力和生物成像能力,为聚合物在生物成像以及肿瘤中的应用得到了很大的提高。下面结合实验数据进行详细分析。
图1是本发明合成的用于体内靶向肿瘤成像与治疗的纳米基因载体中各种单体以及聚合物的结构式,其中图1中a为叶酸的结构式,图1中b为罗丹明b的结构式,图1中c为聚柠檬酸酯预聚物(pp)的结构式,图1中d为ppf聚合物的结构式,图1e为ppr聚合物的结构式。
图2是本发明合成的用于体内靶向肿瘤成像与治疗的纳米基因载体中各单体、ppf和ppr聚合物的ft-ir图谱,其中1700cm-1和1710cm-1处吸收峰的消失表明叶酸(fa)和罗丹明b(rb)上的羧基(-cooh)已与pp聚合物的氨基发生反应,此外,1605cm-1,1509cm-1和1517cm-1处的吸收峰的出现表明ppf和ppr聚合物的成功合成。
图3是本发明合成的用于体内靶向肿瘤成像与治疗的纳米基因载体中ppr聚合物的光学特性。从图3中a看出,ppr在375nm的激发波长下表现出较强的荧光强度,其发射波长在457nm和595nm,并且随着聚合物内pp与罗丹明b含量的不同,其特定发射波长处的荧光强度也不同,从图3中b中可以看出,在365nm的紫外灯激发下,ppr聚合物表现出一定的荧光特性。
图4是本发明合成的用于体内靶向肿瘤成像与治疗的纳米基因载体中聚合物的基因负载能力的测定。从图中可以看出,在不同氮磷摩尔比条件下,材料对于基因的结合能力不同,当氮磷摩尔比达到10:1时,基因能够被ppf和ppr完全负载,这样的材料能够作为基因载体奠定了一定的基础。
图5是本发明合成的用于体内靶向肿瘤成像与治疗的纳米基因载体中聚合物的细胞毒性的测定。图5中a和b是材料在不同天数对成肌细胞毒性的测定,从中可以看出,pp预聚物和ppfr聚合物的细胞毒性特别低,说明其具有很好的细胞相容性。
图6是本发明合成的用于体内靶向肿瘤成像与治疗的纳米基因载体中聚合物的靶向肿瘤成像的测定。图6中a和b是通过尾静脉注射材料24h后,材料在肿瘤处的荧光照片和荧光强度的结果,从图中可以看出,注射ppfr聚合物的老鼠肿瘤的荧光强度明显高于pbs和ppr组,说明ppfr能够更有效的在肿瘤处富集,进步一说明了ppfr的靶向肿瘤成像作用。
图7是本发明合成的用于体内靶向肿瘤成像与治疗的纳米基因载体中聚合物的肿瘤抑制和基因沉默的测定。图7中a和b是每两天尾静脉注射一次材料,12天后肿瘤的重量以及p65基因的相对表达量。从图中可以看出,注射ppfr/sip65的肿瘤质量与p65的相对表达明显低于pbs和ppfr组,说明ppfr/sip65能够更有效的通过降低p65的基因表达从而抑制肿瘤的生长,进步一说明了ppfr的靶向肿瘤治疗作用。
由此可见,本发明合成的用于体内靶向肿瘤成像与治疗的纳米基因载体,具有很好的生物相容性,亲水性好,所使用热聚合反应和催化反应的合成方法环保、操作简单而且原料成本便宜。由于引入某些肿瘤主动靶向受体分子和细胞荧光分子提高聚合物对肿瘤的靶向能力和生物成像能力,为聚合物在生物成像以及肿瘤中的应用得到了很大的提高。因此,该聚合物作为一种纳米基因载体,在生物医学邻域有着一定的发展前景。
以上内容仅为说明本发明的技术思想,不能以此限定本发明的保护范围,凡是按照本发明提出的技术思想,在技术方案基础上所做的任何改动,均落入本发明权利要求书的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!