包括给药COBIMETINIB和威罗菲尼的黑色素瘤的组合疗法的制作方法
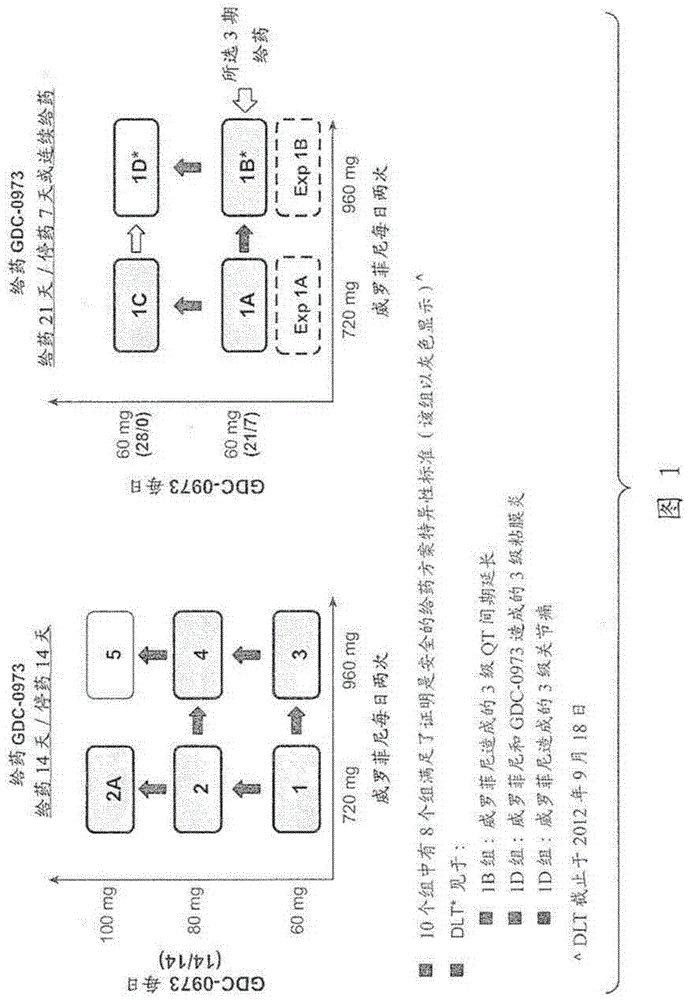
相关申请的交叉参考本申请要求美国专利申请号61/684,673(于2012年8月17日提交)、美国专利申请号61/705,575(于2012年9月25日提交)、美国专利申请号61/706,026(于2012年9月26日提交)、美国专利申请号61/722,725(于2012年11月5日提交)和美国专利申请号61/780,708(于2013年3月13日提交)的优先权,其全部内容引入本文作为参考。发明领域本发明总体涉及分子生物学和信号转导领域。更具体地,本发明涉及治疗病理学病症(例如癌症)的疗法。发明背景癌症仍然是对人类健康最致命的威胁之一。在世界范围内,黑色素瘤病例数的增长速度比任何其他的人类癌症都要快(Roberts等人,Br.J.Dermatol(2002)146:7-17,Boyle等人,Annoncol(2004)15:5-6)。尽管每年发病率在不同人种之间有所不同,但是通常情况下,白皮肤的高加索人的发病率攀升最快(大约每年3-7%)。据估计,每年全世界有约13.2万黑色素瘤新增病例,并且有约3.7万例由黑色素瘤导致的死亡。在2009年,美国有6.872万黑色素瘤新增病例且由黑色素瘤造成8650例死亡(Jemal等人,CACancerJClin(2009)59:225-49)。黑色素瘤患者的临床疗效高度取决于其所处阶段。转移性黑色素瘤是最致命的癌症之一。尽管最近成功研发出针对黑色素瘤的新疗法,但是绝大多数患者最终还是死于他们的疾病;因此,在这部分黑色素瘤患者群体中,对疗效的改善仍存在显著的未得到满足的需要。威罗菲尼(Vemurafenib)获得了FDA批准用于治疗BRAFV600E突变阳性的不可切除或转移性黑色素瘤患者,其使用的是4800BRAFV600突变Test(参见[威罗菲尼]药品说明书)。与达卡巴嗪相比,威罗菲尼使得死亡风险下降63%且使得疾病进展或死亡的风险降低74%(Chapman等人,NEJM(2011)364(26):2507-16。此外,威罗菲尼治疗导致应答率始终高于50%且OS中位数为14至16个月(Flaherty等人,NEJM(2010)363:809-819;Chapman等人,同上;Sosman等人,NEJM(2012)366(8):707)。发明概述本发明提供了治疗病理学病症(例如癌症)的组合疗法,其中将MEK抑制剂与BRAF抑制剂组合,从而提供显著的抗肿瘤活性。具体地,本发明提供了将BRAF抑制剂与MEK抑制剂组合用于患有BRAFV600突变阳性的不可切除或转移性黑色素瘤患者的临床试验数据。在一个方面,提供了治疗(例如,治疗性治疗)患有BRAFV600突变阳性癌症的患者(在本文中可互换地称作“个体”)的方法,包括向该患者给药(i)第一组合物,其包含[3,4-二氟-2-[(2-氟-4-碘苯基)氨基]苯基][3-羟基-3-[(2S)-2-哌啶基]-1-氮杂环丁烷基]甲酮(化合物II),或其药学上可接受的盐;和(ii)第二组合物,其包含丙-1-磺酸{3-[5-(4-氯苯基)-1H-吡咯并[2,3-b]吡啶-3-羰基]-2,4-二氟-苯基}-酰胺(化合物I),或其药学上可接受的盐,在28天周期的第1至28天以960mg的剂量,每日两次。在一个方面,提供了治疗(例如,治疗性治疗)患有BRAFV600突变阳性的不可切除或转移性黑色素瘤患者的方法,包括向该患者给药(i)包含化合物II或其药学上可接受的盐的第一组合物,在28天周期的第1至21天以60mg剂量(例如,60mg的片剂,一片);和(ii)包含化合物I或其药学上可接受的盐的第二组合物,在28天周期的第1至28天以960mg的剂量(例如,240mg的片剂,4片),每日两次。在一些实施方式中,化合物I或其药学上可接受的盐基本上是无定形形式。在一些实施方式中,化合物I或其药学上可接受的盐是无定形形式。在一些实施方式中,化合物I或其药学上可接受的盐包含在用醋酸羟丙基甲基纤维素琥珀酸酯形成的固体分子复合物中,从而使其固定为其无定形形式。在一些实施方式中,在所述复合物中化合物I或其药学上可接受的盐和醋酸羟丙基甲基纤维素琥珀酸酯(HPMC-AS)的各自量的比例为约1:9至约5:5。在一些实施方式中,在所述复合物中化合物I或其药学上可接受的盐和醋酸羟丙基甲基纤维素琥珀酸酯的各自量的比例为约2:8至约4:6。在一些实施方式中,在所述复合物中化合物I或其药学上可接受的盐和醋酸羟丙基甲基纤维素琥珀酸酯的各自量的比例为约3:7。在一些实施方式中,所述第二组合物包括混合物,其中该混合物重量的约97%为上述固体分子复合物且该混合物重量的约3%为二氧化硅。在一些实施方式中,所述第二组合物包括上述固体分子复合物在药学上可接受的载体中的混悬液。在一些实施方式中,所述第二组合物包括片剂,其包含化合物I或其药学上可接受的盐和HPMC-AS的固体分子复合物。在一些实施方式中,化合物I以片剂提供。在一些实施方式中,化合物I以240mg片剂提供(即,包含240mg的化合物I的片剂)。在一些实施方式中,化合物I以市售为的片剂提供。在一些实施方式中,包含化合物II的第一组合物包含乳糖一水合物、维晶纤维素、交联羧甲基纤维素钠和硬脂酸镁中的一种或多种。在一些实施方式中,化合物II以片剂提供,所述片剂包含乳糖一水合物、维晶纤维素、交联羧甲基纤维素钠和硬脂酸镁。在一些实施方式中,所述片剂包含片剂包衣,该包衣包含部分水解的聚乙烯醇、二氧化钛、聚乙二醇3350和滑石。在一些实施方式中,化合物II以20mg片剂、40mg片剂或60mg片剂(即,包含60mg化合物II的片剂)提供。在一些实施方式中,化合物II以60mg片剂提供。在一些实施方式中,所述60mg片剂提供于药丸盒(pillcard)或罩泡包装中。在一些实施方式中,可同时或相继给药,且可以组合制剂或分开的制剂给药。在一些实施方式中,第一组合物(包含化合物II)与第二组合物(包含化合物I)相继给药(包括但不限于:给药一片或多片包含化合物I的片剂,然后给药一片或多片化合物II的片剂;给药一片或多片化合物I的片剂,然后给药一片或多片化合物II的片剂,然后给药一片或多片化合物I的片剂)。在一些实施方式中,第一组合物在第二组合物之前给药。在一些实施方式中,第二组合物在第一组合物之前给药。在一些实施方式中,第一组合物与第二组合物同时给药。在一些实施方式中,第一组合物与第二组合物同时给药,然后给药第一化合物。在一些实施方式中,所述第一和第二组合物以组合制剂提供(在一些实施方式中,作为片剂)。在一些实施方式中,将所述第一和第二组合物共同配制(co-formulated)(例如,作为药物制剂)。在一些实施方式中,在给药第一个960mg(例如,240mg片剂,四片)剂量的化合物I或其药学上可接受的盐后约12个小时,给药第二个960mg剂量(例如,240mg片剂,四片)的化合物I或其药学上可接受的盐。在一些实施方式中,分别口服给药化合物I或其药学上可接受的盐和化合物II或其药学上可接受的盐,餐前或餐后服用。在一些实施方式中,分别口服给药化合物I或其药学上可接受的盐和化合物II或其药学上可接受的盐,餐后给药。在一些实施方式中,分别口服给药化合物I或其药学上可接受的盐和化合物II或其药学上可接受的盐,餐前给药。在一些实施方式中,所述不可切除或转移性黑色素瘤为BRAFV600突变阳性的黑色素瘤。在一些实施方式中,所述不可切除或转移性黑色素瘤为转移性黑色素瘤。在一些实施方式中,所述不可切除或转移性黑色素瘤为不可切除的黑色素瘤。在一些实施方式中,该患者的不可切除或转移性黑色素瘤在先前未经治疗(例如,用威罗菲尼或BRAF抑制剂治疗)。在一些实施方式中,该患者的不可切除或转移性黑色素瘤在先前已得到治疗(在一些实施方式中,先前未经BRAF抑制剂治疗)。在一些实施方式中,BRAFV600突变使用如下方法进行测定,该方法包括:(a)对提取自患者的黑色素瘤样品的核酸(例如,DNA,例如,基因组DNA(genomicDNA))进行PCR或测序;和(b)测定样品中BRAFV600的表达。在一些实施方式中,所述黑色素瘤样品是福尔马林固定、石蜡包埋的。在一些实施方式中,BRAFV600突变使用如下方法进行测定,该方法包括:(a)从患者的黑色素瘤样品中分离出DNA(例如,基因组DNA);(b)对提取自患者的黑色素瘤样品的核酸(例如,DNA)进行PCR或测序;和(c)测定样品中BRAFV600的表达。在一些实施方式中,所述黑色素瘤样品是福尔马林固定、石蜡包埋的。在另一方面,提供了延长患有不可切除或转移性黑色素瘤(例如,BRAFV600突变阳性的不可切除或转移性黑色素瘤)患者对治疗(例如,治疗性治疗)反应的持续时间的方法,所述方法包括向该患者给药(i)包含化合物II或其药学上可接受的盐的第一组合物,在28天周期的第1至21天以60mg的剂量;和(ii)包含化合物I或其药学上可接受的盐的第二组合物,在28天周期的每天以960mg的剂量,每日两次。在另一方面,提供了延迟或预防患有不可切除或转移性黑色素瘤(例如,BRAFV600突变阳性的不可切除或转移性黑色素瘤)患者对治疗产生抗性(例如,对BRAF抑制剂治疗产生抗性)的方法,所述方法包括向该患者给药(i)化合物II或其药学上可接受的盐,在28天周期的第1至21天以60mg的剂量;和(ii)化合物I或其药学上可接受的盐,在28天周期的每天以960mg的剂量,每日两次。在另一方面,提供了药品,其包含(i)第一组合物,其包含[3,4-二氟-2-[(2-氟-4-碘苯基)氨基]苯基][3-羟基-3-[(2S)-2-哌啶基]-1-氮杂环丁烷基]甲酮(化合物II),或其药学上可接受的盐;和(ii)第二组合物,其包含丙-1-磺酸{3-[5-(4-氯苯基)-1H-吡咯并[2,3-b]吡啶-3-羰基]-2,4-二氟-苯基}-酰胺(化合物I),或其药学上可接受的盐;以组合制剂同时或相继地用于治疗BRAFV600突变阳性的不可切除或转移性黑色素瘤,其中将所述化合物II在28天周期的第1至21天以60mg的剂量给药,且其中将所述化合物I在28天周期的每天以960mg的剂量,每日给药两次。在一些实施方式中,化合物I或其药学上可接受的盐基本上是无定形形式。在一些实施方式中,化合物I或其药学上可接受的盐是无定形形式。在一些实施方式中,化合物I或其药学上可接受的盐包含在用醋酸羟丙基甲基纤维素琥珀酸酯形成的固体分子复合物中,从而使其固定为其无定形形式。在一些实施方式中,在所述复合物中化合物I或其药学上可接受的盐和醋酸羟丙基甲基纤维素琥珀酸酯的各自量的比例为约1:9至约5:5。在一些实施方式中,在所述复合物中化合物I或其药学上可接受的盐和醋酸羟丙基甲基纤维素琥珀酸酯的各自量的比例为约2:8至约4:6。在一些实施方式中,在所述复合物中化合物I或其药学上可接受的盐和醋酸羟丙基甲基纤维素琥珀酸酯的各自量的比例为约3:7。在一些实施方式中,所述第二组合物包括混合物,其中该混合物重量的约97%为上述固体分子复合物,且该混合物重量的约3%为二氧化硅。在一些实施方式中,所述第二组合物包括上述固体分子复合物在药学上可接受的载体中的混悬液。在一些实施方式中,所述第二组合物包括片剂,其包含化合物I或其药学上可接受的盐和HPMC-AS的固体分子复合物。在一些实施方式中,化合物I以片剂提供。在一些实施方式中,化合物I以240mg片剂提供(即,包含240mg化合物I的片剂)。在一些实施方式中,化合物I以市售为的片剂提供。在一些实施方式中,所述第一组合物包含乳糖一水合物、维晶纤维素、交联羧甲基纤维素钠和硬脂酸镁中的一种或多种。在一些实施方式中,化合物II以片剂提供,所述片剂包含乳糖一水合物、维晶纤维素、交联羧甲基纤维素钠和硬脂酸镁。在一些实施方式中,所述片剂包含片剂包衣,该包衣包含部分水解的聚乙烯醇、二氧化钛、聚乙二醇3350和滑石。在一些实施方式中,化合物II以20mg片剂、40mg片剂或60mg片剂提供。在一些实施方式中,化合物II以60mg片剂提供。在一些实施方式中,可同时或相继给药,且可以组合制剂或分开的制剂给药。在一些实施方式中,第一组合物(包含化合物II)与第二组合物(包含化合物I)相继给药(包括但不限于:给药一片或多片包含化合物I的片剂,然后给药一片或多片化合物II的片剂;给药一片或多片化合物I的片剂,然后给药一片或多片化合物II的片剂,然后给药一片或多片化合物I的片剂)。在一些实施方式中,第一组合物在第二组合物之前给药。在一些实施方式中,所述第二组合物在第一组合物之前给药。在一些实施方式中,第一组合物与第二组合物同时给药。在一些实施方式中,第一组合物与第二组合物同时给药,然后给药第一化合物。在一些实施方式中,所述第一和第二组合物以组合制剂提供(在一些实施方式中,作为片剂)。在一些实施方式中,将所述第一和第二组合物共同配制(例如,作为药物制剂)。在一些实施方式中在给药第一个960mg(例如,240mg片剂,四片)剂量的化合物I或其药学上可接受的盐后约12个小时,给药第二个960mg剂量(例如,240mg片剂,四片)的化合物I或其药学上可接受的盐。在一些实施方式中,分别口服给药化合物I或其药学上可接受的盐和化合物II或其药学上可接受的盐,餐前或餐后服用。在一些实施方式中,分别口服给药化合物I或其药学上可接受的盐和化合物II或其药学上可接受的盐,餐后给药。在一些实施方式中,分别口服给药化合物I或其药学上可接受的盐和化合物II或其药学上可接受的盐,餐前给药。在一些实施方式中,所述不可切除或转移性黑色素瘤为BRAFV600E突变阳性的黑色素瘤。在一些实施方式中,所述不可切除或转移性黑色素瘤为转移性黑色素瘤。在一些实施方式中,所述不可切除或转移性黑色素瘤为不可切除的黑色素瘤。在一些实施方式中,该患者的不可切除或转移性黑色素瘤在先前未经治疗(例如,用威罗菲尼或BRAF抑制剂治疗)。在一些实施方式中,该患者的不可切除或转移性黑色素瘤在先前已得到治疗(在一些实施方式中,先前并未用BRAF抑制剂治疗)。在一些实施方式中,BRAFV600突变使用如下方法进行测定,该方法包括:(a)对提取自患者的黑色素瘤样品的核酸(例如,DNA))进行PCR或测序;和(b)测定样品中BRAFV600的表达。在一些实施方式中,所述黑色素瘤样品是福尔马林固定、石蜡包埋的样品。在另一方面,提供了选择用于患有不可切除或转移性黑色素瘤患者的疗法的方法,该方法包括测定在患者的不可切除或转移性黑色素瘤样品中BRAFV600突变的存在并基于BRAFV600突变的存在选择癌症药物。在一些实施方式中,样品显示出表达BRAFV600突变,并选择用包含化合物II的组合物与包含化合物I的组合物进行组合治疗。在一些实施方式中,使用如下方法治疗患者的不可切除或转移性黑色素瘤,所述方法包括向该患者给药(i)包含化合物II或其药学上可接受的盐的第一组合物,在28天周期的第1至21天以60mg的剂量;和(ii)包含化合物I或其药学上可接受的盐的第二组合物,在28天周期的第1至28天以960mg的剂量,每日两次。在另一方面,提供了用于优化治疗效果的方法,所述方法包括测定在患者的不可切除或转移性黑色素瘤样品中BRAFV600突变的存在并基于BRAFV600突变的存在选择癌症药物。在一些实施方式中,所述样品显示出表达BRAFV600突变,并选择用包含化合物II的组合物与包含化合物I的组合物进行组合治疗。在一些实施方式中,使用如下方法治疗患者的不可切除或转移性黑色素瘤,所述方法包括向该患者给药(i)包含化合物II或其药学上可接受的盐的第一组合物,在28天周期的第1至21天以60mg的剂量;和(ii)包含化合物I或其药学上可接受的盐的第二组合物,在28天周期的第1至28天以960mg的剂量,每日两次。在本文所述的任意发明的一些实施方式中,通过评估BRAF核酸确定存在的(在一些实施方式中,存在或不存在)BRAFV600突变。在一些实施方式中,使用如下方法确定BRAFV600突变的存在,所述方法选自:聚合酶链反应(PCR)(包括但不限于定量实时PCR和等位基因特异性PCR)、测序(包括但不限于Sanger测序和/或焦磷酸测序(pyrosequencing))、使用等位基因特异性寡核苷酸的杂交、引物延伸、等位基因特异性连接或电泳分离技术(包括但不限于单链构型多态性分析(SSCP)和异源双链分析)和5’核酸检测。在一些实施方式中,使用PCR或测序确定BRAFV600突变的存在。在一些实施方式中,使用如下方法确定BRAFV600突变的存在,所述方法包括:(a)对提取自患者的黑色素瘤样品的基因组DNA进行PCR;和(b)通过测序PCR递增核酸确定突变体BRAF多核苷酸的表达。在一些实施方式中,使用如下方法确定BRAFV600突变的存在:(a)将第一和第二寡核苷酸杂交至BRAF靶序列的至少一个变体;其中所述第一寡核苷酸是与靶序列的一个或多个变体至少部分互补的,且所述第二寡核苷酸是与靶序列的一个或多个变体至少部分互补的,并且具有仅互补于靶序列的一个变体的至少一个内部选择性核苷酸;(b)用核酸聚合酶递增第二寡核苷酸;其中当所述选择性核苷酸与靶标形成碱基对时,所述聚合酶能够优先递增所述第二寡核苷酸,而当所述选择性核苷酸不与靶标形成碱基对时,所述聚合酶基本上很少递增该第二寡核苷酸;和(c)检测所述寡核苷酸递增产物,其中所述递增标志着靶序列变体的存在,而该寡核苷酸具有与靶序列互补的选择性核苷酸。在一些实施方式中,所述样品(黑色素瘤样品)是福尔马林固定、石蜡包埋的样品。所述样品可在患者接受癌症药物治疗之前获得。所述样品可获自原发性肿瘤或转移性肿瘤。所述样品可当癌症被首次诊断时,和/或例如,在肿瘤已发生转移后获得。在一些实施方式中,所述转移性肿瘤样品为肺、皮肤、淋巴结、骨、肝、结肠、甲状腺和/或卵巢的肿瘤样品。在另一方面,本文所述方法还包括用其它治疗性药物的治疗。在一些实施方式中,所述其它治疗性药物为癌症药物。在另一方面,提供了试剂盒,其包含(i)包含化合物II或其药学上可接受的盐的第一组合物;和(ii)包含化合物I或其药学上可接受的盐的第二组合物。在一些实施方式中,所述试剂盒包含实施本文所述任意方法的说明书。在一些实施方式中,所述说明书介绍的是治疗(例如,治疗性治疗)患BRAFV600突变阳性的不可切除或转移性黑色素瘤患者的方法,所述方法包括向该患者给药(i)包含化合物II或其药学上可接受的盐的第一组合物,在28天周期的第1至21天以60mg的剂量;和(ii)包含化合物I或其药学上可接受的盐的第二组合物,在28天周期的第1至28天以960mg的剂量,每日两次。在一些实施方式中,所述试剂盒用于治疗BRAFV600突变阳性的不可切除或转移性黑色素瘤。在一些实施方式中,所述黑色素瘤为BRAFV600E突变阳性的不可切除或转移性黑色素瘤。在一些实施方式中,所述不可切除或转移性黑色素瘤在先前未经治疗。在一些实施方式中,该患者的不可切除或转移性黑色素瘤在先前已得到治疗(在一些实施方式中,先前并未用BRAF抑制剂治疗)。在一些实施方式中,包含化合物II的第一组合物为片剂。在一些实施方式中,包含化合物I的第二组合物为片剂。在一些实施方式中,包含化合物II的第一组合物和包含化合物I的第一组合物各自以片剂提供。在一些实施方式中,包含化合物I的第一组合物和包含化合物II的第二组合物以单一剂型提供。在一些实施方式中,将包含化合物II的第一组合物和包含化合物I的第二组合物共同配制(例如,作为药物制剂)。在另一方面,提供了用于治疗(例如,治疗性治疗)癌症(例如BRAFV600-阳性的不可切除或转移性黑色素瘤)的制品。所述制品包含容器和该容器上或与该容器有关的标签或药品说明书。合适的容器包括,例如,瓶、小瓶(vials)、注射器、药丸包装、泡罩包装、转盘包装(dialpacks)等。在一些实施方式中,所述制品包含容器和含有60mg化合物II的片剂。在一些实施方式中,所述制品包含容器和含有20mg或40mg化合物II的片剂。在一些实施方式中,所述制品包含容器,该容器含有(a)包含化合物II(例如,60mg的化合物II)的第一组合物,其以片剂提供,和(b)包含化合物I(例如,960mg的化合物I)的第二组合物,其以片剂提供。在一些实施方式中,所述容器为药丸包装或泡罩包装。在一些实施方式中,所述制品(例如,以药丸包装或泡罩包装提供)包含21片包含化合物II(例如,60mg的化合物II)的组合物的片剂;和包含化合物I(例如,960mg的化合物I(例如,240mg片剂,四片))的组合物的片剂。在一些实施方式中,所述标签提供了用于本文所述的任意治疗方法的说明书。在另一方面,提供了用于检测本文所鉴定的任一种或多种生物标记的诊断试剂盒。因此,提供了诊断试剂盒,其包含一个或多个用于确定BRAF表达的试剂,例如在癌症患者的样品中BRAFV600生物标记的表达。任选地,所述试剂盒还包含说明书,该说明书介绍了若患者的不可切除或转移性黑色素瘤表达BRAFV600则使用该试剂盒、选择化合物II与化合物I的组合来治疗(例如,治疗性治疗)所述患者,其中治疗包括给药(i)化合物II或其药学上可接受的盐,在28天周期的第1至21天以60mg的剂量;和(ii)化合物I或其药学上可接受的盐,在28天周期的第1至28天以960mg的剂量,每日两次。在一些实施方式中,所述患者的不可切除或转移性黑色素瘤在先前未经治疗。在一些实施方式中,所述患者的不可切除或转移性黑色素瘤在先前已得到治疗(在一些实施方式中,先前并未用BRAF抑制剂治疗)。在另一方面,本发明提供了推销或宣传癌症药物的方法,包括向目标受众推销化合物II与威罗菲尼组合在治疗(例如,治疗性治疗)患有BRAFV600突变阳性的不可切除或转移性黑色素瘤患者中的用途,其中治疗包括给药(i)化合物II或其药学上可接受的盐,在28天周期的第1至21天以60mg的剂量;和(ii)化合物I或其药学上可接受的盐,在28天周期的第1至28天以960mg的剂量,每日两次。在一些实施方式中,所述患者的不可切除或转移性黑色素瘤在先前未经治疗(例如,用威罗菲尼或BRAF抑制剂治疗)。在一些实施方式中,所述患者的不可切除或转移性黑色素瘤在先前已得到治疗(在一些实施方式中,先前并未用BRAF抑制剂治疗)。在另一方面,提供了一种商业方法,其包括销售化合物II与化合物I组合在治疗(例如,治疗性治疗)患有BRAFV600突变阳性的不可切除或转移性黑色素瘤患者中的用途,其中治疗包括给药(i)化合物II或其药学上可接受的盐,在28天周期的第1至21天以60mg的剂量;和(ii)化合物I或其药学上可接受的盐,在28天周期的第1至28天以960mg的剂量,每日两次。在一些实施方式中,所述患者的不可切除或转移性黑色素瘤在先前未经治疗(例如,用威罗菲尼或BRAF抑制剂治疗)。在一些实施方式中,所述患者的不可切除或转移性黑色素瘤在先前已得到治疗(在一些实施方式中,先前并未用BRAF抑制剂治疗)。本申请涉及下述实施方案。1.药品,其包含(i)第一组合物,其包含[3,4-二氟-2-[(2-氟-4-碘苯基)氨基]苯基][3-羟基-3-[(2S)-2-哌啶基]-1-氮杂环丁烷基]甲酮(化合物II),或其药学上可接受的盐;和(ii)第二组合物,其包含丙-1-磺酸{3-[5-(4-氯苯基)-1H-吡咯并[2,3-b]吡啶-3-羰基]-2,4-二氟-苯基}-酰胺(化合物I),或其药学上可接受的盐;以组合制剂同时或相继地用于治疗BRAFV600突变阳性的不可切除或转移性黑色素瘤,其中将所述化合物II在28天周期的第1至21天以60mg的剂量进行给药,且其中将化合物I在28天周期的每天以960mg的剂量每日给药两次。2.实施方案1的药品,其中将第一组合物与第二组合物相继给药。3.实施方案1的药品,其中将第一组合物与第二组合物同时给药。4.实施方案1的药品,其中将第一和第二组合物共同配制。5.实施方案1-4中任一项的药品,其中化合物I或其药学上可接受的盐基本上是无定形形式。6.实施方案1-4中任一项的药品,其中化合物I或其药学上可接受的盐是无定形形式。7.实施方案1-6中任一项的药品,其中化合物I或其药学上可接受的盐包含在用醋酸羟丙基甲基纤维素琥珀酸酯形成的固体分子复合物中,从而使其固定为其无定形形式。8.实施方案7的药品,其中在所述复合物中化合物I或其药学上可接受的盐和醋酸羟丙基甲基纤维素琥珀酸酯的各自量的比例为约1:9至约5:5。9.实施方案7的药品,其中在所述复合物中化合物I或其药学上可接受的盐和醋酸羟丙基甲基纤维素琥珀酸酯的各自量的比例为约2.8至约4.6。10.实施方案7的药品,其中在所述复合物中化合物I或其药学上可接受的盐和醋酸羟丙基甲基纤维素琥珀酸酯的各自量的比例为约3:7。11.实施方案7的药品,其中在所述复合物中化合物I或其药学上可接受的盐和醋酸羟丙基甲基纤维素琥珀酸酯的各自量的比例为3:7。12.实施方案1-7中任一项的药品,其中所述第二组合物包括混合物,其中该混合物重量的约97%为实施方案7的固体分子复合物且该混合物重量的约3%为二氧化硅。13.实施方案1-7中任一项的药品,其中所述第二组合物包括实施方案7的固体分子复合物在药学上可接受的载体中的混悬液。14.实施方案1-7中任一项的药品,其中所述第二组合物包括片剂,其包含化合物I或其药学上可接受的盐和HPMC-AS的固体分子复合物。15.实施方案1-14中任一项的药品,其中所述第一组合物包含乳糖一水合物、维晶纤维素、交联羧甲基纤维素钠和硬脂酸镁中的一种或多种。16.实施方案1-14中任一项的药品,其中化合物II以片剂提供,所述片剂包含乳糖一水合物、维晶纤维素、交联羧甲基纤维素钠和硬脂酸镁。17.实施方案16的药品,其中所述片剂包含片剂包衣,该包衣包含部分水解的聚乙烯醇、二氧化钛、聚乙二醇3350和滑石。18.实施方案1-17中任一项的药品,其中化合物II以20mg片剂、40mg片剂或60mg片剂提供。19.实施方案1-18中任一项的药品,其中在给药第一个960mg剂量的化合物I或其药学上可接受的盐后约12个小时,给药第二个960mg剂量的化合物I或其药学上可接受的盐。20.实施方案1-19中任一项的药品,其中分别口服给药化合物I或其药学上可接受的盐,和化合物II或其药学上可接受的盐,餐前或餐后服用。21.实施方案1-20中任一项的药品,其中所述不可切除或转移性黑色素瘤为BRAFV600E突变阳性的黑色素瘤。22.实施方案1-21中任一项的药品,其中所述不可切除或转移性黑色素瘤为转移性黑色素瘤。23.实施方案1-22中任一项的药品,其中BRAFV600突变使用如下方法进行测定:包括(a)对提取自患者的黑色素瘤样品的核酸(例如,DNA))进行PCR或测序;和(b)测定样品中BRAFV600的表达。24.实施方案23的药品,其中所述黑色素瘤样品是福尔马林固定、石蜡包埋的样品。25.前述任一项实施方案的药品,其中所述患者的不可切除或转移性黑色素瘤在先前未经治疗。26.前述任一项实施方案的药品,其用于制备治疗BRAFV600突变阳性的不可切除或转移性黑色素瘤的药物。27.实施方案26的药品,其中所述BRAFV600突变阳性的不可切除或转移性黑色素瘤在先前未经治疗。28.试剂盒,其包含(i)包含化合物II或其药学上可接受的盐的第一组合物;和(ii)包含化合物I或其药学上可接受的盐的第二组合物。29.实施方案28的试剂盒,其用于治疗BRAFV600突变阳性的不可切除或转移性黑色素瘤。30.实施方案29的试剂盒,其中所述BRAFV600突变阳性的不可切除或转移性黑色素瘤在先前未经治疗。31.延长患有BRAFV600突变阳性的不可切除或转移性黑色素瘤的患者对治疗的反应期的方法,所述方法包括向该患者给药(i)包含化合物II或其药学上可接受的盐的第一组合物,在28天周期的第1至21天以60mg的剂量;和(ii)包含化合物I或其药学上可接受的盐的第二组合物,在28天周期的每天以960mg的剂量,每日两次。32.延迟或预防患有BRAFV600突变阳性的不可切除或转移性黑色素瘤的患者对治疗产生抗性(例如,对BRAF治疗产生抗性)的方法,所述方法包括向该患者给药(i)包含化合物II或其药学上可接受的盐的第一组合物,在28天周期的第1至21天以60mg的剂量;和(ii)包含化合物I或其药学上可接受的盐的第二组合物,在28天周期的每天以960mg的剂量,每日两次。33.选择用于患有不可切除或转移性黑色素瘤的患者的疗法的方法,所述方法包括在所述患者的不可切除或转移性黑色素瘤样品中确定BRAFV600突变的存在,并基于BRAFV600突变的存在选择癌症药物。34.实施方案33的方法,其中所述样品显示出表达BRAFV600突变,且其中选择化合物II与化合物I的组合治疗。35.实施方案34的方法,其中所述患者使用如下方法治疗BRAFV600突变阳性的不可切除或转移性黑色素瘤,所述方法包括向该患者给药(i)包含化合物II或其药学上可接受的盐的第一组合物,在28天周期的第1至21天以60mg的剂量;和(ii)包含化合物I或其药学上可接受的盐的第二组合物,在28天周期的第1至28天以960mg的剂量,每日两次。36.优化治疗效果的方法,该方法包括测定在患者的不可切除或转移性黑色素瘤样品中BRAFV600突变的存在并基于BRAFV600突变的存在选择癌症药物。37.实施方案36的方法,其中所述样品显示出表达BRAFV600突变,且其中选择化合物II与化合物I的组合治疗。38.实施方案37的方法,其中所述患者使用如下方法治疗BRAFV600突变阳性的不可切除或转移性黑色素瘤,所述方法包括向该患者给药(i)包含化合物II或其药学上可接受的盐的第一组合物,在28天周期的第1至21天以60mg的剂量;和(ii)包含化合物I或其药学上可接受的盐的第二组合物,在28天周期的第1至28天以960mg的剂量,每日两次。39.实施方案33-38中任一项的方法,其中BRAFV600突变的存在是通过评估BRAF核酸来确定的。40.实施方案33-38中任一项的方法,其中使用如下方法确定BRAFV600突变的存在,所述方法选自:聚合酶链反应(PCR)(包括但不限于定量实时PCR和等位基因特异性PCR)、测序(包括但不限于Sanger测序和/或焦磷酸测序)、使用等位基因特异性寡核苷酸的杂交、引物延伸、等位基因特异性连接或电泳分离技术(包括但不限于单链构型多态性分析(SSCP)和异源双链分析)和5’核酸检测。41.实施方案33-38中任一项的方法,其中使用PCR或测序确定BRAFV600突变的存在。42.实施方案33-38中任一项的方法,其中使用如下方法确定BRAFV600突变的存在,所述方法包括:(a)将第一和第二寡核苷酸杂交至BRAF靶序列的至少一个变体;其中所述第一寡核苷酸是与靶序列的一个或多个变体至少部分互补的,且所述第二寡核苷酸是与靶序列的一个或多个变体至少部分互补的,且具有仅互补于靶序列的一个变体的至少一个内部选择性核苷酸;(b)用核酸聚合酶递增第二寡核苷酸;其中当所述选择性核苷酸与靶标形成碱基对时,所述聚合酶能够优先递增所述第二寡核苷酸,而当所述选择性核苷酸不与靶标形成碱基对时,所述聚合酶基本上很少递增该第二寡核苷酸;和(c)检测所述寡核苷酸递增产物,其中所述递增标志着靶序列变体的存在,而该寡核苷酸具有与靶序列互补的选择性核苷酸。43.实施方案42的方法,其中所述样品是福尔马林固定、石蜡包埋的样品。44.实施方案31、32、33或36的方法,其中所述BRAFV600突变阳性的不可切除或转移性黑色素瘤在先前未经治疗。45.前述任一项实施方案的方法,还包括用其它治疗性药物的治疗。本发明这些方面和优点以及其他方面和优点通过接下来的发明详述以及所附权利要求将变得更加清楚。应理解,本文所述的各个实施方式中的一个、一些或全部的特征均可组合以形成本发明的其他实施方式。附图简述图1:显示了用于Ib期临床试验的剂量递增方案,包括用威罗菲尼和GDC-0973的组合治疗,使用如下28天剂量方案中的一种:连续给药所研究药物14天然后停药14天(14/14),连续给药所研究药物21天然后停药7天(21/7),或以连续的每日剂量给药(28/0)。各治疗周期为28天。图2:显示了威罗菲尼和GDC-0973或安慰剂的给药方案。描绘了两个给药周期。图3:显示了患者的特征。图4:显示了在所有患者中,由于威罗菲尼或GDC-0973所致的不良事件。图5:显示了导致给药中断、减少和永久性停药的不良事件。图6:显示了在先前给药威罗菲尼发生疾病进展的患者中肿瘤大小从基线到最适应答的改变。图7:显示了在未接受威罗菲尼治疗的患者中肿瘤大小从基线到最适应答的改变。图8A和8B:图8A.患者中的PET扫描应答,该患者在先前的威罗菲尼治疗中发生疾病进展并接着接受威罗菲尼+GDC-0973的治疗。图8B.患者中的其它PET应答实例,所述患者在先前的威罗菲尼治疗中发生疾病进展,且所述患者接受威罗菲尼+GDC-0973(GDC)的治疗。本发明实施方式详述药品,其包含(i)第一组合物,其包含[3,4-二氟-2-[(2-氟-4-碘苯基)氨基]苯基][3-羟基-3-[(2S)-2-哌啶基]-1-氮杂环丁烷基]甲酮(化合物II),或其药学上可接受的盐;和(ii)第二组合物,其包含丙-1-磺酸{3-[5-(4-氯苯基)-1H-吡咯并[2,3-b]吡啶-3-羰基]-2,4-二氟-苯基}-酰胺(化合物I),或其药学上可接受的盐;以组合制剂同时或相继地用于治疗BRAFV600突变阳性的不可切除或转移性黑色素瘤,其中将所述化合物II在28天周期的第1至21天以60mg的剂量给药,且其中将化合物I在28天周期的每天以960mg的剂量,每日给药两次。在另一实施方式中,提供的是第39段的药品,其中所述第一组合物与第二组合物相继给药。在另一实施方式中,提供的是第39段的药品,其中第一组合物与第二组合物同时给药。在另一实施方式中,提供的是第39段的药品,其中将第一和第二组合物共同配制。在另一实施方式中,提供的是第39段至第42段中任一段所述的药品,其中化合物I或其药学上可接受的盐基本上是无定形形式。在另一实施方式中,提供的是第39段至第42段中任一段所述的药品,其中化合物I或其药学上可接受的盐是无定形形式。在另一实施方式中,提供的是第39段至第44段中任一段所述的药品,其中化合物I或其药学上可接受的盐包含在用醋酸羟丙基甲基纤维素琥珀酸酯形成的固体分子复合物中,从而使其固定为其无定形形式。在另一实施方式中,提供的是第45段的药品,其中在所述复合物中化合物I或其药学上可接受的盐和醋酸羟丙基甲基纤维素琥珀酸酯的各自量的比例为约1:9至约5:5。在另一实施方式中,提供的是第45段的药品,其中在所述复合物中化合物I或其药学上可接受的盐和醋酸羟丙基甲基纤维素琥珀酸酯的各自量的比例为约2.8至约4.6。在另一实施方式中,提供的是第45段的药品,其中在所述复合物中化合物I或其药学上可接受的盐和醋酸羟丙基甲基纤维素琥珀酸酯的各自量的比例为约3:7。在另一实施方式中,提供的是第45段的药品,其中在所述复合物中化合物I或其药学上可接受的盐和醋酸羟丙基甲基纤维素琥珀酸酯的各自量的比例为3:7。在另一实施方式中,提供的是第39段至第49段中任一段所述的药品,其中所述第二组合物包括混合物,其中该混合物重量的约97%为权利要求7所述的固体分子复合物且该混合物重量的约3%为二氧化硅。在另一实施方式中,提供的是第39段至第49段中任一段所述的药品,其中所述第二组合物包括权利要求7的固体分子复合物在药学上可接受的载体中的混悬液。在另一实施方式中,提供的是第39段至第49段中任一段所述的药品,其中所述第二组合物包括片剂,其包含化合物I或其药学上可接受的盐和HPMC-AS的固体分子复合物。在另一实施方式中,提供的是第39段至第52段中任一段所述的药品,其中所述第一组合物包含乳糖一水合物、维晶纤维素、交联羧甲基纤维素钠和硬脂酸镁中的一种或多种。在另一实施方式中,提供的是第39段至第52段中任一段所述的药品,其中化合物II以片剂提供,所述片剂包含乳糖一水合物、维晶纤维素、交联羧甲基纤维素钠和硬脂酸镁。在另一实施方式中,提供的是第54段的药品,其中所述片剂包含片剂包衣,该包衣包含部分水解的聚乙烯醇、二氧化钛、聚乙二醇3350和滑石。在另一实施方式中,提供的是第39段至第55段中任一段所述的药品,其中化合物II以20mg片剂、40mg片剂或60mg片剂提供。在另一实施方式中,提供的是第39段至第56段中任一段所述的药品,其中在给药第一个960mg剂量的化合物I或其药学上可接受的盐后约12个小时,给药第二个960mg剂量的化合物I或其药学上可接受的盐.在另一实施方式中,提供的是第39段至第57段中任一段所述的药品,其中分别口服给药化合物I或其药学上可接受的盐和化合物II或其药学上可接受的盐,餐前或餐后服用。在另一实施方式中,提供的是第39段至第58段中任一段所述的药品,其中所述不可切除或转移性黑色素瘤为BRAFV600E突变阳性的黑色素瘤。在另一实施方式中,提供的是第39段至第59段中任一段所述的药品,其中所述不可切除或转移性黑色素瘤为转移性黑色素瘤。在另一实施方式中,提供的是第39段至第60段中任一段所述的药品,其中BRAFV600突变使用如下方法进行测定,该方法包括:(a)对提取自患者的黑色素瘤样品的核酸(例如,DNA))进行PCR或测序;和(b)测定样品中BRAFV600的表达。在另一实施方式中,提供的是第61段的药品,其中所述黑色素瘤样品是福尔马林固定、石蜡包埋的样品。在另一实施方式中,提供的是第39段至第62段中任一段所述的药品,其中所述患者的不可切除或转移性黑色素瘤在先前未经治疗。在另一实施方式中,提供的是第39段至第63段中任一段所述的药品,其用于制备治疗BRAFV600突变阳性的不可切除或转移性黑色素瘤的药物。在另一实施方式中,提供的是第64段的药品,其中所述BRAFV600突变阳性的不可切除或转移性黑色素瘤在先前未经治疗。在另一实施方式中,提供了试剂盒,其包含(i)包含化合物II或其药学上可接受的盐的第一组合物;和(ii)包含化合物I或其药学上可接受的盐的第二组合物。在另一实施方式中,提供的是第66段的试剂盒,其用于治疗BRAFV600突变阳性的不可切除或转移性黑色素瘤。在另一实施方式中,提供的是第67段的试剂盒,其中所述BRAFV600突变阳性的不可切除或转移性黑色素瘤在先前未经治疗。在一个实施方式中,提供了延长患有BRAFV600突变阳性的不可切除或转移性黑色素瘤患者对治疗反应的持续时间的方法,所述方法包括向该患者给药(i)包含化合物II或其药学上可接受的盐的第一组合物,在28天周期的第1至21天以60mg的剂量;和(ii)包含化合物I或其药学上可接受的盐的第二组合物,在28天周期的每天以960mg的剂量,每日两次。在一个实施方式中,提供了延迟或预防患有BRAFV600突变阳性的不可切除或转移性黑色素瘤患者对治疗产生抗性(例如,对BRAF抑制剂治疗产生抗性)的方法,所述方法包括向该患者给药(i)包含化合物II或其药学上可接受的盐的第一组合物,在28天周期的第1至21天以60mg的剂量;和(ii)包含化合物I或其药学上可接受的盐的第二组合物,在28天周期的每天以960mg的剂量,每日两次。在一个实施方式中,提供了治疗患有BRAFV600突变阳性的不可切除或转移性黑色素瘤的患者的方法,所述方法包括向该患者给药(i)包含化合物II或其药学上可接受的盐的第一组合物,在28天周期的第1至21天以60mg的剂量;和(ii)包含化合物I或其药学上可接受的盐的第二组合物,在28天周期的第1至28天以960mg的剂量,每日两次。在另一实施方式中,提供的是第69段至第71段中任一段所述的方法,其中所述第一组合物与第二组合物相继给药。在另一实施方式中,提供的是第69段至第71段中任一段所述的方法,其中第一组合物与第二组合物同时给药。在另一实施方式中,提供的是第73段的方法,其中将第一和第二组合物共同配制。在另一实施方式中,提供了用于选择针对患有不可切除或转移性黑色素瘤患者的疗法的方法,该方法包括测定在患者的不可切除或转移性黑色素瘤样品中BRAFV600突变的存在并基于BRAFV600突变的存在选择癌症药物。在另一实施方式中,提供的是第75段的方法,其中所述样品显示出表达BRAFV600突变,并选择化合物II与化合物I的组合治疗。在另一实施方式中,提供的是第76段的方法,其中所述患者使用如下方法治疗BRAFV600突变阳性的不可切除或转移性黑色素瘤,所述方法包括向该患者给药(i)包含化合物II或其药学上可接受的盐的第一组合物,在28天周期的第1至21天以60mg的剂量;和(ii)包含化合物I或其药学上可接受的盐的第二组合物,在28天周期的第1至28天以960mg的剂量,每日两次。在另一实施方式中,提供了用于优化治疗效果的方法,所述方法包括测定在患者的不可切除或转移性黑色素瘤样品中BRAFV600突变的存在并基于BRAFV600突变的存在选择癌症药物。在另一实施方式中,提供的是第78段的方法,其中所述样品显示出表达BRAFV600突变,且其中选择化合物II与化合物I的组合治疗。在另一实施方式中,提供的是第79段的方法,其中使用如下方法治疗患者的BRAFV600突变阳性的不可切除或转移性黑色素瘤,所述方法包括向该患者给药(i)包含化合物II或其药学上可接受的盐的第一组合物,在28天周期的第1至21天以60mg的剂量;和(ii)包含化合物I或其药学上可接受的盐的第二组合物,在28天周期的第1至28天以960mg的剂量,每日两次。在另一实施方式中,提供的是第75段至第80段中任一段所述的方法,其中通过评估BRAF核酸确定存在的BRAFV600。在另一实施方式中,提供的是第75段至第81段中任一段所述的方法,其中使用如下方法确定BRAFV600突变的存在,所述方法选自:聚合酶链反应(PCR)(包括但不限于定量实时PCR和等位基因特异性PCR)、测序(包括但不限于Sanger测序和/或焦磷酸测序)、使用等位基因特异性寡核苷酸的杂交、引物延伸、等位基因特异性连接或电泳分离技术(包括但不限于单链构型多态性分析(SSCP)和异源双链分析)和5’核酸检测。在另一实施方式中,提供的是第75段至第81段中任一段所述的方法,其中使用PCR或测序确定BRAFV600突变的存在。在另一实施方式中,提供的是第75段至第81段中任一段所述的方法,其中使用如下方法确定BRAFV600突变的存在,所述方法包括:(a)将第一和第二寡核苷酸杂交至BRAF靶序列的至少一个变体;其中所述第一寡核苷酸是与靶序列的一个或多个变体至少部分互补的,且所述第二寡核苷酸是与靶序列的一个或多个变体至少部分互补的,且具有仅互补于靶序列的一个变体的至少一个内部选择性核苷酸;(b)用核酸聚合酶递增第二寡核苷酸;其中当所述选择性核苷酸与靶标形成碱基对时,所述聚合酶能够优先递增所述第二寡核苷酸,而当所述选择性核苷酸不与靶标形成碱基对时,所述聚合酶基本上很少递增该第二寡核苷酸;和(c)检测所述寡核苷酸递增产物,其中所述递增标志着靶序列变体的存在,而该寡核苷酸具有与靶序列互补的选择性核苷酸。在另一实施方式中,提供的是第84段的方法,其中所述样品是由福尔马林固定、由石蜡包埋的的样品。在另一实施方式中,提供的是第39段至第85段中任一段所述的方法,所述方法还包括用其它治疗性药物的治疗。在另一实施方式中,提供的是第69段至第86段中任一段所述的方法,其中所述BRAFV600突变阳性的不可切除或转移性黑色素瘤在先前未经治疗。在另一实施方式中,提供的是第69段至第87段中任一段所述的方法,其中化合物I或其药学上可接受的盐基本上是无定形形式。在另一实施方式中,提供的是第69段至第87段中任一段所述的方法,其中化合物I或其药学上可接受的盐是无定形形式。在另一实施方式中,提供的是第69段至第89段中任一段所述的方法,其中化合物I或其药学上可接受的盐包含在用醋酸羟丙基甲基纤维素琥珀酸酯形成的固体分子复合物中,从而使其固定为其无定形形式。在另一实施方式中,提供的是第90段的方法,其中在所述复合物中化合物I或其药学上可接受的盐和醋酸羟丙基甲基纤维素琥珀酸酯的各自量的比例为约1:9至约5:5。在另一实施方式中,提供的是第90段的方法,其中在所述复合物中化合物I或其药学上可接受的盐和醋酸羟丙基甲基纤维素琥珀酸酯的各自量的比例为约2:8至约4:6。在另一实施方式中,提供的是第90段的方法,其中在所述复合物中化合物I或其药学上可接受的盐和醋酸羟丙基甲基纤维素琥珀酸酯的各自量的比例为约3:7。在另一实施方式中,提供的是第90段的方法,其中在所述复合物中化合物I或其药学上可接受的盐和醋酸羟丙基甲基纤维素琥珀酸酯的各自量的比例为3:7。在另一实施方式中,提供的是第69段至89段中任一段所述的方法,其中所述第二组合物包括混合物,其中该混合物重量的约97%为权利要求7的固体分子复合物,且该混合物重量的约3%为二氧化硅。在另一实施方式中,提供的是第69段至第89段中任一段所述的方法,其中所述第二组合物包括权利要求7的固体分子复合物在药学上可接受的载体中的混悬液。在另一实施方式中,提供的是第69段至第89段中任一段所述的方法,其中所述第二组合物包括片剂,其包含化合物I或其药学上可接受的盐和HPMC-AS的固体分子复合物。在另一实施方式中,提供的是第69段至第97段中任一段所述的方法,其中所述第一组合物包含乳糖一水合物、维晶纤维素、交联羧甲基纤维素钠和硬脂酸镁中的一种或多种。在另一实施方式中,提供的是第69段至第98段中任一段所述的方法,其中化合物II以片剂提供,所述片剂包含乳糖一水合物、维晶纤维素、交联羧甲基纤维素钠和硬脂酸镁。在另一实施方式中,提供的是第98段的方法,其中所述片剂包含片剂包衣,所述包衣包含部分水解的聚乙烯醇、二氧化钛、聚乙二醇3350和滑石。在另一实施方式中,提供的是第69段至第98段中任一段所述的方法,其中化合物II以20mg片剂、40mg片剂或60mg片剂提供。在另一实施方式中,提供的是第69段至第101段中任一段所述的方法,其中在给药第一个960mg剂量的化合物I或其药学上可接受的盐后约12个小时,给药第二个960mg剂量的化合物I或其药学上可接受的盐。在另一实施方式中,提供的是第69段至第102段中任一段所述的方法,其中分别口服给药化合物I或其药学上可接受的盐和化合物II或其药学上可接受的盐,餐前或餐后服用。在另一实施方式中,提供的是第69段至第103段中任一段所述的方法,其中所述不可切除或转移性黑色素瘤为BRAFV600E突变阳性的黑色素瘤。在另一实施方式中,提供的是第69段至第103段中任一段所述的方法,其中所述不可切除或转移性黑色素瘤为转移性黑色素瘤。在另一实施方式中,提供的是第69段至第105段中任一段所述的方法,其中BRAFV600突变使用如下方法进行测定,该方法包括:(a)对提取自患者的黑色素瘤样品的核酸(例如,DNA))进行PCR或测序;和(b)测定样品中BRAFV600的表达。在另一实施方式中,提供的是第106段的方法,其中所述黑色素瘤样品为福尔马林固定、由石蜡包埋的。在另一实施方式中,提供的是第69段至第108段中任一段所述的方法,其中所述BRAFV600突变阳性的不可切除或转移性黑色素瘤在先前未经治疗。在另一实施方式中,提供的是第39段至第108段中任一段所述的方法,该方法还包括用其它治疗性药物的治疗。定义在本文中,“患者”(可互换地称作“个体”)为人类患者。所述患者可为“癌症患者”,即患有或有患癌症的一种或多种症状的风险的个体。所述患者可为“黑色素瘤患者”,即患有或有患黑色素瘤的一种或多种症状的风险的个体。在一些实施方式中,所述患者可为“不可切除或转移性黑色素瘤患者”,即患有或有患不可切除或转移性黑色素瘤的一种或多种症状的风险的个体。除非另外提及,本文所用术语“BRAF”是指任意天然或变体(天然的或合成的)BRAF多肽。术语“野生型BRAF”通常是指包含天然存在的BRAF蛋白的氨基酸序列的多肽。本文所用术语“BRAF变体”是指BRAF多肽,其在天然BRAF序列中含有一个或多个氨基酸突变。任选地,所述一个或多个氨基酸突变包括氨基酸置换。本文所用的“BRAFV600突变阳性的黑色素瘤”是指已证明表达BRAFV600的患者的黑色素瘤(例如,不可切除或转移性黑色素瘤)。本文所用的“BRAFV600E突变阳性的黑色素瘤”是指已证明表达BRAFV600E的患者的黑色素瘤(例如,不可切除或转移性黑色素瘤)。本文所用的BRAF的“V600”突变(可互换地称为“BRAFV600”)是指BRAF蛋白上的突变,其中所述BRAF的600位残基上的缬氨酸氨基酸残基被另一氨基酸残基取代。在以前的编号系统中,“V600”也被称为“V599”(Kumar等人,Clin.CancerRes.9:3362-3368,2003)。本文所用的BRAF的“V600E”突变是指BRAF蛋白的突变,其中BRAF的600位残基上的缬氨酸残基被谷氨酸取代。在以前的编号系统中,“V600E”也被称为“V599E”(Kumar等人,Clin.CancerRes.9:3362-3368,2003)。本文所用的术语“突变”指的是具体的蛋白或核酸(基因,RNA)分别相对于野生型蛋白或核酸在氨基酸或核酸序列上的改变。突变蛋白或核酸可表达于或见于基因的一个等位基团(杂合的)或两个等位基因(纯合的),并且该突变可是体细胞的或生殖细胞的。在本发明中,突变通常为体细胞突变。突变包括序列重排,例如插入、缺失和点突变(包括单核苷酸/氨基酸多态性)。“抑制”是指与参照相比,降低或减小活性、功能和/或量。蛋白的“表达”是指将编码在基因上的信息转录到信使RNA(mRNA)上,然后再翻译为该蛋白。在本文中,“表达”感兴趣的蛋白(例如BRAFV600,例如BRAFV600E)的样品或细胞是指其中的核酸(例如,DNA或mRNA)编码所述蛋白的样品或细胞,或者所述蛋白(包括其片段)被证实存在于该样品或细胞中。“表达”感兴趣的蛋白(例如BRAFV600,例如BRAFV600E)的癌症(例如,不可切除或转移性黑色素瘤)是指其中的核酸(例如,DNA或mRNA)编码所述蛋白的癌症,或者所述蛋白(包括其片段)被证实存在于该癌症(例如,不可切除或转移性黑色素瘤)样品中。患者“群体”是指患有癌症的患者群,例如在临床试验中,或者是指肿瘤科医生依据FDA批准的针对具体适应症(例如不可切除或转移性黑色素瘤)的癌症治疗所诊治的人群。在一些实施方式中,所述适应症为BRAFV600突变阳性的不可切除或转移性黑色素瘤。对于本发明的方法,术语“指导”患者是指通过任意方式,但优选通过文字形式,例如药品说明书或其它书面宣传材料的形式,提供适用疗法、药物治疗、治疗、治疗方案等的指导。对于本发明的方法,术语“推销”是指通过任意方式,包括文字形式,例如药品说明书的形式提供、宣传、出售或开处方具体药物、药物组合物或疗法。本文中推销是指推销治疗性药物,例如MEK抑制剂和/或BRAF抑制剂,用于适应症,例如治疗BRAFV600突变阳性的不可切除或转移性黑色素瘤,其中由于已证明推销与受试者群体中统计学显著性疗效和可接受的安全性有关,因而该推销经食品和药品管理局(FDA)所授权。本文所用术语“销售”描述的是推销、销售或分销产品(例如,药物)。销售具体包括包装、宣传和具有使产品商品化目的的任意商业活动。出于本文的目的,“先前接受治疗”的癌症患者在之前已接受癌症治疗。“先前接受治疗”的不可切除或转移性黑色素瘤患者在之前已接受针对不可切除或转移性黑色素瘤的治疗。“癌症药物”是有效治疗癌症的药物。本文所用术语“生物标记”或“标记”通常是指分子,包括基因、mRNA、蛋白、碳水化合物结构或糖脂,其在组织或细胞中或在组织或细胞上的表达或分泌可通过已知方法(或本文所公开的方法)进行检测,并且其是可预测的或可用于预测(或辅助预测)细胞、组织或患者对于治疗方案的应答。“患者样品”是指获自癌症患者类似细胞的标本。该组织或细胞样品的来源可为获自新鲜、冷冻和/或保存的器官或组织样品的实体组织或活检或抽取物;血液或任意血液成分;体液,例如脑脊液、羊水、腹膜液或间隙液;在受试者妊娠或发育的任意时期获得细胞。组织样品可含有不是在自然界中天然地与该组织混合的化合物,例如防腐剂、抗凝剂、缓冲剂、固定剂、营养素、抗生素等。本文的肿瘤样品实例包括,但不限于肿瘤活检、循环肿瘤细胞、血清或血浆、循环血浆蛋白、腹水、原代细胞培养物或衍生自肿瘤或表现出肿瘤样特性的细胞系,以及保存的肿瘤样品,例如福尔马林固定、石蜡包埋的肿瘤样品或冷冻的肿瘤样品。在一个实施方式中,所述样品为不可切除或转移性黑色素瘤。患者的“有效应答”或患者对于药物治疗的“应答”及类似表述是指一经给药该癌症药物,处于癌症(例如,BRAFV600突变阳性的不可切除或转移性黑色素瘤)风险或患有该癌症的患者被赋予的临床或治疗益处。该益处包括以下的任一种或多种:延长生存(包括总生存和无进展生存);导致客观应答(包括完全应答或部分应答);或改善癌症的迹象或症状等。“生存”是指患者保持活着并包括总生存和无进展生存。“总生存”是指患者从确诊或治疗开始保持活着的确定的时间段。“无进展生存”是指所述患者保持活着,无癌症进展或恶化。“延长生存”意思是相对于未治疗患者(即相对于未接受药物治疗的患者),或相对于在指定水平不表达生物标记的患者,和/或相对于使用经批准的癌症药物,例如威罗菲尼进行治疗的患者,在经治疗的患者中提高了总的或无进展生存。“客观应答”是指可测量的应答,包括完全应答(CR)或部分应答(PR)。“完全应答”或“CR”是指应答于治疗,癌症的全部迹象均消失。其并非总是表示癌症已经被治愈。“部分应答”或“PR”是指应答于治疗,一个或多个肿瘤或病灶的尺寸减小,或癌症在机体的范围缩小。“治疗”是指治疗性治疗和预防性(prophylactic或preventative)治疗。术语“治疗有效量”是指治疗或预防哺乳动物中的疾病或障碍的治疗性药物的量。就癌症而言,治疗有效量的治疗性药物可降低癌细胞数量;减小原发性肿瘤大小;抑制(即,减慢到一定程度,以及优选停止)癌细胞渗入到周围器官;抑制(即,减慢到一定程度,以及优选停止)肿瘤转移;在一定程度上抑制肿瘤生长;和/或在一定程度上缓解一种或多种与该障碍相关的症状。到了药物可预防生长和/或杀死现有的癌细胞的程度,则该药物可为细胞生长抑制的和/或细胞毒性的。对于癌症疗法,其在体内的疗效可例如通过评估生存期、疾病进展时间(TTP)、应答率(RR)、反应期,和/或生活质量进行测量。术语“癌症”和“癌的”是指或描述了哺乳动物中通常以不受调控的细胞生长为特征的生理病症。这个定义中包括的是良性和恶性肿瘤。在一些实施方式中,所述癌症为不可切除或转移性黑色素瘤,其表达或已显示出表达了BRAFV600。术语“多核苷酸”,无论是单数还是复数形式,通常指的是任意多核糖核苷酸或多脱氧核糖核苷酸,其可为未修饰的RNA或DNA,或修饰的RNA或DNA。因此,例如,本文所定义的多核苷酸包括,但不限于,单链和双链DNA、包含单链和双链区域的DNA、单链和双链RNA和包含单链和双链区域的RNA、包含DNA和RNA的杂交分子,其可为单链的或,更通常地,为双链的,或包含单链和双链区域。此外,本文所用术语“多核苷酸”是指包含RNA或DNA或RNA和DNA二者的三链区域。在该区域中的链可以来自相同或不同分子。该区域可包括所有的一个或多个所述分子,但更通常地涉及一些分子的仅一个区域。三股螺旋区域分子中的一个通常为寡核苷酸。术语“多核苷酸”尤其包括cDNA。该术语包括DNA(包括cDNA)和RNA,其含有一个或多个修饰了的碱基。因此,出于稳定性或其它原因进行骨架修饰的DNA或RNA为“多核苷酸”,该术语如本文所预期的。此外,包含稀有碱基(unusualbases)(例如肌苷)或修饰碱基(例如氚标记的碱基)的DNA或RNA包括在本文所定义的术语“多核苷酸”中。通常,术语“多核苷酸”涵盖了未修饰的多核苷酸的全部化学、酶和/或代谢修饰形式,以及病毒和细胞(包括单细胞和复杂细胞)典型的DNA和RNA的化学形式。“目标受众”是指通过销售或宣传,推销或旨在推销具体药物,尤其是将具体用途、治疗或适应症的人群或机构,所述人群或机构例如患者;患者群体;报纸、医学文献和杂志的读者;电视或互联网观众;广播或网络听众;医生;制药公司等。“药品说明书”用于表示通常包括在治疗产品的商品包装内的说明,其含有关于适应症、用法、剂量、给药、禁忌症、与该包装产品组合的其它治疗产品,和/或有关使用该治疗产品的警告等信息。术语“药物制剂”是指一种无菌制剂,该制剂以这样的形式使得药物的生物活性有效,并且该制剂不含任何其它的对受试者而言是不可接受毒性的成分,其中,将该制剂给药至所述受试者。“无菌”制剂是无菌的或不含任何活的微生物及其孢子。“试剂盒”是包含至少一种试剂的任何制品(例如包装或容器),例如,治疗癌症(例如,不可切除或转移性黑色素瘤)的药物,或具体检测生物标记基因或蛋白的试剂(例如,引物)。所述制品优选作为实现本发明方法的单元进行推销、分销或销售。“药学上可接受的载体”是指药物制剂中除了活性成分之外的组分,其对受试者是无毒的。示例性的药学上可接受载体的非限制性列表为缓冲剂、赋形剂、稳定剂或防腐剂。本文所用词组“药学上可接受的盐”是指化合物药学上可接受的有机或无机盐。本文所用术语“基本上无定形的”物质意思是该物质具有不超过约10%的结晶度;且“无定形的”物质意思是该物质具有不超过约2%的结晶度。本文所用术语“成分子状分布”是指化合物(例如,化合物I)与聚合物的随机分布。在具体实施方式中,所述化合物在最终的细分阶段存在于聚合物中。参见,例如,MG,Vachon等人,JMicroencapsulation,14281-301(1997)和Vandelli等人,JMicroencapsulation,10-55-65(1993)。在一些实施方式中,化合物(例如化合物I)可分布于基质内从而将所述化合物固定为其无定形形式,所述基质是聚合物在其固体状态下所形成的。化合物以成分子状分布于聚合物中可通过各种方式(例如,通过所得固体分子复合物具有单一玻璃转化温度(glasstransitiontemperature))进行证明。本文所用术语“固体分子复合物”意思是固体分布,其包括成分子状分布于聚合物基质内的化合物I。本文所用术语“固定于”,参照活性化合物在聚合物基质中的固定,意思是化合物分子与聚合物分子以这样的方式相互作用,该方式使得将所述化合物分子保持在上述基质中,并阻止因缺乏流动性造成的晶体成核。在一些实施方式中,所述聚合物可阻止化合物I的两个或多个药物分子间的分子间氢键或弱色散力。参见,例如,Matsumoro和Zografi,PharmaceuticalResearch,第16卷,No.11,第1722-1728页,1999。癌症药物在一个方面,本发明的特征在于MEK抑制剂和BRAF抑制剂的组合疗法在治疗患者病理学病症(例如癌症)中的用途。在另一方面,本发明涉及基于本文所公开的一种或多种生物标记的表达,选择可用MEK抑制剂和BRAF抑制剂进行治疗的患者。威罗菲尼威罗菲尼是BRAF丝氨酸/苏氨酸激酶的一些突变型(包括BRAFV600E)的口服有效的抑制剂。威罗菲尼可以240mg片剂口服使用。威罗菲尼,本文也称作“化合物I”,具有化学名丙-1-磺酸{3-[5-(4-氯苯基)-1H-吡咯并[2,3-b]吡啶-3-羰基]-2,4-二氟-苯基}-酰胺。这个化合物公开于WO2007/002325(参见例如,第80页和第82页相应的化学式中)。化合物I具有以下化学结构:化合物I存在于其天然(即热力学稳定)状态的结晶形式中。但是,相较于所述结晶形式,该化合物的无定形形式在水中具有更好的溶解性,并因此具有更好的溶解速率,并因此相较于所述结晶形式,具有更好的生物利用度。因此,在本发明的一些实施方式中,化合物I是基本上无定形的形式且,在一些实施方式中,是无定形形式。GDC-0973GDC-0973(本文也称为“cobimetinib”或“化合物II”)是口服有效、强效和MEK1和MEK2的高选择性抑制剂,是RAS/RAF通路的核心成分。GDC-0973具有化学名[3,4-二氟-2-[(2-氟-4-碘苯基)氨基]苯基][3-羟基-3-[(2S)-2-哌啶基]-1-氮杂环丁烷基]甲酮。GDC-0973具有化学结构:化合物II可通过描述于US2009/0156576中的下述方法制备(其内容并入本文作为参考)。化合物II具有以下CAS登记号:934660-93-2。其它治疗性药物本发明的组合疗法可进一步包括使用一种或多种治疗性药物的治疗。在一些实施方式中,所述一种或多种治疗性药物为一种或多种癌症药物。所述组合给药包括同时给药,其使用分开的制剂或单一药物制剂,和以任一顺序相继给药,其中优选存在一段时间两种(或全部)活性试剂同时发挥它们的生物活性。如果将所述治疗性药物给药,该药物通常以已知剂量给药,或者由于该药物的组合作用任选地降低剂量。该治疗性药物的制备和给药方案可根据制造商的说明书或由专业技术人员凭经验所确定的来使用。在一些实施方式中,所述其它治疗性药物为化疗剂。组合疗法在一个方面,提供了治疗癌症患者的方法,其包括给药有效(例如,治疗有效)量的BRAF抑制剂(例如,威罗菲尼)和MEK抑制剂(例如,GDC-0973)。方法包括本文中的任意治疗方法。在一个方面,提供了治疗(例如,治疗性治疗)患有BRAFV600突变阳性的癌症患者的方法,所述方法包括向该患者给药(i)第一组合物,其包含[3,4-二氟-2-[(2-氟-4-碘苯基)氨基]苯基][3-羟基-3-[(2S)-2-哌啶基]-1-氮杂环丁烷基]甲酮(化合物II),或其药学上可接受的盐;和(ii)第二组合物,其包含丙-1-磺酸{3-[5-(4-氯苯基)-1H-吡咯并[2,3-b]吡啶-3-羰基]-2,4-二氟-苯基}-酰胺(化合物I),或其药学上可接受的盐,在28天周期的第1至28天以960mg的剂量(例如,240mg片剂,四片),每日两次。在一个方面,提供了治疗(例如,治疗性治疗)患有BRAFV600突变阳性的不可切除或转移性黑色素瘤患者的方法,所述方法包括向该患者给药(i)包含化合物II或其药学上可接受的盐的第一组合物,在28天周期的第1至21天以60mg的剂量;和(ii)包含化合物I或其药学上可接受的盐的第二组合物,在28天周期的第1至28天以960mg的剂量,每日两次。在一个方面,提供了延长患有不可切除或转移性黑色素瘤患者对治疗的反应期的方法,所述方法包括向该患者给药(i)包含化合物II或其药学上可接受的盐的第一组合物,在28天周期的第1至21天以60mg的剂量;和(ii)包含化合物I或其药学上可接受的盐的第二组合物,在28天周期的每天以960mg的剂量,每日两次。在一些实施方式中,相比于对化合物I治疗(例如化合物I的单一疗法治疗)的反应期,对组合治疗的反应期有所延长。在一个方面,提供了延迟或预防患有不可切除或转移性黑色素瘤患者对治疗产生抗性(例如,对BRAF抑制剂治疗产生抗性)的方法,所述方法包括向该患者给药(i)包含化合物II或其药学上可接受的盐的第一组合物,在28天周期的第1至21天以60mg的剂量;和(ii)包含化合物I或其药学上可接受的盐的第二组合物,在28天周期的每天以960mg的剂量,每日两次。在一些实施方式中,相比于对化合物I治疗(例如,化合物I单一疗法治疗)产生抗性,对组合治疗产生抗性被延迟。在另一方面,提供了用于治疗(例如,治疗性治疗)患有不可切除或转移性黑色素瘤患者的组合物,所述组合物包含包含化合物II或其药学上可接受的盐的第一组合物,其中所述用途包括同时或相继给药包含化合物I的第二组合物;其中将包含化合物II的第一组合物,在28天周期的第1至21天以60mg的剂量给药,且其中将包含化合物I的第二组合物,在28天周期的每天以960mg的剂量,每天给药两次。在本文任意治疗方法的一些实施方式中,所述患者的不可切除或转移性黑色素瘤先前未经治疗。在一些实施方式中,所述患者的不可切除或转移性黑色素瘤在先前已得到治疗(在一些实施方式中,先前并未用BRAF抑制剂治疗)。在一些实施方式中,所述患者先前并未接受Raf通路抑制剂的治疗。在一些实施方式中,所述患者先前并未接受MEK通路抑制剂的治疗。在一些实施方式中,所述患者先前并未接受Raf通路抑制剂或MEK通路抑制剂的治疗。在一些实施方式中,所述患者先前已接受辅助性治疗。在一些实施方式中,所述患者先前并未接受Raf通路抑制剂的治疗,但先前已接受辅助性治疗。在一些实施方式中,所述患者先前并未接受MEK通路抑制剂的治疗,但先前已接受辅助性治疗。在一些实施方式中,所述患者先前并未接受Raf通路抑制剂或MEK通路抑制剂的治疗,但先前已接受辅助性治疗。癌症分期体系描述的是癌症在解剖学上已扩散了多远,以及试图将具有类似预后和治疗的患者归为相同分期组。可进行多个测试以帮助癌症分期,包括活检和一些影像检查,例如胸部x射线、乳房X光检查、骨扫描、CT扫描和MRI扫描。血液检查和临床评估也可用于评价患者的整体健康并检测所述癌症是否已经扩散到一些器官。为了将癌症分期,美国癌症联合委员会(AmericanJointCommitteeonCancer)使用TNM分期体系,首次将癌症,尤其是实体瘤,确定为字母分类。癌症被指定为字母T(肿瘤大小)、N(可触摸的淋巴结(palpablenodes)),和/或M(转移)。T1、T2、T3和T4描述的是增长的原发病灶大小;N0、N1、N2、N3表示逐步递增的淋巴结累及;以及M0和M1反映了是否存在远端转移。在第二个分期方法中,也称作整体分期群组(OverallStageGrouping)或罗马数字分期(RomanNumeralStaging),合并原发病灶大小以及淋巴结分布及远端转移的存在,将癌症分为0至IV期。在这个体系中,将病例划分为4个期,以罗马数字I-IV表示,或者被归类为“复发型”。对于一些癌症,0期指的是“原位”或“原位癌(Tis)”,例如乳腺癌中的原位导管癌或原位小叶癌。也可将高级别腺瘤归类为0期。通常,I期癌症是通常可治愈的小的局部癌症,而IV期通常代表无法手术治疗的或转移性癌症。II期和III期癌症通常为局部晚期的和/或表现为局部淋巴结累及。通常,更高的期数意味着范围更广的疾病,包括更大的肿瘤大小和/或癌症向周围淋巴结和/或与原发性肿瘤相邻器官的扩散更广。这些分期被明确限定,但是该限定随各个癌症类型的不同有所区别,且对本领域技术人员而言是已知的。许多癌症登记处,例如NIC监测流行病学和最终结果项目(NCI’sSurveillance,EpidemiologyandEndResultsProgram(SEER)),使用的是简易分期。这个体系用于所有类型的癌症。它将癌症病例划分为5个主要类型:原位癌是指早期癌症,其仅存在于癌症开始的细胞层中。局部癌是指局限于癌症开始的器官中的癌症,没有迹象显示发生扩散。区域癌是指癌症已经超出原始(最初)部位扩散到附近的淋巴结或器官和组织中。远端癌是指癌症已由最初部位扩散到远端器官或远端淋巴结。未知癌用于描述没有足够的信息来确定何种阶段的病例。美国癌症联合委员会(AJCC)针对黑色素瘤的TNM分期是用于分期黑色素瘤的体系。在一些实施方式中,所述黑色素瘤为不可切除的IIIC期癌症。在一些实施方式中,所述黑色素瘤处于M1a期。在一些实施方式中,所述黑色素瘤处于M1b期。在一些实施方式中,所述黑色素瘤处于M1c期。此外,对于癌症常见的是在已将原发性肿瘤去除后的数月或数年复发。在所有可见肿瘤已被根除后复发的癌症称为复发性疾病。在原发性肿瘤区域复发的疾病为局部复发,而复发发生转移的疾病称为远端复发。在一个方面,将所述癌症患者用其他癌症药物进行治疗(例如,治疗性治疗)。在一些实施方式中,所述其他癌症药物为化疗剂。将本发明所用的治疗性药物以与适当的医学实践相一致的方式进行配制、设定剂量和给药。上下文中所考虑的因素包括所治疗的具体疾病、接受治疗的具体患者、该患者的临床病症、该障碍的病因、药品的递送部位、给药方法、给药方案、组合药品中药物与药物之间的相互作用和医生们已知的其他因素。治疗制剂可使用本领域已知的标准方法,通过将具有所需纯度的活性成分与任选的生理学上可接受的载体、赋形剂或稳定剂混合进行制备(Remington’sPharmaceuticalSciences(第20版),编辑,A.Gennaro,2000,Lippincott,Williams&Wilkins,Philadelphia,PA)。合适的载体、稀释剂和赋形剂是本领域技术人员熟知的且包括以下物质,例如碳水化合物、蜡类、水溶性的和/或可膨胀的聚合物、亲水性或疏水性物质、明胶、油类、溶剂、水等。所使用的具体载体、稀释剂或赋形剂将取决于给药本发明化合物的方式和目的。通常选择的溶剂是基于本领域技术人员公认可安全地给予哺乳动物的溶剂。通常,安全的溶剂是无毒的含水溶剂,例如水和其他可溶的或易溶于水的无毒溶剂。合适的含水溶剂包括水、乙醇、丙二醇、聚乙二醇(例如,PEG400、PEG300)等,及其混合物。所述组合物还可包括一种或多种缓冲剂、稳定剂、表面活性剂、湿润剂、润滑剂、乳化剂、悬浮剂、防腐剂、抗氧化剂、遮光剂、助流剂、加工助剂、着色剂、甜味剂、芳香剂、调味剂和其他已知的添加剂,使得更好的呈现该药物(即,化合物或其药物组合物)或帮助制造该药品(即,药物)。在一些实施方式中,所述化合物与药学上可接受的载体或赋形剂一同配制。例如,通过凝聚技术或通过界面聚合法,也可将活性成分包封在制备的微胶囊中(例如,分别在羟甲基纤维素或明胶-微胶囊和聚(甲基丙烯酸甲酯)微胶囊中)、包封在胶体给药系统中(例如,脂质体、白蛋白微球、微乳剂、纳米颗粒和纳米胶囊)或包封在粗乳状液中。该技术公开于Remington’sPharmaceuticalSciences中,同上。药学上可接受的盐在本文中进行描述且是本领域已知的。示例性的盐包括,但不限于,硫酸盐、柠檬酸盐、乙酸盐、草酸盐、氯化物、溴化物、碘化物、硝酸盐、硫酸氢盐、磷酸盐、酸式磷酸盐、异烟酸盐、乳酸盐、水杨酸盐、酸式柠檬酸盐、酒石酸盐、油酸盐、鞣酸盐、泛酸盐、酒石酸氢盐、抗坏血酸盐、琥珀酸盐、马来酸盐、龙胆酸盐、富马酸盐、葡糖酸盐、葡糖醛酸盐、糖二酸盐、甲酸盐、苯甲酸盐、谷氨酸盐、甲磺酸盐(methanesulfonate或mesylate)、乙磺酸盐、苯磺酸盐、对甲苯磺酸盐及双羟萘酸盐(即1,1'-亚甲基-双-(2-羟基-3-萘甲酸盐))。药学上可接受的盐可涉及包含另一分子,例如乙酸根离子、琥珀酸根离子或其它抗衡离子。所述抗衡离子可以是稳定母体化合物电荷的任何有机或无机基团。此外,药学上可接受的盐在其结构上可具有多于一个带电原子。在部分所述药学上可接受的盐具有多个带电原子部分的实例中,其可具有多个抗衡离子。因此,药学上可接受的盐可具有一个或多个带电原子和/或一个或多个抗衡离子。如果所述化合物为碱,则所需药学上可接受的盐可通过本领域可用的任何合适的方法进行制备,所述方法例如,将游离碱用无机酸处理,如盐酸、氢溴酸、硫酸、硝酸、甲磺酸、磷酸等,或用有机酸处理,如乙酸、马来酸、琥珀酸、扁桃酸、富马酸、丙二酸、丙酮酸、草酸、乙醇酸、水杨酸、吡喃糖基酸(pyranosidylacid)(如葡糖醛酸或半乳糖醛酸)、α-羟基酸(如柠檬酸或酒石酸)、氨基酸(如天冬氨酸或谷氨酸)、芳香酸(如苯甲酸或肉桂酸)、磺酸(如对甲苯磺酸或乙磺酸)等。通常认为适用于由碱性药物化合物形成药学上可用的或可接受的盐的酸在,例如,P.Stahl等人,CamilleG.(编辑)HandbookofPharmaceuticalSalts.Properties,SelectionandUse.(2002)Zurich:Wiley-VCH;S.Berge等人,JournalofPharmaceuticalSciences(1977)66(1)119;P.Gould,InternationalJ.ofPharmaceutics(1986)33201217;Anderson等人,ThePracticeofMedicinalChemistry(1996),AcademicPress,NewYork;Remington'sPharmaceuticalSciences,第18版,(1995)MackPublishingCo.,EastonPa.;和TheOrangeBook(Food&DrugAdministration,Washington,D.C.的网站)中进行讨论。如果所述化合物为酸,则所需药学上可接受的盐可通过任何合适的方法进行制备,例如将游离酸用无机碱或有机碱处理,如胺(伯胺、仲胺或叔胺)、碱金属氢氧化物或碱土金属氢氧化物等。合适的盐的说明性实例包括,但不限于衍生自氨基酸(例如甘氨酸和精氨酸)、胺类(伯胺、仲胺和叔胺),和环胺类(如哌啶、吗啉和哌嗪)的有机盐,以及衍生自钠、钙、钾、镁、锰、铁、铜、锌、铝和锂的无机盐。药学上可接受的盐、水合物和其它固体形式,例如威罗菲尼的多晶型公开于国际专利申请No.PCT/US2012/025965中。在一些实施方式中,化合物II以20mg片剂、40mg片剂,和/或60mg片剂提供。在一些实施方式中,化合物II以60mg片剂提供。在一些实施方式中,化合物II以在片剂核心中包含乳糖一水合物、维晶纤维素、交联羧甲基纤维素钠和硬脂酸镁中的一种或多种的片剂提供。在一些实施方式中,所述片剂包衣包含部分水解的聚乙烯醇、二氧化钛、聚乙二醇3350和滑石中的一种或多种。在一些实施方式中,化合物II以如下片剂提供:片剂核心中包含乳糖一水合物、维晶纤维素、交联羧甲基纤维素钠和硬脂酸镁且片剂包衣包含部分水解的聚乙烯醇、二氧化钛、聚乙二醇3350和滑石。在一些实施方式中,化合物II以如下片剂提供:所述片剂包含(a)60mg的化合物II(活性成分);和(b)所述片剂核心为乳糖一水合物、维晶纤维素、交联羧甲基纤维素钠和硬脂酸镁且片剂包衣包含部分水解的聚乙烯醇、二氧化钛、聚乙二醇3350和滑石。在本发明的实施方式中,化合物I包含在由醋酸羟丙基甲基纤维素琥珀酸酯(HPMC-AS)形成的固体分子复合物中。在具体实施方式中,化合物I在最终的细分阶段存在于该聚合物中。在一些实施方式中,化合物I以成分子状分布于HPMC-AS基质内从而将所述化合物固定为其无定形形式。在一些实施方式中,所述聚合物可阻止化合物I的两个或多个药物分子的分子内氢键或弱色散力。在一些实施方式中,化合物I在所述固体分子复合物中的重量与HPMC-AS在其中的重量的比值为约1:9至约5:5。在一个实施方式中,所述比值为约2:8至约4:6。在另一实施方式中,所述比值为约3:7。在一些实施方式中,化合物I提供于与胶体二氧化硅掺合的化合物I和HPMC-AS的上述固体分子复合物中。在一些实施方式中,该混合物具有至少0.5重量%的二氧化硅。在本发明的一个实施方式中,该混合物为约97%的复合物和约3%的二氧化硅。在其他实施方式中,化合物I作为组合物提供,所述组合物包含上述固体分子复合物,掺合或不掺合上述二氧化硅,和药学上可接受的载体。在一些实施方式中,将包含相同成分的上述复合物或混合物混悬于载体中。载体的一个实例为羟丙基纤维素(HPC)。在一个实施方式中,所述载剂含有约2重量%的HPC。所述组合物还可含有其他试剂,例如防腐剂、增溶剂、稳定剂,湿润剂、乳化剂、甜味剂、着色剂、调味剂、改变渗透压的盐、缓冲剂、包衣剂和抗氧化剂。在一些实施方式中,化合物I作为组合物提供,所述组合物包含化合物I和HPMC-AS的固体分子复合物,其掺合有胶体二氧化硅、羟丙基纤维素、交聚维酮(崩解剂)、硬脂酸镁(可用于片剂和胶囊化操作的润滑剂),和/或交联羧甲基纤维素钠(崩解剂)。在一个实施方式中,化合物I以硬明胶胶囊提供,其包含化合物I和HPMC-AS的固体分子复合物,其掺合有胶体二氧化硅、羟丙基纤维素、硬脂酸镁和交联羧甲基纤维素钠。在一个实施方式中,化合物I以片剂提供,其包含化合物I或其药学上可接受的盐。在一个实施方式中,所述片剂包含化合物I或其药学上可接受的盐和HPMC-AS的固体分子复合物。所述复合物可,例如,与胶体二氧化硅、羟丙基纤维素、硬脂酸镁和交联羧甲基纤维素钠掺合。所述片剂可,例如,用薄膜包衣涂布。所述薄膜包衣可,例如,包括聚乙烯醇、二氧化钛、聚乙二醇3350、滑石和氧化铁红。在一些实施方式中,化合物I以240mg片剂提供。包含化合物I的组合物以及制备该组合物的方法描述于WO2010/114928中(其全部引入本文作为参考)。在一些实施方式中,化合物I或其药学上可接受的盐,基本上是无定形形式。在一些实施方式中,化合物I或其药学上可接受的盐是无定形形式。在一些实施方式中,化合物I或其药学上可接受的盐包含在用醋酸羟丙基甲基纤维素琥珀酸酯形成的固体分子复合物中,从而使其固定为其无定形形式。在一些实施方式中,在所述复合物中化合物I或其药学上可接受的盐和醋酸羟丙基甲基纤维素琥珀酸酯的比例为约1:9至约5:5。在一些实施方式中,在所述复合物中化合物I或其药学上可接受的盐和醋酸羟丙基甲基纤维素琥珀酸酯的比例为约3:7。在一些实施方式中,化合物I包含在混合物中,其中该混合物重量的约97%为固体分子复合物且该混合物重量的约3%为二氧化硅。在一些实施方式中,化合物I包含在所述固体分子复合物在药学上可接受的载体中的混悬液中,其中所述固体分子复合物在药学上可接受的载体中。在一些实施方式中,第一组分包含片剂,该片剂包含化合物I或其药学上可接受的盐和HPMC-AS的固体分子复合物。在一些实施方式中,化合物I以片剂提供。在一些实施方式中,化合物I以240mg片剂提供(即,包含240mg化合物I的片剂)。治疗性药物的组合给药通常在确定的时间段进行(通常为数分钟、数小时、数天或数周,其取决于所选择的组合)。组合治疗旨在涵盖以相继方式给药这些治疗性药物(即,其中将各治疗性药物在不同时间(以任意顺序)给药),以及以同时(共同)方式给药所述治疗性药物。同时给药可以分开的药物制剂或单一药物剂型(例如,以单一药物制剂)。在一些实施方式中,化合物II每天给药一次,例如,在早晨或在晚上。在一些实施方式中,化合物II在一天中的任意时间,每天给药一次。在一些实施方式中,化合物I的第二次960mg剂量(例如,240mg片剂,四片)在化合物I的第一次960mg剂量(例如,240mg片剂,四片)后约12个小时。在一些实施方式中,化合物I在早晨和晚上给药各一次。因此,预期以单一药物剂型提供化合物I和II(例如,共同配制两或多种活性成分)。因此,在一个实施方式中,本文的药物组合物可包含多于一种活性化合物(即,包含第一活性成分的所述第一组合物可与包含第二活性成分的第二组合物共同配制)。该分子以一定量适宜地存在于组合中,该量有效地用于预期目的。在另一方面,将两种(或多种)活性成分中的各活性成分耐心地配制并以分开的药物剂型给药。因此,在一些实施方式中,药品包含第一组合物,其包含(作为活性成分)化合物II;和第二组合物,其包含(作为活性成分)化合物I,其中将所述第一组合物以第一药物剂型给药并将所述第二组合物以第二药物剂型给药。在一些实施方式中,所述第一组合物与所述第二组合物相继给药。在一些实施方式中,第一组合物在第二组合物之前给药。在一些实施方式中,所述第一组合物在所述第二组合物后给药。在一些实施方式中,所述第一组合物与所述第二组合物同时给药。根据已知的方法(例如以推注方式进行静脉内给药或通过连续输注一段时间),将所述治疗性药物经肌内、腹膜内、脑脊髓内、皮下、关节内、滑膜内、鞘内、口服、局部或吸入途径给药至人患者。在一些实施方式中,所述给药为口服给药(在一些实施方式中,餐前或餐后)。在一些实施方式中,口服给药是餐后给药的。在一些实施方式中,口服给药是在餐前给药的。所述治疗性药物可以相同途径或不同途径给药。例如,组合中的一种治疗性药物可通过静脉注射给药而组合中另一种治疗性药物抑制剂可口服给药。或者,例如,两种治疗性药物均可口服给药,或两种治疗性药物均可通过静脉注射给药,其取决于具体的治疗性药物。在一些实施方式中,将化合物II和化合物I口服给药。可将化合物II和化合物I口服给药,餐前或餐后。在一些实施方式中,将化合物II口服给药,餐前或餐后。在一些实施方式中,将化合物I口服给药,餐前或餐后。诊断方法在一些实施方式中,本文所述患者在例如治疗前和/或治疗中和/或治疗后进行诊断测试。在一些方面,提供了选择用于患有不可切除或转移性黑色素瘤患者的疗法的方法,该方法包括确定在所述患者的不可切除或转移性黑色素瘤样品中BRAFV600突变的存在(在一些实施方式中,存在或不存在BRAFV600突变),以及基于BRAFV600突变的存在(在一些实施方式中,存在或不存在BRAFV600突变),选择癌症药物。在一个实施方式中,所述样品显示出表达BRAFV600突变(例如,BRAFV600E突变),其中选择用化合物II组合化合物I进行治疗(例如,治疗性治疗)(例如,如本文所述)。在一些实施方式中,所述患者用以下方法治疗(例如,治疗性治疗)不可切除或转移性黑色素瘤,所述方法包括向该患者给药(i)包含化合物II或其药学上可接受的盐的第一组合物,在28天周期的第1至21天以60mg的剂量;和(ii)包含化合物I或其药学上可接受的盐的第二组合物,在28天周期的第1至28天以960mg的剂量,每日两次。治疗方法包括本文中的任意治疗方法。在一些实施方式中,所述患者的不可切除或转移性黑色素瘤在先前未经治疗(例如,用威罗菲尼或BRAF抑制剂治疗)。在一些实施方式中,所述患者的不可切除或转移性黑色素瘤在先前已得到治疗(在一些实施方式中,先前并未用BRAF抑制剂治疗)。在另一方面,提供了用于优化治疗效果的方法,所述方法包括确定在患者的不可切除或转移性黑色素瘤样品中BRAFV600突变的存在(在一些实施方式中,存在或不存在BRAFV600突变),和并基于BRAFV600突变的存在(在一些实施方式中,存在或不存在BRAFV600突变)选择癌症药物。在一个实施方式中,所述样品显示出表达BRAFV600突变(例如,BRAFV600E突变),其中选择用化合物II组合化合物I进行治疗(例如,如本文所述)。在一些实施方式中,使用如下方法治疗患者的不可切除或转移性黑色素瘤,所述方法包括向该患者给药(i)化合物II或其药学上可接受的盐,在28天周期的第1至21天以60mg的剂量;和(ii)化合物I或其药学上可接受的盐,在28天周期的第1至28天以960mg的剂量,每日两次。治疗方法包括本文所述的任意治疗方法。在一些实施方式中,所述患者的不可切除或转移性黑色素瘤在先前未经治疗(例如,用威罗菲尼或BRAF抑制剂治疗)。在一些实施方式中,所述患者的不可切除或转移性黑色素瘤在先前已得到治疗(在一些实施方式中,先前并未用BRAF抑制剂治疗)。检测BRAF和突变体BRAF的方法是本领域已知的,且是市售可得的。参见,例如,Hailat等人,DiagnMolPathol.2012Mar;21(1):1-8。在一些实施方式中,BRAFV600E突变(也已知为V599E(T1796A))使用以下方法进行检测,该方法包括确定在外显子15的密码子600上的1799位核苷酸是否存在单碱基突变(T突变成A)。这个突变也可由第1799-1800位核苷酸上TG突变成AA的双碱基突变导致。其它突变还可发生在BRAF蛋白残基600。这些包括V600K、V600D和V600R。在一些实施方式中,可通过评估BRAF核酸,例如,基因组DNA或mRNA来判断在1799位是否存在碱基取代,从而确定V600突变的存在。在一些实施方式中,检测了以下V600突变:V600K(GTG突变成AAG)、V600R(GTG突变成AGG)、V600E(GTG突变成GAA)和/或V600D(GTG突变成GAT),括号内的所有情况均指的是BRAF的第1798-1800位核苷酸。在一些实施方式中,突变体BRAF多核苷酸包括T1799A突变。分析DNA(例如基因组DNA或cDNA)的各种方法均是本领域已知的且包括,但不限于基因表达分析、聚合酶链反应(PCR)(包括定量实时PCR(qRT-PCR)、等位基因特异性PCR)、测序、RNA测序、荧光原位杂交(FISH)和/或微阵列分析。在一些实施方式中,核酸的分析方法为以下的一种或多种:使用等位基因特异性寡核苷酸的杂交、引物延伸、等位基因特异性连接、测序(包括但不限于Sanger测序、焦磷酸测序)或电泳分离技术(例如,单链构象多态性检测(SSCP)和异源双链分析)、5’核酸检测、等位基因特异性PCR、经模板引导的荧光素标记碱基掺入反应(template-directeddye-terminatorincorporation)、分子信标等位基因特异性寡核苷酸测定(molecularbeaconallele-specificoligonucleotideassays)、单碱基延伸测定法(single-baseextensionassays)。可使用各种技术,例如微芯片、荧光偏振测定法和基质辅助激光解析电离(MALDI)质谱法进行递增的核酸序列分析。在一些实施方式中,通过测序对递增的核酸进行分析。可使用的两种其它的方法是基于使用Flap核酸酶的侵袭切割和采用锁式探针(padlockprobes)的方法学所进行的测试。4800BRAFV600突变测试是市售可得的,且利用实时PCR技术。在所述反应中的各个靶标特异性的寡核苷酸探针用荧光染料和猝灭剂分子进行标记,所述荧光染料作为报告基因(reporter),而所述猝灭剂分子吸收(淬灭)在完整的探针内的报告基因染料的荧光发射。在递增的各循环周期中,互补于递增子中的单链DNA序列的探针相结合,然后被Z05DNA聚合酶的5'至3'核酸酶活性所裂解。一旦这个核酸酶活性使得所述报告基因染料与淬灭剂分离,则当所述报告基因染料被合适的光谱激发时,特征波长的荧光便可被测量。两种不同的报告基因染料用于标记靶标特异性BRAF野生型(WT)探针和BRAFV600E突变(MUT)探针。通过测量在专用的光通道上的两个特征波长的荧光,便可独立地在单一反应中检测的两个BRAF序列的递增。在一些实施方式中,突变体BRAF多核苷酸(例如,DNA)使用如下方法进行检测,所述方法包括:(a)对提取自患者癌症样品(例如FFPE患者的癌症样品)的核酸(例如,基因组DNA)进行PCR;和(b)确定在所述样品中突变体BRAF多核苷酸的表达。在一些实施方式中,突变体BRAF多核苷酸的表达是使用如下方法进行检测的,所述方法包括:(a)将第一和第二寡核苷酸杂交至BRAF靶序列的至少一个变体;其中所述第一寡核苷酸是与靶序列的一个或多个变体至少部分互补的,且所述第二寡核苷酸是与靶序列的一个或多个变体至少部分互补的,且具有仅互补于靶序列的一个变体的至少一个内部选择性核苷酸;(b)用核酸聚合酶递增第二寡核苷酸;其中当所述选择性核苷酸与靶标形成碱基对时,所述聚合酶能够优先递增所述第二寡核苷酸,而当所述选择性核苷酸不与靶标形成碱基对时,所述聚合酶基本上很少递增该第二寡核苷酸;和(c)检测所述寡核苷酸递增产物,其中所述递增标志着靶序列变体的存在,而该寡核苷酸具有与靶序列互补的选择性核苷酸。在一些实施方式中,突变体BRAF多核苷酸(例如,DNA)使用如下方法进行检测,所述方法包括:(a)对提取自患者癌症样品(例如FFPE固定的患者癌症样品)的核酸(例如,基因组DNA)进行PCR;和(b)确定所述样品中突变体BRAF多核苷酸的表达。在一些实施方式中,突变体BRAF多核苷酸(例如,DNA)使用如下方法进行检测,所述方法包括:(a)从患者癌症样品(例如FFPE患者的癌症样品)中分离DNA(例如,基因组DNA);(b)对提取自患者的癌症样品中的DNA进行PCR;和(c)确定样品中突变体BRAF多核苷酸的表达。在一些实施方式中,突变体BRAF多核苷酸的表达是使用如下方法进行检测的,所述方法包括:(a)从患者的癌症样品(例如FFPE患者的癌症样品)中分离DNA(例如,基因组DNA);(b)将第一和第二寡核苷酸杂交至DNA中的BRAF靶序列的至少一个变体;其中所述第一寡核苷酸是与靶序列的一个或多个变体至少部分互补的,且所述第二寡核苷酸是与靶序列的一个或多个变体至少部分互补的,且具有仅互补于靶序列的一个变体的至少一个内部选择性核苷酸;(c)用核酸聚合酶递增第二寡核苷酸;其中当所述选择性核苷酸与靶标形成碱基对时,所述聚合酶能够优先递增所述第二寡核苷酸,而当所述选择性核苷酸不与靶标形成碱基对时,所述聚合酶基本上很少递增该第二寡核苷酸;和(d)检测所述寡核苷酸递增产物,其中所述递增标志着靶序列变体的存在,而该寡核苷酸具有与靶序列互补的选择性核苷酸。在一些实施方式中,突变体BRAF多核苷酸的表达是使用如下方法进行检测的,所述方法包括:(a)将第一和第二寡核苷酸杂交至BRAF靶序列的至少一个变体;其中所述第一寡核苷酸是与靶序列的一个或多个变体至少部分互补的,且所述第二寡核苷酸是与靶序列的一个或多个变体至少部分互补的,且具有仅互补于靶序列的一个变体的至少一个内部选择性核苷酸;(b)用核酸聚合酶递增第二寡核苷酸;其中当所述选择性核苷酸与靶标形成碱基对时,所述聚合酶能够优先递增所述第二寡核苷酸,而当所述选择性核苷酸不与靶标形成碱基对时,所述聚合酶基本上很少递增该第二寡核苷酸;和(c)检测所述寡核苷酸递增产物,其中所述递增标志着靶序列变体的存在,而该寡核苷酸具有与靶序列互补的选择性核苷酸。在一些实施方式中,突变体BRAF多核苷酸(例如,DNA)是使用如下方法进行检测的,所述方法包括:(a)对提取自患者的癌症样品(例如FFPE患者的癌症样品)的核酸(例如,基因组DNA)进行PCR;(b)测序PCR递增核酸来确定突变体BRAF多核苷酸的表达。在一些实施方式中,突变体BRAF多核苷酸(例如,DNA)使用测序(例如,Sanger测序或焦磷酸测序)检测的。在一些实施方式中,对BRAF(例如,BRAFV600)蛋白表达进行分析。可使用免疫组织化学(IHC)或蛋白生物学方法,例如对患者肿瘤样品进行该蛋白分析。测试患者的样品中本文所述的一种或多种生物标记的表达。所述组织或细胞样品的来源可以是获自新鲜、冷冻和/或保存的器官或组织样品的实体组织或活检或抽取物;血液或任意血液成分;体液,例如脑脊液、羊水、腹膜液或间隙液;在患者妊娠或发育的任意时期获得的细胞。组织样品可含有不是在自然界中天然地与该组织混合的化合物,例如防腐剂、抗凝剂、缓冲剂、固定剂、营养素、抗生素等。本文的肿瘤样品实例包括,但不限于肿瘤活检、肿瘤细胞、血清或血浆、循环血浆蛋白、腹水、原代细胞培养物或衍生自肿瘤或表现出肿瘤样特性的细胞系,以及保存的肿瘤样品,例如福尔马林固定、石蜡包埋的肿瘤样品或冷冻的肿瘤样品。在一个实施方式中,所述患者的样品是福尔马林固定、石蜡包埋的(FFPE)癌症样品(例如,不可切除或转移性黑色素瘤的癌症样品)。所述样品可在所述患者接受癌症药物治疗前获得。所述样品可获自原发性肿瘤或转移性肿瘤。所述样品可当癌症被首次诊断时,和/或例如,在肿瘤已发生转移后获得。在一些实施方式中,所述转移性肿瘤样品为肺、皮肤、淋巴结、骨、肝、结肠、甲状腺和/或卵巢的肿瘤样品。制品在本发明的另一实施方式中,提供了用于治疗癌症(例如BRAFV600-阳性的不可切除或转移性黑色素瘤)的制品。所述制品包含容器和该容器上或与该容器有关的标签或药品说明书。合适的容器包括,例如,瓶、小瓶、注射器、药丸包装、泡罩包装、转盘包装等。所述容器可由各种材料(例如玻璃或塑料)制成。所述容器盛有或含有组合物,该组合物包含作为活性药物的癌症药物(例如,化合物II)。在一些实施方式中,包含癌症药物的组合物以片剂提供。在一些实施方式中,所述制品包含容器和含有60mg化合物II的片剂。在一些实施方式中,所述制品包含容器和含有20mg或40mg化合物II的片剂。在一些实施方式中,包含第一容器的制品包含(a)包含化合物II(例如,60mg化合物II)的第一组合物,以片剂提供和(b)包含化合物I(例如,960mg化合物I)的第二组合物,以片剂提供(例如,240mg片剂,四片)。在一些实施方式中,所述容器为药丸包装或泡罩包装。在一些实施方式中,包含化合物I的第一组合物和包含化合物II的第二组合物以单一剂型提供。在一些实施方式中,将包含化合物II的第一组合物和包含化合物I的第二组合物共同配制(例如,作为药物制剂)。在一些实施方式中,所述制品(例如,以药丸包装或泡罩包装提供)包含21片片剂,(例如,包含化合物II的组合物(例如,包含60mg化合物II);和包含化合物I的组合物片剂(例如,包含240mg化合物I的片剂)。在一些实施方式中,化合物II以60mg片剂提供。在一些实施方式中,化合物II以片剂提供,所述片剂包含乳糖一水合物、维晶纤维素、交联羧甲基纤维素钠和硬脂酸镁中的一种或多种作为所述片剂核心。在一些实施方式中,所述片剂包衣包含部分水解的聚乙烯醇、二氧化钛、聚乙二醇3350和滑石中的一种或多种。在一些实施方式中,化合物II以片剂提供,所述片剂包含乳糖一水合物、维晶纤维素、交联羧甲基纤维素钠和硬脂酸镁作为所述片剂核心,且片剂包衣包含部分水解的聚乙烯醇、二氧化钛、聚乙二醇3350和滑石。在一些实施方式中,化合物II以片剂提供,所述片剂包含(a)60mg的化合物II(活性成分);和(b)乳糖一水合物、维晶纤维素、交联羧甲基纤维素钠和硬脂酸镁作为所述片剂核心,且片剂包衣包含部分水解的聚乙烯醇、二氧化钛、聚乙二醇3350和滑石。所述制品还可包含第二容器和/或基于商业和用户考虑所需的其它物质,包括其它缓冲剂、稀释剂、过滤器、针头和注射器。本发明的制品还包括信息,例如以药品说明书的形式,该信息标明,例如,化合物II与化合物I组合用于治疗(例如,治疗性治疗)患有BRAFV600突变阳性的不可切除或转移性黑色素瘤的患者,其中该治疗包括给药(i)包含化合物II或其药学上可接受的盐的第一组合物,在28天周期的第1至21天以60mg的剂量;和(ii)包含化合物I或其药学上可接受的盐的第二组合物,在28天周期的第1至28天以960mg的剂量(例如,240mg片剂,四片),每日两次。治疗可,例如,提高患者的生存、降低患者癌症复发的风险和/或增加患者存活的可能性。说明书或标签可采用任何形式,例如报纸或电子媒体(例如磁记录介质(如,软盘)或CD-ROM)。所述标签或说明书还可包括该试剂盒或制品中有关药物组合物和药物剂型的其它信息。治疗方法包括本文公开的任意方法。在一些实施方式中,所述患者的不可切除或转移性黑色素瘤在先前未经治疗(例如,用威罗菲尼或BRAF抑制剂治疗)。在一些实施方式中,所述患者的不可切除或转移性黑色素瘤在先前已得到治疗(在一些实施方式中,先前并未用BRAF抑制剂治疗)。本发明还涉及制造一种制品的方法,该方法包括将包含化合物II的药物组合物与标明药物组合物与威罗菲尼组合治疗(例如,治疗性治疗)患有BRAFV600突变阳性的不可切除或转移性黑色素瘤患者的药品说明书组合在包装中,其中(i)将包含化合物II或其药学上可接受的盐的第一组合物,在28天周期的第1至21天以60mg的剂量给药;和(ii)将包含化合物I或其药学上可接受的盐的第二组合物,在28天周期的第1至28天以960mg的剂量,每日给药两次。治疗可,例如,提高患者的生存、降低患者癌症复发的风险、延长对治疗的反应期和/或增加患者存活的可能性。在一些实施方式中,所述不可切除或转移性黑色素瘤在先前未经治疗(即,先前未治疗不可切除或转移性黑色素瘤)。治疗方法包括本文公开的任意方法。在一些实施方式中,所述患者的不可切除或转移性黑色素瘤在先前未经治疗(例如,用威罗菲尼或BRAF抑制剂治疗)。在一些实施方式中,所述患者的不可切除或转移性黑色素瘤在先前已得到治疗(在一些实施方式中,先前并未用BRAF抑制剂治疗)。所述制品还可包含基于商业和用户考虑所需的其它物质,包括其它缓冲剂、稀释剂、过滤器、针头和注射器。试剂盒本发明涉及用于治疗不可切除或转移性黑色素瘤的试剂盒,其包含(i)包含化合物II或其药学上可接受的盐的第一组合物;和(ii)包含化合物I或其药学上可接受的盐的第二组合物;其中将所述化合物II,在28天周期的第1至21天以60mg的剂量给药,且其中将化合物I在28天周期的每天以960mg的剂量(例如,240mg片剂,四片),每日给药两次。所述试剂盒还可包含药品说明书,其标明所述药物组合物是与威罗菲尼组合治疗(例如,治疗性治疗)患有BRAFV600突变阳性的不可切除或转移性黑色素瘤患者,其中(i)将包含化合物II或其药学上可接受的盐的第一组合物,在28天周期的第1至21天以60mg的剂量给药;和(ii)将包含化合物I或其药学上可接受的盐的第二组合物,在28天周期的第1至28天以960mg的剂量(例如,240mg片剂,四片),每日给药两次。治疗可,例如,提高患者的生存、降低患者癌症复发的风险、延长对治疗的反应期和/或提高患者存活的可能性。在一些实施方式中,所述不可切除或转移性黑色素瘤在先前未经治疗(即,先前并未治疗不可切除或转移性黑色素瘤)。在一些实施方式中,所述不可切除或转移性黑色素瘤在先前未经治疗。在一些实施方式中,所述患者的不可切除或转移性黑色素瘤在先前已得到治疗(在一些实施方式中,先前并未用BRAF抑制剂治疗)。在一些实施方式中,包含化合物II的第一组合物为片剂。在一些实施方式中,包含化合物I的第二组合物为片剂。在一些实施方式中,包含化合物II的第一组合物和包含化合物I的第一组合物各自以片剂提供。在一些实施方式中,包含化合物I的第一组合物和包含化合物II的第二组合物以单一剂型提供。在一些实施方式中,将包含化合物II的第一组合物和包含化合物I的第二组合物共同配制(例如,作为药物制剂)。治疗方法包括本文所公开的任意方法。本发明还涉及诊断试剂盒,其用于检测本文所鉴定的任一种或多种生物标记。因此,提供了诊断试剂盒,其包含一种或多种用于确定BRAF的表达的试剂,例如癌症患者的样品中BRAFV600生物标记的表达。任选地,所述试剂盒还包含说明书,该说明书介绍了若患者的不可切除或转移性黑色素瘤表达BRAFV600则使用该试剂盒、选择包含化合物II的组合物与包含化合物I的组合物的组合来治疗(例如,治疗性治疗)所述患者,其中治疗包括给药(i)包含化合物II或其药学上可接受的盐的第一组合物,在28天周期的第1至21天以60mg的剂量;和(ii)包含化合物I或其药学上可接受的盐的第二组合物,在28天周期的第1至28天以960mg的剂量,每日两次。在一些实施方式中,所述患者的不可切除或转移性黑色素瘤在先前未经治疗。在一些实施方式中,所述患者的不可切除或转移性黑色素瘤在先前已得到治疗(在一些实施方式中,先前并未用BRAF抑制剂治疗)。治疗方法包括本文所公开的任意方法。宣传方法本发明还涉及推销或宣传癌症药物的方法,所述方法包括向目标受众推销化合物II与威罗菲尼组合在治疗(例如,治疗性治疗)患有BRAFV600突变阳性的不可切除或转移性黑色素瘤患者中的用途,其中治疗包括给药(i)包含化合物II或其药学上可接受的盐的第一组合物,在28天周期的第1至21天以60mg的剂量;和(ii)包含化合物I或其药学上可接受的盐的第二组合物,在28天周期的第1至28天以960mg的剂量,每日两次。治疗可,例如,提高患者的生存、降低患者癌症复发的风险、延长对治疗的反应期和/或提高患者存活的可能性。在一些实施方式中,所述不可切除或转移性黑色素瘤在先前未经治疗。在一些实施方式中,所述患者的不可切除或转移性黑色素瘤在先前已得到治疗(在一些实施方式中,先前并未用BRAF抑制剂治疗)。宣传通常是经非个人媒体传播的付费通讯,其中标明了赞助商且信息是受控的。用于本文目的的宣传包括推广、公共关系、产品植入、赞助、保险和促销。这个术语还包括出现在任何印刷传播媒介上的商业化信息公告,其旨在吸引大量观众去相信、了解、对其进行推销、诱导或进行其他的行为使所述观众朝着更有利于购买、支持或认可本发明的方式改变。本文中的诊断方法的宣传和推销可通过任意方式完成。用于传递这些信息的宣传媒介的实例包括电视、广播、电影、杂志、报纸、互联网和广告牌,包括广告节目,这些是出现在广播媒体上的信息。宣传还包括在超市购物车座上、机场通道的墙上以及公交车两侧的那些宣传,或者在电话保持信息中或在店内PA系统中所听到的,或可放置在任何看得见或听得着宣传的地方。更具体的推销或宣传方式的实例包括电视、广播、电影、互联网(例如网络广播和网络研讨会)、旨在同时到达用户的交互式电脑网络、固定的或电子广告牌以及其他的公共指示牌、海报、传统的或电子文字(例如杂志和报纸)、其它媒体播送终端、演示文稿或通过例如电子邮件、电话、即时信息、邮政邮件、快递邮件、群发邮件或运输邮件(carriermail)与患者接触,或当面访问等。所使用的宣传类型将取决于许多因素,例如,目标受众的性质,例如,医院、保险公司、诊所、医生、护士和患者,以及成本考虑和管理药品和诊断的宣传的相关管辖权的法律法规。基于通过服务交互和/或其他数据(如用户的人口统计和地理位置)所确定的用户特性,可对所述宣传进行患者个体化或定制。在一些实施方式中,所述推销是通过药品说明书,其中所述药品说明书提供了接受化合物II与化合物I的组合来治疗(例如,治疗性治疗)所述患者的指导,其中治疗包括给药(i)包含化合物II或其药学上可接受的盐的第一组合物,在28天周期的第1至21天以60mg的剂量;和(ii)包含化合物I或其药学上可接受的盐的第二组合物,在28天周期的第1至28天以960mg的剂量(例如,240mg片剂,四片),每日两次。在一些实施方式中,所述推销是在患者接受化合物II治疗(伴有或不伴有化合物I)之后进行的。在一些实施方式中,所述药品说明书标明,若患者的不可切除或复发型转移性黑色素瘤样品为BRAFV600突变阳性,则所述化合物II用于治疗该患者。治疗可,例如,提高患者的生存、降低患者癌症复发的风险、延长对治疗的反应期和/或提高患者存活的可能性。治疗方法包括本文所公开的任意方法。在一些实施方式中,所述患者的不可切除或转移性黑色素瘤在先前未经治疗(例如,用威罗菲尼或BRAF抑制剂治疗)。在一些实施方式中,所述患者的不可切除或转移性黑色素瘤在先前已得到治疗(在一些实施方式中,先前并未用BRAF抑制剂治疗)。本发明还提供商业方法,包括销售化合物II与化合物I组合在治疗(例如,治疗性治疗)患有BRAFV600突变阳性的不可切除或转移性黑色素瘤患者中的用途,其中治疗包括给药(i)包含化合物II或其药学上可接受的盐的第一组合物,在28天周期的第1至21天以60mg的剂量;和(ii)包含化合物I或其药学上可接受的盐的第二组合物,在28天周期的第1至28天以960mg的剂量(例如,240mg片剂,四片),每日两次。治疗可,例如,提高患者的生存、降低患者癌症复发的风险、延长对治疗的反应期和/或提高患者存活的可能性。治疗方法包括本文所公开的任意方法。在一些实施方式中,所述患者的不可切除或转移性黑色素瘤在先前未经治疗(例如,用威罗菲尼或BRAF抑制剂治疗)。在一些实施方式中,所述患者的不可切除或转移性黑色素瘤在先前已得到治疗(在一些实施方式中,先前并未用BRAF抑制剂治疗)。实施例以下是本发明方法和组合物的实施例。应理解,按照上文提供的基本描述可实施各种其它实施方式。实施例1研究NO25395(BRIM-7)是Ib期研究,旨在评估(a)GDC-0973的MEK抑制,和(b)威罗菲尼的BRAF抑制的组合的安全性、耐受性和药代动力学。这个多中心研究具有两个阶段:剂量递增阶段和组扩充阶段(cohort-expansionstage)。这个研究是在患有BRAFV600突变阳性、不可切除的局部晚期或转移性黑色素瘤的患者中进行的,所述患者未接受威罗菲尼治疗(先前未接受治疗,或先前接受治疗但先前未暴露于BRAF治疗)或所述患者在参与这个治疗之前在用威罗菲尼进行的治疗时已发生了进展。关键的入选标准包括:在黑色素瘤肿瘤组织中存在V600E突变,其使用的是4800BRAFV600突变测试;根据实体瘤的疗效评价标准(RECIST)v1.1,可测量的疾病的ECOGPS≤1;以及通过重点实验室测定所评估的充足的血液学和终端器官功能。如果患者具有下列情况,则会被排除:眼部病变或有诱发视网膜静脉闭塞的危险因素;QTc>450ms;或主动的CNS转移。若接受立体定向放射治疗或手术治疗的患者在治疗前保持稳定≥3周,则该患者是合格的。在剂量递增阶段的所有患者均接受威罗菲尼每日两次组合GDC-0973每日一次,其根据以下28天剂量方案中的一种:连续给药所研究的药物14天然后停药14天(14/14),连续给药所研究的药物21天然后停药7天(21/7),或以连续的每日剂量给药(28/0)。各治疗周期为28天。存在10个剂量递增组,每组3-6名患者(图1)。在各28天的组合给药周期中,第1组患者接受威罗菲尼,以720mg剂量,每日两次(BID),持续给药,以及GDC-097360mg每日一次(QD),连续给药14天(14/14)。考虑到组合的安全性和耐受性,剂量递增采用的是标准3+3设计,并继续递增。结果截至2012年9月20日,共92名患者接受了至少一种剂量的威罗菲尼和GDC-0973的组合治疗。以下剂量水平被视为安全和可耐受的:威罗菲尼720mgBID+GDC-097360mgQD14/14(第1组)威罗菲尼720mgBID+GDC-097380mgQD14/14(第2组)威罗菲尼960mgBID+GDC-097360mgQD14/14(第3组)威罗菲尼720mgBID+GDC-097360mgQD21/7(第1A组)威罗菲尼960mgBID+GDC-097360mgQD21/7(第1B组)威罗菲尼720mgBID+GDC-097360mgQD28/0(第1C组)威罗菲尼960mgBID+GDC-097380mgQD14/14(第4组)威罗菲尼720mgBID+GDC-0973100mgQD14/14(第2A组)(BID=每日两次;QD=每日一次)符合条件的患者患有BRAFV600突变的不可切除或转移性黑色素瘤且ECOGPS0–1。患者未接受威罗菲尼治疗或在威罗菲尼治疗下发生病情进展。所述研究由剂量递增和扩充阶段组成。患者在28天周期的每天以720mg或960mg的剂量,BID(每日两次)接受威罗菲尼。按照如下方法给药GDC-0973:以60mg、80mg或100mg剂量,QD(每日一次),给药14天(d)/停药14天(14/14);给药21天/停药7天;或在28天周期的每天给药。主要终点(Primaryendpoints)为最大耐受剂量(MTD)、两种药物的剂量限制性毒性(DLT)、安全性和PK。图3显示了在2012年7月6日的患者特性。70名患者(70%是男性;年龄中位数:57.5岁[范围:19-76];74.3%为IVM1c期,54.5%在先前的威罗菲尼治疗中发生疾病进展)接受大于或等于一个剂量的GDC-0973+威罗菲尼。周期数的中位数是3。截至2012年9月18日,在3名患者中观测到了剂量限制性毒性:威罗菲尼造成的3级QT延长(QTprolongation),导致停止给药威罗菲尼(第1B组)、威罗菲尼和GDC-0973造成的3级粘膜炎(第1D组)和威罗菲尼造成的3级关节痛(第1D组)。图4显示了截至2012年7月6日,全部患者中由于威罗菲尼或GDC-0973所造成的不良事件。在全部患者中,最常见的不良事件为腹泻(51.4%)、非痤疮样皮疹(52.9%)、恶心(28.6%),疲劳(30.0%)和光过敏/晒伤(31.4%)。将GDC-0973加至威罗菲尼未观察到额外毒性。20%的患者表现出肝功能检查升高,其大部分是轻度的(1或2级)。仅4.3%的患者表现出3或4级肝功能检查升高。在12.9%的患者中观测到了关节痛,且这一不良事件是在单独的威罗菲尼治疗观测到的不良事件的范围内。在3名患者中观测到了浆液性脉络膜视网膜病变(Serouschoreoretinopathy),全部病例均为轻度的。在这70名接受威罗菲尼和GDC-0973治疗的患者中,仅有一名患者出现皮肤鳞状细胞癌。因此,鳞状细胞癌的频率似乎比单独用威罗菲尼治疗所观察到的频率要低。这一发现与鳞状细胞癌病变的发展机制是一致的,所述鳞状细胞癌病变是经由MAPK通路的特殊激活而发展的。最常见的与治疗相关的≥3级不良事件为腹泻(5.7%)、肌酸磷酸激酶升高(4.5%)、碱性磷酸酶升高(4.5%)和斑丘疹(4.5%)。图5显示了截止到2012年7月6日的不良事件,其导致剂量中断、降低和永久性停药。暂时中断威罗菲尼的最常见的原因是:皮疹(8名患者)、肝功能试验(LFT)异常(3名患者)和关节痛(3名患者)。暂时中断GDC-0973的最常见的原因是:皮疹(5名患者)和腹泻(3名患者)。威罗菲尼初始剂量降低型中断(primarydosereductioninterruption)的原因是:LFT异常(1名患者)、浆液性中心性视网膜病(1名患者)和皮疹(1名患者)。GDC-0973初始剂量降低型中断的原因是:浆液性中心性视网膜病(1名患者)和皮疹(1名患者)。威罗菲尼停药的原因是:QT间期延长(1名患者)。仅一小部分患者需要剂量降低或永久性停药。这些结果支持了以下结论:该组合在所测试的患者中具有很好的耐受性。选择两个剂量水平用于扩充:威罗菲尼(720mg&960mgBID)+GDC-097360mgQD21/7。图6显示了患者肿瘤大小从基线到最适应答的改变,所述患者在先前的威罗菲尼治疗中发生疾病进展。在先前用威罗菲尼治疗发生了进展的患者中,用该组合进行的治疗与显著的肿瘤应答无关。图7显示了患者肿瘤大小从基线到最适应答的改变,所述患者未接受威罗菲尼治疗。在25名未接受威罗菲尼治疗的患者中的最初疗效数据显示,所有25名患者均出现肿瘤减小。根据RECIST1.1标准,未接受威罗菲尼治疗的患者的确定的应答率为40%而病情稳定为60%。图8A显示了在先前用威罗菲尼治疗发生疾病进展的患者中,在接受威罗菲尼+GDC-0973治疗后的PET扫描应答。在组合治疗的第14天,观测到了PET活性的显著降低。这个结果证明,用威罗菲尼和GDC-0973的组合进行治疗能够迅速地逆转威罗菲尼抗性。图8B显示了在先前用威罗菲尼治疗发生疾病进展的患者中,在接受威罗菲尼(Vem)+GDC-0973(GDC)治疗后的PET应答的其它实例。这些结果证明,GDC-0973与威罗菲尼组合是可耐受的且不良事件是可控的。所述组合以威罗菲尼(960mgBID)和GDC-0973(60mg21/7)各自单一药品MTD进行安全递送。该数据的药物动力学数据显示,威罗菲尼和GDC-0973的暴露量(exposures)与二者在之前的单一药品研究中所观测到的暴露量类似。在威罗菲尼和GDC-0973之间未观测到显著的PK相互作用。最新的结果:截至2013年1月25日,在可评估疗效的患者中观测到的确定的应答如下:客观应答,n(%)未接受BRAF抑制剂治疗(n=59)威罗菲尼进展者(n=49)最佳总体应答43(73)7(14)-完全应答2(3)0-部分应答41(70)7(14)-病情稳定14(24)24(49)-疾病进展1(2)16(33)-无法评估/未评估1(2)2(4)患者群中共有的相关不良事件和所选不良事件如下:*各1名非痤疮样皮疹和痤疮样皮疹患者未进行分级。患者群中由于不良事件进行的治疗调整如下:*根据给药方案,患者中断所研究的药物超过28天,则退出该研究。结论:威罗菲尼和cobimetinib以其各自单一药品MTD安全地组合。最常见的不良事件是皮疹、腹泻、光过敏和肝功能检查升高。大部分不良事件在严重程度上是从轻度至中度的。大部分不良事件用治疗中断和支持性疗法进行控制,而剂量降低是不常见的。实施例2已经证明在28天的治疗周期中,在第1-28天用威罗菲尼960mgBID(每日两次)和在第1-21天用GDC-097360mgQD(每日一次)的治疗是安全且良好耐受的。GO28141是多中心、随机、双盲、安慰剂对照的III期临床研究,用以评价在先前未接受治疗的患有不可切除局部晚期或转移性黑色素瘤的BRAFV600突变阳性的患者中,使用威罗菲尼与GDC-0973的组合以及单独使用威罗菲尼的安全性和疗效。将大约500名之前未接受治疗的患有不可切除局部晚期或转移性黑色素瘤的BRAFV600突变阳性的患者以1:1的比例随机接受以下治疗方案中的一种治疗:-A组(对照组):在28天治疗周期中在第1-28天用威罗菲尼960mg口服(PO)BID和在第1-21天用安慰剂POQD。-B组(研究组):在28天治疗周期中在第1-28天用威罗菲尼960mgPOBID和在第1-21天用GDC-097360mgPOQD。BID=每日两次;QD=每日一次。分层、区组互换的随机方法(stratified,permuted-blockrandomizationscheme)将用于基于以下分层因素(stratificationfactor)进行的治疗分配:-地理区域(北美洲、欧洲、澳大利亚/新西兰,或其它地区).-转移性分级(不可切除IIIc期、M1a期和M1b期;或M1c期)。图2显示了该研究中威罗菲尼和GDC-0973/安慰剂的给药方案。在治疗的全部周期中、在研究结束时的治疗访问时以及在后续随访期间,紧密监测全部患者的安全性和耐受性。在第一个2周期过程中的每两周评估患者的不良事件,然后在各后续周期之前以及必要时评估患者的不良事件。肿瘤应答是根据RECISTv1.1进行评估的。将任何可评估且可测量的疾病在筛选时进行记录并在各后续的肿瘤评估时重新评估。应答是由研究人员以8周间隔评估的。根据调查人员的考虑,如果怀疑疾病进展,则在任意时间重复CT/MRI扫描。NCI的通用术语标准不良事件(CTCAE)v4.0用于表征在所有患者中该研究治疗的毒性。ECG评估在第1个3周期的第15天进行,然后在之后的每3个治疗周期(第6、9、12周期等)的第15天进行。皮肤性评估在第2周期开始时(±1周)进行,然后在之后的每3个治疗周期(±1周)(第5、8、11周期,等)进行。如果临床上有指标,则重复眼科检查。患者的治疗直至疾病进展、患者死亡、不可接受的毒性或取消许可,以先发生为准。用威罗菲尼和安慰剂的治疗组患者在疾病进展时没有资格跨越到威罗菲尼和GDC-0973的治疗组,且监视生存。本研究的主要疗效目标是通过测量PFS的延长,评估威罗菲尼与GDC-0973组合相比于威罗菲尼和安慰剂,在先前未接受治疗的患有不可切除局部晚期或转移性黑色素瘤的BRAFV600突变阳性的患者中的疗效,其是由该研究基地研究人员所评估的。本研究的次要疗效目标是通过测量客观应答率(ORR)、反应期(DOR)和总生存率(OS),评估威罗菲尼与GDC-0973组合相比于威罗菲尼和安慰剂,在先前未接受治疗的患有不可切除局部晚期或转移性黑色素瘤的BRAFV600突变阳性的患者中的疗效。本研究的安全性目标是表征在接受威罗菲尼和GDC-0973的患者中与接受威罗菲尼和安慰剂的患者中的毒性。本研究的药代动力学目标是表征GDC-0973和威罗菲尼的药代动力学,以及比较给药GDC-0973时威罗菲尼的药代动力学和给药安慰剂时威罗菲尼的药代动力学。本研究的患者报告的疗效目标(patient-reportedoutcomeobjective)是,通过欧洲癌症治疗研究组织(EORTC)的生活质量调查问卷和欧洲五维健康量表(EQ-5D)调查问卷测量来评估接受威罗菲尼和GDC-0973的患者与接受威罗菲尼和安慰剂的患者的健康相关的生活质量。患者为了符合该研究,患者在先前并未治疗不可切除局部晚期或转移性黑色素瘤。患者在其黑色素瘤肿瘤组织中具有确定的BRAFV600突变。入选和排除标准的非限制性条件包括:针对疾病的入选标准:-如AJCC第7版所确定的,患者患有组织学上确定的黑色素瘤,可以是不可切除的IIIc期或IV期转移性黑色素瘤。-患者未接受过局部晚期不可切除或转移性疾病的治疗(即,先前未接受系统性抗癌疗法以治疗晚期疾病;IIIc期和IV期)。允许先前的辅助免疫疗法(包括易普利单抗(Ipilimumab))。-记录黑色素瘤肿瘤组织(库存的(archival)或新获得的肿瘤样品)中的BRAFV600突变阳性的状态。-根据RECISTv1.1可测量的疾病癌症相关的排除标准:-有之前用RAF或MEK通路抑制剂治疗的历史。-在首次给药所研究的治疗之前14天内进行了缓解性放疗。-在首次给药所研究的治疗之前14天内进行了大手术或发生外伤。-除了黑色素瘤之外的活性恶性肿瘤,其有可能会干扰对疗效措施的解释。在过去的3年内已患有恶性肿瘤的患者被排除,除非患者患有的是皮肤上可切除的BCC或SCC、原位黑色素瘤、原位宫颈癌和原位乳腺癌。-在没有转移性前列腺癌的影像学证据时,允许前列腺特异性抗原单独升高的病史。GDC-0973和安慰剂GDC-0973作为20mg片剂口服使用。将GDC-0973包装于泡罩包装中。将GDC-0973安慰剂包装于与GDC-0973包装相同的泡罩包装中。GDC-0973中的非活性成分如下:乳糖一水合物、维晶纤维素、交联羧甲基纤维素钠和硬脂酸镁用作所述片剂核心。所述片剂包衣由部分水解的聚乙烯醇、二氧化钛、聚乙二醇3350和滑石组成。GDC-0973的安慰剂由上面所列的全部非活性成分组成并且外观上与GDC-0973相同。威罗菲尼威罗菲尼作为240mg片剂口服使用。将威罗菲尼包装于瓶中。威罗菲尼片剂中的非活性成分如下:醋酸琥珀羟丙甲纤维素、交联羧甲基纤维素钠、胶体二氧化硅、硬脂酸镁、羟丙基纤维素(片剂核心)、聚乙烯醇、二氧化钛、聚乙二醇3350、滑石和氧化铁红(片剂包衣)。BRAFV600突变测试如果其它资格条件也满足,则在4800BRAFV600突变测试中,黑色素瘤肿瘤测试呈BRAFV600突变阳性的患者有资格参与到该临床试验中。只要满足以下所需,则肿瘤样品可获自原发性黑色素瘤肿瘤或任何转移部位。在一些实施方式中,将库存的或新获得的福尔马林固定、石蜡包埋的(FFPE)肿瘤样本用于4800BRAFV600突变测试。在一些实施方式中,收集肿瘤样本以新鲜的冷冻组织,但是获自细针穿刺活检(fineneedleaspirations)(FNA)的组织则不可以。尽管为了清楚理解,前述发明已经通过说明和实施例进行了详尽地描述,但是该说明书和实施例不应被理解为限制本发明的范围。本文所引用的所有专利和科学文献的公开全部引入本文作为参考。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1