Pd(II)催化的游离羧酸的对映选择性C-H芳基化的制作方法
pd(ii)催化的游离羧酸的对映选择性c-h芳基化
[0001]
政府支持声明
[0002]
本发明是在由国立卫生研究院(national institutes of health)授予的基金号gm084019的政府支持下完成的。政府在本发明中具有一定的权利。
[0003]
相关申请的交叉引用
[0004]
本申请要求2018年4月19日提交的美国临时申请序列号62/659,866的优先权,其公开内容通过引用整体并入本文。
背景技术:
[0005]
由于在大多数有机分子中广泛存在对称的前手性(prochiral)c(sp3)-h键,因此通过c-h活化的去对称化有潜力成为广泛可用的手性技术。1最近通过弱配位导向基团与手性双齿配体(bidentate ligand)的组合使pd(ii)催化的对映选择性分子间c(sp3)-h活化成为可能。
2,3,4,5
这种策略首次通过使用单-n-保护的氨基酸(mono-n-protected amino acid,mpaa)作为手性配体开发α-季环丙烷甲酰胺的n-全氟芳基酰胺导向的对映选择性c-h交叉偶联示出。
2a
最近,开发了手性双齿喹啉配体以实现无环n-全氟芳基甲酰胺的亚甲基c(sp3)-h键的对映选择性官能化,从而构建β-手性中心,
2c
而双齿唑啉配体使得能够使n-全氟芳基或甲氧基甲酰胺的偕二甲基(gem-dimethyl)对映选择性c(sp3)-h官能化以用于构建α-手性中心。
2d
然而,这些反应中的底物需要预先安装的需要在c-h官能化之后去除的导向基团。按照实现无保护基合成的相同概念,6我们开始开发不使用外源导向基团的羧酸的对映选择性c-h活化。
[0006]
发明概述
[0007]
在多个实施方案中,本发明涉及用于对具有β-氢原子的羧酸进行立体选择性β-芳基化的方法。例如,本发明可提供对具有β-氢原子的环丙烷羧酸的β-碳原子进行立体选择性芳基化的方法,所述环丙烷羧酸具有α-取代基或不具有α-取代基,所述方法包括:在存在催化量的pd(ii)盐、等摩尔当量或更多的基于ag(i)的ag(i)盐和等摩尔当量或更多的碱的情况下,在1,1,1,3,3,3-六氟异丙醇溶剂中,在存在下式的经乙酰基保护的氨乙基胺(cetyl-protected aminoethyl amine,apaa)配体的(r)或(s)单一对映体的情况下,
[0008]
使环丙烷羧酸与芳基碘接触,以立体选择性地提供β-芳基-环丙烷羧酸,其中β-芳基-环丙烷羧酸产物的芳基化β-碳原子在不存在α-取代基时相应地具有(r)或(s)单一对映体构型,并且在存在α-取代基时相应地具有(s)或(r)单一对映体构型;所引入的芳基相对于环丙烷羧酸的羧酸基团顺式布置:
[0009][0010]
其中ac是乙酰基,每个r是独立选择的甲基或乙基,或者两个r基团和与其键合的氮原子一起形成4至6元杂环基环;并且其中r1是未经取代或经取代的苄基,或者其中r1是(c
3-c4)-烷基。
[0011]
底物环丙烷羧酸可具有式:其中rα可以是氢(即,在本文中称为α-未取代的环丙烷羧酸),或者可以是取代基,例如,烷基、芳基、烷芳基或杂芳基等,其任一个可进一步被除羧酸基团之外的有机官能团取代(即,在本文中称为α-取代的环丙烷羧酸)。如果不存在其他取代基,则该前体是非手性的。当进行本发明的立体选择性芳基化反应时,获得了式的产物,所引入的芳基相对于羧酸基团顺式且立体选择性地插入,使得当使用的配体具有(s)绝对构型时,带有芳基的来自未经取代的环丙烷羧酸前体的产物的β-碳原子在该手性中心处具有(s)绝对构型;以及带有芳基的来自经取代的环丙烷羧酸前体的产物的β-碳原子在该手性中心处具有(r)绝对构型。
[0012]
根据将(r)或(s)的绝对构型分配给手性中心的cahn-ingold-prelog基团优先级规则,由于与β-碳原子键合的基团的优先级变化,将产物β-芳基环丙烷羧酸的绝对构型指定为(s)或(r)在该产物中从未经取代到经取代的情况有所不同。芳基通过pd-配体-底物络合物引入到β-碳原子上,这在α-未取代和α-取代的前体环丙烷羧酸之间类似,但是α-取代基的存在改变了命名方案从而提供了与α-未取代的反应产物相反的(r)或(s)构型分配。
[0013]
在另一些实施方案中,本发明可提供对2-邻苯二甲酰亚胺基异丁酸的β-碳原子进行立体选择性芳基化的方法,其包括:在存在催化量的pd(ii)盐、等摩尔当量或更多的基于ag(i)的ag(i)盐和等摩尔当量或更多的碱的情况下,在1,1,1,3,3,3-六氟异丙醇(hfip)溶剂中,在存在下式的经乙酰基保护的氨乙基胺(apaa)配体的(r)或(s)单一对映体的情况下,使2-邻苯二甲酰亚胺基异丁酸与芳基碘接触,以立体选择性地提供β-芳基-2-邻苯二甲酰亚胺基异丁酸,其中β-芳基-2-邻苯二甲酰亚胺基异丁酸产物相应地具有(r)或(s)单一对映体构型:
[0014][0015]
其中ac是乙酰基,每个r是独立选择的甲基或乙基,或者两个r基团和与其键合的氮原子一起形成4至6元杂环基环;并且其中r1是未经取代或经取代的苄基,或者其中r1是(c
3-c4)-烷基。
[0016]
在实施本发明的方法中,apaa配体可具有式:pd(ii)盐可以是pd(oac)2;碳酸盐碱可以是na2co3,或者ag(i)盐可以是ag2co3,或者二者兼备。
[0017]
例如,pd(ii)盐可以以约10摩尔%存在,配体可以以约20摩尔%存在,或者二者兼备。反应可在hfip中,例如在约80℃下进行。
[0018]
发明详述
[0019]
尽管最近使用吡啶/喹啉和mpaa配体取得了进展,但在不安装外部导向基团的情况下进行羧酸的c(sp3)-h键的定向官能化仍然是重大挑战。7这些困难在开发对映选择性c-h活化反应时上升。首先,由于羧基的弱导向能力,游离羧酸的c(sp3)-h活化反应具有低的反应性。其次,金属-羧酸络合物的构象比金属-酰胺导向基团络合物的构象更灵活,这可引起立体控制的问题。事实上,我们先前开发的双齿经乙酰基保护氨基乙基喹啉配体在单特殊底物经邻苯二甲酰基保护的1-氨基环丙烷羧酸的情况下仅具有有限的成功。
2c
因此,我们开始开发可对游离羧酸实现更有效的对映选择性控制的新的配体类型。在本文中,我们报道了能够对广泛多种环丙烷羧酸以及2-氨基异丁酸进行对映选择性c-h芳基化的乙二胺衍生手性配体的开发。
[0020]
手性环丙烷的不对称合成的开发8因为其在生物活性天然产物和药物中的普遍性而持续受到关注。9因此,我们选择了环丙烷羧酸作为模型底物用于我们的配体开发。值得注意的是,我们先前的环丙烷甲酰胺与ar-bpin的对映选择性c-h偶联需要存在α-季碳中心。
2a,10
[0021]
基于我们先前的手性双齿mpaa、喹啉和唑啉配体,经乙酰基保护的氨基(nhac)是手性配体的用于促进c-h切割的特有部分。因此,我们决定使该基序保持完整而用其他σ供体替换羧基、喹啉和唑啉以进行螯合。特别地,我们合成了一系列经乙酰基保护的氨乙基胺(apaa)配体,以实现游离羧酸的对映选择性c(sp3)-h官能化(方案1,表1)。首先,测试了多种n-烷基叔胺配体。尽管在不存在配体的情况下有适度背景反应(表1),但配体的有效结合和可能的配体加速提供了显著的对映选择性。从l1到l4的结果的比较表明,叔胺上的位阻降低了反应性。例如,二异丙胺配体仅提供8%的产物产率,并且几乎没有对映选择性。环胺配体l5和l6在反应性和对映选择性两方面均较差。值得注意的是,用其他保护基替换乙酰基导致完全丧失反应性(l7至l10)。还检测了具有不同侧链的配体。在不同的取代基中,苄基(l1)产生82%的最高产率和97∶3的最高er,而异丙基(l11)、仲丁基(l12)、叔丁基(l13)和异丁基(l14)产生略微较低的产率和对映选择性。出乎意料地,具有苯基的配体(l15)仅提供20%的产率和低对映选择性。受阻较低的高苄基(l16)也降低了反应性和选择性。因此,我们集中于苄基的修饰。在苯基的对位和邻位引入取代基,以及用萘基替换苯基降低了产率(l17至l21)。最后,我们先前的三类手性配体均产生差的产率或对映选择性(l22至l23)。
[0022]
在掌握了高产率和高选择性条件的情况下,我们检测了芳基碘的范围(表2)。大多数包含吸电子和供电子基团的芳基碘以良好产率和高对映选择性(高至98∶2er)提供了所期望的产物。带有吸电子基团例如对甲氧基羰基(3a)、对乙酰基(3b)、对三氟甲基(3d)、间三氟甲基(3k)和邻甲氧基羰基(3t)的芳基碘比其他芳基碘产生略微较高的产率。然而,具有硝基的芳基碘(3c)产生53%的产物产率,以及90∶10er。碘苄腈(3e)也提供了较低的产率但具有高的对映选择性。值得注意的是,包含溴(3h)、膦酸酯(3j)和醛(3m)的芳基碘以高产率和良好的对映选择性提供了所期望的产物。除经取代的苯基碘之外,杂芳基碘,例如2-乙酰基-5-碘噻吩(3u)和5-碘-2-糠醛(3v)也可在该反应中耐受,提供适度产率和高er。使用碘苯甲酸甲酯作为限制试剂和较低银盐负载的反应也提供了较高的产率和对映选择性(3a)。
[0023]
方案1:针对羧酸的对映选择性c(sp3)-h官能化而开发的双齿配体(本发明)
[0024][0025]
(s)绝对构型的所示apaa配体产生了芳基化碳原子处为(s)构型的环丙烷-羧酸,并且产生了芳基化邻苯二甲酰亚胺基异丁酸的(s)-对映体。还制备了方案1中所示的手性配体的相反对映体,并且其显示与这些底物相容,但是以相反对映体产生相应产物(镜像)。
[0026]
还使用碘苯甲酸甲酯作为偶联配偶体测试了广泛多种α-取代的环丙烷羧酸(表3)。1-芳基-1-环丙烷羧酸(5a至5d)(其是药物化学中的重要基序)
11
被芳基化以优异的产率和对映选择性产生所期望的产物。令人感兴趣的是,没有发生α-苯基的c(sp2)-h芳基化。底物的苯基上的氯(5b)、溴(5c)和三氟甲基(5d)取代基均在该反应中良好耐受。α-烷基环丙烷羧酸也是该反应的合适底物。α-乙基(5e)、丁基(5f)和氯戊基(5h)环丙烷羧酸在60℃下的芳基化以良好的产率和er提供了单芳基化产物。出乎意料地,α-苯丙基取代使产率降低至58%(5g)。尽管包含α-苄基的底物(5i和5j)在这些条件下分解,但是用agoac替换ag2co3以适度产率和高对映选择性提供了所期望的产物。经苄基保护的1-羟甲基(5k)和经邻苯二甲酰基保护的1-氨甲基环丙烷羧酸(5l)提供了良好的产率和优异的对映选择性。这些β-羟基和β-氨基-环丙烷羧酸基序是生物活性分子中的重复结构。
12
[0027]
表1.用于环丙烷羧酸的对映选择性芳基化的配体筛选
a,b
[0028][0029]
a
条件:1(0.2mmol),2a(2.0当量),pd(oac)2(10mol%),配体(20mol%),ag2co3(1.5当量),na2co3(1.5当量),hfip(0.25ml),80℃,空气,16小时。
b1
h nmr产率,使用ch2br2作为内标。
[0030]
表2.用于环丙烷羧酸的对映选择性芳基化的芳基碘的范围
a,b
[0031][0032]
a
条件1(0.2mmol),2(2.0当量),pd(oac)2(10mol%),l1(20mol%),ag2co3(1.5当量),na2co3(1.5当量),hfip(0.25ml),80℃,空气,16小时。
b
分离产率。
c
条件2a(0.2mmol),1(2.0当量),pd(oac)2(10mol%),l1(20mol%),ag2co3(1.0当量),na2co3(1.5当量),hfip(0.25ml),80℃,空气,16小时。
d
使用agoac(3.0当量)代替ag2co3(1.5当量),nahco3(1.5当量)代替na2co3(1.5当量)。
f
使用2(1.5当量)。
[0033]
表3.经取代的环丙烷羧酸的对映选择性芳基化
a,b
[0034][0035]
a
条件4(0.2mmol),2a(2.0当量),pd(oac)2(10mol%),l1(20mol%),ag2co3(1.5当量),na2co3(1.5当量),hfip(0.25ml),80℃,空气,16小时。
b
分离产率。c60℃。
d
使用agoac(3.0当量)代替ag2co3(1.5当量),nahco3(1.5当量)代替na2co3(1.5当量),60℃。
[0036]
这种新的手性配体的性能在经邻苯二甲酰基保护的2-氨基异丁酸的对映选择性芳基化中通过偕二甲基的去对称化进一步测试(表4)。这样的反应可为多种手性α-氨基酸的合成提供简单的途径。
[0037]
表4.2-氨基异丁酸的对映选择性芳基化
a,b
[0038][0039]
a
条件:1(0.1mmol),7(2.5当量),pd(oac)2(10mol%),l1(20mol%),agoac(3.0当量),nahco3(1.5当量),hfip,80℃,空气,24小时。
b
分离产率。
c
作为相应的甲酯分离。
[0040]
尽管带有不同取代基的芳基碘产生类似的产物产率,但对映选择性不同。电子中性基团取代的芳基碘产生良好的对映选择性,包含吸电子基团的芳基碘(7a、7b和7g)提供较低的er。由于芳基碘不参与决定对映体的c-h活化步骤,可能的是,来自该特定底物的一种手性环钯中间体在氧化加成步骤中与芳基碘的反应性较低,从而部分有助于对映选择性。将进行进一步的广泛机理研究以使该观察结果合理化。
[0041]
为了进一步证明这种新方法的实用性,对一种有前景的神经障碍候选药物itanapraced
13
进行了后期c-h官能化。反应顺利进行,并且以高产率和优异的对映选择性获得了经修饰的分子(eq 1)。
[0042]
总之,我们已开发了一类新的手性经乙酰基保护氨乙基胺配体,其能够在不使用外源导向基团的情况下对游离羧酸进行对映选择性c-h活化。简单环丙烷羧酸和经邻苯二甲酰基保护的2-氨基异丁酸的对映选择性c-h芳基化为多种手性羧酸的不对称合成提供了新的合成切断。这种新配体与弱配位羧酸匹配用于立体控制的成功设计为理解sp3c-h活化中的手性诱导提供了框架。
[0043]
实施例
[0044]
羧酸从商业来源获得或按照文献方法合成。烷基碘从商业来源获得。溶剂从sigma-aldrich、oakwood和acros获得,并且不经进一步纯化直接使用。在0.25mm硅胶60-f254上进行分析型薄层色谱。用uv光和溴甲酚绿染色剂进行可视化。在bruker drx-600装置(600mhz)上记录1h nmr。参考四甲基硅烷的文献值,以百万分率(parts per million,ppm)引用化学位移。以下缩写(或其组合)用于说明多重性:s=单峰、d=双重峰、t=三重峰、q=四重峰、p=五重峰、m=多重峰、br=宽峰。耦合常数j以赫兹单位(hz)报道。在bruker drx-600装置(150mhz)上记录
13
c nmr谱,并通过宽带质子去耦完全解耦。参考氯仿-d在77.0ppm下的三重峰中心线或丙酮-d6在29.84ppm下的多重峰中心线,以ppm报道化学位移。使用esi-tof(电喷雾电离-飞行时间(electrospray ionization-time of flight))在agilent质谱仪上记录高分辨率质谱(high-resolution mass spectra,hrms)。对映体比例(enantiomeric ratio,er)使用市售手性柱在agilent sfc系统或waters sfc系统上确定。
[0045]
使用例如本领域中公知的化学基团的标准缩写;例如,me=甲基、et=乙基、i-pr=异丙基、bu=丁基、t-bu=叔丁基、ph=苯基、bn=苄基、ac=乙酰基、bz=苯甲酰基,等等。
[0046]
芳基是在环中可以包含或可以不包含杂原子的环状芳香烃。如本领域中公知的,芳香族化合物是包含4n+2π个电子(其中n是整数)的多不饱和环状体系。一些实例包括苯基、萘基、呋喃基、噻吩基、吡啶基和类似的基团。芳基可以是未经取代的,或者可被烷基、卤素、卤代烷基、烷氧基、卤代烷氧基、甲醛(carboxaldehyde)、羧基酯和类似的取代基取代。
[0047]
芳基碘如该术语本文中使用的是指包含一个或更多个芳基环的化合物,其中碘基团与芳基环共价结合。
[0048]
由于手性中心的存在而产生的异构体包含一对不可重叠的异构体,其称为“对映体”。纯化合物的单一对映体具有光学活性,即,其能够使平面偏振光的平面旋转。单一对映体根据cahn-ingold-prelog系统指定。取代基的优先级基于原子量进行排序,如通过系统方法确定的,较高的原子量具有较高的优先级排序。一旦四个基团的优先级排序确定,分子就定向成使得排序最低的基团指向远离观察者。然后,如果其他基团的递减排序顺序顺时针进行,则将该分子指定为具有(r)绝对构型,以及如果其他基团的递减排序逆时针进行,则将该分子指定为具有(s)绝对构型。在以下方案的实例中,cahn-in和ld-prelog排序为a>b>c>d。排序最低的原子d定向远离观察者。实心楔形表示由此键合的原子投射朝向纸平面之外的观察者,并且虚线楔形表示由此键合的原子投射远离纸平面之外的观察者,即,对于以下所示的(r)构型,“纸”平面由原子a、c和手性碳原子限定。
[0049][0050]
如上所示的带有a-d原子的碳原子被称为“手性”碳原子,并且这样的碳原子在分
子中的位置被称为“手性中心”。本发明的化合物可包含多于一个手性中心,并且在每个手性中心处的构型以相同的方式描述。
[0051]
底物结构
[0052]
芳基碘
[0053][0054]
α-取代的环丙烷羧酸
[0055][0056]
配体的制备
[0057]
使用以下程序由相应的市售boc保护氨基酸合成配体l1至l18、l20至l21。l19由经boc保护的(2,6-二苯基苯基)丙氨酸合成,其按照报道的方法合成1。
[0058][0059]
将相应的经boc保护的氨基酸(s1)(5mmol)、二甲基氯化铵(11mmol,0.90g)和苯并三唑-1-醇水合物(hobt)(5mmol,0.77g)添加至配备有磁力搅拌棒的圆底烧瓶。将固体混合物溶解在dcm(50ml)中,并在0℃下添加1-乙基-(3-(3-二甲基氨基)丙基)-碳二亚胺盐酸盐(edc)(6mmol,1.15g)。将所得溶液在0℃下搅拌,同时缓慢添加n-乙基-n,n-二异丙胺(dipea)(12mmol,1.55g,2.09ml)。允许反应溶液升温至室温并搅拌约3小时,在此之后将溶液倒入分液漏斗中,用另外的dcm稀释至150ml,并用约25ml的10%w/w柠檬酸水溶液洗涤。分离有机层并随后用各自为25ml的饱和nahco3水溶液和盐水洗涤。将有机物经无水na2so4干燥,过滤,并真空浓缩以提供相应的酰胺(s2),其可不经进一步纯化而直接用于下一步。
[0060]
向经boc保护的氨基酰胺(s2)添加4n hcl/二氧六环溶液(5ml)。将所得溶液在室温下搅拌2小时。然后,将挥发性组分真空蒸发,并随后将残余物用于后续还原步骤。
[0061]
在0℃下在n2下向s3在thf(10ml)中的溶液滴加lialh4在thf中的溶液(2.4m,3.12ml,7.5mmol)。然后,将混合物加热至回流持续12小时,然后冷却并用醚稀释。将混合物冷却至0℃,并缓慢添加0.28ml水,随后添加15%w/w的naoh水溶液(0.28ml)和水(0.84ml)。然后将所得混悬液升温至室温并搅拌15分钟,然后添加mgso4。将混合物搅拌另外的15分钟,然后过滤。收集滤出物,并真空去除溶剂,以提供二胺化合物(s4),其可不经纯化而用于
下一步。
[0062]
在0℃下向合成的二胺化合物(s4)在dcm(10ml)中的溶液添加乙酰氯(10mmol,0.78g,0.71ml)。然后将溶液在室温下搅拌2小时。将挥发性组分真空蒸发,并将残余物溶解在10ml水中。将所得溶液用醚萃取(10ml
×
3),然后将水相用15%w/w的naoh水溶液碱化直至ph>13。将碱化的混合物用醚萃取(10ml
×
3),并浓缩有机层以提供所期望的apaa配体。这些化合物通常足够纯,以用于后续pd催化的c-h官能化。可通过重结晶或反相快速柱(reversed phase flash column)进行进一步纯化。
[0063][0064]
(s)-n-(1-(二甲基氨基)-3-苯基丙-2-基)乙酰胺(l1)
[0065]
按照标准程序合成l1,并且可通过重结晶纯化以提供白色固体。
[0066]1h nmr(600mhz,cdcl3)δ7.29(t,j=7.5hz,2h),7.22(1t,j=6.9,1.5hz,1h),7.18(d,j=7.2hz,2h),5.56(br-d,j=8.4hz,1h,n-h)4.22-4.16(m,1h),2.97(dd,j=13.8,4.8hz,1h),2.84(dd,j=13.8,6.6hz,1h),2.29(dd,j=12.6,9.0hz,1h),2.19(s,6h),2.16(dd,j=12.3,5.7hz,1h),1.96(s,3h);
13
c nmr(150mhz,cdcl3)δ170.27,137.85,129.85,128.45,126.52,61.56,48.28,45.70,38.59,23.72.
[0067][0068]
(s)-n-(1-(乙基(甲基)氨基)-3-苯基丙-2-基)乙酰胺(l2)
[0069]
使用乙基甲基胺(6mmol)合成相应的经boc保护的氨基酰胺。然后,按照标准程序,获得为浅黄色固体的l2,其不经进一步纯化即可使用。
[0070]1h nmr(600mhz,cdcl3)δ7.29(t,j=7.8hz,2h),7.23-7.18(m,3h),5.76(br,1h,n-h),4.22-4.17(m,1h),2.98(dd,j=13.8,5.4hz,1h),2.84(dd,j=13.6,6.9hz,1h),2.48-2.43(dq,j=12.6,7.2hz,1h),2.41-2.36(m,2h),2.26(dd,j=12.6,6.0hz,1h),2.19(s,3h),1.96(s,3h),1.00(t,j=7.2hz,3h);3c nmr(150mhz,cdcl3)δ170.29,137.99,129.78,128.45,126.50,59.02,51.53,48.24,41.72,38.72,23.70,12.00.
[0071][0072]
(s)-n-(1-(二乙基氨基)-3-苯基丙-2-基)乙酰胺(l3)
[0073]
根据报道的方法合成相应的经boc保护的氨基酰胺。2然后,按照标准程序,获得为浅黄色固体的l3,其不经进一步纯化即可使用。
[0074]1h nmr(600mhz,cdcl3)δ7.29(t,j=7.5hz,2h),7.22-7.19(m,3h),5.7s(br-d,j=3.6hz,1h,n-h),4.16-4.11(m,1h),2.96(dd,j=13.8,5.4hz,1h),2.86(dd,j=13.8,6.6hz,1h),2.56-2.45(m,4h),2.40(dd,j=12.3,8.1hz,1h),2.36(dd,j=12.36.3hz,1h),
1.94(s,3h),0.95(t,j=7.2hz,6h);
13
c nmr(150mhz,cdcl3)δ170.24,138.26,129.65,128.39,126.39,55.43,48.70,47.03,38.74,23.68,11.68.
[0075][0076]
(s)-n-(1-(二异丙基氨基)-3-苯基丙-2-基)乙酰胺(l4)
[0077]
根据报道的方法合成相应的经boc保护的氨基酰胺。3然后,按照标准程序,获得为浅黄色固体的l4,其不经进一步纯化即可使用。
[0078]1h nmr(600mhz,cdcl3)δ7.29-7.26(m,2h),7.21-7.18(m,3h),5.68(br-d,j=4.8hz,1h,n-h),4.04-3.98(m,1h),3.00-2.94(m 3h),2.87(dd,j=8.1,6.3hz,1h),2.46(dd,j=13.2,6.6hz,1h),2.41(dd,j=13.4,8.7hz,1h),1.93(s,3h),0.96(d,j=7.2hz,6h),0.95(d,j=6.6hz,6h);
13
c nmr(150mhz,cdcl3)δ170.37,138.69,129.56,128.37,126.30,49.38,47.93,47.56,38.91,23.67,21.68,20.31.
[0079][0080]
(s)-n-(1-(氮杂环丁烷-1-基)-3-苯基丙-2-基)乙酰胺(l5)
[0081]
使用氮杂环丁烷(20mmol)合成相应的经boc保护的氨基酰胺。然后,按照标准程序,获得为浅黄色固体的l5,其不经进一步纯化即可使用。
[0082]1h nmr(600mhz,cdcl3)δ7.30-7.27(m,2h),7.21(tt,j=7.5,1.4hz,1h),7.19-7.17(m,2h),5.69(br-d,j=6.0hz,1h,n-h),4.08-4.02(m,1h),3.24-3.19m,4h),2.89(dd,j=13.8,6.0hz,1h),2.78(dd,j=13.8,7.2hz,1h),2.42(abq-d,j
ab
=12.4hz,δδ=0.02,j3=6.9,5.4hz,2h),2.06(p,j=7.2hz,2h),1.95(s,3h);
13
c nmr(150mhz,cdcl3)δ169.93,138.10,129.62,128.48,126.50,61.45,56.17,49.13,38.65,23.72,18.05.
[0083][0084]
(s)-n-(1-苯基-3-(吡咯烷-1-基)丙-2-基)乙酰胺(l6)
[0085]
根据报道的方法合成相应的经boc保护的氨基酰胺。4然后,按照标准程序,获得为浅黄色固体的l6,其不经进一步纯化即可使用。
[0086]1h nmr(600mhz,cdcl3)δ7.29(t,j=7.5hz,2h),7.23-7.18(m,3h),5.63(br-d,j=4.2hz,1h,n-h),4.23-4.17(m,1h),2.97(dd,j=13.5,5.1hz,1h),2.85(dd,j=13.5,6.9hz,1h),2.53-2.50(m,3h),2.47-2.43(m,2h),2.36(dd,j=12.6,6.0hz,1h),1.96(s,3h),1.75-1.72(m,4h);
13
c nmr(150mhz,cdcl3)δ170.14,138.02,129.85,128.42,126.47,58.11,54.36,49.46,38.75,23.77,23.72.
[0087][0088]
(s)-n-(1-(二甲基氨基)-3-苯基丙-2-基)特戊酰胺(l7)
[0089]
将相应的二胺s3用特戊酰氯(10mmol,1.20g,1.22ml)酰化,作为浅黄色固体提供l7,其不经进一步纯化即可使用。
[0090]1h nmr(600mhz,cdcl3)δ7.28(t,j=7.5hz,2h),7.21(1t,j=7.5,1.5hz,1h),7.19-7.15(m,2h),5.83(br-d,j=5.4hz,1h,n-h),4.14-4.09(m,1h),2.97(dd,j=13.5,5.1hz,1h),2.88(dd,j=13.2,6.6hz,1h),2.29(dd,j=12.3,8.1hz,1h),2.21-2.18(m,7h),1.14(s,9h);
13
c nmr(150mhz,cdcl3)δ178.63,138.04,129.91,128.37,126.46,61.47,48.14,45.69,38.89,38.43,27.67.
[0091][0092]
(s)-n-(1-(二甲基氨基)-3-苯基丙-2-基)苯甲酰胺(l8)
[0093]
将相应的二胺s3用苯甲酰氯(7.5mmol,1.05g,0.87ml)酰化,作为浅黄色固体提供l7,其不经进一步纯化即可使用。
[0094]1h nmr(600mhz,cdcl3)δ7.74-7.73(m,2h),7.48(tt,j=7.5,1.5hz,1h),7.42(t,j=7.5hz,2h),7.31-7.29(m,2h),7.24-7.22(m,3h),6.37(br-d,j=4.8hz,1h,n-h),4.37-4.32(m,1h),3.14(dd,j=13.5,4.5hz,1h),2.99(dd,j=13.5,6.9hz,1h),2.42(dd,j=12.0,9.0hz,1h),2.27(dd,j=12.6,6.0hz,1h),2.22(s,6h);
13
c nmr(150mhz,cdcl3)δ16769,137.87,135.05,131.50,129.99,128.67,128.49,127.07,126.57,61.36,48.71,45.72,38.49.
[0095][0096]
(s)-(1-(二甲基氨基)-3-苯基丙-2-基)氨基甲酸叔丁酯(l9)
[0097]
将相应的二胺s3用boc2o(7.5mmol,1.64g)酰化,作为白色固体提供l9,其不经进一步纯化即可使用。
[0098]1h nmr(600mhz,cdcl3)δ7.28(t,j=7.5hz,2h),7.22-7.18(m,3h),4.67(br,1h,n-h),3.87(br,1h),2.94-2.92(br-m,1h),2.83(dd,j=13.5,6.3hz,1h),2.28-2.25(br-m,1h),2.21(s,6h),2.17(dd,j=12.3,6.3hz,1h),1.42(s,9h);
13
c nmr(150mhz,cdcl3)δ155.87,138.10,129.84,128.39,126.38,79.30,61.93,49.49,45.69,39.02,28.54.
[0099][0100]
(s)-(1-(二甲基氨基)-3-苯基丙-2-基)氨基甲酸苄酯(l10)
[0101]
将相应的二胺s3用氯甲酸苄酯(7.5mmol,1.28g)酰化,作为无色油状物提供l10,其不经进一步纯化即可使用。
[0102]1h nmr(600mhz.cdcl3)δ7.37-7.30(m,5h),7.27(t,j=7.2hz,2h),7.21(tt,j=7.5,1.5hz,2h),7.16(d,j=7.2hz,2h),5.12(d,j=12.0hz,1h),5.06(d,j=12.0hz,1h),4.95(br,1h,n-h),3.94-3.92(br-m,1h),2.99-2.96(br-m,1h),2.84(dd,j=13.8,6.6hz,1h),2.27(dd,j=12.0,9.0hz,1h),2.20-2.16(m,7h);
13
c nmr(150mhz,cdcl3)δ156.33,137.81,136.84,129.82,128.63,128.47,128.16,128.15,126.51,66.64,61.96,5010,45.71,38.99.
[0103][0104]
(s)-n-(1-(二甲基氨基)-3-甲基丁-2-基)乙酰胺(l11)
[0105]
按照标准程序作为无色油状物合成l11,并且不经进一步纯化即可使用。
[0106]1h nmr(600mhz,cdcl3)δ5.50(br-d,j=4.8hz,1h,n-h),3.96-3.91(m,1h),2.35(dd,j=12.0,9.6hz,1h),2.22(s,6h),2.20(dd,j=12.6,5.4hz,1h),2.01(s,3h),1.98-1.93(m,1h),0.90(d,j=6.6hz,3h),0.88(d,j=7.2hz,3h);
13
c nmr(150mhz,cdcl3)δ170.34,60.15,51.78,45.86,30.25,23.78,18.81,17.80.
[0107][0108]
n-((2s,3s)-1-(二甲基氨基)-3-甲基戊-2-基)乙酰胺(l12)
[0109]
按照标准程序作为无色油状物合成l12,并且不经进一步纯化即可使用。
[0110]1h nmr(600mhz,cdcl3)65.57(br-d,j=6.0hz,1h,n-h),3.98-3.93(m,1h),2.36(dd,j=12.6,4.2hz,1h),2.20(s,6h),2.16(dd,j=12.3,5.1hz,1h),2.00(s,3h),1.80-1.75(m,1h),1.47-1.40(m,1h),1.13-1.05(m,1h),0.92(t,j=7.5hz,3h),0.86(d,j=6.6hz,3h);
13
c nmr(150mhz,cdcl3)δ170.24,59.17,51.21,45.85,36.95,25.49,23.82,14.70,12.17.
[0111][0112]
(s)-n-(1-(二甲基氨基)-3,3-二甲基丁-2-基)乙酰胺(l13)
[0113]
按照标准程序作为白色固体合成l13,并且通过反相柱纯化。
[0114]1h nmr(600mhz,cdcl3)δ5.321(br-d,j=6.0hz,1h,n-h),3.94(ddd,j=10.9,9.8,3.9hz,1h),2.32(dd,j=12.3,11.1hz,1h),2.25(dd,j=12.3,9.9hz,1h),2.20(s,6h),
2.02(s,3h),0.91(s,9h);
13
c nmr(150mhz,cdcl3)δ170.42,59.55,54.41,45.87,34.61,26.64,23.85.
[0115][0116]
(s)-n-(1-(二甲基氨基)-4-甲基戊-2-基)乙酰胺(l14)
[0117]
按照标准程序作为白色固体合成l14,并且通过反相柱纯化。
[0118]1h nmr(600mhz,cdcl3)δ5.50(br-d,j=8.4hz,1h,n-h),4.10-4.04(m,1h),2.33(dd,j=12.3,8,1hz,1h),2.24(s,6h),2.21(dd,j=12.6,6.0hz,1h),1.98(s,3h),1.68-1.61(m,1h),1.39-1.31(m,2h),0.93(d,j=6.0hz,3h),0.92(d,j=6.6hz,3h);
13
c nmr(150mhz,cdcl3)δ169.98,63.86,46.01,45.89,43.35,25.02,23.73,23.24,22.52.
[0119][0120]
(s)-n-(2-(二甲基氨基)-1-苯乙基)乙酰胺(l15)
[0121]
按照标准程序作为浅黄色固体合成l15,并且不经进一步纯化即可使用。
[0122]1h nmr(600mhz,cdcl3)δ7.32(t,j=7.2hz,2h),7.28-7.26(m,2h),7.24-7.22(m,1h),6.24(br,1h,n-h),4.88(dt,j=10.5,5.4hz,1h),2.58(dd,j=12.9,9.9hz,1h),2.41(dd,j=12.6,5.4hz,1h),2.24(s,6h),2.04(s,3h);
13
c nmr(150mhz,cdcl3)δ170.17,141.54,128.67,127.35,126.29,64.80,51.92,45.56,23.55.
[0123][0124]
(s)-n-(1-(二甲基氨基)-4-苯基丁-2-基)乙酰胺(l16)
[0125]
按照标准程序作为无色油状物合成l16,并且不经进一步纯化即可使用。
[0126]1h nmr(600mhz,cdcl3)δ7.27(t,j=7.5hz,2h),7.20-7.16(m,3h),5.54(br-d,j=6.6hz,1h,n-h),4.06-4.00(m,1h),2.68-2.65(m,2h),2.38(dd,j=12.3,8.7hz,1h),2.24(dd,j=12.3,5.7hz,1h),2.21(s,6h),1.97(s,3h),1.93-1.88(m,1h),1.81-1.75(m,1h);
13
c nmr(150mhz,cdcl3)δ170.23,142.08,128.52,128.48,125.99,63.10,47.71,46.00,35.46,32.27,23.73.
[0127]
[0128]
(s)-n-(1-(二甲基氨基)-3-(4-甲氧基苯基)丙-2-基)乙酰胺(l17)
[0129]
按照标准程序作为浅黄色固体合成l17,并且不经进一步纯化即可使用。
[0130]1h nmr(600mhz,cdcl3)δ7.10-7.08(m,2h),6.84-6.82(m,2h),5.55(br-d,j=7.2hz,1h,n-h),4.17-4.11(m,1h),3.79(s,3h),2.90(dd,j=13.8,4.8hz,1h),2.79(dd,j=13.8,6.6hz,1h),2.27(dd,j=12.3,9.3hz,1h),2.19(s,6h),2.15(dd,j=12.3,5.7hz,1h),1.96(s,3h);
13
c nmr(150mhz,cdcl3)δ170.22,158.33,130.78,129.78,113.85,61.52,55.35,48.35,45.71,37.59,23.74.
[0131][0132]
(s)-n-(1-(2,6-二氟苯基)-3-(二甲基氨基)丙-2-基)乙酰胺(l18)
[0133]
按照标准程序作为浅黄色固体合成l18,并且不经进一步纯化即可使用。
[0134]1h nmr(600mhz,cdcl3)δ7.19-7.14(m,1h),6.88-6.84(m,2h),5.60(br-d,j=7.8hz,1h,n-h),4.29-4.23(m,1h),3.08(dd,j=13.8,5.4hz,1h),2.81(dd,j=13.8,7.8hz,1h),2.40(dd,j=12.3,8.7hz,1h),2.27-2.23(m,7h),1.90(s,3h);
13
c nmr(150mhz,cdcl3)δ170.24,161.94(dd,j=245,8hz),128.32(t,j=10hz),114.14(t,j=20hz),111.16(dd,j=20,4.5hz),62.50,47.68,46.78,26.02,23.51;
19
f nmr(376mhz,cdcl3)δ-114.52(s,2f);
[0135][0136]
(s)-n-(1-([1,1’:3’,1
”-
三联苯]-2
’-
基)-3-(二甲基氨基)丙-2-基)乙酰胺(l19)
[0137]
按照标准程序合成l19,并且可通过重结晶纯化以提供白色固体。
[0138]1h nmr(600mhz,cdcl3)δ7.46-7.41(m,8h),7.38-7.35(m,2h),7.29-7.27(m,1h),7.18(d,j=7.8hz,2h),4.60(br-d,j=9.6hz,1h),3.77-2.70(m,1h),3.12(d,j=13.8,4.2hz,1h),2.80(d,j=14.4,10.8hz,1h),1.85(dd,j=12.0,6.6hz,1h),1.72(s,6h),1.69(s,3h),1.61(dd,j=12.0,7.8hz,1h);
13
c nmr(150mhz,cdcl3)δ169.16,143.49,142.56,133.60,129.92,129.75,128.52,127.18,126.19,64.15,48.22,45.36,32.54,23.57.
[0139][0140]
(s)-n-(1-(二甲基氨基)-3-(萘-2-基)丙-2-基)乙酰胺(l20)
[0141]
按照标准程序作为浅黄色固体合成l20,并且不经进一步纯化即可使用。
[0142]1h nmr(600mhz,cdcl3)δ7.82-7.87(m,3h),7.62(s,1h),7.47-7.42(m,2h),7.35
[0153][0154]
将二异丙基胺基锂(12mmol)在thf/己烷(30ml)中的新鲜制备溶液冷却至-78℃。在5分钟内缓慢滴加环丙烷羧酸叔丁酯(s7)(10mmol,1.42g)在thf(10ml)中的溶液。将所得溶液在-78℃下搅拌2小时。在10分钟内缓慢滴加烷基溴(30mmol)在thf(10ml)中的溶液。然后使溶液缓慢升温至室温并搅拌过夜。然后,通过添加饱和氯化铵水溶液使反应淬灭。将水相用乙醚萃取两次。将合并的有机相用盐水洗涤,经硫酸钠干燥,过滤并真空浓缩。然后将产物(s8)通过硅胶快速色谱进行纯化(通常在己烷中的3%v/v醚)。
[0155]
将10ml在二氧六环中的4n hcl添加至预先制备的叔丁酯中,并向该溶液添加0.5ml水(警告:放热过程)。将混合物在室温下搅拌24小时。将反应溶液真空浓缩,并随后将残余物溶解在甲醇中。将所得溶液经硫酸钠干燥,过滤并浓缩,产生所期望的游离酸,其纯度通常足以不经进一步纯化即可向前进行pd催化的反应。已报道了4e8和4i9的波谱。
[0156][0157]
1-丁基环丙烷-1-羧酸(4f)
[0158]1h nmr(600mhz,cdcl3)δ1.52-1.49(m,2h),1.47-1.42(m,2h),1.30(q,j=7.4hz,2h),1.27-1.25(m,2h),0.89(t,j=7.2,3h),0.76-0.74(m,2h);
13
c nmr(150 mhz,cdcl3)δ182.13,33.46,29.88,23.44,23.02,16.59,14.16.
[0159][0160]
1-(3-苯基丙基)环丙烷-1-羧酸(4g)
[0161]1h nmr(600mhz,cdcl3)δ7.28-7.25(m,2h),7.18-7.16(m,3h),2.61(t,j=7.8hz,2h),1.84-1.78(m,2h),1.57-1.54(m,2h),1.27-1.26(m,2h),0.74-0.73(m.2h);
13
c nmr(150mhz,cdcl3)δ182.57,142.46,128.49,128.42,125.84,36.12,33.41,29.34,28.22,23.41,16.70.
[0162][0163]
1-(5-氯戊基)环丙烷-1-羧酸(4h)
[0164]1h nmr(600mhz,cdcl3)δ3.53(t,j=6.6hz,2h),1.78(p,j=7.2hz,2h),1.53-1.49(m,4h),1.45-1.40(m,2h),1.29-1.27(m,2h),0.77-0.75(m,2h);
13
c nmr(150mhz,cdcl3)δ182.27,45.20,33.61,32.63,27.13,26.98,23.38,16.69.
[0165]
[0166]
1-(4-氟苄基)环丙烷-1-羧酸(4j)
[0167]1h nmr(600mhz,cdcl3)δ7.21-7.18(m,2h),6.97-6.93(m,2h),2.92(s,2h),1.36-1.35(m,2h),0.88-0.86(m,2h);
13
c nmr(150mhz,cdcl3)δ181.94,161.69(d,j=243hz),134.99(d,j=3hz),130.70(d,j=8hz),115.08(d,j=21hz),37.26,23.89,16.22;
19
f nmr(376mhz,cdcl3)δ-117.33(s,1f).
[0168][0169]
向已在冰浴中冷却的矿物油中60%氢化钠(nah)(0.120g,30.0mmol)在无水thf(10ml)中的搅拌混悬液添加甲基1-羟甲基环丙烷羧酸(10.0mmol,1.30g)。将所得混悬液在室温下搅拌20分钟。在0℃下缓慢添加苄基溴(10.0mmol,1.71g,1.21ml),并将反应在室温下搅拌过夜。将反应混悬液在冰浴中冷却,并将过量的nah用水(15ml)淬灭。将反应混合物用乙酸乙酯萃取(3
×
25ml)。将合并的有机物经mgso4干燥,过滤并浓缩。将残余物通过快速色谱(硅胶,己烷中的10%乙酸乙酯)进行纯化,递送s10。
[0170]
将s10溶解在thf(32ml)、水(32ml)和meoh(16ml)的混合物中,并随后添加lioh
·
h2o(30mmol,0.126g)。将所得混合物搅拌过夜,并随后通过添加3m hcl溶液酸化。将混合物用乙酸乙酯萃取。然后将合并的有机层经na2so4干燥,过滤并真空浓缩,提供4k,其可不经进一步纯化而直接用于pd催化的反应。
[0171][0172]
1-((苄氧基)甲基)环丙烷-1-羧酸(4k)
[0173]1h nmr(600mhz,cdcl3)δ7.37-7.32(m,4h),7.31-7.28(m,1h),4.59(s,2h),3.61(s,2h),1.36-1.34(m,2h),0.94-0.93(m,2h);
13
c nmr(150mhz,cdcl3)δ178.28,137.83,128.63,127.99,127.91,73.35,71.80,23.55,14.66.
[0174][0175]
将偶氮二甲酸二乙酯(7.50mmol)添加至1-羟甲基环丙烷羧酸甲酯(651mg,5.00mmol)、三苯基膦(1.97g,7.50mmol)和邻苯二甲酰亚胺(1.103g,7.50mmol)在thf(12ml)中的冷却(0℃)溶液中。在室温下搅拌12小时之后,将反应混合物在真空下浓缩,并在硅胶上通过柱色谱纯化(洗脱剂∶etoac/己烷=1∶5),产生s11。
[0176]
将naoh(6.00mmol,0.240g)添加至s11(3.00mmol)在二氧六环(6ml)和h2o(3ml)中的冷却(0℃)溶液。将反应混合物在室温下搅拌3小时,然后倒入2n hcl(5ml)中,并用etoac萃取。将合并的有机层用盐水洗涤,经无水na2so4干燥,过滤并浓缩。将残余物加热至150℃
保持1小时,并随后冷却至室温。将固体通过快速色谱纯化(洗脱剂∶etoac/己烷=1∶1以及1%v/v hoac),产生作为白色固体的4l。
[0177][0178]
1-((1,3-二氧代异吲哚啉-2-基)甲基)环丙烷-1-羧酸(4l)
[0179]1h nmr(600mhz,cdcl3)δ7.86-7.83(m,2h),7.74-7.70(m,2h),4.01(s,2h),1.38-1.36(m,2h),1.23-1.10(m,2h);
13
c nmr(151mhz,cdcl3)δ179.98,168.44,134.17,132.04,123.52,39.98,22.48,15.76.
[0180]610
和8
11
按照报道的方法合成。
[0181]
环丙烷羧酸的对映选择性芳基化
[0182][0183]
用于环丙烷羧酸的对映选择性芳基化的通用方法:在配备有磁力搅拌棒的2-打兰(dram)小瓶中装入在hfip(0.25ml)中的pd(oac)2(4.4mg,10mol%)和l1(8.8mg,20mol%)。然后添加合适的环丙烷羧酸底物(0.20mmol)、ag2co3(82.7mg,0.30mmol)、na2co3(31.8mg,0.30mmol)和芳基碘(0.40mmol)。随后,将小瓶加盖并盖紧。然后将反应混合物在80℃下以200rpm的速率搅拌16小时。在使冷却至室温之后,将混合物用乙酸乙酯稀释,并随后添加0.1ml乙酸。使混合物通过用乙酸乙酯作为洗脱剂的硅藻土垫,以去除任何不溶的沉淀物。将所得溶液浓缩,并将残余的混合物用最少量的丙酮溶解,并上样到制备型tlc板上。然后使用制备型tlc分离纯的产物,其中乙酸乙酯和己烷(1/4至1/1)作为洗脱剂并且1%v/v的乙酸作为添加剂。
[0184][0185]
(1r,2s)-2-(4-(甲氧基羰基)苯基)环丙烷-1-羧酸(3a)
[0186]
按照一般芳基化程序使底物1芳基化(洗脱剂:己烷/乙酸乙酯=2/1以及1%v/v的乙酸)。获得为白色固体的产物(80%产率)。
[0187]
底物的对映体纯度通过sfc分析确定(ia-3柱,15%(包含0.5%hco2h的meoh)/co2,流速4ml/分钟,保留时间1.734分钟(主要)和2.616分钟(次要),97∶3er);
[0188]1h nmr(600mhz,cdcl3)δ7.92(d,j=8.4hz,2h),7.29(d,j=8.4hz,2h),3.91(s,3h),2.63(q,j=8.6hz,1h),2.08(ddd,j=9.2,7.9,5.7hz,1h),1.69(dt,j=7.5,5.4hz,1h),1.42(td,j=8.2,5.2hz,1h);
13
c nmr(150mhz,cdcl3)δ176.27,167.21,141.51,129.46,129.39,128.74,52.18,26.48,21.81,12.40;
[0189]
c
12
h
13
o
4+
[m+h]
+
的hrms(esi-tof)m/z的计算值:221.0808,实测值:221.0814;
[0190]
基于将3s的旋光度与文献进行比较分配绝对立体化学。
[0191]
3a也可按照标准条件获得,不同之处在于:使用环丙烷羧酸(0.40mmol)、芳基碘(0.20mmol)和ag2co3(0.20mmol),作为白色固体,产率为85%以及96∶4er。
[0192][0193]
(1r,2s)-2-(4-乙酰基苯基)环丙烷-1-羧酸(3b)
[0194]
按照一般芳基化程序使底物1芳基化(洗脱剂:己烷/乙酸乙酯=2/1以及1%v/v的乙酸)。获得为白色固体的产物(83%产率)。
[0195]
底物的对映体纯度通过sfc分析确定(ig-3柱,25%(包含0.5%hco2h的meoh)/co2,流速4ml/分钟,保留时间1.922分钟(次要)和2.268分钟(主要),96∶4er);
[0196]1h nmr(600mhz,cdcl3)δ7.84(d,j=8.4hz,2h),7.32(d,j=7.8hz,2h),2.64(q,j=8.6hz,1h),2.58(s,3h),2.10(ddd,j=9.1,7.9,5.7hz,1h),1.71(dt,j=7.7,5.4hz,1h),1.44(td,j=8.2,5.2hz,1h);
13
c nmr(150mhz,cdcl3)δ198.11,176.15,141.79,135.82,129.63,128.20,26.74,26.48,21.86,12.45;
[0197]
c
12
h
13
o
3+
[m+h]
+
的hrms(esi-tof)m/z的计算值:205.0859,实测值:205.0857;
[0198]
基于将3s的旋光度与文献进行比较分配绝对立体化学。
[0199][0200]
(1r,2s)-2-(4-硝基苯基)环丙烷-1-羧酸(3c)
[0201]
按照一般芳基化程序使底物1芳基化(洗脱剂:己烷/乙酸乙酯=1/1以及1%v/v的乙酸)。获得为浅黄色固体的产物(53%产率)。
[0202]
底物的对映体纯度通过sfc分析确定(ig-3柱,10%(包含0.5%hco2h的meoh)/co2,流速4ml/分钟,保留时间4.443分钟(次要)和4.907分钟(主要),90∶10er);
[0203]1h nmr(600mhz,cdcl3)δ8.11(d,j=9.0hz,2h),7.39(d,j=8.4hz,2h),2.67(q,j=8.5hz,1h),2.15(ddd,j=9.0,8.1,5.7hz,1h),1.72(dt,j=7.6,5.5hz,1h),1.50(td,j=8.2,5.3hz,1h);
13
c nmr(150mhz,cdcl3)δ176.03,147.00,143.86,130.30,123.29,26.21,22.06,12.73.
[0204]
c
10
h
10
no
4+
[m+h]
+
的hrms(esi-tof)m/z的计算值:208.0604,实测值:208.0607。
[0205]
基于将3s的旋光度与文献进行比较分配绝对立体化学。
[0206][0207]
(1r,2s)-2-(4-(三氟甲基)苯基)环丙烷-1-羧酸(3d)
[0208]
按照一般芳基化程序使底物1芳基化(洗脱剂:己烷/乙酸乙酯=4/1以及1%v/v的乙酸)。获得为浅黄色油状物的产物(86%产率)。
[0209]
底物的对映体纯度通过sfc分析确定(as-3柱,5%iproh/co2,流速1.0ml/分钟,保留时间5.853分钟(主要)和6.402分钟(次要),97∶3er);
[0210]1h nmr(600mhz,cdcl3)δ7.49(d,j=8.4hz,2h),7.32(d,j=8.4hz,2h),2.64(q,j=8.6hz,1h),2.09(ddd,j=9.2,7.8,5.6hz,1h),1.69(dt,j=7.7,5.4hz,1h),1.50(ddd,j=8.6,7.8,5.3hz,1h);
13
c nmr(150mhz,cdcl3)δ176.59,140.17,129.75,129.12(q,j=32hz),124.98(q,j=4hz),124.38(q,j=270hz),26.25,21.74,12.32;
19
f nmr(376mhz,cdcl3)δ-62.70(s,3f);
[0211]
c
11
h
10
f3o
2+
[m+h]
+
的hrms(esi-tof)m/z的计算值:231.0627,实测值:231.0631。
[0212]
基于将3s的旋光度与文献进行比较分配绝对立体化学。
[0213][0214]
(1r,2s)-2-(4-氰基苯基)环丙烷-1-羧酸(3e)
[0215]
按照一般芳基化程序使底物1芳基化,不同之处在于:使用agoac(3.0当量)和nahco3(1.5当量)代替ag2co3和na2co3。(洗脱剂:己烷/乙酸乙酯=1/1以及1%v/v的乙酸)。获得为浅黄色固体的产物(53%产率)。
[0216]
底物的对映体纯度通过sfc分析确定(ig-3柱,15%(包含0.5%hco2h的meoh)/co2,流速4ml/分钟,保留时间1.940分钟(次要)和2.366分钟(主要),96∶4er);
[0217]1h nmr(600mhz,cdcl3)δ7.54(d,j=8.4hz,2h),7.33(d,j=8.4hz,2h),2.64(q,j=8.6hz,1h),2.12(ddd,j=9.2,7.9,5.7hz,1h),1.69(dt,j=7.7,5.5hz,1h),1.50(td,j=8.2,5.3hz,1h);
13
c nmr(150mhz,cdcl3)δ176.38,141.71,131.84,130.22,119.06,110.68,26.44,21.98.12.43;
[0218]
c
11
h
10
no
2+
[m+h]
+
的hrms(esi-tof)m/z的计算值:188.0706,实测值:188.0704。
[0219]
基于将3s的旋光度与文献进行比较分配绝对立体化学。
[0220][0221]
(1r,2s)-2-(4-氟苯基)环丙烷-1-羧酸(3f)
[0222]
按照一般芳基化程序使底物1芳基化(洗脱剂:己烷/乙酸乙酯=4/1以及1%v/v的乙酸)。获得为浅黄色固体的产物(73%产率)。
[0223]
底物的对映体纯度通过sfc分析确定(ig-3柱,7%(包含0.5%hco2h的
i
proh)/co2,流速4ml/分钟,保留时间2.492分钟(主要)和3.108分钟(次要),96∶4er);
[0224]1h nmr(600mhz,cdcl3)δ7.19(dd,j=8.4,5.4hz,2h),7.32(t,j=8.7hz,2h),2.59
(q,j=8.5hz,1h),2.09(td,j=8.4,6.2hz,1h),1.69(dt,j=7.8,5.4hz,1h),1.50(ddd,j=8.6,8.0,5.1hz,1h);
13
c nmr(150mhz,cdcl3)δ176.27,161.90(d,j=243hz),131.71(d,j=3hz),130.90(d,j=8hz),114.95(d,j=21hz),25.87,21.38,12.33;
19
f nmr(376mhz,cdcl3)δ-116.17(s,1f);
[0225]
c
10
h
10
fo
2+
[m+h]
+
的hrms(esi-tof)m/z的计算值:181.0659,实测值:181.0658。
[0226]
基于将3s的旋光度与文献进行比较分配绝对立体化学。
[0227][0228]
(1r,2s)-2-(4-氯苯基)环丙烷-1-羧酸(3g)
[0229]
按照一般芳基化程序使底物1芳基化(洗脱剂:己烷/乙酸乙酯=4/1以及1%v/v的乙酸)。获得为浅黄色固体的产物(70%产率)。
[0230]
底物的对映体纯度通过sfc分析确定(ia-3柱,5%(包含0.5%hco2h的meoh)/co2,流速4ml/分钟,保留时间3.060分钟(主要)和3.580分钟(次要),96∶4er);
[0231]1h nmr(600mhz,cdcl3)δ7.22(d,j=8.4,2h),7.32(d,j=8.4hz,2h),2.58(q,j=8.6hz,1h),2.06(ddd,j=8.2,7.3,5.1hz,1h),1.64(dt,j=7.7,5.4hz,1h),1.39(ddd,j=8.6,7.8,5.1hz,1h);
13
c nmr(150mhz,cdcl3)δ175.98,134.56,132.72,130.75,128.26,25.98,21.50,12.31;
[0232]
c
10
h
10
clo
2+
[m+h]
+
的hrms(esi-tof)m/z的计算值:197.0364,实测值:197.0362。
[0233]
基于将3s的旋光度与文献进行比较分配绝对立体化学。
[0234][0235]
(1r,2s)-2-(4-溴苯基)环丙烷-1-羧酸(3h)
[0236]
按照一般芳基化程序使底物1芳基化(洗脱剂:己烷/乙酸乙酯=4/1以及1%v/v的乙酸)。获得为浅黄色固体的产物(81%产率)。
[0237]
底物的对映体纯度通过sfc分析确定(ig-3柱,15%(包含0.5%hco2h的meoh)/co2,流速4ml/分钟,保留时间2.068分钟(次要)和2.276分钟(主要),94∶6er);
[0238]1h nmr(600mhz,cdcl3)δ7.37(d,j=8.4,2h),7.10(d,j=8.4hz,2h),2.55(q,j=8.6hz,1h),2.04(ddd,j=9.2,7.8,5.6hz,1h),1.63(dt,j=7.7,5.4hz,1h),1.38(td,j=8.2,5.2hz,1h);
13
c nmr(150mhz,cdcl3)δ176.92,135.08,131.17,131.13,120.82,26.07,21.63,12.27;
[0239]
c
10
h
10
bro
2+
[m+h]
+
的hrms(esi-tof)m/z的计算值:240.9859,实测值:240.9856。
[0240]
基于将3s的旋光度与文献进行比较分配绝对立体化学。
[0241][0242]
(1r,2s)-2-(对甲苯基)环丙烷-1-羧酸(3i)
[0243]
按照一般芳基化程序使底物1芳基化(洗脱剂:己烷/乙酸乙酯=4/1以及1%v/v的乙酸)。获得为浅黄色固体的产物(73%产率)。
[0244]
底物的对映体纯度通过sfc分析确定(ia-3柱,7%(包含0.5%hco2h的meoh)/co2,流速4ml/分钟,保留时间1.938分钟(主要)和2.725分钟(次要),98∶2er);
[0245]1h nmr(600mhz,cdcl3)δ7.13(d,j=7.8,2h),7.05(d,j=7.8hz,2h),2.59(q,j=8.6hz,1h),2.30(s,3h),2.05-2.01(m,1h),1.65-1.62(m,1h),1.35(td,j=8.1,5.1hz,1h);
13
c nmr(150mhz,cdcl3)δ175.74,136.44,133.01,129.25,128.85,26.33,21.39,21.25,12.23;
[0246]
c
11
h
13
o
2+
[m+h]
+
的hrms(esi-tof)m/z的计算值:177.0910,实测值:177.0905。
[0247]
基于将3s的旋光度与文献进行比较分配绝对立体化学。
[0248][0249]
(1r,2s)-2-(4-((二乙氧基磷酰基)甲基)苯基)环丙烷-1-羧酸(3j)
[0250]
按照一般芳基化程序使底物1芳基化(洗脱剂:己烷/乙酸乙酯=1/1以及1%v/v的乙酸)。获得为浅黄色油状物的产物(74%产率)。
[0251]
底物的对映体纯度通过sfc分析确定(ig-3柱,20%(包含0.5%hco2h的meoh)/co2,流速4ml/分钟,保留时间1.761分钟(次要)和2.047分钟(主要),96∶4er);
[0252]1h nmr(600mhz,cdcl3)δ7.20(d,j=7.8,2h),7.00(dd,j=8.1,2.4hz,2h),4.03-3.85(m,4h),2.79(d,j=14.4hz,2h),2.57(q,j=9.1hz,1h),2.10(ddd,j=9.3,7.7,5.7hz,1h),1.67(dt,j=7.5,5.4hz,1h),1.31(td,j=8.3,5.1hz,1h),1.19(t,j=7.1hz,3h),1.16(t,j=7.1hz,3h);
13
c nmr(150mhz,cdcl3)δ174.19,135.19(d,j=4hz),129.71(d,j=10hz),129.61(d,j=3hz),129.39(d,j=6hz),62.67(d,j=7hz),62.54(d,j=7hz),32.82(d,j=136hz),25.57,21.85,16.39(d,j=6hz),16.35(d,j=6hz),11.26;
[0253]
c
15
h
21
o5p
+
[m+h]
+
的hrms(esi-tof)m/z的计算值:313.1199,实测值:313.1203。
[0254]
基于将3s的旋光度与文献进行比较分配绝对立体化学。
[0255][0256]
(1r,2s)-2-(4-(三氟甲氧基)苯基)环丙烷-1-羧酸(3k)
[0257]
按照一般芳基化程序使底物1芳基化(洗脱剂:己烷/乙酸乙酯=4/1以及1%v/v的
乙酸)。获得为浅黄色油状物的产物(75%产率)。
[0258]
底物的对映体纯度通过sfc分析确定(ia-3柱,3%(包含0.5%hco2h的meoh)/co2,流速4ml/分钟,保留时间2.163分钟(主要)和2.503分钟(次要),97∶3er);
[0259]1h nmr(600mhz,cdcl3)δ7.23(d,j=8.4,2h),7.08(d,j=7.8hz,2h),2.59(q,j=8.6hz,1h),2.04(ddd,j=9.1,7.8,5.6hz,1h),1.63(dt,j=7.7,5.4hz,1h),1.39(td,j=8.5,5.2hz,1h);
13
c nmr(150mhz,cdcl3)δ177.06,148.14(q,j=2hz),134.83,130.74,120.63(q,j=255hz),120.53,25.88,21.60,12.30;
19
f nmr(376mhz,cdcl3)δ-58.12(s,3f);11.26;
[0260]
c
11
h
10
f3o
3+
[m+h]
+
的hrms(esi-tof)m/z的计算值:247.0577,实测值:247.0579。
[0261]
基于将3s的旋光度与文献进行比较分配绝对立体化学。
[0262][0263]
(1r,2s)-2-(3-(甲氧基羰基)苯基)环丙烷-1-羧酸(3l)
[0264]
按照一般芳基化程序使底物1芳基化(洗脱剂:己烷/乙酸乙酯=2/1以及1%v/v的乙酸)。获得为白色固体的产物(76%产率)。
[0265]
底物的对映体纯度通过sfc分析确定(ig-3柱,10%(包含0.5%hco2h的meoh)/co2,流速4ml/分钟,保留时间3.003分钟(次要)和3.428分钟(主要),96∶4er);
[0266]1h nmr(600mhz,cdcl3)δ7.93(s,1h),7.87(d,j=7.8hz,1h),7.40(d,j=7.2hz,1h),7.30(t,j=7.8hz,1h),3.91(s,3h),2.64(q,j=8.5hz,1h),2.08-2.05(m,1h),1.70(dt,j=7.5,5.4hz,1h),1.41(td,j=8.2,5.2hz,1h);
13
c nmr(150mhz,cdcl3)δ175.99,167.22,136.49,133.86,130.78,130.03,128.25,128.13,52.24,26.27,21.44,12.31;
[0267]
c
12
h
13
o
4+
[m+h]
+
的hrms(esi-tof)m/z的计算值:221.0808,实测值:221.0807。
[0268]
基于将3s的旋光度与文献进行比较分配绝对立体化学。
[0269][0270]
(1r,2s)-2-(3-甲酰基苯基)环丙烷-1-羧酸(3m)
[0271]
按照一般芳基化程序使底物1芳基化,不同之处在于:使用agoac(3.0当量)和nahco3(1.5当量)代替ag2co3和na2co3。(洗脱剂:己烷/乙酸乙酯=2/1以及1%v/v的乙酸)。获得为浅黄色油状物的产物(70%产率)。
[0272]
底物的对映体纯度通过sfc分析确定(ig-3柱,20%(包含0.5%hco2h的meoh)/co2,流速4ml/分钟,保留时间1.819分钟(次要)和2.479分钟(主要),93∶7er);
[0273]1h nmr(600mhz,d
6-丙酮)δ10.02(s,1h),7.84(s,1h),7.74(d,j=7.8hz,1h),7.62(d,j=7.8hz,1h),7.48(t,j=7.8hz,1h),2.74(q,j=8.5hz,1h),2.21-2.17(m,1h),1.67
(dt,j=7.4,5.3hz,1h),1.44(td,j=8.2,4.9hz,1h);
13
c nmr(150mhz,d
6-丙酮)193.04,171.84,139.29,137.37,136.19,131.16,129.37,128.42,25.53,22.27,11.76;
[0274]
c
11
h
11
o
3+
[m+h]
+
的hrms(esi-tof)m/z的计算值:191.0703,实测值:191.0700。
[0275]
基于将3s的旋光度与文献进行比较分配绝对立体化学。
[0276][0277]
(1r,2s)-2-(3-(三氟甲基)苯基)环丙烷-1-羧酸(3n)
[0278]
按照一般芳基化程序使底物1芳基化(洗脱剂:己烷/乙酸乙酯=4/1以及1%v/v的乙酸)。获得为浅黄色油状物的产物(84%产率)。
[0279]
底物的对映体纯度通过sfc分析确定(ig-3柱,3%(包含0.5%hco2h的
i
proh)/co2,流速4ml/分钟,保留时间3.999分钟(主要)和4.584分钟(次要),96∶4er);
[0280]1h nmr(600mhz,cdcl3)δ7.48(s,1h),7.45(d,j=7.8hz,1h),7.39(d,j=7.8hz,1h),7.34(t,j=7.8hz,1h),2.64(q,j=8.5hz,1h),2.08(ddd,j=9.1,7.8,5.6hz,1h),1.68(dt,j=7.7,5.4hz,1h),1.43(ddd,j=8.6,7.9,5.2hz,1h);
13
c nmr(150mhz,cdcl3)δ176.64,137.05,132.74,130.42(q,j=32hz),128.45,126.27(q,j=4hz),124.27(q,j=270hz),123.76(q,j=4hz),26.23,21.60,12.37;
19
f nmr(376mhz,cdcl3)δ-62.89(s,3f);
[0281]
c
11
h
10
f3o
2+
[m+h]
+
的hrms(esi-tof)m/z的计算值:231.0627,实测值:231.0628。
[0282]
基于将3s的旋光度与文献进行比较分配绝对立体化学。
[0283][0284]
(1r,2s)-2-(3-氟苯基)环丙烷-1-羧酸(3o)
[0285]
按照一般芳基化程序使底物1芳基化(洗脱剂:己烷/乙酸乙酯=4/1以及1%v/v的乙酸)。获得为浅黄色油状物的产物(79%产率)。
[0286]
底物的对映体纯度通过sfc分析确定(ia-3柱,2%(包含0.5%hco2h的meoh)/co2,流速4ml/分钟,保留时间4.482分钟(主要)和5.337分钟(次要),97∶3er);
[0287]1h nmr(600mhz,cdcl3)δ7.20(td,j=7.9,6.1hz,1h),7.01(dt,j=7.8,0.8hz,1h),6.93(d,j=10.2hz,1h),6.89(td,j=8.4,2.5hz,1h),2.60(q,j=8.6hz,1h),2.05(ddd,j=9.2,7.8,5.6hz,1h),1.64(dt,j=7.7,5.4hz,2h),1.38(ddd,j=8.6,7.8,5.1hz,1h);
13
c nmr(150mhz,cdcl3)δ176.56,162.64(d,j=245hz),138.66(d,j=8hz),129.47(d,j=9hz),125.14(d,j=2hz),116.30(d,j=21hz),113.92(d,j=21hz),26.22,21.57,12.31;
19
f nmr(376mhz,cdcl3)δ-114.29(s,1f);
[0288]
c
10
h
10
fo
2+
[m+h]
+
的hrms(esi-tof)m/z的计算值:181.0659,实测值:181.0658。
[0289]
基于将3s的旋光度与文献进行比较分配绝对立体化学。
[0290][0291]
(1r,2s)-2-(3-氯苯基)环丙烷-1-羧酸(3p)
[0292]
按照一般芳基化程序使底物1芳基化(洗脱剂:己烷/乙酸乙酯=4/1以及1%v/v的乙酸)。获得为浅黄色油状物的产物(80%产率)。
[0293]
底物的对映体纯度通过sfc分析确定(ia-3柱,3%(包含0.5%hco2h的meoh)/co2,流速4ml/分钟,保留时间4.252分钟(主要)和5.031分钟(次要),96∶4er);
[0294]1h nmr(600mhz,cdcl3)δ7.24(s,1h),7.19-7.15(m,2h),7.11-7.09(m,1h),2.58(q,j=8.6hz,1h),2.05(ddd,j=9.2,7.8,5.6hz,1h),1.64(dt,j=7.7,5.4hz,1h),1.38(ddd,j=8.6,7.8,5.2hz,1h);
13
c nmr(150mhz,cdcl3)δ176.48,138.14,133.88,129.65,129.29,127.58,127.19,26.17,21.51,12.29;
[0295]
c
10
h
10
clo
2+
[m+h]
+
的hrms(esi-tof)m/z的计算值:197.0364,实测值:197.0361。
[0296]
基于将3s的旋光度与文献进行比较分配绝对立体化学。
[0297][0298]
(1r,2s)-2-(间甲苯基)环丙烷-1-羧酸(3q)
[0299]
按照一般芳基化程序使底物1芳基化(洗脱剂:己烷/乙酸乙酯=4/1以及1%v/v的乙酸)。获得为浅黄色油状物的产物(71%产率)。
[0300]
底物的对映体纯度通过sfc分析确定(ia-3柱,5%meoh/co2,流速4ml/分钟,保留时间2.136分钟(主要)和2.547分钟(次要),97∶3er);
[0301]1h nmr(600mhz,cdcl3)δ7.13(t,j=7.8hz,1h),7.06(s,1h),7.03(d,j=7.8hz,1h),7.01(d,j=7.8hz,1h),2.59(q,j=8.6hz,1h),2.33(s,3h),2.01(ddd,j=9.2,7.8,5.6hz,1h),1.65(dt,j=7.7,5.3hz,1h),1.35(td,j=8.2,5.0hz,1h);
13
c nmr(150mhz,cdcl3)δ176.10,137.61,135.95,130.22,127.97,127.73,126.35,26.62,21.49,21.35,12.18;
[0302]
c
11
h
13
o
2+
[m+h]
+
的hrms(esi-tof)m/z的计算值:177.0910,实测值:177.0905。
[0303]
基于将3s的旋光度与文献进行比较分配绝对立体化学。
[0304][0305]
(1r,2s)-2-(3-甲氧基苯基)环丙烷-1-羧酸(3r)
[0306]
按照一般芳基化程序使底物1芳基化(洗脱剂:己烷/乙酸乙酯=4/1以及1%v/v的乙酸)。获得为浅黄色油状物的产物(70%产率)。
[0307]
底物的对映体纯度通过sfc分析确定(ia-3柱,10%(包含0.5%
hco2h的meoh)/co2,流速4ml/分钟,保留时间1.670分钟(主要)和2.114分钟(次要),97∶3er);
[0308]1h nmr(600mhz,cdcl3)δ7.15(t,j=7.8hz,1h),6.82(d,j=7.8hz,1h),6.78(s,1h),6.74(dd,j=8.4,3.2hz,1h),3.76(s,3h),2.59(q,j=8.7hz,1h),2.02(ddd,j=9.3,7.7,5.6hz,1h),1.63(dt,j=7.7,5.3hz,1h),1.35(td,j=8.2,5.0hz,1h);
13
c nmr(150mhz,cdcl3)δ177.04,159.37,137.72,129.05,121.83,114.90,112.66,55.26,26.71,21.56,12.35;
[0309]
c
11
h
13
o
3+
[m+h]
+
的hrms(esi-tof)m/z的计算值:193.0859,实测值:193.0861。
[0310]
基于将3s的旋光度与文献进行比较分配绝对立体化学。
[0311][0312]
(1r,2s)-2-苯基环丙烷-1-羧酸(3s)
[0313]
按照一般芳基化程序使底物1芳基化(洗脱剂:己烷/乙酸乙酯=4/1以及1%v/v的乙酸)。获得为浅黄色油状物的产物(70%产率)。
[0314]
底物的对映体纯度通过sfc分析确定(ia-3柱,10%(包含0.5%hco2h的meoh)/co2,流速4ml/分钟,保留时间1.492分钟(主要)和1.730分钟(次要),95∶5er);
[0315]1h nmr(600mhz,cdcl3)δ7.25-7.22(m,3h),7.21-7.18(m,1h),2.62(q,j=8.7hz,1h),2.04(ddd,j=9.0,7.9,5.7hz,1h),1.66(dt,j=7.7,5.3hz,1h),1.37(td,j=8.2,5.1hz,1h);
13
c nmr(150mhz,cdcl3)δ176.20,136.07,129.40,128.10,126.92,26.64,21.42,12.16;
[0316]
c
10
h
11
o
2+
[m+h]
+
的hrms(esi-tof)m/z的计算值:163.0754,实测值:163.0752。
[0317]
基于已知的旋光度分配绝对立体化学。
12
[α]
23d
=-23.1
°
(c=1,chcl3),文献[α]
23d
=-27.6
°
(c=1.00,chcl3)
[0318][0319]
(1r,2s)-2-(2-(甲氧基羰基)苯基)环丙烷-1-羧酸(3t)
[0320]
按照一般芳基化程序使底物1芳基化(洗脱剂:己烷/乙酸乙酯=2/1以及1%v/v的乙酸)。获得为白色固体的产物(84%产率)。
[0321]
底物的对映体纯度通过sfc分析确定(ig-3柱,15%(包含0.5%hco2h的meoh)/co2,流速4ml/分钟,保留时间1.947分钟(次要)和2.349分钟(主要),98∶2er);
[0322]1h nmr(600mhz,cdcl3)δ7.84(d,j=7.8hz,1h),7.42(1d,j=8.0,1.2hz,1h),7.32(d,j=7.8hz,1h),7.28(t,j=8.0hz,1h),3.82(s,1h),2.98(q,j=8.6hz,1h),2.12(ddd,j=9.2,8.0,5.6hz,1h),1.61(dt,j=8.0,5.3hz,1h),1.44(td,j=8.1,5.0hz,1h);
13
c nmr
(150mhz,cdcl3)δ177.16,167.92,137.77,131.75,131.25,131.04,130.26,126.94,52.12,26.48,21.87.13.60;
[0323]
c
12
h
13
o
4+
[m+h]
+
的hrms(esi-tof)m/z的计算值:221.0808,实测值:221.0807。
[0324]
基于将3s的旋光度与文献进行比较分配绝对立体化学。
[0325][0326]
(1r,2s)-2-(5-乙酰基噻吩-2-基)环丙烷-1-羧酸(3u)
[0327]
按照一般芳基化程序使底物1芳基化(洗脱剂:己烷/乙酸乙酯=1/1以及1%v/v的乙酸)。获得为浅黄色固体的产物(65%产率)。
[0328]
底物的对映体纯度通过sfc分析确定(ig-3柱,25%(包含0.5%hco2h的meoh)/co2,流速4ml/分钟,保留时间1.996分钟(次要)和2.557分钟(主要),95∶5er);
[0329]1h nmr(600mhz,cdcl3)δ7.51(d,j=3.6hz,1h),6.89(dd,j=3.9,0.9hz,1h),2.66(q,j=8.1hz,1h),2.64(s,3h),2.15(ddd,j=8.9,7.9,6.0hz,1h),1.70(dt,j=7.4,5.8hz,1h),1.53(ddd,j=8.2,8.0,5.2hz);
13
c nmr(150mhz,cdcl3)δ190.70,175.32,149.33,143.15,132.64,127.86,26.67,22.76,21.24,14.27;
[0330]
c
10
h
11
o3s
+
[m+h]
+
的hrms(esi-tof)m/z的计算值:211.0423,实测值:211.0428。
[0331]
基于将3s的旋光度与文献进行比较分配绝对立体化学。
[0332][0333]
(1r,s)-2-(5-甲酰基呋喃-2-基)环丙烷-1-羧酸(3v)
[0334]
按照一般芳基化程序使底物1芳基化(洗脱剂:己烷/乙酸乙酯=1/1以及1%v/v的乙酸)。获得为浅黄色固体的产物(67%产率)。
[0335]
底物的对映体纯度通过sfc分析确定(as-3柱,10%
i
proh/co2,流速1.0ml/分钟,保留时间9.843分钟(主要)和11.226分钟(次要),96∶4er);
[0336]1h nmr(600mhz,cdcl3)δ9.51(s,1h),7.16(d,j=3.6hz,1h),6.35(dd,j=3.6,0.5hz,1h),2.58(q,j=8.5hz,1h),2.16(ddd,j=8.5,8.0,6.2hz,1h),1.71(ddd,j=7.2,6.0,5.4hz,1h),1.54(ddd,j=8.2,8.1,5.1hz,1h);
13
c nmr(150mhz,cdcl3)(1c重叠)δ177.17,175.16,157.97,152.09,111.05,21.48,18.88,12.63;
[0337]
c9h9o
4+
[m+h]
+
的hrms(esi-tof)m/z的计算值:181.0495,实测值:181.0495。
[0338]
基于将3s的旋光度与文献进行比较分配绝对立体化学。
[0339]
[0340]
(1r,2r)-2-(4-(甲氧基羰基)苯基)-1-苯基环丙烷-1-羧酸(5a)
[0341]
按照一般芳基化程序使底物4a芳基化(洗脱剂:己烷/乙酸乙酯=2/1以及1%v/v的乙酸)。获得为白色固体的产物(76%产率)。
[0342]
底物的对映体纯度通过sfc分析确定(ad-3柱,20%
i
proh/co2,流速2.0ml/分钟,保留时间6.718分钟(主要)和8.227分钟(次要),98:2er);
[0343]1h nmr(600mhz,cdcl3)δ7.96(d,j=7.8hz,2h),7.44(d,j=7.2hz,2h),7.38-7.34(m,4h),7.30(tt,j=7.2,1.5hz,1h),3.93(s,3h),2.90(t,j=8.4hz,1h),2.28(dd,j=7.8,4.8hz,1h),1.70(dd,j=9.0,4.8hz,1h);
13
c nmr(150mhz,cdcl3)δ176.30,167.21,141.47,139.46,130.36,129.53,129.36,128.82,128.54,127.82,52.22,38.01,34.56,19.39;
[0344]
c
18
h
16
o4na
+
[m+na]
+
的hrms(esi-tof)m/z的计算值:319.0941,实测值:319.0943。
[0345]
基于将3s的旋光度与文献进行比较分配绝对立体化学。
[0346][0347]
(1r,2r)-1-(4-氯苯基)-2-(4-(甲氧基羰基)苯基)环丙烷-1-羧酸(5b)
[0348]
按照一般芳基化程序使底物4b芳基化(洗脱剂:己烷/乙酸乙酯=2/1以及1%v/v的乙酸)。获得为白色固体的产物(80%产率)。
[0349]
底物的对映体纯度通过sfc分析确定(ad-3柱,20%
i
proh/co2,流速2.0ml/分钟,保留时间6.030分钟(主要)和9.105分钟(次要),99:1er);
[0350]1h nmr(600mhz,cdcl3)δ7.96(d,j=8.4hz,2h),7.37(dt,j=8.4,2.1hz,2h),7.34(d,j=8.4hz,2h),7.32(dt,j=9.0,2.2hz,2h),3.94(s,3h),2.85(t,j=8.4hz,1h),2.27(dd,j=7.8,5.1hz,1h),1.68(dd,j=9.0,5.1,1h);
13
c nmr(150mhz,cdcl3)δ175.90,167.17,141.05,137.89,133.75,131.74,129.56,129.34,128.96,128.73,52.27,37.28,34.78,19.41;
[0351]
c
18
h
16
clo
4+
[m+h]
+
的hrms(esi-tof)m/z的计算值:331.0732,实测值:331.0724。
[0352]
基于将3s的旋光度与文献进行比较分配绝对立体化学。
[0353][0354]
(1r,2r)-1-(3-溴苯基)-2-(4-(甲氧基羰基)苯基)环丙烷-1-羧酸(5c)
[0355]
按照一般芳基化程序使底物4c芳基化(洗脱剂:己烷/乙酸乙酯=2/1以及1%v/v的乙酸)。获得为无色油状物的产物(90%产率)。
[0356]
底物的对映体纯度通过sfc分析确定(ad-3柱,20%
i
proh/co2,
流速2.0ml/分钟,保留时间6.137分钟(主要)和6.920分钟(次要),98∶2er);
[0357]1h nmr(600mhz,cdcl3)δ7.96(d,j=8.4hz,2h),7.58(t,j=1.8hz,1h),7.43(ddd,j=8.1,1.8,0.9hz,1h),7.38(d,j=7.8hz,1h),7.35(d,j=7.8hz,2h),7.22(t,j=7.8hz,1h),3.95(s,3h),2.88(t,j=8.4hz,1h),2.27(dd,j=7.8,5.2hz,1h),1.70(dd,j=9.1,5.1hz,1h);
13
c nmr(150mhz,cdcl3)δ175.75,167.16,141.55,140.89,133.39,131.02,130.07,129.58,129.35,129.17,129.01,122.37,52.28,37.47,34.65,19.43.
[0358]
c
18
h
16
bro
4+
[m+h]
+
的hrms(esi-tof)m/z的计算值:375.0226,实测值:375.0237。
[0359]
基于将3s的旋光度与文献进行比较分配绝对立体化学。
[0360][0361]
(1r,2r)-2-(4-(甲氧基羰基)苯基)-1-(4-(三氟甲基)苯基)环丙烷-1-羧酸(5d)
[0362]
按照一般芳基化程序使底物4d芳基化(洗脱剂:己烷/乙酸乙酯=2/1以及1%v/v的乙酸)。获得为白色油状物的产物(85%产率)。
[0363]
底物的对映体纯度通过sfc分析确定(ad-3柱,20%
i
proh/co2,流速2.0ml/分钟,保留时间2.852分钟(主要)和3.471分钟(次要),99∶1er);
[0364]1h nmr(600mhz,cdcl3)δ7.98(d,j=7.8hz,2h),7.62(d,j=8.4hz,2h),7.57(d,j=8.4hz,2h),7.38(d,j=7.8hz,2h),3.94(s,3h),2.91(t,j=8.4hz,1h),2.34(dd,j=7.5,5.2hz,1h),1.74(d,j=9.0,5.4hz,1h);
13
c nmr(150mhz,cdcl3)δ175.04,167.13,143.21,140.78,130.80,130.10(q,j=33hz),129.78,129.36,129.13,125.56(q,j=4.0hz),124.13(q,j=272hz)52.30,37.54,34.63,19.38;19f nmr(376mhz,cdcl3)δ-62.84(s,3f);
[0365]
c
19
h
16
f3o
4+
[m+h]
+
的hrms(esi-tof)m/z的计算值:365.0995,实测值:365.0994。
[0366]
基于将3s的旋光度与文献进行比较分配绝对立体化学。
[0367][0368]
(1r,2r)-1-乙基-2-(4-(甲氧基羰基)苯基)环丙烷-1-羧酸(5e)
[0369]
按照一般芳基化程序使底物4e芳基化,不同之处在于:在60℃下进行(洗脱剂:己烷/乙酸乙酯=2/1以及1%v/v的乙酸)。获得为浅黄色固体的产物(71%产率)。
[0370]
底物的对映体纯度通过sfc分析确定(ia-3柱,20%(包含0.5%hco2h的meoh)/co2,流速4ml/分钟,保留时间1.595分钟(主要)和1.873分钟(次要),95∶5er);
[0371]1h nmr(600mhz,cdcl3)δ7.90(d,j=8.4hz,2h),7.23(d,j=8.4hz,2h),3.90(s,3h),2.40(t,j=8.1hz,1h),2.04-1.98(m,1h),1.88(dd,j=7.2,5.4hz,1h),1.46-1.40(m,
1h),1.18(dd,j=8.4,4.8hz,1h),1.05(t,j=7.2hz,3h);
13
c nmr(150mhz,cdcl3)δ177.71,167.26,142.28,129.32,129.22,128.42,52.13,34.30,33.52,28.64,18.69,11.93;
[0372]
c
14
h
17
o
4+
[m+h]
+
的hrms(esi-tof)m/z的计算值:249.1121,实测值:249.1124。
[0373]
基于将3s的旋光度与文献进行比较分配绝对立体化学。
[0374][0375]
(1r,2r)-1-丁基-2-(4-(甲氧基羰基)苯基)环丙烷-1-羧酸(5f)
[0376]
按照一般芳基化程序使底物4f芳基化,不同之处在于:在60℃下进行(洗脱剂:己烷/乙酸乙酯=2/1以及1%v/v的乙酸)。获得为浅黄色固体的产物(76%产率)。
[0377]
底物的对映体纯度通过sfc分析确定(ad-3柱,20%
i
proh/co2,流速2.0ml/分钟,保留时间3.332分钟(主要)和3.850分钟(次要),95∶5er);
[0378]1h nmr(600mhz,cdcl3)δ7.90(d,j=8.4hz,2h),7.23(d,j=8.4hz,2h),3.90(s,3h),2.39(t,j=8.1hz,1h),2.07-2.02(m,1h),1.89(dd,j=7.2,5.4hz,1h),1.52-1.40(m,2h),1.36-1.30(m,3h),1.19(dd,j=8.6,5.1hz,1h),0.91(t,j=7.2hz,3h);
13
c nmr(150mhz,cdcl3)δ177.47,167.25,142.27,129.33,129.20,128.44,52.14,35.47,33.60,33.39,29.93,22.90,18.79,14.12;
[0379]
c
16
h
20
o
4+
[m+h]
+
的hrms(esi-tof)m/z的计算值:277.1434,实测值:277.1437。
[0380]
基于将3s的旋光度与文献进行比较分配绝对立体化学。
[0381][0382]
(1r,2r)-2-(4-(甲氧基羰基)苯基)-1-(3-苯丙基)环丙烷-1-羧酸(5g)
[0383]
按照一般芳基化程序使底物4g芳基化,不同之处在于:在60℃下进行(洗脱剂:己烷/乙酸乙酯=2/1以及1%v/v的乙酸)。获得为浅黄色油状物的产物(58%产率)。
[0384]
底物的对映体纯度通过sfc分析确定(ad-3柱,20%
i
proh/co2,流速2.0ml/分钟,保留时间7.925分钟(主要)和9.066分钟(次要),96∶4er);
[0385]1h nmr(600mhz,cdcl3)δ7.89(d,j=9.4hz,2h),7.28(t,j=8.1hz,2h),7.22-7.17(m,5h),3.89(s,3h),2.63(t,j= 7.8hz,2h)2.36(d,j=7.5hz,1h),2.08-2.02(m,1h),1.90-1.80(m,3h),1.41-1.36(m 1h),167(dd,j=8.4,4.8hz,1h);
13
c nmr(150mhz,cdcl3)δ177.46,167.23,142.14,142.07,129.33,129.22,129.19,128.49,128.47,125.95,52.14,35.95,35.33,33.70,33.14,29.35,18.95;
[0386]
c
21
h
23
o
4+
[m+h]
+
的hrms(esi-tof)m/z的计算值:339.1591,实测值:339.1595。
[0387]
基于将3s的旋光度与文献进行比较分配绝对立体化学。
[0388][0389]
(1r,2r)-1-(5-氯戊基)-2-(4-(甲氧基羰基)苯基)环丙烷-1-羧酸(5h)
[0390]
按照一般芳基化程序使底物4h芳基化,不同之处在于:在60℃下进行(洗脱剂:己烷/乙酸乙酯=2/1以及1%v/v的乙酸)。获得为浅黄色油状物的产物(80%产率)。
[0391]
底物的对映体纯度通过sfc分析确定(ad-3柱,20%
i
proh/co2,流速2.0ml/分钟,保留时间4.610分钟(主要)和5.459分钟(次要),96∶4er);
[0392]1h nmr(600mhz,cdcl3)δ7.90(d,j=8.4hz,2h),7.23(d,j=7.8hz,2h),3.91(s,3h),3.54(t,j=6.6hz,2h),2.40(t,j=8.1hz,1h),2.08-2.04(m,1h),1.91(dd,j=7.2,5.4hz,1h),179(p,j=6.7hz,2h),1.59-143(m,4h),1.38-1.32(m,1h),1.21(dd,j=87,5.0hz,1h);
13
c nmr(150mhz,cdcl3)δ177.17,167.23,142.05,129.36,129.23,128.54,52.18,45.15,35.59,33.69,33.17,32.54,27.07,27.02,18.89;
[0393]
c
17
h
22
clo
4+
[m+h]
+
的hrms(esi-tof)m/z的计算值:325.1201,实测值:325.1205。
[0394]
基于将3s的旋光度与文献进行比较分配绝对立体化学。
[0395][0396]
(1s,2r)-1-苄基-2-(4-(甲氧基羰基)苯基)环丙烷-1-羧酸(5i)
[0397]
按照一般芳基化程序使底物4i芳基化,不同之处在于:使用agoac(3.0当量)和nahco3(1.5当量)代替ag2co3和na2co3,在60℃下进行(洗脱剂:己烷/乙酸乙酯=2/1以及1%v/v的乙酸)。获得为浅黄色固体的产物(63%产率)。
[0398]
底物的对映体纯度通过sfc分析确定(as-3柱,20%
i
proh/co2,流速2.0ml/分钟,保留时间2.409分钟(主要)和2.993分钟(次要),96∶4er);
[0399]1h nmr(600mhz,cdcl3)δ7.89(d,j=8.4hz,2h),7.31-7.28(m,2h),7.24-7.20(m,5h),3.91(s,3h),3.49(d,j=15.0hz,1h),2.82(d,j=15.0hz,1h),2.47(t,j=8.1hz,1h),1.98(dd,j=7.2,5.4hz,1h),1.33(dd,j=8.7,5.3hz,1h);
13
c nmr(150mhz,cdcl3)δ176.91,167.22,141.86,138.65,129.38,129.34,129.21,128.53,126.73,52.17,39.71,33.48,32.89,18.00;
[0400]
c
19
h
19
o
4+
[m+h]
+
的hrms(esi-tof)m/z的计算值:311.1278,实测值:311.1283。
[0401]
基于将3s的旋光度与文献进行比较分配绝对立体化学。
[0402][0403]
(1s,2r)-1-(4-氟苄基)-2-(4-(甲氧基羰基)苯基)环丙烷-1-羧酸(5j)
[0404]
按照一般芳基化程序使底物4j芳基化,不同之处在于:使用agoac(3.0当量)和nahco3(1.5当量)代替ag2co3和na2co3,在60℃下进行(洗脱剂:己烷/乙酸乙酯=2/1以及1%v/v的乙酸)。获得为浅黄色固体的产物(64%产率)。
[0405]
底物的对映体纯度通过sfc分析确定(as-3柱,20%
i
proh/co2,流速2.0ml/分钟,保留时间2.211分钟(主要)和2.593分钟(次要),96∶4er);
[0406]1h nmr(600mhz,cdcl3)δ7.89(d,j=8.4hz,2h),7.21-7.18(m,4h),6.97(t,j=8.7hz,2h),3.91(s,3h),3.45(d,j=14.4hz,1h),2.74(d,j=14.4hz,1h),2.47(t,j=8.2hz,1h)1.98(t,j=6.3hz,1h),1.33(dd,j=8.7,5.3hz,1h);
13
c nmr(150mhz,cdcl3)δ176.95,167.19,161.85(d,j=243hz),141.67,134.43(d,j=3hz),130.69(d,j=10hz),129.38,129.17,128.65,115.33(d,j=21hz),52.19,39.10,33.67,32.98,18.11;
19
f nmr(376mhz,cdcl3)δ-116.67(s,1f);
[0407]
c
19
h
18
fo
4+
[m+h]
+
的hrms(esi-tof)m/z的计算值:329.1184,实测值:329.1185。
[0408]
基于将3s的旋光度与文献进行比较分配绝对立体化学。
[0409][0410]
(1r,2r)-1-((苄氧基)甲基)-2-(4-(甲氧基羰基)苯基)环丙烷-1-羧酸(5k)
[0411]
按照一般芳基化使底物4k芳基化(洗脱剂:己烷/乙酸乙酯=2/1以及1%v/v的乙酸)。获得为浅黄色固体的产物(65%产率)。
[0412]
底物的对映体纯度通过sfc分析确定(as-3柱,20%
i
proh/co2,流速2.0ml/分钟,保留时间2.840分钟(主要)和3.398分钟(次要),96∶4er);
[0413]1h nmr(600mhz,cdcl3)δ7.91(d,j=7.8hz,2h),7.37-7.33(m,4h),7.32-7.29(m,1h),7.26(d,j=8.4hz,2h),4.60(s,2h),3.89(s,3h),3.86(d,j=10.2hz,1h),3.63(d,j=10.2hz,1h),2.59(t,j=8.4hz,1h),1.99(dd,j=7.7,5.3hz,1h),1.42(dd,j=8.9,5.2hz,1h);
13
c nmr(150mhz,cdcl3)δ175.16,167.16,141.29,137.80,129.44,129.31,128.77,128.64,128.01,127.88,73.38,72.12,52.16,32.99,31.28,16.86.
[0414]
c
20
h
21
o
5+
[m+h]
+
的hrms(esi-tof)m/z的计算值:341.1383,实测值:341.1383。
[0415]
基于将3s的旋光度与文献进行比较分配绝对立体化学。
[0416][0417]
(1r,2r)-1-((1,3-二氧代异吲哚啉-2-基)甲基)-2-(4-(甲氧基羰基)苯基)环丙烷-1-羧酸(5l)
[0418]
按照一般芳基化使底物4l芳基化(洗脱剂:己烷/乙酸乙酯=1/1以及1%v/v的乙酸)。获得为白色固体的产物(71%产率)。
[0419]
底物的对映体纯度通过sfc分析确定(ic柱,30%
i
proh/co2,流速2.0ml/分钟,保留时间4.593分钟(主要)和6.826分钟(次要),98∶2er);
[0420]1h nmr(600mhz,cdcl3)δ7.89(d,j=8.4hz,2h),7.87-7.84(m,2h),7.75-7.72(m,2h),7.27(d,j=8.4hz,2h),4.24(d,j=14.6hz,1h),4.50(d,j=14.6hz,1h),3.90(s,3h),2.79(t,j=8.3hz,1h),1.99(dd,j=7.5,5.5hz,1h),1.51(dd,j=8.9,5.6hz,1h);
13
c nmr(150mhz,cdcl3)δ168.48,167.15,140.94,134.32,132.01,129.42,129.28,128.87,123.67,60.57,52.18,41.45,32.88,17.04;
[0421]
c
21
h
18
no
6+
[m+h]
+
的hrms(esi-tof)m/z的计算值:380.1129,实测值:380.1136。
[0422]
基于将3s的旋光度与文献进行比较分配绝对立体化学。
[0423]
2-氨基异丁酸的对映选择性芳基化
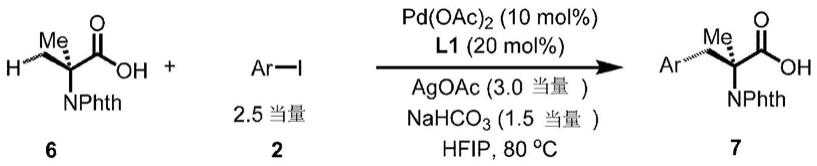
[0424][0425]
用于环丙烷羧酸的对映选择性芳基化的通用方法:在配备有磁力搅拌棒的2-打兰小瓶中装入经邻苯二甲酰基保护的2-氨基异丁酸(23.3mg,0.10mmol)、pd(oac)2(2.2mg,10mol%)、l1(4.4mg,20mol%)、agoac(50.0mg,0.30mmol)和nahco3(12.6mg,0.15mmol)。然后添加芳基碘(0.25mmol)。随后,注入hfip(1.0ml),将小瓶加盖并盖紧。然后将反应混合物在80℃下搅拌24小时。使混合物冷却至室温并添加乙酸(0.05ml)。然后,使混合物通过用乙酸乙酯作为洗脱剂的硅藻土垫,以去除任何不溶的沉淀物。浓缩所得溶液。
[0426]
对于作为酸分离的化合物:将残余的混合物用最少量的丙酮溶解,并上样到制备型tlc板上。然后使用制备型tlc分离纯的酸产物,其中乙酸乙酯/己烷(1/1)以及1%w/w乙酸作为洗脱剂。
[0427]
对于作为酯分离的化合物:将残余的混合物溶解在0.5ml dmf中。向溶液添加cs2co3(99.7mg,0.3mmol)和mei(71.0mg,0.50mmol,31μl)。将混合物在室温下搅拌3小时并随后用水稀释,随后用乙酸乙酯萃取。将有机层经na2so4干燥,过滤并真空浓缩。将残余的混合物用最少量的丙酮溶解,并上样到制备型tlc板上。然后使用制备型tlc分离纯的酯产物,
其中乙酸乙酯/甲苯(1/20)作为洗脱剂。
[0428][0429]
(s)-2-(1,3-二氧代异吲哚啉-2-基)-3-(4-(甲氧基羰基)苯基)-2-甲基丙酸(7a)
[0430]
按照一般芳基化程序使底物6芳基化。产物作为酸分离并作为浅黄色油状物获得(65%产率)。
[0431]
底物的对映体纯度通过sfc分析确定(ig-3柱,25%(包含0.5%hco2h的meoh)/co2,流速4ml/分钟,保留时间3.813分钟(次要)和4.373分钟(主要),86∶14er);
[0432]1h nmr(600mhz,cdcl3)δ7.85(d,j=7.8hz,2h),7.78-7.76(m,2h),7.72-7.70(m,2h),7.13(d,j=8.4hz,2h),3.86(s,3h),3.83(d,j=13.8hz,1h),3.27(d,j=13.8,1h),1.95(s,3h);
13
c nmr(150mhz,cdcl3)δ168.45,167.06,141.11,134.42,131.45,130.65,129.69,129.12,123.52,63.71,52.19,41.05,21.97;
[0433]
c
20
h
18
no
6+
[m+h]
+
的hrms(esi-tof)m/z的计算值:368.1129,实测值:368.1131。
[0434]
基于化合物7f的x射线晶体学数据分配绝对立体化学。
[0435][0436]
(s)-2-(1,3-二氧代异吲哚啉-2-基)-2-甲基-3-(4-(三氟甲基)苯基)丙酸甲酯(7b)
[0437]
按照一般芳基化程序使底物6芳基化。产物作为酯分离并作为无色油状物获得(67%产率)。
[0438]
底物的对映体纯度通过sfc分析确定(ad-3柱,3%
i
proh/co2,流速1.0ml/分钟,保留时间14292分钟(主要)和15.855分钟(次要),87∶13er);
[0439]1h nmr(600mhz,cdcl3)δ7.90-7.77(m,2h),7.75-7.71(m,2h),7.43(d,j=7.8hz,2h),7.19(d,j=7.8hz,2h),3.84(d,j=13.8hz,1h),3.75(s,3h),3.34(d,j=13.8hz,1h),1.90(s,3h);
13
c nmr(150mhz,cdcl3)δ172.62,168.44,140.01(q,j=1.1hz),134.43,131.53,130.96,129.52(q,j=32hz),125.24(q,j=3.5hz),124.25(q,j=270hz),123.46,63.86,52.92,41.32,22.10;
19
f nmr(376mhz,cdcl3)δ-62.75(s,3f);
[0440]
c
21
h
17
f3no
4+
[m+h]
+
的hrms(esi-tof)m/z的计算值:392.1104,实测值:392.1106。
[0441]
基于化合物7f的x射线晶体学数据分配绝对立体化学。
[0442][0443]
(s)-2-(1,3-二氧代异吲哚啉-2-基)-3-(4-氟苯基)-2-甲基丙酸甲酯(7c)
[0444]
按照一般芳基化程序使底物6芳基化。产物作为酯分离并作为无色油状物获得(60%产率)。
[0445]
底物的对映体纯度通过sfc分析确定(oj-3柱,5%
i
proh/co2,流速2.0ml/分钟,保留时间2.868分钟(次要)和3.419分钟(主要),89∶11er);
[0446]1h nmr(600mhz,cdcl3)δ7.79-7.76(m,2h),7.73-7.70(m,2h),7.04-7.00(m,2h),6.7-6.84(m,2h),3.75(s,3h),3.75(d,j=14.4hz,1h),3.23(d,j=14.4hz,1h),1.88(s,3h);
13
c nmr(150mhz,cdcl3)δ172.86,168.47,162.18(d,j=244hz),134.32,132.04(d,j=9hz),131.59,131.52(d,j=4hz),123.39,115.26(d,j=22hz),64.05,52.83,20.65,22.02;
19
f nmr(376mhz,cdcl3)δ-115.88(s,1f);
[0447]
c
19
h
17
fno
4+
[m+h]
+
的hrms(esi-tof)m/z的计算值:342.1136,实测值:342.1148。
[0448]
基于化合物7f的x射线晶体学数据分配绝对立体化学。
[0449][0450]
(s)-3-(4-氯苯基)-2-(1,3-二氧代异吲哚啉-2-基)-2-甲基丙酸甲酯(7d)
[0451]
按照一般芳基化程序使底物6芳基化。产物作为酯分离并作为浅黄色固体获得(60%产率)。
[0452]
底物的对映体纯度通过sfc分析确定(oj-3柱,5%
i
proh/co2,流速2.0ml/分钟,保留时间3.660分钟(次要)和5.426分钟(主要),91∶9er);
[0453]1h nmr(600mhz,cdcl3)δ7.80-7.76(m,2h),7.74-7.71(m,2h),7.14(dt,j=8.4,2.1hz,2h),6.99(dt,j=8.4,2.1hz,2h),3.75(d,j=13.8hz,1h),3.75(s,3h),3.24(d,j=13.8hz,1h),1.88(s,3h);
13
c nmr(150mhz,cdcl3)δ172.78,168.47,134.35,134.31,133.24,131.89,131.58,128.54,123.43,63.96,52.87,40.84,22.03;
[0454]
c
19
h
17
clno
4+
[m+h]
+
的hrms(esi-tof)m/z的计算值:358.0841,实测值:358.0841。
[0455]
基于化合物7f的x射线晶体学数据分配绝对立体化学。
[0456][0457]
(s)-3-(4-溴苯基)-2-(1,3-二氧代异吲哚啉-2-基)-2-甲基丙酸甲酯(7e)
[0458]
按照一般芳基化程序使底物6芳基化。产物作为酯分离并作为白色固体获得(65%产率)。
[0459]
底物的对映体纯度通过sfc分析确定(oj-3柱,5%
i
proh/co2,流速2.0ml/分钟,保留时间4.313分钟(次要)和6.771分钟(主要),92∶8er);
[0460]1h nmr(600mhz,cdcl3)δ7.80-7.77(m,2h),7.74-7.71(m,2h),7.29(d,j=7.8hz,2h),6.94(d,j=8.4hz,2h),3.75-3.72(m,4h),3.22(d,j=13.8hz,1h),1.88(s,3h);
13
c nmr(150mhz,cdcl3)δ172.76,168.46,134.82,134.36,132.27,131.57,131.49,123.44,121.39,63.89,52.88,40.91,22.02;
[0461]
c
19
h
17
brno
4+
[m+h]
+
的hrms(esi-tof)m/z的计算值:402.0335,实测值:402.0341。
[0462]
基于化合物7f的x射线晶体学数据分配绝对立体化学。
[0463][0464]
(s)-2-(1,3-二氧代异吲哚啉-2-基)-2-甲基-3-(对甲苯基)丙酸甲酯(7f)
[0465]
按照一般芳基化程序使底物6芳基化。产物作为酯分离并作为白色固体获得(65%产率)。
[0466]
底物的对映体纯度通过sfc分析确定(oj-3柱,5%
i
proh/co2,流速2.0ml/分钟,保留时间3.360分钟(次要)和5.523分钟(主要),93∶7er);
[0467]1h nmr(600mhz,cdcl3)δ7.79-7.76(m,2h),7.72-7.69(m,2h),6.96(d,j=7.8hz,2h),6.92(d,j=8.4hz,2h),3.74(d,j=13.8hz,1h),3.74(s,3h),3.22(d,j=13.8hz,1h),2.26(s,3h),1.87(s,3h);
13
c nmr(150mhz,cdcl3)δ173.08,168.55,136.71,134.19,132.58,131.73,130.46,129.06,123.33,64.28,52.76,40.96,21.89,21.20;
[0468]
c
20
h
20
no
4+
[m+h]
+
的hrms(esi-tof)m/z的计算值:338.1387,实测值:338.1399。
[0469]
基于化合物7f的x射线晶体学数据分配绝对立体化学。
[0470][0471]
(s)-2-(1,3-二氧代异吲哚啉-2-基)-3-(3-(甲氧基羰基)苯基)-2-甲基丙酸(7g)
[0472]
按照一般芳基化程序使底物6芳基化。产物作为酸分离并作为无色油状物获得(67%产率)。
[0473]
底物的对映体纯度通过sfc分析确定(ig-3柱,25%(包含0.5%hco2h的meoh)/co2,流速4ml/分钟,保留时间3.052分钟(次要)和3.494分钟(主要),86∶14er);
[0474]1h nmr(600mhz,cdcl3)δ7.86-7.84(m,1h),7.75-7.72(m,2h),7.70-7.68(m,3h),7.24-7.23(m,2h),3.77(d,j=13.8hz,1h),3.72(s,3h),3.22(d,j=13.8hz,1h),1.90(s,3h);
13
c nmr(150mhz,cdcl3)δ167.96,166.31,135.64,134.49,133.65,129.58,127.92,127.88,122.80,63.34,51.52,40.20,21.26;13c nmr(150mhz,cdcl3)δ176.90,168.56,166.91,136.24,135.09,134.25,131.63,131.58,130.18,128.52,128.49,123.40,63.94,52.12,40.80,21.86.
[0475]
c
20
h
18
no
6+
[m+h]
+
的hrms(esi-tof)m/z的计算值:368.1129,实测值:368.1136。
[0476]
基于化合物7f的x射线晶体学数据分配绝对立体化学。
[0477][0478]
(s)-2-(1,3-二氧代异吲哚啉-2-基)-2-甲基-3-(间甲苯基)丙酸甲酯(7h)
[0479]
按照一般芳基化程序使底物6芳基化。产物作为酯分离并作为无色油状物获得(65%产率)。
[0480]
底物的对映体纯度通过sfc分析确定(oj-3柱,5%
i
proh/co2,流速2.0ml/分钟,保留时间3.367分钟(次要)和4.225分钟(主要),92∶8er);
[0481]1h nmr(600mhz,cdcl3)δ7.79-7.75(m,2h),7.72-7.69(m,2h),7.05(t,j=7.5hz,1h),6.98(d,j=7.2hz,1h),6.84(d,j=7.2hz,1h),6.81(s,1h),3.75(s,3h),3.73(d,j=13.8hz,1h),3.20(d,j=13.8hz,1h),2.12(s,3h),1.88(s,3h);
13
c nmr(150mhz,cdcl3)δ173.11,168.53,137.80,135.67,134.19,131.74,131.49,128.20,127.90,127.63,123.29,64.23,52.77,41.27,21.95,21.30.
[0482]
c
20
h
20
no
4+
[m+h]
+
的hrms(esi-tof)m/z的计算值:338.1387,实测值:338.1397。
[0483]
基于化合物7f的x射线晶体学数据分配绝对立体化学。
[0484]
药物候选物的对映选择性芳基化
[0485][0486]
在配备有磁力搅拌棒的2-打兰小瓶中装入在hfip(0.25ml)中的pd(oac)2(4.4mg,10mol%)和l1(8.8mg,20mol%)。向溶液添加8(65.0mg,0.2mmol)。然后添加ag2co3(82.7mg,0.30mmol)、na2co3(31.8mg,0.30mmol)和2a(104.8mg,0.40mmol)。随后,将小瓶加盖并盖紧。然后将反应混合物在80℃下以200rpm的速率搅拌16小时。在允许冷却至室温之后,将混合物用乙酸乙酯稀释,并随后添加0.1ml乙酸。使混合物通过用乙酸乙酯作为洗脱剂的硅藻土垫,以去除任何不溶的沉淀物。将所得溶液浓缩,并将残余的混合物用最少量的丙酮溶解,并上样到制备型tlc板上。然后使用制备型tlc分离纯的产物,其中乙酸乙酯和己烷(1/1)作为洗脱剂以及1%v/v的乙酸作为添加剂。获得为白色固体的产物(90%产率)。
[0487][0488]
(1r,2r)-1-(3’,4
’-
二氯-2-氟-[1,1
’-
联苯]-4-基)-2-(4-(甲氧基羰基)苯基)环丙烷-1-羧酸(9)
[0489]
底物的对映体纯度通过sfc分析确定(ad-3柱,30%
i
proh/co2,流速2.0ml/分钟,保留时间6.029分钟(主要)和7.129分钟(次要),97∶3er);
[0490]1h nmr(600mhz,cdcl3)δ7.98(d,j=8.4,2h),7.63(s,1h),7.51(d,j=8.4hz,1),7.38-7.36(m,4h),7.30(d,j=7.8hz,1h),7.26(d,j=10.8hz,1h),3.94(s,3h),2.92(t,j=8.4hz,1h),2.32(dd,j=6.9,5.7hz,1h),1.75(dd,j=8.7,5.1hz,1h);
13
c nmr(150mhz,cdcl3)δ175.21,167.13,159.28(d,j=243hz),141.66(d,j=8hz),140.79,135.32,132.80,132.25,130.88(d,j=3hz),130.61,130.41(d,j=3hz),129.62,129.36,129.12,128.38(d,j=3hz),126.47(d,j=3hz),126.24(d,j=12hz),118.33(d,j=22hz),52.31,37.29,34.85,19.59;
19
f nmr(376mhz,cdcl3)δ-117.31(s,1f);
[0491]
c
24
h
18
cl2fo
4+
[m+h]
+
的hrms(esi-tof)m/z的计算值:459.0561,实测值:459.0564。
[0492]
化合物的x射线晶体学数据
[0493]
图s1:7f的x射线结构
[0494][0495]
表s1:7f的晶体数据和结构精修
[0496][0497]
1.xiao,k.-j.;lin,d.w.;miura,m.;zhu,r.-y.;gong,w.wasa,m.;yu,j.-q.j.am.chem.soc.2014,136,8138.
[0498]
2.li,j.;luo,s.;cheng,j.p.j,org.chem.2009,74,1747.
[0499]
3.ishihara,k.;nakano,k.j.am.chem.soc.2005,127,10504.
[0500]
4.nagamine,t.;lnomata,k.;endo,y.heterocycles 2008,76,1191.
[0501]
5.wasa,m.;engle,k.m.;lin,d.w.;yoo,e.j.;yu,j.-q.j.am,chem.soc.2011,133,19598,
[0502]
6.santen pharmaceutical co.,ltd ep21197032009,a1,
[0503]
7.wyeth us2008/2551922008,a1
[0504]
8,giri,r.;wasa,m,;breazzano,s.p.;yu,j.-q.org.lett.2006,8,5685.
[0505]
9.jahngen,e.g.e.;phillips,d.;kobelski,r.j.;demko,d.m.j.org.chem.1983,48,2472.
[0506]
10.chen,k.;li,z.-w.;shen,p.-x.;zhao,h.-w.;shi,z.-j.chem.eurj.2015,21,7389.
[0507]
11.schiefer,i.t.;abdul-hay,s.;wang,h.;vanni,m.;qin,z.;thatcher,g.r.j.j.medchem.2011,54,2293.
[0508]
12.elling,g.r.;hahn,r.c.;schwab,g.j.am.cherm.soc.1973,17,5659.
[0509]
本文中提及的所有专利和出版物均以如同每个单独的出版物均明确地和单独地表明通过引用整体并入的相同程度通过引用并入本文。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1