一种小分子STAT3抑制剂WZ-2-033及其在制备治疗乳腺癌和胃癌药物中的应用的制作方法
本发明属于医药技术领域,具体涉及小分子stat3抑制剂wz-2-033及其在制备治疗乳腺癌和胃癌中的应用。
技术背景
乳腺癌是最常见的女性恶性肿瘤,全球乳腺癌的发病率自20世纪70年代末开始一直呈上升趋势,美国8名妇女一生中就会有1人患乳腺癌。虽然目前中国乳腺癌发病率较低,但是从90年代以来,我国乳腺癌的发病率和致死率明显上升,在全球排前五位。在乳腺癌的治疗方面,外科手术仍是治疗乳腺癌的主要手段,化疗、放疗和内分泌治疗作为辅助治疗。随着对乳腺癌的深入研究,治疗手段也越来越多样化,患者的疗效也有所提升。尽管如此,乳腺癌因其高异质性、耐药性、转移等原因,使其治疗受到一定的限制,其治疗任务仍然艰巨。
胃癌是消化系统常见的恶性肿瘤,发病率和病死率在我国均较高。它具有“三高三低”的特点,即发病率高、转移率高和死亡率高,早期诊断率低、切除率低和五年生存率低。目前,以手术和化疗为主的综合治疗是胃癌的标准治疗方式。然而,现有的治疗手段有限,单纯的手术治疗的总生存率低,放疗、化疗未能产生显著的生存优势,因此,急需研制新的治疗方法或药物以应对胃癌发病率和死亡率日益增长的现状。
随着分子生物学的快速发展,抗肿瘤的研究逐渐转向靶向治疗时代,新型靶向抗肿瘤药物也逐渐成为当前抗肿瘤研究的热点。分子靶向性药物主要靶向于特定的细胞、基因或受体,具有特异性强、效率高、副作用小、提高患者总生存期等优点。
stat3(signaltransducerandactivatoroftranscription3)作为信号转导与转录激活因子(stat)家族的一员,在细胞内发挥着信号传导和激活下游靶基因的转录两种功能。在细胞内,stat3可被细胞因子和生长因子激活,参与细胞增殖、分化、凋亡、血管生成和免疫调节等多种生理过程。在多种癌症细胞中,stat3呈现出持续激活的状态,并且这种持续激活的状态可以导致与癌症增殖、生存、分化、凋亡、血管生成、免疫抑制等相关的靶基因被异常激活,最终促进多种实体瘤和血液癌的发生发展,包括乳腺癌、胃癌、肺癌、前列腺癌、头颈癌、胰腺癌、白血病、淋巴瘤等。因此,stat3可作为乳腺癌和胃癌分子靶向治疗的潜在靶点。
现有的stat3抑制剂包括了寡核苷酸类、多肽类、天然化合物类和小分子化合物类等。由于寡核苷酸和多肽类抑制剂的体内稳定性差、毒性高、易降解、生物利用度低等因素限制了它们的应用;天然化合物类抑制剂成分复杂,具有多靶点效应,是否直接针对stat3仍不清楚,机制不明;小分子化合物类抑制剂stattic、niclosamide、c188-9、bp-1-102等存在特异性不足,口服生物利用度低、溶解性差以及结构不稳定等问题,需进一步优化提高成药性。尽管已有stat3抑制剂进入了临床试验阶段(如opb-31121、opb-51602、bbi-608等),但至今未有stat3抑制剂被批准用于临床治疗的。因此,进一步开发新型stat3抑制剂十分有必要。
技术实现要素:
本发明的目的在于提供一种新型的以stat3抑制剂发挥作用的化合物,同时提供其在制备治疗恶性肿瘤中的应用。本发明公开的新型stat3抑制剂,用于治疗乳腺癌和胃癌,其作用机制明确,为后续以stat3为靶点开发新型药物奠定基础,具有重要的理论意义和广阔的应用前景。
为实现以上目的,本发明采用的技术方案是:
一种小分子stat3抑制剂wz-2-033在制备治疗恶性肿瘤药物中的应用,所述小分子stat3抑制剂wz-2-033结构式如下:
作为一种优选的方案,所述恶性肿瘤包括血液瘤和实体瘤;其中,所述血液瘤包括白血病或淋巴瘤,所述实体瘤包括乳腺癌、胃癌、胰腺癌、卵巢癌、前列腺癌、肠癌、肺癌或头颈癌。
作为一种优选的方案,所述药物包括药学上可接受的盐,以及药学上可接受的载体。
作为一种优选的方案,所述药物的剂型包括注射剂、胶囊剂、片剂、丸剂或颗粒剂。
术语“药学上可接受的”是指某载体、运载物、稀释剂、辅料,和/或所形成的盐通常在化学上或物理上与构成某药物剂型的其它成分相兼容,并在生理上与受体相兼容。
术语“盐”、“可接受的盐”和“可药用的盐”是指上述化合物或其立体异构体,与无机和/或有机酸和碱形成的酸式和/或碱式盐,也包括两性离子盐(内盐),还包括季铵盐,例如烷基铵盐。这些盐可以是在化合物的最后分离和纯化中直接得到。也可以是通过将上述化合物,或其立体异构体,与一定数量的酸或碱适当(例如等当量)进行混合而得到。这些盐可能在溶液中形成沉淀而以过滤方法收集,或在溶剂蒸发后回收而得到,或在水介质中反应后冷冻干燥制得。
本发明同时保护一种小分子wz-2-033,所述wz-2-033的结构式如下:
包含所述小分子wz-2-033的stat3抑制剂均在本发明保护范围内。
进一步地,本发明所述wz-2-033小分子化合物用于抑制乳腺癌和胃癌的增殖、生长、转移、侵袭、浸润以及克隆形成。
进一步地,所述wz-2-033小分子化合物抑制stat3活性蛋白即p-stat3y705高表达乳腺癌和胃癌细胞的增殖。
进一步地,所述wz-2-033小分子化合物抑制乳腺癌和胃癌细胞株的生长。
进一步地,所述wz-2-033小分子化合物抑制乳腺癌和胃癌细胞株的克隆形成。
进一步地,所述wz-2-033小分子化合物抑制乳腺癌和胃癌细胞株的迁移。
进一步地,所述wz-2-033小分子化合物诱导乳腺癌和胃癌细胞株的细胞凋亡。
进一步地,所述wz-2-033小分子化合物抑制乳腺癌和胃癌细胞株的浸润。
进一步地,所述wz-2-033小分子化合物抑制stat3与靶基因dna片段的结合。
进一步地,所述wz-2-033小分子化合物抑制p-stat3705的核转位及stat3的转录活性。
进一步地,所述wz-2-033小分子化合物抑制stat3二聚体的形成。
进一步地,所述wz-2-033小分子化合物抑制stat3信号通路及下游基因表达,在制备抑制stat3信号通路抑制剂在抗恶性肿瘤药物中的应用。
与现有技术相比,本发明具有以下优点及有益效果:
本发明筛选得到的小分子化合物wz-2-033能够在细胞水平上,与stat3蛋白相互作用,显著降低stat3的磷酸化水平(y705),抑制活化后的stat3(py705-stat3)转位入核、形成二聚体,同时也抑制入核后stat3的dna结合能力,进一步下调其转录活性及其下游靶基因c-myc、bcl-xl和mcl-1的表达。最终,wz-2-033抑制乳腺癌和胃癌细胞的增殖、克隆形成、迁移和侵袭,并诱导细胞凋亡。本发明为靶向stat3蛋白治疗乳腺癌和胃癌的新药开发提供了重要参考,具有良好的应用前景。
附图说明
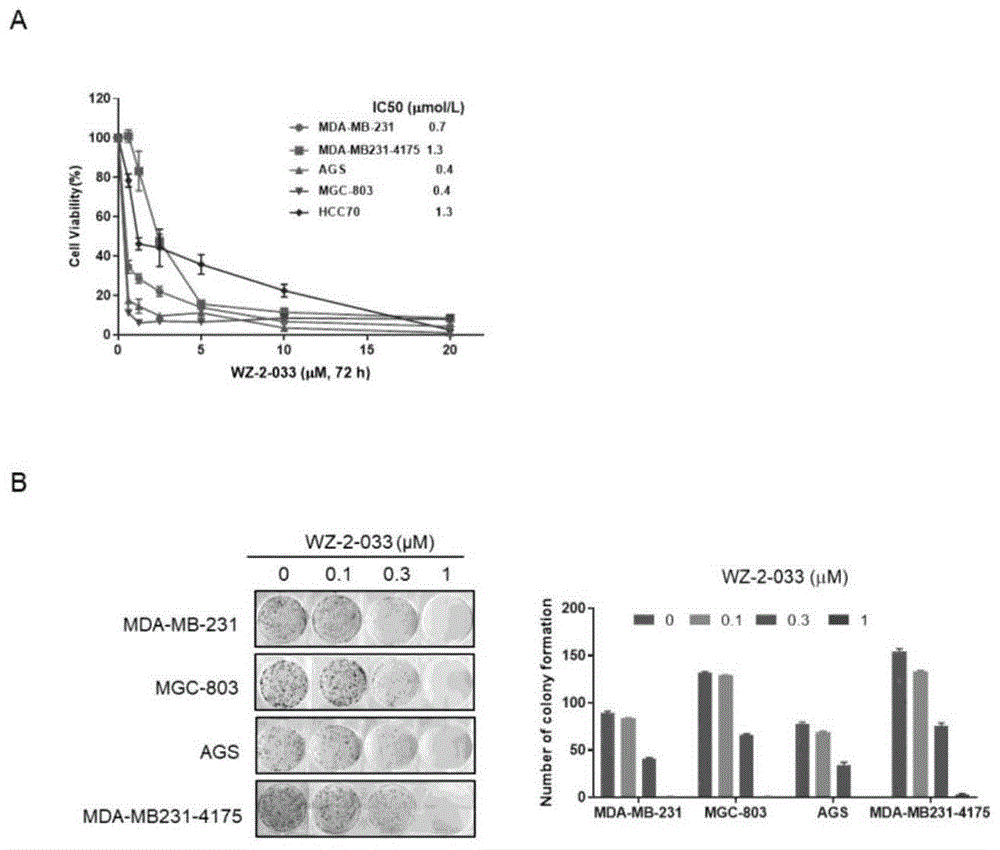
图1所示为wz-2-033对stat3过活化乳腺癌和胃癌细胞增殖、克隆形成的影响结果图。其中,图1a表示不同浓度wz-2-033处理乳腺癌和胃癌细胞72h后对各细胞活力的影响;图1b左边的图表示不同浓度wz-2-033对乳腺癌mda-mb-231和mda-mb231-4175细胞以及胃癌ags和mgc-803细胞的克隆形成的影响,右边的图为对应的克隆集落数目统计图。
图2表示不同浓度wz-2-033对乳腺癌mda-mb-231和mda-mb231-4175细胞以及胃癌ags和mgc-803细胞迁移和侵袭的影响。其中,图2a表示不同浓度wz-2-033对乳腺癌mda-mb-231和hcc70细胞以及胃癌ags和mgc-803细胞的迁移能力的影响图;图2b左边的图表示不同浓度wz-2-033对乳腺癌mda-mb-231和hcc70细胞以及胃癌mgc-803细胞刺激12h后的侵袭细胞图,右边为对应的侵袭细胞数目统计图。
图3表示不同浓度wz-2-033刺激乳腺癌mda-mb-231细胞和胃癌ags、mgc-803细胞凋亡及凋亡相关标记物的影响。其中,图3a表示不同浓度wz-2-033刺激乳腺癌mda-mb-231细胞和胃癌ags、mgc-803细胞48h后的流式检测得到的细胞群分布图;图3b上方的图为对应的凋亡细胞百分比统计图,下方的图表示不同刺激对细胞内凋亡相关蛋白cleaved-caspase7表达水平的影响图。
图4所示为wz-2-033对乳腺癌和胃癌细胞内stat3信号通路的影响。其中,图4a表示不同浓度wz-2-033处理乳腺癌mda-mb-231、hcc70细胞和胃癌ags、mgc-803细胞3个小时对细胞中p-stat3(y705)和p-stat3(s727)水平的影响;图4b表示不同浓度wz-2-033处理乳腺癌mda-mb-231、hcc70细胞和胃癌ags、mgc-803细胞24小时,对p-stat3(y705)、p-stat3(s727)、stat3以及stat3下游基因c-myc、bcl-xl和mcl-1蛋白表达水平的影响。
图5表示不同浓度wz-2-033刺激乳腺癌mda-mb-231细胞或hek-293t细胞对stat3dna结合能力及转录活性的影响。其中,图5a表示不同浓度wz-2-033刺激乳腺癌mda-mb-231细胞3h后对stat3的dna结合能力的影响图;图5b表示不同浓度wz-2-033对稳定表达stat3报告基因的hek-293t细胞中stat3转录活性影响图。
图6表示不同浓度wz-2-033对pstat3(y705)核转位及stat3二聚化的影响。其中,图6a表示不同浓度wz-2-033刺激乳腺癌mda-mb-231细胞和胃癌mgc-803细胞6h后对py705-stat3的细胞内定位情况;图6b表示不同浓度wz-2-033刺激稳定表达ha-stat3和flag-stat3蛋白的hek-293t细胞24h后,对stat3二聚化的影响图。
图7表示wz-2-033给药30天对小鼠人类胃癌模型的影响。其中,图7a表示wz-2-033给药30天对小鼠人类胃癌模型肿瘤生长的影响;图7c左侧的图表示给药30天后处死小鼠,剥离的皮下胃癌肿瘤图,右侧图为剥离的皮下胃癌肿瘤重量统计图;图7b表示各组小鼠给药30天期间小鼠的体重统计图。
图8表示wz-2-033给药对肿瘤组织内stat3信号通路及下游基因的影响。其中,图8a表示在剥离的皮下胃癌肿瘤中,wz-2-033对stat3及下游基因蛋白表达水平的影响图;图8b表示在小鼠皮下胃癌肿瘤组织切片中,wz-2-033对癌细胞生物标记物ki-67和p-stat3(y705)的影响图。
具体实施方式
为使本发明的目的、技术方案和优点更加清楚,下面结合具体实施例对本发明的技术方案进行详细的描述。显然,所描述的实施例仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动的前提下所得到的所有其它实施方式,都属于本发明所保护的范围。
除特殊说明,本实施例、实验例中所用的设备均为常规实验设备,所用的材料、试剂无特殊说明均为市售得到,无特殊说明的实验方法也为常规实验方法。
实施例1
wz-2-033的制备
2-(2-(4-三氟甲基苯基)-7-甲氧基咪唑[1,2-a]吡啶-3-基)-n-(1,1-二氧基苯[b]噻吩-6-基)乙酰胺(i)的结构如下所示
具体制备过程为
步骤1:制备2-(4-三氟甲基苯基)-7-甲氧基咪唑[1,2-a]吡啶
将600毫克(1当量)的2-氨基-4’-甲氧基吡啶与1克(1当量)的2-溴-4’-三氟甲基苯乙酮加入干净的烧瓶中,随后加入盐碳酸氢钠660毫克(1.5当量),用乙醇溶解,78℃下搅拌,加热回流4小时,tlc检测,反应完全,冷却至室温,旋干溶剂,用乙酸乙酯及水萃取分离,合并有机相,无水硫酸钠干燥,旋干溶剂后柱层析(石油醚:乙酸乙酯=5:1,v/v)得棕黄色固体0.9克,产率为:97%。
1hnmr(400mhz,cdcl3)δ8.02(d,j=8.1hz,2h),7.92(d,j=7.4hz,1h),7.75(s,1h),7.66(d,j=8.3hz,2h),6.91(d,j=2.3hz,1h),6.53(dd,j=7.4,2.4hz,1h),3.87(s,3h).ms(ei)m/z292.08(m+).
步骤2:制备乙基2-(2-(4-三氟甲基苯基-7-甲氧基咪唑[1,2-a]吡啶-3-基)乙酸乙酯
在干燥的烧瓶中加入500毫克(1当量)的2-(4-三氟甲基苯基)-7-甲氧基咪唑[1,2-a]吡啶,再加入铑催化剂rh2(s-dosp)4(0.1当量),用氯仿溶解后,在室温搅拌下,缓慢滴加重氮乙酸乙酯(1.1当量)。反应3小时后,tlc检测,反应完全,用二氯甲烷和水萃取分离,合并有机相,无水硫酸钠干燥,旋干溶剂后柱层析(石油醚:乙酸乙酯=2:1,v/v)得黄色液体505毫克,产率为:70%。
1hnmr(500mhz,cdcl3)δ8.04(d,j=7.5hz,1h),7.99(d,j=8.1hz,2h),7.69(d,j=8.1hz,2h),7.08(s,1h),6.65(dd,j=7.5,2.4hz,1h),4.23(q,2h),3.99(s,2h),3.86(s,3h),1.29(t,3h).ms(ei)m/z378.12(m+).
步骤3:制备乙基2-(2-(4-三氟甲基苯基)-7-甲氧基咪唑[1,2-a]吡啶-3-基)乙酸
称量500毫克的乙基2-(2-(4-三氟甲基苯基-7-甲氧基咪唑[1,2-a]吡啶-3-基)乙酸乙酯投入反应,用甲醇溶液溶解,再加入适量的氢氧化钠进行酯水解,室温反应1小时,反应完全。在冰浴条件下用稀盐酸(2n))中和至酸性,用乙酸乙酯与水萃取,合并有机相,用无水硫酸钠干燥,旋干溶剂,得到白色固体360毫克,产率为:82%
1hnmr(400mhz,meod)δ8.67(s,1h),7.95(s,4h),7.36(s,1h),7.23(s,1h),4.26(s,2h),4.11(s,3h).ms(ei)m/z350.09(m+).
步骤4:制备2-(2-(4-三氟甲基苯基)-7-甲氧基咪唑[1,2-a]吡啶-3-基)-n-(1,1-二氧基苯[b]噻吩-6-基)乙酰胺(i)
称量100毫克(1当量)的乙基2-(2-(4-三氟甲基苯基)-7-甲氧基咪唑[1,2-a]吡啶-3-基)乙酸和80毫克(1当量)的6-氨基苯并噻吩-1,1-二氧烷于烧瓶中,用n,n-二甲基甲酰胺作为溶剂,在冰浴条件下,加入228毫克的1-羟基-7-偶氮苯并三氮唑(hoat),以及156毫克的n,n-二异丙基乙胺(dipea),在室温下搅拌4小时,反应完全,用乙酸乙酯以及水萃取后,有机相用无水硫酸钠干燥,将溶剂旋干后柱层析(二氯甲烷:甲醇=20:1,v/v)得白色固体82毫克,产率为:49%。
1hnmr(500mhz,dmso)δ10.93(s,1h),8.34(d,j=7.5hz,1h),8.14(s,1h),7.98(d,j=8.1hz,2h),7.84(d,j=8.2hz,2h),7.76(s,1h),7.58(dd,j=16.3,7.5hz,2h),7.29(d,j=6.9hz,1h),7.04(d,j=2.0hz,1h),6.72(d,j=7.4hz,1h),4.32(s,2h),3.87(s,3h).
13cnmr(126mhz,dmso)δ168.5,158.1,146.1,141.7,141.2,139.1,137.6,133.2,130.5,128.5,127.8,127.0,126.3,126.2–125.8,123.8,115.2,112.0,107.4,94.8,56.1,32.1.ms(ei)m/z514.10(m+);hrmscalcdforc25h18f3n3o4s(m+)514.1051,found:514.1057.
实施例2:化合物wz-2-033小分子化合物抑制乳腺癌细胞核胃癌细胞的增殖
1、操作方法
(1)细胞的培养
本发明中所用的人胚胎肾细胞293(hek-293t)、乳腺癌细胞mda-mb-231、mda-mb231-4175和hcc70细胞胃癌细胞ags和mgc-803均来自于美国atcc细胞库。
人胚胎肾细胞293(hek-293t)、乳腺癌mda-mb-231和mda-mb231-4175细胞培养在含10%胎牛血清和1%双抗的dmem培养基中,胃癌细胞ags、mgc-803和乳腺癌细胞hcc70培养在含10%胎牛血清和1%双抗的rpmi1640培养基中,置于37℃,5%co2的恒温培养箱中。
(2)cck8法测定细胞增殖实验
cck8试剂中含有wst-8(2-(2-甲氧基-4-硝苯基)-3-(4-硝苯基)-5-(2,4-二磺基苯)-2h-四唑单钠盐),它在电子载体(1-methoxypms)的作用下被细胞线粒体中的脱氢酶还原为具有高度水溶性的黄色甲瓒染料,成的甲瓒物的数量与活细胞的数量成正比,因此可以用这一特性用于细胞增殖实验。
取对数生长期的各细胞,以(1-10)×103个/孔,100μl/孔的密度均匀地接种在96孔板中,置于恒温培养箱中培养至细胞贴壁。贴壁后,设置对照组、空白组和给药组,对照组加入相应的培养基,空白组只有培养基不含细胞,给药组加入不同浓度的wz-2-033,药物处理72h后,避光加入cck8,10μl/孔,混匀后避光37℃孵育0.5-4h。用酶标仪测定450nm波长下的吸光度值(od),实验重复3次。细胞活力(%)=[od(加药)-od(空白)]/[od(对照)-od(空白)]×100%。最后用graphpadprism7软件进行非线性回归得到对应的半数抑制浓度(ic50)。
(3)实验结果如图1所示,图1a为不同浓度wz-2-033对乳腺癌细胞mda-mb-231、mda-mb231-4175和hcc70,以及胃癌细胞ags和mgc-803的细胞增殖的抑制曲线。由图可知,wz-2-033可明显抑制这些细胞的细胞活力,ic50值分别为0.7、2.4、1.3、0.4和0.4μm。
实施例3:化合物wz-2-033小分子化合物抑制乳腺癌和胃癌细胞的克隆形成
(1)细胞平板克隆形成实验
当单个细胞在体外增殖6代以上,其后代所组成的细胞群体,成为集落或克隆。每个克隆含有50个以上的细胞,大小在0.3-1.0mm之间。集落形成率表示细胞的独立生存能力,故可采用细胞平板克隆形成实验测定化合物对癌细胞生存能力的影响。
取对数生长期乳腺癌mda-mb-231和mda-mb231-4175细胞、胃癌ags和mgc-803细胞,消化后重悬成单细胞悬液,计数后以约500个/孔的密度,接种于六孔板中。待细胞贴壁后,设置对照组和给药组,对照组加入含药物溶剂的培养基,给药组加入不同浓度的wz-2-033,每组设置3个复孔。待对照组长出肉眼可见的克隆集落时(7-14天),弃培养基,pbs洗涤一次,用4%多聚甲醛固定细胞15min,pbs洗涤3次,结晶紫避光染色30min。最后用流水缓慢洗去多余的结晶紫染液,室温干燥后拍照,计算细胞克隆集落数。
(2)实验结果如图1所示,图1b左侧的图为wz-2-033抑制各细胞的克隆形成图,图1b右侧的柱状图为统计图。由此可知,wz-2-033可浓度依赖性地抑制各细胞的克隆形成,在0.3μm时即可明显抑制克隆形成,说明化合物wz-2-033在细胞水平具有良好的抑制癌细胞生存的能力。
实施例4:化合物wz-2-033小分子化合物抑制乳腺癌和胃癌细胞的侵袭和迁移
(1)细胞划痕实验
细胞划痕法是检测细胞迁移运动与修复能力的方法,类似体外伤口愈合模型,在体外培养皿或平板培养单层贴壁细胞上,用微量枪头或其他硬物在细胞生长的中央区域划线,去除中央部分的细胞,然后继续培养细胞,设置正常对照组和实验组。实验结束后,取出细胞培养板,观察周边细胞是否生长至中央划痕区,以次判断细胞的生长迁移能力。
取对数生长期乳腺癌mda-mb-231和hcc70细胞、胃癌ags和mgc-803细胞,消化后计数,以(1-10)×106个/孔的密度接种于六孔板中。待细胞融合率达100%时,在平板每孔的中央划痕,pbs洗涤2次,去除划下的细胞,显微镜下拍照。设置对照组和给药组,对照组加入对应的培养基,给药组加入含不同浓度wz-2-033的培养基,每组3个复孔。当对照组周边细胞生长至划痕区域时,弃培养基,pbs洗涤1-2次去除漂浮的细胞,显微镜下每孔随机选取3个视野拍照。
(2)transwell小室侵袭实验
transwell侵袭实验,其原理就是transwell嵌套将培养孔分为上下室,在上室种肿瘤细胞,下室加入fbs或某些特定的趋化因子,肿瘤细胞会向营养成分高的下室跑。在聚碳酸酯膜(多孔膜)上室侧铺上一层基质胶,用以模仿体内细胞外基质,细胞若要进入下室,先要分泌基质金属蛋白酶(mmps)将基质胶降解,方可通过聚碳酸酯。计数进入下室的细胞数量可反映肿瘤细胞的侵袭能力。
将对数生长期胃癌mgc-803、乳腺癌mda-mb-231和hcc70细胞消化并计数,用含10%胎牛血清的培养基重悬细胞,以(1-10)×104个/孔(300μl)接种至transwell小室的上室,下室加入含10%胎牛血清的培养基。待细胞贴壁稳定生长后,弃上下室培养基,pbs洗涤一次,设置对照组和给药组,对照组上室加入等量dmso,给药组上室加入不同浓度的wz-2-033,每组设置3个复孔。上室均用无血清培养基,下室均加入500μl含有20%胎牛血清的培养基,之后置于恒温培养箱中继续培养12h。12h后,取出小室,弃培养基,pbs洗涤一次,用棉签轻轻刮去上室细胞,pbs洗涤3次,去除上室刮下的细胞。之后用4%多聚甲醛固定下室细胞15min,pbs洗涤3次,结晶紫染色30min,随后用流水缓慢洗去多余染色液直至背景干净。室温干燥后,显微镜下拍照,计数并统计侵袭细胞的数目。
(3)实验结果如图2所示,图2a为wz-2-033处理前后的细胞划痕图。由图可知,wz-2-033可抑制各细胞迁移至划痕区域,具有浓度依赖性。图2b左边为wz-2-033刺激后的侵袭细胞,右边为对应的统计图,由此可知,wz-2-033可明显减少各细胞的侵袭细胞数目,具有浓度依赖性。以上结果说明wz-2-033可明显抑制乳腺癌细胞和胃癌细胞的迁移和侵袭。
实施例5:化合物wz-2-033小分子化合物诱导乳腺癌和胃癌细胞的凋亡
(1)annexinv-fitc/pi双染法
在正常细胞中,磷脂酰丝氨酸只分布在细胞膜脂质双层的内侧,细胞发生凋亡最早期,膜磷脂酰丝氨酸(ps)由脂膜内侧翻向外侧,这一变化早于细胞皱缩、染色质浓缩、dna片断化和细胞膜的通透性增加等凋亡现象。annexinv是一种磷脂结合蛋白,与磷脂酰丝氨酸有高度亲和力,故可通过细胞外侧暴露的磷脂酰丝氨酸与凋亡早期细胞的胞膜结合。因此annexinv被作为检测细胞早期凋亡的灵敏指标之一。碘化丙啶(propidiumiodide,pi)是一种核酸染料,它不能透过完整的细胞膜,但凋亡中晚期的细胞和死细胞由于细胞膜通透性的增加,pi能够透过细胞膜而使细胞核染红。因此将annexinv与pi匹配使用,就可以将处于不同凋亡时期的细胞区分开来。因此,将annexinv与pi联合使用时,pi则被排除在活细胞(annexinv-/pi-)和早期凋亡细胞(annexinv+/pi-)之外,而晚期凋亡细胞和坏死细胞同时被fitc和pi结合染色呈现双阳性(annexinv+/pi+)。
取经过处理后的细胞,pbs洗涤后用不含edta的胰酶消化,收集细胞。用冷pbs洗涤细胞2次,尽可能吸尽pbs。用400μl1×annexinv结合液重悬细胞,浓度大约为1×106个/孔,转入新的1.5ml离心管中,置于冰上。在细胞悬液中加入2.5μlannexinv-fitc染色液,轻轻混匀后于冰上避光孵育15min。加入5μlpi染色液后轻轻混匀,冰上避光孵育5min。最后,立即用流式细胞仪进行检测。
(2)免疫印迹(westernblot)
用不同浓度wz-2-033刺激乳腺癌mda-mb-231细胞和胃癌mgc-803细胞,48h后弃培养基,pbs洗涤1次,加入ripa裂解液(含磷酸酶抑制剂和蛋白酶抑制剂)裂解细胞。将细胞裂解液离心、定量、煮沸变性,用聚丙烯酰胺凝胶sds-page电泳分离蛋白样品,之后电转至硝酸纤维素膜上,经5%bsa室温封闭1h后,分别用cleaved-caspase7和β-actin一抗4℃孵育过夜,再用相应的二抗室温孵育1h,ecl化学发光液避光孵育2min,最后用化学发光成像系统显影检测蛋白的表达水平。
(3)实验结果如图3所示,图3a为wz-2-033刺激胃癌ags、mgc-803细胞和乳腺癌mda-mb-231细胞48h后的用流式检测细胞群分布的二维散点图,该图的左下角区域代表正常细胞,右下角和右上角区域分别代表早期凋亡和晚期凋亡的细胞,左上角为坏死或机械损伤细胞。图3b上方的柱状图为对应的细胞凋亡率(包括早期和晚期凋亡细胞)统计图。由此图可知,wz-2-033刺激各细胞48h后,细胞凋亡率显著增加,具有浓度依赖性。图3b下方的图为wz-2-033刺激mda-mb-231和mgc-803细胞48h后剪切型caspase7的表达水平,wz-2-033刺激48h后的蛋白表达水平升高。综上,wz-2-033可明显诱导各细胞的凋亡。
实施例6:化合物wz-2-033小分子化合物下调stat3的磷酸化(y705)水平和stat3靶基因的表达水平
(1)免疫印迹(westernblot)
用不同浓度wz-2-033刺激乳腺癌mda-mb-231、hcc70细胞和胃癌mgc-803、ags细胞,3h或24h后弃培养基,pbs洗涤1次,加入ripa裂解液(含磷酸酶抑制剂和蛋白酶抑制剂)裂解细胞。将细胞裂解液离心、定量、煮沸变性,用聚丙烯酰胺凝胶sds-page电泳分离蛋白样品,之后电转至硝酸纤维素膜上,经5%bsa室温封闭1h后,分别用stat3、py705-stat3、ps727-stat3、c-myc、bcl-xl、mcl-1和β-actin一抗4℃孵育过夜,再用相应的二抗室温孵育1h,ecl化学发光液避光孵育2min,最后用化学发光成像系统显影检测蛋白的表达水平。
(2)实验结果如图4所示,图4a为wz-2-033处理各细胞3h后的各个蛋白的表达水平,wz-2-033能剂量依赖性地在较短时间(3h)降低stat3的磷酸化水平(y705),但不明显影响stat3总蛋白的表达水平。随后在较长时间(24h)处理后(图4b),wz-2-033能够明显下调stat3靶基因c-myc、bcl-xl和mcl-1的表达水平。此结果说明wz-2-033能够通过下调stat3的磷酸化水平(y705)从而抑制stat3的激活,并进一步影响stat3下游靶基因c-myc、bcl-xl和mcl-1的表达水平,最终影响各细胞的生长。
实施例7:化合物wz-2-033小分子化合物抑制p-stat3(y705)的核转位
(1)免疫荧光(immunofluorescence,if)
免疫荧光主要是根据抗原抗体反应的原理,先将已知的抗原或抗体标记上荧光基团,再用这种荧光抗体(抗原)作为探针检测细胞或组织内的相应抗原(抗体)。最后利用荧光显微镜确定抗原或抗体的性质和定位。
取对数生长期乳腺癌mda-mb-231细胞和胃癌mgc-803细胞接种于共聚焦皿中,待贴壁后用不同浓度的wz-2-033处理各细胞。6h后用4%多聚甲醛固定细胞15min,0.3%tritonx-100透膜10min,山羊血清室温封闭1h,用py705-stat3一抗4℃孵育过夜。随后用荧光兔二抗室温避光孵育1h,dapi避光染核10min。最后用olympus荧光显微镜观察细胞内py705-stat3的性质和定位,并拍照。
(2)实验结果如图6所示,图6a为wz-2-033处理mda-mb-231和mgc-803细胞6h后py705-stat3的细胞内定位图,wz-2-033能够浓度依赖性的降低活化后的stat3(py705-stat3)在细胞核内的表达量,说明wz-2-033可抑制活化的stat3(py705-stat3)向细胞核内转移,从而抑制stat3在细胞核内发挥转录激活靶基因的功能。
实施例8:化合物wz-2-033小分子化合物抑制stat3的二聚化
(1)免疫荧光共定位(immunofluorescence,if)
取对数生长期hek-293t细胞接种于共聚焦皿中,待贴壁后共转ha-stat3和flag-stat3质粒。待hek-293t细胞稳定表达ha-stat3和flag-stat3蛋白后,用不同浓度的wz-2-033进行刺激。细胞固定前用100ng/ml处理细胞30min,以刺激细胞内ha-stat3和flag-stat3相互作用形成二聚体。24h后用4%多聚甲醛固定细胞15min,0.3%tritonx-100透膜10min,山羊血清室温封闭1h,用ha-tag和flag-tag一抗4℃孵育过夜,随后用荧光兔二抗和荧光鼠二抗室温避光孵育1h,dapi避光染核10min,最后用olympus荧光显微镜观察细胞内ha-stat3和flag-stat3的性质和定位,并拍照。
(2)实验结果如图6所示,图6b为不同浓度wz-2-033处理hek-293t细胞24h后ha-stat3和flag-stat3蛋白在细胞内的共定位情况,其中绿色荧光为ha-stat3蛋白,红色荧光为flag-stat3蛋白,二者重合后为黄色,蓝色荧光为细胞核。wz-2-033处理后,细胞内两种蛋白表达水平下降,且黄色部分明显减少,即二者的共定位减少。这间接说明wz-2-033可以抑制stat3的二聚化。
实施例9:化合物wz-2-033小分子化合物抑制stat3的dna结合
(1)凝胶迁移(electrophoreticmobilityshiftassay,emsa)实验
emsa是一种研究dna(或rna)结合蛋白与其相应的dna(或rna)相互作用的技术,可用于定性核定量分析。原理是蛋白质-dna(或rna)复合物在非变性凝胶中的迁移率小于未结合的dna(或rna),从而检测到活化的与dna(或rna)结合的转录分子。
用wz-2-033处理mda-mb-231细胞3h,提取经过药物处理后的细胞核蛋白,bca定量。取10μg蛋白样品于生物素标记emsa探针stat3/stat5在室温进行结合,随后用非变性聚丙烯酰胺凝胶电泳,分离自由探针和与蛋白结合的探针。电转入尼龙膜上,随后于254nm紫外灯下紫外交联15min左右。用emsa专用封闭液室温封闭1h,加入链亲和素-辣根过氧化物酶交联物(hrp,按1:300比例)继续孵育15min。然后用emsa专用洗脱液洗涤4次,emsa专用发光液避光孵育2min。最后用化学发光成像系统显影。
(2)实验结果如图5所示,图5a为不同浓度wz-2-033处理mda-mb-231后stat3/stat5的dna结合能力,结果图上面的条带为与蛋白结合的探针,下面的条带为未结合蛋白的自由探针。wz-2-033能够明显降低细胞中stat3的dna结合能力,但对stat5的dna结合能力无明显影响。说明wz-2-033可选择性抑制stat3的dna结合能力,不影响stat5的dna结合能力。
实施例10:化合物wz-2-033小分子化合物下调stat3的转录活性
(1)双荧光报告基因实验
双荧光报告基因实验是通过将目的基因转录调控元件构建至带荧光素酶(fireflyluciferase)的表达载体,如pgl3,构建成报告基因质粒,使这段dna序列调控luciferase的转录。然后将报告基因质粒转染细胞,是的刺激或处理后裂解细胞,并加入底物荧光素(luciferin)后,luciferase可以催化荧光素发出荧光,从而可以通过测量荧光值的高低判断刺激前后或不同刺激对目的基因调控元件的影响。为避免由于质粒转染细胞时效率的差异而带来的误差,可以同时转入海肾荧光素酶(renillaluciferase)的报告基因质粒作为内参,即双荧光报告系统。该实验可用于研究转录因子对promoter或enhancer序列的调控。
以pgl3为模板,在其多克隆位点插入stat3特异的结合序列,构建了stat3的报告基因质粒pgl3-stat3。然后将pgl3-stat3、stat3c(stat3自活化质粒)和renilla(作为内参)质粒共同转染hek-293t细胞,待三者在细胞内稳定表达后,加入不同浓度的wz-2-033。24h后,弃培养基,加入适量报告基因细胞裂解液,室温震荡5min使其细胞充分裂解。然后加入萤火虫荧光素酶检测试剂,混匀后用化学发光仪测定rlu(relativelightunit),以报告基因细胞裂解液为空白对照。完成检测后,加入海肾荧光素酶检测工作液,混匀后测定rlu(relativelightunit)。将萤火虫荧光素酶测定得到的rlu值除以海肾荧光素酶测定得到的rlu值,根据比值来比较不同样品间stat3报告基因的激活程度,值越大,激活程度越高。
(2)实验结果如图5所示,图5b为不同浓度wz-2-033刺激转染后的hek-293t细胞24h的相对荧光强度,wz-2-033可浓度依赖性地下调该细胞的相对荧光强度,即wz-2-033可抑制stat3的转录活性。
实施例11:化合物wz-2-033小分子化合物抑制胃癌肿瘤生长
(1)裸鼠皮下荷瘤实验
皮下荷瘤实验即是在裸鼠皮下注射肿瘤细胞,肿瘤细胞吸收小鼠体内营养物质后,迅速增殖形成肿瘤,然后根据肿瘤体积大小,对小鼠进行随机分组,对实验组小鼠进行药物处理,观察药物对肿瘤的抑制效果。
将1×106个胃癌细胞mgc-803皮下注射到免疫缺陷小鼠(balb/c-nude,裸鼠,5-6周)两侧背部皮下,待皮下肿瘤长到100mm3左右时,将小鼠随机分为对照组和实验组,两组小鼠肿瘤的起始平均体积一致。对照组隔天注射100μl的含有15%纯净聚氧乙烯醚(35)蓖麻油的1×pbs,给药组隔天注射溶于15%纯净聚氧乙烯醚(35)蓖麻油的1×pbs的wz-2-033小分子化合物,每隔两天测量肿瘤的体积和小鼠体重,连续给药30天后处死小鼠,并剥离皮下肿瘤,称重并拍照。
(2)免疫组化实验
将各组小鼠的胃癌皮下肿瘤剥离出来,用4%的多聚甲醛固定、脱水、石蜡包埋、切片后,再将脱蜡、抗原修复、去除过氧化氢酶、封闭抗原位点,孵育ki-67和p-stat3(y705)一抗、二抗,然后进行显色,苏木精染色,脱水封片后,在显微镜下观察并拍照,检测各组小鼠胃癌肿瘤中ki67和p-stat3(y705)的表达。
(3)免疫印迹(westernblot)
将剥离出的肿瘤块,用手术剪刀剪成碎块,用pbs清洗后,加入ripa裂解液(含磷酸酶抑制剂和蛋白酶抑制剂)进行超声破碎和裂解。将细胞裂解液离心、定量、煮沸变性,用聚丙烯酰胺凝胶sds-page电泳分离蛋白样品,之后电转至硝酸纤维素膜上,经5%bsa室温封闭1h后,分别用stat3、py705-stat3、ps727-stat3、c-myc、bcl-xl、mcl-1和β-actin一抗4℃孵育过夜,再用相应的二抗室温孵育1h,ecl化学发光液避光孵育2min,最后用化学发光成像系统显影检测蛋白的表达水平。
实验结果如图7和图8所示,图7a显示式(i)wz-2-033能够显著地抑制胃癌肿瘤的生长;图7b为剥离的胃癌肿瘤的图片及重量统计,式(i)wz-2-033给药处理组的胃癌肿瘤重量明显小于对照组;图7c为给药期间小鼠体重的变化,对照组和实验组的小鼠体重无明显差异。图8a为小鼠剥离的胃癌肿瘤组织块中p-stat3(y705)、c-myc、bcl-xl和mcl-1的表达,如图所示,(i)wz-2-033能够显著地抑胃癌肿瘤中stat3的活性和下游基因的表达。图8b为各组小鼠剥离的胃癌肿瘤的免疫组化图,ki-67为细胞增殖的标志物,其表达量随着胃癌恶性程度的增加而升高,从图中可以看出式(i)wz-2-033组的褐色较浅且少,而对照组则褐色较多且深,说明式(i)wz-2-033可以显著抑制胃癌的恶性增长,而p-stat3(y705)染色也呈现相似的趋势,这说明式(i)wz-2-033抑制胃癌的恶性增殖是通过对stat3信号通路的抑制而实现的。
最后所应当说明的是,以上实施例仅用以说明本发明的技术方案而非对本发明保护范围的限制,对于本领域的普通技术人员来说,在上述说明及思路的基础上还可以做出其它不同形式的变化或变动,这里无需也无法对所有的实施方式予以穷举。凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明权利要求的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!