一种靶向CKIP-1的用于检测骨质疏松症的荧光探针及其在活体检测中的应用的制作方法
一种靶向ckip-1的用于检测骨质疏松症的荧光探针及其在活体检测中的应用
技术领域
[0001]
本发明涉及一种检测骨质疏松症的生物标志物ckip-1、及其可激活式近红外荧光探针的制备方法及应用。
背景技术:
[0002]
骨质疏松症(osteoporosis,op)是一种以骨量下降和骨微结构恶化为特征的骨骼退行性疾病,最终导致骨骼脆弱性和骨折风险增加。它的发生是由于骨重塑紊乱,而骨重塑又主要受骨形成和骨吸收的调节。骨质疏松症包括两种类型:原发性(i型:绝经后,ii型:老年)和继发性(如先天性疾病、药物和失重/停用)。由于其高发病率和死亡率,已成为世界范围内的重大公共卫生问题。据估计到2020年,美国的骨质疏松症患者数量将从大约1000万增加到1400多万;在中国,40-49岁人群中骨质疏松症患病率为3.2%,50岁以上人群为19.2%,65岁以上人群为32.0%。此外,骨质疏松性骨折最严重的为髋部骨折,且正在呈逐年增加。世界卫生组织(who)预测,2025年全球髋部骨折数量将达到260万,2050年将达到450万。骨质疏松患者髋部骨折的终生风险高达40%,与冠心病相当。足可见其危害性及严重性,随之带来的巨大社会医疗经济负担。op也被认为是一种“无声的流行病”,因为它通常在骨折住院患者中才得到初步诊断。虽然op目前仍无法治愈,但早期诊断和治疗后的随访有助于减缓其发展进程。
[0003]
目前,临床骨质疏松症主要依靠双能x线骨密度仪(dxa)或定量ct(qct)成像技术来测量骨密度或骨骼微结构,是临床判断骨质疏松症的金标准。基于光学成像的分子探针作为临床检测手段的重要补充,其本身没有辐射暴露问题,可以实现体内无创或微创成像效果。它能以体内特定分子作为荧光成像的靶点,在细胞或分子水平上直接显示生理和病理过程,从而达到疾病检测和诊断的目的。
[0004]
近红外荧光(nir)日益成为体内荧光成像的首选工具,因为近红外发射波长为650-900nm,这为荧光探针提供了高的组织穿透性,并避免了组织的自发荧光。近红外成像的这种优势使其能够更多的应用于临床,特别是在肿瘤学研究和外科指导。
[0005]
然而,到目前为止,只有几个基于nir的应用被开发来监测骨重塑活动的探针。一种选择是将近红外荧光团(如irdye78、irdye800cw、indocyanine green)与具有骨的高结合亲和力的物质(如二磷酸盐和四环素)结合的探针。探针发展的另一个方向是利用具有催化活性的组织特异性酶的活化策略。最近,开发了一种利用cathepsin k可分裂序列的可激活探针。在cathepsin k存在的情况下,该探针从原本淬灭形式变成荧光,这使得它对骨吸收的变化敏感这些探针只能监测骨形成或骨吸收活动,不能监测活体动物的骨密度或骨质疏松状态。也就是说缺乏可靶标的生物标志物或指标,使得基于nir的荧光成像技术在动态骨重塑中面临挑战。因此,深入挖掘有效的骨代谢或骨质疏松标志物势在必行,如何激活和捕获靶点的荧光信号也待解决,特别是对于低丰度的靶点或生物标志物。
[0006]
有鉴于此,特提出本发明。
技术实现要素:
[0007]
第一方面,本发明提供了一种可用于检测骨质疏松症的生物标志物,其特征在于,所述标志物为酪蛋白激酶2相互作用蛋白-1(ckip-1),其与骨质疏松症呈负相关性。
[0008]
第二方面,本发明提供了一种基于上述生物标志物的近红外荧光探针,其特征在于,所述探针可特异性识别ckip-1mrna序列。
[0009]
本发明提供的近红外荧光探针,其特征在于,所述探针由带有荧光标记的dna荧光链f-dna、带有淬灭基团的dna淬灭链q-dna和杂交连接dna链linker dna组成的双链结构,见图1;linker dna上具有第一结合区域和第二结合区域,其中第二结合区域与f-dna的临近荧光基团部分序列互补,第一结合区域与待检测靶标部分或完全互补。
[0010]
当不存在待检测靶标时,荧光标记和猝灭基团临近,不发光。
[0011]
当存在待检测靶标时,linker dna能够优先与靶标序列互补结合,释放f-dna,发出荧光。
[0012]
进一步地,第一结合区域比第二结合区域长,使得当存在待检测靶标时,linker dna能够优先与靶标互补,释放f-dna。
[0013]
进一步地,探针还包括燃料链,所述燃料链与linker dna部分互补,且互补区域包括第二结合区域互补。
[0014]
进一步地,燃料链与linker dna互补区域长于待检测靶标与linker dna互补区域,使得燃料链能够与第二结合区域互补结合,释放q-dna和待检测靶标。
[0015]
进一步地,荧光标记可选用cy5,还可选用irdye78、irdye800cw、indocyanine green等荧光标记。当荧光标记为cy5时,可选用猝灭基团bhq3。
[0016]
进一步地,探针还包括燃料链,所述燃料链与linker dna部分互补,且互补区域包括第二结合区域。
[0017]
更进一步地,燃料链与linker dna互补区域长于待检测靶标与linker dna互补区域,使得燃料链能够与第二结合区域互补结合,释放q-dna和待检测靶标。
[0018]
本发明提供的近红外荧光探针,其特征在于,cy5标记dna荧光链f-dna为seq id no:1所示序列,bhq3标记dna淬灭链q-dna为seq id no:2所示序列,杂交连接dna链linker dna为seq id no:3所示序列,燃料链dna为seq id no:4所示序列。
[0019]
本发明提供的近红外荧光探针,其制备方法包括以下步骤:将f-dna链、q-dna链和linker dna链混合,反应,即得。
[0020]
基于ckip-1的近红外荧光探针的制备方法具体如下:
[0021]
(1)将f-dna链、q-dna链和linker dna链以1:2:2比例混合,95℃孵育5分钟,然后以0.1℃/s梯度降温至37℃;
[0022]
(2)待步骤(1)所述反应结束后,将所得探针进一步与燃料链dna混合,与3000(thermo fisher scientific,usa)室温孵育30min;探针与燃料链dna的摩尔比为1:5。
[0023]
(3)步骤(2)反应结束后,即得近红外荧光探针。
[0024]
第三方面,本发明提供一种近红外荧光探针的制备方法,其特征在于,将上述linker dna链、q-dna链和f-dna链以合适比例混合,反应,即得。
[0025]
进一步地,所述反应的具体条件为:90-98℃孵育10分钟,然后以梯度降温至37℃;
反应结束后,将所得探针进一步与燃料链dna混合,于室温孵育30min。
[0026]
更进一步地,所述反应的具体条件为:95℃孵育5分钟,然后以0.1℃/s梯度降温至37℃;反应结束后,将所得探针进一步与燃料链dna混合,于室温孵育30min;探针与燃料链dna的摩尔比为1:5。
[0027]
本发明设计了一种特异性、高灵敏的近红外荧光探针,用于骨质疏松症小鼠模型骨骼内ckip-1mrna水平变化的研究,反应原理如下:在没有靶标序列的情况下,f-dna上的cy5基团与q-dna上的bhq3基团接触,导致接触性淬灭,探针处于稳定的双链结构,不发光。在靶标存在的情况下,该链与linker dna上的第一结合区域toehold1(7nt)互补结合,通过替换迁移方式从linker dna释放f-dna,暴露第二结合区域toehold2(5nt),f-dna上的cy5荧光基团离开q-dna上的bhq3基团,从而激活荧光信号。但因其产生的荧光强度较弱,为了进一步放大信号,燃料链(fuel)被添加到该检测系统中。燃料链可以与暴露的第二结合区域toehold2互补结合,释放q-dna和靶标链。释放的靶标链可以继续循环与探针杂交以催化荧光放大反应。见图2。
[0028]
如上所述,linker dna上的第一结合区域toehold1可以是5-10nt、5-15nt、5-20nt长度;第二结合区域toehold2可以是3-10nt、3-15nt、3-7nt长度。linker dna上的第一结合区域(toehold1)要长于第二结合区域(toehold2),使当存在靶标时,linker dna能够优先与靶标互补,释放f-dna。另外,燃料链与linker dna互补区域长于待检测靶标与linker dna互补区域,使得燃料链能够与第二结合区域互补结合,释放q-dna和待检测靶标。
[0029]
另一方面,本发明提供了一种采用任一上述的近红外荧光探针检测细胞内ckip-1mrna水平变化的方法,包括:
[0030]
用含有10%胎牛血清、青霉素(100μg/ml)和链霉素(100μg/ml)的dmem培养基,于37℃5%二氧化碳下培育待测细胞24小时,用含有权利要求1或7所述的近红外荧光探针的培养基替换完全培养基并立即将细胞置于lsm 880airyscan活细胞成像系统中,进行荧光成像,即可监测探针在细胞内22小时的变化情况;所述细胞为小鼠巨噬前体细胞系raw264.7细胞。
[0031]
本发明还提供了一种采用任一上述的近红外荧光探针检测骨质疏松症小鼠骨骼内ckip-1mrna水平变化的方法,包括:
[0032]
向正常小鼠和三种骨质疏松症小鼠尾静脉分别注射权利要求2-4所述的近红外荧光探针,6小时后利用ivis光谱ct成像系统对小鼠进行成像,根据荧光强度的不同,确定骨质疏松症小鼠骨骼内ckip-1mrna水平的变化情况。
[0033]
另一方面,本发明提供了上述的近红外荧光探针在ckip-1mrna的水平变化检测中的应用。
[0034]
另一方面,本发明提供一种制备近红外荧光探针在检测骨质疏松症小鼠骨骼内ckip-1mrna水平的应用。
[0035]
本发明的有益效果在于:
[0036]
(1)可以作为一种新的指标来监测骨量变化和追踪体内的后续治疗反应。检测探针合成简单、检测速度快,能够追踪体内ckip-1mrna,具有高准确性和特异性。
[0037]
(2)检测探针细胞毒性小、灵敏度高,有利于细胞内检测以及活体内实时、原位监测。因此带来了一种新的在体监测骨质疏松症的发展方法与策略,为在mrna水平上检测骨
质疏松特异性分子影像学标记提供了一个新的思路。
[0038]
(3)检测探针的稳定性好、操作方法简单,具有普适性。
附图说明
[0039]
为了更清楚地说明本发明实施例或现有的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明中记载的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,还可以根据这些附图获得其他的附图。
[0040]
图1为基于ckip-1的近红外荧光探针的结构示意图;
[0041]
图2为近红外荧光探针检测ckip-1mrna的水平变化的原理示意图;
[0042]
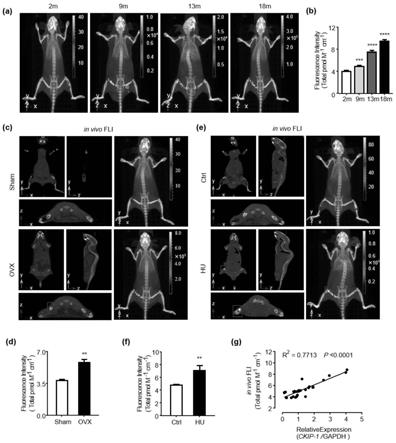
图3为衰老型骨质疏松模型小鼠中骨量丢失程度与ckip-1mrna的相关性;
[0043]
图4为绝经后骨质疏松模型小鼠中骨量丢失程度与ckip-1mrna的相关性;
[0044]
图5为废用性或失重性骨质疏松模型小鼠中骨量丢失程度与ckip-1mrna的相关性;
[0045]
图6为三种骨质疏松模型样本中ckip-1mrna表达与骨量的相关性分析;
[0046]
图7为基于ckip-1的近红外荧光探针的细胞毒性与半衰期分析;
[0047]
图8为基于ckip-1的近红外荧光探针在活细胞内荧光成像结果;
[0048]
图9为基于ckip-1的近红外荧光探针在小鼠活体内荧光成像结果;
[0049]
图10为基于ckip-1的近红外荧光探针在小鼠离体骨骼样本中荧光成像结果。
具体实施方式
[0050]
以下的实施例便于更好地理解本发明,但并不限定本发明。下属实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的试验材料,如无特殊说明,均为自常规生化试剂商店购买得到的。以下实施例中的定量试验,均设置三次重复实验,结果取平均值。
[0051]
实施例1、ckip-1mrna表达与骨质疏松的相关性
[0052]
1、构建衰老型骨质疏松模型,使用不同年龄(9m、13m和18m)的c57bl/6j雄鼠(n=5/组),以2m小鼠作为对照组(n=5)。
[0053]
2、构建绝经后骨质疏松模型,c57bl/6j雌鼠(20只)分别于4月龄时进行假手术(sham)或去卵巢(ovx),并在相同的饲养条件下饲养8周,具体手术操作如下:小鼠称重、麻醉成功后,取出卵巢并置于污物盘。确认彻底止血后,将组织还纳入腹腔。随后,在对侧相应位置予以同样操作,将小鼠右侧卵巢予以切除,最后用碘伏消毒。假手术组:暴露双侧卵巢后,不予切除,仅在双侧卵巢附近切除与卵巢大小相近的脂肪组织。彻底止血后,将组织还纳入腹腔。37℃保温板上复苏,待小鼠清醒后,将其放回洁净笼具后放回饲养室饲养。术后连续3d肌肉注射青霉素4万单位预防感染,注射0.1ml/kg的美洛昔康止痛,观察小鼠状态及死亡情况并做好记录。
[0054]
3、构建废用性骨质疏松或失重性骨丢失模型,选取6月龄、体重相差不超过0.5g的c57bl/6j雄鼠,随机分成对照组和尾吊组,利用医用一次性胶带及透气输液贴固定小鼠尾部,建立小鼠尾部悬吊模型。
[0055]
具体步骤如下:
[0056]
(1)小鼠置于固定器中,酒精棉球擦拭鼠尾部,去除油污及污垢,干棉球擦干。
[0057]
(2)用透气输液贴粘在小鼠尾部近中端三分之一处,其上再以合适的松紧度自尾根至尾中缠绕,末端保留一小段与可活动滑轮相连。
[0058]
(3)滑轮位于笼中横杆上,调整高度,确保小鼠后肢悬空,躯干与地面水平呈30
°
角,保证其前肢能够自由活动、饮水、进食和梳理毛发,昼夜节律无改变。
[0059]
(4)每日观察悬吊情况,调整合适的悬吊角度,注意尾部血运情况,尤其是有无水肿异常,如有变化及时调整胶带松紧度,避免小鼠过多应激反映影响实验结果。悬吊时间为28天,每隔3天更换清洁饮水、标准小鼠饲料,并称重。
[0060]
(5)每个尾吊笼一只对照组小鼠,一只尾吊组小鼠,中间用隔板分开,保证环境均一性。
[0061]
4、采用micro-ct对步骤1-3所述的对照组和骨质疏松组的小鼠股骨进行扫描,有效像素尺寸为8.89μm,电压为60kv,电流为220μa,每360个旋转曝光时间为1500ms。图像由1536个切片组成,三个轴上的体素大小为8.89μm。利用二维图像重建三维可视化图像(横截面和冠状面),并利用inveon research workplace(siemens)计算参数。分别测量骨密度(bmd)、相对骨体积(bv/tv)、骨表面积/骨体积(bs/bv)、小梁数目(tb.n)、小梁厚度(tb.th)、小梁分离(tb.sp)和小梁形态因子(tb.pf)。感兴趣的分析区域是股骨远端的第二生长板下1-2毫米的区域。
[0062]
在步骤1所述的衰老型骨质疏松小鼠模型中,随着小鼠年龄的增长,骨密度(bmd)、骨小梁相对体积(bv/tv)、骨小梁厚度(tb.th)、骨小梁数量(tb.n)均明显降低,而骨小梁间距(tb.sp)和骨小梁模式因子增加,提示骨质疏松程度越高。见图3(c)。
[0063]
在步骤2所述的绝经后骨质疏松小鼠模型中,实验组小鼠的骨密度(bmd)、骨小梁相对体积(bv/tv)、骨小梁厚度(tb.th)、骨小梁数量(tb.n)均明显降低,而骨小梁间距(tb.sp)和骨小梁模式因子增加,提示骨质疏松程度严重。见图4(c)。
[0064]
在步骤3所述的废用性骨质疏松或失重性骨丢失小鼠模型中,与对照组相比,实验组小鼠骨密度(bmd)、骨小梁相对体积(bv/tv)、骨小梁厚度(tb.th)、骨小梁数量(tb.n)均明显降低,而骨小梁间距(tb.sp)和骨小梁模式因子增加,提示骨质疏松发生。见图5(c)。
[0065]
5、取步骤1-3所述的模型小鼠的骨组织进行he染色。
[0066]
明显见三种骨质疏松小鼠模型中,骨质疏松组的骨小梁数量均不同程度低于对照组。
[0067]
6、取步骤1-3所述的模型小鼠的骨组织置于1.5ml ep管,进行匀浆化处理、分离得到rna,检测rna质量。
[0068]
7、取步骤6所得的rna进行反转录pcr得到cdna,反应体系如下:5
×
mix 2μl,total rna 1μg,depc水补齐至10μl。pcr反应条件为:37℃反应15分钟,98℃5分钟终止,4℃保存。
[0069]
8、取步骤7所得的cdna为模板,通过rt-qpcr反应检测ckip-1mrna的表达,以gapdh为内参。上游引物:5
’-
aggaatccctaccccctgtc-3
’
;下游引物:5
’-
gcagc tcctgagtcttctcc-3
’
。pcr反应体系:2
×
mix 10μl,pcr forward primer 0.5μl,pcr reverse primer 0.5μl,dna模板1μl,ddh2o 8μl。pcr反应条件为:95℃反应10分钟,40个循环扩增(95℃10s,60℃10s,72℃反应10s);溶解温度95℃ 10s,65℃ 1min,97℃ 1s;37℃冷却30s。反应结束后得
到阈值循环(ct)值,代表靶基因的相对表达,确认实时定量pcr的扩增曲线和溶解曲线。使用内参gapdh的2-δδct方法相对定量ckip-1的相对表达水平。
[0070]
在步骤1所述的衰老型骨质疏松小鼠模型中,ckip-1表达水平随年龄的增长而增加,随骨质疏松程度的加深而递增,见图3(d)。
[0071]
在步骤2所述的绝经后骨质疏松小鼠模型中,去卵巢组的ckip-1表达水平明显高于假手术组,见图4(d)。
[0072]
在步骤3所述的废用性骨质疏松或失重性骨丢失小鼠模型中,尾吊组的ckip-1表达水平明显高于对照组,见图5(d)。
[0073]
9、进一步将三种骨质疏松模型样本数据放在一起,进行ckip-1表达与bmd的相关性分析,发现ckip-1mrna水平与骨密度呈负相关(r=0.5858,p<0.0001),见图6。这些数据提示,无论何种因素导致的骨质疏松症,ckip-1mrna表达水平均随骨质疏松的发生成比例增加,使其成为有价值的体内骨量变化的生物标志物。
[0074]
实施例2、基于ckip-1的近红外荧光探针的制备与检测
[0075]
1、在pcr管中混合50μl tris-hcl buffer(ph7.4,10mm mgcl2)、20μl linker dna链(100μm)、20μl q-dna链(100μm)和10μl f-dna链(100μm),95℃孵育10分钟,然后以0.1℃/s梯度降温至37℃。用紫外分光光度计测定了所形成的linker/f/q双链结构。接着将探针进一步与燃料链混合,混合摩尔比例为1:5,与3000(thermo fisher scientific,usa)室温孵育30min,完成探针体系制备。
[0076]
当探针用于活细胞检测时,制备体系及步骤如下:lipofectamine
tm 3000试剂6μl和opti-mem
tm
培养基100μl充分混匀(a液),探针(5μg/μl)8μl、p3000
tm
试剂16μl和opti-mem
tm
培养基100μl也充分混匀(b液),室温孵育5min,将b液加入a液中,室温孵育15min,检测前该体系中加入8μl的燃料链(100μm)孵育5min即可。
[0077]
也可采用如下方法进行制备:当探针用于活体检测时,制备体系及步骤如下:lipofectamine
tm 3000试剂100μl(a液),探针(20μg/μl)50μl和p3000
tm
试剂100μl充分混匀(b液),室温孵育5min,将b液加入a液中,室温孵育15min,检测前该体系中加入50μl的燃料链(500μm)孵育5min即可。
[0078]
所需序列显示如下(5'-3'):
[0079]
linker dna(linker):
[0080]
aaccgctatgtggtgctgaatagggacccgtaagttagtgaga
[0081]
q-dna (q):tctcactaacttacgg-bhq3
[0082]
f-dna(f):cy5-ccctatagcttatcagact
[0083]
fuel dna(fp):ctaacttacgggaccctattcagcaccacat
[0084]
ckip-1:ttcagcaccacatagcggtt
[0085]
2、体外模拟步骤1所得的探针与ckip-1的结合,在黑色96孔板中,添加200μl tris-hcl溶液后,37℃条件下分别加入不同比例的linker/f/q(10μm)和fuel(100μm),随后在上述混合液中加入靶标链(ckip-1 100μm)。定量酶标仪在不同时间点测量相对荧光强度,持续12h。体外溶液反应6h后,利用ivis光谱成像系统拍摄荧光图像。
[0086]
3、用cck-8活力法检测步骤1所得探针的细胞毒性,所述细胞为raw264.7细胞系。细胞接种于96孔板,37℃下分别加入6个不同浓度(0~200μg/ml)的探针溶液。处理24h后,
弃去探针与培养液,用100μl的1
×
pbs溶液洗涤2次后,在100μl的新鲜培养基中加入10μl的cck-8试剂。在450nm下,通过m200 pro nano定量酶标仪测量96孔板的吸光度,得到细胞毒性实验的细胞活力(cv)值。即使用最高浓度(200μg/ml)的探针孵育,细胞存活率也接近95%,表明探针的细胞毒性极低,见图7(a)。
[0087]
4、检测步骤1所得的探针的半衰期,采集小鼠全血后,edta抗凝处理,将其加入96孔板中,每孔200μl。分为空白组、探针+fuel组、探针+fuel+ckip-1组,每组重复3次。为了找出探针在血浆中的半衰期,每隔2h使用定量酶标仪监测相对荧光强度变化,连续监测48h后定量分析。探针在小鼠血浆中的半衰期为16h,见图7(b)。
[0088]
5、在细胞水平检测步骤1所得的探针的特异性,分离8周龄同窝野生型和ckip-1敲除的雄性小鼠的骨髓细胞,csf刺激后诱导成bmdm,巨噬细胞膜表面特异性抗体双标(cd11b和f40/8)后流式鉴定,双阳细胞均达到95%以上;并在上述细胞中加入探针,6小时后固定,0.5%bsa封闭0.5小时,cd68一抗4℃过夜,次日标记荧光二抗(488nm),共聚焦显微镜下拍摄野生型和ckip-1敲除小鼠的bmdm中的cd68和探针荧光的变化情况。
[0089]
实施例3、基于ckip-1的近红外荧光探针在活细胞内荧光成像及小鼠活体荧光成像
[0090]
1、将小鼠巨噬前体细胞系raw264.7细胞接种于共聚焦培养皿中,在dmem培养基中添加10%胎牛血清、青霉素(100μg/ml)和链霉素(100μg/ml),于37℃5%二氧化碳下培养24小时后,用含探针的培养液替换完全培养基并立即将培养皿置于活细胞成像系统中,监测探针在细胞内22小时变化情况。在加入探针1.5h后,细胞开始出现近红外荧光,6h达到荧光信号峰值,随后逐渐下降,见图8(a)-(b)。相比之下,本底ckip-1表达量极低的mc3t3-e1细胞中没有激活探针,见图8(c),表明其高选择性。
[0091]
2、在三种骨质疏松模型的小鼠尾静脉注射近红外荧光探针(60mg/kg)6小时后,将小鼠麻醉再使用ivis光谱ct成像系统中在647nm的激发波长下对小鼠进行ct与荧光成像。
[0092]
在衰老型骨质疏松模型中,2月龄c57雄鼠股骨上可以观察到极微弱荧光;相比之下,随着年龄的增加,在9月、13月和18月龄小鼠股骨中可以看到逐渐增强的共区域荧光,见图9(a)。活体荧光定量分析也显示,年龄越大,荧光强度明显增强,与ckip-1mrna水平随着年龄增长骨质疏松症的发生而升高一致,见图9(b)。
[0093]
在绝经后骨质疏松模型中,注射探针的实验组雌鼠从多个角度(冠状面、矢状面、横轴和360
°
)均可见明显的荧光成像,而对照组未见,见图9(c)。进一步荧光定量分析也证实了实验组荧光强度显著高于对照组,见图9(d)。
[0094]
在废用性骨质疏松或失重性骨丢失模型中,与对照组相比,实验组小鼠的探针荧光强度也出现了明显的增强,见图9(e)-(f)。
[0095]
集中三种骨质疏松模型的数据,以分析探针体内荧光强度与ckip-1mrna水平的相关性,结果表明二者存在高正相关(r=0.77,p<0.0001),说明探针在体内检测ckip-1mrna具有较高的准确性和特异性,特别是在骨质疏松的骨组织中,见图9(g)。
[0096]
3、活体成像结束后,对小鼠实施安乐死后,采集离体骨骼样本,用预冷1
×
pbs清洗标本后,利用ivis光谱ct成像系统对近红外荧光探针在骨组织(股骨和胫骨)的分布进行荧光成像,并测量骨组织的荧光强度,如图10所示。
[0097]
与对照组相比,在骨质疏松模型组(衰老型、绝经后和废用性或失重性诱导模型)
中,探针的荧光强度显著增强,见图10(a),(e),(i)。定量荧光分析进一步证实以上结论,见图10(b),(f),(j)。为了更精准观察骨骼组织中探针的定位和强度变化,用calcein标记骨矿化形成线,并在未脱钙骨的冰冻切片上成像calcein和探针。我们管理钙黄绿素标记骨矿物形成过程和co-imaged钙黄绿素和undecalcified冰冻切片的骨头。图10(c),(g),(k)显示,骨质疏松模型组比对照组表现出更多更强的分布在骨矿化形成线(calcein,绿色)附近的探针荧光点(粉色)信号,定量荧光分析验证了该现象,见图10(d),(h),(l)。
[0098]
基因序列表
[0099]
seq id no:1cy5标记dna荧光链(f-dna)
[0100]
cy5-ccctatagcttatcagact
[0101]
seq id no:2bhq3标记dna淬灭链(q-dna)
[0102]
tctcactaacttacgg-bhq3
[0103]
seq id no:3杂交连接dna链(linker dna)
[0104]
aaccgctatgtggtgctgaatagggacccgtaagttagtgaga
[0105]
seq id no:4燃料链dna
[0106]
ctaacttacgggaccctattcagcaccacat
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 肿瘤靶向核磁共振/荧光双模态成像造影剂及其制备和应用的制造方法与工艺
- pH氧化还原双敏感的PAMAM靶向纳米给药载体及其制备方法与制造工艺
- 具有卵巢肿瘤靶向D构型多肽及其基因递释系统的制造方法与工艺
- 靶向survivin纳米抗体及其制备方法和应用与制造工艺
- 用于PSMA靶向的成像和放射疗法的金属/放射性金属标记的PSMA抑制物的制造方法与工艺
- 一种线粒体靶向的粘度荧光探针及其制备方法和应用与制造工艺
- 一种兼具荧光可视、磁靶向和pH敏多功能的复合空心微球药物载体及其制备方法与制造工艺
- 一种用于修饰微泡的多肽以及靶向GBM的药物制剂的制造方法与工艺
- 白果内酯作为脑靶向增效剂在制备防治脑肿瘤药物的应用的制造方法与工艺
- 机器人辅助精确靶向穿刺软组织目标柔性针夹紧固定装置的制造方法