全反式视黄酸在制备抗猪传染性胃肠炎病毒药物中的应用
1.本发明涉及一种抗猪传染性胃肠炎病毒药物,具体涉及全反式视黄酸在制备抗猪传染性胃肠炎病毒药物中的应用。
背景技术:
2.猪传染性胃肠炎(transmissible gastroenteritis ofswine,tge)是由猪传染性胃肠炎病毒(transmissible gastroenteritis virus ofswine,tgev)引起的一种急性、高度接触性肠道传染病。tgev是猪的重要病原体,是冠状病毒科(coronaviridae)的一员,临床上以发生呕吐、腹泻和脱水为特征,不同年龄和品种的猪对本病均易感,其中两周龄以内的仔猪感染后死亡率可达100%;随着感染仔猪日龄的增加,猪群的发病率和病死率降低,5周龄以上的猪感染该病临床症状只表现为呕吐、水样腹泻、体重减轻,病死率较低;成年猪临床症状轻,仅表现为厌食、腹泻,几乎没有死亡,但感染病毒的猪生长缓慢,容易成为僵猪,料肉比高。该病在1946年首次在美国进行报告,此后世界上许多国家和地区都相继报道,称为一种世界性猪疾病,受到世界各国猪病学者的高度重视。从50年代末我国便有tge(猪传染性胃肠炎)的报道,近几年该病在我国大部分省市仍在流行和发生,并且该病毒和轮状病毒、流行性腹泻病毒等腹泻病毒或细菌混合感染,给生猪养殖产业带来了巨大的经济损失。
3.目前,对tgev感染暂无有效药物,主要是通过接种灭活苗与弱毒苗来预防此病发生,而灭活苗与弱毒苗各自仍存在缺陷,不能彻底控制疫情的发生,因此寻找和开发一种安全有效的抗tgev药物具有十分重要的作用。
技术实现要素:
4.本发明的目的是提供一种全反式视黄酸在制备抗猪传染性胃肠炎病毒药物中的应用,解决了目前tgev感染暂无有效药物的问题,全反式视黄酸通过抑制猪传染性胃肠炎病毒的复制来发挥抗病毒作用,能够用于抗猪传染性胃肠炎病毒。
5.为了达到上述目的,本发明提供了全反式视黄酸在作为制备抗猪传染性胃肠炎病毒药物中的应用。
6.优选地,所述抗猪传染性胃肠炎病毒药物包含:全反式视黄酸,及药学上可接受的辅料。
7.优选地,所述全反式视黄酸在所述抗猪传染性胃肠炎病毒药物中的质量百分比不低于98%。
8.优选地,所述抗猪传染性胃肠炎病毒药物的剂型包括:片剂、粉剂、颗粒剂、胶囊、口服液、针剂或缓释剂。
9.优选地,所述全反式视黄酸的浓度为40~80μm/l。
10.优选地,所述全反式视黄酸能够抑制猪传染性胃肠炎病毒的感染。
11.优选地,所述全反式视黄酸能够抑制猪传染性胃肠炎病毒在ipec
‑
j2细胞中的感
染。
12.优选地,所述全反式视黄酸能够抑制猪传染性胃肠炎病毒的复制。
13.优选地,所述全反式视黄酸能够抑制猪传染性胃肠炎病毒在ipec
‑
j2细胞中的复制。
14.本发明的全反式视黄酸在制备抗猪传染性胃肠炎病毒药物中的应用,解决了目前tgev感染暂无有效药物的问题,具有以下优点:
15.本发明采用全反式视黄酸抑制猪传染性胃肠炎病毒的感染,全反式视黄酸是维生素a的中间代谢产物,也是维生素a发挥生理功能的主要活性形式,在调控胚胎发育,繁殖,细胞增值和分化,以及炎症和凋亡中起关键作用,但目前还没有用于抑制猪传染性胃肠炎病毒的研究报道,本发明首次公开了全反式视黄酸在制备抗猪传染性胃肠炎病毒药物中的应用,而且全反式视黄酸主要通过抑制猪传染性胃肠炎病毒的复制来发挥抗病毒作用,随着全反式视黄酸浓度升高,抑制效果越明显,其用于抗猪传染性胃肠炎病毒安全、毒副作用少,容易被动物机体所代谢和吸收,动物排泄物对环境无污染。
附图说明
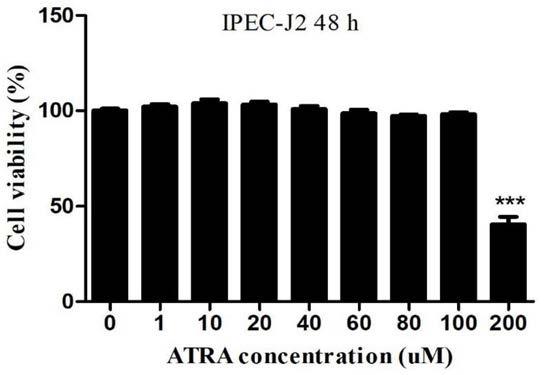
16.图1为cck8方法检测全反式视黄酸对ipec
‑
j2细胞的毒性。
17.图2为全反式视黄酸处理接种猪传染性胃肠炎病毒后经流式细胞仪检测猪传染性胃肠炎病毒感染ipec
‑
j2细胞的百分比。
18.图3为全反式视黄酸处理接种猪传染性胃肠炎病毒感染后定量猪传染性胃肠炎病毒感染ipec
‑
j2细胞的百分比(a);荧光定量pcr测定tgev mrna表达水平(b)。
19.图4为全反式视黄酸预处理后流式细胞仪检测猪传染性胃肠炎病毒感染ipec
‑
j2细胞的百分比。
20.图5为全反式视黄酸预处理后定量猪传染性胃肠炎病毒感染ipec
‑
j2细胞的百分比(a);荧光定量pcr测定tgev mrna表达水平(b)。
21.图6为全反式视黄酸处理感染猪传染性胃肠炎病毒细胞后经流式细胞仪检测猪传染性胃肠炎病毒感染ipec
‑
j2细胞的百分比。
22.图7为全反式视黄酸处理感染猪传染性胃肠炎病毒细胞后定量猪传染性胃肠炎病毒感染ipec
‑
j2细胞的百分比(a);荧光定量pcr测定tgev mrna表达水平(b)。
23.图8为全反式视黄酸处理接种猪传染性胃肠炎病毒细胞后流式细胞仪检测猪传染性胃肠炎病毒感染ipec
‑
j2细胞的百分比。
24.图9为全反式视黄酸处理接种猪传染性胃肠炎病毒细胞后定量猪传染性胃肠炎病毒感染ipec
‑
j2细胞的百分比(a);荧光定量pcr测定tgev mrna表达水平(b)。
25.图10为全反式视黄酸直接处理的猪传染性胃肠炎病毒接种于细胞后经流式细胞仪检测猪传染性胃肠炎病毒感染ipec
‑
j2细胞的百分比。
26.图11为全反式视黄酸直接处理的猪传染性胃肠炎病毒接种于细胞后定量猪传染性胃肠炎病毒感染ipec
‑
j2细胞的百分比(a);荧光定量pcr测定tgev mrna表达水平(b)。
27.注:图2、4、6、8、10中,control组为正常ipec
‑
j2细胞培养组;tgev组为正常ipec
‑
j2细胞与tgev共培养1小时组,tgev感染1小时后用pbs液洗3次,换用正常培养基继续培养细胞;tgev+atra组即正常ipec
‑
j2细胞与tgev共培养1小时后用pbs液洗3次,换用含有atra
的正常培养基继续培养细胞。
具体实施方式
28.下面将对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
29.以下实验采用的材料如下:
30.猪传染性胃肠炎病毒wh
‑
1毒株受赠于四川农业大学动物医学院;全反式视黄酸(atra)购于sigma公司;cck8检测试剂盒购自碧云天公司;tgev抗体购自santa cruz生物试剂公司;山羊抗小鼠igg h&l(alexa 488)购自abcam公司;实时荧光定量pcr(real time pcr)引物及试剂盒均购自takara公司。
31.实施例1全反式视黄酸在ipec
‑
j2细胞上细胞毒性的测定
32.ipec
‑
j2细胞计数后用含10%胎牛血清(fbs)的dmem
‑
f12营养液稀释到适当密度后以1
×
104个/孔的浓度加于96孔细胞培养板,每孔100μl,置于37℃,5%co2培养箱中培养,待细胞长到70~80%的密度后,用不同浓度(0,1,10,20,40,60,80,100,200μm/l)的全反式视黄酸处理ipec
‑
j2细胞(全反式视黄酸用二甲基亚砜(dmso)溶解,每个处理组均向培养基中加入相同体积的含不同浓度全反式视黄酸的dmso溶液),每个处理8个重复。药物作用48h后,每孔加入10μl cck8工作液,继续培养2h,然后将96孔板置于酶标仪在450nm波长处测定各孔吸光值。
33.如图1所示,与对照组相比,1~100μm/l全反式视黄酸对ipec
‑
j2细胞细胞活性无显著影响,而200μm/l全反式视黄酸显著降低了ipec
‑
j2细胞细胞活性,说明全反式视黄酸浓度低于100μm/l时对ipec
‑
j2细胞不具有明显细胞毒性。
34.实施例2全反式视黄酸在ipec
‑
j2细胞上抑制猪传染性胃肠炎病毒感染(流式细胞术和荧光定量pcr)
35.将ipec
‑
j2细胞以1
×
105个/孔的浓度接种于12孔板中,置于37℃,5%co2培养箱中培养,待细胞长到80%左右,弃旧培养液,用不同浓度(0,1,10,20,40,60,80μm/l)的全反式视黄酸预处理ipec
‑
j2细胞12h后,接种1moi(multiplicity ofinfection)的猪传染性胃肠炎病毒于ipec
‑
j2细胞,37℃,5%co2培养箱孵育1h并有全反式视黄酸存在,弃旧培养液,用pbs洗3遍,每个孔再添加与先前对应浓度的全反式视黄酸,置于37℃,5%co2培养箱中继续培养36h后,收集细胞样品。
36.以上方式处理的细胞样品制备两份,一份细胞样品先用4%多聚甲醛固定15min后,0.05%x
‑
triton打孔15min,然后4℃孵育一抗(tgev抗体)过夜,一抗孵育完成后,室温孵育二抗(山羊抗小鼠igg h&l)1h,然后用流式细胞仪来检测猪传染性胃肠炎病毒感染ipec
‑
j2细胞的百分比;另一份细胞样品用trizon处理,提取rna,并反转录合成cdna,使用actin基因作为内参,实时荧光定量pcr检测tgev mrna表达水平。
37.如图2和3所示,全反式视黄酸显著的降低了tgev病毒感染细胞的百分比和tgev mrna丰度,并且具有明显的剂量依赖性,即随着全反式视黄酸浓度的增加,tgev病毒感染细胞的百分比和tgev mrna丰度显著降低,说明全反式视黄酸能够显著抑制猪传染性胃肠炎
病毒的感染。
38.实施例3全反式视黄酸对猪传染性胃肠炎病毒感染过程的影响
39.1、全反式视黄酸对猪传染性胃肠炎病毒感染ipec
‑
j2细胞预处理的影响
40.将ipec
‑
j2细胞以1
×
105个/孔的浓度接种于12孔板中,置于37℃,5%co2培养箱中培养,待细胞长到80%左右,弃旧培养液,分别用不同浓度(0,60,80μm/l)的全反式视黄酸预处理ipec
‑
j2细胞12h,用pbs洗3遍,然后接种1moi的猪传染性胃肠炎病毒于ipec
‑
j2细胞,37℃,5%co2培养箱孵育1h后,用pbs洗3遍,换成不含全反式视黄酸的dmem
‑
f12营养液,置于37℃,5%co2培养箱中继续培养36h后,收集细胞样品。
41.以上方式处理的细胞样品制备两份,一份细胞样品用流式细胞术检测猪传染性胃肠炎病毒感染ipec
‑
j2细胞的百分比;另一份细胞样品用实时荧光定量pcr检测tgev mrna表达水平。
42.如图4和5所示,与对照组相比,全反式视黄酸对tgev病毒感染ipec
‑
j2细胞的百分比和tgev mrna丰度无显著影响,说明全反式视黄酸对猪传染性胃肠炎病毒的感染没有预防作用。
43.2、全反式视黄酸对猪传染性胃肠炎病毒入胞的影响
44.将ipec
‑
j2细胞以1
×
105个/孔的浓度接种于12孔板中,置于37℃,5%co2培养箱中培养,待细胞长到80%左右,用1moi的猪传染性胃肠炎病毒在4℃感染ipec
‑
j2细胞1h,用pbs洗3遍,分别用不同浓度(0,60,80μm/l)的全反式视黄酸处理ipec
‑
j2细胞,置于37℃,5%co2培养箱中培养1h后,用pbs洗3遍,换成不含全反式视黄酸的dmem
‑
f12营养液,在37℃,5%co2培养箱中继续培养36h后,收集细胞样品。
45.以上方式处理的细胞样品制备两份,一份细胞样品用流式细胞术检测猪传染性胃肠炎病毒感染ipec
‑
j2细胞的百分比;另一份细胞样品用实时荧光定量pcr检测tgev mrna表达水平。
46.如图6和7所示,与对照组相比,全反式视黄酸对tgev病毒感染ipec
‑
j2细胞的百分比和tgev mrna丰度无显著影响,说明全反式视黄酸对猪传染性胃肠炎病毒入胞过程没有显著影响。
47.3、全反式视黄酸对猪传染性胃肠炎病毒复制的影响
48.将ipec
‑
j2细胞以1
×
105个/孔的浓度接种于12孔板中,置于37℃,5%co2培养箱中培养,待细胞长到80%左右,接种1moi的猪传染性胃肠炎病毒于ipec
‑
j2细胞,37℃,5%co2培养箱孵育1h后,弃旧培养液,用pbs洗3遍,分别加入不同浓度(0,60,80μm/l)的全反式视黄酸处理细胞,置于37℃,5%co2培养箱中继续培养36h后,收集细胞样品。
49.以上方式处理的细胞样品制备两份,一份细胞样品用流式细胞术检测猪传染性胃肠炎病毒感染ipec
‑
j2细胞的百分比;另一份细胞样品用实时荧光定量pcr检测tgev mrna表达水平。
50.如图8和9所示,与对照组相比,全反式视黄酸显著降低了tgev病毒感染ipec
‑
j2细胞的百分比和tgev mrna丰度,说明全反式视黄酸能够显著抑制猪传染性胃肠炎病毒的复制。
51.4、全反式视黄酸对猪传染性胃肠炎病毒直接杀灭作用
52.将不同浓度(0,60,80μm/l)的全反式视黄酸溶液与tgev在37℃孵育1h后,接种
ipec
‑
j2细胞,置于37℃,5%co2培养箱中培养1h后,用pbs洗3遍,换成不含全反式视黄酸的dmem
‑
f12营养液,在37℃,5%co2培养箱中继续培养36h后,收集细胞样品。
53.以上方式处理的细胞样品制备两份,一份细胞样品用流式细胞术检测猪传染性胃肠炎病毒感染ipec
‑
j2细胞的百分比;另一份细胞样品用实时荧光定量pcr检测tgev mrna表达水平。
54.如图10和11所示,与对照组相比,全反式视黄酸对tgev病毒感染ipec
‑
j2细胞的百分比和tgev mrna丰度无显著影响,说明全反式视黄酸对猪传染性胃肠炎病毒没有直接杀灭作用。
55.尽管本发明的内容已经通过上述优选实施例作了详细介绍,但应当认识到上述的描述不应被认为是对本发明的限制。在本领域技术人员阅读了上述内容后,对于本发明的多种修改和替代都将是显而易见的。因此,本发明的保护范围应由所附的权利要求来限定。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1