一种废铅酸蓄电池铅膏的还原方法与流程
本发明属于废铅酸蓄电池回收利用领域,特别涉及一种废铅酸蓄电池铅膏的还原方法。
背景技术:
近年来,随着铅酸蓄电池消费量的节节攀升,其报废量也相应增大。目前我国铅酸蓄电池的耗铅量占据总额的70%左右,但是废铅蓄电池回收率不足90%,而发达国家一般保证100%;在我国再生铅冶炼过程中的铅回收率一般为80%左右,而国外先进水平可达98%以上。因此每年我国约有3万吨左右的废铅蓄电池未能得到回收利用,同时由于回收率低导致我国每年约有4.5万吨左右的铅及铅化合物流入到空气、土壤和水体中,造成严重的资源浪费和环境污染。因此开展无污染或轻污染铅再生过程的研究直接关系着我国铅工业的发展。
同时据文献报道,依据目前已探明铅矿资源的储采比,铅矿只足够开采25~30年。随着铅矿资源的日益枯竭,铅金属的回收及再生利用已成为实现铅工业可持续发展的必由之路。目前铅金属主要消耗在蓄电池的生产上,因此铅的再生过程主要是对废铅酸蓄电池中的铅膏渣泥进行还原转化以获得铅及铅合金的过程。该过程的难点在于铅膏的冶炼,其方法目前可分为火法、湿法和干湿联合法。火法冶炼存在着金属回收率低,能耗高和污染严重三大问题。干湿联合法一般采取湿法脱硫、火法熔炼,即对废铅蓄电池进行破碎分选、综合回收、铅膏脱硫转化之后,再用回转短窑或反射炉进行熔炼。这种方法比较纯火法冶炼,大幅降低了SO2的排放量,但是后期熔炼仍采用了高温设备,因此无法避免地会造成铅尘污染。废铅蓄电池的湿法处理可分为三类:(1)铅膏脱硫转化——浸出——电积法;(2)铅膏直接浸出——电积法;(3)铅膏直接电积法。
废铅酸蓄电池经过破碎分选后得到的铅膏是含铅化合物的混合固体,主要成分大致为:PbSO4 25%~30%,PbO2 15%~20%,Pb 2%~3%。铅膏的脱硫转化即是将其中的PbSO4转化为较易还原处理的其它化合物形态的过程。目前该工艺主要采用可溶性碳酸盐作为脱硫剂,例如Na2CO3、NH4HCO3等。而脱硫剂主要消耗在铅膏中PbSO4的转化上,铅膏中的PbO2与Pb不参与反应。
在湿法再生铅的过程中,铅膏中的PbO、Pb、PbSO4可以转化为PbCO3,之后用H2SiF4或HBF4溶液浸出制成电解液,PbO与Pb也可以直接浸出。而铅膏中的主要成分PbO2不能直接转化或浸出,必须将其还原成PbO或Pb才能进行,因此铅膏中PbO2的还原过程是湿法再生铅工艺的重要环节。
技术实现要素:
本发明所要解决的技术问题是提供一种废铅酸蓄电池铅膏的还原方法,该方法通过控制反应时间、反应温度、还原剂浓度、液固比等因素,确定了最佳的工艺参数,铅膏中的PbO2可以绝大部分被还原转化,工艺简单,成本低,具有良好的应用前景。。
本发明的一种废铅酸蓄电池铅膏的还原方法,包括:
将Na2S2O3、H2C2O4或FeSO4作为还原剂配制成浓度为0.2~1mol/l的转化液;将转化液加热至20℃~80℃后,加入废铅酸蓄电池铅膏反应30~90min,反应液固比为10~30ml/g;待反应完毕后冷却,真空过滤,冲洗,即可。
优选的,所述Na2S2O3作为还原剂,反应条件为:反应液固比30ml/g,反应温度70℃,转化液浓度1mol/L,反应时间90min。
优选的,所述H2C2O4作为还原剂,反应条件为:反应液固比30ml/g,反应温度70℃,转化液浓度1mol/L,反应时间90min。
优选的,所述FeSO4作为还原剂,反应条件为:反应液固比20ml/g,反应温度50℃,转化液浓度0.6mol/L,反应时间90min。
所述FeSO4作为还原剂,在转化液中添加与FeSO4摩尔比为5:1的H2SO4。
所述废铅酸蓄电池铅膏的粒径为125~180μm,由6-备用DZM-10型铅酸蓄电池分解后预处理获得。
本发明以Na2S2O3、H2C2O4、FeSO4还原铅膏中PbO2的反应机理分别如下:
PbO2+2Na2S2O3+H2O→PbO+Na2S2O3+2NaOH+2S;
3PbO2+H2C2O4→3PbO+H2O+2CO2↑+O2↑;
PbO2+2Fe2++SO42-+4H+→PbSO4+2Fe3++2H2O。
采用的分析纯试剂Na2S2O3、H2C2O4、FeSO4、H2SO4等产自上海国药集团化学试剂有限公司。
有益效果
本发明通过控制反应时间、反应温度、还原剂浓度、液固比等因素,确定了最佳的工艺参数,铅膏中的PbO2可以绝大部分被还原转化,工艺简单,成本低,具有良好的应用前景。
附图说明
图1为本发明反应温度对铅膏还原效率的影响;
图2为本发明反应时间对铅膏还原效率的影响;
图3为本发明还原剂浓度对铅膏还原效率的影响;
图4为本发明反应液固比对铅膏还原效率的影响;
图5为本发明铅膏还原转化指标趋势图。
具体实施方式
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。此外应理解,在阅读了本发明讲授的内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
实施例1
将Na2S2O3、H2C2O4或FeSO4作为还原剂配制成浓度为0.2~1mol/l的转化液(FeSO4转化液中含有H2SO4(固定摩尔比n H2SO4:n FeSO4=5:1));用恒温水浴床将转化液加热至20℃~80℃后,加入废铅酸蓄电池铅膏反应30~90min,反应液固比为10~30ml/g;待反应完毕后冷却,用陶瓷坩埚真空过滤,并用蒸馏水反复冲洗滤渣多次。将滤渣干燥、研磨并均匀取样,溶于乙酸钠与乙酸的混合液中。之后加入KI溶液至有游离态碘生成,以淀粉为指示剂,Na2S2O3溶液滴定,测出还原后铅膏试样中PbO2的含量,计算方法如下:
n(PbO2)=0.5*c(S2O32-)*V(S2O32-)
式中:c(S2O32-)为Na2S2O3溶液浓度,V(S2O32-)为滴定所消耗的Na2S2O3溶液体积。通过检测铅膏还原前后PbO2的含量变化,转化为还原率H,H表达式为:
H=[1-(w2/w1)]*100%
式中:w1、w2分别对应铅膏还原转化前后其中PbO2的物质含量,%。
实施例2
铅膏还原单因素实验结果与分析
分别以Na2S2O3、H2C2O4、FeSO4作为还原剂,控制条件为单因子改变,每个变化因子取5种水平,每种水平下做2次试验,取平均值结果分析。
1.温度对还原效率的影响
条件控制为反应时间60min,还原剂浓度0.6mol/L,液固比20ml/g,研究不同温度对铅膏还原效率的影响。实验结果如图1所示。
由图1可见,对于三种还原剂来说,由于温度改变导致的还原效率值的变化是不一致的。对于Na2S2O3,温度的增加与还原效率值的提升基本上呈线性关系,由20℃时的43.05%逐渐提升至80℃时的77.63%;对于H2C2O4,当温度在50℃以下时,还原效率从20℃时的55.72%迅速提升至50℃时的79.57%,当温度超到50℃,还原效率仅从79.57%升至80℃时的86.91%,变化不再显著;对于FeSO4,过高的温度反而会降低铅膏中PbO2的还原效率,温度在50℃以下时,还原效率从20℃时的48.01%提升至50℃时的最大值77.12%,之后随着温度的升高,还原效率从77.12%下降至80℃时的46.58%,原因可能是因为反应产物PbSO4在较高温度下的粘性较大,因而增大了内扩散阻力,导致实验中出现固体成团和粘壁现象,还原反应受阻,效率下降。因此本实验条件下,三种还原剂还原铅膏对应的反应温度可控制为:Na2S2O3 80℃、H2C2O4和FeSO4 50℃。
2.反应时间对还原效率的影响
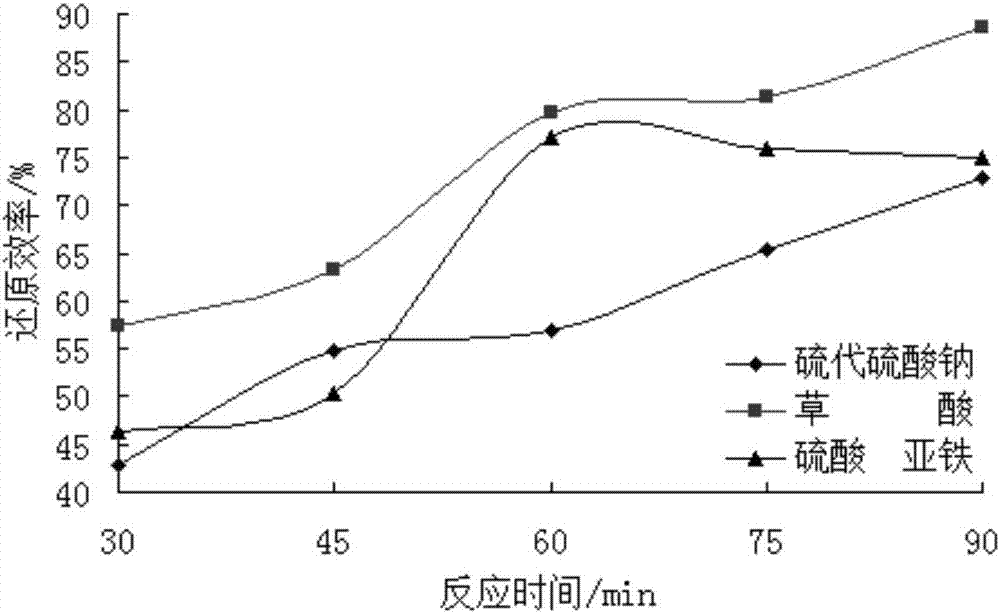
条件控制为反应温度50℃,还原剂浓度0.6mol/L,液固比20ml/g,研究反应时间对铅膏还原效率的影响。结果如图2所示。
由图2可见,随着反应时间的增加,三种还原剂对铅膏中PbO2的还原效率会随之上升。对于Na2S2O3,还原效率从30min时的42.78%逐渐提升至90min时的最大值72.87%;对于H2C2O4和FeSO4,当反应时间在60min以下时,还原效率分别从30min时的57.44%、46.25%迅速提升至79.57%,77.12%,若时间超过60min,还原效率仅从79.57%,77.12%增至90min时的88.65%,74.98%,影响效果不再显著。因此铅膏还原过程中,三种还原剂对应的反应时间可控制为:Na2S2O3 90min、H2C2O4和FeSO4 60min。
3还原剂浓度对还原效率的影响
条件控制为反应温度50℃,反应时间60min,液固比20ml/g,研究还原剂浓度对铅膏还原效率的影响。结果如图3所示。
由图3可见,对于三种还原剂来说,由于还原剂浓度的变化导致的还原效率值的改变也是不一致的。对于Na2S2O3,还原剂浓度的增加与还原效率值的提升基本上呈线性关系,由0.2mol/L时的42.42%逐渐提升至1mol/L时的75.93%;对于H2C2O4,当还原剂浓度在0.6mol/L以下时,还原效率从0.2mol/L时的54.58%迅速提升至0.6mol/L时的79.57%,当还原剂浓度超到0.6mol/L,还原效率仅从79.57%升至1mol/L时的87.89%,无显著变化;对于FeSO4,过高的还原剂浓度反而会降低铅膏中PbO2的还原效率,浓度在0.6mol/L以下时,还原效率从0.2mol/L时的51.01%提升至0.6mol/L时的最大值77.12%,之后随着温度的升高,还原效率从77.12%下降至1mol/L时的59.09%,原因可能是因为高浓度的FeSO4在溶液中易发生电化学反应生成胶体颗粒状物质,导致反应固体出现成团和粘壁现象,增大了内扩散阻力,阻碍了还原反应的进行,降低了还原效率。因此铅膏还原过程中,三种还原剂浓度可控制为:Na2S2O3 1mol/L、H2C2O4和FeSO4 0.6mol/L。
4.反应液固比对还原效率的影响
条件控制为反应温度50℃,反应时间60min,还原剂浓度0.6mol/L,研究反应液固比对铅膏还原效率的影响。实验结果如图4所示。
由图4可见,随着反应液固比的增加,三种还原剂对铅膏中PbO2还原效率的影响有所差异。对于Na2S2O3,还原效率从10ml/g时的36.44%逐渐提升至30ml/g时的最大值75.34%;对于H2C2O4和FeSO4,当反应液固比在20ml/g以下时,还原效率分别从10ml/g时的55.26%、44.22%迅速提升至79.57%,77.12%,若液固比超过20ml/g,H2C2O4和FeSO4的还原效率分别会缓慢变化至30ml/g时的81.36%,63.16%,影响效果并不显著。因此铅膏还原过程中,三种还原剂对应的反应液固比可控制为:Na2S2O3 30ml/g、H2C2O4和FeSO4 20ml/g。
铅膏还原正交实验结果与分析
①正交试验设计
分别使用Na2S2O3、H2C2O4、FeSO4作为还原剂,采用正交实验法研究反应温度、反应时间、还原剂浓度、反应液固比4个因素对铅膏中PbO2还原效率的影响。正交实验因素水平表见表1,根据四因素三水平表L9(34)进行实验。
表1铅膏还原的正交实验因素和水平
②Na2S2O3法还原铅膏实验研究
以Na2S2O3作为还原剂对铅膏进行还原转化的实验结果及每一因素在不同水平条件下的平均还原效率和极差计算值见表2。
表2Na2S2O3法还原铅膏的实验结果与分析
根据极差大小,可知以Na2S2O3还原铅膏中的PbO2,各控制因素对还原效率影响程度的降低顺序排列为:反应液固比>反应温度>还原剂浓度>反应时间。
根据实验结果中各因素平均水平值的高低,从表中可以看出,在不考虑交互作用情况下,以Na2S2O3作为还原剂还原铅膏中的PbO2,本实验条件下的优选方案应为:反应液固比30ml/g,反应温度70℃,还原剂浓度1mol/L,反应时间90min。按照此优选方案条件进行实验,得到铅膏的脱硫转化率为76.87%,高于正交试验的最佳脱硫结果68.74%。
③H2C2O4法还原铅膏实验研究
以H2C2O4作为还原剂对铅膏进行还原转化的实验结果及每一因素在不同水平条件下的平均还原效率和极差计算值见表3:
表3H2C2O4法还原铅膏的实验结果与分析
根据极差大小,可知以H2C2O4还原铅膏中的PbO2,各控制因素对还原效率影响程度的降低顺序排列为:反应温度>还原剂浓度>反应时间>反应液固比。该反应过程中,会有大量的水生成,因此液固比会在反应过程中不断改变,但是并不影响反应的进行,所以液固比对还原效率的影响不大。
根据实验结果中各因素平均水平值的高低,从表中可以看出,在不考虑交互作用情况下,以H2C2O4作为还原剂还原铅膏中的PbO2,本实验条件下的优选方案应为:反应温度70℃,还原剂浓度1mol/L,反应时间90min,反应液固比30ml/g。按照此优选方案条件进行实验,得到铅膏的脱硫转化率为94.46%,高于正交试验的最佳脱硫结果92.81%。
④FeSO4法还原铅膏实验研究
以FeSO4作为还原剂对铅膏进行还原转化的实验结果及每一因素在不同水平条件下的平均还原效率和极差计算值见表4:
表4FeSO4法还原铅膏的实验结果与分析
根据极差大小,可知以FeSO4还原铅膏中的PbO2,各控制因素对还原效率影响程度的降低顺序排列为:反应液固比>反应时间>还原剂浓度>反应温度。
根据实验结果中各因素平均水平值的高低,从表中可以看出,在不考虑交互作用情况下,以FeSO4作为还原剂还原铅膏中的PbO2,本实验条件下的优选方案应为:反应液固比20ml/g,反应时间90min,还原剂浓度0.6mol/L,反应温度50℃。按照此优选方案条件进行实验,得到铅膏的脱硫转化率为86.73%,高于正交试验的最佳脱硫结果75.22%。
⑤铅膏还原转化指标趋势对比分析图
分别以各自控制因素条件下各还原剂对铅膏还原效率的平均值为纵坐标绘制折线图,即还原指标趋势图如图5所示。
由图5可见,Na2S2O3、H2C2O4、FeSO4分别对应反应温度70℃、70℃、50℃时,对铅膏还原率达到最大值,因为50℃以后Na2S2O3还原效率提升不明显,因此以Na2S2O3作还原剂时的反应温度保持50℃即可。同理,三种还原剂的浓度应为0.6mol/L、1.0mol/L、0.6mol/L。当反应时间为90min时,三种还原剂的还原效率同时达到最大值。Na2S2O3与FeSO4的液固比分别应为30ml/g、20ml/g,对于H2C2O4来说,因为还原铅膏的过程中有H2O不断生成,液固比的影响并不显著,初始值取10ml/g即可。
结论:
(1)以Na2S2O3作为还原剂对铅膏进行还原转化的优选方案控制条件应为:反应液固比30ml/g,反应温度70℃,还原剂浓度1mol/L,反应时间90min。此方案条件下,铅膏中PbO2的还原效率达76.87%。
(2)以H2C2O4作为还原剂对铅膏进行还原转化的优选方案控制条件应为:反应温度70℃,还原剂浓度1mol/L,反应时间90min,反应液固比30ml/g。此方案条件下,铅膏中PbO2的还原效率92.81%。
(3)以FeSO4作为还原剂对铅膏进行还原转化的优选方案控制条件应为:反应液固比20ml/g,反应时间90min,还原剂浓度0.6mol/L,反应温度50℃。此方案条件下,铅膏中PbO2的还原效率86.73%。
(4)从趋势图可以看出,三种还原剂之中,H2C2O4对铅膏中PbO2的还原能力总体上要优于FeSO4和Na2S2O3,按还原能力强弱依次排列为:H2C2O4﹥FeSO4﹥Na2S2O3。
- 还没有人留言评论。精彩留言会获得点赞!