氧化亚铜类材料的合成及其在光声技术检测硫化物上的应用的制作方法
本发明涉及氧化亚铜及其应用领域,尤其是涉及一种氧化亚铜类材料的合成及其在光声技术检测硫化物上的应用。
背景技术:
光声成像是近年来发展起来的一种非入侵式和非电离式的新型生物医学成像方法。光声成像结合了纯光学组织成像中高选择和纯超声组织成像中深穿透的优点,克服了光散射限制,实现了对活体深层组织的高分辨、高对比度成像。该成像技术对内源物质例如脱氧血红蛋白、含氧血红蛋白、黑色素、脂质等进行成像,提供了活体生物组织结构和功能信息,已经在生物医学领域表现出巨大的应用前景。
医学界逐渐认识到体内自身产生的硫化氢(h2s)是一种有益气体,它是继co,no后的第三种气体信号分子,适量的产生和激活可以有效调节神经传导、调控胰岛素的释放、调节心血管活动,并能够参与炎症调节,促进缺血区血管新生,对有效预防心脏病、老年痴呆症等有重要作用。
而氧化亚铜(cu2o)是p型半导体材料,纳米级氧化亚铜具有低成本及水溶性好的特点。目前氧化亚铜用于光声检测体内硫化氢方面尚未见报道。
技术实现要素:
本发明的目的就是为了克服上述现有技术存在的缺陷而提供一种氧化亚铜类材料及其合成与在光声技术检测硫化物上的应用。
本发明的目的可以通过以下技术方案来实现:
本发明的技术方案之一在于一种氧化亚铜类材料在光声技术检测硫化物上的应用。硫化物可以是硫氢化钠、硫化氢等,也可以是其他可产生s2-的硫化物。氧化亚铜类材料为聚乙烯吡咯烷酮包覆氧化亚铜纳米粒子,其中氧化亚铜是主体,与硫化氢接触后能够产生特异性近红外吸收增强,进而通过光声仪器检测到溶液乃至活体中的光声信号;聚乙烯吡咯烷酮包覆在纳米粒子的表面,能有效提高纳米材料的生物兼容性。
其具体应用原理为:根据软硬酸碱理论,o2-电负性高,极化性低难被氧化,是硬碱。s2-电负性低,极化性高易被氧化,是软碱。而cu+体积大,正电荷数低,可极化性高,是软酸。因此,cu+与s2-的结合力远远大于cu+与o2-的相互作用力。在纳米级氧化亚铜中加入硫化氢会导致氧化亚铜转变成铜缺陷的硫化铜。这会导致一系列物理化学性质的变化,其中,加入硫化氢前后的近红外吸收变化可以指导光声检测硫化氢等硫化物。
优选的,氧化亚铜类材料用于溶于溶液中光声检测硫氢化钠。
检测前,先将氧化亚铜类材料分散在溶剂中,利用紫外可见分光光度计等可检测加入硫氢化钠前后的近红外吸收强度变化。根据检测结果,可以发现,加入硫氢化钠后,近红外吸收有明显增强,特别是在900nm附近增强显著。此外,利用光声仪器检测加入不同浓度硫氢化钠后的光声强度,结果是加入硫氢化钠后光声信号显著增强,并且随着硫氢化钠浓度的增加光声信号逐渐增强。根据上述测试结果,可知,氧化亚铜类材料可以用于检测硫氢化钠等物质的存在。
优选的,氧化亚铜类材料在制备光声检测小鼠肿瘤内源性硫化氢的光声探针中的应用。
实验前,可通过构建hct116肿瘤模型,设计对照组,氧化亚铜类材料组和预处理后+氧化亚铜类材料组,分别瘤内注射该氧化亚铜类材料,利用光声仪器实时检测不同时间点光声强度的变化。结果氧化亚铜类材料组的光声信号强度是对照组信号强度的三倍,具有明显差异。同时,预处理后+氧化亚铜类材料组的光声信号强度是对照组信号强度的六十倍,这说明hct116肿瘤的硫化氢含量异常能被该氧化亚铜检测到。
预处理的方法具体为:先对小鼠腹腔注射s-腺苷基甲硫氨酸(20mg/kg),24h后再瘤内注射氧化亚铜,进行光声信号的追踪。
由上可知,氧化亚铜类材料在制备光声检测小鼠肿瘤内源性硫化氢的试剂时,可以是直接注入hct116肿瘤内,注入形式可以是溶液形式,也可以是其他常见形式,更优选的是,先预处理后,再注入氧化亚铜类材料,这种预处理后的检测灵敏度会更高。
本发明的技术方案之二在于提出了一种适用于以上应用的氧化亚铜类材料的合成方法,其包括以下步骤:
(1):取聚乙烯吡咯烷酮溶于氮甲基吡咯烷酮中,制得聚乙烯吡咯烷酮溶液;
(2):往步骤(1)制得的聚乙烯吡咯烷酮溶液加入硝酸铜盐,搅拌溶解得到pvp-cu前驱体;
(3):加热pvp-cu前驱体,反应,纯化,得到沉淀物,再次分散于水中,即得到目的产物。
优选的,所述的聚乙烯吡咯烷酮的分子量为58000、40000、24000或10000中的一种。
优选的,所述的硝酸铜盐为cu(no3)2、cu(no3)2·3h2o或cu(no3)2·(2·5h2o)中的一种。
优选的,步骤(1)中,聚乙烯吡咯烷酮与氮甲基吡咯烷酮的质量比为1:5-15;
加入的硝酸铜盐满足:硝酸铜与聚乙烯吡咯烷酮的质量比为不小于1。
优选的,步骤(3)中,反应的温度为120-250℃,反应时间为0.5-2h。
优选的,步骤(3)中,纯化过程具体为:
将反应后的混合溶液冷却至室温,加入丙酮洗涤1-3遍,得到沉淀物,再用无水乙醇洗涤3-5遍,即完成。
更优选的,每次加入的丙酮与混合溶液的体积比为1:1-4,每次加入的无水乙醇与混合溶液的体积比1:1-4。本发明采用热解法,在聚乙烯吡咯烷酮辅助下,添加铜源,通过调控聚乙烯吡咯烷酮和氮甲基吡咯烷酮的添加量、聚乙烯吡咯烷酮的分子量、反应温度和时间即可获得不同粒径的氧化亚铜材料。这种粒径的变化对材料的溶解性、近红外吸收性能会产生一定的影响,这将对光声成像性能产生一定影响。当粒径大于500nm时,氧化亚铜的溶解性降低,生物安全性降低,在生物体内的滞留时间将受到影响,将会在内源性硫化氢的检测的灵敏度和稳定性上产生较大影响。
与现有技术相比,本发明利用球状纳米氧化亚铜与硫化氢结合能力强,能够产生显著地近红外吸收差异的特性,将其用于光声技术检测硫化氢等,且已经实现在hct116肿瘤鼠上光声检测肿瘤内源性硫化氢。这种利用光声技术检测硫化氢的氧化亚铜纳米球,制备方法简单易行,稳定性好,易于操作,而且材料价格便宜。
附图说明
图1为实施例1中制备得到的各阶段产物的tem图谱,其中,图1a为纳米光声探针的tem图谱,图1b为纳米光声探针加入硫氢化钠后的tem图谱;
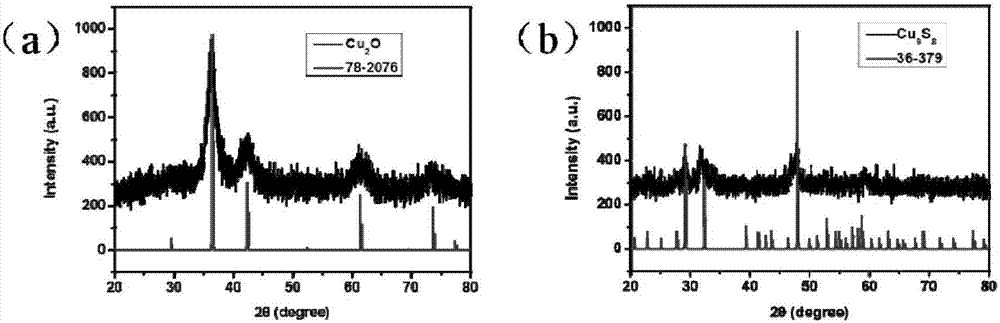
图2为实施例1制备得到的各阶段产物的xrd图谱,图2a为纳米光声探针的xrd图谱,图2b为纳米光声探针加入硫氢化钠后的xrd图谱;
图3为实施例1制得的各阶段产物的近红外吸收图谱;
图4为实施例1制得的纳米光声探针在加入不同浓度硫氢化钠的溶液和不同ph条件下加入硫氢化钠的溶液的光声图谱,其中,图4a对应纳米光声探针在加入不同浓度硫氢化钠的溶液的光声图谱,图4b对应纳米光声探针在不同ph条件下加入硫氢化钠的溶液的光声图谱;
图5为实施例1制备得到的纳米光声探针的竞争性实验近红外吸收图谱;
图6为实施例1制备得到的纳米光声探针的细胞毒性实验图谱;
图7为实施例1中不同试验组的肿瘤内源性硫化氢光声检测图谱,其中,图7a对应纳米光声探针组,图7b对应经s-腺苷基甲硫氨酸预处理小鼠后的纳米光声探针组,图7c对应对照组;
图8为实施例1中不同试验组的光声信号变化图谱。
具体实施方式
下面结合附图和具体实施例对本发明进行详细说明。本实施例以本发明技术方案为前提进行实施,给出了详细的实施方式和具体的操作过程,但本发明的保护范围不限于下述的实施例。
下述各实施例中,“预先激活硫化氢的肿瘤鼠”即“预处理后+氧化亚铜类材料组”,也就是发明内容里面提及的预处理后的试验组:对老鼠腹腔注射s-腺苷基甲硫氨酸(20mg/kg),24h后再瘤内注射氧化亚铜类材料,进行光声信号的追踪。
此外,纯化过程为:待反应后的混合溶液冷却至室温后,加入丙酮洗涤混合溶液1-3遍(其中丙酮与混合溶液的体积比为1:1-4),得到沉淀物,再用无水乙醇洗涤3-5遍(其中乙醇与混合溶液的体积比为1:1-4)。
实施例1
(1)首先称量1.0g聚乙烯吡咯烷酮,加入10ml氮甲基吡咯烷酮溶解分散,等溶液变成澄清透明后,在磁力搅拌下,加入3.0g硝酸铜固体,继续搅拌10分钟得到绿色透明溶液;
(2)将上述溶液在加热磁力搅拌器中升温至200℃,磁力搅拌反应60分钟;
(3)反应结束后,通过离心纯化,并重新分散于二次水中,即可制得最终产物聚乙烯吡咯烷酮包覆氧化亚铜纳米粒子(即纳米光声探针或氧化亚铜类材料),粒径为80nm。
(4)取纳米光声探针重新分散在磷酸盐缓冲液pbs中,浓度为50微克每毫升,利用光声仪器,测试加入硫氢化钠前后的光声强度,可发现光声信号提高了60倍。
(5)将200微升50微克每毫升的纳米光声探针溶液瘤内注射到构建有hct116肿瘤的blab/c裸鼠中,与对照组相比光声信号增强了2倍,而预先激活硫化氢的肿瘤鼠光声信号是对照组的30倍。
图1中,图1a和图1b分别为制得的纳米光声探针的tem图谱(a)和纳米光声探针加入硫氢化钠后的tem图谱(b)。由图谱可知,该纳米光声探针在加入硫氢化钠之后从实心纳米球转变为空心纳米球。
图2中,图2a和图2b分别为制得的纳米光声探针的xrd图谱(a)和纳米光声探针加入硫氢化钠后的xrd图谱(b)。由图谱可知,该纳米光声探针在加入硫氢化钠之后发生了化学反应,从cu2o部分转变成cu9s8。
图3中显示了制得的纳米光声探针的近红外吸收图谱和纳米光声探针加入硫氢化钠后的近红外吸收图谱。由图谱可知,该纳米光声探针在加入硫氢化钠之后在波长800~1000nm的近红外光区域范围内,吸收呈现明显的升高趋势。
图4中,图4a和图4b分别为制得的纳米光声探针加入不同浓度硫氢化钠的溶液光声图谱(a)和纳米光声探针在不同ph条件下加入硫氢化钠的溶液光声图谱(b)。由图谱可知,随着加入硫氢化钠浓度的增大,纳米光声探针的光声强度也逐渐增强;微酸性环境下探针的光声信号的强度没有受到影响。
本实施例制得的纳米光声探针的竞争性实验近红外吸收图谱如图5所示。由图谱可知,不同竞争性粒子对纳米光声探针检测硫氢化钠没有干扰。
本实施例制得的纳米光声探针的细胞毒性实验图谱如图6所示。由图谱可知,该纳米光声探针具有良好的生物相容性和低毒性。
本实施例制得的纳米光声探针的肿瘤内源性硫化氢光声检测图谱如图7和图8所示,其中,图7a代表探针组(a),图7b代表经s-腺苷基甲硫氨酸预处理小鼠后的探针组(b),图7c代表对照组(c),图8代表光声信号变化图谱(d)。由图谱可知,该纳米光声探针能够特异性检测活体肿瘤内源性硫化氢。
实施例2:
(1)首先称量1.0g聚乙烯吡咯烷酮,加入10ml氮甲基吡咯烷酮溶解分散,等溶液变成澄清透明后,在磁力搅拌下,加入1.0g硝酸铜固体,继续搅拌10分钟得到绿色透明溶液;
(2)将上述溶液在加热磁力搅拌器中升温至200℃,磁力搅拌反应60分钟;
(3)反应结束后,通过离心纯化,并重新分散于二次水中,即可制得最终产物聚乙烯吡咯烷酮包覆氧化亚铜纳米粒子(即纳米光声探针或氧化亚铜类材料),粒径为50nm。
(4)将纳米光声探针重新分散在二次水中,浓度为50微克每毫升,利用光声仪器,测试加入硫氢化钠前后的光声强度,光声信号提高了55倍。
(5)将200微升50微克每毫升纳米光声探针瘤内注射到构建有hct116肿瘤的blab/c裸鼠中,与对照组相比光声信号增强了1.8倍。而预先激活硫化氢的肿瘤鼠光声信号是对照组的25倍。
实施例3:
(1)首先称量1.0g聚乙烯吡咯烷酮,加入10ml氮甲基吡咯烷酮溶解分散,等溶液变成澄清透明后,在磁力搅拌下,加入2.0g硝酸铜固体,继续搅拌10分钟得到绿色透明溶液;
(2)将上述溶液在加热磁力搅拌器中升温至200℃,磁力搅拌反应60分钟;
(3)反应结束后,通过离心纯化,并重新分散于二次水中,即可制得最终产物聚乙烯吡咯烷酮包覆氧化亚铜纳米粒子(即纳米光声探针或氧化亚铜类材料),粒径为200nm。
(4)将纳米光声探针重新分散在磷酸盐缓冲液pbs中,浓度为50微克每毫升,利用光声仪器,测试加入硫氢化钠前后的光声强度,光声信号提高了50倍。
(5)将200微升50微克每毫升纳米光声探针瘤内注射到构建有hct116肿瘤的blab/c裸鼠中,与对照组相比光声信号增强了1.2倍。而预先激活硫化氢的肿瘤鼠光声信号是对照组的20倍。
实施例4:
(1)首先称量1.0g聚乙烯吡咯烷酮,加入10ml氮甲基吡咯烷酮溶解分散,等溶液变成澄清透明后,在磁力搅拌下,加入3.0g硝酸铜固体,继续搅拌10分钟得到绿色透明溶液;
(2)将上述溶液在加热磁力搅拌器中升温至220℃,磁力搅拌反应60分钟;
(3)反应结束后,通过离心纯化,并重新分散于二次水中,即可制得最终产物聚乙烯吡咯烷酮包覆氧化亚铜纳米粒子(即纳米光声探针或氧化亚铜类材料),粒径为100nm。
(4)将纳米光声探针重新分散在磷酸盐缓冲液pbs中,浓度为50微克每毫升,利用光声仪器,测试加入硫氢化钠前后的光声强度,光声信号提高了45倍。
(5)将200微升50微克每毫升纳米光声探针瘤内注射到构建有hct116肿瘤的blab/c裸鼠中,与对照组相比光声信号增强了1.5倍。而预先激活硫化氢的肿瘤鼠光声信号是对照组的24倍。
实施例5:
(1)首先称量1.0g聚乙烯吡咯烷酮,加入10ml氮甲基吡咯烷酮溶解分散,等溶液变成澄清透明后,在磁力搅拌下,加入3.0g硝酸铜固体,继续搅拌10分钟得到绿色透明溶液;
(2)将上述溶液在加热磁力搅拌器中升温至180℃,磁力搅拌反应60分钟;
(3)反应结束后,通过离心纯化,并重新分散于二次水中,即可制得最终产物聚乙烯吡咯烷酮包覆氧化亚铜纳米粒子(即纳米光声探针或氧化亚铜类材料),粒径为250nm。
(4)将纳米光声探针重新分散在磷酸盐缓冲液pbs中,浓度为50微克每毫升,利用光声仪器,测试加入硫氢化钠前后的光声强度,光声信号提高了30倍。
(5)将200微升50微克每毫升纳米光声探针瘤内注射到构建有hct116肿瘤的blab/c裸鼠中,与对照组相比光声信号增强了1.2倍。而预先激活硫化氢的肿瘤鼠光声信号是对照组的15倍。
实施例6:
(1)首先称量1.0g聚乙烯吡咯烷酮,加入10ml氮甲基吡咯烷酮溶解分散,等溶液变成澄清透明后,在磁力搅拌下,加入3.0g硝酸铜固体,继续搅拌10分钟得到绿色透明溶液;
(2)将上述溶液在加热磁力搅拌器中升温至200℃,磁力搅拌反应80分钟;
(3)反应结束后,通过离心纯化,并重新分散于二次水中,即可制得最终产物聚乙烯吡咯烷酮包覆氧化亚铜纳米粒子(即纳米光声探针或氧化亚铜类材料),粒径为60nm。
(4)将纳米光声探针重新分散在磷酸盐缓冲液pbs中,浓度为50微克每毫升,利用光声仪器,测试加入硫氢化钠前后的光声强度,光声信号提高了50倍。
(5)将200微升50微克每毫升纳米光声探针瘤内注射到构建有hct116肿瘤的blab/c裸鼠中,与对照组相比光声信号增强了2倍。而预先激活硫化氢的肿瘤鼠光声信号是对照组的26倍。
实施例7:
(1)首先称量1.0g聚乙烯吡咯烷酮,加入10ml氮甲基吡咯烷酮溶解分散,等溶液变成澄清透明后,在磁力搅拌下,加入3.0g硝酸铜固体,继续搅拌10分钟得到绿色透明溶液;
(2)将上述溶液在加热磁力搅拌器中升温至200℃,磁力搅拌反应40分钟;
(3)反应结束后,通过离心纯化,并重新分散于二次水中,即可制得最终产物聚乙烯吡咯烷酮包覆氧化亚铜纳米粒子(即纳米光声探针或氧化亚铜类材料),粒径为180nm。
(4)将纳米光声探针重新分散在磷酸盐缓冲液pbs中,浓度为50微克每毫升,利用光声仪器,测试加入硫氢化钠前后的光声强度,光声信号提高了60倍。
(5)将200微升50微克每毫升纳米光声探针瘤内注射到构建有hct116肿瘤的blab/c裸鼠中,与对照组相比光声信号增强了1倍。而预先激活硫化氢的肿瘤鼠光声信号是对照组的25倍。
实施例8
与实施例1相比,绝大部分都相同,除了本实施例中最终产物聚乙烯吡咯烷酮包覆氧化亚铜纳米粒子的制备过程中,氮甲基吡咯烷酮的添加量满足:聚乙烯吡咯烷酮与氮甲基吡咯烷酮质量比为1:5。
实施例9
与实施例1相比,绝大部分都相同,除了本实施例中最终产物聚乙烯吡咯烷酮包覆氧化亚铜纳米粒子的制备过程中,氮甲基吡咯烷酮的添加量满足:聚乙烯吡咯烷酮与氮甲基吡咯烷酮质量比为1:15。
实施例10
与实施例1相比,绝大部分都相同,除了本实施例中最终产物聚乙烯吡咯烷酮包覆氧化亚铜纳米粒子的制备过程中,反应温度调整为120℃,反应时间为2h。
实施例11
与实施例1相比,绝大部分都相同,除了本实施例中最终产物聚乙烯吡咯烷酮包覆氧化亚铜纳米粒子的制备过程中,反应温度调整为250℃,反应时间为0.5h。
实施例12-15
与实施例1相比,绝大部分都相同,除了本实施例中最终产物聚乙烯吡咯烷酮包覆氧化亚铜纳米粒子的制备过程中,分别限定了聚乙烯吡咯烷酮的分子量为58000、40000、24000和10000。
实施例16-18
与实施例1相比,绝大部分都相同,除了本实施例中最终产物聚乙烯吡咯烷酮包覆氧化亚铜纳米粒子的制备过程中,分别限定了硝酸铜盐为cu(no3)2、cu(no3)2·3h2o和cu(no3)2·(2·5h2o)。
上述的对实施例的描述是为便于该技术领域的普通技术人员能理解和使用发明。熟悉本领域技术的人员显然可以容易地对这些实施例做出各种修改,并把在此说明的一般原理应用到其他实施例中而不必经过创造性的劳动。因此,本发明不限于上述实施例,本领域技术人员根据本发明的揭示,不脱离本发明范畴所做出的改进和修改都应该在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!