一种制备高纯氨的方法与流程
本发明属于化工领域,具体涉及一种制备高纯氨的方法。
背景技术:
现代微电子和光电子等工业发展对氮化物特别是氮化镓(gan)和氮化硅(si3n4)提出了更高的质量要求。gan是新一代二极管发光材料,目前主要采用三甲基镓(ga(ch3)3)和高纯氨(nh3)反应制备。si3n4作为绝缘层,广泛应用于大规模集成电路、液晶显示器和太阳能电池等领域。si3n4是通过高纯氨(nh3)与硅烷(sih4)反应制备。氨气的纯度对这些制备有着极为显著的影响。在gan时,如果在mocvd中氨气中含有3ppm的水或氧,其制备的外延片的发光波长将无法控制;在制备si3n4时,若氨中含有50ppm的水或氧,则只会生成氧化硅sio2而不会生成si3n4。
目前工业上采用高温高压合成氨来制备高纯氨,其中含有大量未反应的氮气和氢气杂质,要在精馏塔内进行两次精馏进行去除,再经多级吸附器进一步除去微量的水即得高纯氨。该制备流程长,设备复杂、制备成本高。
另外也有一些其他合成方法可以合成氨,比如通过氯化铵与氢氧化钙反应、通过氮化锂与水反应等来制备氨气,但这些方法所制备的产物中会含有大量的水很难去除。
由此可见,目前高纯氨的制备存在高能耗、反应条件苛刻、工艺复杂等问题,迫切需要发展经济、环保、快速高效制备高纯氨的新技术。
技术实现要素:
本发明针对现有技术中存在的不足,提供一种制备高纯氨的方法。利用金属氮化物与无水铵盐反应,直接制备不含氮、氢和水以及其他杂质的高纯氨。
为实现上述目的,本发明采用以下技术方案:
一种制备高纯氨的方法,将金属氮化物axny与无水铵盐混合后进行加热反应,反应温度介于473-973k,收集冷却除尘后的气体产物,即得到高纯氨。
所述金属氮化物axny中a为碱土金属或碱金属中的一种或多种,x、y均为1-5的自然数。
优选地,所述金属氮化物axny为mg3n2、lin3、ca3n2、ba3n2中的一种或几种。
所述的无水铵盐为(nh4)2so4、nh4hso4、nh4h2po4、(nh4)2hpo4、(nh4)2s、nh4hs、卤化铵中的一种或几种。
本发明具有以下有益效果:
本发明提供的高纯氨制备方法化学原理是通过固固复分解反应来制备氨气,所制备氨气是干燥的,且是唯一的气态产物。而且在制备过程中氨气几乎不分解,因此产物中的水、氮气、氢气的含量都极低,直接就是高纯氨。此方法操作简单,其仅需加热,即可快速制备高纯氨。
附图说明
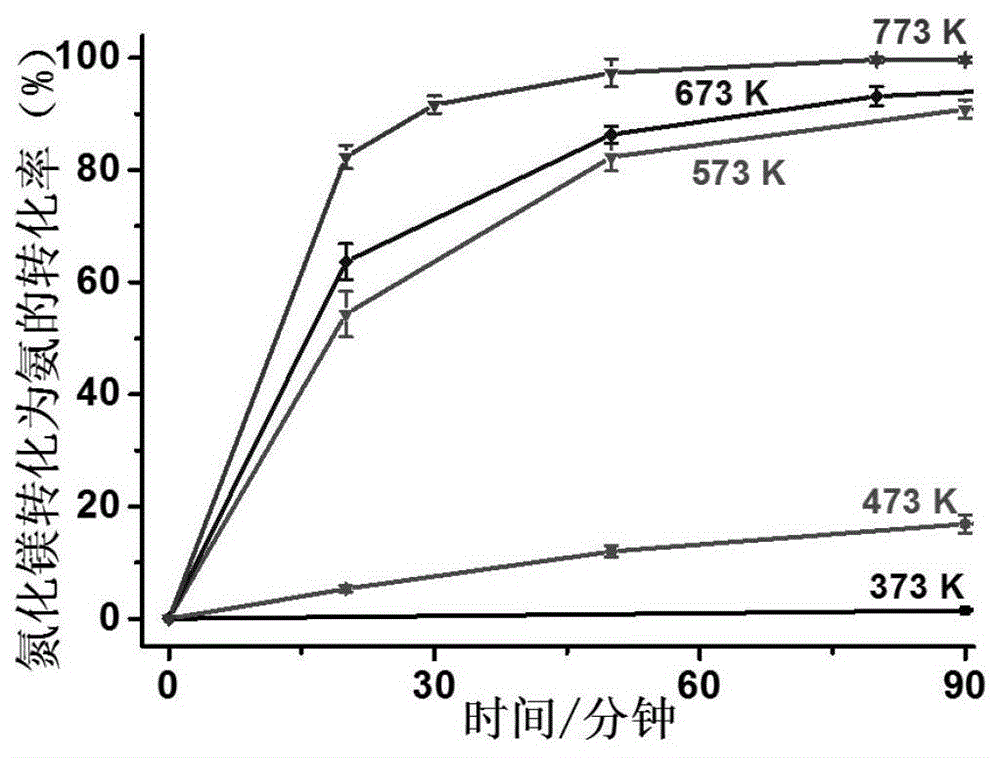
图1为实施例1中以氮化镁转化率表示的产氨速度及产率;
图2为实施例1在提示温度下反应90分钟后固体产物的xrd;
图3为实施例5中生成气体中氢气检测的气相色谱图与氢气标准图谱的比较。
具体实施方式
通过以下详细说明结合附图可以进一步理解本发明的特点和优点。所提供的实施例仅是对本发明方法的说明,而不以任何方式限制本发明揭示的其余内容。
本发明中,用量的比例只影响反应产氨量的多少,以及完全释放氨所需设定的温度和时间。一般而言,用量是化学计量比1:1,即可100%将金属氮化物中的氮以氨的形式释放出来。
实施例1
在手套箱中称取0.83g氮化镁和2.64g无水氯化铵后混合均匀,在密封条件下加热至373、473、573、673或者773k,加热时间为20、30、50、80或者90分钟,均有氨气产生,其中在773k反应80分钟左右所制备的氨气的量与氮化镁完全反应后的理论产量相当。
实施例2
在手套箱中称取0.83g氮化镁和8g无水氯化铵后混合均匀,在密封条件下加热至673k,反应2小时,并收集反应的气体产物,分析表明所制备的氨气的量与氮化镁完全反应后的理论产量相当。
实施例3
在手套箱中称取0.83g氮化镁和2.64g无水氯化铵后混合均匀,在密封条件下加热至873k,加热时间为1小时,并收集反应的气体产物,分析表明所制备的氨气的量与氮化镁完全反应后的理论产量相当。
实施例4
在手套箱中称取0.302g的高纯氮化镁和1g高纯无水氯化铵后混合均匀,在密封条件下加热至673k,反应气体产物密封在带气阀的石英管中。反应30分钟后打开气阀,将气体通过导管进入光腔衰荡水分分析仪中进行含水量的测试。测试结果显示水含量为5ppb。
实施例5
在手套箱中称取0.302g的高纯氮化镁和1g高纯无水氯化铵后混合均匀,在密封条件下加热至673k,反应气体产物密封在带气阀的石英管中。反应60分钟后用氩气将气态产物导入到硫酸溶液中将氨气完全吸收后对氨的量进行分析,尾气引入到气相色谱中对氢气含量进行测定。分析表明所制备的氨气的量与氮化镁反应80%后的理论产量相当;产物中氢气的浓度低于1ppm,说明所生成的nh3几乎不分解,因此产物中n2气及h2含量极低。在673k温度下,制备的氨气热分解率低,其直接达到电子级高纯氨的标准。
实施例6
在手套箱中称取0.302g的高纯氮化镁和1g高纯无水氯化铵后混合均匀,在密封条件下加热至773k,反应气体产物密封在带气阀的石英管中。反应80分钟后用氩气将气态产物导入到硫酸溶液中将氨气完全吸收后对氨的量进行分析,尾气引入到气相色谱中对氢气含量进行测定。分析表明所制备的氨气的量与氮化镁完全反应后的理论产量相当;产物中氢气的浓度约为30ppm,说明nh3的分解率仅约为0.003%左右。在773k以上,因为氨分解所生成的氨并非是理论意义上的6n、7n电子级别高纯氨,但经过简单的精馏即可以除去氮气(沸点77.35k)和氢气(沸点20.27k),从而获得电子级别高纯氨(沸点239.8k)。
实施例7
在手套箱中称取0.153g氮化锂和1.4g无水氯化铵后混合均匀,在密封条件下加热至773k,加热时间为1小时,并收集反应的气体产物,分析表明所制备的氨气的量与氮化锂完全反应后的理论产量相当。
实施例8
在手套箱中称取0.133g氮化钡和0.1g无水氯化铵后混合均匀,在密封条件下以10℃/min进行程序升温加热至973k,加热时间为1小时,并冷却过滤收集反应的气体产物,分析表明所制备的氨气的量与氮化锂完全反应后的理论产量相当。
实施例9
在手套箱中称取0.233g氮化钙和0.954g无水溴化铵后混合均匀,在密封条件下以10℃/min进行程序升温加热至973k,加热时间为1小时,并冷却过滤收集反应的气体产物,分析表明所制备的氨气的量与氮化锂完全反应后的理论产量相当。
实施例10
在手套箱中称取0.09g氮化镁和0.363g无水硫酸铵后混合均匀,在密封条件下加热至673k,加热时间为3小时,并收集反应的气体产物,分析表明所制备的氨气的量与氮化锂完全反应后的理论产量相当。
实施例11
在手套箱中称取0.09g氮化镁、0.16g氮化锂、0.37g无水硫酸铵、1.43g无水氯化铵后混合均匀,在密封条件下加热至673k,加热时间为2小时,并收集反应的气体产物,分析表明所制备的氨气的量与氮化锂完全反应后的理论产量相当。
实施例12
在手套箱中称取0.09g氮化镁、0.16g氮化锂、2.63g无水氯化铵后混合均匀,在密封条件下加热至673k,加热时间为1小时,并收集反应的气体产物,分析表明所制备的氨气的量与氮化锂完全反应后的理论产量相当。
实施例13
在手套箱中称取0.11g氮化镁、0.2g无水硫酸铵、0.4g无水氯化铵后混合均匀,在密封条件下加热至673k,加热时间为2小时,并过滤、除尘收集反应的气体产物,分析表明所制备的氨气的量与氮化锂完全反应后的理论产量相当。
- 还没有人留言评论。精彩留言会获得点赞!