用于纯化免疫球蛋白的方法与流程
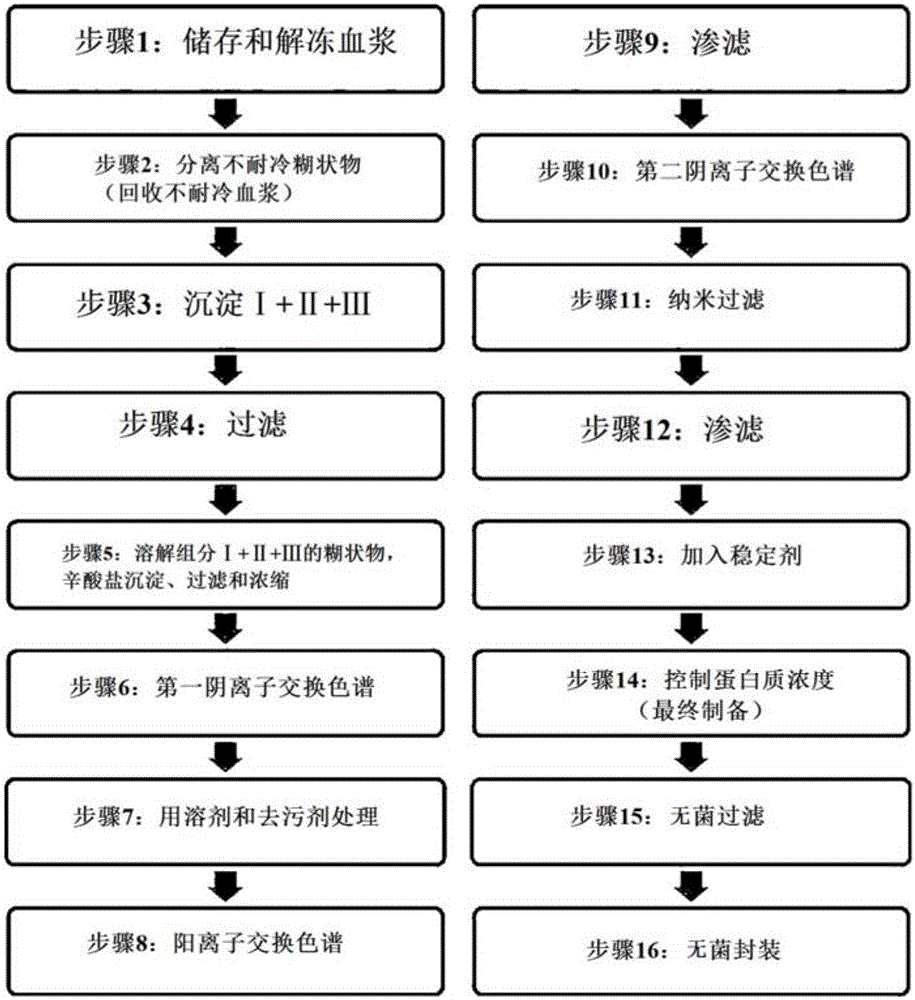
本发明涉及用于纯化免疫球蛋白的方法,更具体地,涉及的用于纯化免疫球蛋白的方法包括:溶解含免疫球蛋白的血浆蛋白质组分(fraction)I+II+III或组分II+III,然后通过加入辛酸盐而实施沉淀反应,实施透析和浓缩,然后经过阴离子交换树脂和陶瓷阳离子交换树脂纯化过程而有效地除去加入的用于灭活病毒的溶剂和去污剂,并保持盐浓度在恒定水平,以保持免疫球蛋白的聚合物含量在低的水平。
背景技术:
免疫球蛋白是包含抗各种病毒和细菌抗体的血浆蛋白质,通过给药给天然缺少抗体的受试者或由于病毒性疾病或细菌性疾病而需要人工补充抗体的患者而被用作预防或治疗疾病的药物。
为了使这样的免疫球蛋白用作为药物,已经根据Cohn和Oncley开发的冷乙醇分馏法(Cohn E.等,J.Am.Chem.Soc.,68:459,1946)或者Kistler和Nitschmann开发的改进的冷乙醇分馏法(Kistler P,Nitschmann HS,Vox Sang,7:414.1952)制备了用于皮下或肌肉注射的免疫球蛋白。
然而,用于肌肉注射的免疫球蛋白具有下述问题:1)这样的免疫球蛋白的剂量受限,使得不可能大量施用免疫球蛋白;2)免疫球蛋白在注射免疫球蛋白的位点引起疼痛;3)免疫球蛋白中具有抗体活性的天然免疫球蛋白G(IgG)的含量低;4)注射位点的蛋白酶降低了免疫球蛋白的抗体活性;以及5)达到峰值血浆浓度的时间为24小时或更久。
为了解决肌肉注射的问题,尝试通过静脉注射给药免疫球蛋白。然而,当静脉注射给药免疫球蛋白制剂时,由于其与抗补体活性结合(aggregate)引起的严重的副作用(过敏反应),出现了各种直接的副作用,包括呼吸困难和循环系统休克。这样的症状主要在免疫球蛋白缺陷的患者中出现。特别地,在出现抗IgA抗体的患者中观察到严重超敏性的副作用。
因此,由于上述问题,不可能静脉注射免疫球蛋白,所以需要开发用于静脉注射的免疫球蛋白制剂,以及开发在制备过程中能够除去上述聚集体和/或防止聚集体形成的方法。由于用诸如胃蛋白酶、木瓜蛋白酶或血纤维蛋白溶酶(Plasmin)的蛋白酶或者诸如β-丙内酯的化学物质处理免疫球蛋白以改变它们的结构,从而抑制免疫球蛋白聚集体的形成或破坏免疫球蛋白聚集体,进而降低免疫球蛋白的抗补体活性,使得静脉注射免疫球蛋白变得可能。
通过用胃蛋白酶处理原料(Cohn组分II)以除去免疫球蛋白聚集体而制备第一代静脉注射免疫球蛋白(IVIG)产品。制备过程不包括柱色谱步骤,并冻干制得的产物,以便在适当的时间段内保持稳定,并在使用前立即溶解。然而,发现一些制造商制造的IVIG产品会引起病毒性感染,例如C型病毒性肝炎。由于这个原因,在制备过程中增加灭活和/或除去已知病毒的一个或多个步骤。之后,在上世纪八十年代中期公开了具有低抗补体活性和更高稳定性的第二代IVIG产品,并通过数个色谱步骤纯化IVIG产品。
静脉注射这样的制剂,从而克服肌肉注射免疫球蛋白的缺点,包括受限的剂量、注射位点的疼痛以及蛋白酶降低免疫球蛋白的抗体活性,并且还将达到峰值血浆浓度需要的时间缩短至几个小时或更短。
然而,由于其结构变化,上述静脉注射免疫球蛋白产品具有很少的有抗体活性的天然IgG,或者不具有抗体活性的天然IgG,所以补体结合活性减小,或者不具有补体结合活性,并且具有短至约4~12天的血液半衰期,因此,表明它们对预防和治疗疾病呈现不令人满意的作用。此外,以冻干粉形态制得的第一代和第二代IVIG产品需要溶解它们的额外过程,并且具有低的溶解速度。由于这个原因,开发了液体IVIG产品,并且需要改善的工艺,以获得更稳定且更纯的IVIG产品。
与此相关地,德国专利申请No.2,604,759和美国专利申请No.4,124,576公开了通过使用诸如聚乙二醇的非离子型表面活性剂获得具有抗体活性的纯IgG(第三代IVIG)的方法,它们与上述用于静脉注射的γ免疫球蛋白不同。这样的IgG制剂具有补体结合活性,以及提高的血液半衰期,因此显示出对预防和治疗疾病的良好效果。然而,这些用聚乙二醇处理而生产的制剂仍然会引起副作用,因为难以从这些制剂中完全除去具有抗补体活性的聚集体(显示约0.02U/mg的抗补体活性)。
此外,韩国公开No.1983-0007083公开了一种通过使用聚乙二醇处理从人血浆分离的Cohn组分II或组分II+III而制备静脉注射免疫球蛋白的方法。然而,该方法存在的有问题为其较复杂且产量较低。
因此,本发明人为解决现有技术中出现的上述问题做出了巨大的努力,结果发现当通过辛酸钠沉淀、阴离子交换色谱和阳离子交换色谱从作为原料的含免疫球蛋白的血浆蛋白组分Ⅰ+Ⅱ+Ⅲ或组分Ⅱ+Ⅲ中纯化免疫球蛋白时,可解决包括在利用聚乙二醇处理的常规制备方法中出现的复杂步骤和产率较低的问题,并可省略用于制备组分II的沉淀Ⅰ+Ⅲ步骤和沉淀Ⅱ步骤,因此非常易于实施生产静脉注射免疫球蛋白制剂的过程,从而完成本发明。
技术实现要素:
技术问题
本发明的目的为提供一种用于纯化免疫球蛋白的方法,该方法可有效地除去杂质和血栓性物质,以生产稳定且高纯度的免疫球蛋白。技术方案
为实现上述目的,本发明提供了一种用于纯化免疫球蛋白的方法,包括如下步骤:
(a)溶解含免疫球蛋白的血浆蛋白组分I+II+III或组分II+III,然后通过加入沉淀剂而实施沉淀反应;
(b)除去(a)中产生的沉淀,然后过滤包含免疫球蛋白的上清液,浓缩滤液,使浓缩物经过阴离子交换色谱,并回收未吸附到阴离子交换色谱柱上的组分;
(c)用溶剂/去污剂处理所述回收的组分,以灭活病毒,然后使所述组分经过阳离子交换色谱,以除去所述溶剂/去污剂;
(d)透析和/或浓缩从所述阳离子交换色谱获得的洗脱液,使所述洗脱液经过阴离子交换色谱,并回收未吸附到所述阴离子交换色谱柱上的组分;以及
(e)通过病毒滤器过滤回收的组分,并透析和/或浓缩滤液,从而获得纯化的免疫球蛋白。
附图说明
图1为显示根据本发明制备静脉注射免疫球蛋白的过程的示意图。
图2显示了每个制备步骤中免疫球蛋白纯度(凝血酶/IgG)的测量结果。
图3显示了通过SDS—PAGE测量的每个制备步骤中滤液或者沉淀物含有的FXI(人凝血因子XI)浓度的结果。
最佳实施方式
除非另有定义,否则本文所用的所有技术术语和科学术语都具有与本领域普通技术人员通常理解相同的含义。通常,本领域中已知并且普遍地使用下文将描述的文中使用的术语及实验方法。
如文中使用,表述“含免疫球蛋白的血浆蛋白”意思是包括通过从人血浆或人胎盘血浆除去诸如因子IX和抗凝血酶的各种血浆蛋白而获得的无冷凝蛋白血浆(cryoprecipitate-free plasma)、各种Cohn组分、以及通过硫酸铵或PEG获得的组分(Polson等,Biochem Biophys Acta,82:463,1964);Polson and Ruiz-Bravo,Vox Sang,23:107.1972)。优选地,在本发明中使用的血浆蛋白组分可为Cohn组分Ⅱ、Cohn组分Ⅰ+Ⅱ+Ⅲ或Cohn组分Ⅱ+Ⅲ。
在本发明中,使用根据常规Cohn血浆组分方法从人血浆获得组分Ⅰ+Ⅱ+Ⅲ或组分Ⅱ+Ⅲ。然后实施从Ⅰ+Ⅱ+Ⅲ或组分Ⅱ+Ⅲ中除去各种因子脂蛋白、纤维蛋白原、α球蛋白质、β球蛋白质和各种凝血因子的纯化过程。
在本发明中,人血浆使用FDA批准且经生物检测的美国血浆,生物检测包括对人免疫缺陷病毒(HIV)、C型肝炎病毒(HCV)、B型肝炎病毒(HBV)和微小病毒B19进行的核酸扩增检测以及血清学检测。通过在夹套式容器中于1~6℃培养12~72小时而解冻在﹣20℃或更低温度下储存的血浆。
在上述条件下解冻血浆时,产生包括纤维蛋白原和凝血因子的冷凝蛋白。通过离心除去产生的冷凝蛋白,并回收剩余的不耐冷(cryo-poor)血浆。然后,重复沉淀和过滤过程,从而获得组分Ⅰ+Ⅱ+Ⅲ。
在分离含免疫球蛋白血浆的过滤过程中,加入助滤剂,并与不耐冷血浆混合,然后通过压滤机的方式分离成上清液和沉淀物。作为助滤剂,可使用Celpure 300或Celpure 1000。
本发明的方法中,通过将蒸馏水加到上述组分中使得组分Ⅰ+Ⅱ+Ⅲ或组分Ⅱ+Ⅲ与蒸馏水的比为1∶6至1∶10,从而实施步骤(a)中组分Ⅰ+Ⅱ+Ⅲ或组分Ⅱ+Ⅲ的溶解,并且所述蒸馏水可为注射用蒸馏水。
优选地,在基本不变性的温度和pH下将所述血浆蛋白质组分悬浮(溶解)于水和/或缓冲液中。术语“基本不变性”是指该术语涉及的条件基本上不会造成IgG分子功能活性不可逆的丧失,例如抗原结合活性的丧失和/或生物Fc功能的丧失。
有利地,用至少一种非变性缓冲液酸化的水以6~10倍、优选7~8倍血浆蛋白组分体积的体积溶解所述血浆蛋白组分。优选地,保持含免疫球蛋白的悬浮液的pH在小于6,例如在4.0~6.0的范围内,优选为4.1~4.3,以确保免疫球蛋白的最佳溶解度。可使用本领域中已知的任何酸性缓冲液,但是优选可使用磷酸钠、乙酸钠、乙酸、盐酸或水(蒸馏水)作为酸性缓冲液。本发明中,使用蒸馏水或注射用蒸馏水。
在本发明中,步骤(a)为通过沉淀从其它物质中分离含免疫球蛋白上清液的步骤。
在本发明中所用的沉淀剂可为选自各种分子量形态的聚乙二醇(PEG)、辛酸和硫酸铵中的至少一种。非变性的水溶性蛋白沉淀剂可用作沉淀的替代方式。优选地,可使用辛酸。
通过以5~26mM,优选为19~21mM的浓度加入沉淀剂,然后调节溶液的pH至4.0~6.0,优选至4.5~5.5而实施步骤(a)中沉淀物的形成。可通过加入乙酸或氢氧化钠而实施pH的调节,但并不限于此。对本领域技术人员显而易见的是:在本发明中可使用通常可用于调节pH的其它物质。
通过加入沉淀剂实施沉淀约1小时,优选为50分钟至1小时10分钟,直到达到固相和液相之间的平衡。在整个沉淀期间,保持悬浮液在低温,优选在2~6℃,并且最适温度取决于蛋白质沉淀剂的特性。
通过沉淀形成的沉淀物含有大量聚集的蛋白质材料,并且上清液含有免疫球蛋白,因此可仅收集上清液,以纯化免疫球蛋白。另外,可过滤含免疫球蛋白的上清液,以除去例如大的聚集体、助滤剂和残余的不溶解相。优选通过深滤器的方式进行过滤,例如C150AF、AF 2000或AF 1000(Schenk)、30LA(Cuno)或相似的滤器。在一些情况下,还可通过离心进行聚集体、助滤剂和残余的不溶解蛋白质材料的除去。
在本发明中,为了从组分Ⅰ+Ⅱ+Ⅲ的糊状物中提取免疫球蛋白,加入蒸馏水或WFI(注射用蒸馏水),使得组分Ⅰ+Ⅱ+Ⅲ的糊状物与蒸馏水的比为1∶6至10,并且提取的蛋白质的浓度为15mg/ml。使用1M的乙酸调节溶液的pH至 4.2±0.1,然后提取组分Ⅰ+Ⅱ+Ⅲ的糊状物。
将1M辛酸钠溶液加到提取物中,使得辛酸盐的浓度为20±1.0mM,然后使用1M乙酸或0.5M氢氧化钠(NaOH)调节提取物溶液的pH至5.1±0.1,并在4℃经沉淀1小时±10分钟。回收上清液,并通过深滤器过滤,以获得免疫球蛋白溶液。
在本发明中,步骤(b)是浓缩免疫球蛋白并除去杂质的步骤。在这个步骤中,控制免疫球蛋白的浓度至10~50mg/ml,优选至20~30mg/ml,并在5.0~6.0的pH以95~145cm/hr的流速实施阴离子交换色谱。用1.6~2.0倍的上样体积(loading volume,LV)回收未吸附到用于实施阴离子交换的色谱柱上的组分。优选地,调节pH至5.4~5.8,更优选至5.5~5.7。
浓缩的含免疫球蛋白溶液在一个或多个步骤中经阴离子交换色谱或阳离子交换色谱,以除去沉淀剂以及其它的血浆蛋白,包括免疫球蛋白A(IgA)、白蛋白和聚集体。在本发明中,实施阴离子交换色谱,以从浓缩的含免疫球蛋白溶液中除去辛酸盐和其它血浆蛋白。
用在阴离子交换色谱步骤中的阴离子交换树脂可为被二乙氨乙基(DEAE)或季铵基取代的阴离子交换树脂,但并不限于此。优选地,阴离子交换树脂可为选自具有强碱性季铵基或弱碱性二乙氨乙基(DEAE)的阴离子交换树脂中的任意一种。
例如,对于强碱性阴离子交换树脂,可使用Q Sepharose Fast Flow、Q Sepharose High Performance、Resource Q、Source 15Q、Source 30Q、Mono Q、Mini Q、Capto Q、Capto Q ImpRes、Q HyperCel、Q Cermic HyperD F、Nuvia Q、UNOsphere Q、Macro-Prep High Q、Macro-Prep 25 Q、Fractogel EMD TMAE(S)、Fractogel EMD TMAE Hicap(M)、Fractogel EMD TMAE(M)、Eshmono Q、Toyopearl QAE-550C、Toyopearl SuperQ-650C、Toyopearl GigaCap Q-650M、Toyopearl Q-600C AR、Toyopearl SuperQ-650M、Toyopearl SuperQ-650S、TSKgel SuperQ-5PW(30)、TSKgel SuperQ-5PW(20)、TSKgel SuperQ-5PW等等,但并不限于此,并且可使用本领域中已知的任何阴离子交换树脂。
柱子的尺寸(即柱子的直径和树脂的高度)反映了用于阴离子交换色谱的树脂的合适体积,并可根据例如所使用的溶液中的免疫球蛋白的量以及所使用树脂的结合性能而变化。在实施阴离子交换色谱前,优选用缓冲液平衡阴离子交换树脂,该缓冲液使得树脂结合其反离子。
本发明中,所用的阴离子交换树脂为Q Sepharose Fast Flow,并且所用的柱缓冲液可为本领域中已知的平衡缓冲液(例如磷酸钠缓冲液、柠檬酸盐缓冲液、乙酸盐缓冲液等),洗涤缓冲液以及洗脱缓冲液。
用25±0.5mM的乙酸钠(NaOAc)缓冲液装载阴离子交换色谱柱,使得其pH为5.6±0.1,并调节流动相的流速至120±25cm/hr。以90.0±20mg/mL的量装载浓缩的免疫球蛋白溶液到柱子中。
本发明中,步骤(c)为灭活病毒的步骤,该病毒例如为含免疫球蛋白溶液中潜在的脂包膜病毒(lipid enveloped viruse),然后除去用于灭活的物质。在这个步骤中,可使用病毒灭活剂,优选为溶剂和/或去污剂。最优选地,可使用溶剂&去污剂处理所用的溶剂—去污剂的混合物。
通过步骤(c),可灭活脂包膜病毒(例如HIV1和HIV2,C型肝炎以及非A-B-C型肝炎、HTLV 1和HTLV 2,疱疹病毒家族,包括CMV和人类疱疹病毒4型),从而提高最终产品的安全性。
步骤(c)中,只要它们具有灭活病毒的性质,可无限制地使用任何溶剂和去污剂,尤其是灭活脂包膜病毒。去污剂可选自由非离子型去污剂和离子型去污剂组成的组中,并且优选为基本不变性的去污剂。特别地,在易于除去方面优先选择非离子型去污剂。溶剂最优选为美国专利申请No.4,764,369中公开的磷酸三正丁酯(TNBP),但是不限于此。
在本发明中所用的病毒灭活剂优选为TNBP与选自聚山梨醇酯80(Tween 80)、Triton X-100和Triton X-45中的至少一种的混合物,但是不限于此。
加入优选的溶剂/去污剂混合物,使得TNBP在含免疫球蛋白的溶液中的浓度为0.2~0.6wt%,优选为0.24~0.36wt%,并使得Tween 80的浓度为0.8~1.5wt%,优选为0.8~1.2wt%。
在灭活包膜病毒的条件下实施病毒的灭活步骤,产生基本抗病毒(virus-safe)的含免疫球蛋白的溶液。这样的条件包括4~30℃、优选19~28℃、最优选24~26℃的温度,以及1~24小时、优选4~12小时,最优选约8小时的培养时间,以确保充分灭活病毒。
本发明中,可在4.5~5.5的pH下以110~130cm/hr的流速实施步骤(c)中的阳离子交换色谱。优选地,调节pH至4.9~5.1。装载到阳离子交换树脂上的免疫球蛋白的量为90~130mg/每毫升阳离子交换树脂,优选为95~105mg/每毫升树脂。在吸附免疫球蛋白后,用平衡缓冲液实施洗涤。用于洗涤的平衡缓冲液的用量可为至少3倍柱体积,优选至少5倍柱体积。在洗涤后,用至少8倍柱体积的洗脱缓冲液洗脱免疫球蛋白。
本发明中所用的阳离子交换色谱可为Sephardex、Sepharose、HyperCell或Source,但是不限于此,还可使用本领域中已知的其它阳离子交换树脂。本发明中,优选使用陶瓷基阳离子交换树脂。在本发明的实施例中,可将陶瓷基树脂CM Hyper D凝胶用作阳离子交换树脂,并将本领域中已知的平衡缓冲液(例如磷酸钠缓冲液、柠檬酸盐缓冲液或乙酸盐缓冲液)、洗涤缓冲液以及洗脱缓冲液用作柱缓冲液。
用具有足以有效洗脱IgG的pH和离子强度的基本非变性的缓冲液来实施从阳离子交换树脂上洗脱免疫球蛋白,从而回收含免疫球蛋白的洗脱液。文中,“有效洗脱”意思是从阳离子交换树脂上洗脱至少75%,例如至少80%,例如至少85%的装载到阳离子交换树脂上的免疫球蛋白溶液。
本发明中,可在足以从阳离子交换树脂上移除免疫球蛋白的洗脱缓冲液的高盐浓度下实施步骤(c)中的阳离子交换色谱。可在400~600mM,优选在500mM的盐浓度下实施。
在本发明中,步骤(d)为进一步除去杂质的步骤。
为了在透析和/或浓缩中保持聚合物的含量,优选在保持从阳离子交换色谱柱获得的洗脱液的盐浓度为50~150mM状况下实施步骤(d)。当在蛋白洗脱步骤中使用能保持低盐浓度的洗脱方法时,可减小免疫球蛋白的聚合物含量,因而可纯化具有改善质量的免疫球蛋白。在本发明中,保持从阳离子交换树脂获得的洗脱液的盐浓度为100mM或更低,以保持聚合物的含量。
在本发明中,可使用超滤/渗滤(UF/DF)系统实施步骤(d)中的透析和/或浓缩。在10mOsmol/kg或更低的渗透压下实施,然后调节pH值至5.5~6.5。即透析和浓缩来自阳离子交换色谱柱的洗脱液,并且在一个步骤中分别通过渗滤和超滤实施透析和浓缩。有利地,用于渗滤/超滤的膜具有50,000Da范围内的理论截留分子量(nominal weight cutoff)。
本发明中,实施渗滤以从阳离子交换色谱洗脱液中除去低分子量的离子,并保持UF/DF系统中的渗透压为10mOsmol/kg或更小。发现通过折射计(T/S meter)测量,透析和/或浓缩的免疫球蛋白被浓缩至1.5±0.1。
本发明中,在5.5~6.5的pH下以90~150cm/hr的流速实施步骤(d)中的阴离子交换色谱,并用0.8~1.2倍的上样体积(LV)回收未吸附到用于实施阴离子交换色谱的柱子上的组分。优选地,可调节pH至5.78~6.30,优选至6.0~6.2,并且优选用0.96~1.04倍的上样体积(LV)回收未吸附到阴离子交换色谱柱上的组分。
此外,在步骤(d)中,可通过加入酸,优选1M硫酸、盐酸或乙酸调节未吸附到阴离子交换色谱柱上的组分的pH至4.0~5.5,优选至4.3~4.7。
在本发明中,EMD TMAE(Fractogel EMD TMAE)用作阴离子交换树脂。将其装入柱子中,然后用20±1.0mM的乙酸钠(NaOAc)缓冲液平衡,使得pH为6.1±0.05。调节移动相的流速至120±30cm/hr。以110.0±10mg/mLr的量装载透析和/或浓缩的免疫球蛋白溶液到柱子中,并以1.0±0.04倍的上样体积的量回收未吸附到阴离子交换色谱柱上的组分,然后通过加入1M乙酸调节pH值至4.5±0.2。
在本发明中,可使用纳米过滤或超滤/渗滤系统实施步骤(e)中的过滤。可在2.0~3.0巴的压力下实施纳米过滤,并且可在10mOsmol/kg或更低的渗透压下实施超滤/渗滤,然后可调节pH至4.5~5.5。
纳米过滤是重要的除去病毒的步骤。在这个步骤中,通过Pall DVD预滤器和DV20病毒滤器在2.5±0.5巴(优选2.5±0.2巴)的压力下过滤未吸附到第二阴离子交换色谱柱上的组分,以从免疫球蛋白溶液中除去病毒。然后,在10mOsmol/kg或更低的压力下使用超滤/渗滤(UF/DF)系统实施渗滤,以除去低分子量的离子。
本发明的方法可进一步包括在步骤(e)之后加入稳定剂的步骤,以制备用于静脉注射的免疫球蛋白。
本发明中,加入的稳定剂可为选自糖醇、麦芽糖、山梨糖醇、甘露糖、葡萄糖、海藻糖、白蛋白、赖氨酸、甘氨酸、PEG和Tween 80中的至少一种。优选地,甘氨酸用作稳定剂。
可以200~300mM的浓度加入稳定剂。在加入稳定剂后,可调节免疫球蛋白溶液的pH至4.5~5.5。优选地,可通过加入酸,优选为硫酸或盐酸,调节pH至4.7~4.9。
本发明中,为了稳定免疫球蛋白,加入甘氨酸到透析和/或浓缩的免疫球蛋白溶液至250±50mM的终浓度,并充分混合,然后通过加入0.5N的盐酸调节溶液的pH至4.8±0.1,然后使用0.2μm滤器灭菌并储存。
可稀释或浓缩用于静脉注射的灭菌的免疫球蛋白制剂,使得蛋白质(已纯化的免疫球蛋白)的浓度为1~30wt%。本发明中,用WFI稀释或者通过超滤浓缩灭菌免疫球蛋白制剂,使得蛋白质浓度为40~60g/l,优选为45~55g/l,更优选为49.5~50.5g/l。然后,将甘氨酸加到免疫球蛋白溶液中至250±50mM的终浓度,并充分混合,然后将盐酸加到免疫球蛋白溶液中,以调节pH至4.8±0.1,从而制备静脉注射免疫球蛋白制剂。
另一方面,本发明涉及根据本发明的制备方法制备的静脉注射免疫球蛋白。
在本发明的实施例中,测定每个制备步骤中免疫球蛋白溶液的纯度(凝血酶/IgG)以及每个制备步骤中滤液或沉淀物中FXI(人凝血因子XI)的浓度。因此,可看到纯化了具有99%或更高纯度的免疫球蛋白溶液(图2),并且除去了大部分的凝血因子FXI(表2和图3)。
实施例
下文,将参考实施例进一步详细地描述本发明。对本领域普通技术人员显而易见的是:这些实施例仅为描述的目的,而不能解释为对本发明范围的限制。因此,本发明的实质范围将由所附权利要求书及其等价方式所限定。
实施例1:制备静脉注射免疫球蛋白
1-1:制备血浆
对于血浆,使用经过生物检测的FDA批准的血浆,该生物检测包括对人免疫缺陷病毒(HIV)、C型肝炎病毒(HCV)、B型肝炎病毒(HBV)和微小病毒B19进行的核酸扩增检测以及血清学检测。
本发明中,使用源自美国的血浆(批号600B0491)。血浆储存在﹣20℃或更低的温度下直至使用。用瓶子切割机打开装有血浆的瓶子,并通过在夹套式容器中1~6℃培养12~72小时而解冻血浆。
在上述条件下解冻血浆时,生产包含纤维蛋白原和凝血因子的冷凝蛋白。通过离心除去产生的冷凝蛋白,并回收剩余的不耐冷血浆。
1-2:沉淀Ⅰ
将96%乙醇加到实施例1-1中回收的不耐冷血浆,使得在﹣3±1℃下的乙醇终浓度为8±0.8%,然后使用乙酸盐缓冲液调节溶液的pH至7.2±0.2。根据工艺产物的消耗而决定是否实施沉淀Ⅰ的回收。在本发明中,进行沉淀Ⅰ过程,但是不进行通过离心除去沉淀。
1-3:沉淀Ⅱ+Ⅲ和过滤
在沉淀Ⅰ过程后,为进一步沉淀不耐冷血浆中含有的免疫球蛋白,实施沉淀Ⅱ+Ⅲ步骤。
另外将96%乙醇加到经沉淀Ⅰ步骤处理的不耐冷血浆中,使得在﹣5±1.0℃下的乙醇终浓度为20±2%。然后,使用乙酸盐缓冲液调节溶液的pH至6.9±0.1。
然后,以每千克血浆0.0284千克的量将助滤剂(Celpure 300或Celpure 1000)加到溶液中,并混合30±10分钟。混合物在保持2~8℃温度的冷藏室中的压滤机(装置信息)上分离为上清液和沉淀物。
命名上清液为“上清液Ⅰ+Ⅱ+Ⅲ(或Ⅱ+Ⅲ)”,并命名沉淀物为“组分Ⅰ+Ⅱ+Ⅲw(或Ⅱ+Ⅲw)”(w;洗涤)。立即使用组分Ⅰ+Ⅱ+Ⅲw(或Ⅱ+Ⅲw),或在-20℃或更低的温度下储存。
1-4:提取组分Ⅰ+Ⅱ+Ⅲ的糊状物,辛酸盐沉淀,过滤及浓缩
为了从实施例1-3中获得的组分Ⅰ+Ⅱ+Ⅲ的糊状物中提取免疫球蛋白,加蒸馏水或WFI(注射用蒸馏水)到组分I+II+III的糊状物,使得组分I+II+III的糊状物与蒸馏水的比为1∶6至10,且提取的蛋白质浓度为15mg/ml。然后,通过加入1M乙酸调节溶液的pH至4.2±0.1,然后在2~8℃的温度下提取组分I+II+III的糊状物11±0.5小时。
将1M辛酸钠溶液加到提取物中,使得辛酸盐的浓度为20±1.0mM。然后通过加入1M乙酸或0.5M氢氧化钠(NaOH)而调节提取溶液的pH至5.1±0.1,并在4℃下经沉淀1小时±10分钟。然后,回收上清液,并用深滤器(Ahlstrom-924滤器、Ahlstrom-950滤器)从上清液中回收免疫球蛋白溶液。浓缩回收的免疫球蛋白溶液至28±2mg/ml。
1-5:第一阴离子交换色谱
为了从实施例1-4中获得的浓缩的免疫球蛋白溶液中除去辛酸盐及其它血浆蛋白,进行阴离子交换色谱。
将阴离子交换树脂Q Sepharose FF(GE Healthcare,目录号17-0510)装入柱子中,然后用平衡缓冲液(25±0.5mM乙酸钠(NaOAc),pH为5.6)平衡,使得pH为5.6±0.1。然后,在25℃或更高的温度下以120±25cm/hr的流速装载90.0±20mg/mLr量的实施例1-4中获得的浓缩的免疫球蛋白溶液到柱子上。然后,用1.6~2.0倍的上样体积(LV)回收未吸附到阴离子交换色谱柱上的组分。
1-6:溶剂/去污剂处理
为灭活含免疫球蛋白溶液中潜在的脂质包膜病毒,实施用溶剂和去污剂处理含免疫球蛋白溶液的步骤。
首先,调节所述组分的pH至5.0±0.1,将乙酸加到实施例1-5中未吸附到阴离子交换色谱柱并回收的组分中。然后,加入磷酸三正丁酯(TNBP)和聚山梨醇酯80(Tween 80)到所述组分分别至0.3±0.06%和1±0.2%的浓度,然后在200±50RPM下搅拌20~30分钟。为了确定TNBP和Tween 80在溶液中是否均匀混合,取样并分析一部分溶液。然后,在25±1.0℃、200±50RPM下连续搅拌溶液8小时。
1-7:阳离子交换色谱
为了从经溶剂/去污剂处理的免疫球蛋白溶液中除去TNBP、Tween 80和其它血栓性物质,例如凝血因子,实施阳离子交换色谱。
阳离子交换树脂CM Hyper D凝胶(Pall Corporation;目录号20050)为陶瓷材料,将其装入柱中,然后用平衡缓冲液(25±0.5mM乙酸钠(NaOAc))平衡,使得pH为5.0±0.1。然后,在20±2℃的温度下以120±10cm/hr的流速装载100.0±5mg/mLr量的实施例1-6中用溶剂/去污剂处理的免疫球蛋白溶液到柱子中。此外,用至少5个柱子体积的洗涤缓冲液洗涤后,用至少8个柱子体积的洗脱缓冲液洗脱免疫球蛋白(洗脱缓冲液的组成:20mM NaOAc pH 4.5w/0.5M NaCl)。
1-8:渗滤
为了从阳离子交换色谱洗脱液中除去低分子量的离子,实施渗滤。
在10mOsmol/kg或更低的渗透压下使用超滤/渗滤系统(Millipore Pellicon2(50K))渗滤实施例1-7中获得的洗脱液。为了保持免疫球蛋白的聚合物含量,将阳离子交换色谱洗脱液加至计算的透析浓缩物中,并在保持100mM或更低的氯化钠浓度的同时连续实施超滤/渗滤(UF/DF)。
1-9:第二阴离子交换色谱
为了从实施例1-8中获得的透析和/或浓缩的免疫球蛋白溶液中除去聚合物及其它血浆蛋白,实施第二阴离子交换色谱。
将阴离子交换树脂Fractogel EMD TMAE(Merck-Millipore,目录号116887)装入柱子中,然后用平衡缓冲液(20±0.5mM乙酸钠(NaOAc),pH为6.1)平衡,使得pH为6.1±0.1。然后,在20±2℃的温度下以120±30cm/hr的流速装载110.0±10mg/mLr量的实施例1-8中获得的浓缩的免疫球蛋白溶液到柱子中。然后,用1.0±0.04倍的上样体积(LV)回收未吸附到阴离子交换色谱柱上的组分,然后通过加入盐酸调节pH至4.5±0.1。
1-10:纳米过滤以及渗滤
纳米过滤是重要的除菌步骤。在2.0±0.5巴或更低的压力下,通过FlorodyneⅡ预滤器(AB1DJL7PH4)过滤实施例1-9中获得的透析/浓缩的免疫球蛋白溶液,并通过病毒滤器(DV20,AB3DV207PH4)在2.0±0.5巴的压力下过滤,从而除去免疫球蛋白溶液中的病毒。
然后,为了除去低分子量的离子,在10mOsmol/kg或更低的渗透压下利用超滤/渗滤(UF/DF)系统渗滤免疫球蛋白溶液。
1-11:加入稳定剂以及制备最终制剂
为了稳定免疫球蛋白,将甘氨酸加到透析和/或浓缩的免疫球蛋白溶液中至250±50mM的终浓度,并充分混合,然后测量稳定的免疫球蛋白溶液的pH,通过加入0.5N盐酸调节免疫球蛋白溶液的pH至4.8±0.1。然后使用0.2μm的滤器灭菌滤液,并储存在不锈钢储存罐中。
用WFI稀释或通过超滤浓缩生成的用于静脉注射的免疫球蛋白制剂,使得蛋白质浓度为50±0.5g/l。然后,向其中加入甘氨酸至250±50mM的终浓度,并充分混合。然后测量稳定的免疫球蛋白制剂的pH,并通过加入盐酸调节pH至4.8±0.1。
在调节pH后,灭菌免疫球蛋白制剂,并转移至包装间,以制备产品,然后在2~8℃的温度下储存所述产品。
实施例2:测量每个制备步骤中免疫球蛋白溶液中产生的凝血酶/IgG(血栓栓塞风险)
测量实施例1的每个制备步骤中取样的免疫球蛋白制剂的纯度(凝血酶/IgG)。
2-1:实验方法
本发明中,根据FDA的六个附属分析机构之一的CBER(生物制品评价和研究中心)提供的Thrombin Generation方案(CBER Thrombin Generation protocol 01Experiment(100916)a)实施实施例1的每个步骤中免疫球蛋白溶液的血栓栓塞风险的测量。
2-2:实验结果
根据本发明的免疫球蛋白纯化工艺包括Cohn血浆分级方法和离子交换色谱纯化技术。如下面的图2和表1所示,可看到辛酸盐沉淀过程以及色谱纯化工艺中的阳离子交换色谱和第二阴离子交换色谱过程中,有效地减少了产生的凝血酶(即血栓性物质)的量。
表1:每个制备过程中产物的分析
上面表1中的结果显示了可减小静脉注射免疫球蛋白引起的血栓形成,因此可有效地防止血栓形成引起的血栓栓塞,从而提高免疫球蛋白的安全性。
实施例3:在每个制备步骤中测量滤液或沉淀物中FXI(人凝血因子XI)的浓度
为了检测除去凝结剂的程度,通过ELISA(AssayMax Human Factor XI(FXI)ELISA Kit;ssaypro,目录号EF1011-1)和SDS—PAGE测量实施例1的每个制备步骤中取样的滤液和沉淀物中的FXI(人凝血因子XI)的浓度。
表2:纯化过程产品的FXI含量
可通过ELISA和SDS—PAGE测量根据本发明的纯化过程产物的FXI含量。因此,如上面的表2和图3所示,在锌酸盐沉淀、阳离子交换色谱和阴离子交换色谱中几乎除去了FXI。
工业实用性
如上述,根据本发明用于制备静脉注射免疫球蛋白的方法,可省略从作为原材料的组分I+II+III或组分II+III制备组分II的沉淀步骤,并且通过使用第一辛酸钠沉淀、阴离子交换色谱和阳离子交换色谱而解决包括在实施聚乙二醇处理过程(聚乙二醇处理)的常规制备方法中出现的复杂的步骤和低产率的问题。此外,当使用根据本发明的纯化免疫球蛋白的方法时,可提高除去杂质和血栓性物质的效率,并可保持免疫球蛋白的聚合物含量,所以可生产具有提高质量的稳定的免疫球蛋白。
尽管已经参考具体的特征详细描述了本发明,但是对本领域技术人员显而易见的是:该描述仅用于优选的实施方式,而非限制本发明的范围。因此,本发明的实质范围将由所附权利要求及其等价方式所限定。
- 还没有人留言评论。精彩留言会获得点赞!