自动化防腐剂效力测试方法和设备与流程
本发明涉及用于确定存在于材料中以预防微生物生长的一种或多种防腐剂的效力的方法和设备。更具体地,本发明涉及能够确定一种或多种存在于制造的商品中的一种或多种防腐剂预防或阻碍产品中的微生物生长的效力和/或有效性的方法和设备。
对于多种制造的产品,如美容和化妆产品,可实施一些微生物测试防腐剂效力测试(PET)以确定特定防腐剂的效率,所述特定防腐剂经设计以防止微生物如细菌、酵母和霉生长。与确定产品中微生物存在或不存在的常规微生物测试(测定)不同的是,PET通过故意使用活微生物接种产品的样品来“刺激/挑战”产品,并在预定的暴露时间后测试微生物的浓度从而确定防腐剂是否有效消除微生物或显著减少其数目。
一些制造产品的使用涵盖产品和潜在的污染源间的反复接触。例如,多种美容和化妆产品如粉底(foundations)、乳霜/面霜(creams)、防晒霜(sun tan lotion)、睫毛膏(mascara)和口红(lipstick)涉及其中消费者频繁触及容器中的产品以获得施用部分的施用技术。该过程可不小心地将微生物引入产品。在许多实例中,将一种或多种防腐剂添加至产品以消除引入的微生物和/或防止或减少微生物的增殖。确定一种或多种这些防腐剂在减少或消除可在产品使用过程中引入的不合意的微生物增殖的效力。效力测试是必需的以验证产品将不会发展成对其使用者的微生物灾害。
防腐剂效力测试(也称为抗微生物刺激/挑战测试或抗微生物有效性测试)目前使用传统的平板计数方法实施,其中测试产品以微生物接种,允许所述微生物在产品中温育预定量的时间。此后,在中和溶液中稀释产品以消除防腐剂的作用从而允许存活微生物的后续生长。在培养皿(Petri-dish)平板上计数存活微生物的数目以确定防腐剂的作用。在培养皿平板方法中,制备了中和的接种产品的十倍稀释。将每个十倍稀释引入配备有琼脂和适当生长培养基的培养皿平板。将所得包含琼脂、生长培养基和相关的接种的十倍稀释样品的接种的培养皿平板分别温育数日,使任何存活微生物生长为菌落并对其计数。
当暴露后经过一段时间后探究防腐剂的效力时,可以提供随时间洞察效力的方式实施刚刚概述的效力测试。在许多实例中,以数个不同的预定的时间间隔重复刚刚概述的培养皿方法和过程。在一些情况中,可采用下述一种或多种暴露时间:7天、14天、21天、28天,而成功的效力测试结果通常是当无论何时将接种的产品暴露至防腐剂,随时间进展更少的生物存活。
如概述的培养皿测试方法也用于确定何种防腐剂和防腐剂浓度为产品或消费者提供有效的保护而不引起副作用。美国药典第51章详明了针对多种微生物实施的防腐剂效力测试,所述微生物包括但不限于下述微生物:白色念珠菌(Candida albicans,ATCC编号10231)、巴西曲霉(Aspergillus brasiliensis,ATCC编号16404)、大肠杆菌(Escherichia coli,ATCC编号8739)、铜绿假单胞菌(Pseudomonas aeruginosa,ATCC编号9027)和金黄色葡萄球菌(Staphylococcus aureus,ATCC编号6538)。
上文概述的常规的培养皿效力测试方法具有多种缺陷。常规的培养皿效力测试方法是复杂的多步骤方法,其需要过多的人工操作和劳动力。在通常的美容或化妆制造设施中,数千个培养皿平板必须单独接种并单独置于温育器中。当对其进行特定时间段的温育时,必须对每个平板进行监测。温育后,必须对已作为微生物生长的结果产生的微生物菌落计数且每个培养皿平板的结果必须人工记录。计数操作和记录操作都有发生错误的机会。此外,需要最终的分析以确认生物随时间的减少(以对数标度表示)符合对于产品、生物和进展暴露日的每个组合为特异性的预定的标准值。因此,提供能够减少或最小化与效力测试相关的人工操作而不对精确性和效力妥协的方法和设备是合意的。此外,如上概述的培养皿方法不允许对微生物生长进行有效的动态分析。
发明概述
本文公开了用于测试可消费产品的样品中存在的至少一种防腐剂的效力的方法和设备,所述方法包括下述步骤:在时间0以初始数目的活的刺激/挑战微生物接种可消费产品样品以获得具有刺激/挑战微生物的第一浓度的接种样品。刺激/挑战微生物从微生物的至少一种纯培养物获得。允许可消费产品中存在的防腐剂与刺激/挑战微生物相互作用进行足以将接种的微生物的浓度从刺激/挑战微生物的第一浓度减少至刺激/挑战微生物的第二浓度的暴露时间。经过暴露时间间隔后,终止防腐剂和刺激/挑战微生物之间的相互作用。该终止步骤可包括将至少一种化合物引入样品,所述化合物中和防腐剂对样品中存在的刺激/挑战微生物的防腐效果以产生中和的样品。
本文公开的方法还包括将中和的样品引入测试容器的步骤,所述测试容器包含液体培养基和至少一个传感器。所述传感器经配置以通过感知由液体生长培养基中刺激/挑战微生物的生长生成的代谢副产物来监测刺激/挑战微生物的生长并能够产生至少一种输出信号。包含引入的刺激/挑战微生物的测试容器在足以促进有效微生物生长的温度温育。通过在多个时间增量测量传感器的输出信号将微生物生长监测为时间的函数。可将多个时间增量测量为标准暴露时间。在多个时间增量确定温育其间中和样品中的微生物的浓度。中和样品中微生物的浓度可使用存活校准函数计算,所述存活校准函数将传感器的输出与所述时间增量的中和样品中微生物的浓度相关联。校准可源自纯培养物的温育和分析。
附图简述
为进一步阐述本发明,参照下列附图。这些附图应认为是说明性的且不应理解为是对本文公开的发明的限制,且其中:
图1是可应用于如本文公开的方法中的设备的实施方案的侧主视图;
图2是与图1所示的设备相关的自动读取器的实验设置的图;
图3是根据如本文公开的方法的实施方案的大肠杆菌的代表性的生长曲线的图示,且其一为干净的样品作为光密度对时间的函数;
图4是根据本文公开的实施方案的铜绿假单胞菌接种的乳霜/面霜产品的代表性的校准曲线的图示,其表示为微生物的菌落形成单位对检测时间的对数函数;
图5是描绘滴眼液制剂中苯扎氯铵(BAK)针对多种生物的有效性的表;
图6是描绘无苯扎氯铵(BAK)的图5中采用的滴眼液制剂针对多种生物的有效性的表。
发明详述
本文公开的方法可使用经配置以监测和记录微生物的动态生长的设备实施,所述设备利用与其连接的一个或多个传感器。设备的非限制性实例和代表性的传感器如下。由bioMerieux(bioMerieux,Inc.,Hazelwood,Mo)制造的Bactometer和由Don Whitley Scientific Limited(Shipley,West Yorkshire,England)制造的RABIT,其利用测量生长培养基的电阻抗作为时间的函数的金属电极。由Trek Diagnostics(TREK Diagnostic Systems,Inc.Cleveland,Ohio)制造的ESP血液培养系统,其测量容器(其中生物在生长培养基中生长)的顶部空间中变化的压力,和BacT/Alert(bioMerieux,Inc.,Hazelwood,Mo),其使用CO2传感器测量微生物的生长。合适的系统将是其中可分析动态测量的微生物生长图样以确定测试样品中微生物浓度的那些,如以Eden等,."Impedance Microbiology"Research Studies Press Ltd.,John Wiley&Sons Inc.,1984中通常概述的方式进行。Eden等证明上述参考文献中的数学分析显示细菌污染水平(浓度)与测量的检测时间(DT)成反比,这指示其中在细菌生长的“对数阶段”过程中测量的动态图样开始遵循指数细菌增加的时间。
本文公开的方法不能通过简单地用由一种自动仪器生成的计算值来交换枚举培养皿平板计数方法的生物的方法学而完成。由于上文讨论的自动化系统的校准曲线依赖于将检测时间与细菌浓度关联且严重依赖于被测量的微生物的物理健康水平(physical wellness),因此直接的方法对于如本文公开的效力测试是失败的。在如本文公开的效力测试方法中,所述微生物的健康和增殖基本上受整合入产品的防腐剂的存在的影响。任何防腐剂都是通过改变细菌增殖过程而抑制或消除生长。“损伤的”生物在其生长上延迟或其进一步的生长受到完全抑制。通过直接应用上文讨论的设备(其中从与那些设备相关的方法和相关的方法学中直接取代培养皿)而产生的校准曲线可生成指示“安全的”产品(充分抑制微生物)的错误的效力测试结果,而暴露至环境或使用者污染物后产品可最终变得污染。
本文公开的发明预测了意想不到的发现,即防腐剂效力可以自动化的方式确定,其精确提供了与利用标准平板计数的经典效力测试相关联的结果。本文公开的方法使用如之前所讨论的监测仪器。除提供精确的结果,本文公开的方法以满足多个监管机构颁布的一项或多项要求的方式实现了相对于标准培养皿平板计数方法的花费和/或时间上的节省。
在本文公开的方法中,将存在于组合物中的防腐剂中和后,分析了经历预定的刺激/挑战时间间隔的微生物的刺激/挑战的包含防腐剂的可消费材料的一个或多个测试样品的微生物活性和生长。
如本文使用,术语“可消费产品”可定义为任何施用于消费者或由消费者使用的材料。特别感兴趣的是经配置用于局部施用或使用的可消费产品,包括但不限于化妆品如肥皂和清洁剂、去污剂、乳液(lotions)、乳霜/面霜、药膏(salves)、润肤剂(emollients)、收敛剂(astringents)、爽肤水(toners)、精华(serums)。还涵盖的是通常分类为美容品的材料,包括但不限于唇膏(lipsticks)、润唇膏(lip balm)和其他唇部制剂、皮肤粉底制剂和遮瑕剂(concealers)、腮红(blushes)和胭脂(rouges)等。还涵盖多种睫毛着色和上色剂如睫毛膏(mascara)等,以及在眼部附近使用的其他美容产品,包括但不限于眼线、眼影等。
在一些应用中,术语“可消费产品”还可包括在特定情况中呈现止痛或治疗特性的局部材料。这种组合物的非限制实例可包括材料如药膏、凝胶等以及多种溶液,包括但不限于隐形眼镜溶液等。
如本文所述的术语“防腐剂”可包括组合物中存在的抑制或防止微生物生长的一种或多种化合物。涵盖的是防腐剂材料可为存在于组合物中并具有或呈现抗微生物活性的一种或多种材料。还涵盖的是组合物中存在的一种或多种防腐剂可为存在于组合物中特异性地用于抗微生物活性或功能的化合物或材料。
在本文公开的方法中,对存在于组合物中的防腐剂通过一种或多种刺激/挑战微生物以合适的刺激/挑战时间间隔进行刺激/挑战。刺激/挑战时间间隔可为在暴露事件的至少部分中足以用尽或耗尽防腐剂作用且足以提供相关的性能数据的那些。在许多情况中,刺激/挑战时间间隔会是至少1天,而通常采用的时间间隔是7天、14天、21天和/或28天。应该理解的是其他时间间隔可详明为合意的或需要的。涵盖的是,在一些应用中,可接种多个产品样品从而提供在多个刺激/挑战时间间隔的性能数据。还涵盖的是可将不同的多种产品样品暴露至一种或多种刺激/挑战微生物,其或为单一的个体生物类型或生物类型的组合,如合意的或要求的。
刺激/挑战微生物可为可感染所述产品组合物的酵母、霉菌、细菌等的一种或多种微生物菌株的那些。这样的微生物的非限制性实例包括下述的一种或多种:白色念珠菌(Candida albicans,ATCC编号10231)、巴西曲霉(Aspergillus brasiliensis,ATCC编号16404)、大肠杆菌(Escherichia coli,ATCC编号8739)、铜绿假单胞菌(Pseudomonas aeruginosa,ATCC编号9027)和金黄色葡萄球菌(Staphylococcus aureus,ATCC编号6538)。涵盖的是本文公开的方法可以这些刺激/挑战微生物应用,当合意的或要求时。
在本文公开的方法的一个实施方案中,将待测定的产品组合物的一部分转移入一个或多个无菌容器。使用的产品部分的大小可为足以提供用于刺激/挑战测试的基质的大小。在一些实施方案中,所述部分可以是1-100克,而在一些应用中5-30克的部分是通常的。当多个刺激/挑战时间间隔下的分析为合意时,可将产品组合物的多个部分转移至多个相应的容器。例如,可将待研究的产品组合物的50克部分以10克的部分转移至5个单独的无菌容器。
在研究中,可对如此制备的包含产品组合物的测量部分的容器以刺激/挑战微生物的液化纯培养物的测量部分接种。如本文使用的,术语纯培养物一般定义为以已知的初始微生物浓度特异性生长和培养的感兴趣的微生物菌株。这可通过任何适当的方法获得,如通过合适的培养并收获已知初始菌落形成单位并稀释至已知浓度。
以在产品和接种物中的微生物之间提供紧密接触的方式混合接种物和产品样品。允许所得的混合物保持静置合意的暴露时间间隔,其中在一些情况中7、14、21和24天的时间间隔是通常的。在该时间间隔过程中可将样品维持在合适的温度。在一些情况中,涵盖的是暴露时间间隔过程中的温度可为模拟生长条件的那些,所述生长条件是在预期的使用条件过程中以相关的产品组合物通常遇到的。因此暴露时间间隔过程中的温度可为近似产品的标准使用条件的那些。可替换地,温度可为根据需要模拟极端的那些。
一旦经过预定的暴露时间间隔,可在每个测试容器中终止组合物中的防腐剂和刺激/挑战微生物之间的相互作用。这可通过将能够消除防腐剂对刺激/挑战微生物的作用的中和剂引入组合物伴随合适的混合来完成。中和剂会是选择性消除防腐剂效果而不损害可在测试样品中保留的任何刺激/挑战微生物的活性的那些。合适的中和剂包括在培养皿测试方法中通常采用的那些。当合意或要求时,中和剂以可以已知的浓度存在于溶液中,从而可将测量的量的中和剂溶液引入每个各自的测试容器。
一旦防腐剂作用已被中和,可将所得的测试样品混合物的部分引入配置有液体生长培养基和至少一个能够监测微生物生长的传感器的测试容器或小瓶。监测微生物生长可通过多种方法完成。在本文公开的一些实施方案中,微生物生长可通过感知由微生物生长生成的代谢副产物的增加而确定。
在本文公开的方法中采用的测试容器或小瓶可包括液体生长培养基的部分,其含有能够支持可存在于测试样品中的微生物的有效生长的合适的营养物。可使用的特异性和非特异性液体生长培养基的非限制性实例包括Triptic Soy Broth、Plate Count Broth(Difco,Becton Dickenson and Company,Sparks,MD,USA)或CM-Coliform Medium(bioMerieux,Hazelwood,MO,USA)。还认为会在本发明的范围之内的是当合意或要求时,可使用用于检测霉菌和酵母或所选生物组(如葡萄球菌属、大肠杆菌或乳酸菌)的多种类型的选择性培养基。
在一些实施方案中,在测试容器或小瓶中采用的传感器可为在测试容器或小瓶的至少一部分中产生透光率(light transmittance)特征变化的那些。传感器可包括但不限于多种指示剂或染料。容器中指示剂或染料的位置可取决于所采用的设备而变化。在一些配置中,指示剂或染料可为分散遍及液体培养基的全部或部分的材料。还涵盖的是指示剂或染料可夹带在合适的介质中于容器中限定的位置。
可在多种合意的情况中采用的指示剂的非限制性实例包括材料如百里酚酞(Thymolphtalein)、溴百里酚蓝(Bromothymol blue)和二甲酚蓝(Xylenol bule)。可在可见光范围使用的指示剂的其他实例包括pH指示剂,如溴甲酚紫(Bromocresol Purple)、氯酚红(Chlorophenol Red)、溴百里酚蓝(Brothymol blue)(Sigma-Aldrich,St.Louis,MO,USA),和还原指示剂,如亚甲基蓝(Methylen Blue)、刃天青(Resazurin)和四唑(Tetrazolium)(Sigma-Aldrich,St.Louis,MO,USA)。具有在UV范围性质变化的荧光化合物可用作指示剂底物,如多种伞形酮(Umbelliferones)和香豆素(Coumarins)。例如,4-甲基伞形基-3-D-葡糖苷酸(MUG)(Sigma-Aldrich,St.Louis,MO,USA)可与选择性培养基联合使用以检测大肠杆菌。可使用4-甲基-伞型基磷酸酯(MUP)(Sigma-Aldrich,St.Louis,MO,USA),因为多种生物代谢该化合物以生成荧光。PYR(焦谷氨酰基氨基肽酶反应)在鉴定A组链球菌属中有效,且L-焦谷氨酰基-7-氨基-4-甲基香豆素可用作PYR活性的指示剂。涵盖的是多种其他显色的(chromomeric)和酶化合物,其可被利用,如合意的或要求的。
测试容器或小瓶可具有任何适当的构造。在一些实施方案中,测试小瓶可为具有至少一个透光区的塑料小瓶。光可以是可见光范围和至少一部分长紫外范围。例如,可使用聚碳酸酯,其对整个可见波长且对350纳米以上的长紫外辐射是透明的。
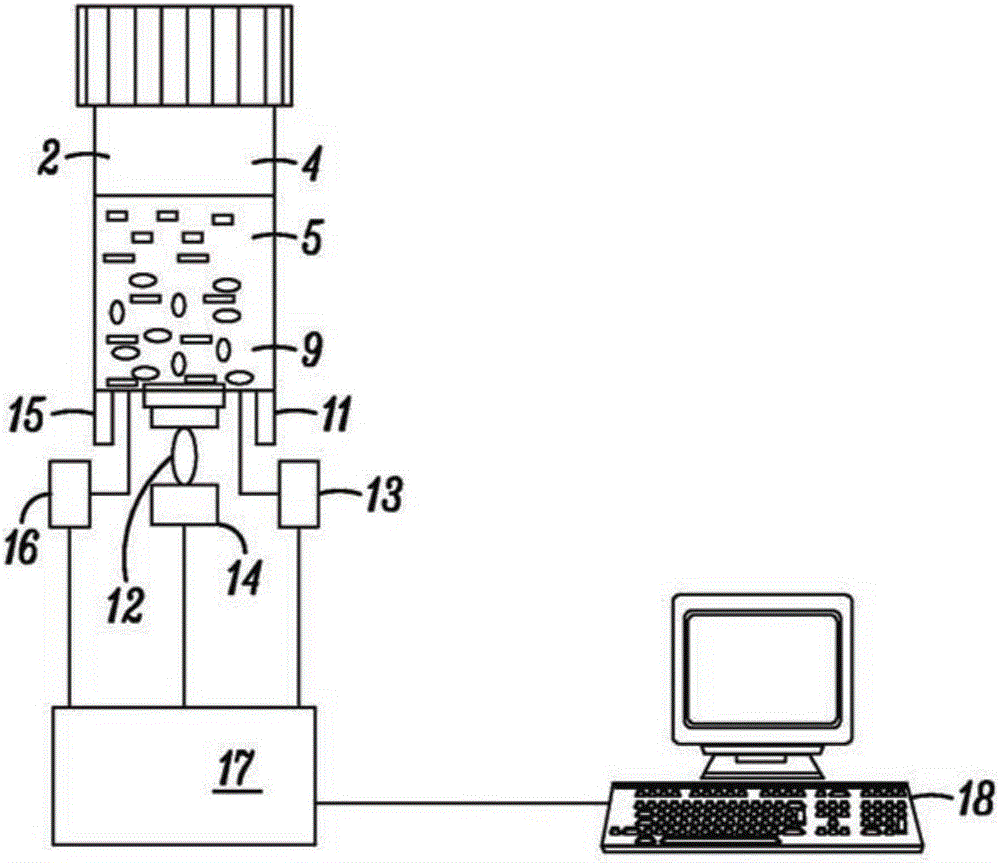
在描绘的非限制性实例中,如果合意或要求,如图1中公开的容器或小瓶2可与图2中描述的设备一起使用且可用盖3密封。在一些应用中,盖2同样可由聚碳酸酯制成。在一些应用中,涵盖的是容器或小瓶2和盖3都可由能够在121℃热消毒的材料构成,且聚碳酸酯可忍受该温度。
在一些实施方案中,容器或小瓶2可具有容器底部,其包括至少一个窗口如矩形窗口8。窗口8具有两个平行的相反表面(一个表面示于图3中)且应对光透明,如上文所指示的。容器或小瓶2的内部体积由顶部空间4、生长区5和检测区9组成。如图1所示,可将试剂的液体混合物引入小瓶2以至少占据区5。检测区9可为固体、液体或半固体,如合意的或要求的。
一个合适的设备构造描绘于图2,其中容器或小瓶2与光学仪器设备组合以检测与微生物生长相关的透光率和/或吸光度的变化。仪器设备可经配置以接受小瓶2的多个容器。
仪器设备可经配置从而一个或多个多光源单元可与每个各自的容器或小瓶2关联。例如,在图2描绘的实施方案中,存在两个光源单元如可见光源11和紫外光源12。可见光源单元11可为白炽灯泡、发光二极管、气体放电管等。可见光源11和紫外光源12可接收它们的能量并分别通过合适的机构如控制器13和14进行控制。
仪器设备可包括一个或多个光检测器,其与各自的容器或小瓶2关联。在图2描绘的实施方案中,单光检测器15与各自的容器或小瓶2关联。光检测器15可用于检测由来自光源的能量与检测区9中的指示剂底物相互作用而生成的能量。光检测器15可为光电二极管、光电晶体管、光子倍增管(PMT)或任何其他光敏感设备。在描绘的设备中,放大器16放大由光检测器15检测到的模拟信号。电子处理器17通过顺序打开控制器13和14而激活光源11和12,并处理所得的信号,其可传输至合适的CPU或其他设备,如合意的或要求的。
试剂的液体混合物可为生长培养基的混合物。容器中的液相是生长培养基和至少一种指示剂底物的混合物。生长培养基允许源自测试样品的微生物的有效生长。可使用数种特异性或非特异性培养基,如mPCB(Difco,Becton Dickenson and Company,Sparks,MD,USA)及溴甲酚紫作为用于总需氧平板计数的指示剂或CM-Coliform Medium(bioMerieux,Hazelwood,MO,USA)。可使用用于检测霉菌和酵母或所选生物组如葡萄球菌属、大肠杆菌或乳酸菌的的选择培养基。
在本文公开的方法中,将包含具有中和的防腐剂的样品部分的测试小瓶在促进刺激/挑战微生物生长的温度温育,所述刺激/挑战微生物已在防腐剂中和前引入产品样品。通过在特定的时间增量测量传感器装置的输出信号并从生产的时间图样确定检测时间而在特定的时间间隔监测微生物生长并记录为时间的函数。在本文公开的方法的一些实施方案中,输出测量结果可在4-10分钟的特定时间间隔测量,而在一些实施方案中,采用6分钟的时间间隔。检测时间可从产生的测量结果确定。
在各测试样品中的微生物浓度可通过应用初级校准曲线而确定,所述初级校准曲线将检测时间与在预定的暴露时间通过平板计数方法确定的微生物浓度相关联。样品中微生物的减少(或增加)可通过如下获得:计算在特定暴露时间微生物的浓度相对于参照混合物(其在接种样品后通过在减少的暴露时间(通常数小时)后混合中和剂而获得)中的微生物浓度,并应用第二校准曲线,所述第二校准曲线将微生物的纯培养物的生成的检测时间与通过平板计数方法确定的它们的浓度相关联。
本发明的方法还可包括确定防腐剂防止或减少微生物生长的有效性的步骤。这可以通过将每种微生物在预定的暴露时间的减少与标准(greed upon standards),如在美国药典第51章所述的那些进行比较而实现。
本文公开的方法可重复多个暴露时间,如目前在培养皿平板计数方法中采用的那些。该过程可通过能够监测液体培养基中生成的代谢副产物的任何新开发的传感器系统、通过利用多种类型的代谢传感器如光学传感器、基于阻抗的传感器和气体传感器而自动化。例如,光学传感器可测量生长培养基中的浊度,其从生物细胞的投影光散射进行测量。另一实例是与液体培养基混合的染料指示剂(如pH指示剂如溴甲酚紫或酶指示剂如荧光MUG)。在这样的情况中,光学传感器可测量光学指示剂中的一种或多种变化,而无论是在可见光范围、在UV、IR中或作为荧光。可在如本文公开的方法中采用的传感器系统的另一实例是嵌入容器中与微生物在其中生长的液体培养基相邻的CO2传感器,其检测由代谢生物生成的CO2。这些传感器的共同特性是它们通过在特定的时间间隔保存传感器的输出而生成时间图样的能力。
举例而言,图3显示用于无菌样品和用于以大肠杆菌污染的样品的基于光学的传感器的两种动态图样。如果样品中不存在微生物,图样几乎平坦。污染样品的特征在于平坦的初始部分随后是遵循微生物生长的对数期的加速部分(迟滞期后的阶段,其中生物呈指数生长)。图样的平坦和加速部分之间的偏转点的时间定义为检测时间(DT)。在图3中,检测时间确定为3.7小时,其由黑色三角标示。
DT和样品中的细菌浓度之间关系的数学分析已在Eden等,Research Studies Press Ltd.,John Wiley&Sons Inc.1984的Impedance Microbiology中形成。该分析允许生成用于不同产品/微生物组合的多种应用的校准曲线。更具体地,校准曲线是具有至少2个系数A和B的线性公式,其形式类似于
log(CFU)=A-B*DT,
其中DT是检测时间且CFU是在标准的对应的培养皿板中形成和计数的菌落形成单位,其指示样品中生物的浓度。术语log是数学对数函数。
温育和微生物生长可通过任何合适的手段完成。在本文公开的具体实施方案中,涵盖的是温育和微生物生长可使用监测系统如BioLumix系统中可得到的来支持和监测。
为进一步说明本公开,请注意下述实施例,提供它们以说明本公开而不认为是限制性的。
实施例1
校准曲线的生成
将铜绿假单胞菌接种入数种具有相似防腐剂系统的乳霜/面霜产品。允许接种的乳霜/面霜产品静置多个暴露时间间隔,其后中和多个样品并将每个中和的样品的各自的部分引入包含生长培养基的测试小瓶并在BioLumix-32光学仪器中温育。通过利用BioLumix-32光学仪器及其测试小瓶(BioLumix Inc.Ann Arbor Michigan USA)获得检测时间。
图4显示使用接种入数种具有相似防腐剂系统的乳霜/面霜产品的铜绿假单胞菌获得的校准曲线。如所见的,全部结果拟合在单校准曲线上。获得的线性方程为:
Log cfu/克=10.88-0.618*DT
相关系数(R)是0.97。
将每种微生物的每个校准曲线的线性方程嵌入光学仪器软件。对于每种生物,软件计算在7、14、21和28天后的log减少。
微生物的混合物还可用于生成校准曲线,条件是混合物中的全部生物具有相似的生成时间以拟合单校准曲线。出于本实施例的目的,使用了发酵性革兰氏阴性杆菌的混合物,包括肺炎克雷伯氏菌(Klebsiella pneumoniae),ATCC#13883、大肠杆菌ATCC#8739和吉戈菲肠杆菌(Enterobacter gergoviae),ATCC#33028。
实施例2
具有和不具有苯扎氯铵(BAK)的滴眼液制剂的评价
苯扎氯铵(BAK)一般认为看作用于预防青光眼滴眼液细菌污染的有效作用剂。然而,其对于医疗和手术管理可能的作用的优势和劣势尚在审查中。为评价新形成的方法的相关性,使用了两种滴眼液配方,一种包含BAK且第二种无BAK防腐剂。使用BioLumix-32仪器获得了包含针对大肠杆菌、金黄色葡萄球菌、铜绿假单胞菌、白色念珠菌、巴西曲霉的防腐剂的滴眼液样品的结果并示于图5的表中。无BAK的滴眼液也以相同的方式测试。结果总结于图6中所示的表中。
如图5中所示,7天后具有BAK的滴眼液减少了至少5.00log的每种生物,除了巴西曲霉,且其后至多28天都未观察到生长。平板计数方法和如本文公开的方法都显示相同的趋势。巴西曲霉浓度在7天中减少了约5log且其后受到完全抑制,如通过两种方法确定的。
无BAK的滴眼液证明了仅对于铜绿假单胞菌两种方法的5log的浓度减少。其花费14天来抑制大肠杆菌。在残留的生物中,获得生物的仅部分而缓慢的减少。通过标准USP方法和新的方法看到相同的趋势。新的方法使用单个小瓶代替数个平板、稀释空白和移液管尖。使用光学仪器完成PET测试后,生成具有每种产品微生物特性的简明报告的分析证书。
尽管本发明已结合目前认为是最实用和优选的实施方案进行了描述,可理解的是本发明不限于公开的实施方案,而是意在覆盖包含在权利要求的精神和范围内的多种修饰和等同安排。权利要求应符合最宽泛的可能的解释从而涵盖法律允许下的全部这样的修饰和等同的结构和指示。
- 还没有人留言评论。精彩留言会获得点赞!