扩增子长度的测量方法与流程
本发明是有关于一种测量方法,且特别是有关于一种扩增子长度的测量方法。
背景技术:
在分子生物学领域,需要对核酸标靶(例如:DNA或RNA)进行基因定序,将核酸标靶以正确的碱基排列作串列表示,进而通过传递遗传信息的基因序列以研究具体样品。基因定序的发展加速生物学与医学的研究与发现,并且广泛地应用于生物诊断、生物科技、鉴定科学和生物系统学领域中。
近年来,已发展出次世代定序(Next Generation Sequencing,简称NGS)技术,此高效率定序技术可大幅降低定序所需的成本和时间。次世代定序检测需先建立数据库(library),包括利用两端已知序列的转接子(adaptor),接上核酸模板片段,此接合物即为次世代定序数据库。在进行次世代定序检测之前,必须先确认其数据库品质,若次世代定序数据库含量过高,则群集密度(cluster density)过高,可能导致检测实验数据品质不佳。反之,若次世代定序数据库含量过低,则群集密度过低,可能导致低产率(yield)。另外,若次世代定序数据库中的长度分布过广,则可能导致读取深度(read depth)过低。因此,在次世代定序技术的操作过程中,在上机步骤之前,须进行品质管控(quality control)以确认次世代定序数据库的长度及含量。
目前,大多通过qPCR(quantitative polymerase-chain-reaction,定量即时聚合酶链锁反应,亦称Real-time PCR)技术确认次世代定序数据库的含量,并通过毛细管电泳法(capillary electrophoresis,简称CE)确认次世代定序数据库的长度。然而,qPCR技术需制作标准曲线,实验程序上较为复杂,而毛细管电泳法则具有低敏感度与非特异性反应等缺点。再者,须分别以两种不同实验确认次世代定序数据库的长度及含量,也导致实验所需的成本和时间 增加。因此,开发一种能够同时精确地分析次世代定序数据库的长度及含量的测量方法,为本领域技术人员亟欲发展的目标。
技术实现要素:
本发明提供一种扩增子长度的测量方法,能够同时精确地分析核酸样品中扩增子的长度及含量。更具体而言,以qPCR技术来检测次世代定序数据库的含量时,次世代定序数据库放大后的核酸产物即为扩增子,本发明是通过检测扩增子的长度及含量以进一步计算次世代定序数据库的长度及含量。
本发明提出一种扩增子长度的测量方法,包括以下步骤。首先,将qPCR混合试剂(master mix)、前置引子(forward primer)、反置引子(reverse primer)、杂交探针(hybridization probe)、双股DNA结合染料(double stranded DNAdye)及极端稀释(3copies/μl至30copies/μl)的核酸样品混合,以形成qPCR反应混合液。接着,将此qPCR反应混合液分配于测试载片的反应孔中,每一反应孔中至多可分配到一个以下的核酸样品。之后,对qPCR反应混合液进行qPCR反应,分别测得核酸样品中的每一扩增子的杂交探针及双股DNA结合染料随着反应循环数变化的荧光强度。接着,进行运算方法,以计算出每一扩增子的长度。
在本发明的一实施例中,运算方法包括在每一扩增子所测得的杂交探针的荧光强度中定出临界值(threshold value),并对应得出当杂交探针的荧光强度为临界值时,每一扩增子的临界反应循环数(threshold cycle)。之后,对应得出在临界反应循环数时,每一扩增子的双股DNA结合染料的个别荧光强度。将个别荧光强度代入双股DNA结合染料的荧光强度及扩增子长度的线性回归曲线,以计算出每一扩增子的长度。
在本发明的一实施例中,运算方法包括针对每一扩增子所测得的双股DNA结合染料的荧光强度及杂交探针的荧光强度,分别换算成双股DNA结合染料的正规化荧光强度及所杂交探针的正规化荧光强度。之后,将每一扩增子的双股DNA结合染料的正规化荧光强度及杂交探针的正规化荧光强度相除,以取得荧光强度比值。接着,将临界反应循环数时每一扩增子的荧光强度比值代入荧光强度比值及扩增子长度的线性回归曲线,以计算出每一扩增子的长度。
在本发明的一实施例中,双股DNA结合染料的正规化荧光强度及杂交探针的正规化荧光强度的换算方法,包括将每一反应循环时的双股DNA结合染料的荧光强度除以反应循环区间内双股DNA结合染料的平均荧光强度,以换算出双股DNA结合染料的正规化荧光强度。将每一反应循环时的杂交探针的荧光强度除以反应循环区间内杂交探针的平均荧光强度,以换算出杂交探针的正规化荧光强度。
在本发明的一实施例中,双股DNA结合染料包括SYBR green染料、Evagreen染料、LC green染料或SYTO 9染料。
在本发明的一实施例中,临界值为1.1至1.5。
在本发明的一实施例中,qPCR混合试剂包括反应缓冲液、dNTP、MgCl2及Taq聚合酶。
在本发明的一实施例中,双股DNA结合染料在qPCR反应混合液中的浓度为1uM至10uM。
在本发明的一实施例中,杂交探针在qPCR反应混合液中的浓度为0.2uM至1uM。
在本发明的一实施例中,前置引子在qPCR反应混合液中的浓度为0.03uM至0.5uM,所述反置引子在qPCR反应混合液中的浓度为0.03uM至0.5uM。
在本发明的一实施例中,核酸样品与qPCR反应混合液的体积比为1:60至1:10。
在本发明的一实施例中,杂交探针包括TaqMan探针、分子信号(Molecular Beacon)探针、双杂交探针(Dual Hybridization Probes)或Eclipse探针。
在本发明的一实施例中,核酸样品包括次世代定序数据库。
基于上述,本发明所提出的扩增子长度的测量方法,通过同时将杂交探针(与扩增子的含量相关)及双股DNA结合染料(与扩增子的长度相关)加入qPCR反应混合液进行qPCR反应,分别测得杂交探针及双股DNA结合染料随着反应循环数变化的荧光强度,对应得出扩增子的临界反应循环数,进而计算出扩增子的长度。因此,本发明所提出的扩增子长度的测量方法能够同时精确地分析核酸样品中扩增子的长度及含量,并应用于次世代定序技术 的品质管控。
为让本发明的上述特征和优点能更明显易懂,下文特举实施例,并配合附图作详细说明如下。
附图说明
图1为本发明一实施例的扩增子长度的测量方法的流程示意图;
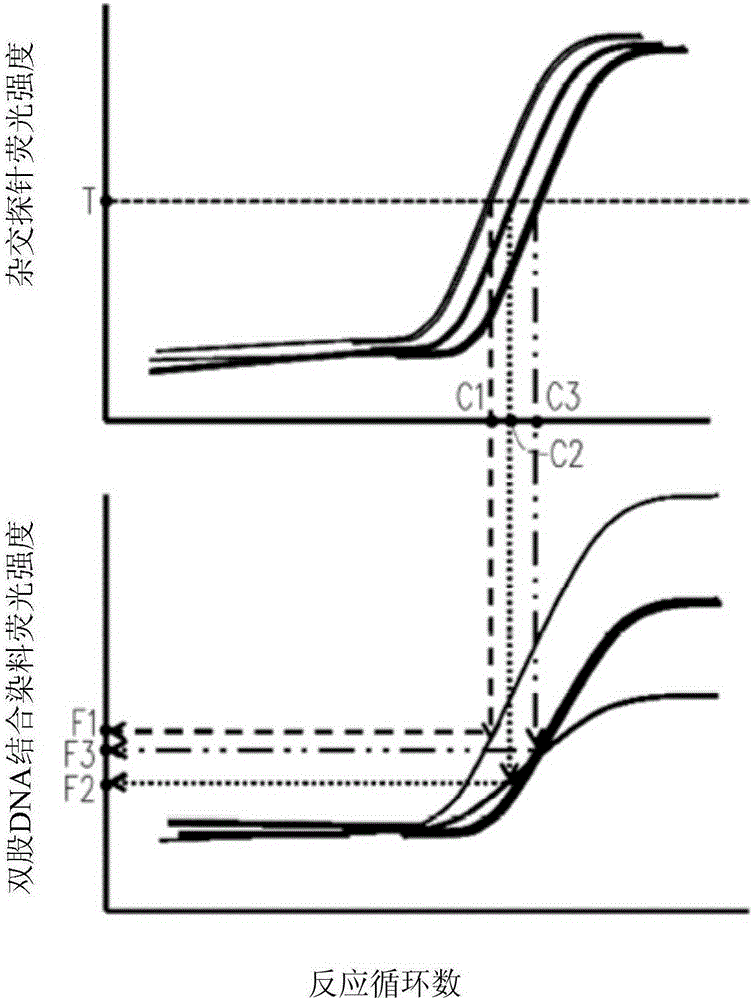
图2为本发明一实施例的扩增子长度的测量方法中,所测得的杂交探针及双股DNA结合染料随着反应循环数变化的荧光强度曲线图;
图3为本发明另一实施例的扩增子长度的测量方法的流程示意图;
图4为本发明另一实施例的扩增子长度的测量方法中,所测得的正规化Eva Green荧光强度及正规化TaqMan荧光强度的荧光强度比值随着反应循环数变化的曲线图;
图5为本发明一实施例的扩增子长度的测量方法所执行的实验例,所测得的TaqMan探针及Eva green染料随着反应循环数变化的荧光强度曲线图;
图6为本发明一实施例的扩增子长度的测量方法所执行的实验例中,不同长度的扩增子的正规化Eva green染料荧光强度的直方图;
图7为本发明一实施例的扩增子长度的测量方法所执行的实验例中,正规化Eva green染料荧光强度与扩增子长度的曲线图。
具体实施方式
图1为本发明一实施例的扩增子长度的测量方法的流程示意图。图2为本发明一实施例的扩增子长度的测量方法中,所测得的杂交探针及双股DNA结合染料随着反应循环数变化的荧光强度曲线图。以下,将以图1及图2详细描述依照本发明一实施例的扩增子长度的测量方法。
请参照图1,先进行步骤S110,在测试载片的反应孔中加入qPCR混合试剂、前置引子、反置引子、杂交探针、双股DNA结合染料及核酸样品,以形成qPCR反应混合液。测试载片可以是具有多个反应孔的载片板,且可在每个反应孔中进行qPCR反应。
更详细而言,在所形成的qPCR反应混合液中,前置引子的浓度例如是0.03uM至0.5uM,反置引子的浓度例如是0.03uM至0.5uM,双股DNA结 合染料的浓度例如是1uM至10uM,杂交探针的浓度例如是0.2uM至1uM。
在本实施例中,双股DNA结合染料可包括SYBR green染料、Eva green染料、LC green染料或SYTO 9染料,较佳为Eva green染料,但本发明不以此为限,也可使用其他能够与双股DNA结合的荧光染料。更详细而言,双股DNA结合染料的添加量比现有qPCR反应的添加量多出例如一倍浓度(1×)至五倍浓度(5×)的量。杂交探针可包括TaqMan探针、分子信号探针、双杂交探针或Eclipse探针,但本发明不以此为限,也可使用其他能够在每一次DNA复制循环(replication cycle)即发出一次荧光信号的荧光染料。
在本实施例中,核酸样品与qPCR反应混合液的体积比例如是1:60至1:10。核酸样品可包括次世代定序数据库,亦即,本发明所提出的扩增子长度的测量方法可应用于次世代定序技术的品质管控,但并不以此为限,本发明所提出的测量方法也可应用于其他任何需要精确地分析扩增子的长度及含量的技术。
在本实施例中,qPCR混合试剂可使用市售品,其中可包括反应缓冲液、dNTP、MgCl2及Taq聚合酶。qPCR混合试剂的市售品例如是凯杰(Qiagen)公司的QuantiTect探针PCR试验组(Probe PCR Kit)、美商应用生命系统(ABI)公司的TaqMan基因表现混合溶剂(Gene Expression Master Mix)、伯瑞(Bio-Rad)公司的iTaq Supermix with ROX以及英杰(Invitrogen)公司的Express qPCR SuperMix,但本发明不以此为限。更详细而言,当形成qPCR反应混合液时,qPCR混合试剂的浓度例如是一倍浓度(1×)。
接着,请继续参照图1,进行步骤S120,对步骤S110在测试载片的反应孔中所形成的qPCR反应混合液进行qPCR反应。qPCR反应的操作条件设定可比照现有qPCR反应的操作设定,例如先在50℃反应2分钟之后,在95℃反应3分钟进行Taq聚合酶热启动步骤,接着进行40个如下所述的循环:在95℃反应36秒、在60℃反应72秒,但本发明不以此为限,也可依据实际需求调整qPCR反应的操作设定。
之后,请同时参照图1与图2,如图1所示,进行步骤S130,分别测得核酸样品中的每一扩增子的杂交探针及双股DNA结合染料随着反应循环数变化的荧光强度。在本实施例中,示出如图2所示的曲线图。在图2中,上方的曲线图呈现杂交探针随着反应循环数变化的荧光强度,而下方的曲线图 呈现双股DNA结合染料随着反应循环数变化的荧光强度,将两者对齐并列呈现,以便于后续流程说明。必须说明的是,虽然图2中仅示出三组扩增子的曲线图形,但图2所示的曲线图仅用于例示说明本实施例,本发明并不以此为限,扩增子的实验组数及所示出的曲线数目可依实际实验情形而加以调整。
接下来,请同时参照图1与图2,进行步骤S140,在所测得的杂交探针的荧光强度中定出临界值T。如图2所示,临界值T为随着反应循环数增加时,杂交探针的荧光强度逐渐上升区段中的一杂交探针荧光强度数值。在本实施例中,临界值T例如是1.1至1.5,但本发明不以此为限,也可依实际实验情形,在杂交探针的荧光强度逐渐上升区段(即,线性区段(linear phase))中定出适当数值作为临界值T。
请同时参照图1与图2,进行步骤S150,对应得出当杂交探针的荧光强度为临界值T时,核酸样品中每一扩增子的临界反应循环数C1、C2及C3。由于杂交探针的反应原理是当扩增子每复制一次,就发出一次荧光信号,亦即,杂交探针的荧光强度是与扩增子的含量正相关。然而,核酸样品中每一扩增子的qPCR反应扩增效率可能不同(基于GC碱基含量不同),故即使在相同的反应循环数时,每一扩增子的含量也可能不同。因此,在杂交探针的荧光强度中定出临界值T,即可正规化每一扩增子的含量使其彼此相同。亦即,每一扩增子在临界反应循环数C1、C2及C3时,含量彼此相同。
请同时参照图1与图2,进行步骤S160,对应得出在临界反应循环数C1、C2及C3时,每一扩增子的双股DNA结合染料的个别荧光强度F1、F2及F3。由于双股DNA结合染料的作用机制是与扩增子结合并嵌入双股核酸中,当扩增子的长度越长,能结合嵌入的双股DNA结合染料越多,荧光强度则越强,亦即,双股DNA结合染料的荧光强度是与扩增子的长度正相关。如上所述,每一扩增子在临界反应循环数C1、C2及C3时含量彼此相同,因此,步骤S160能够在每一扩增子含量彼此相同时,得出每一扩增子的双股DNA结合染料的个别荧光强度F1、F2及F3。
最后,请参照图1及图2,进行步骤S170,将个别荧光强度F1、F2及F3代入双股DNA结合染料的荧光强度及扩增子长度的线性回归曲线,以计算出每一扩增子的长度。关于双股DNA结合染料的荧光强度及扩增子长度的线性回归曲线以及详细计算步骤,可利用本领域中的现有技术进行,故在此 不予赘述。如上所述,步骤S160能够在每一扩增子含量彼此相同时,得出每一扩增子的双股DNA结合染料的个别荧光强度F1、F2及F3,因此,步骤S170可准确地测量在每一扩增子含量彼此相同时,每一扩增子的长度。
图3为本发明另一实施例的扩增子长度的测量方法的流程示意图。图4为本发明另一实施例的扩增子长度的测量方法中,所测得的正规化Eva Green荧光强度及正规化TaqMan荧光强度的荧光强度比值随着反应循环数变化的曲线图。
必须说明的是,图3及图4所示的实施例相似于图1及图2所示的实施例。相似之处在于,在图3及图4所示的实施例中,也进行如图1中所示的步骤S110、步骤S120及步骤S130。本实施例与上述实施例不同之处在于,当进行步骤S130之后,本实施例不进行上述实施例中的步骤S140、步骤S150、步骤S160及步骤S170,而是进行步骤S340、步骤S350及步骤S360。由于步骤S110、步骤S120及步骤S130的细节已于上文中进行详尽地说明,故在此不再赘述。因此,在下文中仅直接针对步骤S340、步骤S350及步骤S360加以叙述。
请先参照图3,进行步骤S340,针对每一扩增子所测得的双股DNA结合染料的荧光强度及杂交探针的荧光强度,分别换算成双股DNA结合染料的正规化荧光强度及所杂交探针的正规化荧光强度。
更详细而言,双股DNA结合染料的正规化荧光强度的换算方法可包括将每一反应循环时的双股DNA结合染料的荧光强度除以反应循环区间内双股DNA结合染料的平均荧光强度,以换算出双股DNA结合染料的正规化荧光强度。另一方面,杂交探针的正规化荧光强度的换算方法包括将每一反应循环时的杂交探针的荧光强度除以反应循环区间内杂交探针的平均荧光强度,以换算出杂交探针的正规化荧光强度。在本实施例中,反应循环区间例如是荧光强度尚未上升的基准线区域(baseline region)中第三个反应循环至第八个反应循环,但本发明不以此为限,也可依据实际实验情形,在基准线区域中定出适当反应循环区间。
之后,请同时参照图3及图4,如图3所示,进行步骤S350,将每一扩增子的双股DNA结合染料的正规化荧光强度及杂交探针的正规化荧光强度相除,以取得荧光强度比值。在本实施例中,可示出如图4所示的曲线图, 其中呈现荧光强度比值随着反应循环数的变化。必须说明的是,虽然图4中仅示出三组扩增子的曲线图形,但图4所示的曲线图仅用于例示说明本实施例,本发明并不以此为限,扩增子的实验组数及所示出出的曲线数目可依实际实验情形而加以调整,扩增子的长度以及所使用的双股DNA结合染料及杂交探针的种类也不以此为限。
接着,请同时参照图3及图4,如图3所示,进行步骤S360,将临界反应循环数时每一扩增子的荧光强度比值代入荧光强度比值及扩增子长度的线性回归曲线,以计算出每一扩增子的长度。
在本实施例中,临界反应循环数可包括25至35。在图4中,临界反应循环数例如是30,但本发明不以此为限,也可依据实际实验情形,在荧光强度比值逐渐上升区段(即,线性区段(linear phase))中定出所对应的适当反应循环数作为临界反应循环数。如图4所示,当临界反应循环数为30时,100bp扩增子的荧光强度比值为1.4,200bp扩增子的荧光强度比值为2.1,400bp扩增子的荧光强度比值为3.1。之后,将上述荧光强度比值代入荧光强度比值及扩增子长度的线性回归曲线,即可计算出每一扩增子的长度。
以下,通过实验例来详细说明上述实施例扩增子长度的测量方法。然而,下述实验例并非用以限制本发明。
实验例
为了证明本发明所提出的扩增子长度的测量方法能够同时精确地分析核酸样品中扩增子的长度及含量,以下特别作此实验例。
在测试载片的反应孔中加入qPCR反应混合液,qPCR反应混合液的组成含量如以下表1所示。核酸样品为扩增子长度已知的标准品,其中含有长度分别为100bp(base pair)、200bp、400bp及800bp的扩增子。接着,对反应孔中的qPCR反应混合液进行qPCR反应。
表1
图5为本发明一实施例的扩增子长度的测量方法所执行的实验例,测得的TaqMan探针及Eva green染料随着反应循环数变化的荧光强度曲线图。在图5中,上方的曲线图呈现TaqMan探针随着反应循环数变化的荧光强度,而下方的曲线图呈现Eva green染料随着反应循环数变化的荧光强度,其中每一点代表一次反应循环。
请参照图5,在所测得的TaqMan探针的荧光强度中定出临界值1.3,临界值1.3为随着反应循环数增加时,荧光强度逐渐上升区段中的一荧光数值。接着,对应得出当TaqMan探针的荧光强度为临界值1.3时,每一扩增子的临界反应循环数。之后,对应得出在临界反应循环数时,每一扩增子的Eva green染料的个别荧光强度。如图5所示,100bp扩增子的Eva green染料荧光强度为3,200bp扩增子的Eva green染料荧光强度为4,400bp扩增子的Eva green染料荧光强度为6。之后,将Eva green染料的个别荧光强度代入Eva green染料荧光强度及扩增子长度的线性回归曲线,以计算出每一扩增子的长度。
图6为本发明一实施例的扩增子长度的测量方法所执行的实验例中,不同长度的扩增子的正规化Eva green染料荧光强度的直方图。请参照图6,100bp扩增子、200bp扩增子、400bp扩增子及800bp扩增子明显分成彼此分离的四大区块。因此,可得知本发明所提出的扩增子长度的测量方法可在每一扩增子含量彼此相同时,精确地分辨出每一扩增子的长度。
图7为本发明一实施例的扩增子长度的测量方法所执行的实验例中,正规化Eva green染料荧光强度与扩增子长度的曲线图。图7是以上述实验例中100bp扩增子、200bp扩增子、400bp扩增子及800bp扩增子分别测得的Evagreen染料荧光强度平均值对应各扩增子的长度作图。如图7所示,呈现接近平滑的直线,且R2为0.998,相当接近1。因此,可得知本发明所提出的扩增子长度的测量方法可在每一扩增子含量彼此相同时,精确地测量出每一扩增子的长度。
综上所述,本发明所提出的扩增子长度的测量方法,因同时使用两种类 型的染料(杂交探针及双股DNA结合染料)进行qPCR反应,可精确地测定每一扩增子的长度。另一方面,由于核酸样品在极端稀释范围下进行qPCR反应,可利用统计分布原理计算含量,因此不需进行序列稀释制作标准曲线,故本发明所提出的测量方法仅需少量核酸样品即可执行,且检测限制较低。因此本发明方法可于同一次的qPCR实验中,即能够同时分析核酸样品中扩增子的长度及含量,可用于次世代定序技术的品质管控,或是其他任何需要同时精确地分析核酸样品中扩增子的长度及含量的分子生物学领域相关应用。
最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
- 还没有人留言评论。精彩留言会获得点赞!