细胞的分化状态的评价方法与流程
本发明涉及用于评价细胞的分化状态的方法。
背景技术:
以往,为了评价细胞的分化状态,广泛使用利用免疫染色的方法(例如参见专利文献1)、对标记基因(marker gene)的表达水平进行定量的方法(例如参见专利文献2)。
利用了免疫染色的方法中,首先在用多聚甲醛等对作为评价对象的细胞例如多能性干细胞进行固定化的基础上进行抗原-抗体反应。在此,作为用于判定多能性干细胞是否为未分化状态的抗体广泛使用SSEA-4、TRA1-60(例如参见专利文献1)。其次,向细胞中添加与前述抗体结合的二次抗体,之后检测出预先对前述二次抗体赋予的荧光标记等。由此能够评价在细胞上是否存在相对于前述抗体的抗原、即该细胞是否为未分化状态。
另外,在利用对标记基因的表达水平进行定量的方法中,例如从多能性干细胞中提取mRNA,通过逆转录酶将其转变为cDNA后,利用PCR(Polymerase Chain Reaction、聚合酶链反应)扩增标记基因。此时,作为用于评价多能性干细胞的未分化性的标记基因,广泛使用NANOG、POU5F1(OCT3/4)(例如参见非专利文献1)。通过用电泳、实时PCR装置对该PCR产物进行检测从而确认前述细胞中的标记基因的表达量,基于该结果来评价该细胞是否为未分化状态。
现有技术文献
专利文献
专利文献1:日本特开2004-313184号公报
专利文献2:日本特开2006-042663号公报
非专利文献
非专利文献1:《自然·生物技术》(Nature Biotechnology),2007,第25卷,pp.803-816
技术实现要素:
发明要解决的问题
然而,上述以往的评价方法中均需对细胞进行侵入性的处理。因此,在进行分化状态的评价之后无法将用于该评价的细胞应用于例如作为再生医疗用的细胞源的其它目的。另外,对于同一样品(即同一培养皿中的细胞)不能评价随时间经过的变化,在评价分化状态的经时性变化时需要用多个培养皿进行并行培养等繁琐的操作。
本发明是鉴于上述问题而完成的,其目的在于:提供非侵入性地评价细胞的分化状态的方法。
用于解决问题的方案
本发明人进行了深入广泛的研究,其结果发现根据细胞的分化状态不同,培养上清液中的腐胺、犬尿氨酸、胱硫醚、抗坏血酸、核黄素、丙酮酸、丝氨酸、半胱氨酸、苏糖酸、柠檬酸、及乳清酸的含量不同,从而完成了本发明。
即、为了解决上述课题而完成的本发明的细胞分化状态的评价方法的特征在于,其是将未知分化状态的干细胞或由干细胞进行了分化诱导的细胞作为被检细胞,基于该被检细胞的培养上清液中的规定物质的含量来评价该被检细胞的分化状态的方法;
前述规定物质为选自由腐胺、犬尿氨酸、胱硫醚、抗坏血酸、核黄素、丙酮酸、丝氨酸、半胱氨酸、苏糖酸、柠檬酸、及乳清酸组成的组中的至少一个的化合物。
上述本发明的细胞分化状态的评价方法例如可以通过对前述被检细胞的培养上清液中的前述规定物质的含量、和已知分化状态的对照细胞的培养上清液中的前述规定物质的含量进行比较来评价前述被检细胞的分化状态。
另外,本发明的细胞分化状态的评价方法的前述干细胞可以为ES细胞(Embryonic Stem cells、胚胎干细胞)、iPS细胞(Induced Pluripotent Stem cells、诱导多能性干细胞)等多能性干细胞。
另外,本发明的细胞分化状态的评价方法能够对前述培养上清液中的前述规定物质的含量通过质谱分析法进行定量。
发明的效果
根据上述本发明的细胞分化状态的评价方法,不需要如以往那样破坏细胞就能够非侵入性地评价细胞的分化状态。由此,在评价分化状态之后可以将被检细胞作为再生医疗用的细胞源等利用。另外,在评价分化状态的经时性变化时也不需要如以往那样用多个培养皿进行并行培养这样繁琐的操作,就能够将同一培养皿中的细胞作为对象容易地评价随时间经过的分化状态的变化。
附图说明
图1是说明本发明的一实施例中的细胞分化状态的评价方法的模式图。
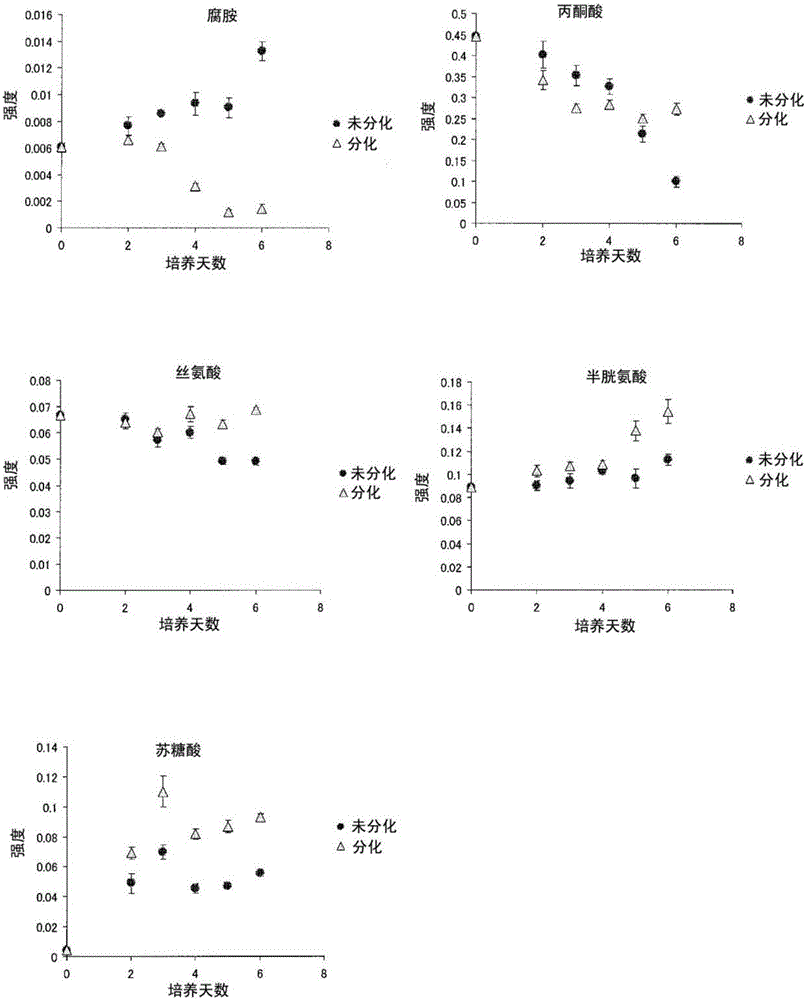
图2是表示上述实施例中培养上清液中通过GC-MS分析求出的各物质的含量的经时变化的图。
图3是表示上述实施例中培养上清液中通过LC-MS分析求出的各物质的含量的经时变化的图。
图4是表示DMEM/F12的构成成分的表。
图5是表示mTeSR1的构成成分的表的前半部分。
图6是表示mTeSR1的构成成分的表的后半部分。
具体实施方式
本发明的细胞分化状态的评价方法如下:将选自由腐胺、犬尿氨酸、胱硫醚、抗坏血酸、核黄素、丙酮酸、丝氨酸、半胱氨酸、苏糖酸、柠檬酸、及乳清酸组成的组中的至少一个的化合物作为生物标志物,基于被检细胞的培养上清液中的前述生物标志物的含量来评价该被检细胞的分化状态。
作为前述被检细胞可以使用干细胞、典型的为ES细胞、iPS细胞等多能性干细胞。此外也可以使用由前述干细胞进行了分化诱导的细胞作为被检细胞。另外,作为用于培养这样的被检细胞的培养基可以使用在干细胞的培养中通常使用的培养基例如DMEM/F12、以该DMEM/F12作为主要成分的培养基(例如mTeSR1等)。图4示出DMEM/F12的构成成分。
作为测定培养上清液中的前述生物标志物的含量的方法,可以优选利用通过质谱分析法的定量分析特别是使用液相质谱分析装置(LC-MS)、气相质谱分析装置(GC-MS)的定量分析,但不限定于这些。例如也可以以下述方式进行,即在培养上清液中添加使前述各生物标志物特异性显色或发光的试剂等,基于该显色或发光的强度求出生物标志物的含量。
实施例
下面对根据本发明的方法的细胞的分化状态评价的一实施例进行说明。图1是表示根据本实施例的细胞分化状态的评价方法的实施步骤的模式图。
本实施例中使用2种人ES细胞株KhES-1及KhES-3。另外,将对各ES细胞株施加了分化诱导刺激的细胞作为被检细胞,将相同ES细胞株维持未分化状态的细胞作为对照细胞。下面对本实施例中的自细胞培养至培养上清液的分析的步骤进行说明。
[对照细胞的培养及培养上清液的回收]
在涂布有BioCoat Matrigel(注册商标、Corning International株式会社)的4个培养皿(直径60mm)中对前述KhES-1株进行继代培养(图1中为了简化仅示出1个培养皿)。作为培养基使用mTeSR1(modified Tenneille Serum Replacer1),每天进行培养基的更换。mTeSR1的构成成分示于图5及图6。同样地对于KhES-3株也用4个培养皿进行继代培养。将进行细胞接种(继代)之日作为第0天,持续培养至达到汇合(confluent),将每天进行培养基更换时从培养皿中回收的培养上清液作为质谱分析用的样品。需要说明的是,培养第0天是将mTeSR1本身作为质谱分析用样品。
[被检细胞的培养及培养上清液的回收]
在涂布有基质胶(Matrigel)的4个培养皿(直径60mm)中对前述KhES-1株进行继代培养(图1中为了简化仅示出1个培养皿)。作为培养基使用mTeSR1,每天进行培养基的更换并持续培养至达到汇合。同样地对于KhES-3株也用4个培养皿进行继代培养。将进行继代之日作为第0天,在从第2天开始、更换前述培养基时,通过更换为以最终浓度成为0.1μM的方式添加维甲酸后的mTeSR1来进行分化诱导刺激。将每天更换培养基时从培养皿中回收的培养上清液作为质谱分析用的样品,培养第0天是将mTeSR1本身作为质谱分析用样品。
[样品的预处理]
在前述样品中分别添加异丙基苹果酸作为内标物质,用提取溶液(甲醇:氯仿:水=2.5:1:1)处理进行脱蛋白。回收提取后的上清液并使其干燥。
[通过GC-MS的分析]
将进行上述预处理后的各样品在含有甲氧胺盐酸盐的吡啶溶液中进行孵育,从而对样品中的化合物进行甲肟化。进而,通过在各样品中添加MSTFA(N-甲基-N-(三甲基硅烷基)三氟乙酰胺)对样品中的化合物进行三甲基硅烷化。并且,将实施这些衍生化处理后的样品用于通过GC-MS的分析。解析分析结果时使用岛津制作所制造的“GCMS代谢成分数据库Ver.2”。该数据库汇集了用GC-MS对实施与前述相同的衍生化处理后的多种化合物标准品进行分析的数据。化合物的鉴定以下述为指标进行:由前述数据库设定的保留指标(对保留时间进行相对化后的数值)与样品中的衍生化化合物的保留指标之差是否为±5以内、及对于样品中的衍生化化合物而言是否检测出由前述数据库设定的定量离子和定性离子这两者。另一方面,化合物的定量是根据由前述数据库设定的条件通过计算出涉及对于样品中各衍生化化合物的特征性离子的质谱图的面积的方法来实施。
[通过LC-MS的分析]
在进行上述预处理后的各样品中加入适量的超纯水(Milli-Q(注册商标)水、默克株式会社)并使其溶解,用于通过LC-MS的分析。LC-MS分析中通过使用反相分离柱的梯度洗脱对各样品中的化合物按时间地进行分离后,通过多反应监测(MRM、Multiple Reaction Monitoring)模式进行了质谱分析。MRM模式中的分析条件的设定使用化合物标准品来实施。化合物的鉴定以标准品的保留时间与样品中的化合物的保留时间之差是否为±0.1分钟以内作为基准进行。另外,化合物的定量通过计算出对于样品中的各化合物的特征性离子的质谱图的面积的方法来实施。
对于培养最后一天回收的培养上清液(即从达到汇合(confluent)后的培养皿中采取的培养上清液),计算出通过进行上述GC-MS分析及LC-MS分析而求出的各化合物的定量值(面积值)除以前述内部标准物质的定量值(面积值)而得到的值,将其作为培养上清液中的各化合物的含量的指标值。而且,有关对照细胞和被检细胞这两者,对从前述4个培养皿中回收的培养上清液分别用GC-MS及LC-MS分析后的结果中得到的前述指标值取平均值,使用该指标值的平均值对对照细胞和被检细胞中的各化合物的含量进行比较。具体而言,将对照细胞将求出的前述指标值的平均值记作A、对被检细胞求出的前述指标值的平均值记作B时,A/B、或B/A为1.2以上且Student's t检验为P<0.05时,判定在该化合物的含量方面对照细胞的培养上清液与被检细胞的培养上清液之间存在显著性差异。
由上可知,下面的表1~表4示出判定对照细胞的培养上清液中与被检细胞的培养上清液中的含量存在显著性差异的化合物。需要说明的是,表中的“E”表示10的乘方,例如“1.326E-02”表示“1.326×10-2”。
下面的表1及表2示出了证实对照细胞的培养上清液中的含量多于被检细胞的培养上清液中的含量的化合物。表1是KhES-1株的结果,表2是KhES-3株的结果。需要说明的是,这些表中的“变动值”是指上述的A/B,即“对照细胞中的前述指标值的平均值”相对于“被检细胞中的前述标准值的平均值”之比的意思。
[表1]
[表2]
下面的表3及表4示出了证实被检细胞的培养上清液中的含量多于对照细胞的培养上清液中的含量的化合物。表3是KhES-1株的结果,表4是KhES-3株的结果。需要说明的是,这些表中的“变动值”是指上述的B/A,即“被检细胞中的前述指标值的平均值”相对于“对照细胞中的前述指标值的平均值”之比的意思。
[表3]
[表4]
由上所述,可知的是:表1~表4所述的各化合物是由分化诱导导致细胞中的代谢量和/或向细胞外的分泌量变化的物质,可以作为用于评价细胞的分化状态的生物标志物利用。即,例如将不清楚是否维持着未分化状态的干细胞作为被检细胞、将明确为未分化状态的干细胞作为对照细胞,对于表1及表2所述的化合物的任意一个求出“对照细胞的培养上清液中的含量”相对于“被检细胞的培养上清液中的含量”之比,若该值为预定的阈值以上,则可以判定前述被检细胞不是未分化状态。或者,对于表3、4所述的化合物的任意一个求出“被检细胞的培养上清液中的含量”相对于“对照细胞的培养上清液中的含量”之比,若该值为预定的阈值以上,则也可以判定前述被检细胞不是未分化状态。
另外,与上述相反,将明确为分化了的细胞作为对照细胞,对于表1及表2所述的化合物的任意一个求出“被检细胞的培养上清液中的含量”相对于“对照细胞的培养上清液中的含量”之比,若该值为预定的阈值以上,则可以判定前述被检细胞为未分化状态。或者,对于表3、4所述的化合物的任意一个求出“对照细胞的培养上清液中的含量”相对于“被检细胞的培养上清液中的含量”之比,若该值为预定的阈值以上,则也可以判定前述被检细胞为未分化状态。
另外,例如将不清楚未分化状态的细胞是否残存的来源于干细胞的分化诱导细胞作为被检细胞、将明确为未分化的细胞作为对照细胞,对于表1及表2所述的化合物的任意一个求出“被检细胞的培养上清液中的含量”相对于“对照细胞的培养上清液中的含量”之比,若该值为预定的阈值以上,则可以判定前述被检细胞混有未分化状态的细胞。或者,对于表3、4所述的化合物的任意一个求出“对照细胞的培养上清液中的含量”相对于“被检细胞的培养上清液中的含量”之比,若该值为预定的阈值以上,则也可以判定前述被检细胞混有未分化状态的细胞。
另外,例如与上述相同地将不清楚未分化状态的细胞是否残存的来源于干细胞的分化诱导细胞作为被检细胞,对照细胞与上述相反使用明确为分化了的细胞,对于表1及表2所述的化合物的任意一个求出“被检细胞的培养上清液中的含量”相对于“对照细胞的培养上清液中的含量”之比,若该值为预定的阈值以上,则可以判定前述被检细胞混有未分化状态的细胞。或者,对于表3、4所述的化合物的任意一个求出“对照细胞的培养上清液中的含量”相对于“被检细胞的培养上清液中的含量”之比,若该值为预定的阈值以上,则也可以判定前述被检细胞混有未分化状态的细胞。需要说明的是,根据上述任意的方法进行判定的情况,对照细胞的培养上清液中的化合物的含量不需要在与被检细胞相同的时间进行测定,也可以使用预先测定的数据。
需要说明的是,证实了:上述的表1~表4所述的化合物当中与被检细胞的上清液中的含量相比对照细胞的培养上清液中的含量较多的腐胺、胱硫醚、犬尿氨酸、及抗坏血酸的变动值为3.00以上这一含量的变化很大(参见表1及表2)。因此,可以认为,这些化合物是能够特别适合作为显示被检细胞为未分化状态的或者显示在被检细胞中混有未分化状态的细胞的生物标志物而利用。
另外,KhES-1株的培养第0天~第6天的培养上清液中的前述生物标志物的含量的变化示于图2及图3。需要说明的是,图2是通过GC-MS分析的结果,图3是通过LC-MS分析的结果。由这些图可以明确,证实了:培养刚开始后被检细胞与对照细胞在前述生物标记化合物的含量方面没有差异,但随时间的经过被检细胞与对照细胞之间各生物标记化合物的含量的差异扩大。需要说明的是,图2及图3中示出了有关KhES-1株的结果,但对于KhES-3株而言也证实显示出相同的变化。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种用于外阴鳞状细胞癌中药制剂及其制备方法
- miR-455-3p在食管鳞状细胞癌中的诊断、治疗和预后的应用
- Eif5a2在制备食管鳞状细胞癌预后诊断试剂中的应用的制作方法
- 粘纤网球食管脱落细胞采集器的制作方法
- 一种新的多肽——人细胞分化转录因子13.7和编码这种多肽的多核苷酸的制作方法
- 一种新的多肽——人细胞分化转录因子10和编码这种多肽的多核苷酸的制作方法
- 一种新的多肽——人细胞分化转录因子11和编码这种多肽的多核苷酸的制作方法
- 一种新的多肽——人细胞分化转录因子14和编码这种多肽的多核苷酸的制作方法
- 一种新的多肽——人细胞分化转录因子11.1和编码这种多肽的多核苷酸的制作方法
- 一种新的多肽——人细胞分化转录因子58和编码这种多肽的多核苷酸的制作方法