改进植物中的蛋白产生的制作方法
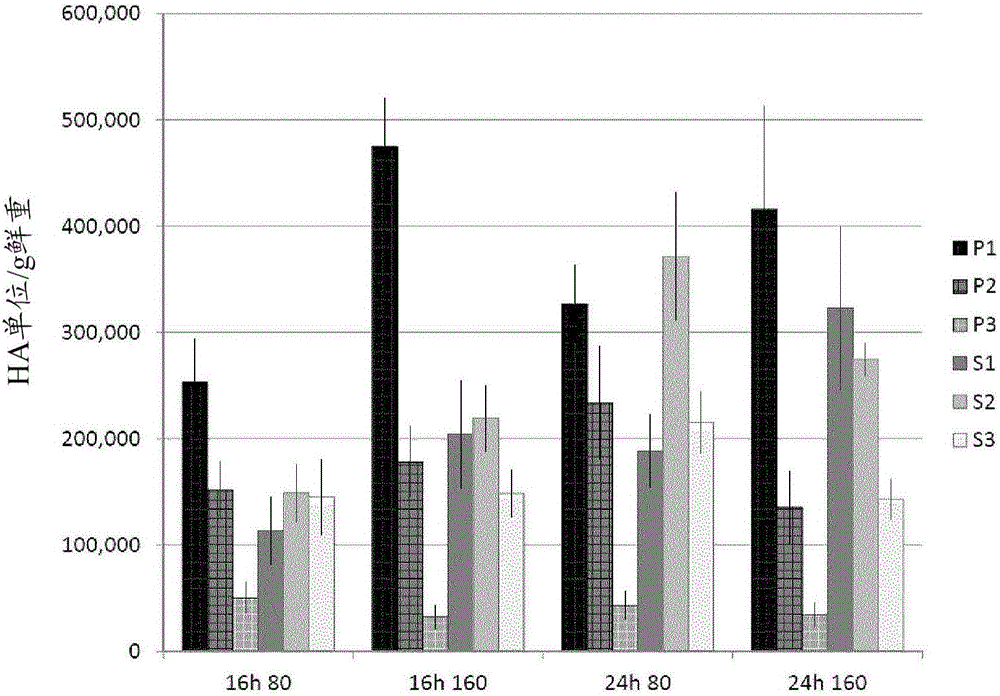
本发明涉及在植物中产生蛋白的方法。本发明还提供了增加植物中一种或多种蛋白产生的方法。发明背景基于植物的蛋白表达平台是应对全世界生物治疗学和诊断学增长需求的有用解决方案。与细菌或酵母不同,植物细胞能够正确折叠、组装并修饰哺乳动物来源的复杂蛋白,如治疗或诊断用抗体。与基于哺乳动物细胞的产生系统相比,植物还在安全性、资本投资和容易放大方面呈现优势。因此,植物是用于产生当前应用于生命科学中的蛋白(诸如,例如mAbs或病毒抗原,如来自流感的HA)的合适宿主。WO07016276公开了稳定转化植物的方法,其通过在两片子叶接触的点切开幼苗以去除两片子叶和最初的真叶,并且允许从切割面长出新枝。该方法包括使植物受伤,以利于在受伤部位引入农杆菌并提高转化效率。将切除的幼苗在细菌悬液中涡旋,所述悬液中包含携带期望的转移DNA的转化质粒。受伤的步骤是转化步骤之前所必须的。精确的切割介导的转化能够导致稳定转化从幼苗的切割面出现的新枝。这些枝能够发育成植物的地上部分,并由此产生转化的子代。Spokevicus等(FunctionalPlantBiology2006)公开了杨属树木中休眠侧芽(DLB)的体内转化。通过中央垂直切割使DLB受伤,或者去除植物的顶部,并将剩下的DLB通过垂直切割、添加保护层或添加根瘤农杆菌(A.tumefaciens)相结合来处理。利用这种方法,受伤的步骤是转化步骤之前所必须的。WO2008/151444公开了利用瞬时表达系统在植物内合成目的蛋白的方法。在期望的核酸构建体浸润之前,植物被修剪。在用转化有合适的质粒的农杆菌菌株真空浸润叶之前,通过挤压机械从植物去除或化学修剪本氏烟(N.benthamiana)植株的顶芽和腋芽。Wydro等(ActaBiochimicaPolonica,Vol53No.2/2006289-298)公开了在用根瘤农杆菌浸润的本氏烟的最新的叶(位于植株的顶部)中检测到了最高水平的瞬时绿色荧光蛋白(GFP)基因表达,而在位于中间和底部位置处的较老的叶中的表达则较低。Halfhill等(PlantCellRep22:338-343,2003)提出,GFP荧光的变化与叶老化过程中可溶性蛋白浓度的改变相关。在不同位置处的单片叶中,gfp基因表达的水平和可溶性蛋白的浓度在相似的时间并以相似的程度下降。Wydro等提出这两个因素之间的密切关联暗示GFP表达的下降是叶生理机能综合变化的结果。通过开发利用农杆菌浸润瞬时蛋白表达的高产系统已增强了在植物中表达临床上有用的蛋白。存在在植物中优化表达并增加重组蛋白的数量和质量的需求。发明概述本发明涉及在植物中产生蛋白的方法。本发明还提供了增加植物中一种或多种蛋白产生的方法。本发明的目的是提供在植物中产生蛋白的改进方法。本发明提供了在植物或植物部分内产生目的蛋白的方法,其包括:a)处理所述植物或植物部分以增加所述植物或植物部分中的次生叶生物质产生;b)将一种或一种以上核酸引入所述植物或植物部分,所述核酸包含编码所述目的蛋白的核苷酸序列,所述核苷酸序列与在植物中有活性的调控区可操作地连接;c)在允许编码所述目的蛋白的核苷酸序列表达的条件下培育所述植物或植物部分,由此产生所述目的蛋白,其中与在相同条件下生长但未经处理以增加次生叶生物质的相似植物的相同植物组织获得的目的蛋白的产量相比,所述目的蛋白的产量增加。可用于上述方法中的目的蛋白可以为抗体、抗原、疫苗或酶。目的蛋白可以为流感HA蛋白,并且在植物或植物部分中表达时,HA可以形成流感病毒样颗粒(VLP)。一种或一种以上核酸可以被引入植物或植物部分中,所述植物或植物部分的次生叶生物质与初生叶生物质之比为0.2:1至3:1。本发明还提供了如上所述的方法,其中从引入一种或一种以上核酸的步骤之前约40天直到引入一种或一种以上核酸的当天,或者从引入一种或一种以上核酸的步骤之前约40天直到收获植物或植物部分的当天实施步骤a)的处理步骤。本发明包括如上所述的方法,其中步骤a)的处理植物的步骤,包括:增加植物生长过程中的光持续时间,增加植物生长过程中的光强度,选择生长过程中植物所暴露的波长,修剪植物初生茎的顶芽,在存在增加次生枝发育的试剂、激素或其组合的情况下培育植物,施加减弱顶端优势的化合物,机械修剪,化学修剪,基因修饰敲入、敲除,以及促进次生生长的植物育种,或以上的组合。在如上所述的方法中,可以在存在植物激素的情况下培育植物。例如,可以在存在约50ppm至900ppm植物激素的情况下培育植物。植物激素可以是合成的细胞分裂素,例如6-苄氨基嘌呤(BAP)。本发明还包括如上所述的方法,其中所述方法还包括收获植物以及任选地纯化目的蛋白的步骤。在收获步骤中,可以收获次生叶,或者初生叶和次生叶。此外,可以收获次生叶、来自初生茎的中间叶(P2)和来自初生茎的新叶(P1),或者可以收获来自初生茎的中间叶(P2)、来自初生茎的新叶(P1)、来自次生茎的老叶(S3)、来自次生茎的中间叶(S2)和来自次生茎的新叶(S1)。此外,可以不收获来自植物初生茎的老叶(P3)。本发明提供了如上所述的方法,其中在步骤b)的引入步骤中,核酸在植物中瞬时表达或者核酸在植物中稳定表达。通过增加次生叶生物质,与未经处理以增加次生生物质并在相同条件下生长的植物的相同植物组织获得的目的蛋白的产量相比,可以获得来自初生生物质和次生生物质的蛋白产量的增加。本发明的概述未必描述了本发明的所有特征。附图说明从以下参照附图的描述中,本发明的这些和其它特征将变得更加显而易见,其中:图1显示了在温室中不同的光周期(16h和24h)和光强度处理(80和160μmol/m2.s)下,浸润之前在生长的植物的生物质产生。收获主茎的新叶(P1)、成熟叶(P2)和老叶(P3)以及次生茎的新叶(S1)、成熟叶(S2)和老叶(S3),并测定生物质。图2显示了在不同的光周期(16h和24h)和光强度处理(80和160μmol/m2.s)下,主茎的新叶(P1)、成熟叶(P2)和老叶(P3)以及次生茎的新叶(S1)、成熟叶(S2)和老叶(S3)中的HA产生。图3显示了在不同的光周期(16h和24h)和光强度处理(80和160μmol/m2.s)下,主茎的新叶(P1)、成熟叶(P2)和老叶(P3)以及次生茎的新叶(S1)、成熟叶(S2)和老叶(S3)中的HA总产量(HA/植株)。图4显示了在不同的光周期(16h和24h)和光强度处理(80和160μmol/m2.s)下,主茎的叶(底部(P))和次生茎的叶(顶部(S))中的HA总产量。图5显示了在生长室中低光强度或高光强度下生长的植物的生物质产生。收获主茎的新叶(P1)、成熟叶(P2)和老叶(P3)以及次生茎的新叶(S1)、成熟叶(S2)和老叶(S3),并测定生物质。图6显示了在生长室中低光强度或高光强度下生长的每株植物的HA总产量。收获主茎的新叶(P1)、成熟叶(P2)和老叶(P3)以及次生茎的新叶(S1)、成熟叶(S2)和老叶(S3),并测定每株植物的HA总产量。图7显示了具有初生叶(P1、P2、P3)和次生叶(SI1、S2、S3)的植物的示意图。图8显示了修剪(在这种情况下,在幼苗移植后5、7或12天从植物去除顶芽)对每株植物的总初生生物质(P)与总次生生物质(S)的影响。图9显示了对于在幼苗移植后7和/或12天,用100、500或1,000ppm浓度的苄氨基嘌呤(BAP)处理的植物,6-苄氨基嘌呤(BAP)对总初生生物质(P)与总次生生物质(S)的影响。图10显示了在幼苗移植后7和/或12天,用100、500或1,000ppm浓度的6-苄氨基嘌呤(BAP)处理的植物中,HA产生的平均速率(HA单位/g鲜重)。图11显示了在幼苗移植后7和/或12天,用100、500或1,000ppm浓度的6-苄氨基嘌呤(BAP)处理的植物中,HA的总产量(HA/植株)。图12A和图12B分别显示了引物IF-PDI.S1+3c(SEQIDNO:1)和IF-H1cTMCT.S1-4r(SEQIDNO:2)。图13显示了PDISP/H1加利福尼亚的核苷酸序列(SEQIDNO:3)。图14显示了构建体1191的图示。图15显示了构建体1191的核苷酸序列(SEQIDNO:4)。tDNA边界加下划线。图16显示了表达盒484的核苷酸序列。编码PDISP/H1加利福尼亚的序列加下划线。图17显示了PDISP/H1加利福尼亚的氨基酸序列(SEQIDNO:6)。图18显示了构建体编号484(2X35S/CPMVHT)的图示。详细描述本发明涉及在植物中产生蛋白的方法。本发明还提供了在植物中产生目的蛋白的方法和组合物。还提供了在植物或植物部分内产生目的蛋白的方法。本发明提供了在植物或植物部分内产生目的蛋白的方法,其包括:a)处理所述植物或植物部分以增加所述植物或植物部分中的次生叶生物质产生;b)将一种或一种以上核酸引入所述植物或植物部分,所述核酸包含编码所述目的蛋白的核苷酸序列,所述核苷酸序列与在植物中有活性的调控区可操作地连接;c)在允许编码所述目的蛋白的核苷酸序列表达的条件下培育所述植物或植物部分,由此产生所述目的蛋白,其中与在相同条件下生长但未经处理以增加次生生物质的相似植物的相同植物组织获得的目的蛋白的产量相比,所述目的蛋白的产量增加。可以收获植物组织,并从植物中提取目的蛋白。如果需要,可以利用本领域公知的标准技术纯化目的蛋白。可选地,可以收获植物并用作食物、营养物或医疗补充剂,或者可以部分加工植物以产生用作食物、营养物或医疗补充剂的轻度加工植物提取物。“相似的植物”意指与经处理以增加次生生物质产生的植物属于同一属、物种和品种的植物。当次生叶生物质与初生叶生物质之比为0.2:1至3:1或其之间的任何比时,一种或一种以上核酸可以被引入植物或植物部分。例如,次生叶生物质与初生叶生物质之比可以为约0.2:1、0.3:1、0.4:1、0.5:1、0.6:1、0.7:1、0.8:1、0.9:1、1:1、1.2:1、1.4:1、1.6:1、1.8:1、2:1、2.2:1、2.4:1、2.6:1、2.8:1、3:1或其之间的任何比。目的蛋白可以是任何蛋白,例如,酶、药学活性蛋白、血液凝结因子、抗体、抗原、疫苗、食物补充剂、营养补充剂、工业酶、或者可以在植物内形成“病毒样颗粒”的一种或多种蛋白。术语“病毒样颗粒”(VLP)或“VLP”是指自组装且包含诸如流感HA蛋白的结构蛋白的结构。VLP通常在形态学和抗原性上与感染中产生的病毒粒子相似,但是缺少足够的遗传信息来复制,因而是非感染性的。在一些实例中,VLP可以包含一种蛋白或一种以上的蛋白。参见,例如WO2009/009876;WO2009/076778;WO2010/003225(各自通过引用并入本文)。本发明因而还涉及在植物中产生VLP的方法。本发明还提供了在植物中产生VLP的方法和组合物。例如,提供了在植物或植物部分内产生病毒样颗粒(VLP)的方法,其包括:a)处理所述植物或植物部分以增加所述植物或植物部分中的次生叶生物质产生;b)将一种或一种以上核酸引入所述植物或植物部分,所述核酸包含编码血凝素(HA)的核苷酸序列,所述核苷酸序列与在植物中有活性的调控区可操作地连接;c)在允许编码所述HA的核苷酸序列表达的条件下培育所述植物或植物部分,由此产生所述HA,其中与在相同条件下生长并且未经处理以增加次生生物质的相似植物的相同植物组织获得的HA的产量相比,所述HA的产量增加。可以收获植物组织,并从植物提取VLP。如果需要,可以利用本领域公知的标准技术纯化VLP(参见,例如WO2009/009876;WO2009/076778;WO2010/003225;各自通过引用并入本文)。可选地,可以收获植物并用作食物、营养物或医疗补充剂,或者可以部分加工植物以产生用作食物、营养物或医疗补充剂的轻度加工植物提取物。当次生叶生物质与初生叶生物质之比为0.2:1至3:1或其之间的任何比时,一种或一种以上核酸可以被引入植物或植物部分。例如,次生叶生物质与初生叶生物质之比可以为约0.2:1、0.3:1、0.4:1、0.5:1、0.6:1、0.7:1、0.8:1、0.9:1、1:1、1.2:1、1.4:1、1.6:1、1.8:1、2:1、2.2:1、2.4:1、2.6:1、2.8:1、3:1或其之间的任何比。如图7所示,植物10包括初生茎20、顶芽40以及从初生茎20长出的叶(P1、P2、P3以及S1、S2和S3)。在植物10的顶端40附近长出的新叶被称为P1。P1叶或上部的叶仍在生长并增加其生物质。P1叶沿主茎位于P2叶以上,并且当‘顶端复合物’(即顶芽和任何新形成的叶)存在时,包括该复合物的非常新的叶。新植物(例如25至30日龄植物)的P1叶,通常对应于叶1、叶2和顶端复合物。P2叶是指尚未开始衰老的成熟叶。P2叶包括接近完成或已经完成其扩增期的叶。从上看植物,P2叶是可见的最大的叶,并且可以遮住或覆盖P3叶。P2叶通常对应于主茎上的叶3、叶4和叶5(叶的编号从植物的上部或顶端开始;参见Robertetal.2013,PLoSONE8(7):e70203,doi:10.1371/journal.pone.0070203的图2A;其通过引用并入本文)。P3叶或底部叶是在主茎上位于P2叶以下的叶。P3叶包括但不限于,可能显现出一些发黄的衰老的叶。P3叶通常包括叶5、叶6、叶7以及植物较老的叶。衰老的症状(例如叶绿素丧失)通常从叶7或叶8可看出。叶5和6看起来并未衰老但是通常含有低量的蛋白。S1、S2和S3叶附着至次生(以及最终的第三代)茎。S1叶为附着至从P1叶长出的次生茎的那些叶。这些次生叶接近顶端,并且比S2和S3叶更新。S2叶附着至从P2叶长出的次生茎,而S3叶附着至从P3叶长出的次生茎。S3叶为最老的次生叶,但是越新的S3叶会越比P3叶更有效地产生蛋白。发现目的蛋白的总产量随着植物中的次生叶生物质的增加而增加。利用本文所述的方法,当将目的蛋白的产生与在利用相似的转化方案,并暴露于相似的生长条件,但在将核酸引入植物的步骤之前未处理植物或植物部分以增加次生叶生物质的植物中产生相同的目的蛋白相比,产生了高产量的目的蛋白。如图8所示,与未去除顶端的植物相比,去除植物的顶端(修剪植物)导致每株植物次生茎(S)中目的蛋白(血凝素;HA)产量的增加和每株植物初生茎(P)中目的蛋白(HA)产量的下降。此外,去除植物的顶端导致次生叶生物质增加2.1倍,初生叶生物质下降,其中次生叶生物质与初生叶生物质之比从0.4:1增加至1.6:1(参见表3;实施例5)。目的蛋白产量的增加意指,利用本领域内的标准技术所确定的,当与植物(其中植物未经处理以增加次生叶生物质)中表达的目的蛋白的产量相比,目的蛋白的产量增加约5%至约500%(即增加高达5倍),或其之间的任何量,例如,约10%至约50%或其之间的任何数值,例如约5%、8%、10%、12%、15%、18%、20%、22%、24%、25%、26%、28%、30%、32%、34%、35%、36%、38%、40%、42%、44%、45%、46%、48%、50%、52%、54%、55%、56%、58%、60%、65%、70%、75%、80%、85%、90%、95%、100%、110%、120%、130%、140%、150%、160%、170%、180%、200%、220%、240%、260%、280%、300%、320%、340%、360%、380%、400%、420%、440%、460%、480%或500%。次生叶生物质的增加意指,利用本领域内的标准技术所确定的,当与未经处理以增加次生叶生物质的相同条件下生长的相似植物(即相同植物品种)相比,次生叶生物质增加约2%至约300%,或其之间的任何量(即增加高达3倍),例如约10%至约200%或其之间的任何数值,例如约2%、5%、8%、10%、12%、15%、18%、20%、22%、24%、25%、26%、28%、30%、32%、34%、35%、36%、38%、40%、42%、44%、45%、46%、48%、50%、52%、54%、55%、56%、58%、60%、65%、70%、75%、80%、85%、90%、95%、100%、110%、120%、130%、140%、150%、160%、170%、180%、200%、220%、240%、260%、280%或300%。生物质可以利用本领域技术人员已知的任何技术来确定,并且可以包括确定鲜重、干重、蛋白含量、排水体积等。除非另有说明,“叶生物质”意指叶和叶柄的生物质。次生叶生物质的增加可以是次生茎和次生叶数量的增加,次生茎和次生叶长度的增加,叶体积的增加,叶面积的增加,或以上的组合。处理植物的步骤之后,如上文提供的方法的步骤a中所示出的,次生叶生物质可以为植物总生物质的20%至50%,或其之间的任何量。例如,次生叶生物质(相对于植物的总生物质)的百分比可以为21%、22%、23%、24%、25%、26%、27%、28%、29%、30%、31%、32%、33%、34%、35%、36%、37%、38%、39%、40%、41%、42%、43%、44%、45%、46%、47%、48%或49%或其之间的任何量。如从图2至图6和图8可以看出,植物或植物部分中蛋白累积的水平受到次生叶生物质与初生叶生物质之比的影响,例如约0.2:1至约1:1(次生叶生物质:初生叶生物质),或其之间的任何量,例如约0.2:1、0.3:1、0.4:1、0.5:1、0.6:1、0.7:1、0.8:1、0.9:1、1:1、1.2:1、1.4:1、1.6:1、1.8:1、2:1、2.2:1、2.4:1、2.6:1、2.8:1、3:1或之间的任何比(次生叶生物质:初生叶生物质),或其之间的任何量。植物中次生叶生物质与初生叶生物质之比可以随以下而不同:相比初生叶生物质增加次生叶生物质,例如增加植物生长过程中的光持续时间,增加植物生长过程中的光强度,修剪植物的顶芽40(图7),在存在增加次生生物质形成的试剂、增加次生生物质形成的激素的情况下培育植物,施加减弱顶端优势的化合物,或以上的组合。因此,本发明还提供了相比未经处理的相似植物,通过处理植物以增加次生叶生物质来调节次生叶生物质与初生叶生物质之比,从而增加目的蛋白的产量的方法。初生叶生物质(或初生生物质),意指涵盖初生叶(P1、P2、P3和相关的叶柄)生物质的植物生物质。因此,初生叶生物质不包括来自次生叶或第三代叶的生物质,也不包括来自根的生物质。通常,茎(也可以称为枝)为芽、果实和叶提供了轴。维管植物的主结构轴之一为主茎或初生茎(20,图7)。初生茎20通常为初生叶(P1、P2、P3)、花、芽、果实和次生茎30提供支持。初生叶生物质包括来自初生叶(P1、P2、P3)及其相关的叶柄的生物质。“次生茎形成”意指导致次生叶生物质比例增加的新的次生茎的萌发、已经萌发的次生茎的发育或者萌发和已经萌发的次生茎的发育均有。植物初生茎可以具有直接从初生茎20伸出的不同龄的叶。初生茎的叶可以根据叶龄被分成老叶(P3)、中间叶(P2)或新叶(P1)。次生叶生物质(或次生生物质),意指获自次生茎30的叶和叶柄的生物质。更具体地,次生叶生物质是不包括来自初生叶、花、顶芽40或根的生物质的生物质。次生叶生物质还可以包括来源于从次生茎30长出的第三代茎或其它茎的叶生物质。“次生”、“附属”、“腋生”或“侧生”茎也可以从植物的主茎或初生茎20伸出。因此,次生茎30可以包括一个或多个次生茎以及一个或多个次生叶(S1、S2、S3)。此外,次生茎可以包括一个或多个第三代茎或其它茎。植物的次生茎30可以具有不同龄的叶,并且这些叶可以被分成新叶(S1)、中间叶(S2)或老叶(S3)。在浸润包含编码目的蛋白的核苷酸序列的核酸之前,发现处理植物以增加次生叶生物质能增加目的蛋白表达的水平(作为总合成蛋白的%)和产量(mg蛋白/kg鲜重)。增加次生叶生物质的植物处理可以包括但不限于,导致次生生长的增加的生长过程中植物所暴露的光强度的增加,导致次生生长增加的生长过程中植物暴露于光的时间(光持续时间)的增加,选择生长过程中植物所暴露的波长使得次生生长增加,改变导致次生生长增加的白昼/黑夜温度方案,例如从20℃的基数,改变约+/-1℃至约+/-15℃,或其之间的任何量的温度,从20℃的基数,改变约+/-1℃至约+/-15℃,或其之间的任何量的温度持续约5分钟至约16小时或其之间的任何时间的时间段,如果提供短于黑暗或光照周期的不同温度的脉冲,那么这种脉冲可以在光周期开始或结束时提供,例如在光周期开始或结束时约30分钟至约2小时,或者在光周期结束时提供不同温度的脉冲。此外,增加次生叶生物质的植物处理可以包括但不限于,在存在能诱导次生茎、次生生物质形成、或以上两者的试剂,能诱导次生茎形成、次生生物质形成、或以上两者的激素的情况下培养,施加减弱顶端优势的化合物,修剪初生顶芽40以诱导次生茎形成、次生生物质形成、或以上两者,导致次生茎形成、次生生物质形成、或以上两者增强的基因修饰如基因敲入或敲除,植物育种结合选择与其亲本品系相比展现出次生生长增加的植物,或以上的组合。“光”意指包括被植物的叶利用的波长,例如约400至约700nm的波长或其之间的任何波长的光谱的光,并且可以包括蓝光、绿光和红光,如果需要的话,包括电磁谱的红外波长部分。能够发射可以被植物利用的波长的任何合适的光源包括,例如,天然光、陶瓷金属卤化物光源、金属卤化物光源、高压钠光源、LED、荧光光源、白炽光源、或以上的组合。浸润之前处理植物以增加次生叶生物质的步骤可以整个植物生长周期实施,从发芽(即第0天)直到浸润(即将重组载体引入植物)或收获植物的当天、或其之间的任何时间。例如,如果处理为24小时的光周期,则发芽的幼苗可以暴露于该光周期一段处理时间,从发芽的当天延长到植物转化或浸润的步骤、培育转化的植物、直到收获的当天。然而,也可以使用更短的处理时间。以相似的方式,处理植物以增加次生生长的步骤可以包括生长过程中植物所暴露的光并导致次生生长增加的光强度的增加。可在植物生长的整个时间施加这种处理,从发芽、到植物转化或浸润、到收获植物的当天、或其之间的任何时间。相似地,可在植物生长的整个时间实施暴露植物以选择在生长过程中导致次生生长增加的波长,从发芽(即第0天)直到浸润(即将重组载体引入植物)或收获植物的当天、或其之间的任何时间。可以改变白昼/黑夜温度方案(从20℃的基数,改变约+/-1℃至约+/-15℃,或其之间的任何量;或可以提供保持温度的脉冲)以增加次生植物生长,并且可将植物在整个植物生长周期暴露于这种处理,从发芽(即第0天)直到浸润(即将重组载体引入植物)或收获植物的当天、或其之间的任何时间。可选地,可在转化或浸润步骤之前实施其它处理方法以增加植物次生叶生物质,从浸润之前约20天直到浸润的当天,或其之间的任何时间,例如从浸润之前20天至浸润当天,或之间的任何时间,例如从浸润之前20天、19天、18天、17天、16天、15天、14天、13天、12天、11天、10天、9天、8天、7天、6天、5天、4天、3天、2天、1天至浸润当天,或其之间的任何时间。增加光持续时间以增加次生叶生物质的应用,涉及使植物暴露于光约12h至约24h或其之间的任何值,例如约12h、13h、14h、15h、16h、17h、18h、19h、20h、21h、22h、23h或24h。例如,光持续时间可以为24h,使得植物在浸润步骤之前暴露于恒定光照。可从约发芽的当天直到浸润的当天,或者直到收获植物的当天,或其之间的任何时间实施光持续时间的增加。例如,但不认为限于从浸润之前40天、35天、30天、25天、20天、19天、18天、17天、16天、15天、14天、13天、12天、11天、10天、9天、8天、7天、6天、5天、4天、3天、2天,直到浸润的当天,收获的当天,或其之间的任何时间。本领域技术人员能够容易地确定修剪之前的适合间隔。光强度可以包括天然的日光、或补充了人造光的天然日光、或人造光。如果人造光被单独使用,或用于补充天然日光,则可以使用约60(μmol/m2·s)至约200(μmol/m2·s)或其之间的任何值,例如约60、70、80、90、100、110、120、130、140、150、160、170、180、190或200(μmol/m2·s)、或其之间的任何量。例如,光强度可以为160(μmol/m2·s)。可在整个植物生长周期实施光强度的增加,从发芽(即第0天)直到浸润(即将重组载体引入植物),或收获植物的当天,或其之间的任何时间。例如从浸润之前约40天、35天、30天、25天、20天、19天、18天、17天、16天、15天、14天、13天、12天、11天、10天、9天、8天、7天、6天、5天、4天、3天、2天、1天,直到浸润的当天,收获的当天,或其之间的任何时间。本领域技术人员能够容易地确定修剪之前的适合间隔。修剪,意指去除一个或一个以上顶芽40,或者去除包括顶芽40的茎的尖端或上部。修剪还可以包括顶芽的杀伤、诱导坏死或减缓生长,但并不从植物去掉该芽。芽生长的减缓(或减缓芽生长)意指,与未经处理的芽相比,该芽展现出在限定的时段内例如代谢活性或尺寸增加降低约50%至100%,或其之间的任何量。还可以通过施加减弱顶端优势的化合物来完成修剪。如果为修剪的目的而施加化合物,那么所用的剂量通常为化合物的生产商所推荐的剂量。可以通过本领域技术人员已知的且包括但不限于以下的任何方式来完成修剪:机械去除芽,例如但不限于,例如使用夹具等切割、修剪、挤压、压迫,例如通过将液氮流局部引导至芽,或者用已利用适合的冷源包括液氮、干冰、乙醇-干冰、冰等冷却的夹具或其它工具环绕芽而局部冷冻,使得芽的温度降低以便减缓芽的生长或杀伤芽。修剪还包括化学修剪,例如,施加能够杀伤或减缓芽生长的除草剂(化合物;修剪剂),或者施加能够杀伤或减缓芽生长的生长调节剂。化学修剪的应用成为修剪处理的有效方式,因为植物能够容易地通过以下进行处理:在植物上喷洒、喷雾、浸湿化合物,或者将植物浸入包含化合物的溶液。植物在浸润步骤之前可以被处理一次,或者在浸润步骤之前可以被处理一次以上。试剂、化合物或激素增加次生茎形成、次生生物质形成、或以上两者,或者减弱顶端优势或以上的组合。例如,植物可以用促进次生茎形成或减弱顶端优势或以上的组合的细胞因子或植物激素培养或处理。例如,植物可以用植物激素如细胞分裂素(CK)处理以增加或促进次生茎形成。细胞分裂素可以为,例如合成的细胞分裂素,如6-苄氨基嘌呤(BAP),又被称为苄基腺嘌呤。可以用以下量的植物激素处理植物:约50ppm至约900ppm或其之间的任何量,例如100ppm、150ppm、200ppm、250ppm、300ppm、350ppm、400ppm、450ppm、500ppm、550ppm、600ppm、650ppm、700ppm、750ppm、800ppm、850ppm、900ppm或其之间的任何量。例如,植物可以用约100ppm至500ppm的植物激素例如BAP处理。如图9、图10和图11所示,用BAP处理植物对初生生物质具有很小的影响,但是对次生生物质具有显著积极的影响(参见图9b)。此外,可以向植物施加减弱顶端优势的试剂或化合物,例如,植物可以被化学修剪或以其它方式处理以减弱顶端优势。可以使用的化合物的实例包括但不限于除草剂,例如,植物生长调节剂乙烯利(例如Bromeflor、Cerone、ChlorethephonEthrel、Florel、Prep和Flordimex)、丁酰肼(丁二酸单-2,2-二甲基肼,-琥珀酸2,2-二甲基肼;例如B-nine;Alar,Kylar,SADH,B-nine,B-995,aminozide)、Atrimmec(敌草克钠(dikegulacsodium))、马来酰肼(l,2,-二氢-3,6-吡嗪二酮),并且包括赤霉酸合成的抑制剂,例如但不限于,矮壮素(Cycocel)(氯化氯代胆碱)、A-Rest(嘧啶醇)、三氮唑,例如,Bonzi(多效唑)、Sumagic(烯效唑)或3-氨基-l,2,4-三氮唑(3-AT)。可以以植物生长改良已知的剂量范围使用这些化合物,例如所用的剂量范围可以为化合物的生产商所推荐的剂量范围。还可以以植物生长改良已知的剂量范围以下的剂量范围使用这些化合物,例如所用的剂量范围可以以化合物的生产商所推荐的剂量范围的75%、50%、25%、10%使用。可以以约0.2ppm至约5,000ppm,以及其之间的任何量使用这些化合物,这取决于所选择的生长调节剂。此外,修剪剂(化合物)可以被施加一次,或者可以按需要进行另外的施加。例如,化合物可以被施加一次,或者化合物可以被施加一次以上,以导致植物在浸润之前或之后的化学修剪。如果使用化学修剪,那么可以在浸润之前约20天至浸润之后约2天或其之间的任何时间施加化合物,例如,可以有效使用在浸润之前14天、7天或5天的化合物施加。顶芽的修剪可在以下时间实施:从浸润之前约20天至浸润之前约2天或其之间的任何时间,例如浸润之前19天至浸润之前约2天或其之间的任何时间,例如浸润之前18天至浸润之前约2天或其之间的任何时间,例如浸润之前17天至浸润之前约2天或其之间的任何时间,例如浸润之前16天至浸润之前约2天或其之间的任何时间,例如浸润之前15天至浸润之前约2天或其之间的任何时间,例如浸润之前14天至浸润之前约2天或其之间的任何时间,例如浸润之前15天至浸润之前约2天或其之间的任何时间,例如浸润之前14天至浸润之前约2天或其之间的任何时间,例如浸润之前13天至浸润之前约2天或其之间的任何时间,例如浸润之前12天至浸润之前约2天或其之间的任何时间,例如,从浸润之前约11天至浸润之前约2天或其之间的任何时间,例如,从浸润之前约10天至浸润之前约2天或其之间的任何时间,例如,从浸润之前约9天至浸润之前约2天或其之间的任何时间,例如,从浸润之前约8天至浸润之前约2天或其之间的任何时间,例如,从浸润之前约7天至浸润之前约2天或其之间的任何时间,例如,从浸润之前约6天至浸润之前约2天或其之间的任何时间,例如,从浸润之前约5天至浸润之前约2天或其之间的任何时间,例如,从浸润之前约4天至浸润之前约2天或其之间的任何时间,例如,从浸润之前约3天至浸润之前约2天或其之间的任何时间,或从浸润之前20天、19天、18天、17天、16天、15天、14天、13天、12天、11天、10天、9天、8天、7天、6天、5天、4天、3天至浸润之前约2天或其之间的任何时间。本领域技术人员能够容易地确定修剪之前的适合间隔。所述方法还可以包括收获植物或植物部分。例如,可以收获包含初生茎和次生茎的整株植物。可选地,可以收获包含次生生物质、初生生物质、或以上的组合的植物部分。例如,可以收获S1、S2、S3、P1、P2、P3叶,具有相关叶柄的S1、S2、S3、P1、P2、P3叶,或以上的组合。如果需要,可不收获植物的老叶(P3)。术语“植物部分”,意指来源于植物的任何部分,包括获自植物的组织,例如但不限于获自植物的叶、叶和茎、根、地上部分包括叶、茎以及任选地植物的花部分、细胞、原生质体或以上的任何组合。例如,“植物部分”可以指植物的叶或茎。植物部分还可以包括次生生物质、初生生物质、或以上的组合,例如,S1、S2、S3、P1、P2、P3叶,具有相关叶柄的S1、S2、S3、P1、P2、P3叶,或以上的任何组合。术语“植物物质”,意指来源于植物的任何材料。植物物质可以包括整个植物、组织、细胞或其任何部分。此外,植物物质可以包括细胞内植物成分、细胞外植物成分,植物的液体或固体提取物,或以上的组合。另外,植物物质可以包括来自植物的叶、茎、果实、根或以上的组合的植物、植物细胞、组织、液体提取物或以上的组合。植物物质可以包括没有经过任何加工步骤的植物或其部分。然而,还考虑植物材料可以经过以下所限定的轻度加工步骤,或多步严格的加工,包括利用本领域内通常已知的技术(包括但不限于层析法、电泳等)进行部分或基本的蛋白纯化。利用本领域技术人员已知的方法,可以从植物、植物部分或植物物质纯化、部分纯化根据本发明产生的目的蛋白,或者可以将其作为口服疫苗施用。纯化可以包括如WO2011/035422(其通过引用并入本文)中所描述的,产生质外体(apoplast)部分。对于预制的尺寸排阻层析,可以获得包含目的蛋白的制备物,并通过离心去除不溶物质。还可以使用PEG进行沉淀。回收的蛋白可以利用常规方法(例如,BradfordAssay,BCA)定量,使提取物通过利用例如SEPHACRYLTM、SEPHADEXTM或相似介质的尺寸排阻柱,并收集组分。BlueDextran2000或合适的蛋白可以用作校准用标准品。还可以使提取物通过阳离子交换柱并收集活性组分。层析之后,还可以通过蛋白电泳、免疫印迹或以上两者来进一步分析组分,以便确认组分中目的蛋白和蛋白补体的存在。术语“轻度加工”,意指植物物质,例如,包含目的蛋白的植物或其部分被部分纯化以产生植物提取物、匀浆、植物匀浆组分等(即轻度加工的)。部分纯化可以包括但不限于破坏植物细胞结构,由此产生包含可溶植物成分和不溶植物成分(其可以通过例如但不限于离心、过滤或其组合被分离)的组合物。在这方面,分泌到叶或其它组织的细胞外间隙内的蛋白能够利用真空或离心提取而容易地获得,或者能够通过滚压机或碾磨等在压力下提取组织,以挤压或释放在细胞外间隙内游离的蛋白。轻度加工还可以涉及可溶性蛋白粗提取物的制备物,因为这些制备物将具有来自次生植物产物的可忽略的污染物。此外,轻度加工还可以涉及水提叶中的可溶性蛋白,随后用任何合适的盐沉淀。其它方法可以包括大规模浸渍和汁液提取,以便允许直接使用提取物。“目的核苷酸(或核酸)序列”或“目的编码区”,意指宿主生物体例如植物内待表达以产生目的蛋白的任何核苷酸序列或编码区(这些术语可以互换使用)。此类目的核苷酸序列可以编码,但不限于,天然或修饰的蛋白、工业酶或修饰的工业酶、农业蛋白或修饰的农业蛋白、辅助蛋白、蛋白补充剂、药学活性蛋白、保健品、附加值产品、或其用于饲料、食物或饲料和食物用途的片段。目的蛋白可以在本发明的核苷酸序列、或构建体、或载体转化的任何合适的植物宿主中表达。合适宿主的实例包括但不限于,拟南芥(Arabidopsis)、农作物包括例如油菜(canola)、芸苔属植物(Brassicaspp.)、玉米、烟草属植物(Nicotianaspp.)例如本氏烟(Nicotianabenthamiana)、苜蓿、马铃薯、甘薯(Ipomoeabatatus)、高丽参、豌豆、燕麦、稻、大豆、小麦、大麦、向日葵、棉花、谷物、黑麦(Secalecereale)、高粱(Sorghumbicolor,Sorghumvulgare)、红花(Carthamustinctorius).“表达盒”是指包含目的核酸的核苷酸序列,所述目的核酸受以下元件控制且与以下元件可操作地连接:合适的启动子或用于在宿主细胞例如植物细胞中转录该目的核酸的其它调控元件。“调控区”、“调控元件”或“启动子”,意指通常但并非总是位于基因的蛋白编码区上游的核酸部分,其可以由DNA或RNA,或DNA和RNA两者组成。“可操作地连接”,意指特定序列直接或间接相互作用以实施预期功能,如介导或调节基因表达。可操作地连接的序列的相互作用可以,例如通过与这些可操作地连接的序列相互作用的蛋白介导。当转录调控区和目的序列在功能上连接以允许被该转录调控区介导或调节的目的序列转录时,这些序列是可操作地连接的。当调控区有活性,并且与目的基因可操作地结合或可操作地连接时,这可以导致目的基因的表达。调控元件可能能够介导器官特异性、或控制发育或暂时的基因激活。“调控区”包括启动子元件、展现出基本启动子活性的核心启动子元件、响应外部刺激可诱导的元件、介导启动子活性的元件如负调控元件或转录增强子。本文所用的“调控区”还包括在转录后有活性的元件,例如调节基因表达的调控元件,如翻译和转录增强子、翻译和转录抑制子、上游激活序列和mRNA不稳定性决定因子。这些后面的元件中的几种可以位于编码区附近。在本公开的上下文中,术语“调控元件”或“调控区”通常是指常常但并非总是位于结构基因的编码序列上游(5')的DNA序列,其通过提供用于在特定位点起始转录所需的RNA聚合酶和/或其它因子的识别来控制编码区的表达。然而,应当理解,位于内含子内或序列3'的其它核苷酸序列也可能有助于调控目的编码区的表达。提供RNA聚合酶或其它转录因子识别以确保在特定位点起始的调控元件的实例是启动子元件。大多数而并非所有真核生物启动子元件均包含TATA盒,其为通常位于转录起始位点上游约25个碱基对处的由腺苷和胸苷核苷酸碱基对组成的保守核酸序列。启动子元件包含负责起始转录的基础启动子元件,以及修饰基因表达的其它调控元件(如上文所列出的)。组成型调控区在植物的各个部分以及持续整个植物发育中指导基因的表达。已知的组成型调控元件的实例包括与CaMV35S转录本(Odelletal.,1985,Nature,313:810-812)、稻肌动蛋白1(Zhangetal,1991,PlantCell,3:1155-1165)基因、肌动蛋白2(Anetal,1996,PlantJ.,10:107-121)基因、或tms2(U.S.5,428,147,其通过引用并入本文)基因、和磷酸丙糖异构酶1(Xuet.al.,1994,PlantPhysiol.106:459-467)基因、玉米泛素1基因(Cornejoetal,1993,PlantMol.Biol.29:637-646)、拟南芥泛素1和6基因(Holtorfetal,1995,PlantMol.Biol.29:637-646)、以及烟草翻译起始因子4A基因(Mandeletal,1995PlantMol.Biol.29:995-1004)相关的启动子。本文所用的术语“组成型”并不必然指在组成型调控区控制下的基因在所有细胞类型中以同一水平表达,而是指该基因在大范围的细胞类型中表达,即使常常观察到丰度上的变化。在另一实例中,目的蛋白可以在包含扩增元件和/或调控元件或调控区(在本文又被称为增强子元件)的表达系统中表达。例如,来自双生病毒的扩增元件如,例如来自菜豆黄矮病毒(BeYDV)的扩增元件可用于表达目的蛋白。BeYDV属于适用于双子叶植物的玉米线条病毒属(Mastreviruses)。BeYDV是具有单链环状DNA基因组的单组份,并且能够通过滚环机制复制至非常高的拷贝数。BeYDV来源的DNA复制子载体系统已用于在植物中进行快速高产量的蛋白产生。本文所用的短语“扩增元件”,是指包含双生病毒基因组的一个或多个长基因间区(LIR)的至少一部分的核酸区段。本文所用的“长基因间区”是指含有rep结合位点的长基因间区的区域,所述rep结合位点能够通过双生病毒Rep蛋白介导切除和复制。在一些方面,包含一个或多个LIR的核酸区段还可以包含双生病毒基因组的短基因间区(SIR)。本文所用的“短基因间区”是指互补链(玉米线条病毒的短IR(SIR))。本文可以使用任何合适的双生病毒来源的扩增元件。参见,例如,WO2000/20557;WO2010/025285;ZhangX.etal.(2005,BiotechnologyandBioengineering,Vol.93,271-279)、HuangZ.etal.(2009,BiotechnologyandBioengineering,Vol.103,706-714)、HuangZ.etal.(2009,BiotechnologyandBioengineering,Vol.106,9-17);其通过引用并入本文)。如果构建体中使用一个以上的LIR,例如两个LIR,那么启动子,CMPV-HT区和目的核酸序列以及终止子被两个LIR的每一个括在一起。增强子元件可用于实现目的蛋白的高水平瞬时表达。增强子元件可以基于RNA植物病毒,包括豇豆花叶病毒属,诸如豇豆花叶病毒(CPMV,Cowpeamosaicvirus;参见例如,WO2007/135480;WO2009/087391;US2010/0287670,SainsburyF.etal.,2008,PlantPhysiology;148:121-1218;SainsburyF.etal.,2008,PlantBiotechnologyJournal;6:82-92;SainsburyF.etal.,2009,PlantBiotechnologyJournal;7:682-693;SainsburyF.etal.2009,MethodsinMolecularBiology,RecombinantProteinsFromPlants,vol.483:25-39),“CPMVHT+”描述于US61/971,274中,其通过引用并入本文,或“CPMVX”(又被称为“CPMV160”)和/或“CPMVX+”(又被称为“CPMV160+”)描述于US61/925,852中,其通过引用并入本文。转录后基因沉默(PTGS)可能参与植物中转基因的限制表达,并且来自马铃薯病毒Y(HcPro)的沉默阻抑基因的共表达可用于抵消转基因mRNA的特异性降解(Brignetietal.,1998,EMBOJ.17,6739-6746,其通过引用并入本文)。其它的沉默阻抑基因是本领域内公知的,并且可以如本文所述来使用(Chibaetal.,2006,Virology346:7-14;其通过引用并入本文),例如但不限于,TEV-p1/HC-Pro(烟草蚀纹病毒-pl/HC-Pro)、BYV-p21、番茄丛矮病毒的p19(TBSVpl9;p19的构建描述于WO2010/0003225中,其通过引用并入本文)、番茄皱缩病毒的衣壳蛋白(TCV-CP)、黄瓜花叶病毒的2b(CMV-2b)、马铃薯病毒X的p25(PVX-p25),马铃薯病毒M的p11(PVM-pll)、马铃薯病毒S的p11(PVS-pll)、蓝莓枯黄病毒的p16(BScV-pl6)、柑桔衰退病毒的p23(CTV-p23)、葡萄卷叶伴随病毒-2的p24(GLRaV-2p24)、葡萄病毒A的p10(GVA-p10)、葡萄病毒B的p14(GVB-p14)、独活潜隐病毒的p10(HLV-p10)、或蒜头普通潜伏病毒的P16(GCLV-p16)。因此,一种或多种沉默阻抑基因,例如但不限于,HcPro、TEV-pl/HC-Pro、BYV-p21、TBSVp19、TCV-CP、CMV-2b、PVX-p25、rgscam、来自FHV的B2蛋白、CPMV的小外壳蛋白、以及来自TCV的外壳蛋白、PVM-p11、PVS-p/11、BScV-p16、CTV-p23、GLRaV-2p24、GBV-p14、HLV-p10、GCLV-p16或GVA-p10可以与基于豇豆花叶病毒属的表达盒,双生病毒来源的扩增元件,以及编码目的蛋白的核酸序列共表达,从而进一步确保植物中高水平的蛋白产生。利用Ti质粒、Ri质粒、植物病毒载体、直接DNA转化、显微注射、电穿孔等可将本发明的构建体引入植物细胞。对此类技术的综述参见,例如Weissbach和Weissbach,MethodsforPlantMolecularBiology,AcademyPress,NewYorkVIII,pp.421-463(1988);Geierson和Corey,PlantMolecularBiology,2dEd.(1988);以及Miki和Iyer,FundamentalsofGeneTransferinPlants.InPlantMetabolism,2dEd;DT.Dennis,DHTurpin,DDLefebrve,DBLayzell(eds),AddisonWesly,LangmansLtd.London,pp.561-579(1997)。其它方法包括直接DNA摄入、脂质体的使用、电穿孔,例如使用原生质体、显微注射、微弹(microprojectile)或晶须(whisker)以及真空浸润。参见,例如,Bilang等(1991,Gene100:247-250),Scheid等(1991,Mol.Gen.Genet.228:104-112),Guerche等(1987,PlantScience52:111-116),Neuhause等(1987,Theor.ApplGenet.75:30-36),Klein等(2987,Nature327:70-73);Freeman等(1984,PlantCellPhysiol.29:1353),Howell等(1980,Science208:1265),Horsch等(1985,Science227:1229-1231),DeBlock等(1989,PlantPhysiology91:694-701),MethodsforPlantMolecularBiology(WeissbachandWeissbach,eds.,AcademicPressInc.,1988),MethodsinPlantMolecularBiology(Schuler和Zielinski,eds.,AcademicPressInc.,1989),WO92/09696,WO94/00583,EP331083,EP175966,Liu和Lomonossoff(2002,JVirolMeth,105:343-348),EP290395;WO8706614;美国专利号4,945,050;5,036,006;和5,100,792,1995年5月10日提交的美国专利申请系列号08/438,666,以及1992年9月25日提交的07/951,715(所有均通过引用并入本文)。可以使用瞬时表达法来表达本发明的构建体(参见,D'Aoustetal.,2009,Methodsinmolecularbiology,Vol483,pages41-50;LiuandLomonossoff,2002,JournalofVirologicalMethods,105343-348;通过引用并入本文)。可选地,可以使用基于真空的瞬时表达法,如KaP1laetal.,(1997,PlantSci.122,101-108;其通过引用并入本文)或WO00/063400、WO00/037663(其均通过引用并入本文)中所描述的。这些方法可以包括,例如但不限于农杆菌接种或农杆菌浸润、注射器浸润,但是还可使用如上所述的其它瞬时方法。对于农杆菌接种、农杆菌浸润、注射器浸润,包含期望核酸的农杆菌混合物进入组织的细胞间隙,例如叶、植物的地上部分(包括茎、叶和花)、植物的其它部分(茎、根、花)或整个植株。穿过表皮后,农杆菌侵染并将t-DNA拷贝传递进细胞。t-DNA被游离转录并且mRNA被翻译,使得所侵染细胞产生目的蛋白,但t-DNA在细胞核内的传代是瞬时的。本发明还考虑的部分是含有本发明的基因构建体的转基因植物、植物细胞或种子,其可以用作适合于本文所述的瞬时蛋白表达的平台植物。从植物细胞再生整株植物的方法也是本领域内已知的(例如,参见GuerineauandMullineaux(1993,Planttransformationandexpressionvectors,PlantMolecularBiologyLabfax(CroyRRDed)Oxford,BIOSScientificPublisher,pp121-148)。通常,将转化的植物细胞在适合的培养基中培养,如果选择性标志物用于促进转化的植物细胞的鉴定,培养基可以含有诸如抗生素的选择试剂。一旦形成愈伤组织,可以根据已知的方法通过采用适合的植物激素来促使嫩芽形成,并将嫩芽转移至生根培养基以再生植物。然后从种子或利用营养繁殖技术,植物可以用于建立重复的世代。在不使用组织培养的情况下也能够生成转基因植物。稳定转化并再生这些生物体的方法在本领域内已建立并且是本领域技术人员所熟知的。可用的技术在Vasil等(CellCultureandSomaticCellGeneticsofPlants,VolI,IIandIII,LaboratoryProceduresandTheirApplications,AcademicPress,1984)以及Weissbach和Weissbach(MethodsforPlantMolecularBiology,AcademicPress,1989)中概述。获得转化和再生植物的方法不是本发明的关键。如果植物、植物部分或植物细胞被两种或更多种核酸构建体转化或共转化,则核酸构建体可以在合并核酸的一次转染事件中被引入农杆菌,并如所述那样转染细菌细胞。可选地,构建体可以被连续引入。在这种情况下,如所述的那样将第一构建体引入农杆菌,细胞在只有单转化的细菌能够生长的选择性条件下(例如,在存在抗生素的情况下)生长。在该第一选择步骤之后,如所述的那样将第二核酸构建体引入农杆菌,并且细胞在只有双转化的细菌能够生长的双选择性条件下生长。然后可将双转化的细菌用于转化本文所述的植物、植物部分或植物细胞,或者可以进行另一个转化步骤以容纳第三核酸构建体。可选地,如果植物、植物部分或植物细胞被两种或更多种核酸构建体转化或共转化,则可以通过共浸润农杆菌细胞与植物、植物部分或植物细胞的混合物而将核酸构建体引入植物,各农杆菌细胞均可以含有待被引入植物内的一种或多种构建体。为了改变构建体内的目的核苷酸序列在植物、植物部分或植物细胞内的相对表达水平,在浸润步骤中,可以改变包含期望构建体的不同农杆菌群的浓度。目的蛋白可以包含天然或非天然的信号肽;非天然的信号肽可以是植物来源的。例如,信号肽可以是蛋白质二硫键异构酶信号肽(PDI)。天然的信号肽可以对应于待表达的目的蛋白的信号肽。目的核苷酸序列或目的编码区还可以包括编码药学活性蛋白(例如生长因子、生长调节剂、抗体、抗原及其片段或用于免疫或接种等的衍生物)的核苷酸序列。此类蛋白包括但不限于人病原体蛋白,病毒蛋白,例如但不限于来自呼吸道合胞体病毒(RSV)、轮状病毒、流感病毒、人类免疫缺陷病毒(HIV)、狂犬病病毒、人乳头瘤病毒(HPV)、肠病毒71(EV71)的一种或多种蛋白;或白介素,例如IL-1至IL-24、IL-26和IL-27的一种或一种以上;细胞因子、红细胞生成素(EPO)、胰岛素、G-CSF、GM-CSF、hPG-CSF、M-CSF或以上的组合;干扰素,例如干扰素-α、干扰素-β、干扰素-γ;凝血因子,例如因子VIII、因子IX或tPAhGH;受体、受体激动剂、抗体例如但不限于利妥昔单抗、神经多肽、胰岛素、疫苗、生长因子例如但不限于表皮生长因子、角化细胞生长因子、转化生长因子、抗原、自身抗原、其片段、或以上的组合。目的蛋白还可以包括流感血凝素(HA;参见WO2009/009876,其通过引用并入本文)。HA是同源三聚体I型膜糖蛋白,通常包含信号肽、HA1结构域和位于C-末端的包含跨膜锚定位点的HA2结构域以及小的胞质尾。编码HA的核苷酸序列是公知的,并且是可获得的(参见,例如,URL:biohealthbase.org/GSearch/home.do?decorator=流感的生物防御和公共卫生数据库(BioDefenseandPublicHealthDatabase)(流感研究数据库(流感ResearchDatabase);Squiresetal.,2008NucleicAcidsResearch36:D497-D503);或由美国国家生物技术信息中心维护的数据库(参见URL:ncbi.nlm.nih.gov),二者均通过引用并入本文)。HA蛋白可以为A型流感、B型流感,或者是选自H1、H2、H3、H4、H5、H6、H7、H8、H9、H10、H11、H12、H13、H14、H15和H16的A型流感HA的亚型。在本发明的一些方面,HA可以来自选自组H1、H2、H3、H5、H6、H7和H9的A型流感。上文列出的HA的片段也可以为目的蛋白。此外,可以组合来自上文列出的HA型或亚型的结构域以产生嵌合HA(参见例如WO2009/076778,其通过引用并入本文)。包含HA蛋白的亚型的实例,包括A/新喀里多尼亚/20/99(H1N1)、A/印度尼西亚/5/2006(H5N1)、A/鸡/纽约/1995、A/银鸥/DE/677/88(H2N8)、A/德克萨斯/32/2003、A/野鸭/MN/33/00、A/鸭/上海/1/2000、A/针尾鸭/TX/828189/02、A/火鸡/安大略/6118/68(H8N4)、A/琵嘴鸭/伊朗/G54/03、A/鸡/德国/N/1949(H10N7)、A/鸭/英格兰/56(H11N6)、A/鸭/亚伯达/60/76(H12N5)、A/鸥/马里兰/704/77(H13N6)、A/野鸭/Gurjev/263/82、A/鸭/澳大利亚/341/83(H15N8)、A/红嘴鸥/瑞典/5/99(H16N3)、B/Lee/40、C/约翰尼斯堡/66、A/波多黎各/8/34(H1N1)、A/布里斯班/59/2007(H1N1)、A/所罗门群岛3/2006(H1N1)、A/布里斯班10/2007(H3N2)、A/威斯康星/67/2005(H3N2)、B/马来西亚/2506/2004、B/佛罗里达/4/2006、A/新加坡/1/57(H2N2)、A/安徽/1/2005(H5N1)、A/越南/1194/2004(H5N1)、A/水鸭/香港/W312/97(H6N1)、A/马/布拉格/56(H7N7)、A/香港/1073/99(H9N2))。HA蛋白可以为H1、H2、H3、H5、H6、H7或H9亚型。例如,H1蛋白可以来自A/新喀里多尼亚/20/99(H1N1)、A/波多黎各/8/34(H1N1)、A/布里斯班/59/2007(H1N1)、A/所罗门群岛3/2006(H1N1)、A/加利福尼亚/04/2009(H1N1)或A/加利福尼亚/07/2009(H1N1)毒株。H3蛋白也可以来自A/布里斯班10/2007(H3N2)、A/威斯康星/67/2005(H3N2)、A/维多利亚/361/2011(H3N2)、A/德克萨斯/50/2012(H3N2),A/夏威夷/22/2012(H3N2)、A/纽约/39/2012(H3N2)或A/佩斯/16/2009(H3N2)毒株。在本发明的另一方面,H2蛋白可以来自A/新加坡/1/57(H2N2)毒株。H5蛋白可以来自A/安徽/1/2005(H5N1)、A/越南/1194/2004(H5N1)或A/印度尼西亚/5/2005毒株。在本发明的一方面,H6蛋白可以来自A/水鸭/香港/W312/97(H6N1)毒株。H7蛋白可以来自A/马/布拉格/56(H7N7)毒株或H7A/杭州/1/2013、A/安徽/1/2013(H7N9)或A/上海/2/2013(H7N9)毒株。在本发明的一方面,H9蛋白来自A/香港/1073/99(H9N2)毒株。在本发明的另一方面,HA蛋白可以来自B型病毒的流感病毒,包括B/马来西亚/2506/2004、B/佛罗里达/4/2006、B/布里斯班/60/08、B/马萨诸塞/2/2012样病毒(山形谱系)、或B/威斯康星/1/2010(山形谱系)。H1、H2、H3、H5、H6、H7、H9或B亚型的HA蛋白的的氨基酸序列的非限制性实例包括WO2009/009876、WO2009/076778、WO2010/003225(其通过引用并入本文)中所描述的序列。流感病毒HA蛋白可以是H5印度尼西亚。HA可以包含天然或非天然的信号肽;非天然的信号肽可以是植物来源的。例如,信号肽可以是蛋白质二硫键异构酶信号肽(PDI)。天然的信号肽可以对应于待表达血凝素的信号肽,或者可以对应于第二血凝素。本发明还提供了包含编码HA蛋白的序列的核酸分子。核酸分子还包含与编码HA蛋白的序列可操作地连接的一个或多个调控区。核酸分子可以包含编码H1、H2、H3、H4、H5、H6、H7、H8、H9、H10、H11、H12、H13、H14、H15、H16或来自B型流感的HA的序列。例如,核酸分子所编码的HA蛋白可以是H1、H2、H3、H5、H6、H7、H9亚型或来自B型的HA。核酸所编码的H1蛋白可以来自A/新喀里多尼亚/20/99(H1N1)、A/波多黎各/8/34(H1N1)、A/布里斯班/59/2007(H1N1)、A/所罗门群岛3/2006(H1N1)、A/加利福尼亚/04/2009(H1N1)或A/加利福尼亚/07/2009(H1N1)毒株。核酸分子所编码的H3蛋白可以来自:A/布里斯班10/2007(H3N2)、A/威斯康星/67/2005(H3N2)、A/维多利亚/361/2011(H3N2)、A/德克萨斯/50/2012(H3N2)、A/夏威夷/22/2012(H3N2)、A/纽约/39/2012(H3N2)或A/佩斯/16/2009(H3N2)毒株。核酸分子所编码的H2蛋白可以来自A/新加坡/1/57(H2N2)毒株。核酸分子所编码的H5蛋白可以来自A/安徽/1/2005(H5N1)、A/越南/1194/2004(H5N1)或A/印度尼西亚/5/2005毒株。核酸分子所编码的H6蛋白可以来自A/水鸭/香港/W312/97(H6N1)毒株。核酸分子所编码的H7蛋白可以来自A/马/布拉格/56(H7N7)毒株、或H7A/杭州/1/2013,A/安徽/1/2013(H7N9)、或A/上海/2/2013(H7N9)毒株。此外,核酸分子所编码的H9蛋白可以来自A/香港/1073/99(H9N2)毒株。核酸分子所编码的HA蛋白可以来自流感病毒B型病毒,包括B/马来西亚/2506/2004、B/佛罗里达/4/2006、B/布里斯班/60/08、B/马萨诸塞/2/2012样病毒(山形谱系)、或B/威斯康星/1/2010(山形谱系)。来自H1、H2、H3、H5、H6、H7、H9或B亚型的HA蛋白的氨基酸序列的非限制性实例包括WO2009/009876、WO2009/076778、WO2010/003225(其通过引用并入本文)中所描述的序列。流感病毒HA蛋白可以是H5印度尼西亚。植物材料形式的植物物质或组织可以经口递送至个体。植物物质可以作为饮食补充剂的一部分,与其它食物一起施用,或者被封装。植物物质或组织还可以被浓缩以改善或增加适口性,或者按需要与其它材料、组分或药物赋形剂一起提供。考虑可以根据需要和情况以多种方式将包含目的蛋白的植物施用于个体,例如动物或人。例如,获自植物的目的蛋白可以在其使用之前被提取为粗制形式、部分纯化形式或纯化形式。如果蛋白将被纯化,那么其可以在可食用的或不可食用的植物中产生。此外,如果蛋白经口施用,可以收获植物组织并直接供给个体,或者可以在供给之前将收获的组织干燥,或者可以在没有进行前期收获的情况下允许动物吃植物。还认为将收获的植物组织提供为动物饲料内的食物补充剂在本发明的范围内。如果将植物在少许加工或没有进一步加工的情况下供给动物,优选待施用的植物组织是可食用的。表1:序列表实施例实施例1:A-2X35S/CPMV-HT/PDISP/H1加利福尼亚/NOS(构建体编号484)利用以下基于PCR的方法,将编码来自流感A/加利福尼亚/7/2009的H1的序列(其中天然信号肽被苜蓿蛋白质二硫键异构酶的信号肽取代)(PDISP/H1加利福尼亚)克隆入2X35S-CPMV-HT-NOS表达盒。利用PDISP/H1加利福尼亚序列(图13,SEQIDNO:3)作为模板,利用引物IF-PDI.S1+3c(图12A,SEQIDNO:1)和IF-H1cTMCT.S1-4r(图12B,SEQIDNO:2)来扩增含有PDISP/H1加利福尼亚编码序列的片段。利用In-Fusion克隆系统(Clontech,MountainView,CA),将PCP产物克隆入2X35S/CPMV-HT/NOS表达系统。构建体编号1191(图14)用SacII和Stul限制性酶酶切,并将线性化的质粒用于In-Fusion组装反应。构建体编号1191是用于将目的基因“InFusion”克隆入基于CPMV-HT的表达盒中的受体质粒。还整合了用于在苜蓿质体蓝素基因启动子和终止子控制下共表达TBSVP19沉默阻抑基因的基因构建体。骨架为pCAMBIA双元质粒,从左t-DNA边界至右t-DNA边界的序列在图15(SEQIDNO:4)中示出。得到的构建体给予编号484(图16,SEQIDNO:5)。来自流感A/加利福尼亚/7/2009的成熟H1与PDISP融合后的氨基酸序列在图17(SEQIDNO:6)中示出。质粒484代表图在图18中示出。实施例2:农杆菌转染利用D'Aoust等(PlantBiotechnologyJournal6:930-940,2008)所描述的方法,用DNA构建体通过电穿孔转染农杆菌菌株AGL1。转染的农杆菌在补充有10mM2-(N-吗啉代)乙磺酸(MES)、20μΜ乙酰丁香酮、50μg/ml卡那霉素和25μg/ml羧苄青霉素(pH5.6)的YEB培养基中培养至OD600为0.6至1.6。将农杆菌悬液在使用之前离心,并重悬在浸润培养基(10mMMgC12和10mMMESpH5.6)中。植物生物质、接种物和农杆菌浸润物的制备在装满商业泥炭土基质的平底容器中,从种子生长出本氏烟植物。使植物在温室中16/8的光周期和28℃白昼/24℃黑夜的温度方案下生长。播种之后三周,挑选出单个小植株,移植到盆中,并使其在温室中相同的环境条件下再生长三周。用各构建体转染的农杆菌在补充有10mM2-(N-吗啉代)乙磺酸(MES)、20μΜ乙酰丁香酮、50μg/ml卡那霉素和25μg/ml羧苄青霉素(pH5.6)的YEB培养基中生长,直到它们的OD600达到0.6至1.6。将农杆菌悬液在使用之前离心,重悬在浸润培养基(10mMMgC12和10mMMESpH5.6)中,并于4℃下过夜保存。在浸润的当天,以2.5倍的培养体积稀释各培养批次,并在使用前使其变暖。于20-40托的真空下,将本氏烟的整株植物倒置在气密性不锈钢槽的细菌悬液中2-min。将浸润的植物在收获之前放在PGR15CMP5090Conviron室(Conviron,WinnipegMB,Canada)中培育6-7天的时间。实施例3:分析程序基于图7中提供的方案,从初生P1、P2、P3叶和叶柄以及次生S1、S2、S3叶和叶柄提取叶蛋白。将收获的叶称重以确定基于鲜叶组织的生物质产量。利用OmnibeadRuptor24匀浆器和2.8-mm锆珠(OMNIInternational,KennesawGA,U.S.A.)破坏叶组织,在含有500mMNaCl、1mMPMSF和0.04%(w/v)焦亚硫酸钠的50mMTris-HCl,pH8.0(提取缓冲液)中提取叶蛋白。将收获的叶组织于-80℃冷冻并于液氮中研磨,稀释于提取缓冲液(1.5g鲜叶粉于3mL提取缓冲液中,含有10颗锆珠),并根据供应商的说明书在OmnibeadRuptor匀浆器中匀浆。将1mL混合物转移至1.5-mL微管中,于4℃下以20,000g离心10min,并将回收的上清液用于进一步的分析。以牛血清白蛋白作为蛋白标准品,根据Bradford(BradfordMM(1976)AnalyticalBiochemistry72,248-254)来确定上清液中的蛋白含量。在血凝分析之前,将样品在冰上或于-80℃冷冻保存。基于Nayak和Reichl(2004)所描述的方法进行血凝分析。简而言之,在含有100μLPBS的V-底96-孔微量滴定板中进行试样(100μL)的连续二倍稀释,在每孔中留下100μL稀释的样品。向各孔添加100μL0.25%火鸡红细胞悬液(BioLinkInc.,Syracuse,NY;对于所有B毒株,H1,H5和H7)或0.5%豚鼠红细胞悬液(对于H3),并将板于室温下孵育2小时。显示出完全血凝的最高稀释液的倒数被记录为HA活性。基于图7中提供的方案,从初生P1、P2、P3叶和叶柄以及次生S1、S2、S3叶和叶柄提取叶RNA。利用ABIPRISM7500快速实时PCR装置,系统2.0.1版(AppliedBiosystems),通过实时RTPCR分析HA编码序列的mRNA转录本。如Robert等(PLoSOne,8:e70203)早期所描述的,根据供应商的说明书利用QiagenRNeasy植物微型试剂盒(Qiagen)来提取总RNA。RNA样品用DNaseI(RocheDiagnostics)处理以去除污染的DNA,并利用ND-1000分光光度计(NanoDropTechnologies,WilmingtonDE,USA)来评估质量和数量。利用4单位Omniscript逆转录酶(Qiagen)和1μΜ寡-dT(15)核苷酸(Roche),从500ng总RNA合成第一链cDNA。PCR混合物含有10μLFastSYBRGreenPCRMasterMix(AppliedBiosystems)、2μLcDNA模板和适合的正向引物和反向引物各2.5μL(终浓度为625nM)。在各96-孔板中包括无模板混合物对照。扩增循环由以下组成:95℃下20s的变性步骤,随后为95℃3s和60℃30s的两步40个循环。在扩增之后,用SYBRGreenMasterMix进行解离曲线分析,然后将各样品的循环阈值与设计用于各引物对的DNA标准曲线相比较。根据NEBTaq聚合酶常规方案(NewEnglandBiolabs),用2μLcDNA模板生成标准曲线。使用IllustraGFX试剂盒(GEHealthcare)纯化扩增产物,并使用于无核酸酶的水中的纯化PCR产物的连续稀释物(107至102拷贝/μL)设计DNA标准曲线。将Ct数据针对对应的转录本拷贝数作图。所有扩增一式两份进行。实施例4:光照分析利用标准生长室条件(如上文的实施例2所限定的)作为基线比较对象,将不同的光照方案用于农杆菌浸润之前的生物质产生。如上文的实施例2所描述的,将三周龄幼苗移植到盆中,并使其在温室(图1至图4)或ConvironPGW363224生长室(图5和图6)中三周以产生生物质。然后,用构建体484(用于表达来自流感A/加利福尼亚/7/2009的H1(HA;实施例1))转化的农杆菌菌株对植物进行农杆菌浸润,使其表达目的蛋白(HA)6-7天,并如实施例2和3中所描述的,评估生物质和HA产生。温室和生长室试验中的光处理涉及不同的照明设备,包括1,000W高压钠(HPS)灯(Philips)、1,000W金属卤化物(MH)灯(Sylvania)和GreenPowerLED灯(Phillips)。对于温室试验,使用以下光照方案:(1)16h白昼/8h黑夜光周期,80μmo1/m2.s的光强度;(2)16h白昼/8h黑夜光周期,160μmo1/m2.s的光强度;(3)24h白昼光周期,80μmo1/m2.s的光强度;(4)24h白昼光周期,160μmo1/m2.s的光强度。对于生长室试验,使用以下照明方案:(1)24h白昼光周期,175μmo1/m2.s的光强度(低光强度对照);(2)24h白昼光周期,350μmo1/m2.s的光强度(高光强度试验)。试验结果显于图1至图6中。关于温室试验(图1至图4),随着光强度增加(80至160μmo1/m2.s),对于暴露于16hr或24hr光周期的植物,观察到总叶生物质相应增加(图1)。此外,次生叶生物质与初生叶生物质的比例随着光周期的增加和光强度的增加而增加(按以下次生叶生物质与初生叶生物质比(S/P)):对于16h80处理,S/P比为0.27:1;对于16h160处理,S/P比为0.39:1;对于24h80处理,S/P比为0.44:1,以及对于24h160处理,S/P比为0.53:1。这证实由这两种光处理(增加的光强度和增加的光周期)导致次生叶生物质的量增加。次生叶生物质中目的蛋白(HA)的产量也由于光强度和光周期处理而增加(图2,图3和图4)。此外,获自次生叶生物质与初生叶生物质的HA蛋白产量之比(HAS/P比)按以下增加:对于16h80处理,HAS/P比为0.33:1;对于16h160处理,HAS/P比为0.35:1;对于24h80处理,HAS/P比为0.62:1;以及对于24h160处理,HAS/P比为0.89:1。这证实由这两种光处理(增加的光强度和增加的光周期)导致次生叶生物质中目的蛋白产量的增加。来自总叶生物质(初生和次生)的目的蛋白的产量随着增加的光强度和增加的光周期而增加(图3和图4)。用生长室试验获得了相似的结果(图5和图6,以及表2)。如图5所示,随着光强度的增加,总叶生物质相应增加。与获自初生叶生物质的HA产量相比时,还观察到获自次生叶生物质的HA产量增加(图6)。这与最老的次生叶(S3)中用于HA生物合成的mRNA转录本的数目比最老的初生叶(P3)中的对应数目更高相关(表2)。这些数据共同证实,通过在浸润和收获之前增加次生叶生物质的生长,获得了次生叶生物质的增加,以及生物合成率和目的蛋白产量的增加。应当理解,目的蛋白可以获自次生叶生物质、初生叶生物质、或次生叶生物质和初生叶生物质两者。表2:生长室-培育的植物的主茎的新叶(P1)、成熟叶(P2)和老叶(P3),以及次生茎的新叶(S1)、成熟叶(S2)和老叶(S3)中的HA的mRNA转录本。产生单元HA转录本(100万拷贝/mg叶f.w.)P14.57±1.68aS13.95±1.43aP23.20±0.84aS23.39±1.35aS31.96±0.77aP30.47±0.22a实施例5:幼苗移植后的物理挤压处理在幼苗移植后5天、7天或12天(分别对应于浸润之前16天、14天或9天),通过去除顶(主茎)芽40(参见图7上的‘A’)来增强收获的总生物质中次生枝的相对重要性。将三周龄幼苗移植到盆中,使其在温室中产生生物质持续一周,并去除顶端以产生修剪的植物。使修剪的植物在温室中再放置16天、14天或9天。然后,如实施例2所描述的,用构建体484(用于表达来自流感A/加利福尼亚/7/2009的H1(HA;实施例1))转化的农杆菌菌株对修剪的植物进行农杆菌浸润,并将其放置在PGR15CMP5090Conviron室(在实施例2所限定的条件下)中6-7天。在该时段之后,如实施例3所描述的,对修剪的植物的生物质进行评估。在该时段之后,如实施例3所描述的,对修剪的植物的生物质和HA产生进行评估。以下条件用于试验:24h白昼/0h黑夜光周期,由HPS(Philips)和MH(Sylvania)灯提供的160μmo1/m2.s的光强度,28℃白昼/24℃黑夜的温度方案,以及33株植物/m2的植物林冠密度。植物转化之前修剪顶芽对植物生物质的结果示于表3和图8中。修剪没有改变总的叶生物质(即初生和次生叶生物质组合),除了移植后5天的早期挤压显著影响了植物生长(图8)。由于修剪,叶生物质的比例随着次生叶生物质发生转移(参见图8,对于HA培育之后收获的生物质)。例如,浸润之前所测定的次生叶生物质从对照植物(未修剪的)的10.4g增加至修剪的植物的23.0g,而初生叶生物质从26.3g(对照)下降至14.5g(修剪的植物),次生叶生物质与初生叶生物质之比从0.4:1增加至1.6:1。这些数据共同证实,幼苗移植后的机械挤压是浸润之前,在整株植物规模上增加次生叶生物质以提高目的蛋白产生的相对重要性的一种方式。应当理解,目的蛋白可以获自次生叶生物质、初生叶生物质、或次生叶生物质和初生叶生物质两者。表3:幼苗移植后7天修剪对初生叶生物质、次生叶生物质和总叶生物质(g鲜重)的影响。平均总叶生物质平均初生叶生物质平均次生叶生物质对照植物36.7±4.026.3±2.510.4±1.9修剪的植物37.5±6.014.5±4.623.0±3.4实施例6:幼苗移植后用合成的激素苄氨基嘌呤(BAP)的化学处理在幼苗移植后7或12天,即用于HA表达的浸润之前14或9天,通过用合成的植物激素苄氨基嘌呤(BAP)处理植物来增强收获的总生物质中次生枝的相对重要性。将三周龄幼苗移植到盆中,使其在温室中产生生物质7天或12天,并在7天和/或12天之后,用于水中的100ppm、500ppm或1,000ppm的工作剂量的合成激素进行处理。使经处理的植物再留置在温室中14天或9天,然后,如实施例2所描述的,用构建体484(用于表达来自流感A/加利福尼亚/7/2009的H1(HA;实施例1))转化的农杆菌菌株对其进行农杆菌浸润,并将其放置在PGR15CMP5090Conviron室(在实施例2所限定的条件下)中6-7天。在该时段之后,如实施例3所描述的,对经处理的植物的生物质和HA产生进行评估。以下条件用于试验:24h白昼/0h黑夜光周期,由HPS(Philips)和MH(Sylvania)灯提供的160μmo1/m2.s的光强度,28℃白昼/24℃黑夜的温度方案,以及33株植物/m2的植物林冠密度。植物转化之前用BAP处理植物对植物生物质和HA产量的结果示于图9、图10和图11中。BAP处理对初生生物质具有很小的影响,但是对次生生物质具有显著的积极效应,除了1,000ppm的处理没有显示积极影响(图9)。例如,相比对照(未处理的)植物的ca.16g,从移植后7天用500ppm处理的植物收获ca.22g次生叶生物质,相比初生生物质增加少于10%,为约37.5%的相对增加。BAP处理的植物中次生生物质的增加比例与总的统一增加的HA产生/g鲜重(图10)和随之增加的HA总产量/植物(图11)相关。例如,相比7天和12天后用500ppmBAP处理的植物中的高于300,000单位/g鲜重,对照(未处理的)植物中的HA产量/g鲜重低于200,000单位(图10),每株植物的总产量增加了45-50%。这些数据共同证实,幼苗移植后用合成的细胞分裂素BAP处理的效力,浸润之前在整株植物规模上增加次生叶生物质的相对重要性,并且提高浸润后目的蛋白的产生。应当理解,目的蛋白可以获自次生叶生物质、初生叶生物质、或者次生叶生物质和初生叶生物质两者。所有引用文献通过引用并入本文。已针对一个或多个实施方案对本发明进行了描述。然而,对本领域技术人员来说显而易见的是,可在不偏离权利要求所限定的本发明范围的情况下进行大量的变化和改变。序列表<110>多米尼克·米考德;斯蒂夫·珀皮恩;吉尔伯特·艾西尔;玛丽-克莱尔·古利特;琳达·高德瑞奥;玛耶勒·加涅;米歇尔·马特尔;尼克尔·贝克托尔德;马克-安德烈·道斯特;安德烈·戈瑟兰<120>改进植物中的蛋白产生<130>16C82879CN<150>US62/023,718<151>2014-07-11<160>6<170>PatentInversion3.5<210>1<211>48<212>DNA<213>人工序列<220><223>引物IF-PDI.S1+3c<400>1aaatttgtcgggcccatggcgaaaaacgttgcgattttcggcttattg48<210>2<211>46<212>DNA<213>人工序列<220><223>引物IF-H1cTMCT.S1-4r<400>2actaaagaaaataggcctttaaatacatattctacactgtagagac46<210>3<211>1722<212>DNA<213>人工序列<220><223>PDISP/H1加利福尼亚<400>3atggcgaaaaacgttgcgattttcggcttattgttttctcttcttgtgttggttccttct60cagatcttcgctgacacattatgtataggttatcatgcgaacaattcaacagacactgta120gacacagtactagaaaagaatgtaacagtaacacactctgttaaccttctagaagacaag180cataacgggaaactatgcaaactaagaggggtagccccattgcatttgggtaaatgtaac240attgctggctggatcctgggaaatccagagtgtgaatcactctccacagcaagctcatgg300tcctacattgtggaaacacctagttcagacaatggaacgtgttacccaggagatttcatc360gattatgaggagctaagagagcaattgagctcagtgtcatcatttgaaaggtttgagata420ttccccaagacaagttcatggcccaatcatgactcgaacaaaggtgtaacggcagcatgt480cctcatgctggagcaaaaagcttctacaaaaatttaatatggctagttaaaaaaggaaat540tcatacccaaagctcagcaaatcctacattaatgataaagggaaagaagtcctcgtgcta600tggggcattcaccatccatctactagtgctgaccaacaaagtctctatcagaatgcagat660gcatatgtttttgtggggtcatcaagatacagcaagaagttcaagccggaaatagcaata720agacccaaagtgagggatcaagaagggagaatgaactattactggacactagtagagccg780ggagacaaaataacattcgaagcaactggaaatctagtggtaccgagatatgcattcgca840atggaaagaaatgctggatctggtattatcatttcagatacaccagtccacgattgcaat900acaacttgtcaaacacccaagggtgctataaacaccagcctcccatttcagaatatacat960ccgatcacaattggaaaatgtccaaaatatgtaaaaagcacaaaattgagactggccaca1020ggattgaggaatatcccgtctattcaatctagaggactatttggggccattgccggtttc1080attgaaggggggtggacagggatggtagatggatggtacggttatcaccatcaaaatgag1140caggggtcaggatatgcagccgacctgaagagcacacagaatgccattgacgagattact1200aacaaagtaaattctgttattgaaaagatgaatacacagttcacagcagtaggtaaagag1260ttcaaccacctggaaaaaagaatagagaatttaaataaaaaagttgatgatggtttcctg1320gacatttggacttacaatgccgaactgttggttctattggaaaatgaaagaactttggac1380taccacgattcaaatgtgaagaacttatatgaaaaggtaagaagccagctaaaaaacaat1440gccaaggaaattggaaacggctgctttgaattttaccacaaatgcgataacacgtgcatg1500gaaagtgtcaaaaatgggacttatgactacccaaaatactcagaggaagcaaaattaaac1560agagaagaaatagatggggtaaagctggaatcaacaaggatttaccagattttggcgatc1620tattcaactgtcgccagttcattggtactggtagtctccctgggggcaatcagtttctgg1680atgtgctctaatgggtctctacagtgtagaatatgtatttaa1722<210>4<211>4903<212>DNA<213>人工序列<220><223>构建体11912X35S/CPMV-HT/NOS<400>4tggcaggatatattgtggtgtaaacaaattgacgcttagacaacttaataacacattgcg60gacgtttttaatgtactgaattaacgccgaatcccgggctggtatatttatatgttgtca120aataactcaaaaaccataaaagtttaagttagcaagtgtgtacatttttacttgaacaaa180aatattcacctactactgttataaatcattattaaacattagagtaaagaaatatggatg240ataagaacaagagtagtgatattttgacaacaattttgttgcaacatttgagaaaatttt300gttgttctctcttttcattggtcaaaaacaatagagagagaaaaaggaagagggagaata360aaaacataatgtgagtatgagagagaaagttgtacaaaagttgtaccaaaatagttgtac420aaatatcattgaggaatttgacaaaagctacacaaataagggttaattgctgtaaataaa480taaggatgacgcattagagagatgtaccattagagaatttttggcaagtcattaaaaaga540aagaataaattatttttaaaattaaaagttgagtcatttgattaaacatgtgattattta600atgaattgatgaaagagttggattaaagttgtattagtaattagaatttggtgtcaaatt660taatttgacatttgatcttttcctatatattgccccatagagtcagttaactcattttta720tatttcatagatcaaataagagaaataacggtatattaatccctccaaaaaaaaaaaacg780gtatatttactaaaaaatctaagccacgtaggaggataacaggatccccgtaggaggata840acatccaatccaaccaatcacaacaatcctgatgagataacccactttaagcccacgcat900ctgtggcacatctacattatctaaatcacacattcttccacacatctgagccacacaaaa960accaatccacatctttatcacccattctataaaaaatcacactttgtgagtctacacttt1020gattcccttcaaacacatacaaagagaagagactaattaattaattaatcatcttgagag1080aaaatggaacgagctatacaaggaaacgacgctagggaacaagctaacagtgaacgttgg1140gatggaggatcaggaggtaccacttctcccttcaaacttcctgacgaaagtccgagttgg1200actgagtggcggctacataacgatgagacgaattcgaatcaagataatccccttggtttc1260aaggaaagctggggtttcgggaaagttgtatttaagagatatctcagatacgacaggacg1320gaagcttcactgcacagagtccttggatcttggacgggagattcggttaactatgcagca1380tctcgatttttcggtttcgaccagatcggatgtacctatagtattcggtttcgaggagtt1440agtatcaccgtttctggagggtcgcgaactcttcagcatctctgtgagatggcaattcgg1500tctaagcaagaactgctacagcttgccccaatcgaagtggaaagtaatgtatcaagagga1560tgccctgaaggtactcaaaccttcgaaaaagaaagcgagtaagttaaaatgcttcttcgt1620ctcctatttataatatggtttgttattgttaattttgttcttgtagaagagcttaattaa1680tcgttgttgttatgaaatactatttgtatgagatgaactggtgtaatgtaattcatttac1740ataagtggagtcagaatcagaatgtttcctccataactaactagacatgaagacctgccg1800cgtacaattgtcttatatttgaacaactaaaattgaacatcttttgccacaactttataa1860gtggttaatatagctcaaatatatggtcaagttcaatagattaataatggaaatatcagt1920tatcgaaattcattaacaatcaacttaacgttattaactactaattttatatcatcccct1980ttgataaatgatagtacaccaattaggaaggagcatgctcgcctaggagattgtcgtttc2040ccgccttcagtttgcaagctgctctagccgtgtagccaatacgcaaaccgcctctccccg2100cgcgttgggaattactagcgcgtgtcgacaagcttgcatgccggtcaacatggtggagca2160cgacacacttgtctactccaaaaatatcaaagatacagtctcagaagaccaaagggcaat2220tgagacttttcaacaaagggtaatatccggaaacctcctcggattccattgcccagctat2280ctgtcactttattgtgaagatagtggaaaaggaaggtggctcctacaaatgccatcattg2340cgataaaggaaaggccatcgttgaagatgcctctgccgacagtggtcccaaagatggacc2400cccacccacgaggagcatcgtggaaaaagaagacgttccaaccacgtcttcaaagcaagt2460ggattgatgtgataacatggtggagcacgacacacttgtctactccaaaaatatcaaaga2520tacagtctcagaagaccaaagggcaattgagacttttcaacaaagggtaatatccggaaa2580cctcctcggattccattgcccagctatctgtcactttattgtgaagatagtggaaaagga2640aggtggctcctacaaatgccatcattgcgataaaggaaaggccatcgttgaagatgcctc2700tgccgacagtggtcccaaagatggacccccacccacgaggagcatcgtggaaaaagaaga2760cgttccaaccacgtcttcaaagcaagtggattgatgtgatatctccactgacgtaaggga2820tgacgcacaatcccactatccttcgcaagacccttcctctatataaggaagttcatttca2880tttggagaggtattaaaatcttaataggttttgataaaagcgaacgtggggaaacccgaa2940ccaaaccttcttctaaactctctctcatctctcttaaagcaaacttctctcttgtctttc3000ttgcgtgagcgatcttcaacgttgtcagatcgtgcttcggcaccagtacaacgttttctt3060tcactgaagcgaaatcaaagatctctttgtggacacgtagtgcggcgccattaaataacg3120tgtacttgtcctattcttgtcggtgtggtcttgggaaaagaaagcttgctggaggctgct3180gttcagccccatacattacttgttacgattctgctgactttcggcgggtgcaatatctct3240acttctgcttgacgaggtattgttgcctgtacttctttcttcttcttcttgctgattggt3300tctataagaaatctagtattttctttgaaacagagttttcccgtggttttcgaacttgga3360gaaagattgttaagcttctgtatattctgcccaaatttgtcgggcccgcggatggcgaaa3420aacgttgcgattttcggcttattgttttctcttcttgtgttggttccttctcagatcttc3480gcctgcaggctcctcagccaaaacgacacccccatctgtctatccactggcccctggatc3540tgctgcccaaactaactccatggtgaccctgggatgcctggtcaagggctatttccctga3600gccagtgacagtgacctggaactctggatccctgtccagcggtgtgcacaccttcccagc3660tgtcctgcagtctgacctctacactctgagcagctcagtgactgtcccctccagcacctg3720gcccagcgagaccgtcacctgcaacgttgcccacccggccagcagcaccaaggtggacaa3780gaaaattgtgcccagggattgtggttgtaagccttgcatatgtacagtcccagaagtatc3840atctgtcttcatcttccccccaaagcccaaggatgtgctcaccattactctgactcctaa3900ggtcacgtgtgttgtggtagacatcagcaaggatgatcccgaggtccagttcagctggtt3960tgtagatgatgtggaggtgcacacagctcagacgcaaccccgggaggagcagttcaacag4020cactttccgctcagtcagtgaacttcccatcatgcaccaggactggctcaatggcaagga4080gcgatcgctcaccatcaccatcaccatcaccatcaccattaaaggcctattttctttagt4140ttgaatttactgttattcggtgtgcatttctatgtttggtgagcggttttctgtgctcag4200agtgtgtttattttatgtaatttaatttctttgtgagctcctgtttagcaggtcgtccct4260tcagcaaggacacaaaaagattttaattttattaaaaaaaaaaaaaaaaaagaccgggaa4320ttcgatatcaagcttatcgacctgcagatcgttcaaacatttggcaataaagtttcttaa4380gattgaatcctgttgccggtcttgcgatgattatcatataatttctgttgaattacgtta4440agcatgtaataattaacatgtaatgcatgacgttatttatgagatgggtttttatgatta4500gagtcccgcaattatacatttaatacgcgatagaaaacaaaatatagcgcgcaaactagg4560ataaattatcgcgcgcggtgtcatctatgttactagatctctagagtctcaagcttggcg4620cgcccacgtgactagtggcactggccgtcgttttacaacgtcgtgactgggaaaaccctg4680gcgttacccaacttaatcgccttgcagcacatccccctttcgccagctggcgtaatagcg4740aagaggcccgcaccgatcgcccttcccaacagttgcgcagcctgaatggcgaatgctaga4800gcagcttgagcttggatcagattgtcgtttcccgccttcagtttaaactatcagtgtttg4860acaggatatattggcgggtaaacctaagagaaaagagcgttta4903<210>5<211>3462<212>DNA<213>人工序列<220><223>盒484,从2X35S启动子至NOS终止子<400>5gtcaacatggtggagcacgacacacttgtctactccaaaaatatcaaagatacagtctca60gaagaccaaagggcaattgagacttttcaacaaagggtaatatccggaaacctcctcgga120ttccattgcccagctatctgtcactttattgtgaagatagtggaaaaggaaggtggctcc180tacaaatgccatcattgcgataaaggaaaggccatcgttgaagatgcctctgccgacagt240ggtcccaaagatggacccccacccacgaggagcatcgtggaaaaagaagacgttccaacc300acgtcttcaaagcaagtggattgatgtgataacatggtggagcacgacacacttgtctac360tccaaaaatatcaaagatacagtctcagaagaccaaagggcaattgagacttttcaacaa420agggtaatatccggaaacctcctcggattccattgcccagctatctgtcactttattgtg480aagatagtggaaaaggaaggtggctcctacaaatgccatcattgcgataaaggaaaggcc540atcgttgaagatgcctctgccgacagtggtcccaaagatggacccccacccacgaggagc600atcgtggaaaaagaagacgttccaaccacgtcttcaaagcaagtggattgatgtgatatc660tccactgacgtaagggatgacgcacaatcccactatccttcgcaagacccttcctctata720taaggaagttcatttcatttggagaggtattaaaatcttaataggttttgataaaagcga780acgtggggaaacccgaaccaaaccttcttctaaactctctctcatctctcttaaagcaaa840cttctctcttgtctttcttgcgtgagcgatcttcaacgttgtcagatcgtgcttcggcac900cagtacaacgttttctttcactgaagcgaaatcaaagatctctttgtggacacgtagtgc960ggcgccattaaataacgtgtacttgtcctattcttgtcggtgtggtcttgggaaaagaaa1020gcttgctggaggctgctgttcagccccatacattacttgttacgattctgctgactttcg1080gcgggtgcaatatctctacttctgcttgacgaggtattgttgcctgtacttctttcttct1140tcttcttgctgattggttctataagaaatctagtattttctttgaaacagagttttcccg1200tggttttcgaacttggagaaagattgttaagcttctgtatattctgcccaaatttgtcgg1260gcccatggcgaaaaacgttgcgattttcggcttattgttttctcttcttgtgttggttcc1320ttctcagatcttcgctgacacattatgtataggttatcatgcgaacaattcaacagacac1380tgtagacacagtactagaaaagaatgtaacagtaacacactctgttaaccttctagaaga1440caagcataacgggaaactatgcaaactaagaggggtagccccattgcatttgggtaaatg1500taacattgctggctggatcctgggaaatccagagtgtgaatcactctccacagcaagctc1560atggtcctacattgtggaaacacctagttcagacaatggaacgtgttacccaggagattt1620catcgattatgaggagctaagagagcaattgagctcagtgtcatcatttgaaaggtttga1680gatattccccaagacaagttcatggcccaatcatgactcgaacaaaggtgtaacggcagc1740atgtcctcatgctggagcaaaaagcttctacaaaaatttaatatggctagttaaaaaagg1800aaattcatacccaaagctcagcaaatcctacattaatgataaagggaaagaagtcctcgt1860gctatggggcattcaccatccatctactagtgctgaccaacaaagtctctatcagaatgc1920agatgcatatgtttttgtggggtcatcaagatacagcaagaagttcaagccggaaatagc1980aataagacccaaagtgagggatcaagaagggagaatgaactattactggacactagtaga2040gccgggagacaaaataacattcgaagcaactggaaatctagtggtaccgagatatgcatt2100cgcaatggaaagaaatgctggatctggtattatcatttcagatacaccagtccacgattg2160caatacaacttgtcaaacacccaagggtgctataaacaccagcctcccatttcagaatat2220acatccgatcacaattggaaaatgtccaaaatatgtaaaaagcacaaaattgagactggc2280cacaggattgaggaatatcccgtctattcaatctagaggactatttggggccattgccgg2340tttcattgaaggggggtggacagggatggtagatggatggtacggttatcaccatcaaaa2400tgagcaggggtcaggatatgcagccgacctgaagagcacacagaatgccattgacgagat2460tactaacaaagtaaattctgttattgaaaagatgaatacacagttcacagcagtaggtaa2520agagttcaaccacctggaaaaaagaatagagaatttaaataaaaaagttgatgatggttt2580cctggacatttggacttacaatgccgaactgttggttctattggaaaatgaaagaacttt2640ggactaccacgattcaaatgtgaagaacttatatgaaaaggtaagaagccagctaaaaaa2700caatgccaaggaaattggaaacggctgctttgaattttaccacaaatgcgataacacgtg2760catggaaagtgtcaaaaatgggacttatgactacccaaaatactcagaggaagcaaaatt2820aaacagagaagaaatagatggggtaaagctggaatcaacaaggatttaccagattttggc2880gatctattcaactgtcgccagttcattggtactggtagtctccctgggggcaatcagttt2940ctggatgtgctctaatgggtctctacagtgtagaatatgtatttaaaggcctattttctt3000tagtttgaatttactgttattcggtgtgcatttctatgtttggtgagcggttttctgtgc3060tcagagtgtgtttattttatgtaatttaatttctttgtgagctcctgtttagcaggtcgt3120cccttcagcaaggacacaaaaagattttaattttattaaaaaaaaaaaaaaaaaagaccg3180ggaattcgatatcaagcttatcgacctgcagatcgttcaaacatttggcaataaagtttc3240ttaagattgaatcctgttgccggtcttgcgatgattatcatataatttctgttgaattac3300gttaagcatgtaataattaacatgtaatgcatgacgttatttatgagatgggtttttatg3360attagagtcccgcaattatacatttaatacgcgatagaaaacaaaatatagcgcgcaaac3420taggataaattatcgcgcgcggtgtcatctatgttactagat3462<210>6<211>573<212>PRT<213>人工序列<220><223>PDISP/H1加利福尼亚的氨基酸序列<400>6MetAlaLysAsnValAlaIlePheGlyLeuLeuPheSerLeuLeuVal151015LeuValProSerGlnIlePheAlaAspThrLeuCysIleGlyTyrHis202530AlaAsnAsnSerThrAspThrValAspThrValLeuGluLysAsnVal354045ThrValThrHisSerValAsnLeuLeuGluAspLysHisAsnGlyLys505560LeuCysLysLeuArgGlyValAlaProLeuHisLeuGlyLysCysAsn65707580IleAlaGlyTrpIleLeuGlyAsnProGluCysGluSerLeuSerThr859095AlaSerSerTrpSerTyrIleValGluThrProSerSerAspAsnGly100105110ThrCysTyrProGlyAspPheIleAspTyrGluGluLeuArgGluGln115120125LeuSerSerValSerSerPheGluArgPheGluIlePheProLysThr130135140SerSerTrpProAsnHisAspSerAsnLysGlyValThrAlaAlaCys145150155160ProHisAlaGlyAlaLysSerPheTyrLysAsnLeuIleTrpLeuVal165170175LysLysGlyAsnSerTyrProLysLeuSerLysSerTyrIleAsnAsp180185190LysGlyLysGluValLeuValLeuTrpGlyIleHisHisProSerThr195200205SerAlaAspGlnGlnSerLeuTyrGlnAsnAlaAspAlaTyrValPhe210215220ValGlySerSerArgTyrSerLysLysPheLysProGluIleAlaIle225230235240ArgProLysValArgAspGlnGluGlyArgMetAsnTyrTyrTrpThr245250255LeuValGluProGlyAspLysIleThrPheGluAlaThrGlyAsnLeu260265270ValValProArgTyrAlaPheAlaMetGluArgAsnAlaGlySerGly275280285IleIleIleSerAspThrProValHisAspCysAsnThrThrCysGln290295300ThrProLysGlyAlaIleAsnThrSerLeuProPheGlnAsnIleHis305310315320ProIleThrIleGlyLysCysProLysTyrValLysSerThrLysLeu325330335ArgLeuAlaThrGlyLeuArgAsnIleProSerIleGlnSerArgGly340345350LeuPheGlyAlaIleAlaGlyPheIleGluGlyGlyTrpThrGlyMet355360365ValAspGlyTrpTyrGlyTyrHisHisGlnAsnGluGlnGlySerGly370375380TyrAlaAlaAspLeuLysSerThrGlnAsnAlaIleAspGluIleThr385390395400AsnLysValAsnSerValIleGluLysMetAsnThrGlnPheThrAla405410415ValGlyLysGluPheAsnHisLeuGluLysArgIleGluAsnLeuAsn420425430LysLysValAspAspGlyPheLeuAspIleTrpThrTyrAsnAlaGlu435440445LeuLeuValLeuLeuGluAsnGluArgThrLeuAspTyrHisAspSer450455460AsnValLysAsnLeuTyrGluLysValArgSerGlnLeuLysAsnAsn465470475480AlaLysGluIleGlyAsnGlyCysPheGluPheTyrHisLysCysAsp485490495AsnThrCysMetGluSerValLysAsnGlyThrTyrAspTyrProLys500505510TyrSerGluGluAlaLysLeuAsnArgGluGluIleAspGlyValLys515520525LeuGluSerThrArgIleTyrGlnIleLeuAlaIleTyrSerThrVal530535540AlaSerSerLeuValLeuValValSerLeuGlyAlaIleSerPheTrp545550555560MetCysSerAsnGlySerLeuGlnCysArgIleCysIle565570当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1