作为有机光伏器件的供体材料的新型碳环和杂环螺环化合物及其制备的制作方法
相关申请的交叉引用
本申请要求2014年8月11日提交的美国临时申请序列号62/035,602的权益,其通过引用以其全文(包括任何图、表或附图)由此并入。
发明背景
本发明涉及碳环和杂环螺环化合物在有机光伏(opv)器件制造中作为供体材料的利用。
在近二十年来opv器件由于其作为电能的可再生替代源的重大技术潜力而已经引起了巨大的兴趣。智能材料和创新器件工程的开发上的重大进展已经将功率转换效率(pce)提高至9.2%(对于单个电池)和提高至10.6%(对于串联器件)。直到现在,具有最高记录的pce的大多数opv器件基于新合成的聚合物或低聚物作为供体材料结合富勒烯受体的使用(z.he,c.zhong,s.su,m.xu,h.wu,y.cao,nat.photonics2012,6,591;j.you,l.dou,k.yoshimura,t.kato,k.ohya,t.moriarty,k.emery,c.chen,j.gao,y.yang,nat.commun.2013,4,1446)。然而,制造非常有效的聚合物opv器件的主要挑战包括制备高质量薄膜以及获得高的批次间重现性的困难。此外,非常难以控制共混的活性层的形态和相分离,该活性层在决定整体器件性能上起着关键作用。另一方面,小分子本质上是单分散的,具有非常确定的化学结构,并且从合成上来说重现性好,纯度高。与聚合物基薄膜相比,通过真空沉积制备基于小分子的高质量且均匀的薄膜还容易地多。
尽管基于小分子的opv器件原则上可具有更高的性能和更久的稳定性,但由于与其聚合物相应物的pce相比它们的pce相对较低,基于小分子的opv器件的开发受到较少关注。kearns和calvin在1958年展示了第一个基于小分子的双层opv器件,其中双层酞菁镁和氧化的四甲基对苯二胺器件获得了200mv的相当高的光电压及3×10–12w的功率输出(d.kearns,m.calvin,j.chem.phys.1958,29,950)。在1986年,tang报道了基于酞菁铜(cupc)作为供体和3,4,9,10-苝四甲酸二苯并咪唑(ptcbi,苝二酰亚胺的类似物)作为受体以形成p-n结的非常有效的双层opv器件。在模拟大气质量(airmass,am)2照度下记录了约1%的pce及0.65的高填充因子(ff)(c.w.tang,appl.phys.lett.1986,48,183)。据信这种成功的展示归因于光活化材料的仔细选择。特别地,有机异质结处的cupc供体与ptcbi受体之间的大的能量补偿提供了对于有效激子离化足够大的驱动力,产生了与单层器件相比的显著的pce提高。
这种突破可追溯到富勒烯的发现,其展示优异的电子传输性能并可用作opv器件中的受体材料(n.s.sariciftci,d.braun,c.zhang,v.i.srdanov,a.j.heeger,g.stucky,f.wudl,appl.phys.lett.,1993,62,585)。从那时起,已经存在利用富勒烯衍生物作为受体材料的高效opv器件的众多报道。富勒烯衍生物是作为opv器件中的受体材料的最有前景的候选物。然而,仍然存在开发良好的空穴传输材料作为供体结合富勒烯以产生有效opv器件的需求。
螺二芴及其衍生物,由于它们高达10–3cm2v–1s–1数量级的高空穴迁移率,是最众所周知的一类的空穴传输材料。两个芴单元之间用sp3-杂化碳原子的螺环连接可导致两半的垂直排列,产生结构刚性。此外,螺二芴的这种三维(3d)特征可提高其溶解度和玻璃化转变温度(tg)(t.p.i.saragi,t.spehr,a.siebert,t.f.lieker,j.salbeck,chem.rev.2007,107,1011)。沿着分子的水平方向的共轭也可提高真空沉积薄膜中的分子间电荷传输性能(c.wu,w.liu,w.hung,t.liu,y.lin,h.lin,k.wong,y.chien,r.chen,t.hung,t.chao,y.chen,appl.phys.lett.2005,87,052103)。受这种结构特征的启发,已将螺二芴及其衍生物广泛地用作有机发光器件(oled)中的空穴传输层。
与探究螺二芴作为空穴传输材料在oled中的用途的大量出版物相比,对它们在制造opv器件中的用途关注较少。实际上,螺二芴在可见光谱内具有非常低的吸收系数并可能有害于光伏过程。最近,已经探究了使用螺二芴作为具有锚定基团的结构单元构造opv器件的感光剂的可能性(d.heredia,j.natera,m.gervaldo,l.otero,f.fungo,c.-y.lin,k.-t.wong,org.lett.2010,12,12;h.-c.ting,c.-h.tsai,j.-h.chen,l.-y.lin,s.-h.chou,k.-t.wong,t.-w.huang,c.-c.wu,org.lett.2012,14,6338;g.pozzi,s.orlandi,m.cavazzini,d.minudri,l.macor,l.otero,f.fungo,org.lett.2013,15,4642;q.yan,y.zhou,y.-q.zheng,j.pei,d.zhao,chem.sci.2013,doi:10.1039/c3sc5184h)。位阻大的螺环核可有效地减少分子间的相互作用并抑制分子之间聚集诱导的自猝灭。同时,已通过将螺二芴核与苯并噻二唑单元结合来合成有效的交替共聚物(m.wang,c.li,a.lv,z.wang,z.bo,macromolecules2012,45,3017)。这种共聚物展示高达7×10–3cm2v–1s–1的高空穴迁移率,并且对于基于该共聚物/富勒烯共混物的器件,已获得高达4.6%的高pce。尽管螺二芴是用于设计有效供体材料的有用的结构单元,但是几乎没有任何关于利用该杂环螺环化合物来制造opv器件的文献报道。
发明简述
本发明提供使用碳环和杂环螺环化合物作为有机光伏(opv)器件的供体材料的组合物和方法。在优选的实施方案中,包含三芳基胺的螺环化合物及其衍生物在opv器件中展示有效的空穴传输性质,实现了高达5.46%的pce。
有利地,本文中提供的优选化合物是热稳定性和挥发性的,足够通过真空沉积或通过旋涂形成用于opv器件的光活化层的薄膜。
在一个方面中,本发明提供下式的opv供体化合物:
(i)
其中a、b、c和d相同或不同并且独立地选自任选取代的芳烃和任选取代的杂芳烃;
其中m1和m2独立地为碳原子;
其中x任选存在,并且如果存在,x为碳原子或杂原子,各自任选被至少一个官能团r取代或任选被氧化,其中所述杂原子选自硼、硫、氧、氮、磷、硅、锗、硒和碲,并且r选自烷基、芳基、杂芳基和烷氧基;并且如果x不存在,那么m1和m2彼此直接键合;和
其中d1、d2、d3和d4相同或不同并且独立地选自烷基、芳基、杂芳基、烷氧基和芳基烷氧基,各自为任选取代的。
优选的实施方案提供a、b、c和d为选自以下的5-或6-元环:苯、吡啶、噻吩、呋喃、稠合噻吩、吡唑、嘧啶、吡咯、硒吩(selenophenes)、碲吩(tellurophenes)、苯并咪唑、苯并呋喃、苯并噻唑、苯并噁唑、苯并磷杂环戊二烯(benzophospholes)、吲哚、茚满、萘、蒽、芘、噻唑、吡喃、噻喃、咔唑、二苯并噻吩、二苯并呋喃、二苯并硅杂环戊二烯(dibenzosiloles)、芴和二苯并磷杂环戊二烯(dibenzophospholes),各自为任选取代的。
在某些实施方案中,x任选不存在,使得当x不存在时,m1和m2彼此直接键合。
在优选的实施方案中,所述螺环化合物包含d1、d2、d3和d4中的一个或更多个,其各自选自任选取代的烷基氨基、芳基胺、噻吩、低聚噻吩、稠合噻吩、芴、二苯并噻吩、二苯并呋喃和二苯并磷杂环戊二烯的官能团。
在另一方面中,本发明提供opv器件,其依次包含阳极、任选的阳极缓冲层、光活化层、任选的激子阻挡层和阴极,所述光活化层包含富勒烯化合物或其衍生物以及本文中提供的碳环或杂环化合物。
在一些实施方案中,所述碳环或杂环化合物在真空中热蒸发或旋涂到所述阳极缓冲层上。在一个具体实施方案中,所述碳环或杂环螺环化合物与所述富勒烯化合物热共蒸发(thermallyco-evaporated)到所述阳极缓冲层上。
有利地,随着pce达到约5.46%,优选的螺环供体化合物在受体基体中的掺杂可有效地改善opv器件的光伏响应。
从现在将继续的发明详述结合表、附图和附带的权利要求书,本发明的目的、特征和优点对于本领域技术人员而言将是明显的。
附图简述
图1显示opv器件的优选结构,其中所述光活化层包含与作为受体材料的富勒烯化合物结合的碳环和杂环螺环化合物。
图2显示298k下化合物1在二氯甲烷中的uv-vis吸收和发射光谱。没有针对发射波长实施仪器校正。
图3显示298k下化合物3在二氯甲烷中的uv-vis吸收和发射光谱。没有针对发射波长实施仪器校正。
图4显示298k下化合物4在二氯甲烷中的uv-vis吸收和发射光谱。没有针对发射波长实施仪器校正。
图5显示298k下化合物5在二氯甲烷中的uv-vis吸收和发射光谱。没有针对发射波长实施仪器校正。
图6显示298k下化合物6在二氯甲烷中的uv-vis吸收和发射光谱。没有针对发射波长实施仪器校正。
图7显示298k下化合物7在二氯甲烷中的uv-vis吸收和发射光谱。没有针对发射波长实施仪器校正。
图8显示化合物3在三电极电池中使用0.1mnbu4npf6作为支持电解质在二甲基甲酰胺中的循环伏安图。
图9显示化合物7在三电极电池中使用0.1mnbu4npf6作为支持电解质在二甲基甲酰胺中的循环伏安图。
图10显示化合物8在三电极电池使用0.1mnbu4npf6作为支持电解质在二甲基甲酰胺中的循环伏安图。
图11显示使用化合物1作为供体以不同浓度掺杂在c70受体中的器件的电流密度–电压(j–v)曲线。
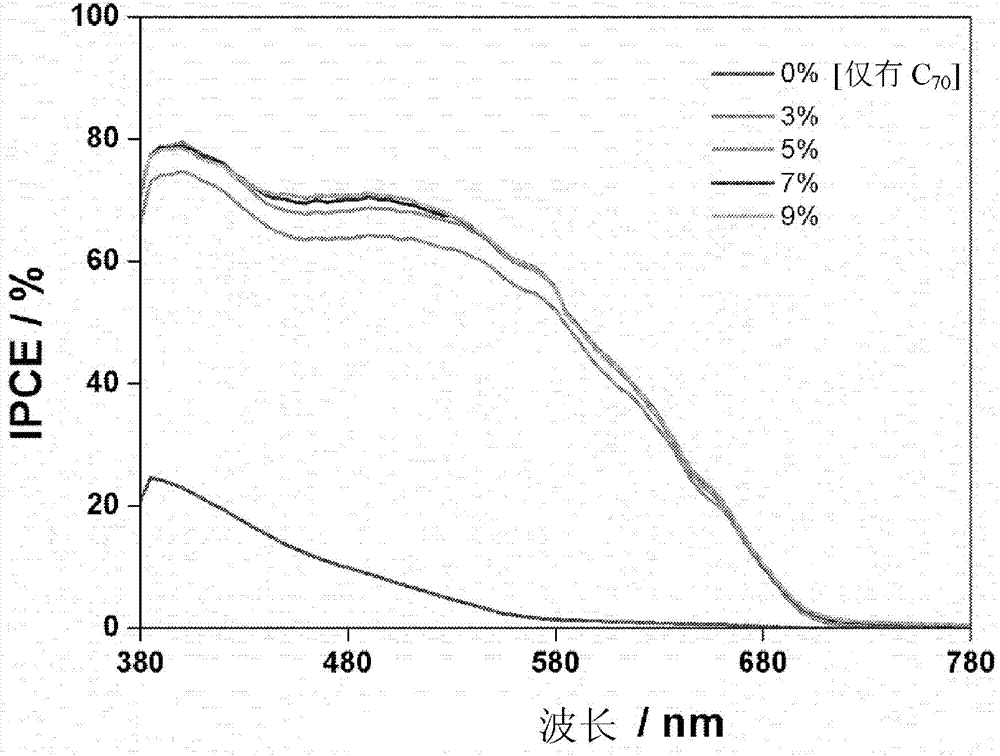
图12显示使用化合物1作为供体以不同浓度掺杂在c70受体中的器件的入射光子电流转换效率(ipce)曲线。
发明详细公开
在以下详述中,提及本发明的附图,描绘的示例性、非限制性和非穷举性的实施方案。足够详细地描述这些实施方案以使得本领域技术人员能够实践本发明,并且应理解可以使用其它实施方案,并可作出其它变化,而不背离本发明的精神或范围。因此,以下详述不以限制性的意义看待,并且本发明的范围仅由附录的权利要求书限定。本文中提及或引用的所有专利、专利申请、临时申请和出版物通过引用以其全文(包括所有图和表)并入,只要它们没有与本说明书的明确教导不一致。
本发明提供使用碳环和杂环螺环化合物作为opv器件的供体材料的组合物和方法。在优选的实施方案中,包含三芳基胺的螺环化合物及其衍生物在opv器件中展示有效的空穴传输性质,实现了高达5.46%的pce。
有利地,本文中提供的优选化合物是热稳定性和挥发性的,足够通过真空沉积或通过旋涂与受体材料形成薄膜。
在一个方面中,本发明提供下式的opv供体化合物:
(i)
其中a、b、c和d相同或不同并且独立地选自任选取代的芳烃和任选取代的杂芳烃;
其中m1和m2独立地为碳原子;
其中x任选存在,并且如果存在,x为碳原子或杂原子,各自任选被至少一个官能团r取代或任选被氧化,其中所述杂原子选自硼、硫、氧、氮、磷、硅、锗、硒和碲,并且r选自烷基、芳基、杂芳基和烷氧基;并且如果x不存在,那么m1和m2彼此直接键合;和
其中d1、d2、d3和d4相同或不同并且独立地选自烷基、芳基、杂芳基、烷氧基和芳基烷氧基,各自为任选取代的。
优选的实施方案提供a、b、c和d为选自以下的5-或6-元环:苯、吡啶、噻吩、呋喃、稠合噻吩、吡唑、嘧啶、吡咯、硒吩、碲吩、苯并咪唑、苯并呋喃、苯并噻唑、苯并噁唑、苯并磷杂环戊二烯、吲哚、茚满、萘、蒽、芘、噻唑、吡喃、噻喃、咔唑、二苯并噻吩、二苯并呋喃、二苯并硅杂环戊二烯、芴和二苯并磷杂环戊二烯,各自为任选取代的。
在一些实施方案中,x包含选自如下的至少一个取代基r:烷基、芳基、杂芳基、烷氧基和芳基烷氧基,其各自为任选取代的。r的非限制性实例包括噻吩、低聚噻吩和稠合噻吩。
在某些实施方案中,x任选不存在,使得当x不存在时,m1和m2彼此直接键合。
在优选的实施方案中,所述螺环化合物包含d1、d2、d3和d4中的一个或更多个,其各自选自任选取代的烷基氨基、芳基胺、噻吩、低聚噻吩、稠合噻吩、芴、二苯并噻吩、二苯并呋喃和二苯并磷杂环戊二烯的官能团。
在一个特别优选的实施方案中,d1、d2、d3和d4中的至少一个是任选取代的三芳基胺基。
在另一方面中,本发明提供opv器件,其依次包含阳极、阳极缓冲层、光活化层、激子阻挡层和阴极,所述光活化层包含富勒烯化合物或其衍生物以及本文中提供的碳环或杂环化合物。
在一些实施方案中,所述碳环或杂环化合物在真空中热蒸发或旋涂到所述阳极缓冲层上。在一个具体实施方案中,所述碳环或杂环螺环化合物与所述富勒烯化合物热共蒸发到所述阳极缓冲层上。
有利地,随着pce达到约5.46%,优选的螺环供体化合物在受体基体中的掺杂可有效地改善opv器件的光伏响应。
术语“任选的”或“任选地”意味着随后描述的事件或情形可能发生或可能不发生,并且该描述包括其中所述事件或情形发生的情况和其中它不发生的情况。例如,“任选取代的烷基”是指“烷基”和“取代的烷基”两者。
如本文中所用的术语“烷基”,单独或者组合,是指完全饱和的直链或支链烃链的官能团。优选的烷基是包含1至18个碳原子的那些,其中非限制性的实例包括甲基、乙基、丙基、异丙基、丁基、异丁基、叔丁基等等。
如本文中所用的术语“烷氧基”,单独或者组合,是指通过氧原子连接到母体结构的直链或支链烷基的官能团。优选的烷氧基是包含1至18个碳原子的那些,其中非限制性的实例包括甲氧基、乙氧基、丙氧基、异丙氧基等等。
如本文中所用的术语“芳基”或“芳”(“aryl”or“ar”)是指具有烃共轭π电子体系的环或环体系的官能团。该术语包括单环或稠环多环(即,共享相邻原子对的环)基团,条件是整个环体系是芳族的。本文中提供的优选的芳基是5-或6-元环,一个非限制性实例为苯基。
如本文中所用的术语“杂芳基”,单独或者组合,是指在环骨架中包含一个或更多个杂原子(即不同于碳的元素,包括但不限于氮、氧和硫)的芳族环或环体系(即,共享两个相邻原子的两个或更多个稠合环)的官能团。所述体系可包含至少一个环,其中所述环可以侧基的方式相连或可稠合。所述杂芳基可具有5-18个环成员(即,组成环骨架的原子(包括碳原子和杂原子)的数目),尽管本定义还涵盖其中没有指定数值范围的术语“杂芳基”的出现。本文中提供的优选杂芳基包含5-或6-元环。杂芳基的实例包括但不限于呋喃基、噻吩基(thienyl)、酞嗪基、吡咯基、噁唑基、噻唑基、咪唑基、吡唑基、异噁唑基、异噻唑基、三唑基、噻二唑基、吡啶基、哒嗪基、嘧啶基、吡嗪基、三嗪基、喹啉基、异喹啉基(isoquinlinyl)、苯并咪唑基、苯并噁唑基、苯并噻唑基、吲哚基、异吲哚基、苯并噻吩基、噻吩基(thiophenyl)、稠合噻吩基、硒吩基、碲吩基、苯并呋喃基、苯并磷杂环戊二烯基、吡喃基、噻喃基、咔唑基、二苯并噻吩基、二苯并呋喃基、二苯并硅杂环戊二烯基和二苯并磷杂环戊二烯基。
如本文中所用的术语“芳基烷氧基”(“arylalkoxy”),单独或者组合,是指通过氧原子连接到母体结构的芳基。优选的芳基烷氧基包含3至7个碳原子,其中非限制性的实例包括苯氧基。
术语“取代的”是指将未取代的母体基团中的一个或更多个氢原子调换成另一原子或基团。除非另外指出,当基团被认为是“取代的”时,这意味着该基团被一个或更多个取代基取代。“取代的”可指任何水平的取代,尽管优选单取代、二取代和三取代。优选的取代基包括卤素、芳基、烷基、杂芳基、烷氧基和芳基烷氧基。
如本文中所用的术语“富勒烯”,单独或者组合,是指可用作opv器件中的受体材料的c60、c70和具有更高数量的碳原子的类似化合物。富勒烯衍生物的示例性实例(embodiment)包括苯基-c61-丁酸甲酯(pc61bm)和苯基-c71-丁酸甲酯(pc71bm)。
以下为示例用于实践本发明的步骤的实施例。这些实施例不应解释为限制性的。除非另外指出,所有百分数均按重量计,并且所有溶剂混合物比例均按体积计。
实施例1
杂环螺环化合物的合成和表征
使用单/二溴-螺环骨架与d侧基的相应硼酸的标准suzuki偶联反应合成化合物1–10。示例性步骤如下。将pd(pph3)4加入4-(n,n-二苯基氨基)苯基硼酸和2,7-二溴螺-芴-9,9'-呫吨在干燥thf和k2co3水溶液(2m)中的混合物中。在氮气下将反应混合物加热至回流过夜。然后用二氯甲烷萃取反应混合物至少三次。有机层用去离子水洗涤数次并经无水mgso4干燥并过滤。在真空下蒸发溶剂。粗产物通过柱层析法在二氧化硅上使用二氯甲烷-己烷作为洗脱剂来纯化。通过用氯仿-己烷重结晶实现进一步纯化。
按照以下方法合成化合物11和12。使2-溴联苯锂化并与9h-芴酮反应,然后用催化量的三氟甲磺酸进行闭环反应。为了通过举例展示该方法,通过正丁基锂在干燥thf中使2-(2-溴苯基)苯并[b]噻吩锂化并让其与9h-芴酮反应。用去离子水使反应混合物骤冷(quenched)。然后用二氯甲烷萃取反应混合物至少三次。有机层用去离子水洗涤数次并经无水mgso4干燥并过滤。在真空下蒸发溶剂。粗产物用己烷洗涤并且不经过进一步纯化使用叔醇中间体。然后将叔醇中间体溶解于二氯甲烷中并加入催化量的三氟甲磺酸。使用tlc分析监测反应直到不能检测到原材料。反应物(reaction)用去离子水洗涤数次并经无水mgso4干燥并过滤。在真空下蒸发溶剂。粗产物通过柱层析法使用己烷作为洗脱剂来纯化。通过使产物从二氯甲烷-甲醇中重结晶实现进一步纯化。
化合物1−12的特征光谱性质如下。
化合物1
产率:68%。1hnmr(400mhz,cdcl3,298k,相对于me4si):δ6.51(d,2h,8.0hz),6.79(t,2h,6.4hz),6.99−7.09(m,16h),7.17−7.25(m,12h),7.36−7.39(m,6h),7.60(d,2h,8.0hz),7.83(d,2h,8.0hz)。c61h42on2的hrms(正ei)计算值:m/z=818.3292;实测值:818.3279[m]+。
化合物2
产率:65%。1hnmr(400mhz,cdcl3,298k,相对于me4si):δ6.60(d,2h,2.0hz),6.96−7.06(m,16h),7.10(d,4h,8.0hz),7.21−7.25(m,12h),7.30(d,2h,8.0hz),7.34−7.41(m,4h),7.79(d,2h,8.0hz)。c61h42on2的hrms(正ei)计算值:m/z=818.3292;实测值:818.3271[m]+。
化合物3
产率:76%。1hnmr(400mhz,cd2cl2,298k,相对于me4si):δ6.35(d,2h,8.0hz),6.47(d,2h,8.0hz),6.57(t,2h,8.0hz),6.91(t,2h,8.0hz),7.00−7.07(m,16h),7.21−7.26(m,8h),7.43−7.49(m,6h),7.58(t,1h,8.0hz),7.64(m,4h),7.68(t,2h,8.0hz),7.86(d,2h,8.5hz)。c67h47n3的ms(正fab)计算值:m/z=894.1;实测值:894.4[m]+。
化合物4
产率:70%。1hnmr(400mhz,cd2cl2,298k,相对于me4si):δ6.63(d,2h,8.0hz),6.89(t,2h,8.0hz),6.99−7.06(m,16h),7.15(t,2h,8.0hz),7.23(t,8h,7.4hz),7.40−7.43(m,6h),7.64(d,2h,8.0hz),7.78(s,2h),7.84(d,2h,8.0hz)。c61h42sn2的hrms(正ei)计算值:m/z=834.3063;实测值:834.3063[m]+。
化合物5
产率:68%。1hnmr(400mhz,cdcl3,298k,相对于me4si):δ6.71(d,2h,8.0hz),6.99−7.08(m,16h),7.23(t,8h,7.5hz),7.28(d,2h,8.0hz),7.37(d,4h,8.0hz),7.46(t,2h,8.0hz),7.60(s,2h),7.67(d,2h,8.0hz),7.87(d,2h,8.0hz),8.24(d,2h,8.0hz)。c61h42o2n2s的ms(正fab)计算值:m/z=867.1;实测值:867.3[m]+。
化合物6
产率:75%。1hnmr(400mhz,cdcl3,298k,相对于me4si):δ6.80(d,2h,8.0hz),7.27−7.30(m,4h),7.37−7.43(m,10h),7.52−7.59(m,6h),7.75−7.79(m,6h),7.84(d,2h,8.0hz),8.02(d,2h,8.0hz),8.13(d,4h,8.0hz),8.32(d,2h,8.0hz)。c61h38o2n2s的ms(正fab)计算值:m/z=863.0;实测值:863.3[m]+。
化合物7
产率:75%。1hnmr(400mhz,cdcl3,298k,相对于me4si):δ1.46(s,36h)6.79(d,2h,8.0hz),7.37−7.43(m,10h),7.52−7.59(m,6h),7.75−7.79(m,6h),7.84(d,2h,8.0hz),8.01(d,2h,8.0hz),8.12(s,4h),8.31(d,2h,8.0hz)。c77h70o2n2s的ms(正fab)计算值:m/z=1087.5;实测值:1086.1[m−1]+。
化合物8
产率:78%。1hnmr(400mhz,cdcl3,298k,相对于me4si):δ6.81(d,2h,8.0hz),6.89(s,2h),6.98−7.06(m,16h),7.11(t,2h,8.0hz),7.19−7.25(m,8h),7.26−7.31(m,4h),7.37(t,2h,8.0hz),7.58(d,2h,8.0hz),7.84(d,2h,8.0hz),7.88(d,2h,8.0hz)。c61h42n2的hrms(正ei)计算值:m/z=802.3343;实测值:802.3356[m]+。
化合物9
产率:78%。1hnmr(400mhz,cdcl3,298k,相对于me4si):δ1.20(s,18h),6.81(s,2h),7.07(s,2h),7.26-7.29(m,4h),7.38−7.45(m,10h),7.53(d,4h,8.3hz),7.68(d,4h,8.3hz),7.76−7.78(m,4h),8.03(d,2h,7.8hz),8.13(d,4h,7.8hz)。
化合物10
产率:73%。1hnmr(400mhz,cd2cl2,298k,相对于me4si):δ6.55(d,1h,7.5hz),6.61(s,1h),6.80(d,2h,7.5hz),6.95−7.08(m,9h),7.13(t,2h,7.6hz),7.22(t,4h,7.5hz),7.30(t,1h,4.3hz),7.37(t,4h,7.5hz),7.52(d,1h,7.6hz),7.84(d,2h,7.6hz)。c41h27ns的hrms(正ei)计算值:m/z=565.1859;实测值:565.1858[m]+。
化合物11
产率:56%。1hnmr(400mhz,丙酮-d6,298k,相对于me4si):δ6.52(d,1h,7.6hz),6.70(d,1h,7.6hz),6.74(d,2h,7.6hz),7.02(t,1h,8.0hz),7.15(t,3h,7.6hz),7.21(t,1h,8.0hz),7.39−7.47(m,3h),7.75(d,1h,8.0hz),7.97(d,1h,7.6hz),8.08(d,2h,7.6hz)。c27h16s的hrms(正ei)计算值:m/z=372.0967;实测值:372.0226[m]+。
化合物12
产率:65%。1hnmr(400mhz,丙酮-d6,298k,相对于me4si):δ1.58(s,6h),6.64(d,1h,7.6hz),6.71(d,2h,7.6hz),7.09−7.25(m,6h),7.40−7.44(m,3h),7.50(d,1h,7.3hz),7.56(d,1h,7.3hz),8.03(t,3h,7.6hz),8.20(s,1h)。c34h24的hrms(正ei)计算值:m/z=432.1873;实测值:432.1861[m]+。
实施例2
螺环化合物的uv-vis吸收性质
所有碳环和杂环螺环化合物在大约350–450nm处显示强的吸收带,其归因于π-π*吸收。图2–7显示298k下化合物1–7在二氯甲烷中的uv-vis吸收和发射光谱并且所有化合物的光物理性质显示于表1中。当杂环螺环核变成碳环螺环核时,与螺环骨架上没有任何杂原子的化合物8的uv-vis吸收和发射光谱相比,化合物1、3、4和5显示红移吸收带。用较不富电子的咔唑部分替代供体部分(即,化合物6和7)导致蓝移的uv吸收光谱(即,化合物5)。具有富电子噻吩环嵌入螺环核的化合物10显示最大的红移吸收带,这与电化学数据良好吻合。
表1:化合物1–12的光物理数据。
实施例3
螺环化合物的电化学性质
为了探查电化学性质,在三电极电池中使用0.1mnbu4npf6作为支持电解质在二甲基甲酰胺中针对化合物1至12进行循环伏安法,除了化合物9在四氢呋喃中进行之外。使用二茂铁盐/二茂铁对(fc+/fc)作为内标。
与不具有杂原子的螺环化合物(化合物8)的氧化电势相比,具有杂原子的螺环化合物(化合物1–7)的氧化电势更正。用较不富电子的咔唑部分(即化合物6和7)取代三苯基胺部分(即化合物1–5和8)将氧化对移动到更正的值。在此一系列化合物中,化合物10的氧化电势负得最少。化合物3(其包含氮原子作为螺环骨架的杂原子)显示两个准可逆氧化对(图8),而在二甲基甲酰胺的溶剂窗口内没有在化合物12中发现氧化波。化合物9和12各自显示单一还原对;而其它化合物显示多个还原对,这归因于螺环核的电子还原。图9和10是化合物7和8在二甲基甲酰胺中的循环伏安图。电化学数据汇总于表2中。
表2:化合物1–12的电化学性质
a在室温下,0.1mnbu4npf6(tbah)作为支持电解质;扫描速率100mvs-1。be1/2=(epa+epc)/2;epa和epc分别是阳极峰电势和阴极峰电势。c不可逆氧化波的阳极峰电势。d不可逆还原波的阴极峰电势。ethf用作溶剂。
实施例4
opv器件的制造和光伏响应
以下面的方式构造根据本发明的优选实施方案的opv器件:
(a)将薄层电阻为15欧姆/方块的透明阳极氧化铟锡(ito)涂布的硼硅酸盐玻璃基底在商业洗涤剂decon90中超声处理,在具有18.2mω的电阻率的去离子水中清洗15分钟,并然后在120℃的烘箱中干燥1小时。然后使基底在装备有汞格栅灯的jelight42-220uvo-cleaner中经历uv-臭氧处理15分钟以便除去任何残余的水;
(b)将基底放入真空室中,并将该室从1巴泵抽降压至5×10–6毫巴;
(c)通过热蒸发使2-nm厚的氧化钼(vi)(moo3)阳极缓冲层沉积到ito涂布的玻璃基底上;
(d)通过热蒸发使60-nm厚的光活化层沉积到moo3层上,其中使化合物1作为供体以不同浓度(即,3、5、7和9重量%)与c70作为受体共蒸发以形成光活化层;
(e)通过热蒸发使8-nm厚的红菲绕啉(bphen)激子阻挡层沉积到光活化层上;和
(f)通过热蒸发使100-nm厚的铝(al)层沉积到bphen层上以形成阴极。
通过施加电流经过钽舟通过热蒸发由钽舟制备所有的有机材料和金属。用石英振荡晶体和sigmasqm-242石英晶体卡(quartzcrystalcard)监测沉积速率。对于有机层和金属层两者将石英振荡控制在0.1–0.2nms–1。使用可编程的keithley2420型电源测定opv器件的j–v特性。在来自装备有am1.5g(am:大气质量;g:全球)过滤器的oriel300w太阳模拟器的照度下测定光电流并使用orielkg-5参比电池测定光强度。对于ipce测定,经由使用300w氙弧灯(oriel型号66984)作为光源的orielcornerstone2601/4m单色器使用可变波长的单色光来辐照器件。使用经校准的硅检测器(oriel型号71639)确定该光源在各波长处的强度。然后使用双通道辐射计(orielmerlindigitallock-inradiometrysystem型号7104)以10nm间隔记录各器件在短路条件下的光电流。
实施例5
对照opv器件的光伏响应
制造仅有c70的器件作为对照电池,其中采用与实施例4中所述的相同材料和加工步骤,所不同的是纯(pristine)c70受体用作光活化层。
图11显示使用化合物1作为供体以不同浓度掺杂在c70受体中的器件的j–v曲线。不出乎意料地,仅有c70的电池显示差的光伏响应,其中短路电流密度(jsc)=1.27macm–2;开路电压(voc)=0.98v;ff=0.37;pce=0.46%。通过结合化合物1作为供体,光伏响应得到显著改善。当化合物1的掺杂剂浓度从0提高到约9%时,opv器件的jsc从约1.27macm–2显著地提高到约10.78macm–2。同时,器件的ff从约0.37提高到约0.50。特别地,具有约9%的化合物1的优化器件展示约10.78macm–2的高jsc和约0.95v的高voc。这些值对应于约5.1%的高pce,比仅有c70的电池的pce(约0.46%)高地多。此外,化合物1的掺杂能加宽光谱范围以及提高器件的ipce,如图12中描绘。发现掺杂器件的稳定感光度(plateausensitivity)完全覆盖380至700nm之间的可见光谱,这很好地对应于c70和化合物1的光谱吸收的叠加。掺杂有约9%的化合物1的器件在490nm处的ipce为约70.7%,比仅有c70的器件在490nm处的ipce(约7.8%)高一个数量级。
实施例6
用螺环化合物作为供体材料制造的opv器件的光伏响应
采用与实施例4中所述的相同材料和加工步骤,所不同的是将化合物2–8和10掺杂在c70受体基体中以形成光活化层。
当碳环或杂环螺环化合物以约7%(按重量计)掺杂在c70受体基体中时,在1个太阳光照度下,获得了jsc在约3.96至约11.00macm–2范围内的有前景的光伏响应。此外,所有器件的ff得到改善。这些改善的光伏响应产生pce高达5.46%的非常有效的opv器件。表3汇总了分别具有7%的化合物1–8和10作为供体掺杂在c70受体基体中并在80ºc下热退火5分钟后所制备的器件的光伏响应。这些结果展示碳环和杂环螺环化合物在有效的基于小分子的opv器件的制造中是有前景的供体材料。
表3:用不同螺环化合物制造的opv器件的光伏响应
这些实施例不应解释为限制本发明的范围,而应解释为提供本发明的一些实施方案的示例。应理解其中可作出改变和变化而不偏离如下文中所请求保护的本发明的范围和精神。
本文中提及或引用的所有专利、专利申请、临时申请和出版物通过引用以其全文(包括所有图和表)并入,只要它们没有与本说明书的明确教导不一致。
参考文献
1.z.he,c.zhong,s.su,m.xu,h.wu,y.cao,nat.photonics2012,6,591;j.you,l.dou,k.yoshimura,t.kato,k.ohya,t.moriarty,k.emery,c.chen,j.gao,y.yang,nat.commun.2013,4,1446.
2.d.kearns,m.calvin,j.chem.phys.1958,29,950.
3.c.w.tang,appl.phys.lett.1986,48,183.
4.n.s.sariciftci,d.braun,c.zhang,v.i.srdanov,a.j.heeger,g.stucky,f.wudl,appl.phys.lett.,1993,62,585.
5.t.p.i.saragi,t.spehr,a.siebert,t.f.lieker,j.salbeck,chem.rev.2007,107,1011.
6.c.wu,w.liu,w.hung,t.liu,y.lin,h.lin,k.wong,y.chien,r.chen,t.hung,t.chao,y.chen,appl.phys.lett.2005,87,052103.
7.d.heredia,j.natera,m.gervaldo,l.otero,f.fungo,c.-y.lin,k.-t.wong,org.lett.2010,12,12.
8.h.-c.ting,c.-h.tsai,j.-h.chen,l.-y.lin,s.-h.chou,k.-t.wong,t.-w.huang,c.-c.wu,org.lett.2012,14,6338.
9.g.pozzi,s.orlandi,m.cavazzini,d.minudri,l.macor,l.otero,f.fungo,org.lett.2013,15,4642.
10.q.yan,y.zhou,y.-q.zheng,j.pei,d.zhao,chem.sci.2013,doi:10.1039/c3sc5184h.
11.m.wang,c.li,a.lv,z.wang,z.bo,macromolecules2012,45,3017。
- 还没有人留言评论。精彩留言会获得点赞!