半乳糖改造的免疫球蛋白1抗体的制作方法
本发明涉及半乳糖改造(galactoengineered)的重组IgG1同种型抗体、用于产生该抗体的方法及其用途。
背景技术:
IgG是丰度最高的抗体同种型,以IgG1抗体为显示最显著效应子功能程度和系列的亚类。IgG1抗体是最常用于免疫治疗的抗体,其中常常认为ADCC和CDC很重要。在抗体的结构内,CH2结构域以及IgG铰链区在Fc介导的抗体效应子功能中发挥主要作用。每个CH2结构域在定位于约297位(按照Kabat的EU指数的编号)的天冬酰胺残基处包含保守的糖基化位点,在该位点处共价结合聚糖部分(Wright,A.和Morrison,S.L.,TIBTECH 15(1997)26-32)。在成熟IgG分子中,聚糖埋藏在CH2结构域之间,影响IgG分子的三级结构。已知存在于抗体Fc区中的N连接聚糖对抗体介导效应子功能(如ADCC)很重要(Lifely,M.R.等Glycobiology.1995年12月;5(8):813-22;,Jefferis R.等Immunol Rev.1998年6月;163:59-76.)。
一般而言,已知三类主要的N连接聚糖,包括高甘露糖结构(图1A)、复杂双触角结构(图1C)及具有甘露糖残基分支和复杂分支的杂合结构(图1B)。抗体Fc区的聚糖主要是图1C中所示的高度异质的复杂双触角结构。虽然抗体Fab区内可以存在其他非保守糖基化位点,但抗体糖基化对其效应子功能的影响归因于Fc糖基化。已显示,N连接聚糖的组成影响IgG分子Fc区的结构,从而改变抗体效应子功能,如Fc受体结合、ADCC活性和CDC活性(Presta,L.Curr Opin Struct Biol.2003Aug;13(4):519-25)。在重组表达系统中表达(例如通过在原核或真核宿主细胞中表达)的抗体内,N连接聚糖结构在单个抗体分子间不同。因此,在重组表达系统中产生的抗体可以视为“抗体群体(population of antibodies)”(本文中进一步使用的术语),抗体在其氨基酸序列上相同,但就其Fc区的N连接聚糖模式而言显示异质性。
已知Fc聚糖的组成在用于表达重组抗体的不同宿主细胞种类之间不同。两种常用于重组表达抗体的宿主细胞系是中国仓鼠卵巢细胞(CHO细胞)和小鼠骨髓瘤细胞(例如sp2/0、P3X63Ag8.653、NS0)。CHO细胞表达的重组抗体基本不含末端唾液酸残基,同时大部分聚糖模式岩藻糖基化。相反,小鼠骨髓瘤细胞产生的抗体群体含有至多50%(相对频率)唾液酸残基,但岩藻糖残基少。
已知聚糖结构的一些末端残基影响IgG效应子功能。已知末端岩藻糖残基的存在致使FcγRIIIa结合降低和ADCC降低。因此,缺乏末端岩藻糖残基(“无岩藻糖基化(afucosylation)”抗体)的抗体与抗体群体介导的ADCC提高相关。虽然无岩藻糖基化对改善ADCC介导的影响在本领域内已广为接受,但对Fc半乳糖基化在ADCC介导中的作用的报道存在争议。几篇研究显示,半乳糖基化对ADCC没有影响(Boyd,P.N.等MolImmunol.1995年12月;32(17-18):1311-8;Hodoniczky J.等Biotechnol Prog.2005年11月-12月;21(6):1644-52;Raju T.S.Curr Opin Immunol.2008年8月;20(4):471-8);而其他研究确实报道了IgG的半乳糖基化提高FcγRIIIa结合(Houde D.等Mol Cell Proteomics.2010年8月;9(8):1716-28;Kumpel B.M.等Hum Antibodies Hybridomas.1995;6(3):82-8)。
目前,改造IgG分子以改善抗体介导的ADCC集中在调节IgG分子的岩藻糖基化。重组表达的IgG的无岩藻糖基化可以通过在遗传改造的宿主细胞(例如,蛋白质岩藻糖基化缺乏的Lec13CHO细胞,或敲除细胞系,如α-1,6-岩藻糖基转移酶(FUT8)基因敲除的CHO细胞)中表达抗体来达到。
但是,通过目前的表达系统(例如CHO细胞)产生的抗体显示异质的聚糖模式,导致不同聚糖种类的分布在所产生的不同批次抗体内的变异。
因此,仍存在调整重组IgG抗体的效应子功能、尤其是提供用于改善治疗性抗体介导的ADCC的手段的需要。
发明概述
本发明涉及半乳糖改造的重组IgG1同种型抗体的群体,其包含相对频率至少80%的Fc半乳糖基化抗体。
本发明还涉及半乳糖改造的重组IgG1同种型抗体的群体,其包含相对频率至少70%的Fc双半乳糖基化抗体和相对频率低于20%的Fc无岩藻糖基化抗体。
本发明的一个实施方案涉及抗体群体,其中抗体在其Fab片段中不包含糖基化位点。
本发明的一个实施方案涉及抗体群体,其中该抗体的作用方式是诱导ADCC。
本发明的一个实施方案涉及抗体群体,其中抗体选自曲妥珠单抗(trastuzumab)、利妥昔单抗(rituximab)、帕妥珠单抗(pertuzumab)和obinutuzumab。
本发明的另一方面是用于产生半乳糖改造的重组抗体群体的方法,其包括步骤:
a)在包含编码抗体的核酸分子的宿主细胞中重组产生IgG1同种型抗体,以获得重组抗体群体;
b)遗传改造该宿主细胞以改善蛋白质半乳糖基化,使得获得该半乳糖改造的重组抗体群体,其包含相对频率至少70%的Fc双半乳糖基化抗体。
本发明的另一方面是用于产生半乳糖改造的抗体群体的方法,其包括步骤:
a)在包含编码抗体的核酸分子的宿主细胞中重组产生IgG1同种型抗体,以获得该重组抗体群体;
b)分离该重组抗体群体;
c)用半乳糖基转移酶酶处理该抗体群体,以获得包含相对频率至少70%的Fc双半乳糖基化抗体的抗体群体,随后从该酶分离该抗体群体。
本发明的另一方面是该方法在改善该重组IgG1同种型抗体群体介导的ADCC中的用途。
本发明的另一方面是本发明的半乳糖改造的重组IgG1同种型抗体群体用于介导ADCC。
本发明的另一方面是本发明的半乳糖改造的重组IgG1同种型抗体群体用作药物。
根据本发明,借助半乳糖改造来调整IgG1分子的效应子功能,尤其是ADCC介导的效应子功能。本发明提供在其产生后调整重组IgG1的聚糖谱以提供基本同质的聚糖模式的手段和方法,其在所产生的不同批次IgG1抗体之间可重复。本发明还允许通过糖改造提供具有某种聚糖谱的IgG1分子来改善IgG1分子介导的ADCC。
附图简述
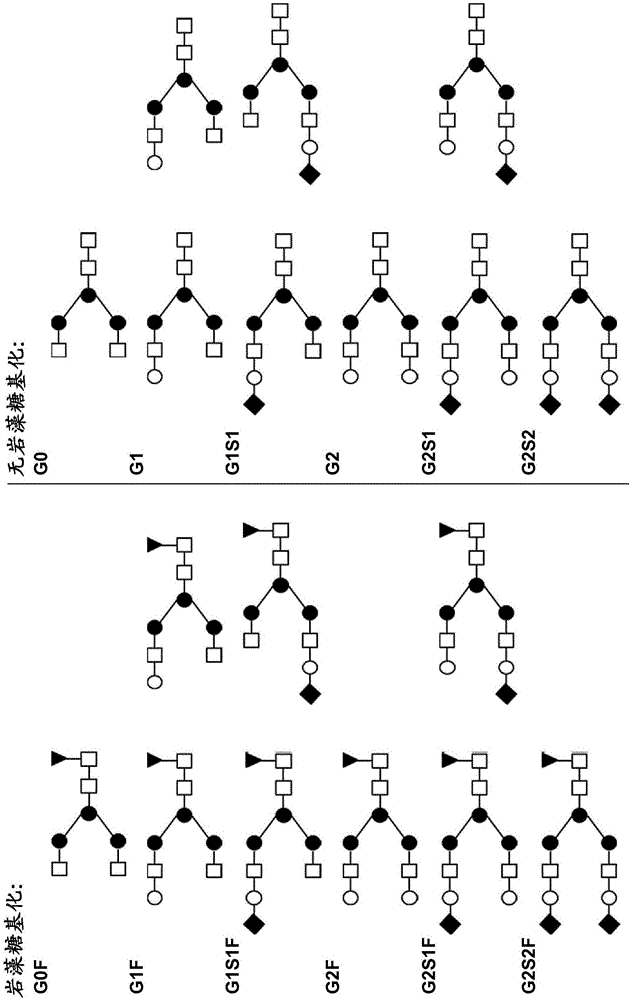
图1:IgG分子N连接聚糖示意图(示意图内所用符号的说明:白色方形-N-乙酰葡糖胺,黑色圆形-甘露糖,黑色三角形-岩藻糖,白色圆形-半乳糖,黑色菱形-唾液酸)。重组表达的IgG分子的唾液酸通常是5-N-乙酰神经氨酸(NANA)或5-N-羟乙酰神经氨酸(NGNA),而人IgG分子仅包含NANA。
图1A:示例性高甘露糖类型聚糖结构,其包含两个N-乙酰葡糖胺,具有许多甘露糖残基;
图1B:示例性杂合聚糖结构,其包含甘露糖残基的分支和复杂分支;
图1C:示例性复杂聚糖结构,所显示的是所有可能附着的糖残基,包括二等分(bisecting)N-乙酰葡糖胺;
图1D:岩藻糖基化和无岩藻糖基化复杂双触角结构及本文所用的相应缩写。
图2:来自不同生产批次(#1-#4)的酶处理得到的高半乳糖基化抗体的ADCC。
图2A:来自所示各生产批次的未处理曲妥珠单抗(黑色圆,实线)和酶处理高半乳糖基化曲妥珠单抗(白色方形,虚线)介导的示例性剂量依赖性ADCC;
图2B:未处理对照(灰色条)和酶处理高半乳糖基化材料(白色条)介导的ADCC的比较。误差棒代表单个实验(n≥3)间的标准差。mAb1=曲妥珠单抗;mAb2=利妥昔单抗;mAb3=帕妥珠单抗;mAb5=Obinutuzumab;afu=无岩藻糖基化。
图3:实施例3中用于样品制备的体外半乳糖改造方法的流程示意图。在CHO细胞中产生并纯化重组IgG1(未处理重组IgG1)。为了制备无半乳糖基化(aGal)对照样品,用半乳糖苷酶处理抗体。为了制备含有高相对频率的双半乳糖基化IgG1(biGal IgG1)的抗体群体,通过实施例3中所述的本发明的方法用半乳糖基转移酶处理未处理过的抗体。为了提供含有高相对频率的单唾液酸化IgG1(biGal/monoSia IgG1)的IgG1群体,按针对本发明的方法及在实施例3中所述用唾液酸转移酶处理双半乳糖基化抗体,为了产生含有高相对频率的双唾液酸化IgG1(biGal/biSia)的抗体群体,按实施例3中所述对唾液酸化抗体群体进行再一次唾液酸转移酶处理。
图4:通过表面等离振子共振分析的Fc-γ-R结合。所显示的是,相对于未处理抗体群体的结合(设为100%),通过SPR分析的实施例3的不同IgG1抗体群体(包括未处理对照样品和无半乳糖基化比较样品)与Fc-γRIa、Fc-γRIIa和Fc-γRIIIa的结合。所有样品都分析三次。
图5:通过亲和层析分析的Fc-γ-R结合。所显示的是通过亲和层析分析的实施例3的不同IgG1抗体群体(包括未处理对照样品和无半乳糖基化比较样品)与Fc-γRIIa和Fc-γRIIIa的结合。
图6:具有不同聚糖种类的IgG1抗体的ADCC。所显示的是通过实施例2和7中所述基于细胞的ADCC测定分析的实施例3的不同IgG1抗体群体(包括未处理对照样品和无半乳糖基化比较样品)的相对ADCC。所显示的是未处理对照IgG1群体,以及酶处理群体aGal(比较实例)、biGal、biGal/monoSia和biGal/biSia。
图7:高半乳糖基化对Fc-γRIIIa结合和ADCC的影响。相对于参考材料的Fc-γRIIIa结合和ADCC;未处理对照(灰色条),高半乳糖基化材料(白色条)。误差棒代表独立实验(n≥3)之间的标准差。mAb2=利妥昔单抗;mAb3=帕妥珠单抗;afu=无岩藻糖基化。
发明详述
1.定义
除非文中另有明确说明,术语“一”、“一个”和“该”一般包括复数指代物。
本文中的术语“抗体”以最广泛的含义使用,且涵盖多种抗体结构,包括但不限于单克隆抗体、多克隆抗体、多特异性抗体(例如双特异性抗体)和抗体片段,只要它们显示希望得到的抗原结合活性。
术语“全长抗体”、“完整抗体”和“全抗体”在本文中可互换使用,指具有基本类似于天然抗体结构的结构或具有包含本文定义的Fc区的重链的抗体。
本文所用的术语“单克隆抗体”指获自基本同质的抗体群体的抗体,即除了例如包含天然存在的突变或在产生单克隆抗体制剂期间出现的可能的变体抗体(这类变体通常以较小的量存在)外,包含该群体的单种抗体相同和/或结合相同的表位。与通常包含抗不同决定簇(表位)的不同抗体的多克隆抗体制剂不同,单克隆抗体制剂的每种单克隆抗体抗抗原上的单个决定簇。因此,修饰词“单克隆”指抗体获自基本同质的抗体群体的特征,而不解释为需要通过任意具体方法来产生该抗体。例如,将要按照本发明使用的单克隆抗体可以通过多种技术制备,其包括但不限于杂交瘤法、重组DNA法、噬菌体展示法及利用含有全部或部分人免疫球蛋白基因座的转基因动物的方法,本文描述用于制备单克隆抗体的这类方法和其他示例性方法。
“分离的”抗体是已从其天然环境的成分分开的抗体。在一些实施方案中,将抗体纯化至通过例如电泳(例如SDS-PAGE、等电聚焦(IEF)、毛细管电泳)或层析(例如离子交换或反相HPLC)测定的纯度大于95%或99%。用于评估抗体纯度的方法综述参见例如Flatman等,J.Chromatogr.B 848:79-87(2007)。
抗体的“种类”指其重链所具有的恒定结构域或恒定区的类型。存在5个主要的抗体种类:IgA、IgD、IgE、IgG和IgM,这些种类中的几种可以进一步划分为亚类(同种型),例如IgG1、IgG2、IgG3、IgG4、IgA1和IgA2。对应于不同种类免疫球蛋白的重链恒定结构域分别称为α、δ、ε、γ和μ。本发明的抗体属于IgG1同种型。
本文的术语“Fc区”用于定义免疫球蛋白重链的C端区域,其包含至少部分恒定区。该术语包括天然序列Fc区和变体Fc区。在一个实施方案中,人IgG重链Fc区从Cys226或从Pro230延伸至重链的羧基端。除非本文另有说明,Fc区或恒定区中氨基酸残基的编号按照Kabat等,Sequences of Proteins of Immunological Interest,第5版Public Health Service,National Institutes of Health,Bethesda,MD,1991中所述的EU编号系统,也称为EU指数。
“效应子功能”指可归因于抗体Fc区且随抗体同种型而变的那些生物活性。抗体效应子功能的实例包括:C1q结合和依赖补体的细胞毒性(CDC);Fc受体结合;依赖抗体的细胞毒性(ADCC);吞噬作用;细胞表面受体(例如B细胞受体)的下调;及B细胞激活。
“依赖抗体的细胞毒性”或“ADCC”指这样的细胞毒性形式,其中分泌的免疫球蛋白(Ig)结合至存在于某些细胞毒性细胞(例如NK细胞、嗜中性粒细胞和巨噬细胞)上的Fc受体(FcR)上,使得这些细胞毒性效应细胞能够特异性结合具有抗原的靶细胞,随后用细胞毒素杀死靶细胞。介导ADCC的主要细胞NK细胞仅表达FcγRIII,而单核细胞表达FcγRI、FcγRII和FcγRIII。造血细胞上的Fc表达总结在Ravetch和Kinet,Annu.Rev.Immunol.9:457-92(1991)的第464页上的表3中。为了评估目的分子的ADCC活性,可以进行体外ADCC测定,如描述于美国专利号5,500,362或5,821,337或美国专利号6,737,056(Presta)中的体外ADCC测定。用于这类测定的效应细胞包括PBMC和NK细胞。备选地,或此外,可以在体内,例如在诸如公开于Clynes等,PNAS USA 95:652-656(1998)中的动物模型的动物模型中评估目的分子的ADCC活性。
“依赖补体的细胞毒性”或“CDC”指在补体存在下裂解靶细胞。经典补体途径的激活由补体系统第一成分(C1q)与结合于其关联抗原的(适当亚类的)抗体的结合起始。为了评估补体激活,可以进行例如Gazzano-Santoro等,J.Immunol.Methods 202:163(1996)中所述的CDC测定。Fc区氨基酸序列改变(具有变体Fc区的多肽)且C1q结合能力提高或降低的多肽变体描述于例如美国专利号6,194,551B1和WO 1999/51642中。还参见例如Idusogie等J.Immunol.164:4178-4184(2000)。
“Fc受体”或“FcR”描述结合抗体Fc区的受体。在一些实施方案中,FcR是天然人FcR。在一些实施方案中,FcR是结合IgG抗体的FcR(γ受体),且包括FcγRI、FcγRII和FcγRIII亚类的受体,包括这些受体的等位基因变体和选择性剪接形式。FcγRII受体包括FcγRIIA(“激活受体”)和FcγRIIB(“抑制受体”),它们具有主要在其胞质结构域中不同的相似氨基酸序列。激活受体FcγRIIA在其胞质结构域中包含基于免疫受体酪氨酸的激活基序(ITAM)。抑制受体FcγRIIB在其胞质结构域中包含基于免疫受体酪氨酸的抑制基序(ITIM)(参见例如Annu.Rev.Immunol.15:203-234(1997))。FcR综述于例如Ravetch和Kinet,Annu.Rev.Immunol 9:457-92(1991);Capel等,Immunomethods 4:25-34(1994);及de Haas等,J.Lab.Clin.Med.126:330-41(1995)中。本文的术语“FcR”涵盖了其他FcR,包括有待在将来鉴定的那些。
“激活Fc受体”是在与抗体(或免疫缀合物)Fc区结合后引出刺激具有受体的细胞执行效应子功能的信号发放事件的Fc受体。激活Fc受体包括Fc-γRIIIa(CD16a)、Fc-γRI(CD64)、Fc-γRIIa(CD32)和FcαRI(CD89)。
IgG1抗体的“作用方式”描述活生物暴露于抗体产生的细胞水平的功能变化或解剖学变化。包含IgG1Fc区的抗体有效激活免疫系统。IgG1的治疗性应用因此以利用不同免疫细胞和分子杀伤肿瘤靶细胞的范围进行。IgG1同种型抗体通过CD16A激活NK细胞,并诱导依赖抗体的细胞毒性(ADCC)。因此,IgG1的一种作用方式是诱导ADCC。IgG1同种型抗体激活补体产生依赖补体的细胞毒性(CDC)。因此,IgG1的另一种作用方式是诱导CDC。
“重组抗体”是通过重组改造的宿主细胞产生的抗体。它可选地是分离的或纯化的。
“人抗体”是具有这样的氨基酸序列的抗体,该氨基酸序列对应于由人或人细胞产生或源自利用人抗体库或其他人抗体编码序列的非人来源的抗体的氨基酸序列。人抗体的此定义明确排除了包含非人抗原结合残基的人源化抗体。
术语“嵌合”抗体指这样的抗体,其中部分重链和/或轻链源自特定来源或物种,而重链和/或轻链的其余部分源自不同来源或物种。“人源化”抗体指包含来自非人HVR的氨基酸残基和来自人构架(FR)的氨基酸残基的嵌合抗体。在某些实施方案中,人源化抗体将包含至少一个且通常为两个可变结构域的基本上全部,其中全部或基本上全部HVR(例如CDR)对应于非人抗体的HVR,而全部或基本上全部FR对应于人抗体的FR。人源化抗体可以可选地包含源自人抗体的抗体恒定区的至少一部分。抗体(例如非人抗体)的“人源化形式”指已进行了人源化的抗体。
IgG抗体是在重链恒定区CH2结构域中的Asn297处包含保守的Fc糖基化位点的糖蛋白。术语“糖基化位点”指抗体氨基酸序列内共价连接聚糖的氨基酸。N连接聚糖通常连接至作为Asn-X-Ser或Asn-X-Thr共有序列的部分存在的天冬酰胺(Asn)侧链的氮原子,其中X是除脯氨酸外的氨基酸,Ser是丝氨酸,Thr是苏氨酸。虽然Fc区中的保守糖基化位点存在于所有野生型IgG抗体中,但其他糖基化位点可以存在于抗体Fab区内。
本文所用的“Asn297”指定为在IgG1分子Fc区中的约297位的氨基酸天冬氨酸。根据抗体小的序列变异,Asn297也可以定位于297位上游或下游的一些氨基酸(通常不超过+3氨基酸),即在294位和300位之间。
术语“N连接聚糖”指共价连接至抗体天冬酰胺残基的氮原子的寡糖。一般而言,已知三类主要的N连接聚糖,包括高甘露糖结构(图1A)、复杂双触角结构(图1C)和具有甘露糖残基分支和复杂分支的杂合结构(图1B)。CH2结构域Asn297的N连接聚糖是复杂双触角寡糖,其埋藏在CH2结构域之间,与多糖主链形成广泛接触。它们的存在对抗体介导效应子功能(依赖抗体的细胞毒性(ADCC))非常重要(Lifely,M.,R.等,Glycobiology 5(1995)813-822;Jefferis,R.等,Immunol.Rev.163(1998)59-76;Wright,A.和Morrison,S.L.,Trends Biotechnol.15(1997)26-32)。
“糖基化变体”指其中附着于Fc区的糖类改变的抗体。因此,本发明的抗体群体包含通过宿主细胞重组表达的抗体的糖基化变体。
图1D中显示N连接聚糖的不同复杂双触角结构。本文所用的术语“糖基化”抗体指这样的抗体,其中抗体的N连接聚糖(在一个实施方案中,与抗体Asn297偶联的N连接聚糖)包含至少一个半乳糖残基(包括G1F、G1、G2F、G2、G1S1F、G1S1、G2S1F、G2S1、G2S2F和G2S2结构)。本文所用的术语“双半乳糖基化”抗体指这样的抗体,其中抗体的N连接聚糖(在一个实施方案中,与抗体Asn297偶联的N连接聚糖)是包含正好两个半乳糖残基的复杂双触角结构(包括G2F、G2、G2S1F、G2S1、G2S2F和G2S2结构)。本文所用的术语“单半乳糖基化”抗体指这样的抗体,其中抗体的N连接聚糖(在一个实施方案中,与抗体Asn297偶联的N连接聚糖)是包含一个半乳糖残基的复杂双触角结构(包括G1F、G1、G1S1F和G1S1结构)。本文所用的术语“无半乳糖基化”抗体指这样的抗体,其中抗体的N连接聚糖(在一个实施方案中,与抗体Asn297偶联的N连接聚糖)不含半乳糖残基(包括G0、G0F及其他不含半乳糖残基的结构)。
本文所用的术语“唾液酸化”抗体指这样的抗体,其中抗体的N连接聚糖(在一个实施方案中,与抗体Asn297偶联的N连接聚糖)包含至少一个唾液酸残基(包括G1S1F、G1S1、G2S1F、G2S1、G2S2F和G2S2结构)。本文所用的术语“唾液酸”指神经氨酸的N取代衍生物,尤其包括5-N-乙酰神经氨酸(NANA)或5-N-羟乙酰神经氨酸(NGNA)。虽然人IgG分子仅包含以NANA作为唾液酸唾液酸化N连接聚糖,但重组表达的IgG分子(即在除人细胞外的宿主细胞中)包含以NANA或NGNA二者作为唾液酸的唾液酸化N连接聚糖。本文所用的术语“双唾液酸化”抗体指这样的抗体,其中抗体的N连接聚糖(在一个实施方案中,与抗体Asn297偶联的N连接聚糖)是包含正好两个唾液酸残基的复杂双触角结构(包括G2S2F和G2S2结构)。本文所用的术语“单唾液酸化”抗体指这样的抗体,其中抗体的N连接聚糖(在一个实施方案中,与抗体Asn297偶联的N连接聚糖)是包含正好一个唾液酸残基的复杂双触角结构(包括G1S1F、G1S1、G2S1F和G2S1结构)。本文所用的术语“无唾液酸化”抗体指这样的抗体,其中抗体的N连接聚糖(在一个实施方案中,与抗体Asn297偶联的N连接聚糖)不含唾液酸残基(包括G0、G0F及其他不含唾液酸残基的结构)。
本文所用的术语“岩藻糖基化”抗体指这样的抗体,其中抗体的N连接聚糖(在一个实施方案中,与抗体Asn297偶联的N连接聚糖)包含岩藻糖残基(包括G1F、G2F、G1S1F、G2S1F、G2S2F及其他包含岩藻糖残基的结构)。本文所用的术语“无岩藻糖基化”抗体指这样的抗体,其中抗体的N连接聚糖(在一个实施方案中,与抗体Asn297偶联的N连接聚糖)不含岩藻糖残基(包括G1、G2、G1S1、G2S1、G2S2及其他不含岩藻糖残基的结构)。术语“无岩藻糖基化的”在本文中也缩写为“afu”。
本文所用的术语“不含”不同糖残基指抗体CH2结构域中没有一个的聚糖模式包含该不同糖残基。因此,“不含半乳糖”指抗体CH2结构域中没有一个的聚糖模式包含半乳糖残基。因此,“不含岩藻糖”指抗体CH2结构域中没有一个的聚糖模式包含岩藻糖残基。
在提到本文所用的“基本不含”不同糖残基(例如半乳糖、岩藻糖或唾液酸)的抗体时,它是指抗体群体仅包含低相对频率的含有该不同糖残基的抗体,使得本领域技术人员可认为含有该不同糖残基的抗体部分在抗体生物学特征(例如,抗体介导的ADCC、FcR结合)的背景内几乎没有或没有生物学意义。因此,“基本不含Fc半乳糖残基”的抗体指这样的抗体群体,其仅包含低相对频率的含有半乳糖残基的抗体,使得本领域技术人员可认为含有该不同糖残基的抗体部分在抗体生物学特征(例如,抗体介导的ADCC、FcR结合)的背景内几乎没有或没有生物学意义。“基本不含”不同糖残基(例如半乳糖、岩藻糖或唾液酸)的抗体可以以2%或更低、优选1%或更低、优选0.5%或更低的相对频率存在于抗体群体中。因此,基本不含不同糖残基的抗体群体包含相对频率为至少98%、优选至少99%、优选至少99.5%的不含该不同糖残基的抗体。
术语“抗体群体”指可以包含异质聚糖模式的(优选单克隆)抗体的混合物。具体而言,就其Fc区的N连接聚糖模式而言,抗体可以显示异质性。在重组表达系统中表达的IgG抗体(例如通过在原核或真核宿主细胞中表达)包含可在单个抗体分子之间和在所产生的不同批次抗体之间不同的异质N连接聚糖结构。在抗体群体内,除可能的变体抗体(例如包含天然存在的突变或在产生单克隆抗体制备物期间出现的突变,这类变体通常小量存在)外,单个抗体在其氨基酸序列上基本相同。
本文提到的抗体群体的“相对频率”指抗体群体内的不同聚糖模式相对于抗体群体内的所有糖结构的百分比。具体而言,抗体群体的相对频率指抗体群体内的不同聚糖模式相对于在抗体群体的PNGase F处理样品中通过NP-UHPLC分析鉴定出的所有糖结构的百分比。例如,包含相对频率70%的双半乳糖基化抗体的抗体群体在本文中指抗体群体内70%的糖结构是含有正好两个半乳糖残基的复杂双触角结构(包括G2F、G2、G2S1F、G2S1、G2S2F和G2S2结构),其中抗体群体内所有糖结构的其余30%是i)具有包含正好一个半乳糖残基的复杂双触角结构的糖结构(包括G1F、G1、G1S1F和G1S1结构),和/或ii)具有复杂双触角结构但不含半乳糖残基的糖结构(包括G0、G0F及其他不含半乳糖残基的结构)。
本文提到的术语“体外糖改造”指在重组表达系统中表达并优选纯化抗体后在体外进行的抗体N连接聚糖结构的改变。本发明术语内的体外糖改造总是涵盖向包含在进行体外糖改造的抗体群体内的至少一部分抗体的N连接聚糖结构加入至少一个糖残基。可选地,体外糖改造可以涵盖从包含在进行体外糖改造的抗体群体内的至少一部分抗体的N连接聚糖结构切割至少一个糖残基。在本发明的范围内,术语“体外糖改造”不涵盖(即明确排除)向抗体的N连接聚糖结构加入或从抗体的N连接聚糖结构切割岩藻糖残基。
本发明术语内的体外糖改造包括在重组表达系统中表达并优选纯化的抗体的至少一个酶处理步骤。在一个实施方案中,该酶处理包括用糖基转移酶优选能够向蛋白质的N连接寡糖结构加入末端糖残基的糖基转移酶处理抗体。在一个实施方案中,该酶处理包括用半乳糖基转移酶优选β-1,4-半乳糖基转移酶处理抗体。本发明术语内的体外糖改造还可以包括至少一个用能够从蛋白质的N连接寡糖结构切割末端糖残基的酶进行酶处理的步骤。在一个实施方案中,该酶选自半乳糖苷酶和神经氨酸酶。此外,本发明术语内的体外糖改造还可以包括至少一个用唾液酸转移酶优选唾液酸转移酶6(ST6,催化形成α-2,6-糖苷键)或唾液酸转移酶3(ST3,催化形成α-2,3-糖苷键)进行酶处理的步骤。
还可以例如通过在细胞系中过量表达能够向蛋白质的N连接寡糖结构加入末端糖残基或从蛋白质的N连接寡糖结构切割末端糖残基的酶来在体内进行糖改造。此外,还可以例如通过降低细胞系中酶的表达或敲除细胞系中的酶来在体内进行糖改造,该酶能够向蛋白质的N连接寡糖结构加入末端糖残基或从蛋白质的N连接寡糖结构切割末端糖残基。
本文提到的术语“半乳糖改造”指仅改变与半乳糖残基相关的抗体的N连接聚糖结构,即改变抗体N连接聚糖结构内半乳糖残基的数目。本发明术语内的半乳糖改造总是涵盖向包含在进行半乳糖改造的抗体群体内的至少一部分抗体的N连接聚糖结构加入至少一个半乳糖残基。可选地,半乳糖改造可以涵盖从包含在进行半乳糖改造的抗体群体内的至少一部分抗体的N连接聚糖结构切割至少一个半乳糖残基。半乳糖改造可以在体内进行。还可以例如通过以下来进行半乳糖改造:i)在细胞系中过量表达能够向蛋白质的N连接寡糖结构加入末端半乳糖残基或从蛋白质的N连接寡糖结构切割末端半乳糖残基的酶;或ii)降低细胞系中酶的表达或敲除细胞系中的酶,该酶能够向蛋白质的N连接寡糖结构加入末端半乳糖残基或从蛋白质的N连接寡糖结构切割末端半乳糖残基。本文所用的“半乳糖改造”是“糖改造”的具体形式,“半乳糖改造的”是“糖改造的”的具体形式。
本发明术语内的术语“体外半乳糖改造”包括在重组表达系统中表达并优选纯化的抗体的至少一个酶处理步骤。在一个实施方案中,该酶处理包括用半乳糖基转移酶优选能够向蛋白质的N连接寡糖结构加入末端半乳糖残基的半乳糖基转移酶处理抗体。在一个实施方案中,该酶处理包括用β-1,4-半乳糖基转移酶处理抗体。本发明术语内的体外半乳糖改造还可以包括至少一个用能够从蛋白质的N连接寡糖结构切割末端半乳糖残基的酶进行酶处理的步骤。在一个实施方案中,该酶是半乳糖苷酶。
本发明的抗体通过重组手段产生。用于重组产生抗体的方法在现有技术中众所周知,包括在原核和真核细胞中表达蛋白质,随后分离抗体,且通常纯化至可药用纯度。为了在宿主细胞中表达前述抗体,通过标准方法将编码该抗体轻链和重链的核酸插入表达载体。在适当的原核或真核宿主细胞(如CHO细胞、NS0细胞、SP2/0细胞、HEK293细胞、COS细胞、PER.C6细胞、酵母或大肠杆菌细胞)中进行表达,并从细胞(上清或裂解后的细胞)回收抗体。用于重组产生抗体的一般方法为现有技术中公知,并描述于例如综述文章Makrides,S.C.,Protein Expr.Purif.17(1999)183-202;Geisse,S.等,Protein Expr.Purif.8(1996)271-282;Kaufman,R.J.,Mol.Biotechnol.16(2000)151-161;Werner,R.G.,Drug Res.48(1998)870-880中。
本文中可互换使用的“多核苷酸”或“核酸”指任意长度的核苷酸聚合物,且包括DNA和RNA。核苷酸可以是脱氧核糖核苷酸、核糖核苷酸、修饰的核苷酸或碱基、和/或其类似物,或可以通过DNA或RNA聚合酶或通过合成反应掺入聚合物的任意底物。多核苷酸可以包含修饰的核苷酸,如甲基化的核苷酸及其类似物。核苷酸的序列可以由非核苷酸成分中断。多核苷酸可以包含合成后进行的修饰,如与标记缀合。其他类型的修饰包括例如“帽”,用类似物取代一个或多个天然存在的核苷酸,核苷酸间修饰,例如具有不带电荷的连接(例如磷酸甲酯、磷酸三酯、磷酰胺、氨基甲酸酯等)和具有带电荷的连接(例如硫代磷酸酯、二硫代磷酸酯等)的那些,包含悬垂部分(例如蛋白质(例如核酸酶、毒素、抗体、信号肽、聚-L-赖氨酸等))的那些,具有嵌入剂(例如吖啶、补骨脂素等)的那些,包含螯合剂(例如金属、放射性金属、硼、氧化性金属等)的那些,包含烷化剂的那些,具有修饰的连接的那些(例如α异头核酸等),以及未修饰形式的多核苷酸。另外,通常存在于糖中的任意羟基可以例如通过膦酸基团、磷酸基团取代,通过标准保护基团保护,或活化以制备与附加核苷酸的附加连接,或可以缀合至固体或半固体支持物。5’和3’端OH可以磷酸化或用1至20个碳原子的胺或有机帽化基团部分取代。其他羟基也可以衍生至标准保护基团。多核苷酸还可以包含本领域公知的核糖或脱氧核糖的类似物形式,包括例如2’-O-甲基-、2’-O-烯丙基、2’-氟-或2’-叠氮基-核糖,碳环糖类似物,α-异头糖,差向异构糖如阿拉伯糖、木糖或来苏糖,吡喃糖,呋喃糖,景天庚酮糖,无环类似物和碱性核苷类似物如甲基核苷。可以用备选的连接基团取代一个或多个磷酸二酯键。这些备选的连接基团包括但不限于其中用P(O)S(“硫代”)、P(S)S(“二硫代”)、(O)NR2(“酰胺”)、P(O)R、P(O)OR’、CO或CH2(“formacetal”)取代磷酸的实施方案,其中每个R或R’独立地是H或可选地包含醚(-O-)键的取代或未取代的烷基(1-20C)、芳基、链烯基、环烷基、环烯基或araldyl。多核苷酸中的所有键无需相同。前面的描述适用于本文提到的所有多核苷酸,包括RNA和DNA。
“分离的”核酸指已从其天然环境的成分分开的核酸分子。分离的核酸包括包含这样的核酸分子,其包含在通常含有该核酸分子的细胞内,但该核酸分子存在于染色体外或不同于其天然染色体位置的染色体位置上。
“分离的编码抗体的核酸”指编码抗体重链和轻链(或其片段)的一个或多个核酸分子,包括单个载体或分开的载体中的这种(类)核酸分子,及存在于宿主细胞中的一个或多个位置的这种(类)核酸分子。
本文所用的术语“载体”指能够繁殖与之连接的另一核酸的核酸分子。该术语包括作为自我复制核酸结构的载体,以及掺入它所引入的宿主细胞的基因组中的载体。该术语包括功能主要是将DNA或RNA插入细胞(例如染色体整合)的载体,功能主要是复制DNA或RNA的复制载体,及功能是转录和/或翻译DNA或RNA的表达载体。还包括提供一种以上所述功能的载体。
“表达载体”是能够指导与之有效连接的核酸的表达的载体。在将表达载体引入适当的宿主细胞中时,它可以转录并翻译为多肽。在本发明的方法中转化宿主细胞时,使用“表达载体”;因此与本文所述转化宿主细胞关联的术语“载体”指“表达载体”。“表达系统”通常指包含表达载体的适宜宿主细胞,其可以发挥功能来产生希望得到的表达产物。
本文所用的“表达”指核酸转录为mRNA的过程和/或所转录的mRNA(也称为转录物)随后翻译为肽、多肽或蛋白质的过程。转录物和所编码的多肽单独称为或统称为基因产物。如果核酸源自基因组DNA,则在真核细胞中的表达可以包括相应mRNA的剪接。
本文所用的术语“转化”指将载体/核酸转入宿主细胞的过程。如果用没有难以对付的细胞壁屏障的细胞作为宿主细胞,则例如通过Graham and Van der Eh,Virology 52(1978)546ff所述的磷酸钙沉淀法进行转染。但是,也可以使用其他用于将DNA引入细胞的方法,如通过核注射或通过原生质体融合。如果使用包含实质性细胞壁结构的原核细胞,则例如转染的一种方法Cohen,F.N等,PNAS 69(1972)7110et seq所述的使用氯化钙的钙处理。
本申请中所用的术语“宿主细胞”指可以改造来产生本发明的抗体的任何种类的细胞系统。
本文所用的表述“细胞”、“细胞系”和“细胞培养物”可互换使用,且所有这类命名都包括后代。因此,词语“转化体”和“转化细胞”包括最初的主题细胞及从其衍生的培养物,而不考虑转移的数目。还应理解,由于有意或无意的突变,所有后代的DNA含量可以并非精确相同。包括具有与在最初转化的细胞中筛选的功能或生物学活性相同的功能或生物学活性的突变体后代。在旨在不同命名时,它将从文中显而易见。
NS0细胞中的表达由例如Barnes,L.M.等,Cytotechnology 32(2000)109-123;Barnes,L.M.等,Biotech.Bioeng.73(2001)261-270描述。瞬时表达由例如Durocher,Y.等,Nucl.Acids.Res.30(2002)E9描述。可变结构域的克隆由Orlandi,R.等,Proc.Natl.Acad.Sci.USA 86(1989)3833-3837;Carter,P.等,Proc.Natl.Acad.Sci.USA 89(1992)4285-4289;Norderhaug,L.等,J.Immunol.Methods 204(1997)77-87描述。优选的瞬时表达系统(HEK293)由Schlaeger,E.-J.和Christensen,K.在Cytotechnology 30(1999)71-83中及Schlaeger,E.-J.,J.Immunol.Methods 194(1996)191-199描述。
本文所用的术语“纯化的”指这样的多肽,其从其天然环境或从重组产生的来源移出,或以其他方式分离或分开,且至少60%(例如至少80%)游离于与之天然相关的其他成分(例如膜和微粒体)。通过包括碱/SDS处理、CsCl分带、柱层析、琼脂糖凝胶电泳和本领域公知的其他方法的标准技术进行抗体的纯化(从宿主细胞培养物回收抗体),以去除细胞成分或其他污染物,例如其他细胞核酸或蛋白质。参见Ausubel,F.等,编辑Current Protocols in Molecular Biology,Greene Publishing and Wiley Interscience,New York(1987)。良好地建立了不同的方法并广泛用于蛋白质纯化,如使用微生物蛋白质的亲和层析(例如蛋白A、蛋白G亲和层析)、离子交换层析(例如阳离子交换(羧甲基树脂)、阴离子交换(氨乙基树脂)和混合模式交换)、亲硫吸附(例如具有β-巯基乙醇和其他SH配体)、疏水相互作用或芳族吸附层析(例如具有苯基-琼脂糖、aza-arenophilic树脂或间-氨基苯基硼酸)、金属螯合亲和层析(例如具有Ni(II)-和Cu(II)亲和材料)、大小排阻层析和电泳方法(如凝胶电泳、毛细管电泳)(Vijayalakshmi,M.A.,Appl.Biochem.Biotech.75(1998)93-102)。
术语“药物组合物”指这样的制备物,其以这样的形式存在,使得允许包含在其中的活性成分的生物活性有效,且不包含对将要施用该组合物的个体具有不可接受的毒性的附加成分。本发明的药物组合物可以通过本领域已知的多种方法施用。如熟练的技术人员将理解,施用的途径和/或方式将取决于希望得到的结果而不同。为了通过某些给药途径施用本发明的抗体,可以有必要用防止其失活的材料包被抗体,或者与防止其失活的材料共同施用抗体。例如,抗体可以在适当的载体(例如脂质体)或稀释剂中对个体施用。可药用稀释剂包括盐水和水性缓冲溶液。
药物组合物包含有效量的本发明的抗体。药物(agent)(例如抗体)的“有效量”指对在剂量下和必要的时间内达到希望得到的治疗或预防结果有效的量。具体而言,“有效量”指本发明的抗体的量,在对个体施用时,其(i)治疗或预防具体疾病、病症或障碍,(ii)减轻、改善或消除具体疾病、病症或障碍的一种或多种症状,或(iii)预防或延迟本文所述具体疾病、病症或障碍的一种或多种症状的起始。治疗有效量将取决于所使用的抗体分子、所治疗的疾病状态、所治疗的疾病严重度、个体的年龄和相对健康、施用的途径和方式、主治医生或兽医的判断及其他因素而变。
“可药用载体”指药物制剂中除活性成分之外的成分,其对个体无毒性。可药用载体包括生理上相容的任何和全部溶剂、分散介质、包衣、抗细菌和抗真菌剂、等渗和吸收延迟剂等。在一个实施方案中,该载体适合用于静脉内、肌内、皮下、胃肠外、脊髓或表皮施用(例如通过注射或输注)。
本发明的药物组合物还可以包含佐剂,如防腐剂、湿润剂、乳化剂和分散剂。可以通过上文的灭菌流程及通过包含多种抗细菌和抗真菌剂(例如对羟苯甲酸酯、三氯叔丁醇、苯酚、山梨酸等)二者来确保防止微生物的存在。还可以希望在组合物中包含等渗剂,例如糖、氯化钠等。此外,可以通过包含延迟吸收的材料如单硬脂酸铝和明胶来产生可注射药物形式的延长吸收。
本文所用的短语“肠胃外施用”指肠内和局部施用之外的施用方式,通常通过注射,且非限制性地包括静脉内、肌内、动脉内、鞘内、囊内、眶内、心内、真皮内、腹膜内、经气管、皮下、表皮下、关节内、囊下、蛛网膜下、脊柱内、硬膜外和胸骨内注射和输注。
无论选择何种给药途径,都通过本领域技术人员已知的常规方法,将本发明的化合物(其可以以适宜的水合形式使用)和/或本发明的药物组合物配制为可药用剂型。
本发明的药物组合物中活性成分的实际剂量水平可以不同,以获得对就具体患者、组合物和施用方式达到希望得到的治疗反应有效而对患者没有毒性的活性成分量。所选择的剂量水平将取决于多种药代动力学因素,其包括所利用的本发明的具体组合物的活性;给药途径;施用时间;所利用的具体化合物的排泄速率;处理持续时间;与所利用的具体组合物组合使用的其他药物、化合物和/或材料;所治疗的患者的年龄、性别、体重、状态、一般健康和过往病史;和医学领域公知的类似因素。
组合物必须无菌,且为流体,至可通过注射器递送组合物的程度。除水外,在一个实施方案中载体是等渗缓冲盐溶液。
可以例如通过使用诸如卵磷脂的包衣、在分散体的情况下通过维持所需的颗粒大小及通过使用表面活性剂来维持恰当的流动性。在许多情况下,优选在组合物中包含等渗剂,例如糖、多元醇(如甘露醇或山梨醇)和氯化钠。
本文所用的“处理”(及其语法变形)指改变所处理的个体的自然过程的尝试中的临床干预,且可以为了预防而进行或在临床病理的过程中进行。希望得到的处理作用包括但不限于防止疾病的发生或复发、减轻症状、减少疾病的任何直接或间接的病理结果、防止转移、降低疾病进展的速率、改善或缓和疾病状态及消退或改善的预后。在一些实施方案中,用本发明的抗体来延迟疾病的发展或减慢疾病的进展。
“个体(individual)”或“个体(subject)”是哺乳动物。哺乳动物包括但不限于饲养的动物(例如牛、绵羊、猫、狗和马)、灵长类(例如人类和非人灵长类,如猴)、兔和啮齿类(例如小鼠和大鼠)。在某些实施方案中,该个体是人。
HER2是人表皮生长因子受体家族的成员,在其胞质结构域中具有蛋白激酶活性。HER2在肿瘤细胞中过量表达,与弱的预后和存活相关。HER2因此是有价值的乳腺癌治疗靶标。抗HER2的抗体从Takai,N.等,Cancer 104(2005)2701-2708;Yeon,C.H.等,Invest.New Drugs 23(2005)391-409;Wong,W.M.等,Cancer Pract.7(1999)48-50;Albanell,J.等,Drugs Today(Barc).35(1999)931-46已知。
CD20抗原是见于超过90%的来自外周血或淋巴器官的B细胞表面上的~35kDa的非糖基化磷蛋白。CD20在早期前B细胞发育期间表达,并保持至浆细胞分化。CD20在正常B细胞以及恶性B细胞上都存在。CD20在文献中的其他名称包括“B淋巴细胞限制抗原”和“Bp35”。CD20抗原描述于例如Clark等PNAS(USA)82:1766(1985)中。
曲妥珠单抗(INN)(在本文中也称为mAb1)是用于治疗HER2过量表达/HER2基因扩增的转移性乳腺癌的重组人源化抗HER2单克隆抗体。临床研究表明,该抗体在体内和体外具有抗肿瘤活性。此外,在小鼠模型中与多种抗肿瘤剂组合观察到了曲妥珠单抗抗肿瘤活性的累加或协同增强。在临床研究中,在HER2过量表达转移性乳腺癌患者中观察到了存活期延长。曲妥珠单抗报道于WO 92/022653、WO 99/057134、WO 97/04801、US 5,677,171和US 5,821,337(在此引入作为参考)中。
利妥昔单抗(INN)(在本文中也称为mAb2)是抗CD20抗原的遗传改造嵌合鼠/人单克隆抗体,在美国专利号5,736,137(在此明确引入作为参考)中命名为“C2B8”。该抗体是包含鼠轻链和重链可变区序列及人恒定区序列的IgG1κ免疫球蛋白。
帕妥珠单抗(INN)(在本文中也称为mAb3)是基于人IgG1(κ)构架产生的重组人源化单克隆抗体。帕妥珠单抗作为人源化抗体开发,其抑制HER2与其他HER受体二聚化,从而抑制配体驱动的磷酸化和激活,及RAS和AKT途径的下游激活。
Obinutuzumab(INN,之前称为afutuzumab)(在本文中也称为mAb5)是抗CD20抗原的人源化IgG1抗体。
术语“癌症”和“癌性的”指或描述哺乳动物中通常表征为细胞生长/增殖失调的生理病症。癌症的实例包括但不限于癌、淋巴瘤(例如霍奇金和非霍奇金淋巴瘤)、胚细胞瘤、肉瘤和白血病。这类癌症更具体的实例包括鳞状细胞癌、小细胞肺癌、非小细胞肺癌、肺腺癌、肺鳞状细胞癌、腹膜癌、肝细胞癌、胃肠癌、胰腺癌、成胶质细胞瘤、宫颈癌、卵巢癌、肝癌、膀胱癌、肝细胞瘤、乳腺癌、结肠癌、结肠直肠癌、子宫内膜癌或子宫癌、涎腺癌、肾癌、肝癌、前列腺癌、外阴癌、甲状腺癌、肝癌、白血病和其他淋巴增生性障碍、及多种类型的头颈癌,
术语“炎性疾病”和“炎性障碍”可互换使用,指其中哺乳动物免疫系统的成分引起、介导或以其他方式有助于促成哺乳动物中的病态的炎症反应的疾病或障碍。还包括其中炎症反应的诱导对疾病的进展具有改善作用的疾病。此定义内包括免疫介导的炎症反应,包括自身免疫病。
本文中的“自身免疫障碍”是由个体自身组织或器官引起且针对个体自身组织或器官的疾病或障碍,或其共分离或表现形式或从其产生的病症。在许多这些自身免疫和炎性障碍中,可以存在许多临床和实验室标记,包括但不限于高γ球蛋白血症、高水平自身抗体、组织中的抗原-抗体复合物沉积物、从糖皮质激素或免疫抑制治疗受益、及受影响组织中的淋巴细胞聚集体。不受限于任何理论,关于B细胞介导的自身免疫障碍,认为B细胞通过许多机制途径在人自身免疫病中显示致病作用,包括自身抗体产生、免疫复合物形成、树突细胞和T细胞激活、细胞因子合成、直接趋化因子释放和提供用于异位新淋巴发生的胞窝。这些途径中的每一条可以不同程度地参与自身免疫病的病理。
“自身免疫病”可以是器官特异性疾病(即免疫反应特异性针对器官系统,如内分泌系统、造血系统、皮肤、心肺系统、胃肠和肝系统、肾系统、甲状腺、耳、神经肌肉系统、中枢神经系统等)或可以影响多个器官系统的全身性疾病(例如全身性红斑狼疮(SLE)、类风湿性关节炎(RA)、多肌炎等)。优选的这类疾病包括自身免疫性风湿性障碍(例如RA、综合征、硬皮病、狼疮如SLE和狼疮肾炎、多肌炎-皮肌炎、冷球蛋白血症、抗磷脂抗体综合征和银屑病关节炎)、自身免疫性胃肠和肝障碍(例如炎性肠病(例如溃疡性结肠炎和克罗恩病)、自身免疫性胃炎和恶性贫血、自身免疫性肝炎、原发性胆汁性硬化、原发性硬化性胆管炎和乳糜泻)、脉管炎(例如ANCA阴性脉管炎和ANCA相关脉管炎,包括Churg-Strauss脉管炎、Wegener肉芽肿和微小性多脉管炎)、自身免疫性神经障碍(例如多发性硬化、视性眼阵挛-肌阵挛综合征、重症肌无力、视神经脊髓炎、帕金森病、阿尔茨海默病和自身免疫性多神经病)、肾障碍(例如肾小球肾炎、Goodpasture综合征和Berger病)、自身免疫性皮肤障碍(例如银屑病、风疹、荨麻疹、寻常性天疱疮、大疱性类天疱疮和皮肤红斑狼疮)、血液障碍(例如血小板减少性紫癜、血栓性血小板减少性紫癜、输血后紫癜和自身免疫性溶血性贫血)、动脉粥样硬化、葡萄膜炎、自身免疫性听力病(例如内耳病和耳聋)、Behcet病、Raynaud综合征、器官移植和自身免疫性内分泌障碍(例如糖尿病相关自身免疫病如胰岛素依赖性糖尿病(IDDM)、Addison病和自身免疫性甲状腺病(例如Graves病和甲状腺炎))。更优选的这类疾病包括例如RA、溃疡性结肠炎、ANCA相关脉管炎、狼疮、多发性硬化、综合征、Graves病IDDM、恶性贫血、甲状腺炎和肾小球肾炎。
2.本发明的实施方案详述
本发明提供具有改变的N连接聚糖谱的重组IgG1抗体,其通过酶处理糖改造为包含高量末端半乳糖残基和可选的唾液酸残基,从而显示改善的介导ADCC的能力。此外,本发明提供用于产生该抗体的糖改造方法。借助糖改造,可以产生具有基本同质的聚糖模式的群体,其可以针对在单个类型宿主细胞的不同表达批次中产生的抗体可重现地产生。本发明证明,显示N连接半乳糖基化和岩藻糖基化聚糖结构间不同平衡的IgG1抗体显示改善的ADCC特性。该抗体的ADCC特性可以通过借助半乳糖改造加入(末端)半乳糖残基来调整。通过糖改造加入末端唾液酸残基保留了ADCC特性,但此外可以改善抗体的生物学特性(例如增加血清半衰期)。
a)抗体
在一方面,本发明涉及半乳糖改造的重组IgG1同种型抗体,其包含相对频率至少80%的Fc半乳糖基化抗体。
在一方面,本发明涉及半乳糖改造的重组IgG1同种型抗体,其包含相对频率至少70%的Fc双半乳糖基化抗体。
在本发明的一个实施方案中,该抗体群体包含相对频率低于20%的Fc无岩藻糖基化抗体。
因此,在一个实施方案中,本发明涉及半乳糖改造的重组IgG1同种型抗体,其包含相对频率至少80%的Fc半乳糖基化抗体和相对频率低于20%的Fc无岩藻糖基化抗体。在另一实施方案中,本发明涉及体外糖改造的重组IgG1同种型抗体,其包含相对频率至少70%的Fc双半乳糖基化抗体和相对频率低于20%的Fc无岩藻糖基化抗体。
在本发明的一个实施方案中,该抗体群体包含相对频率至多100%的Fc半乳糖基化抗体(包括单半乳糖基化和双半乳糖基化聚糖结构)。在一个实施方案中,该抗体群体包含相对频率至多99.5%的Fc半乳糖基化抗体。在一个实施方案中,该抗体群体包含相对频率至多95%的Fc半乳糖基化抗体。在一个实施方案中,该抗体群体包含相对频率至多90%的Fc半乳糖基化抗体。在一个实施方案中,该抗体群体包含相对频率80%至99.5%的Fc半乳糖基化抗体。
在本发明的一个实施方案中,该抗体群体包含相对频率至多98%的Fc双半乳糖基化抗体。在一个实施方案中,该抗体群体包含相对频率至多95%的Fc双半乳糖基化抗体。在一个实施方案中,该抗体群体包含相对频率至多90%的Fc双半乳糖基化抗体。在一个实施方案中,该抗体群体包含相对频率70%至95%的Fc双半乳糖基化抗体。在本一个实施方案中,该抗体群体包含相对频率80%至95%的Fc双半乳糖基化抗体。在本一个实施方案中,该抗体群体包含相对频率80%至90%的Fc双半乳糖基化抗体。
在本发明的一个实施方案中,该抗体群体包含相对频率至多16%的Fc无岩藻糖基化抗体。在本发明的一个实施方案中,该抗体群体包含相对频率至少2%的Fc无岩藻糖基化抗体。在一个实施方案中,该抗体群体包含相对频率至少5%的Fc无岩藻糖基化抗体。在一个实施方案中,该抗体群体包含相对频率至少7%的Fc无岩藻糖基化抗体。在一个实施方案中,该抗体群体包含相对频率2-20%的Fc无岩藻糖基化抗体。在一个实施方案中,该抗体群体包含相对频率5-20%的Fc无岩藻糖基化抗体。在一个实施方案中,该抗体群体包含相对频率7-16%的Fc无岩藻糖基化抗体。在一个实施方案中,该抗体群体包含相对频率8-12%的Fc无岩藻糖基化抗体。
在本发明的一个实施方案中,该抗体群体未进行糖改造来改善无岩藻糖基化。在一个实施方案中,该抗体群体包含相对频率对应于在相同宿主细胞中表达的抗体中Fc无岩藻糖基化的相对频率的Fc无岩藻糖基化抗体。在一个实施方案中,该抗体群体包含相对频率对应于在CHO细胞中表达的抗体的Fc无岩藻糖基化的相对频率的Fc无岩藻糖基化抗体。
在本发明的一个实施方案中,该抗体群体包含相对频率至多98%的Fc唾液酸化抗体(包括单唾液酸化和双唾液酸化聚糖结构)。在一个实施方案中,该抗体群体包含相对频率至多97%的Fc唾液酸化抗体。在一个实施方案中,该抗体群体包含相对频率至多95%的Fc唾液酸化抗体。在一个实施方案中,该抗体群体包含相对频率至多90%的Fc唾液酸化抗体。在一个实施方案中,该抗体群体包含相对频率50%至90%的Fc唾液酸化抗体。在一个实施方案中,该抗体群体包含相对频率50%至80%的Fc唾液酸化抗体。
在一个实施方案中,该唾液酸化抗体包含NANA或NGNA作为唾液酸。在一个实施方案中,该唾液酸化抗体包含NANA作为唾液酸。在一个实施方案中,该唾液酸化抗体包含NANA作为唾液酸,且不包含NGNA。
在一个实施方案中,该抗体群体基本不包含含有二等分N乙酰葡糖胺分支的抗体。在一个实施方案中,基本不含不同糖残基的抗体群体以2%或更低的相对频率包含含有该不同糖残基的抗体。在一个实施方案中,基本不含不同糖残基的抗体群体以1%或更低的相对频率包含含有该不同糖残基的抗体。在一个实施方案中,基本不含不同糖残基的抗体群体以0.5%或更低的相对频率包含含有该不同糖残基的抗体。
在一个实施方案中,该抗体群体不包含含有二等分N乙酰葡糖胺分支的抗体。
在本发明的一个实施方案中,该抗体群体包含相对频率80-99.5%的Fc半乳糖基化抗体(包括单半乳糖基化和双半乳糖基化聚糖结构),相对频率低于20%的Fc无岩藻糖基化抗体,及可选的相对频率20-98%的Fc唾液酸化抗体(包括单唾液酸化和双唾液酸化聚糖结构)。在本发明的一个实施方案中,该抗体群体包含相对频率80-99.5%的Fc半乳糖基化抗体,相对频率低于20%的Fc无岩藻糖基化抗体,及可选的相对频率至多20-98%的Fc唾液酸化抗体,且该抗体群体不包含含有二等分N乙酰葡糖胺分支的抗体。
在本发明的一个实施方案中,该抗体群体包含相对频率80-99.5%的Fc半乳糖基化抗体(包括单半乳糖基化和双半乳糖基化聚糖结构),相对频率7-16%的Fc无岩藻糖基化抗体,及可选的相对频率20-90%的Fc唾液酸化抗体(包括单唾液酸化和双唾液酸化聚糖结构)。在本发明的一个实施方案中,该抗体群体包含相对频率80-99.5%的Fc半乳糖基化抗体,相对频率7-16%的Fc无岩藻糖基化抗体,及可选的相对频率20-90%的Fc唾液酸化抗体,且该抗体群体不包含含有二等分N乙酰葡糖胺分支的抗体。
在本发明的一个实施方案中,该抗体群体包含相对频率80%至95%的Fc双半乳糖基化抗体,相对频率低于20%的Fc无岩藻糖基化抗体,及可选的相对频率20-98%的Fc唾液酸化抗体(包括单唾液酸化和双唾液酸化聚糖结构)。在本发明的一个实施方案中,该抗体群体包含相对频率80%至95%的Fc双半乳糖基化抗体,相对频率低于20%的Fc无岩藻糖基化抗体,及可选的相对频率20-98%的Fc唾液酸化抗体(包括单唾液酸化和双唾液酸化聚糖结构),且该抗体群体不包含含有二等分N乙酰葡糖胺分支的抗体。
在一个实施方案中,该抗体群体包含相对频率80%至90%的Fc双半乳糖基化抗体,相对频率7-16%的Fc无岩藻糖基化抗体。在一个实施方案中,该抗体群体包含相对频率80%至90%的Fc双半乳糖基化抗体和相对频率7-16%的Fc无岩藻糖基化抗体,其中该抗体群体不包含含有二等分N乙酰葡糖胺分支的抗体。
在一个实施方案中,该抗体在定位于重链CH2结构域中294和300位(按照Kabat的EU指数的编号)之间的天冬酰胺残基处包含糖基化位点。在一个实施方案中,该抗体在定位于重链CH2结构域中的294和300位(按照Kabat的EU指数的编号)之间的天冬酰胺残基处包含糖基化位点,且不包含其他糖基化位点。
在本发明的一个实施方案中,该重组抗体在Fab区中不包含糖基化位点。在一个实施方案中,本发明的抗体在Fab区中不包含N连接聚糖的糖基化位点。在一个实施方案中,本发明的抗体的Fab区不包含以下氨基酸序列:Asn-X-Ser和Asn-X-Thr,其中X是除脯氨酸外的氨基酸,Ser是丝氨酸,Thr是苏氨酸。
在本发明的一个实施方案中,该抗体属于人IgG1同种型。在一个实施方案中,该抗体是人抗体。在一个实施方案中,该抗体是人源化抗体。在一个实施方案中,该抗体是嵌合鼠/人抗体。
在本发明的一个实施方案中,该抗体是全长IgG1抗体。在一个实施方案中,该抗体是单克隆抗体。在一个实施方案中,该抗体是单克隆全长人IgG1同种型抗体。
在本发明的一个实施方案中,该抗体属于含有突变L234A和L235A(按照Kabat的EU指数的编号)的人IgG1同种型。在本发明的一个实施方案中,该抗体属于含有突变L234A、L235A和P329G(按照Kabat的EU指数的编号)的人IgG1同种型。
在本发明的一个实施方案中,该重组IgG1抗体的作用方式是诱导ADCC。
在本发明的一个实施方案中,该抗体是单特异性抗体。
在本发明的一个实施方案中,该抗体是多特异性抗体。
在本发明的一个实施方案中,该抗体是二价或三价抗体。在本发明的一个实施方案中,该抗体是二价抗体。
在本发明的一个实施方案中,该抗体曲妥珠单抗、利妥昔单抗、帕妥珠单抗和obinutuzumab。
在一个实施方案中,该抗体特异性结合HER2。在一个实施方案中,该抗体特异性结合HER2,且包含SEQ ID NO:1的重链可变结构域和SEQ ID NO:2的轻链可变结构域。在一个实施方案中,该抗体是曲妥珠单抗。
在一个实施方案中,该抗体特异性结合CD20。在一个实施方案中,该抗体特异性结合CD20,且包含SEQ ID NO:3的重链可变结构域和SEQ ID NO:4的轻链可变结构域。在一个实施方案中,该抗体是利妥昔单抗。
在一个实施方案中,该抗体特异性结合HER2。在一个实施方案中,该抗体特异性结合HER2,且包含SEQ ID NO:5的重链可变结构域和SEQ ID NO:6的轻链可变结构域。在一个实施方案中,该抗体是pertuzumab。
在一个实施方案中,该抗体特异性结合CD20。在一个实施方案中,该抗体特异性结合CD20,且包含SEQ ID NO:7的重链可变结构域和SEQ ID NO:8的轻链可变结构域。在一个实施方案中,该抗体是obinutuzumab。
在本发明的一个实施方案中,该抗体是体外半乳糖改造的抗体。在本发明的一个实施方案中,该抗体是体内半乳糖改造的抗体。
b)方法
本发明的另一方面是用于产生半乳糖改造的重组抗体群体的方法,其包括步骤:
a)在包含编码抗体的核酸分子的宿主细胞中重组产生IgG1同种型抗体,以获得重组抗体群体;
b)遗传改造该宿主细胞以改善蛋白质半乳糖基化,使得获得该半乳糖改造的重组抗体群体,其包含相对频率至少70%的Fc双半乳糖基化抗体。
本发明的另一方面是用于产生半乳糖改造的重组抗体群体的方法,其包括步骤:
a)在包含编码抗体的核酸分子的宿主细胞中重组产生IgG1同种型抗体,以获得重组抗体群体;
b)遗传改造该宿主细胞以改善蛋白质半乳糖基化,使得获得该半乳糖改造的重组抗体群体,其包含相对频率至少80%的Fc双半乳糖基化抗体(包括单半乳糖基化和双半乳糖基化聚糖结构)。
本发明的另一方面是用于产生半乳糖改造的抗体群体的方法,其包括步骤:
a)在包含编码抗体的核酸分子的宿主细胞中重组产生IgG1同种型抗体,以获得重组抗体群体;
b)分离该重组抗体群体;
c)用半乳糖基转移酶酶处理该抗体群体,以获得该半乳糖改造的重组抗体群体,其包含相对频率至少80%的Fc双半乳糖基化抗体(包括单半乳糖基化和双半乳糖基化聚糖结构),随后从该酶分离该半乳糖改造的重组抗体群体。
本发明的另一方面是用于产生半乳糖改造的抗体群体的方法,其包括步骤:
a)在包含编码抗体的核酸分子的宿主细胞中重组产生IgG1同种型抗体,以获得重组抗体群体;
b)分离该重组抗体群体;
c)用半乳糖基转移酶酶处理该抗体群体,以获得该半乳糖改造的重组抗体群体,其包含相对频率至少70%的Fc双半乳糖基化抗体,随后从该酶分离该半乳糖改造的重组抗体群体。
在本发明的方法之一的一个实施方案中,该抗体群体包含相对频率低于20%的Fc无岩藻糖基化抗体。
因此,在一个实施方案中,本发明涉及用于产生上述半乳糖改造的重组抗体群体的方法,该半乳糖改造的重组抗体群体包含相对频率至少80%的Fc半乳糖基化抗体和相对频率低于20%的Fc无岩藻糖基化抗体。
在另一实施方案中,本发明涉及用于产生上述半乳糖改造的重组抗体群体的方法,该半乳糖改造的重组抗体群体包含相对频率至少70%的Fc双半乳糖基化抗体和相对频率低于20%的Fc无岩藻糖基化抗体。
以上方法适合用于产生包含高量的半乳糖基化尤其是双半乳糖基化的N连接聚糖结构的抗体群体。通过本发明的方法,包含IgG1分子的抗体群体介导ADCC的能力得到改善。在一个实施方案中,该IgG1分子与至少一种激活FcγR的结合得到改善。在一个实施方案中,该IgG1分子与FcγRIIIa的结合得到改善。在一个实施方案中,该IgG1分子与FcγRIIa的结合得到改善。
在一个实施方案中,该方法用于产生本发明的抗体。
在本发明的一个实施方案中,该半乳糖改造的重组抗体群体包含相对频率低于25%的Fc无半乳糖基化抗体。在本发明的一个实施方案中,该半乳糖改造的重组抗体群体包含至多100%的Fc半乳糖基化抗体。在一个实施方案中,该半乳糖改造的重组抗体群体包含相对频率至多99.5%的Fc半乳糖基化抗体。在一个实施方案中,该半乳糖改造的重组抗体群体包含相对频率至多95%的Fc半乳糖基化抗体。在一个实施方案中,该半乳糖改造的重组抗体群体包含相对频率至多90%的Fc半乳糖基化抗体。在一个实施方案中,该半乳糖改造的重组抗体群体包含相对频率80%至99.5%的Fc半乳糖基化抗体。
在本发明的一个实施方案中,该半乳糖改造的重组抗体群体包含相对频率至多98%的Fc双半乳糖基化抗体。在一个实施方案中,该半乳糖改造的重组抗体群体包含相对频率至多95%的Fc双半乳糖基化抗体。在一个实施方案中,该半乳糖改造的重组抗体群体包含相对频率至多90%的Fc双半乳糖基化抗体。在一个实施方案中,该半乳糖改造的重组抗体群体包含相对频率70%至95%的Fc双半乳糖基化抗体。在一个实施方案中,该半乳糖改造的重组抗体群体包含相对频率80%至95%的Fc双半乳糖基化抗体。在一个实施方案中,该半乳糖改造的重组抗体群体包含相对频率80%至90%的Fc双半乳糖基化抗体。
在本发明的方法之一的一个实施方案中,步骤a)中获得的重组抗体群体包含相对频率至多16%的Fc无岩藻糖基化抗体。在本发明的方法之一的一个实施方案中,步骤a)中获得的重组抗体群体包含相对频率至少2%的Fc无岩藻糖基化抗体。在一个实施方案中,步骤a)中获得的重组抗体群体包含相对频率至少5%的Fc无岩藻糖基化抗体。在一个实施方案中,步骤a)中获得的重组抗体群体包含相对频率至少7%的Fc无岩藻糖基化抗体。在一个实施方案中,步骤a)中获得的重组抗体群体包含相对频率至少8%的Fc无岩藻糖基化抗体。在一个实施方案中,步骤a)中获得的重组抗体群体包含相对频率低于16%的Fc无岩藻糖基化抗体。在一个实施方案中,步骤a)中获得的重组抗体群体包含相对频率2%至20%的Fc无岩藻糖基化抗体。在一个实施方案中,步骤a)中获得的重组抗体群体包含相对频率5%至15%的Fc无岩藻糖基化抗体。在一个实施方案中,步骤a)中获得的重组抗体群体包含相对频率7%至16%的Fc无岩藻糖基化抗体。在一个实施方案中,步骤a)中获得的重组抗体群体包含相对频率8%至12%的Fc无岩藻糖基化抗体。
在本发明的一个实施方案中,该重组抗体在Fab区中不包含糖基化位点。在一个实施方案中,本发明的抗体在Fab区中不包含N连接聚糖的糖基化位点。在一个实施方案中,本发明的抗体的Fab区不包含以下氨基酸序列:Asn-X-Ser和Asn-X-Thr,其中X是除脯氨酸外的氨基酸,Ser是丝氨酸,Thr是苏氨酸。
在本发明的方法之一的一个实施方案中,关于遗传改造宿主细胞以改善蛋白质半乳糖基化的步骤是通过在该宿主细胞中过量表达能够提高Fc双半乳糖基化抗体的相对频率的酶来进行。在本发明的方法之一的一个实施方案中,该能够提高Fc双半乳糖基化抗体的相对频率的酶是半乳糖基转移酶。在本发明的方法之一的一个实施方案中,该能够提高Fc双半乳糖基化抗体的相对频率的酶是β-(1-4)-半乳糖基转移酶。在本发明的方法之一的一个实施方案中,关于遗传改造宿主细胞以改善蛋白质半乳糖基化的步骤是通过在该宿主细胞中过量表达能够提高Fc双半乳糖基化抗体的相对频率的酶来进行。在本发明的方法之一的一个实施方案中,该能够提高Fc双半乳糖基化抗体的相对频率的酶是半乳糖基转移酶。在本发明的方法之一的一个实施方案中,该能够提高Fc双半乳糖基化抗体的相对频率的酶是β-(1-4)-半乳糖基转移酶。
在本发明的方法之一的一个实施方案中,关于遗传改造宿主细胞以改善蛋白质半乳糖基化的步骤是通过降低该宿主细胞中能够降低Fc双半乳糖基化抗体的相对频率的酶的表达或通过敲除该宿主细胞中能够降低Fc双半乳糖基化抗体的相对频率的酶来进行。在本发明的方法之一的一个实施方案中,该能够降低Fc双半乳糖基化抗体的相对频率的酶是半乳糖苷酶。在本发明的方法之一的一个实施方案中,该能够降低Fc双半乳糖基化抗体的相对频率的酶是β(1-4)-半乳糖苷酶。在本发明的方法之一的一个实施方案中,关于遗传改造宿主细胞以改善蛋白质半乳糖基化的步骤是通过降低该宿主细胞中能够降低Fc双半乳糖基化抗体的相对频率的酶的表达或通过敲除该宿主细胞中能够降低Fc双半乳糖基化抗体的相对频率的酶来进行。在本发明的方法之一的一个实施方案中,该能够降低Fc双半乳糖基化抗体的相对频率的酶是半乳糖苷酶。在本发明的方法之一的一个实施方案中,该能够降低Fc双半乳糖基化抗体的相对频率的酶是β(1-4)-半乳糖苷酶。
在本发明的方法之一的一个实施方案中,关于遗传改造宿主细胞以改善蛋白质半乳糖基化的步骤是通过在该宿主细胞中过量表达能够提高Fc半乳糖基化抗体的相对频率的酶来进行。在本发明的方法之一的一个实施方案中,该能够提高Fc半乳糖基化抗体的相对频率的酶是半乳糖基转移酶。在本发明的方法之一的一个实施方案中,该能够提高Fc半乳糖基化抗体的相对频率的酶是β-(1-4)-半乳糖基转移酶。在本发明的方法之一的一个实施方案中,关于遗传改造宿主细胞以改善蛋白质半乳糖基化的步骤是通过在该宿主细胞中过量表达能够提高Fc半乳糖基化抗体的相对频率的酶来进行。在本发明的方法之一的一个实施方案中,该能够提高Fc半乳糖基化抗体的相对频率的酶是半乳糖基转移酶。在本发明的方法之一的一个实施方案中,该能够提高Fc半乳糖基化抗体的相对频率的酶是β-(1-4)-半乳糖基转移酶。
在本发明的方法之一的一个实施方案中,关于遗传改造宿主细胞以改善蛋白质半乳糖基化的步骤是通过降低该宿主细胞中能够降低Fc半乳糖基化抗体的相对频率的酶的表达或通过敲除该宿主细胞中能够降低Fc半乳糖基化抗体的相对频率的酶来进行。在本发明的方法之一的一个实施方案中,该能够降低Fc半乳糖基化抗体的相对频率的酶是半乳糖苷酶。在本发明的方法之一的一个实施方案中,该能够降低Fc半乳糖基化抗体的相对频率的酶是β(1-4)-半乳糖苷酶。在本发明的方法之一的一个实施方案中,关于遗传改造宿主细胞以改善蛋白质半乳糖基化的步骤是通过降低该宿主细胞中能够降低Fc半乳糖基化抗体的相对频率的酶的表达或通过敲除该宿主细胞中能够降低Fc半乳糖基化抗体的相对频率的酶来进行。在本发明的方法之一的一个实施方案中,该能够降低Fc半乳糖基化抗体的相对频率的酶是半乳糖苷酶。在本发明的方法之一的一个实施方案中,该能够降低Fc半乳糖基化抗体的相对频率的酶是β(1-4)-半乳糖苷酶。
在本发明的方法之一的一个实施方案中,遗传改造宿主细胞以改善蛋白质半乳糖基化是通过标准分子生物学技术来进行。在一个实施方案中,可以通过选自同源重组、使用锌指核酸酶、RNA干扰(RNAi)和micro RNA(miRNA)的方法,来降低宿主细胞中能够降低Fc双半乳糖基化抗体的相对频率的酶的表达,或敲除宿主细胞中能够降低Fc双半乳糖基化抗体的相对频率的酶。在一个实施方案中,提高Fc双半乳糖基化抗体的相对频率可以通过生产工艺开发来进行。在一个实施方案中,提高Fc双半乳糖基化抗体的相对频率可以通过在细胞培养基中补充半乳糖来进行。在一个实施方案中,提高Fc双半乳糖基化抗体的相对频率可以通过在细胞培养基中补充谷氨酸来进行。在一个实施方案中,提高Fc双半乳糖基化抗体的相对频率可以通过在细胞培养基中用谷氨酸替代谷氨酰胺来进行。在一个实施方案中,提高Fc双半乳糖基化抗体的相对频率可以通过在细胞培养基中补充锰来进行。在一个实施方案中,在宿主细胞中过量表达能够提高Fc双半乳糖基化抗体的相对频率的酶可以通过用氨甲蝶呤选择压力产生稳定表达该酶的细胞系来进行。
在本发明的方法之一的一个实施方案中,遗传改造宿主细胞以改善蛋白质半乳糖基化是通过标准分子生物学技术来进行。在一个实施方案中,可以通过选自同源重组、使用锌指核酸酶、RNA干扰(RNAi)和micro RNA(miRNA)的方法,来降低宿主细胞中能够降低Fc半乳糖基化抗体的相对频率的酶的表达,或敲除宿主细胞中能够降低Fc半乳糖基化抗体的相对频率的酶。在一个实施方案中,提高Fc半乳糖基化抗体的相对频率可以通过生产工艺开发来进行。在一个实施方案中,提高Fc半乳糖基化抗体的相对频率可以通过在细胞培养基中补充半乳糖来进行。在一个实施方案中,提高Fc半乳糖基化抗体的相对频率可以通过在细胞培养基中补充谷氨酸来进行。在一个实施方案中,提高Fc半乳糖基化抗体的相对频率可以通过在细胞培养基中用谷氨酸替代谷氨酰胺来进行。在一个实施方案中,提高Fc半乳糖基化抗体的相对频率可以通过在细胞培养基中补充锰来进行。在一个实施方案中,在宿主细胞中过量表达能够提高Fc半乳糖基化抗体的相对频率的酶可以通过用氨甲蝶呤选择压力产生稳定表达该酶的细胞系来进行。
在本发明的方法之一的一个实施方案中,步骤c)的酶处理在30-38℃进行。在一个实施方案中,步骤c)的酶处理在31-38℃进行。在一个实施方案中,步骤c)的酶处理在31-35℃进行。在一个实施方案中,步骤c)的酶处理在约32℃进行。
在本发明的方法之一的一个实施方案中,步骤c)的酶处理在pH 6-7的溶液中进行。在一个实施方案中,步骤c)的酶处理在pH 6.3-6.8的溶液中进行。在一个实施方案中,步骤c)的酶处理在约pH 6.5的溶液中进行。
在本发明的方法之一的一个实施方案中,步骤c)的酶处理进行至少150分钟。在一个实施方案中,步骤c)的酶处理进行至少2小时。在一个实施方案中,步骤c)的酶处理进行至多150小时。在一个实施方案中,步骤c)的酶处理进行至少150分钟。
在本发明的方法之一的一个实施方案中,步骤c)涉及用半乳糖基转移酶在pH 6-7的溶液中,30-35℃下酶处理该抗体群体至少150分钟。在本发明的方法之一的一个实施方案中,步骤c)涉及用半乳糖基转移酶在pH 6.3-6.8的溶液中,31-34℃下酶处理该抗体群体至少150分钟。在本发明的方法之一的一个实施方案中,步骤c)涉及用半乳糖基转移酶在pH 6.3-6.8的溶液中,31-34℃下酶处理该抗体群体2-150小时。在本发明的方法之一的一个实施方案中,步骤c)涉及用半乳糖基转移酶在约pH 6.5的溶液中,约32℃下酶处理该抗体群体2-150小时。
在一个实施方案中,步骤c)在半乳糖基转移酶和UDP-半乳糖(尿苷二磷酸半乳糖)的存在下进行。在一个实施方案中,步骤c)在半乳糖基转移酶、UDP-半乳糖和MnCl2的存在下进行。
在一个实施方案中,该半乳糖基转移酶是能够将半乳糖从UDP-半乳糖转移至寡糖的N乙酰葡糖胺残基的β(1-4)-半乳糖基转移酶。
在本发明的方法之一的一个实施方案中,在宿主细胞中重组产生IgG1同种型抗体,其中未遗传改造宿主细胞来改善或削弱蛋白质岩藻糖基化。在一个实施方案中,在宿主细胞中产生抗体,其中宿主细胞不显示由宿主细胞的遗传改变引起的岩藻糖转移酶的表达改变(例如减少),且其中宿主细胞能够表达至少一部分岩藻糖基化蛋白质。
在本发明的方法之一的一个实施方案中,该宿主细胞是真核细胞。在一个实施方案中,该宿主细胞是CHO细胞或小鼠骨髓瘤细胞。在一个实施方案中,该宿主细胞是CHO细胞。在一个实施方案中,该宿主细胞未遗传改造来改善或削弱蛋白质岩藻糖基化的CHO细胞。在一个实施方案中,该宿主细胞是不显示由CHO细胞的遗传改变引起的岩藻糖转移酶的表达改变(例如减少)的CHO细胞,且其中该CHO细胞能够表达至少一部分岩藻糖基化蛋白质。
在一个实施方案中,该宿主细胞能够表达含有相对频率至多20%的Fc无岩藻糖基化抗体的抗体群体。在一个实施方案中,该宿主细胞能够表达含有相对频率至多16%的Fc无岩藻糖基化抗体的抗体群体。在一个实施方案中,该宿主细胞能够表达含有相对频率至少2%的Fc无岩藻糖基化抗体的抗体群体。在一个实施方案中,该宿主细胞能够表达含有相对频率至少5%的Fc无岩藻糖基化抗体的抗体群体。在一个实施方案中,该宿主细胞能够表达含有相对频率至少7%的Fc无岩藻糖基化抗体的抗体群体。在一个实施方案中,该宿主细胞能够表达含有相对频率至少8%的Fc无岩藻糖基化抗体的抗体群体。在一个实施方案中,该宿主细胞能够表达含有相对频率5%至20%的Fc无岩藻糖基化抗体的抗体群体。在一个实施方案中,该宿主细胞能够表达含有相对频率7%至16%的Fc无岩藻糖基化抗体的抗体群体。在一个实施方案中,该宿主细胞能够表达含有相对频率8%至12%的Fc无岩藻糖基化抗体的抗体群体。
在一个实施方案中,本发明的方法不包括从抗体的N连接聚糖结构体外加入或体外切割岩藻糖残基。在一个实施方案中,遗传改造宿主细胞以改善或削弱蛋白质岩藻糖基化,且本发明的方法不包括从抗体的N连接聚糖结构体外加入或体外切割岩藻糖残基。在一个实施方案中,宿主细胞是未遗传改造以改善或削弱蛋白质岩藻糖基化的CHO细胞,且本发明的方法不包括从抗体的N连接聚糖结构体外加入或体外切割岩藻糖残基。
因此,在本发明的方法之一的一个实施方案中,半乳糖改造的重组抗体群体包含相对频率80-99.5%的Fc半乳糖基化抗体(包括单半乳糖基化和双半乳糖基化聚糖结构)和相对频率低于20%的Fc无岩藻糖基化抗体。在一个实施方案中,半乳糖改造的重组抗体群体包含相对频率80-99.5%的Fc半乳糖基化抗体和相对频率低于20%的Fc无岩藻糖基化抗体,且该抗体群体不包含含有二等分N乙酰葡糖胺分支的抗体。
在本发明的一个实施方案中,半乳糖改造的重组抗体群体包含相对频率80-99.5%的Fc半乳糖基化抗体和相对频率7-16%的Fc无岩藻糖基化抗体。在一个实施方案中,半乳糖改造的重组抗体群体包含相对频率80-99.5%的Fc半乳糖基化抗体和相对频率7-16%的Fc无岩藻糖基化抗体,且该抗体群体不包含含有二等分N乙酰葡糖胺分支的抗体。
在本发明的一个实施方案中,半乳糖改造的重组抗体群体包含相对频率80%至95%的Fc双半乳糖基化抗体和相对频率低于20%的Fc无岩藻糖基化抗体。在本发明的一个实施方案中,半乳糖改造的重组抗体群体包含相对频率至多80%至95%的Fc双半乳糖基化抗体和相对频率低于20%的Fc无岩藻糖基化抗体,且该抗体群体不包含含有二等分N乙酰葡糖胺分支的抗体。
在一个实施方案中,半乳糖改造的重组抗体群体包含相对频率80%至95%的Fc双半乳糖基化抗体和相对频率7-16%的Fc无岩藻糖基化抗体。在一个实施方案中,半乳糖改造的重组抗体群体包含相对频率80%至90%的Fc双半乳糖基化抗体和相对频率7-16%的Fc无岩藻糖基化抗体,且该抗体群体不包含含有二等分N乙酰葡糖胺分支的抗体。
在本发明的方法的一个实施方案中,在CHO细胞中重组产生抗体,且半乳糖改造的重组抗体群体包含相对频率80-99.5%的Fc半乳糖基化抗体(包括单半乳糖基化和双半乳糖基化聚糖结构)和相对频率低于20%的Fc无岩藻糖基化抗体。在本发明的方法的一个实施方案中,在CHO细胞中重组产生抗体,且半乳糖改造的重组抗体群体包含相对频率80-99.5%的Fc半乳糖基化抗体和相对频率低于20%的Fc无岩藻糖基化抗体,且该抗体群体不包含含有二等分N乙酰葡糖胺分支的抗体。
在本发明的方法的一个实施方案中,在CHO细胞中重组产生抗体,且半乳糖改造的重组抗体群体包含相对频率80%至95%的Fc双半乳糖基化抗体和相对频率低于20%的Fc无岩藻糖基化抗体。在本发明的方法的一个实施方案中,在CHO细胞中重组产生抗体,且半乳糖改造的重组抗体群体包含相对频率至多80%至95%的Fc双半乳糖基化抗体和相对频率低于20%的Fc无岩藻糖基化抗体,且该抗体群体不包含含有二等分N乙酰葡糖胺分支的抗体。
在本发明的方法的一个实施方案中,在CHO细胞中重组产生抗体,且步骤c)涉及用半乳糖基转移酶在pH 6-7的溶液中,30-38℃下酶处理该抗体群体至少150分钟,由此使步骤c)中获得的抗体群体包含相对频率80-99.5%的Fc半乳糖基化抗体和相对频率低于20%的Fc无岩藻糖基化抗体,且该抗体群体不包含含有二等分N乙酰葡糖胺分支的抗体。
在本发明的方法的一个实施方案中,在CHO细胞中重组产生抗体,且步骤c)涉及用半乳糖基转移酶在pH 6-7的溶液中,30-38℃下酶处理该抗体群体至少150分钟,由此使步骤c)中获得的抗体群体包含相对频率至多80%至95%的Fc双半乳糖基化抗体和相对频率低于20%的Fc无岩藻糖基化抗体,且该抗体群体不包含含有二等分N乙酰葡糖胺分支的抗体。
在本发明的方法的一个实施方案中,在CHO细胞中重组产生抗体,且步骤c)涉及用半乳糖基转移酶在pH 6.3-6.8的溶液中,31-35℃下酶处理该抗体群体至少150分钟,由此使步骤c)中获得的抗体群体包含相对频率80-99.5%的Fc半乳糖基化抗体和相对频率低于20%的Fc无岩藻糖基化抗体,且该抗体群体不包含含有二等分N乙酰葡糖胺分支的抗体。
在本发明的方法的一个实施方案中,在CHO细胞中重组产生抗体,且步骤c)涉及用半乳糖基转移酶在pH 6.3-6.8的溶液中,31-35℃下酶处理该抗体群体至少150分钟,由此使步骤c)中获得的抗体群体包含相对频率至多80%至95%的Fc双半乳糖基化抗体和相对频率低于20%的Fc无岩藻糖基化抗体,且该抗体群体不包含含有二等分N乙酰葡糖胺分支的抗体。
在本发明的方法之一的一个实施方案中,对步骤c)中获得的抗体群体(其N连接聚糖结构为高半乳糖基化的)进行步骤d)用唾液酸转移酶进行酶处理,以获得包含相对频率至多98%的Fc唾液酸化抗体(包括单唾液酸化和双唾液酸化聚糖结构)的抗体群体,随后从该唾液酸转移酶分离唾液酸化抗体群体。
步骤d)有利于产生包含高相对频率的唾液酸化IgG1分子的抗体群体。通过用CMP-NANA(胞苷-5’-单磷酸-N-乙酰神经氨酸)作为活化糖,可以有利地产生仅包含NANA残基的同质群体。
在一个实施方案中,唾液酸转移酶处理在35-40℃进行。在一个实施方案中,唾液酸转移酶处理在36-38℃进行。在一个实施方案中,唾液酸转移酶处理在约37℃进行。
在一个实施方案中,唾液酸转移酶处理在pH 6-9的溶液中进行。在一个实施方案中,唾液酸转移酶处理在pH 6.5-8.5的溶液中进行。在一个实施方案中,唾液酸转移酶处理在约pH 7至约pH 8的溶液中进行。
在一个实施方案中,唾液酸转移酶处理进行至少150分钟。在一个实施方案中,唾液酸转移酶处理进行至少2小时。在一个实施方案中,唾液酸转移酶处理进行至2-120小时。
在一个实施方案中,唾液酸转移酶处理按以下条件进行:
i)在第一步中,使唾液酸转移酶和在本发明的方法之一的步骤c)中获得的抗体群体在上文所示温度下在pH 6-8(在一个实施方案中为pH 6.5-7.5)的溶液中接触至少150分钟(在一个实施方案中为2-80小时);和
ii)可选地,在第二步中,使唾液酸转移酶和步骤i)中获得的抗体群体在上文所示温度下在溶液中接触至少150分钟(在一个实施方案中为2至10小时)。
通过包括步骤i)的唾液酸转移酶处理,可以获得具有高相对频率的单唾液酸化N连接聚糖结构的抗体群体。因此,在一个实施方案中,唾液酸转移酶处理包括步骤(i)(或由步骤i)组成)。包括上文所示步骤ii)的另一处理导致产生具有高相对频率的双唾液酸化N连接聚糖结构的抗体群体。因此,在一个实施方案中,唾液酸转移酶处理包括步骤i)和ii)。
在一个实施方案中,步骤i)或可选地步骤i)和ii)中所示的唾液酸转移酶处理进行总计至多120小时的时间。
在一个实施方案中,步骤d)在唾液酸转移酶和CMP-NANA的存在下进行。
在一个实施方案中,该唾液酸转移酶是能够将唾液酸(NANA)从CMP-NANA转移至寡糖的末端半乳糖残基的α(2-6)-唾液酸转移酶。在一个实施方案中,该唾液酸转移酶是能够将唾液酸(NANA)从CMP-NANA转移至寡糖的末端半乳糖残基的α(2-3)-唾液酸转移酶。
在一个实施方案中,步骤i)用包含氨基酸序列SEQ ID NO:10的α(2-6)-唾液酸转移酶进行。在一个实施方案中,步骤ii)用包含氨基酸序列SEQ ID NO:9的α(2-6)-唾液酸转移酶进行。在一个实施方案中,该方法包括步骤i)和ii),且步骤i)用包含氨基酸序列SEQ ID NO:10的α(2-6)-唾液酸转移酶进行,步骤ii)用包含氨基酸序列SEQ ID NO:9的α(2-6)-唾液酸转移酶进行。
在本发明的一个实施方案中,步骤d)中获得的抗体群体包含相对频率至多97%的Fc唾液酸化抗体。在一个实施方案中,步骤d)中获得的抗体群体包含相对频率至多95%的Fc唾液酸化抗体。在一个实施方案中,步骤d)中获得的抗体群体包含相对频率至多90%的Fc唾液酸化抗体。在一个实施方案中,步骤d)中获得的抗体群体包含相对频率50%至90%的Fc唾液酸化抗体。在一个实施方案中,步骤d)中获得的抗体群体包含相对频率50%至80%的Fc唾液酸化抗体。
在一个实施方案中,该唾液酸是5-N-乙酰神经氨酸(NANA)或5-N-羟乙酰神经氨酸(NGNA)。在一个实施方案中,该唾液酸是NANA。在一个实施方案中,该唾液酸是NGNA。
在本发明的方法的一个实施方案中,步骤d)中获得的抗体群体包含相对频率80-99.5%的Fc半乳糖基化抗体、相对频率低于20%的的Fc无岩藻糖基化抗体和相对频率70%至90%的Fc唾液酸化抗体。在本发明的方法的一个实施方案中,在CHO细胞中重组产生抗体,且步骤d)中获得的抗体群体包含相对频率80-99.5%的Fc半乳糖基化抗体、相对频率低于20%的的Fc无岩藻糖基化抗体和相对频率50%至90%的Fc唾液酸化抗体,其中该抗体群体不包含含有二等分N乙酰葡糖胺分支的抗体。
在本发明的方法的一个实施方案中,步骤d)中获得的抗体群体包含相对频率80-99.5%的Fc半乳糖基化抗体、相对频率7-16%的的Fc无岩藻糖基化抗体和相对频率50%至90%的Fc唾液酸化抗体。在本发明的方法的一个实施方案中,在CHO细胞中重组产生抗体,且步骤d)中获得的抗体群体包含相对频率80-99.5%的Fc半乳糖基化抗体、相对频率7-16%的的Fc无岩藻糖基化抗体和相对频率50%至90%的Fc唾液酸化抗体,其中该抗体群体不包含含有二等分N乙酰葡糖胺分支的抗体。
在本发明的方法的一个实施方案中,步骤d)中获得的抗体群体包含相对频率80%至95%的Fc双半乳糖基化抗体、相对频率低于20%的Fc无岩藻糖基化抗体和相对频率50%至90%的Fc唾液酸化抗体。在本发明的方法的一个实施方案中,步骤d)中获得的抗体群体包含相对频率80%至95%的Fc双半乳糖基化抗体、相对频率低于20%的Fc无岩藻糖基化抗体和相对频率50%至90%的Fc唾液酸化抗体,其中该抗体群体不包含含有二等分N乙酰葡糖胺分支的抗体。
在本发明的方法的一个实施方案中,步骤d)中获得的抗体群体包含相对频率80%至90%的Fc双半乳糖基化抗体、相对频率7-16%的Fc无岩藻糖基化抗体和相对频率50%至90%的Fc唾液酸化抗体。在本发明的方法的一个实施方案中,步骤d)中获得的抗体群体包含相对频率80%至90%的Fc双半乳糖基化抗体、相对频率7-16%的Fc无岩藻糖基化抗体和相对频率50%至90%的Fc唾液酸化抗体,其中该抗体群体不包含含有二等分N乙酰葡糖胺分支的抗体。
在本发明的方法的一个实施方案中,在CHO细胞中重组产生抗体,且半乳糖改造的重组抗体群体包含相对频率80-99.5%的Fc半乳糖基化抗体(包括单半乳糖基化和双半乳糖基化聚糖结构)、相对频率低于20%的的Fc无岩藻糖基化抗体和相对频率50%至90%的Fc唾液酸化抗体。在本发明的方法的一个实施方案中,在CHO细胞中重组产生抗体,且半乳糖改造的重组抗体群体包含相对频率80-99.5%的Fc半乳糖基化抗体、相对频率低于20%的的Fc无岩藻糖基化抗体和相对频率50%至90%的Fc唾液酸化抗体,且该抗体群体不包含含有二等分N乙酰葡糖胺分支的抗体。
在本发明的方法的一个实施方案中,在CHO细胞中重组产生抗体,且半乳糖改造的重组抗体群体包含相对频率80%至95%的Fc双半乳糖基化抗体、相对频率低于20%的的Fc无岩藻糖基化抗体和相对频率50%至90%的Fc唾液酸化抗体。在本发明的方法的一个实施方案中,在CHO细胞中重组产生抗体,且半乳糖改造的重组抗体群体包含相对频率80%至95%的Fc双半乳糖基化抗体、相对频率低于20%的的Fc无岩藻糖基化抗体和相对频率50%至90%的Fc唾液酸化抗体,且该抗体群体不包含含有二等分N乙酰葡糖胺分支的抗体。
在本发明的方法的一个实施方案中,在CHO细胞中重组产生抗体,且步骤c)涉及用半乳糖基转移酶在pH 6-7的溶液中,30-38℃下酶处理该抗体群体至少150分钟,由此使步骤c)中获得的抗体群体包含相对频率80-99.5%的Fc半乳糖基化抗体、相对频率低于20%的Fc无岩藻糖基化抗体和相对频率50%至90%的Fc唾液酸化抗体,且该抗体群体不包含含有二等分N乙酰葡糖胺分支的抗体。
在本发明的方法的一个实施方案中,在CHO细胞中重组产生抗体,且步骤c)涉及用半乳糖基转移酶在pH 6-7的溶液中,30-38℃下酶处理该抗体群体至少150分钟,由此使步骤c)中获得的抗体群体包含相对频率至多80%至95%的Fc双半乳糖基化抗体、相对频率低于20%的Fc无岩藻糖基化抗体和相对频率50%至90%的Fc唾液酸化抗体,且该抗体群体不包含含有二等分N乙酰葡糖胺分支的抗体。
在本发明的方法的一个实施方案中,在CHO细胞中重组产生抗体,且步骤c)涉及用半乳糖基转移酶在pH 6.3-6.8的溶液中,31-35℃下酶处理该抗体群体至少150分钟,由此使步骤c)中获得的抗体群体包含相对频率80-99.5%的Fc半乳糖基化抗体、相对频率低于20%的Fc无岩藻糖基化抗体和相对频率50%至90%的Fc唾液酸化抗体,且该抗体群体不包含含有二等分N乙酰葡糖胺分支的抗体。
在本发明的方法的一个实施方案中,在CHO细胞中重组产生抗体,且步骤c)涉及用半乳糖基转移酶在pH 6.3-6.8的溶液中,31-35℃下酶处理该抗体群体至少150分钟,由此使步骤c)中获得的抗体群体包含相对频率至多80%至95%的Fc双半乳糖基化抗体、相对频率低于20%的Fc无岩藻糖基化抗体和相对频率50%至90%的Fc唾液酸化抗体,且该抗体群体不包含含有二等分N乙酰葡糖胺分支的抗体。
在本发明的方法的一个实施方案中,在CHO细胞中重组产生抗体,且步骤c)涉及用半乳糖基转移酶在pH 6-7的溶液中,30-38℃下酶处理该抗体群体至少150分钟,且按以下条件进行唾液酸转移酶处理:
i)使唾液酸转移酶和步骤c)中获得的抗体群体在上文所示温度下在pH 6-8(在一个实施方案中为pH 6.5-7.5)的溶液中接触至少150分钟(在一个实施方案中为2-120小时)。
在本发明的方法的一个实施方案中,在CHO细胞中重组产生抗体,且步骤c)涉及用半乳糖基转移酶在pH 6.3-6.8的溶液中,31-35℃下酶处理该抗体群体至少150分钟,且按以下条件进行唾液酸转移酶处理:
i)在第一步中,使唾液酸转移酶和步骤c)中获得的抗体群体在上文所示温度下在pH 6-8(在一个实施方案中为pH 6.5-7.5)的溶液中接触至少150分钟(在一个实施方案中为2-120小时);和
ii)在第二步中,使唾液酸转移酶和步骤i)中获得的抗体群体在上文所示温度下在pH 6-8的溶液中再接触至少150分钟(在一个实施方案中为2至10小时)。
在一个实施方案中,本发明的方法涵盖向包含在进行半乳糖改造的抗体群体内的至少一部分抗体加入至少一个半乳糖残基。在一个实施方案中,本发明的方法涵盖向包含在进行半乳糖改造的抗体群体内的至少一部分抗体加入至少一个半乳糖残基,以达到相对频率至少80%的Fc半乳糖基化抗体。在一个实施方案中,本发明的方法涵盖向包含在进行半乳糖改造的抗体群体内的至少一部分抗体加入至少一个半乳糖残基,以达到相对频率至少70%的Fc双半乳糖基化抗体。
在本发明的方法的一个实施方案中,该抗体选自曲妥珠单抗、利妥昔单抗、帕妥珠单抗和obinutuzumab。本发明的另一方面是通过本发明的方法获得的半乳糖改造的重组IgG1抗体群体。
c)药物组合物、治疗
本发明的另一方面是包含本发明的半乳糖改造的重组IgG1同种型抗体群体的药物组合物。本发明的一方面是与至少一种可药用载体组合包含本发明的半乳糖改造的重组IgG1同种型抗体群体的药物组合物。
本发明的另一方面是本发明的药物组合物用作药物。本发明的另一方面是本发明的药物组合物用于治疗癌症。本发明的另一方面是本发明的药物组合物用于治疗炎性障碍。本发明的另一方面是本发明的药物组合物用于治疗自身免疫障碍。
本发明的另一方面是通过对需要这种治疗的患者施用本发明的半乳糖改造的重组IgG1同种型抗体来治疗患有疾病的患者的方法。本发明的另一方面是通过对需要这种治疗的患者施用本发明的半乳糖改造的重组IgG1同种型抗体来治疗患有癌症疾病的患者的方法。本发明的另一方面是通过对需要这种治疗的患者施用本发明的半乳糖改造的重组IgG1同种型抗体来治疗患有炎性障碍的患者的方法。本发明的另一方面是通过对需要这种治疗的患者施用本发明的半乳糖改造的重组IgG1同种型抗体来治疗患有自身免疫障碍的患者的方法。
本发明的另一方面是通过对需要这种治疗的患者施用本发明的药物组合物来治疗患有疾病的患者的方法。本发明的另一方面是通过对需要这种治疗的患者施用本发明的药物组合物来治疗患有癌症的患者的方法。本发明的另一方面是通过对需要这种治疗的患者施用本发明的药物组合物来治疗患有炎性障碍的患者的方法。本发明的另一方面是通过对需要这种治疗的患者施用本发明的药物组合物来治疗患有自身免疫障碍的患者的方法。
d)本发明的抗体的用途和方法
本发明的另一方面是本发明的方法在改善由该重组IgG1同种型抗体群体介导的ADCC中的用途。
本发明的另一方面是本发明的方法在改善重组抗体与FcγRIIa和FcγRIIIa的结合亲和力中的用途。
本发明的另一方面是本发明的半乳糖改造的重组抗体群体在介导ADCC中的用途。本发明的另一方面是本发明的半乳糖改造的重组抗体群体在招募和/或激活天然杀伤细胞中的用途。本发明的另一方面是本发明的半乳糖改造的重组抗体群体在激活包含FcγR的效应细胞中的用途。
本发明的另一方面是本发明的半乳糖改造的重组抗体群体用作药物。本发明的另一方面是本发明的半乳糖改造的重组抗体群体用于治疗癌症。本发明的另一方面是本发明的半乳糖改造的重组抗体群体用于治疗炎性障碍。本发明的另一方面是本发明的半乳糖改造的重组抗体群体用于治疗自身免疫障碍。
3.本发明的具体实施方案
以下项目进一步提供本公开的具体方面和实施本文提供的教导的具体实施方案。
1.半乳糖改造的重组IgG1同种型抗体群体,其包含相对频率至少70%的Fc双半乳糖基化抗体和相对频率低于20%的Fc无岩藻糖基化抗体。
2.实施方案1的抗体群体,其包含相对频率80-95%的Fc双半乳糖基化抗体和相对频率低于20%的Fc无岩藻糖基化抗体。
3.实施方案1的抗体群体,其包含相对频率80-95%的Fc双半乳糖基化抗体和相对频率7-16%的Fc无岩藻糖基化抗体。
4.实施方案1的抗体群体,其包含相对频率80-95%的Fc双半乳糖基化抗体、相对频率低于20%的Fc无岩藻糖基化抗体和相对频率50%至90%的Fc唾液酸化抗体。
5.实施方案1的抗体群体,其包含相对频率80-95%的Fc双半乳糖基化抗体、相对频率7-16%的Fc无岩藻糖基化抗体和相对频率50%至90%的Fc唾液酸化抗体。
6.实施方案1至5中任一个的抗体群体,其中抗体群体不包含含有二等分N乙酰葡糖胺分支的抗体。
7.实施方案1至6中任一个的抗体群体,其中抗体的Fab区不包含以下氨基酸序列:Asn-X-Ser和Asn-X-Thr,其中X是除脯氨酸外的氨基酸,Ser是丝氨酸,Thr是苏氨酸。
8.实施方案1至7中任一个的抗体群体,其中抗体是单克隆全长人IgG1同种型抗体。
9.实施方案1至7中任一个的抗体群体,其中抗体是人源化抗体。
10.实施方案1至7中任一个的抗体群体,其中抗体选自曲妥珠单抗、利妥昔单抗、帕妥珠单抗和obinutuzumab。
11.实施方案1至10中任一个的抗体群体,其中抗体是体外半乳糖改造的重组抗体。
12.实施方案1至10中任一个的抗体群体,其中抗体是体内半乳糖改造的重组抗体。
13.半乳糖改造的重组IgG1同种型抗体群体,其包含相对频率至少80%的Fc半乳糖基化抗体和相对频率低于20%的Fc无岩藻糖基化抗体。
14.实施方案13的抗体群体,其包含相对频率80-99.5%的Fc半乳糖基化抗体和相对频率低于20%的Fc无岩藻糖基化抗体。
15.实施方案13的抗体群体,其包含相对频率80-99.5%的Fc半乳糖基化抗体和相对频率7-16%的Fc无岩藻糖基化抗体。
16.实施方案13的抗体群体,其包含相对频率80-99.5%的Fc半乳糖基化抗体、相对频率低于20%的Fc无岩藻糖基化抗体和相对频率50%至90%的Fc唾液酸化抗体。
17.实施方案13的抗体群体,其包含相对频率80-99.5%的Fc半乳糖基化抗体、相对频率低于7-16%的Fc无岩藻糖基化抗体和相对频率50%至90%的Fc唾液酸化抗体。
18.实施方案13至17中任一个的抗体群体,其中抗体群体不包含含有二等分N乙酰葡糖胺分支的抗体。
19.实施方案13至18中任一个的抗体群体,其中抗体的Fab区不包含以下氨基酸序列:Asn-X-Ser和Asn-X-Thr,其中X是除脯氨酸外的氨基酸,Ser是丝氨酸,Thr是苏氨酸。
20.实施方案13至19中任一个的抗体群体,其中抗体是单克隆全长人IgG1同种型抗体。
21.实施方案13至20中任一个的抗体群体,其中抗体是人源化抗体。
22.实施方案13至21中任一个的抗体群体,其中抗体选自曲妥珠单抗、利妥昔单抗、帕妥珠单抗和obinutuzumab。
23.实施方案13至21中任一个的抗体群体,其中抗体是体外半乳糖改造的重组抗体。
24.实施方案13至21中任一个的抗体群体,其中抗体是体内半乳糖改造的重组抗体。
25.半乳糖改造的重组IgG1同种型抗体群体,其中抗体特异性结合HER2且包含SEQ ID NO:1的重链可变结构域和SEQ ID NO:2的轻链可变结构域,其包含相对频率至少70%的Fc双半乳糖基化抗体和相对频率低于20%的Fc无岩藻糖基化抗体。
26.半乳糖改造的重组IgG1同种型抗体群体,其中抗体特异性结合CD20且包含SEQ ID NO:3的重链可变结构域和SEQ ID NO:4的轻链可变结构域,其包含相对频率至少70%的Fc双半乳糖基化抗体和相对频率低于20%的Fc无岩藻糖基化抗体。
27.半乳糖改造的重组IgG1同种型抗体群体,其中抗体特异性结合HER2且包含SEQ ID NO:5的重链可变结构域和SEQ ID NO:6的轻链可变结构域,其包含相对频率至少70%的Fc双半乳糖基化抗体和相对频率低于20%的Fc无岩藻糖基化抗体。
28.半乳糖改造的重组IgG1同种型抗体群体,其中抗体特异性结合CD20且包含SEQ ID NO:7的重链可变结构域和SEQ ID NO:8的轻链可变结构域,其包含相对频率至少70%的Fc双半乳糖基化抗体和相对频率低于20%的Fc无岩藻糖基化抗体。
29.实施方案25至28中任一个的抗体群体,其包含相对频率80-95%的Fc双半乳糖基化抗体和相对频率低于20%的Fc无岩藻糖基化抗体。
30.实施方案25至28中任一个的抗体群体,其包含相对频率80-95%的Fc双半乳糖基化抗体和相对频率7-16%的Fc无岩藻糖基化抗体。
31.实施方案25至28中任一个的抗体群体,其包含相对频率80-95%的Fc双半乳糖基化抗体、相对频率低于20%的Fc无岩藻糖基化抗体和相对频率50%至90%的Fc唾液酸化抗体。
32.实施方案25至28中任一个的抗体群体,其包含相对频率80-95%的Fc双半乳糖基化抗体、相对频率7-16%的Fc无岩藻糖基化抗体和相对频率50%至90%的Fc唾液酸化抗体。
33.实施方案25至32中任一个的抗体群体,其中抗体群体不包含含有二等分N乙酰葡糖胺分支的抗体。
34.实施方案25至33中任一个的抗体群体,其中抗体的Fab区不包含以下氨基酸序列:Asn-X-Ser和Asn-X-Thr,其中X是除脯氨酸外的氨基酸,Ser是丝氨酸,Thr是苏氨酸。
35.实施方案25至34中任一个的抗体群体,其中抗体是单克隆全长人IgG1同种型抗体。
36.实施方案25至35中任一个的抗体群体,其中抗体是人源化抗体。
37.实施方案25至36中任一个的抗体群体,其中抗体是体外半乳糖改造的重组抗体。
38.实施方案25至36中任一个的抗体群体,其中抗体是体内半乳糖改造的重组抗体。
39.半乳糖改造的重组IgG1同种型抗体群体,其中抗体特异性结合HER2且包含SEQ ID NO:1的重链可变结构域和SEQ ID NO:2的轻链可变结构域,其包含相对频率至少80%的Fc半乳糖基化抗体和相对频率低于20%的Fc无岩藻糖基化抗体。
40.半乳糖改造的重组IgG1同种型抗体群体,其中抗体特异性结合CD20且包含SEQ ID NO:3的重链可变结构域和SEQ ID NO:4的轻链可变结构域,其包含相对频率至少80%的Fc半乳糖基化抗体和相对频率低于20%的Fc无岩藻糖基化抗体。
41.半乳糖改造的重组IgG1同种型抗体群体,其中抗体特异性结合HER2且包含SEQ ID NO:5的重链可变结构域和SEQ ID NO:6的轻链可变结构域,其包含相对频率至少80%的Fc半乳糖基化抗体和相对频率低于20%的Fc无岩藻糖基化抗体。
42.半乳糖改造的重组IgG1同种型抗体群体,其中抗体特异性结合CD20且包含SEQ ID NO:7的重链可变结构域和SEQ ID NO:8的轻链可变结构域,其包含相对频率至少80%的Fc半乳糖基化抗体和相对频率低于20%的Fc无岩藻糖基化抗体。
43.实施方案39至42中任一个的抗体群体,其包含相对频率80-99.5%的Fc半乳糖基化抗体和相对频率低于20%的Fc无岩藻糖基化抗体。
44.实施方案39至42中任一个的抗体群体,其包含相对频率80-99.5%的Fc半乳糖基化抗体和相对频率7-16%的Fc无岩藻糖基化抗体。
45.实施方案39至42中任一个的抗体群体,其包含相对频率80-99.5%的Fc半乳糖基化抗体、相对频率低于20%的Fc无岩藻糖基化抗体和相对频率50%至90%的Fc唾液酸化抗体。
46.实施方案39至42中任一个的抗体群体,其包含相对频率80-99.5%的Fc半乳糖基化抗体、相对频率7-16%的Fc无岩藻糖基化抗体和相对频率50%至90%的Fc唾液酸化抗体。
47.实施方案39至46中任一个的抗体群体,其中抗体群体不包含含有二等分N乙酰葡糖胺分支的抗体。
48.实施方案39至47中任一个的抗体群体,其中抗体的Fab区不包含以下氨基酸序列:Asn-X-Ser和Asn-X-Thr,其中X是除脯氨酸外的氨基酸,Ser是丝氨酸,Thr是苏氨酸。
49.实施方案39至48中任一个的抗体群体,其中抗体是单克隆全长人IgG1同种型抗体。
50.实施方案39至49中任一个的抗体群体,其中抗体是人源化抗体。
51.实施方案39至50中任一个的抗体群体,其中抗体是体外半乳糖改造的重组抗体。
52.实施方案39至50中任一个的抗体群体,其中抗体是体内半乳糖改造的重组抗体。
53.半乳糖改造的曲妥珠单抗群体,其包含相对频率至少70%的Fc双半乳糖基化抗体和相对频率低于20%的Fc无岩藻糖基化抗体。
54.半乳糖改造的利妥昔单抗群体,其包含相对频率至少70%的Fc双半乳糖基化抗体和相对频率低于20%的Fc无岩藻糖基化抗体。
55.半乳糖改造的帕妥珠单抗群体,其包含相对频率至少70%的Fc双半乳糖基化抗体和相对频率低于20%的Fc无岩藻糖基化抗体。
56.半乳糖改造的obinutuzumab群体,其包含相对频率至少70%的Fc双半乳糖基化抗体和相对频率低于20%的Fc无岩藻糖基化抗体。
57.实施方案53至56中任一个的抗体群体,其包含相对频率80-95%的Fc双半乳糖基化抗体和相对频率低于20%的Fc无岩藻糖基化抗体。
58.实施方案53至56中任一个的抗体群体,其包含相对频率80-95%的Fc双半乳糖基化抗体和相对频率7-16%的Fc无岩藻糖基化抗体。
59.实施方案53至56中任一个的抗体群体,其包含相对频率80-95%的Fc双半乳糖基化抗体、相对频率低于20%的Fc无岩藻糖基化抗体和相对频率50%至90%的Fc唾液酸化抗体。
60.实施方案53至56中任一个的抗体群体,其包含相对频率80-95%的Fc双半乳糖基化抗体、相对频率7-16%的Fc无岩藻糖基化抗体和相对频率50%至90%的Fc唾液酸化抗体。
61.实施方案53至60中任一个的抗体群体,其中抗体群体不包含含有二等分N乙酰葡糖胺分支的抗体。
62.半乳糖改造的曲妥珠单抗群体,其包含相对频率至少80%的Fc半乳糖基化抗体和相对频率低于20%的Fc无岩藻糖基化抗体。
63.半乳糖改造的利妥昔单抗群体,其包含相对频率至少80%的Fc半乳糖基化抗体和相对频率低于20%的Fc无岩藻糖基化抗体。
64.半乳糖改造的帕妥珠单抗群体,其包含相对频率至少80%的Fc半乳糖基化抗体和相对频率低于20%的Fc无岩藻糖基化抗体。
65.半乳糖改造的obinutuzumab群体,其包含相对频率至少80%的Fc半乳糖基化抗体和相对频率低于20%的Fc无岩藻糖基化抗体。
66.实施方案62至65中任一个的抗体群体,其包含相对频率80-99.5%的Fc半乳糖基化抗体和相对频率低于20%的Fc无岩藻糖基化抗体。
67.实施方案62至65中任一个的抗体群体,其包含相对频率80-99.5%的Fc半乳糖基化抗体和相对频率7-16%的Fc无岩藻糖基化抗体。
68.实施方案62至65中任一个的抗体群体,其包含相对频率80-99.5%的Fc半乳糖基化抗体、相对频率低于20%的Fc无岩藻糖基化抗体和相对频率50%至90%的Fc唾液酸化抗体。
69.实施方案62至65中任一个的抗体群体,其包含相对频率80-99.5%的Fc半乳糖基化抗体、相对频率7-16%的Fc无岩藻糖基化抗体和相对频率50%至90%的Fc唾液酸化抗体。
70.实施方案62至69中任一个的抗体群体,其中抗体群体不包含含有二等分N乙酰葡糖胺分支的抗体。
71.用于产生半乳糖改造的重组抗体群体的方法,其包括步骤:
a)在包含编码抗体的核酸分子的宿主细胞中重组产生IgG1同种型抗体,以获得重组抗体群体;
b)遗传改造该宿主细胞以改善蛋白质半乳糖基化,使得获得该半乳糖改造的重组抗体群体,其包含相对频率至少70%的Fc双半乳糖基化抗体和相对频率低于20%的Fc无岩藻糖基化抗体。
72.实施方案71的方法,其中该半乳糖改造的重组抗体群体包含相对频率80-95%的Fc双半乳糖基化抗体和相对频率低于20%的Fc无岩藻糖基化抗体。
73.实施方案71的方法,其中该半乳糖改造的重组抗体群体包含相对频率80-95%的Fc双半乳糖基化抗体和相对频率7-16%的Fc无岩藻糖基化抗体。
74.实施方案71的方法,其中该半乳糖改造的重组抗体群体包含相对频率80-95%的Fc双半乳糖基化抗体、相对频率低于20%的Fc无岩藻糖基化抗体和相对频率50%至90%的Fc唾液酸化抗体。
75.实施方案71的方法,其中该半乳糖改造的重组抗体群体包含相对频率80-95%的Fc双半乳糖基化抗体、相对频率7-16%的Fc无岩藻糖基化抗体和相对频率50%至90%的Fc唾液酸化抗体。
76.实施方案71至75中任一个的方法,其中该半乳糖改造的重组抗体群体不包含含有二等分N乙酰葡糖胺分支的抗体。
77.实施方案71至76中任一个的方法,其中抗体的Fab区不包含以下氨基酸序列:Asn-X-Ser和Asn-X-Thr,其中X是除脯氨酸外的氨基酸,Ser是丝氨酸,Thr是苏氨酸。
78.实施方案71至77中任一个的方法,其中抗体是单克隆全长人IgG1同种型抗体。
79.实施方案71至78中任一个的方法,其中抗体是人源化抗体。
80.实施方案71至79中任一个的方法,其中抗体是体内半乳糖改造的抗体。
81.实施方案71至80中任一个的方法,其中抗体选自曲妥珠单抗、利妥昔单抗、帕妥珠单抗和obinutuzumab。
82.实施方案71至81中任一个的方法,其中宿主细胞是真核细胞。
83.实施方案71至81中任一个的方法,其中宿主细胞是CHO细胞。
84.实施方案71至83中任一个的方法,其中未遗传改造宿主细胞以改善或削弱蛋白质岩藻糖基化,且该方法不包括从抗体的N连接聚糖结构体内加入或体内切割岩藻糖残基。
85.用于产生半乳糖改造的重组抗体群体的方法,其包括步骤:
a)在包含编码抗体的核酸分子的宿主细胞中重组产生IgG1同种型抗体,以获得重组抗体群体;
b)遗传改造该宿主细胞以改善蛋白质半乳糖基化,使得获得该半乳糖改造的重组抗体群体,其包含相对频率至少80%的Fc半乳糖基化抗体和相对频率低于20%的Fc无岩藻糖基化抗体。
86.实施方案85的方法,其中该半乳糖改造的重组抗体群体包含相对频率80-95%的Fc双半乳糖基化抗体和相对频率低于20%的Fc无岩藻糖基化抗体。
87.实施方案85的方法,其中该半乳糖改造的重组抗体群体包含相对频率80-95%的Fc双半乳糖基化抗体和相对频率7-16%的Fc无岩藻糖基化抗体。
88.实施方案85的方法,其中该半乳糖改造的重组抗体群体包含相对频率80-95%的Fc双半乳糖基化抗体、相对频率低于20%的Fc无岩藻糖基化抗体和相对频率50%至90%的Fc唾液酸化抗体。
89.实施方案85的方法,其中该半乳糖改造的重组抗体群体包含相对频率80-95%的Fc双半乳糖基化抗体、相对频率7-16%的Fc无岩藻糖基化抗体和相对频率50%至90%的Fc唾液酸化抗体。
90.实施方案85至89中任一个的方法,其中该半乳糖改造的重组抗体群体不包含含有二等分N乙酰葡糖胺分支的抗体。
91.实施方案85至90中任一个的方法,其中抗体的Fab区不包含以下氨基酸序列:Asn-X-Ser和Asn-X-Thr,其中X是除脯氨酸外的氨基酸,Ser是丝氨酸,Thr是苏氨酸。
92.实施方案85至91中任一个的方法,其中抗体是单克隆全长人IgG1同种型抗体。
93.实施方案85至92中任一个的方法,其中抗体是人源化抗体。
94.实施方案85至93中任一个的方法,其中抗体是体内半乳糖改造的抗体。
95.实施方案85至94中任一个的方法,其中抗体选自曲妥珠单抗、利妥昔单抗、帕妥珠单抗和obinutuzumab。
96.实施方案85至95中任一个的方法,其中宿主细胞是真核细胞。
97.实施方案85至96中任一个的方法,其中宿主细胞是CHO细胞。
98.实施方案85至97中任一个的方法,其中未遗传改造宿主细胞以改善或削弱蛋白质岩藻糖基化,且该方法不包括从抗体的N连接聚糖结构体内加入或体内切割岩藻糖残基。
99.用于产生半乳糖改造的重组抗体群体的方法,其包括步骤:
a)在包含编码抗体的核酸分子的宿主细胞中重组产生IgG1同种型抗体,以获得重组抗体群体;
b)分离该重组抗体群体;
c)用半乳糖基转移酶酶处理该重组抗体群体,以获得包含相对频率至少70%的Fc双半乳糖基化抗体和相对频率低于20%的Fc无岩藻糖基化抗体的半乳糖改造的重组抗体群体,随后从该酶分离该半乳糖改造的重组抗体群体。
100.实施方案99的方法,其中该半乳糖改造的重组抗体群体包含相对频率80-95%的Fc双半乳糖基化抗体和相对频率低于20%的Fc无岩藻糖基化抗体。
101.实施方案99的方法,其中该半乳糖改造的重组抗体群体包含相对频率80-95%的Fc双半乳糖基化抗体和相对频率7-16%的Fc无岩藻糖基化抗体。
102.实施方案99的方法,其中该半乳糖改造的重组抗体群体包含相对频率80-95%的Fc双半乳糖基化抗体、相对频率低于20%的Fc无岩藻糖基化抗体和相对频率50%至90%的Fc唾液酸化抗体。
103.实施方案99的方法,其中该半乳糖改造的重组抗体群体包含相对频率80-95%的Fc双半乳糖基化抗体、相对频率7-16%的Fc无岩藻糖基化抗体和相对频率50%至90%的Fc唾液酸化抗体。
104.实施方案99至103中任一个的方法,其中该半乳糖改造的重组抗体群体不包含含有二等分N乙酰葡糖胺分支的抗体。
105.实施方案99至104中任一个的方法,其中抗体的Fab区不包含以下氨基酸序列:Asn-X-Ser和Asn-X-Thr,其中X是除脯氨酸外的氨基酸,Ser是丝氨酸,Thr是苏氨酸。
106.实施方案99至105中任一个的方法,其中重组抗体是单克隆全长人IgG1同种型抗体。
107.实施方案99至106中任一个的方法,其中重组抗体是人源化抗体。
108.实施方案99至107中任一个的方法,其中重组抗体是体外半乳糖改造的抗体。
109.实施方案99至108中任一个的方法,其中抗体选自曲妥珠单抗、利妥昔单抗、帕妥珠单抗和obinutuzumab。
110.实施方案99至109中任一个的方法,其中宿主细胞是真核细胞。
111.实施方案99至110中任一个的方法,其中宿主细胞是CHO细胞。
112.实施方案99至111中任一个的方法,其中未遗传改造宿主细胞以改善或削弱蛋白质岩藻糖基化,且该方法不包括从抗体的N连接聚糖结构体外加入或体外切割岩藻糖残基。
113.实施方案99至112中任一个的方法,其中步骤c)涉及用半乳糖基转移酶在pH 6-7的溶液中,30-35℃下酶处理该重组抗体群体至少150分钟。
114.实施方案99至113中任一个的方法,其中步骤c)涉及用半乳糖基转移酶在pH 6.3-6.8的溶液中,31-34℃下酶处理该重组抗体群体至少150分钟。
115.实施方案99至114中任一个的方法,其中步骤c)在半乳糖基转移酶和UDP-半乳糖(尿苷二磷酸半乳糖)的存在下进行。
116.实施方案99至115中任一个的方法,其中对步骤c)中获得的重组抗体群体进行:
d)唾液酸转移酶酶处理,以获得包含相对频率至多98%的Fc唾液酸化抗体(包括单唾液酸化和双唾液酸化聚糖结构)的半乳糖改造的重组抗体群体,随后从该唾液酸转移酶分离唾液酸化抗体群体。
117.实施方案116的方法,其中按以下条件进行唾液酸转移酶酶处理:
i)使唾液酸转移酶和步骤c)中获得的该半乳糖改造的重组抗体群体在pH 6-8(在一个实施方案中为pH 6.5-7.5)的溶液中接触至少150分钟(在一个实施方案中为2-120小时)。
118.实施方案116的方法,其中按以下条件进行唾液酸转移酶酶处理:
i)在第一步中,使唾液酸转移酶和步骤c)中获得的该半乳糖改造的抗体群体在pH 6-8(在一个实施方案中为pH 6.5-7.5)的溶液中接触至少150分钟(在一个实施方案中为2-120小时);和
ii)在第二步中,使唾液酸转移酶和步骤i)中获得的抗体群体在pH 6-8(在一个实施方案中为pH 6.5-7.5)的溶液中再接触至少150分钟(在一个实施方案中为2至10小时)。
119.实施方案116至118中任一个的方法,其中步骤i)或可选地步骤i)-ii)中所示的唾液酸转移酶处理进行总计至多120小时的时间。
120.实施方案116至119中任一个的方法,其中步骤d)中获得的抗体群体包含相对频率80%至95%的Fc双半乳糖基化抗体、相对频率低于20%的Fc无岩藻糖基化抗体和相对频率50%至90%的Fc唾液酸化抗体,其中该抗体群体不包含含有二等分N乙酰葡糖胺分支的抗体。
121.用于产生半乳糖改造的重组抗体群体的方法,其包括步骤:
a)在包含编码抗体的核酸分子的宿主细胞中重组产生IgG1同种型抗体,以获得重组抗体群体;
b)分离该重组抗体群体;
c)用半乳糖基转移酶酶处理该重组抗体群体,以获得包含相对频率至少80%的Fc半乳糖基化抗体和相对频率低于20%的Fc无岩藻糖基化抗体的半乳糖改造的重组抗体群体,随后从该酶分离该半乳糖改造的重组抗体群体。实施方案85的方法,其中步骤c)中获得的该半乳糖改造的重组抗体群体包含相对频率80-99.5%的Fc半乳糖基化抗体和相对频率低于20%的Fc无岩藻糖基化抗体。
122.实施方案121的方法,其中步骤c)中获得的该半乳糖改造的重组抗体群体包含相对频率80-99.5%的Fc半乳糖基化抗体和相对频率7-16%的Fc无岩藻糖基化抗体。
123.实施方案121的方法,其中步骤c)中获得的该半乳糖改造的重组抗体群体包含相对频率80-99.5%的Fc半乳糖基化抗体、相对频率低于20%的Fc无岩藻糖基化抗体和相对频率50%至90%的Fc唾液酸化抗体。
124.实施方案121的方法,其中步骤c)中获得的该半乳糖改造的重组抗体群体包含相对频率80-99.5%的Fc半乳糖基化抗体、相对频率7-16%的Fc无岩藻糖基化抗体和相对频率50%至90%的Fc唾液酸化抗体。
125.实施方案121至124中任一个的方法,其中步骤c)中获得的该半乳糖改造的重组抗体群体不包含含有二等分N乙酰葡糖胺分支的抗体。
126.实施方案121至125中任一个的方法,其中抗体的Fab区不包含以下氨基酸序列:Asn-X-Ser和Asn-X-Thr,其中X是除脯氨酸外的氨基酸,Ser是丝氨酸,Thr是苏氨酸。
127.实施方案121至126中任一个的方法,其中抗体是单克隆全长人IgG1同种型抗体。
128.实施方案121至127中任一个的方法,其中抗体是人源化抗体。
129.实施方案121至128中任一个的方法,其中抗体是体外半乳糖改造的抗体。
130.实施方案121至129中任一个的方法,其中抗体选自曲妥珠单抗、利妥昔单抗、帕妥珠单抗和obinutuzumab。
131.实施方案121至130中任一个的方法,其中宿主细胞是真核细胞。
132.实施方案121至131中任一个的方法,其中宿主细胞是CHO细胞。
133.实施方案121至132中任一个的方法,其中未遗传改造宿主细胞以改善或削弱蛋白质岩藻糖基化,且该方法不包括从抗体的N连接聚糖结构体外加入或体外切割岩藻糖残基。
134.实施方案121至133中任一个的方法,其中步骤c)涉及用半乳糖基转移酶在pH 6-7的溶液中,30-35℃下酶处理该抗体群体至少150分钟。
135.实施方案121至134中任一个的方法,其中步骤c)涉及用半乳糖基转移酶在pH 6.3-6.8的溶液中,31-34℃下酶处理该抗体群体至少150分钟。
136.实施方案121至135中任一个的方法,其中步骤c)在半乳糖基转移酶和UDP-半乳糖(尿苷二磷酸半乳糖)的存在下进行。
137.实施方案121至136中任一个的方法,其中对步骤c)中获得的抗体群体进行:
d)唾液酸转移酶酶处理,以获得包含相对频率至多98%的Fc唾液酸化抗体(包括单唾液酸化和双唾液酸化聚糖结构)的抗体群体,随后从该唾液酸转移酶分离唾液酸化抗体群体。
138.实施方案137的方法,其中按以下条件进行唾液酸转移酶酶处理:
i)使唾液酸转移酶和步骤c)中获得的抗体群体在pH 6-8(在一个实施方案中为pH 6.5-7.5)的溶液中接触至少150分钟(在一个实施方案中为2-120小时)。
139.实施方案137的方法,按以下条件进行唾液酸转移酶酶处理:
i)在第一步中,使唾液酸转移酶和步骤c)中获得的抗体群体在pH 6-8(在一个实施方案中为pH 6.5-7.5)的溶液中接触至少150分钟(在一个实施方案中为2-120小时);和
ii)在第二步中,使唾液酸转移酶和步骤i)中获得的抗体群体在pH 6-8(在一个实施方案中为pH 6.5-7.5)的溶液中再接触至少150分钟(在一个实施方案中为2至10小时)。
140.实施方案137至139中任一个的方法,其中步骤i)或可选地步骤i)-ii)中所示的唾液酸转移酶处理进行总计至多120小时的时间。
141.实施方案137至140中任一个的方法,其中步骤d)中获得的抗体群体包含相对频率80-99.5%的Fc半乳糖基化抗体、相对频率低于20%的Fc无岩藻糖基化抗体和相对频率50%至90%的Fc唾液酸化抗体,其中该抗体群体不包含含有二等分N乙酰葡糖胺分支的抗体。
142.用于产生特异性结合HER2且包含SEQ ID NO:1的重链可变结构域和SEQ ID NO:2的轻链可变结构域的半乳糖改造的重组抗体群体的方法,其包括步骤:
a)在包含编码抗体的核酸分子的宿主细胞中重组产生IgG1同种型抗体,以获得重组抗体群体;
b)遗传改造该宿主细胞以改善蛋白质半乳糖基化,使得获得该半乳糖改造的重组抗体群体,其包含相对频率至少70%的Fc双半乳糖基化抗体和相对频率低于20%的Fc无岩藻糖基化抗体。
143.用于产生特异性结合CD20且包含SEQ ID NO:3的重链可变结构域和SEQ ID NO:4的轻链可变结构域的半乳糖改造的重组抗体群体的方法,其包括步骤:
a)在包含编码抗体的核酸分子的宿主细胞中重组产生IgG1同种型抗体,以获得重组抗体群体;
b)遗传改造该宿主细胞以改善蛋白质半乳糖基化,使得获得该半乳糖改造的重组抗体群体,其包含相对频率至少70%的Fc双半乳糖基化抗体和相对频率低于20%的Fc无岩藻糖基化抗体。
144.用于产生特异性结合HER2且包含SEQ ID NO:5的重链可变结构域和SEQ ID NO:6的轻链可变结构域的半乳糖改造的重组抗体群体的方法,其包括步骤:
a)在包含编码抗体的核酸分子的宿主细胞中重组产生IgG1同种型抗体,以获得重组抗体群体;
b)遗传改造该宿主细胞以改善蛋白质半乳糖基化,使得获得该半乳糖改造的重组抗体群体,其包含相对频率至少70%的Fc双半乳糖基化抗体和相对频率低于20%的Fc无岩藻糖基化抗体。
145.用于产生特异性结合CD20且包含SEQ ID NO:7的重链可变结构域和SEQ ID NO:8的轻链可变结构域的半乳糖改造的重组抗体群体的方法,其包括步骤:
a)在包含编码抗体的核酸分子的宿主细胞中重组产生IgG1同种型抗体,以获得重组抗体群体;
b)遗传改造该宿主细胞以改善蛋白质半乳糖基化,使得获得该半乳糖改造的重组抗体群体,其包含相对频率至少70%的Fc双半乳糖基化抗体和相对频率低于20%的Fc无岩藻糖基化抗体。
146.用于产生特异性结合HER2且包含SEQ ID NO:1的重链可变结构域和SEQ ID NO:2的轻链可变结构域的半乳糖改造的重组抗体群体的方法,其包括步骤:
a)在包含编码抗体的核酸分子的宿主细胞中重组产生IgG1同种型抗体,以获得重组抗体群体;
b)分离该重组抗体群体;
c)用半乳糖基转移酶酶处理该重组抗体群体,以获得包含相对频率至少70%的Fc双半乳糖基化抗体和相对频率低于20%的Fc无岩藻糖基化抗体的半乳糖改造的重组抗体群体,随后从该酶分离该半乳糖改造的重组抗体群体。
147.用于产生特异性结合CD20且包含SEQ ID NO:3的重链可变结构域和SEQ ID NO:4的轻链可变结构域的半乳糖改造的重组抗体群体的方法,其包括步骤:
a)在包含编码抗体的核酸分子的宿主细胞中重组产生IgG1同种型抗体,以获得重组抗体群体;
b)分离该重组抗体群体;
c)用半乳糖基转移酶酶处理该重组抗体群体,以获得包含相对频率至少70%的Fc双半乳糖基化抗体和相对频率低于20%的Fc无岩藻糖基化抗体的半乳糖改造的重组抗体群体,随后从该酶分离该半乳糖改造的重组抗体群体。
148.用于产生特异性结合HER2且包含SEQ ID NO:5的重链可变结构域和SEQ ID NO:6的轻链可变结构域的半乳糖改造的重组抗体群体的方法,其包括步骤:
a)在包含编码抗体的核酸分子的宿主细胞中重组产生IgG1同种型抗体,以获得重组抗体群体;
b)分离该重组抗体群体;
c)用半乳糖基转移酶酶处理该重组抗体群体,以获得包含相对频率至少70%的Fc双半乳糖基化抗体和相对频率低于20%的Fc无岩藻糖基化抗体的半乳糖改造的重组抗体群体,随后从该酶分离该半乳糖改造的重组抗体群体。
149.用于产生特异性结合CD20且包含SEQ ID NO:7的重链可变结构域和SEQ ID NO:8的轻链可变结构域的半乳糖改造的重组抗体群体的方法,其包括步骤:
a)在包含编码抗体的核酸分子的宿主细胞中重组产生IgG1同种型抗体,以获得重组抗体群体;
b)分离该重组抗体群体;
c)用半乳糖基转移酶酶处理该重组抗体群体,以获得包含相对频率至少70%的Fc双半乳糖基化抗体和相对频率低于20%的Fc无岩藻糖基化抗体的半乳糖改造的重组抗体群体,随后从该酶分离该半乳糖改造的重组抗体群体。
150.实施方案142至149中任一个的方法,其中步骤c)中获得的该半乳糖改造的重组抗体群体包含相对频率80-95%的Fc双半乳糖基化抗体和相对频率低于20%的Fc无岩藻糖基化抗体。
151.实施方案142至149中任一个的方法,其中步骤c)中获得的该半乳糖改造的重组抗体群体包含相对频率80-95%的Fc双半乳糖基化抗体和相对频率7-16%的Fc无岩藻糖基化抗体。
152.实施方案142至149中任一个的方法,其中该半乳糖改造的重组抗体群体包含相对频率80-95%的Fc双半乳糖基化抗体、相对频率低于20%的Fc无岩藻糖基化抗体和相对频率50%至90%的Fc唾液酸化抗体。
153.实施方案142至149中任一个的方法,其中该半乳糖改造的重组抗体群体包含相对频率80-95%的Fc双半乳糖基化抗体、相对频率7-16%的Fc无岩藻糖基化抗体和相对频率50%至90%的Fc唾液酸化抗体。
154.实施方案142至153中任一个的方法,其中该半乳糖改造的重组抗体群体不包含含有二等分N乙酰葡糖胺分支的抗体。
155.实施方案142至154中任一个的方法,其中抗体的Fab区不包含以下氨基酸序列:Asn-X-Ser和Asn-X-Thr,其中X是除脯氨酸外的氨基酸,Ser是丝氨酸,Thr是苏氨酸。
156.实施方案142至155中任一个的方法,其中抗体是单克隆全长人IgG1同种型抗体。
157.实施方案142至156中任一个的方法,其中抗体是人源化抗体。
158.实施方案146至157中任一个的方法,其中抗体是体外半乳糖改造的抗体。
159.实施方案142至145和150至158中任一个的方法,其中抗体是体内半乳糖改造的抗体。
160.实施方案142至159中任一个的方法,其中宿主细胞是真核细胞。
161.实施方案142至159中任一个的方法,其中宿主细胞是CHO细胞。
162.实施方案142至161中任一个的方法,其中未遗传改造宿主细胞以改善或削弱蛋白质岩藻糖基化,且该方法不包括从抗体的N连接聚糖结构体外加入或体外切割岩藻糖残基。
163.实施方案146至162中任一个的方法,其中步骤c)涉及用半乳糖基转移酶在pH 6-7的溶液中,30-35℃下酶处理该重组抗体群体至少150分钟。
164.实施方案146至163中任一个的方法,其中步骤c)涉及用半乳糖基转移酶在pH 6.3-6.8的溶液中,31-34℃下酶处理该重组抗体群体至少150分钟。
165.实施方案146至164中任一个的方法,其中步骤c)在半乳糖基转移酶和UDP-半乳糖(尿苷二磷酸半乳糖)的存在下进行。
166.实施方案146至165中任一个的方法,其中对步骤c)中获得的半乳糖改造的重组抗体群体进行:
d)唾液酸转移酶酶处理,以获得包含相对频率至多98%的Fc唾液酸化抗体(包括单唾液酸化和双唾液酸化聚糖结构)的抗体群体,随后从该唾液酸转移酶分离唾液酸化抗体群体。
167.实施方案166的方法,其中按以下条件进行唾液酸转移酶酶处理:
i)使唾液酸转移酶和步骤c)中获得的该半乳糖改造的重组抗体群体在pH 6-8(在一个实施方案中为pH 6.5-7.5)的溶液中接触至少150分钟(在一个实施方案中为2-120小时)。
168.实施方案166的方法,其中按以下条件进行唾液酸转移酶酶处理:
i)在第一步中,使唾液酸转移酶和步骤c)中获得的该半乳糖改造的抗体群体在pH 6-8(在一个实施方案中为pH 6.5-7.5)的溶液中接触至少150分钟(在一个实施方案中为2-120小时);和
ii)在第二步中,使唾液酸转移酶和步骤i)中获得的抗体群体在pH 6-8(在一个实施方案中为pH 6.5-7.5)的溶液中再接触至少150分钟(在一个实施方案中为2至10小时)。
169.实施方案166至168中任一个的方法,其中步骤i)或可选地步骤i)-ii)中所示的唾液酸转移酶处理进行总计至多120小时的时间。
170.实施方案166至169中任一个的方法,其中步骤d)中获得的抗体群体包含相对频率80%至95%的Fc双半乳糖基化抗体、相对频率低于20%的Fc无岩藻糖基化抗体和相对频率50%至90%的Fc唾液酸化抗体,其中该抗体群体不包含含有二等分N乙酰葡糖胺分支的抗体。
171.用于产生特异性结合HER2且包含SEQ ID NO:1的重链可变结构域和SEQ ID NO:2的轻链可变结构域的半乳糖改造的重组抗体群体的方法,其包括步骤:
a)在包含编码抗体的核酸分子的宿主细胞中重组产生IgG1同种型抗体,以获得重组抗体群体;
b)遗传改造该宿主细胞以改善蛋白质半乳糖基化,使得获得该半乳糖改造的重组抗体群体,其包含相对频率至少80%的Fc半乳糖基化抗体和相对频率低于20%的Fc无岩藻糖基化抗体。
172.用于产生特异性结合CD20且包含SEQ ID NO:3的重链可变结构域和SEQ ID NO:4的轻链可变结构域的半乳糖改造的重组抗体群体的方法,其包括步骤:
a)在包含编码抗体的核酸分子的宿主细胞中重组产生IgG1同种型抗体,以获得重组抗体群体;
b)遗传改造该宿主细胞以改善蛋白质半乳糖基化,使得获得该半乳糖改造的重组抗体群体,其包含相对频率至少80%的Fc半乳糖基化抗体和相对频率低于20%的Fc无岩藻糖基化抗体。
173.用于产生特异性结合HER2且包含SEQ ID NO:5的重链可变结构域和SEQ ID NO:6的轻链可变结构域的半乳糖改造的重组抗体群体的方法,其包括步骤:
a)在包含编码抗体的核酸分子的宿主细胞中重组产生IgG1同种型抗体,以获得重组抗体群体;
b)遗传改造该宿主细胞以改善蛋白质半乳糖基化,使得获得该半乳糖改造的重组抗体群体,其包含相对频率至少80%的Fc半乳糖基化抗体和相对频率低于20%的Fc无岩藻糖基化抗体。
174.用于产生特异性结合CD20且包含SEQ ID NO:7的重链可变结构域和SEQ ID NO:8的轻链可变结构域的半乳糖改造的重组抗体群体的方法,其包括步骤:
a)在包含编码抗体的核酸分子的宿主细胞中重组产生IgG1同种型抗体,以获得重组抗体群体;
b)遗传改造该宿主细胞以改善蛋白质半乳糖基化,使得获得该半乳糖改造的重组抗体群体,其包含相对频率至少80%的Fc半乳糖基化抗体和相对频率低于20%的Fc无岩藻糖基化抗体。
175.用于产生特异性结合HER2且包含SEQ ID NO:1的重链可变结构域和SEQ ID NO:2的轻链可变结构域的半乳糖改造的重组抗体群体的方法,其包括步骤:
a)在包含编码抗体的核酸分子的宿主细胞中重组产生IgG1同种型抗体,以获得重组抗体群体;
b)分离该重组抗体群体;
c)用半乳糖基转移酶酶处理该重组抗体群体,以获得包含相对频率至少80%的Fc半乳糖基化抗体和相对频率低于20%的Fc无岩藻糖基化抗体的半乳糖改造的重组抗体群体,随后从该酶分离该半乳糖改造的重组抗体群体。
176.用于产生特异性结合CD20且包含SEQ ID NO:3的重链可变结构域和SEQ ID NO:4的轻链可变结构域的半乳糖改造的重组抗体群体的方法,其包括步骤:
a)在包含编码抗体的核酸分子的宿主细胞中重组产生IgG1同种型抗体,以获得重组抗体群体;
b)分离该重组抗体群体;
c)用半乳糖基转移酶酶处理该重组抗体群体,以获得包含相对频率至少80%的Fc半乳糖基化抗体和相对频率低于20%的Fc无岩藻糖基化抗体的半乳糖改造的重组抗体群体,随后从该酶分离该半乳糖改造的重组抗体群体。
177.用于产生特异性结合HER2且包含SEQ ID NO:5的重链可变结构域和SEQ ID NO:6的轻链可变结构域的半乳糖改造的重组抗体群体的方法,其包括步骤:
a)在包含编码抗体的核酸分子的宿主细胞中重组产生IgG1同种型抗体,以获得重组抗体群体;
b)分离该重组抗体群体;
c)用半乳糖基转移酶酶处理该重组抗体群体,以获得包含相对频率至少80%的Fc半乳糖基化抗体和相对频率低于20%的Fc无岩藻糖基化抗体的半乳糖改造的重组抗体群体,随后从该酶分离该半乳糖改造的重组抗体群体。
178.用于产生特异性结合CD20且包含SEQ ID NO:7的重链可变结构域和SEQ ID NO:8的轻链可变结构域的半乳糖改造的重组抗体群体的方法,其包括步骤:
a)在包含编码抗体的核酸分子的宿主细胞中重组产生IgG1同种型抗体,以获得重组抗体群体;
b)分离该重组抗体群体;
c)用半乳糖基转移酶酶处理该重组抗体群体,以获得包含相对频率至少80%的Fc半乳糖基化抗体和相对频率低于20%的Fc无岩藻糖基化抗体的半乳糖改造的重组抗体群体,随后从该酶分离该半乳糖改造的重组抗体群体。
179.实施方案171至178中任一个的方法,其中该半乳糖改造的重组抗体群体包含相对频率80-99.5%的Fc半乳糖基化抗体和相对频率低于20%的Fc无岩藻糖基化抗体。
180.实施方案171至179中任一个的方法,其中该半乳糖改造的重组抗体群体包含相对频率80-99.5%的Fc半乳糖基化抗体和相对频率7-16%的Fc无岩藻糖基化抗体。
181.实施方案171至180中任一个的方法,其中该半乳糖改造的重组抗体群体包含相对频率80-99.5%的Fc半乳糖基化抗体、相对频率低于20%的Fc无岩藻糖基化抗体和相对频率50%至90%的Fc唾液酸化抗体。
182.实施方案171至181中任一个的方法,其中该半乳糖改造的重组抗体群体包含相对频率80-99.5%的Fc半乳糖基化抗体、相对频率7-16%的Fc无岩藻糖基化抗体和相对频率50%至90%的Fc唾液酸化抗体。
183.实施方案171至182中任一个的方法,其中该半乳糖改造的重组抗体群体不包含含有二等分N乙酰葡糖胺分支的抗体。
184.实施方案171至183中任一个的方法,其中抗体的Fab区不包含以下氨基酸序列:Asn-X-Ser和Asn-X-Thr,其中X是除脯氨酸外的氨基酸,Ser是丝氨酸,Thr是苏氨酸。
185.实施方案171至184中任一个的方法,其中抗体是单克隆全长人IgG1同种型抗体。
186.实施方案171至185中任一个的方法,其中重组抗体是人源化抗体。
187.实施方案175至186中任一个的方法,其中重组抗体是体外半乳糖改造的抗体。
188.实施方案171至174和179至186中任一个的方法,其中重组抗体是体内半乳糖改造的抗体。
189.实施方案171至188中任一个的方法,其中宿主细胞是真核细胞。
190.实施方案171至189中任一个的方法,其中宿主细胞是CHO细胞。
191.实施方案171至190中任一个的方法,其中未遗传改造宿主细胞以改善或削弱蛋白质岩藻糖基化,且该方法不包括从抗体的N连接聚糖结构体外加入或体外切割岩藻糖残基。
192.实施方案175至191中任一个的方法,其中步骤c)涉及用半乳糖基转移酶在pH 6-7的溶液中,30-35℃下酶处理该重组抗体群体至少150分钟。
193.实施方案175至192中任一个的方法,其中步骤c)涉及用半乳糖基转移酶在pH 6.3-6.8的溶液中,31-34℃下酶处理该重组抗体群体至少150分钟。
194.实施方案175至193中任一个的方法,其中步骤c)在半乳糖基转移酶和UDP-半乳糖(尿苷二磷酸半乳糖)的存在下进行。
195.实施方案175至194中任一个的方法,其中对步骤c)中获得的半乳糖改造的重组抗体群体进行:
d)唾液酸转移酶酶处理,以获得包含相对频率至多98%的Fc唾液酸化抗体(包括单唾液酸化和双唾液酸化聚糖结构)的抗体群体,随后从该唾液酸转移酶分离唾液酸化抗体群体。
196.实施方案195的方法,其中按以下条件进行唾液酸转移酶酶处理:
i)使唾液酸转移酶和步骤c)中获得的该半乳糖改造的重组抗体群体在pH 6-8(在一个实施方案中为pH 6.5-7.5)的溶液中接触至少150分钟(在一个实施方案中为2-120小时)。
197.实施方案195的方法,按以下条件进行唾液酸转移酶酶处理:
i)在第一步中,使唾液酸转移酶和步骤c)中获得的该半乳糖改造的重组抗体群体在pH 6-8(在一个实施方案中为pH 6.5-7.5)的溶液中接触至少150分钟(在一个实施方案中为2-120小时);和
ii)在第二步中,使唾液酸转移酶和步骤i)中获得的抗体群体在pH 6-8(在一个实施方案中为pH 6.5-7.5)的溶液中再接触至少150分钟(在一个实施方案中为2至10小时)。
198.实施方案195至197中任一个的方法,其中步骤i)或可选地步骤i)-ii)中所示的唾液酸转移酶处理进行总计至多120小时的时间。
199.实施方案195至198中任一个的方法,其中步骤d)中获得的抗体群体包含相对频率80-99.5%的Fc半乳糖基化抗体、相对频率低于20%的Fc无岩藻糖基化抗体和相对频率50%至90%的Fc唾液酸化抗体,其中该抗体群体不包含含有二等分N乙酰葡糖胺分支的抗体。
200.药物组合物,其包含实施方案1至70中任一个的半乳糖改造的重组IgG1同种型抗体群体。
201.药物组合物,其包含通过实施方案71至199中任一个的方法获得的半乳糖改造的重组IgG1同种型抗体群体。
202.实施方案200或201的药物组合物,其中半乳糖改造的抗体与至少一种可药用载体组合配制。
203.治疗患有疾病的患者的方法,其通过对需要这种治疗的患者施用实施方案1至70中任一个的半乳糖改造的重组IgG1同种型抗体群体来治疗。
204.治疗患有疾病的患者的方法,其通过对需要这种治疗的患者施用通过实施方案71至199中任一个的方法获得的半乳糖改造的重组IgG1同种型抗体群体来治疗。
205.实施方案203或204中任一个的方法,其中疾病选自癌症、炎性障碍和自身免疫障碍。
206.实施方案71至199中任一个的方法,其用于改善该重组IgG1同种型抗体群体介导的ADCC。
207.实施方案65至218中任一个的方法的用途,用于改善重组抗体与FcγRIIa和FcγRIIIa的结合亲和力。
208.实施方案1至70中任一个的或通过实施方案71至199中任一个的方法获得的半乳糖改造的重组抗体群体的用途,用于介导ADCC。
209.实施方案1至70中任一个的或通过实施方案71至199中任一个的方法获得的半乳糖改造的重组抗体群体的用途,用于招募和/或激活天然杀伤细胞。
210.实施方案1至70中任一个的或通过实施方案71至199中任一个的方法获得的半乳糖改造的重组抗体群体的用途,用于激活包含FcγR的效应细胞。
211.实施方案1至70中任一个的或通过实施方案71至199中任一个的方法获得的半乳糖改造的重组抗体群体,其用作药物。
212.实施方案1至70中任一个的或通过实施方案71至199中任一个的方法获得的半乳糖改造的重组抗体群体,其用于治疗选自癌症、炎性障碍和自身免疫障碍的疾病。
213.半乳糖改造的重组抗体群体,其通过实施方案71至199中任一个的方法获得。
氨基酸序列描述
实施例
提供以下实施例来辅助理解本发明,本发明的真实范围在所附权利要求书中显示。应理解,可以在所示方法中进行修改而不背离本发明的精神。
实施例1:
通过体外糖改造制备高度半乳糖基化的IgG1抗体(曲妥珠单抗)并鉴定糖结构
在第一实验中,通过酶对获自四个不同生产批次的曲妥珠单抗(mAb1)进行高半乳糖基化。
为了产生这种高度半乳糖基化(高半乳糖基化)的mAb曲妥珠单抗,向抗体中加入牛β-1,4-半乳糖基转移酶(Roche)。加入反应缓冲液(20mM MnCl、10mM UDP-Gal、100mM MES缓冲液、pH 6.5)和H2O以达到3至15mg mAb/ml的浓度。在32至37℃范围内的温度下孵育样品。孵育24小时(22mU)或孵育48小时(44mU)后加入其他量的酶。使用MabSelect Sure protein A柱,通过更换缓冲液为25mM柠檬酸钠并调节pH至pH 5.5来终止反应。最终mAb浓度在2至15mg/ml范围内。
为了分析糖结构,对150μg mAb进行缓冲液更换至磷酸盐缓冲液(10mM、pH7.2)。然后用2μl PNGase F(500000U/ml,BioLabs)在45℃孵育1小时,2-AB 65℃标记2小时(Signal 2-AB标记试剂盒,Glyko,GKK404)。在HILIC柱(Waters,BEH Glycan 1.7μm,2.1 x 150mm;45分钟梯度)上通过NP-UHPLC进行分析。
未处理的原材料和半乳糖基转移酶处理的群体的糖结构比较显示在表1中。
表1:未处理和半乳糖基转移酶处理的曲妥珠单抗的糖结构(相对频率以%显示)
实施例2:
评估高度半乳糖基化的IgG1抗体介导的ADCC
在基于NK细胞系的体外ADCC测定中分析了抗体介导的ADCC。
为了此分析,按之前所述(Schnueriger,A.等Mol Immunol 48,1512-1517(2011),在此引入作为参考)产生和培养表达人FcγRIIIa的重组效应细胞。靶细胞系购自美国典型培养物保藏中心(American Type Culture Collection,ATCC)。按照供应商提供的建议用BATDA配体(Perkin Elmer)标记多种靶细胞系。效应细胞和标记的靶细胞在生长培养基中混合,并接种在96孔微量滴定板上。将抗体样品稀释在生长培养基中,并加至效应细胞-靶细胞混合物。在37℃/5%CO2的湿润培养箱中孵育测定平板。孵育后,离心平板,并将来自各孔的上清转移至白色96孔板。向每个孔加入200μl铕溶液(Perkin Elmer),然后在平板震荡器上短时间孵育。按BATDA配体供应商(Perkin Elmer)提供的说明书制备自发释放和最大释放的对照。用345nm激发、615nm发射以RFU(相对荧光单位)测量时间分辨荧光。在Spectramax M5酶标仪(Molecular Devices)上进行读数。特异性毒性值按以下计算:100%x(特异性释放–自发释放)/(最大释放–自发释放)。对于相对ADCC计算,将%特异性毒性对抗体浓度作图,并通过全曲线平行线分析测定相对ADCC(Gottschalk,P.G.&Dunn,J.R.J Biopharm Stat 15,437-463(2005))。
修饰样品与参考材料、起始材料和伪处理对照一起分析。每个样品在五次独立实验中分析。与起始材料相比,在缺乏修饰酶的情况下与修饰样品平行制备的伪处理对照(称为对照)显示ADCC无变化(数据未显示)。
图2A显示高半乳糖基化曲妥珠单抗(mAb1)样品(虚线,白色方形)和未处理的对照mAb样品(实线,黑色圆)介导的代表性剂量依赖性ADCC。无论何种样品处理,饱和抗体浓度(约1000ng/ml)下的最大靶细胞裂解达到可比的水平。就EC50值观察到对照和高半乳糖基化材料间的差异,高半乳糖基化材料的EC50值更低。因此,相对于其伪处理对照,高半乳糖基化曲妥珠单抗样品一致地引出提高的ADCC。
为了确定半乳糖对ADCC活性的影响是否是更普遍的现象,用一组抗不同靶标的抗体产生了高半乳糖基化样品。使基于NK细胞的体外测定系统适应这些不同抗体,在三次独立实验中相对于每种抗体各自的参考标准品比较了糖修饰样品及其相关对照的ADCC活性。类似于用曲妥珠单抗观察到的剂量-反应曲线,与各自的对照材料相比,高半乳糖基化样品显示更低的EC50值,而饱和浓度下的最大ADCC在所有情况下保持不变(数据未显示)。图2B中显示相对于参考材料以ADCC表示的定量结果。高半乳糖基化时,利妥昔单抗(mAb2)批次#1、2和3的相对ADCC从对照的55%、96%和111%(图2B,灰色条)提高至高半乳糖基化样品的85%、113%和123%(图2B,白色条)。在帕妥珠单抗(mAb3)的情况下,批次#1和2的相对ADCC从对照样品的64%和53%(图2B,灰色条)提高至高半乳糖基化样品的75%和71%(图2B,白色条)。mAb4批次#1、2和3显示ADCC从对照的48%、97%和90%(图2B,灰色条)提高至高半乳糖基化样品的58%、112%和98%(图2B,白色条)。一般而言,用所测试的mAb1-4的全部12个抗体批次都观察到了高半乳糖基化增强ADCC活性的趋势。
鉴于无岩藻糖对ADCC的显著影响,产生了更高的半乳糖水平是否可以调节含有高水平无岩藻糖基化的mAb的ADCC的问题。为了研究这一点,通过酶半乳糖基化无岩藻糖基化的mAb4(mAb4 afu)和无岩藻糖基化的obinutuzumab(mAb5 afu),并与其相关对照相比较(图2B)。对照材料和高半乳糖基化材料的剂量反应曲线大致重叠(数据未显示)。在定量上,无岩藻糖基化的mAb4(100%)和无岩藻糖基化的obinutuzumab(107%)对照材料(图2B,灰色条)介导的相对ADCC与高半乳糖基化材料介导的ADCC(无岩藻糖基化的mAb4和无岩藻糖基化的obinutuzumab分别为101%和108%。参见图2B,白色条)可比。因此,高半乳糖基化时,高度无岩藻糖基化的抗体的ADCC保持不变。
无岩藻糖基化的mAb4变体用FUT-8-/-CHO表达系统产生(mAb4 afu),而无岩藻糖基化的曲妥珠单抗变体(mAb1 afu)和无岩藻糖基化的obinutuzumab变体(mAb5 afu)产生自过量表达GnT-III(β-1,4-N-乙酰葡糖胺转移酶III)的细胞。
实施例3:
通过体外糖改造制备具有不同N连接聚糖结构的IgG1抗体(曲妥珠单抗)群体
在第二实验中,对获自标准生产批次的曲妥珠单抗进行体外糖改造,以产生具有不同聚糖谱的不同曲妥珠单抗群体。体外糖改造方法的示意性流程显示在图3中。
无半乳糖基化聚糖种类(“aGal”):
通过用半乳糖苷酶处理mAb来制备包含高相对频率的无半乳糖基化聚糖结构(例如G0、G0F)的曲妥珠单抗mAb群体。简言之,为了制备无半乳糖基化抗体,向1mg曲妥珠单抗加入5μlβ(1-4)-半乳糖苷酶(Prozyme,GKX-5014)(10mU酶/mg抗体),并在37℃孵育24小时。随后通过蛋白A层析从游离酶纯化酶处理的mAb群体。
双半乳糖基化聚糖种类(“biGal”):
通过按照实施例1中所述的方法用半乳糖基转移酶处理mAb来制备包含高相对频率的双半乳糖基化聚糖结构(例如G2、G2、G2S1和G2S2及相应的岩藻糖基化种类)的曲妥珠单抗mAb群体。简言之,将1g曲妥珠单抗(浓度=25mg/ml)与157ml反应缓冲液(10mM UDP-Gal、20mM MnCl2、100mM MES pH 6.5)混合。用dH2O将来自Sigma的β-(1-4)-半乳糖基转移酶(G5507-25U)稀释至10U/ml的浓度。开始孵育时向样品中加入4.6ml半乳糖基转移酶,并在2和3天后再加入2.3ml。总孵育时间为32℃下4天。随后通过蛋白A层析纯化酶处理的样品。
双半乳糖基化、单唾液酸化聚糖种类(“biGal/monoSia”):
为了制备包含高相对频率的双半乳糖基化和单唾液酸化聚糖结构(例如G2S1和G2S1F)的曲妥珠单抗mAb群体,用唾液酸转移酶对所获得的双半乳糖基化聚糖种类的群体(其按上文所述制备)进行酶处理。简言之,为了达到500mg上文所述双半乳糖基化曲妥珠单抗样品(浓度=8.1mg/ml)的单唾液酸化,加入50mg ST6和25ml浓度为10mg/ml的CMP-NANA水溶液。样品在37℃孵育24小时,然后通过蛋白A纯化来纯化。
双半乳糖基化、双唾液酸化聚糖种类(“biGal/biSia”):
为了制备包含高相对频率的双半乳糖基化和双唾液酸化聚糖结构(例如G2S2和G2S2F)的曲妥珠单抗mAb群体,使用唾液酸转移酶ST6(Roche,氨基酸序列SEQ ID NO:9),用唾液酸转移酶对所获得的双半乳糖基化和单唾液酸化聚糖种类的群体(其按上文所述制备)进行另一酶处理。简言之,为了进一步提高唾液酸化程度,将100mg双半乳糖基化和单唾液酸化曲妥珠单抗样品与3ml CMP-NANA水溶液和10mg ST6(Roche,产品号07012250103)混合。样品在37℃孵育7小时,然后通过蛋白A纯化来纯化。
实施例4:
具有不同N连接聚糖结构的IgG1抗体(曲妥珠单抗)群体的聚糖分析
为了分析实施例3的单种(individual)糖改造的曲妥珠单抗样品的聚糖结构(通过与实施例1中所述相同的方法),对150μg各mAb进行缓冲液更换至磷酸盐缓冲液(10mM、pH7.2),然后用2μl PNGase F(500000U/ml,BioLabs)在45℃孵育1小时,2-AB 65℃标记2小时后纯化(Signal 2-AB标记试剂盒,Glyko,GKK404)。标记的聚糖通过亲水相互作用(BEH聚糖柱,1.7μm,2.1 x 150mm,Waters)液相层析(45分钟梯度)分离,并在420nm(激发波长330nm)检测荧光信号。
表2:未处理和体外糖改造的曲妥珠单抗群体的糖结构(相对频率以%显示)
n.d.–低于检测限
如从表2可见,与未处理的样品相比,该体外糖改造导致希望得到的聚糖种类的比例提高。在通过半乳糖苷酶处理衍生的无半乳糖基化样品中,超过85%的聚糖种类为无半乳糖基化的。在所提供的包含高频率的双半乳糖基化曲妥珠单抗抗体的样品中,超过80%的聚糖种类是双半乳糖基化的。在制备为包含提高量的单唾液酸化曲妥珠单抗抗体的样品中,超过45%的聚糖种类是单唾液酸化的,另有约5%的部分是双唾液酸化IgG1。在制备为包含提高量的双唾液酸化曲妥珠单抗抗体的最后一个样品中,双唾液酸化IgG1的比例进一步提高至约30%,样品中存在约相同比例的单唾液酸化抗体。
由于可认为不同样品包含非常同质的聚糖谱,就其对FcγR结合和ADCC介导的影响分析了每个样品。
实施例5:
评估IgG1抗体(曲妥珠单抗)的不同聚糖种类介导的Fc-γR结合-表面等离振子共振
为了通过表面等离振子共振(SPR)分析FcγR结合,使用了T100系统(GE Healthcare)。对于FcγR和IgG1糖变体的相互作用分析,注入抗His捕获抗体(GE Healthcare)以达到12,000个共振单位(RU)的水平。在pH 4.5用标准胺偶联试剂盒(GE Healthcare)在CM5芯片上进行捕获抗体的固定。按10μl/分钟流速以60秒脉冲按200nM浓度捕获Fc-γRIa、Fc-γRIIa和Fc-γRIIIa。随后按300nM浓度和30μl/分钟流速应用曲妥珠单抗糖变体60秒。监测解离期180秒。通过按30μl/分钟流速用10mM甘氨酸pH 1.5进行的洗涤步骤来再生表面。所有实验均在HBS-N缓冲液(10mM HEPES、pH 7.4、150mM NaCl)中进行。用Biacore T100评价软件2.0.3进行数据评价。
结果显示在图4中。所显示(y轴)的是相对于未处理的对照样品(其因此归一化为与各受体100%结合)的结合强度。数据显示,曲妥珠单抗的无半乳糖基化导致Fc-γRIa、IIa和IIIa结合减少(Fc-γRIIa和IIIa为显著减少)。具有高频率的双半乳糖基化聚糖种类的曲妥珠单抗样品显示与Fc-γRIIa和Fc-γRIIIa的结合改善。
实施例6:
评估IgG1抗体(曲妥珠单抗)的不同聚糖种类介导的Fc-γR结合-亲和层析
为了通过亲和层析分析Fc-γR结合,分别将生物素化的人Fc-γRIIa或Fc-γRIIIa_V158与链霉抗生物素蛋白琼脂糖轻轻振荡孵育2小时。将各Fc-γ受体衍生的琼脂糖装填在Tricorn 5/50柱(内径5mm x长度50mm,GE Healthcare)中,并用explorer或Dionex Summit系统按0.5ml/分钟流速用20mM Tris、150mM NaCl pH 8.0(Fc-γRIIa)或20mM柠檬酸钠、150mM NaCl pH 6.0(Fc-γRIIIa)平衡亲和柱。将含有50至100μg抗体样品的平衡缓冲液加至各柱。随后,用5个柱体积的平衡缓冲液洗涤柱。分别用20mM柠檬酸钠、150mM NaCl pH 4.0(Fc-γRIIa)或pH 3.0(Fc-γRIIIa)以15个柱体积的线性pH梯度洗脱样品。实验在室温进行。通过连续测量280nm吸光大度来获得洗脱图。
结果显示在图5中。所显示的是各样品的保留时间。对于Fc-γRIIIa结合,显示岩藻糖基化聚糖种类(亲和层析中的早期洗脱峰)和(部分)无岩藻糖基化聚糖种类(亲和层析中的晚期洗脱峰)的保留时间。与SPR数据一致,这些数据证明,无半乳糖基化减少Fc-γRIIa和IIIa结合,而双半乳糖基化改善曲妥珠单抗与该受体的结合。可针对岩藻糖基化以及无岩藻糖基化的聚糖种类观察到该效应(参见Fc-γRIIIa结合数据)。
实施例7:
评估IgG1抗体(曲妥珠单抗)的不同聚糖种类介导的ADCC-亲和层析
在按实施例2中所述进行的基于NK细胞系的体外ADCC测定中分析了实施例3中产生的抗体群体介导的ADCC。
结果显示在图6中。所显示的是与未处理的曲妥珠单抗样品相比的相对ADCC。数据证明,无半乳糖基化的曲妥珠单抗种类降低抗体介导的ADCC,而IgG1的双半乳糖基化(针对唾液酸化聚糖种类以及无唾液酸化聚糖种类观察到)改善ADCC介导。
实施例8:
评估不同IgG1抗体的高半乳糖基化种类介导的Fc-γR结合
在使用基于球珠的非放射性发光同质接近测定形式的竞争结合测定中评估了单克隆抗体样品与人Fc-γRIIIa的结合。在此测定中,将人谷胱甘肽S转移酶(GST)标记的Fc-γ受体及抗体参考标准品、对照和样品加至96孔板,然后加入生物素化的抗体链霉抗生物素蛋白供体球珠和谷胱甘肽受体球珠。在缺乏竞争抗体样品的情况下,供体球珠结合的抗体和受体球珠结合的Fc-γ受体相互作用产生发光信号。样品破坏了供体球珠结合的抗体/Fcγ受体相互作用,减少发光信号。发光的变化与竞争抗体的量成比例。将表示为发光计数的结果对抗体浓度作图,用四参数曲线拟合程序来测定样品相对于适当的参考标准品的活性。
为了确认高半乳糖基化对ADCC的影响源自修饰的mAb Fc和表达在NK细胞上的Fc-γRIIIa之间的相互作用增加,在Fc-γRIIIa结合实验中分析了利妥昔单抗(mAb2)和帕妥珠单抗(mAb3)批次的亚组。结果(图7)证明,抗体的高半乳糖基化显著增加Fc-γRIIIa结合。对照和高半乳糖基化mAb样品的Fc-γRIIIa结合活性分别是,对于利妥昔单抗(mAb2)从62%提高至103%,对于帕妥珠单抗(mAb3)从73%提高至138%,对于mAb4从77%提高至160%,对于无岩藻糖基化的mAb4(mAb4 afu)从100%提高至165%。与对Fc-γRIIIa结合的影响相比,高半乳糖基化对ADCC活性的影响程度较低。如图7中所示,对照和高半乳糖基化mAb样品的相应批次的ADCC分别为,对于利妥昔单抗(mAb2)从55%提高至85%,对于帕妥珠单抗(mAb3)从64%提高至75%,对于mAb4从90%提高至98%。mAb4的无岩藻糖基化变体(mAb4 afu)的ADCC保持不变(对照和高半乳糖基化材料分别为100%和101%)。
- 还没有人留言评论。精彩留言会获得点赞!