新型肽及其用途的制作方法
本发明涉及新型肽和含有该肽的免疫激活剂、疫苗用佐剂、疫苗组合物或育发剂。
背景技术:
佐剂是通过与抗原混合后给药于生物体而增强针对所给药的抗原的免疫应答的物质。佐剂包括诱导Th1型反应的佐剂、诱导Th2型反应的佐剂、或者诱导Th1型和Th2型这两型反应的佐剂。疫苗治疗中通常需要佐剂,一方面使宿主容易识别抗原,另一方面要求长期停留在局部的性能。由于佐剂具有引起炎症的性质,因此给药部位的疼痛、肿胀等副反应常常成为问题,在迄今为止已得到临床应用的疫苗中给药部位的副反应也常常作为问题被提出。一直以来,使用Alum(氢氧化铝)作为佐剂,但要求安全性比较高的、对于提高疫苗的效率更为有效的佐剂。
因年龄增长、遗传因素、社会压力等原因所导致的脱发症而烦恼的人很多,对促进生发的育发剂、防止脱发的抗脱发剂等进行了各种开发。
例如,已知含有来源于具有特定序列的大豆蛋白的肽作为有效成分的抗脱发剂(专利文献1)。
本发明人们之前发现了作为兼具血管新生作用和抗菌作用的肽的由30个氨基酸残基构成的AG30(非专利文献1、专利文献2),对其加以改变而对血管新生作用和抗菌作用进行了改良(非专利文献2、专利文献3、专利文献4、专利文献5、专利文献6)。
现有技术文献
专利文献
专利文献1:日本特开2008-247874号公报
专利文献2:国际公开第2005/090564号
专利文献3:国际公开第2010/061915号
专利文献4:国际公开第2010/101237号
专利文献5:国际公开第2010/137594号
专利文献6:日本特开2012-14583号公报
非专利文献
非专利文献1:J.Cell.Mol.Med.,2008;13:535-46
非专利文献2:J.Cell.Mol.Med.Vol16,No7,2012,pp.1629-1639
技术实现要素:
发明所要解决的问题
本发明的课题在于提供具有免疫激活作用或育发、生发促进作用的新型短链肽,并提供含有该肽的新型免疫激活剂、疫苗用佐剂、疫苗组合物或育发剂。
用于解决问题的方法
为了解决上述问题,本发明人通过对AG30进一步加以改变而发现了具有免疫激活作用或育发、生发促进作用的由23个以下的氨基酸残基构成的肽,从而完成了本发明。本发明包含下述各发明。
[1]一种肽,其包含LHRLKRLRKRL(序列编号1)所表示的氨基酸序列且由23个以下的氨基酸构成。
[2]如上述[1]所述的肽,其包含LHRLKRLRKRLK(序列编号9)所表示的氨基酸序列。
[3]如上述[1]或[2]所述的肽,其包含ELKLIFLHRLKRLRKRLKRK(序列编号2)的氨基酸序列或与该氨基酸序列具有90%以上的同一性的氨基酸序列。
[4]如上述[1]~[3]中任一项所述的肽,其C末端进行了酰胺化。
[5]如上述[1]~[4]中任一项所述的肽,其N末端进行了乙酰化。
[6]一种免疫激活剂,其含有上述[1]~[5]中任一项所述的肽。
[7]如上述[6]所述的免疫激活剂,其为疫苗用佐剂。
[8]一种疫苗组合物,其含有上述[1]~[5]中任一项所述的肽和至少一种抗原。
[9]一种育发剂,其含有上述[1]~[5]中任一项所述的肽。
[10]一种免疫激活方法,其特性在于,对哺乳动物给药有效量的上述[1]~[5]中任一项所述的肽。
[11]一种疫苗抗原的免疫原性增强方法,其特性在于,对哺乳动物给药有效量的上述[1]~[5]中任一项所述的肽。
[12]如上述[1]~[5]中任一项所述的肽,其用于激活免疫应答。
[13]如上述[1]~[5]中任一项所述的肽,其用于增强疫苗抗原的免疫原性。
[14]上述[1]~[5]中任一项所述的肽在制造免疫激活剂、疫苗用佐剂或疫苗组合物中的用途。
[15]一种育发或生发促进方法,其特征在于,对哺乳动物给药有效量的上述[1]~[5]中任一项所述的肽。
[16]如上述[1]~[5]中任一项所述的肽,其用于促进育发或生发。
[17]上述[1]~[5]中任一项所述的肽在制造育发剂中的用途。
发明效果
本发明提供新型肽。本发明的新型肽具有免疫激活作用和育发、生发促进作用。本发明的新型肽与之前的专利等中记载的类似肽相比具有显著强的免疫激活作用。此外,本发明能够提供含有该肽的新型免疫激活剂、疫苗用佐剂、疫苗组合物和育发剂。
本发明的肽具有细胞因子产生诱导作用、T细胞活化共刺激分子表达诱导作用、炎性小体活化作用,作为免疫激活剂有用。此外,具有疫苗抗原的免疫原性增强作用,作为疫苗用佐剂特别有用。含有本发明的肽的疫苗用佐剂在针对感染症、癌症、生活习惯病等的各种疫苗疗法中能够作为高效的佐剂使用。此外,由于建立了高效的合成法、检验法,因此本发明的氨基酸残基数为23以下的短链肽具有能够以低廉的成本批量生产的优点。
本发明的肽具有毛乳头细胞生长作用和促进针对毛乳头细胞的生长因子产生的作用,作为育发剂、生发促进剂等有用。本发明人们对由30个氨基酸残基构成的AG30加以改变而合成了多种肽,结果,在毛乳头细胞生长作用和促进针对毛乳头细胞的生长因子产生的作用方面,本发明的肽具有显著强的活性。此外,由于建立了高效的合成法和检验法,因此作为有效成分的氨基酸残基数为23以下的短链肽具有能够以低廉的成本批量生产的优点。
附图说明
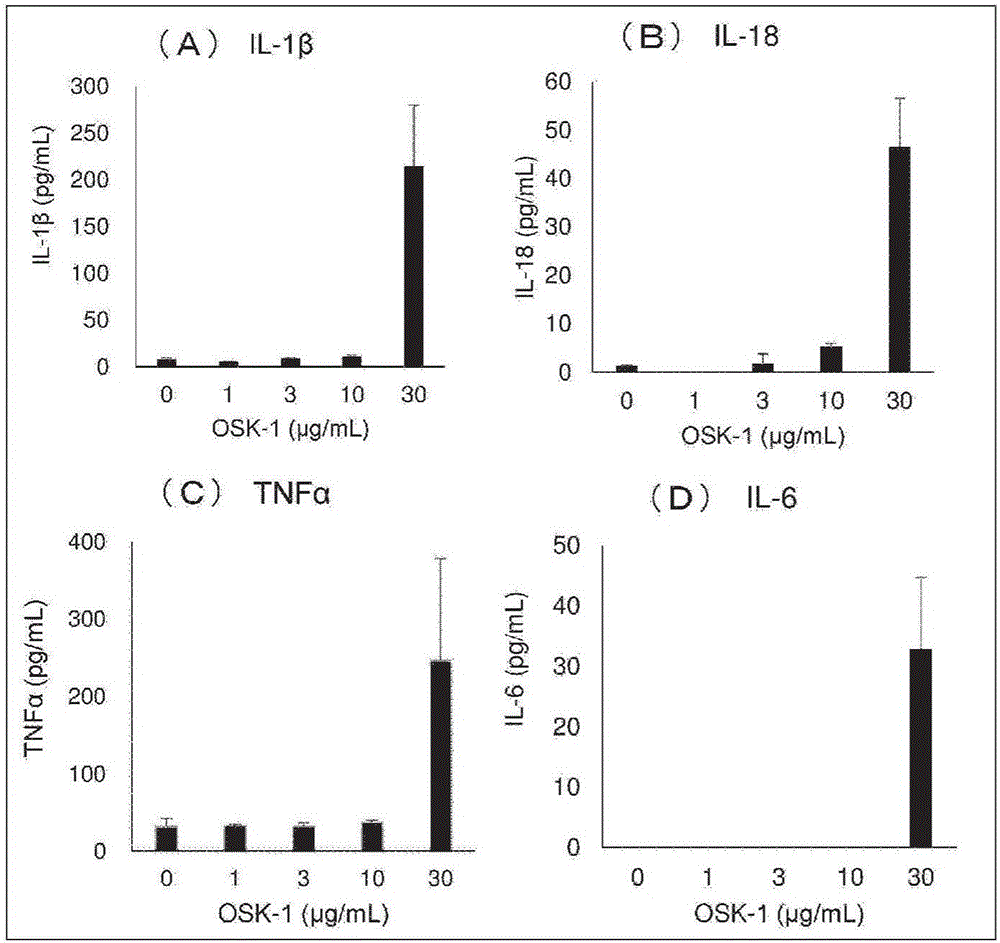
图1是示出对在利用LPS致敏的THP-1细胞中添加OSK-1后的培养上清中的细胞因子浓度进行测定的结果的图,(A)为IL-1β的结果、(B)为IL-18的结果、(C)为TNFα的结果、(D)为IL-6的结果。
图2是示出对在利用PMA进行了分化的THP-1细胞中添加OSK-1后的培养上清中的细胞因子浓度进行测定的结果的图,(A)为IL-1β的结果、(B)为IL-18的结果、(C)为TNFα的结果、(D)为IL-6的结果。
图3是示出对在THP-1细胞中添加OSK-1、AAP-1~AAP-6后的CD86和CD54的表达量进行测定的结果的图,(A)为CD86的结果、(B)为CD54的结果。
图4是示出对在THP-1细胞中添加AAP-6、AAP-11和AAP-12后的CD86和CD54的表达量进行测定的结果的图,(A)为CD86的结果、(B)为CD54的结果。
图5是示出利用蛋白免疫印迹对NLRP3的表达水平进行确认的结果的图。
图6是示出使用转染了针对NLRP3的siRNA或对照siRNA的THP-1细胞、对以10μg/mL的浓度添加OSK-1后的IL-1β和TNFα产生量进行比较的结果的图,(A)为IL-1β的结果、(B)为TNFα的结果。
图7是示出基于利用LPS对THP-1细胞致敏的有无,对OSK-1的IL-1β产生作用进行比较的结果的图。
图8是示出基于组织蛋白酶B抑制剂和半胱天冬酶-1抑制剂的有无,对OSK-1的IL-1β产生作用进行比较的结果的图。
图9是示出将犬体内的OSK-1的佐剂效果与弗氏佐剂(FA)的效果进行比较的结果的图,(A)为OSK-1组的结果、(B)为FA组的结果。
图10是示出将小鼠体内的OSK-1的佐剂效果与Alum、弗氏佐剂(FA)的佐剂效果进行比较的结果的图。
图11是示出使OSK-1、AAP-1~AAP-6作用于人毛乳头细胞并对培养上清中的生长因子浓度进行测定的结果的图,(A)为KGF的结果、(B)为HGF的结果、(C)为VEGF的结果。
图12是示出将OSK-1和类似肽对THP-1细胞的CD54表达诱导作用进行比较的结果的图。
图13是示出OSK-1的MS分析结果的图。
图14是示出OSK-1的HPLC分析结果的图。
图15是示出对在利用PMA进行了分化的THP-1细胞中添加OSK-1后的培养上清中的细胞因子、趋化因子浓度进行测定的结果的图,(A)为IL-1β的结果、(B)为IL-18的结果、(C)为TNFα的结果、(D)为IL-6的结果、(E)为RANTES的结果、(F)为MIP-1α的结果、(G)为MIP-1β的结果。
图16是示出对在利用LPS致敏的RAW264.7细胞中添加OSK-1后的培养上清中的细胞因子浓度进行测定的结果的图,(A)为IL-1β的结果、(B)为IL-18的结果、(C)为TNFα的结果、(D)为IL-6的结果。
图17是示出对在小鼠骨髄来源树突细胞中添加OSK-1后的培养上清中的细胞因子浓度进行测定的结果的图,(A)为IL-1β的结果、(B)为IFNγ的结果、(C)为TNFα的结果、(D)为IL-6的结果、(E)为IL-12p70的结果。
图18是示出对在利用LPS致敏的THP-1细胞中添加OSK-1、Alum或CpG核苷酸后的培养上清中的细胞因子浓度进行测定的结果的图,(A)为IL-1β的结果、(B)为IL-18的结果、(C)为TNFα的结果、(D)为IL-6的结果。
图19是示出对在THP-1细胞中添加OSK-1或Alum后的CD86和CD54的表达量进行测定的结果的图,(A)为CD86的结果、(B)为CD54的结果。
图20是示出确认OSK-1对于THP-1细胞的NFκB的活化作用的结果的图。
图21是示出将OSK-1-血管紧张素II结合疫苗给药于小鼠并对抗体产生作用进行评价的结果的图。
图22是示出将OSK-1-血管紧张素II结合疫苗给药于小鼠并对所产生的抗体的亚型进行分析的结果的图,(A)是使用10倍稀释血清的结果、(B)是使用50倍稀释血清的结果。
图23是示出使OSK-1、AAP-11作用于人毛乳头细胞并对培养上清中的生长因子浓度进行测定的结果的图,(A)为KGF的结果、(B)为HGF的结果、(C)为VEGF的结果。
图24是示出对OSK-1在小鼠中的育发作用进行确认的结果的图,(A)为第17天的被毛的长度,(B)为示出生毛得分的结果的图。
具体实施方式
[肽]
本发明提供包含LHRLKRLRKRL(序列编号1)所表示的氨基酸序列且由23个以下的氨基酸构成的肽(以下,也将它们简称为“本发明的肽”)。本发明的肽只要包含序列编号1所表示的氨基酸序列即可。
本发明的肽为由序列编号1所表示的氨基酸序列构成的肽、或者由在序列编号1所表示的氨基酸序列的N末端侧、C末端侧、或N末端侧和C末端侧附加一个以上的氨基酸而得到的氨基酸序列表示的肽。本发明的肽可以包含在序列编号1所表示的氨基酸序列的N末端侧附加F、IF、LIF、KLIF、LKLIF、ELKLIF等氨基酸序列而得到的氨基酸序列。本发明的肽可以包含在序列编号1所表示的氨基酸序列的C末端侧附加K、KR、KRK、KRKL、KRKLR、KRKLRL、KRKLRLW、KRKLRLWH、KRKLRLWHR、KRKLRLWHRK、KRKLRLWHRKR、KRKLRLWHRKRY等氨基酸序列而得到的氨基酸序列。
本发明的肽优选为包含在序列编号1所表示的氨基酸序列的C末端侧附加K而得到的序列、即LHRLKRLRKRLK(序列编号9)所表示的氨基酸序列且由23个以下的氨基酸构成的肽。进一步优选序列编号9所表示的氨基酸序列的C末端的K为L型。
本发明的肽进一步优选为包含LHRLKRLRKRL(序列编号1)所表示的氨基酸序列且由23个以下的氨基酸构成的、包含ELKLIFLHRLKRLRKRLKRK(序列编号2)的氨基酸序列或与该氨基酸序列具有90%以上的同一性的氨基酸序列的肽。更优选为包含具有95%以上的同一性的氨基酸序列的肽。作为进一步优选的肽,包括由序列编号2、3或6所表示的氨基酸序列构成的肽和包含这些序列的肽。
本发明的肽进一步优选包含序列编号1所表示的氨基酸序列且由ELKLIFLHRLKRLRKRLKRKLRLWHRKRY(序列编号14)所表示的氨基酸序列中的23个以下的氨基酸构成的肽。
本发明的肽中氨基酸的个数的下限值为11个,可以为12个、13个、14个、15个、16个、17个、18个、19个、20个、21个、22个、23个。本发明的肽中氨基酸的个数的上限值为23个,可以为22个、21个、20个、19个、18个、17个、16个、15个、14个、13个、12个、11个。
LHRLKRLRKRL(序列编号1)所表示的氨基酸序列的C末端的“L”、“RL”或“KRL”对于本发明的肽的免疫激活作用或育发作用有很大影响。
LHRLKRLRKRL(序列编号1)所表示的氨基酸序列的N末端的“L”对本发明的肽的免疫激活作用或育发作用有很大影响。
本发明的肽进一步优选为包含ELKLIFLHRLKRLRKRLKRK(序列编号2)、ELKLIFLHRLKRLRKRLK(序列编号3)、LKLIFLHRLKRLRKRLKR(序列编号6)、KLIFLHRLKRLRKRLK(序列编号7)、LIFLHRLKRLRKRL(序列编号8)、FLHRLKRLRKRL(序列编号10)等所表示的氨基酸序列的肽。
本发明的肽特别优选为由ELKLIFLHRLKRLRKRLKRK(序列编号2)、ELKLIFLHRLKRLRKRLK(序列编号3)、LKLIFLHRLKRLRKRLKR(序列编号6)、KLIFLHRLKRLRKRLK(序列编号7)、LIFLHRLKRLRKRL(序列编号8)、FLHRLKRLRKRL(序列编号10)等所表示的氨基酸序列构成的肽。
本发明的肽进一步特别优选为由ELKLIFLHRLKRLRKRLKRK(序列编号2)、ELKLIFLHRLKRLRKRLK(序列编号3)、LKLIFLHRLKRLRKRLKR(序列编号6)、KLIFLHRLKRLRKRLK(序列编号7)所表示的氨基酸序列构成的肽。
本发明的肽进一步特别优选为由ELKLIFLHRLKRLRKRLKRK(序列编号2)、ELKLIFLHRLKRLRKRLK(序列编号3)、LKLIFLHRLKRLRKRLKR(序列编号6)构成的肽。
本发明的肽的C末端可以为羧基(-COOH)、羧酸根(-COO-)、酰胺(-CONH2)或酯(-COOR)中的任意一种。作为酯中的R,除了可以列举例如甲基、乙基、正丙基、异丙基或正丁基等C1-6烷基;例如环戊基、环己基等C3-8环烷基;例如苯基、α-萘基等C6-12芳基;例如苄基、苯乙基等苯基-C1-2烷基或α-萘基甲基等α-萘基-C1-2烷基等C7-14芳烷基以外,还可以列举作为经口用酯通用的特戊酰氧基甲基等。作为酰胺体,可以列举酰胺、由1个或2个C1-6烷基取代的酰胺、由1个或2个经苯基取代的C1-6烷基取代的酰胺、包含酰胺基的氮原子在内形成5至7元环的氮杂环烷烃的酰胺等。在本发明的肽在C末端以外具有羧基或羧酸根的情况下,将这些基团进行酰胺化或酯化而得到的肽也包含在本发明的肽中。本发明的肽优选C末端进行了酰胺化。
本发明的肽还包含N末端的氨基被保护基(例如,甲酰基、乙酰基等C2-6烷酰基等C1-6酰基等)保护着的肽、N末端侧在生物体内被切断而生成的谷氨酰基发生了焦谷氨酸化的肽、分子内的氨基酸的侧链上的取代基(例如,-OH、-SH、氨基、咪唑基、吲哚基、胍基等)被适当的保护基(例如,甲酰基、乙酰基等C2-6烷酰基等C1-6酰基等)保护着的肽。本发明的肽优选N末端进行了乙酰化。本发明的肽进一步优选N末端进行了乙酰化且C末端进行了酰胺化。
构成本发明的肽的氨基酸的侧链可以被任意的取代基进行修饰。取代基没有特别限定,可以列举例如氟原子、氯原子、氰基、羟基、硝基、烷基、环烷基、烷氧基、氨基、磷酸基等。另外,侧链的取代基可以被保护基进行保护。此外,结合有糖链的糖肽也包含在本发明的肽中。
本发明的肽可以形成盐,作为其盐,优选生理学上可接受的盐。作为生理学上可接受的盐,可以列举例如与盐酸、硫酸、乳酸、酒石酸、马来酸、富马酸、草酸、苹果酸、柠檬酸、油酸、棕榈酸、硝酸、磷酸、三氟乙酸、甲磺酸、苯磺酸、对甲苯磺酸等酸的盐;与钠、钾、钙等碱金属或碱土金属、或铝的氢氧化物或碳酸盐的盐;与三乙胺、苄胺、二乙醇胺、叔丁胺、二环己胺、精氨酸等的盐等。其中,更优选盐酸盐、乙酸盐、三氟乙酸盐。
本发明的肽只要可保持原来的肽的特性,也可以包含非天然氨基酸。另外,本发明的肽只要可保持原来的肽的特性,也可以在肽上连接其他物质。作为可连接在肽上的其他物质,可以列举例如脂质、糖或糖链、乙酰基、天然或合成的聚合物等。另外,本发明的肽只要可保持原来的肽的特性,也可以对肽进行糖链附加、侧链氧化、磷酸化等修饰。
本发明的肽可以按照公知的一般的肽合成的操作规程利用固相合成法(Fmoc法、Boc法)或液相合成法来制造。另外,可以使用导入有含有编码本发明的肽的DNA的表达载体的转化体来制造。另外,可以通过使用导入有含有编码在一部分包含本发明的肽的肽的DNA的表达载体的转化体来获取肽、并将其用适当的蛋白酶或肽酶切断来制造。另外,可以通过使用体外转录、翻译系统的方法来制造。
本发明的肽具有细胞因子产生诱导作用、T细胞活化共刺激分子表达诱导作用、炎性小体活化作用,作为免疫激活剂有用。特别是作为疫苗用佐剂有用。此外,本发明的肽具有毛乳头细胞生长作用、促进针对毛乳头细胞的生长因子产生的作用等,对育发、养发、促进生发有用。
[免疫激活剂]
本发明提供含有上述本发明的肽作为有效成分的免疫激活剂。本发明适合提供疫苗用佐剂。此外,本发明提供含有上述本发明的肽的疫苗组合物。
本发明的免疫激活剂含有至少一种本发明的肽。可以进一步含有为了免疫激活而使用的其他有效成分。通过将本发明的肽与为了免疫激活而使用的其他有效成分组合使用,可以期待相加或协同地提高免疫激活作用。
另外,本发明的免疫激活剂可以单独或与多种药剂并用来治疗各种疾病。例如,可以与抗癌剂并用而用于治疗。
本发明的免疫激活剂通过具有例如细胞因子产生诱导作用、T细胞活化共刺激分子表达诱导作用、炎性小体活化作用等而显示出优良的免疫激活作用。另外,本发明的免疫激活剂在激活Th1型、Th2型这两型免疫应答的方面有用。
此外,本发明的免疫激活剂具有增强疫苗抗原的免疫原性的作用,可以适合作为优良的疫苗用佐剂使用。
本发明的疫苗用佐剂包含至少一种本发明的肽。本发明的疫苗用佐剂可以进一步含有其他佐剂或为了免疫激活而使用的其他有效成分。通过将本发明的肽与佐剂或为了免疫激活而使用的其他有效成分组合使用,可以期待相加或协同地提高佐剂作用或免疫激活作用。作为佐剂或为了免疫激活而使用的其他有效成分,可以列举Alum、弗氏佐剂(Freund’s Adjuvant,完全弗氏佐剂、不完全弗氏佐剂)、TLR激活剂(云芝多糖(Krestin)、脂多糖、鞭毛蛋白、CpG核苷酸)等。
另外,本发明的疫苗用佐剂可以是与包含至少一种抗原的疫苗分别包装、在使用时进行混合的试剂盒制剂。
疫苗没有限定,为了增强感染症预防疫苗、癌疫苗、诱导针对导致疾病的生物体内蛋白的免疫的疫苗等所有疫苗的免疫原性,可以适当使用本发明的疫苗用佐剂。作为感染症预防疫苗,可以列举流感、脊髓灰质炎、流行性乙型脑炎、结核菌、人乳头瘤、疟疾、SARS、伤寒、副伤寒、鼠疫、百日咳、斑疹伤寒等感染症用疫苗。作为癌疫苗的癌抗原或癌抗原肽,可以列举例如WT1肽、MAGE肽、MUC1肽、生存素等。作为导致疾病的生物体内蛋白,可以列举β-淀粉样蛋白、血管紧张素II、DPPIV、IgE、IL-17、PD-1、PD-L1等。抗原可以为表位序列与载体蛋白(例如钥孔戚血蓝蛋白(KLH)等)结合的形态。
作为疫苗用佐剂特别优选的肽为由序列编号2、3、6、7、8和10中任一序列所表示的氨基酸序列构成的肽,更优选由序列编号2、3、6和7中任一序列所表示的氨基酸序列构成的肽,进一步优选由序列编号2或3所表示的氨基酸序列构成的肽。更优选由序列编号2所表示的氨基酸序列构成的肽。此外,更优选N末端进行了乙酰化且C末端进行了酰胺化的肽。认为本发明的疫苗用佐剂与以往的Alum、油性佐剂相比,不易产生疼痛、硬结等不期望的作用。
另外,本发明的免疫激活剂也可以适当用于将人或其他哺乳动物等的组织、细胞取出至其体外并激活、将激活的组织、细胞用于治疗等的方法。例如,在取出癌症患者的单核细胞,在含有细胞生长因子、GM-CSF、IL-4等的培养基中培养,由此诱导出树突细胞,使树突细胞摄取癌抗原或癌抗原肽并将其返回至体内的治疗方法中,可以与癌抗原或癌抗原肽一同使用本发明的免疫激活剂。此时,可以与佐剂或为了免疫激活而使用的其他有效成分组合使用。作为癌抗原或癌抗原肽,可以列举例如WT1肽、MAGE肽、MUC1肽、生存素等。
[疫苗组合物]
本发明的疫苗组合物包含至少一种上述本发明的肽和至少一种抗原。该疫苗组合物包括:至少一种本发明的肽与至少一种抗原配合而成的制剂的方式;和包含至少一种本发明的肽与至少一种抗原连接而成的连接体的制剂的方式。作为连接体,可以列举例如本发明的肽与抗原形成一条多肽而连接的方式。该连接体可以是抗原与本发明的肽直接进行连接,另外也可以经由间隔物等进行连接。作为间隔物,可以列举例如ε-氨基己酸,但不限定于此。将间隔物与本发明的肽或抗原肽结合的方法可以利用酰胺键、二硫键。另外,可以列举以PEG或任意的寡肽作为间隔物的方法等。
本发明的疫苗组合物中含有的抗原没有特别限定。只要是能够用于上述感染症预防疫苗、癌疫苗、诱导针对导致疾病的生物体内蛋白的免疫的疫苗等所有疫苗的抗原,则任意的抗原均可以适当用于本发明的疫苗组合物。另外,抗原特别优选使用表位序列的肽。抗原也可以为与载体蛋白结合的形态。本说明书中,将作为疫苗的抗原使用的抗原称为“疫苗抗原”。
[细胞因子产生诱导剂、T细胞活化共刺激分子表达诱导剂、炎性小体活化剂]
本发明的免疫激活剂由于具有例如细胞因子产生诱导作用、T细胞活化共刺激分子表达诱导作用、炎性小体活化作用等而显示出优良的免疫激活作用。因此,本发明的免疫激活剂包括细胞因子产生诱导剂、T细胞活化共刺激分子表达诱导剂、炎性小体活化剂等。
作为确认本发明的肽的细胞因子产生诱导作用的方法,可以列举例如实施例2和3记载的方法等。作为确认本发明的肽的T细胞活化共刺激分子表达诱导作用的方法,可以列举例如实施例4记载的方法等。作为确认本发明的肽的炎性小体活化作用的方法,可以列举例如实施例5和6记载的方法等。作为确认本发明的肽的佐剂作用的方法,可以列举例如上述免疫激活作用(实施例2~6)和实施例7和8记载的方法等。
细胞因子产生诱导剂包含至少一种本发明的肽。特别优选的肽为由序列编号2、3、6、7、8和10中任一序列所表示的氨基酸序列构成的肽,更优选由序列编号2所表示的氨基酸序列构成的肽。此外,更优选N末端进行了乙酰化且C末端进行了酰胺化的肽。
本说明书中,细胞因子可以列举例如IL-1β、IL-18、TNFα、IL-6、IL-8、IL-12、IFN-γ、IFN-α、IL-10、MCP-1、MIP-1α、MIP-1β、iNOS、IL-17、IL-23等,优选为IL-1β、IL-18、TNFα、IL-6等。
T细胞活化共刺激分子表达诱导剂包含至少一种本发明的肽。特别优选的肽为由序列编号2、3、6、7、8和10中任一序列所表示的氨基酸序列构成的肽,更优选由序列编号2、3、6和7中任一序列所表示的氨基酸序列构成的肽,进一步优选由序列编号2或3所表示的氨基酸序列构成的肽。此外,更优选N末端进行了乙酰化且C末端进行了酰胺化的肽。
本说明书中,T细胞活化共刺激分子可以列举例如CD86、CD54、CD80、CD106、CD40等,优选为CD86、CD54等。
炎性小体的活化剂包含至少一种本发明的肽。特别优选的肽为由序列编号2、3、6、7、8和10中任一序列所表示的氨基酸序列构成的肽,更优选由序列编号2所表示的氨基酸序列构成的肽。此外,更优选N末端进行了乙酰化且C末端进行了酰胺化的肽。
本发明的免疫抑制剂、疫苗用佐剂或疫苗组合物含有上述本发明的肽,可以适当配合药学上可接受的载体或添加剂而进行制剂化。具体而言,可以制成片剂(包括糖衣片)、包覆片剂、丸剂、散剂、颗粒剂、胶囊剂、液剂、悬浮剂、乳剂等经口剂;注射剂(例如皮下注射剂、静脉内注射剂、肌肉内注射剂、腹腔内注射剂)、输液、点滴剂、外用剂(例如经鼻给药制剂、经皮制剂、软膏剂)、栓剂(例如直肠栓剂、阴道栓剂)、软膏、贴片剂、液剂等非经口剂。
经口用的固体剂(片剂、丸剂、胶囊剂、散剂、颗粒剂等)可以将有效成分与赋形剂(乳糖、甘露醇、葡萄糖、微晶纤维素、淀粉等)、粘结剂(羟丙基纤维素、聚乙烯基吡咯烷酮、硅酸铝镁等)、崩解剂(纤维素乙醇酸钙等)、润滑剂(硬脂酸镁等)、稳定剂、助溶剂(谷氨酸、天冬氨酸等)等混合,按照常规方法进行制剂化。可以根据需要用包衣剂(白糖、明胶、羟丙基纤维素、羟丙基甲基纤维素邻苯二甲酸酯等)进行包覆,另外也可以用两层以上的层进行包覆。
经口用的液剂(水剂、悬浮剂、乳剂、糖浆剂、酏剂等)通过将有效成分溶解、悬浮或乳化在通常使用的稀释剂(纯水、乙醇或它们的混合液等)中进行制剂化。该液剂可以进一步含有润湿剂、助悬剂、乳化剂、甜味剂、风味剂、芳香剂、防腐剂、缓冲剂等。
作为非经口剂,可以列举例如皮肤外用剂。皮肤外用剂可以应用于液剂、霜剂、软膏剂、凝胶剂、气溶胶剂等,但只要是适合外用的剂型,则不限定于这些。
皮肤外用剂中可以根据需要配合水、低级醇、助溶剂、表面活性剂、乳化稳定剂、凝胶化剂、粘合剂、以及为了得到期望的剂型而通常使用的基剂成分,也可以根据使用目的在不损害本发明效果的范围内适当配合血管扩张剂、肾上腺皮质激素、保湿剂、杀菌剂、清凉剂、维生素类、香料、色素等。
作为非经口剂,可以列举例如注射剂。注射剂包含溶液、悬浮液、乳浊液和使用时溶解或悬浮在溶剂中使用的固体的注射剂。注射剂通过将有效成分溶解、悬浮或乳化在溶剂中进行制剂化。作为溶剂,可以使用例如注射用蒸馏水、生理盐水、植物油、丙二醇、聚乙二醇、乙醇之类的醇类等和它们的组合。该注射剂可以进一步含有稳定剂、助溶剂(谷氨酸、天冬氨酸、聚山梨酯80(注册商标)等)、助悬剂、乳化剂、无痛剂、缓冲剂、防腐剂等。这些注射剂在最终工序中灭菌或者通过无菌操作法来制造。另外也可以制造无菌的固体剂、例如冷冻干燥品,在其使用前进行无菌化或溶解在无菌的注射用蒸馏水或其他溶剂中来使用。
关于本发明的免疫激活剂、疫苗用佐剂和疫苗组合物的制剂化中使用的载体或添加剂的配合比例,基于药品领域中通常采用的范围适当设定即可。可以配合的载体或添加剂没有特别限制,可以列举例如:水、生理盐水、其他水性溶剂、水性或油性基剂等各种载体;赋形剂、粘结剂、pH调节剂、崩解剂、吸收促进剂、润滑剂、着色剂、矫味剂、香料等各种添加剂。
作为在片剂、胶囊剂等中可以混合的添加剂,可以使用例如:明胶、玉米淀粉、黄蓍胶、阿拉伯树胶之类的粘结剂;结晶性纤维素之类的赋形剂;玉米淀粉、明胶、海藻酸等之类的膨化剂;硬脂酸镁之类的润滑剂、蔗糖、乳糖或糖精之类的甜味剂;薄荷、白株树油(ア力モノ油)或樱桃之类的香味剂等。在制剂单元形态为胶囊的情况下,上述类型的材料中可以进一步含有油脂之类的液态载体。用于注射的无菌组合物可以按照通常的制剂方法(例如将有效成分溶解或悬浮在注射用水、天然植物油等溶剂中等)来制备。作为注射用的水性液,可以使用例如含有生理盐水、葡萄糖或其他辅助药剂的等渗液(例如D-山梨醇、D-甘露醇、氯化钠等)等,可以与适当的助溶剂、例如醇(例如乙醇)、多元醇(例如丙二醇、聚乙二醇)、非离子性表面活性剂(例如聚山梨酯80TM、HCO-50)等并用。作为油性液,可以使用例如芝麻油、大豆油等,可以与作为助溶剂的苯甲酸苄酯、苄醇等并用。另外,可以与缓冲剂(例如磷酸盐缓冲液、乙酸钠缓冲液)、无痛剂(例如苯扎氯铵、盐酸普鲁卡因等)、稳定剂(例如人血清白蛋白、聚乙二醇等)、防腐剂(例如苄醇、苯酚等)、抗氧化剂等配合。
如此得到的制剂例如可以对人或其他哺乳动物(例如大鼠、小鼠、兔、山羊、猪、牛、猫、犬、猴等)进行给药。
给药量根据给药对象、对象疾病、给药途径等而不同,例如在经口给药的情况下,通常对于成人(以体重60kg计)而言,每天给药约0.1mg~约100mg、优选约1.0mg~约50mg、更优选约1.0mg~约20mg的有效成分。例如,在以注射剂的形态非经口给药的情况下,通常对于成人(以体重60kg计)而言,每天静脉内给药约0.01mg~约30mg、优选约0.1mg~约20mg、更优选约0.1mg~约10mg的有效成分。每天的总给药量可以为单次给药量,也可以为多次给药量。
作为本发明的免疫激活剂、疫苗用佐剂或疫苗用组合物的给药方法,可以列举经皮给药、经粘膜给药、经口给药、皮下注射、皮内注射、肌肉内注射等,更优选皮内注射、肌肉内注射。在将本发明的疫苗用佐剂与疫苗抗原并用给药的情况下,疫苗抗原的给药可以于与本发明的疫苗用佐剂同时给药,也可以在本发明的疫苗用佐剂给药后进行疫苗抗原的给药,还可以在本发明的疫苗用佐剂给药前进行疫苗抗原的给药。
[育发剂]
本发明提供含有上述本发明的肽作为有效成分的育发剂。本发明的育发剂由于具有例如毛乳头细胞生长作用、促进针对毛乳头细胞的生长因子产生的作用、养发作用、生发促进作用、生发作用、增发作用等而显示出优良的育发作用。因此,本发明的育发剂可以换言之为毛乳头细胞生长剂、针对毛乳头细胞的生长因子产生促进剂、养发剂、生发促进剂、生发剂、增发剂等。本发明的育发剂可以以化妆品、准药品(医薬部外品)、药品、饮食品、营养补充剂等的方式实施。
本发明的育发剂、毛乳头细胞生长剂、针对毛乳头细胞的生长因子产生促进剂、养发剂、生发促进剂、生发剂或增发剂含有至少一种本发明的肽。特别适宜的肽为由序列编号2、3、6、7和8中任一序列所表示的氨基酸序列构成的肽,更优选由序列编号2、3、6和7中任一序列所表示的氨基酸序列构成的肽,更优选由序列编号2、3、和6中任一序列所表示的氨基酸序列构成的肽,进一步优选由序列编号2或3所表示的氨基酸序列构成的肽。更优选由序列编号2所表示的氨基酸序列构成的肽。此外,更优选N末端进行了乙酰化且C末端进行了酰胺化的肽。
本说明书中,生长因子可以列举例如KGF(角质细胞生长因子、keratinocyte growth factor)、HGF(肝细胞生长因子、hepatocyte growth factor)、VEGF(血管内皮细胞生长因子、vascular endothelial growth factor)、IGF(胰岛素生长因子,Insulin growth factor)、EGF(表皮生长因子,Epithelial growth factor)、FGF(成纤维细胞生长因子,Fibroblast growth factor)、PDGF(血小板衍生生长因子,Platelet derived growth factor)、TGF β1(转化生长因子β1,Transforming growth factor β1)等,优选为KGF、HGF、VEGF等。
在本发明的育发剂为化妆品或准药品的方式的情况下,形态没有特别限定。例如可以为皮肤外用剂、洗发水、护发素、焗油膏、头发护理剂、造型剂的形态。
在本发明的育发剂为化妆品或准药品的情况下,除了本发明的肽以外,可以根据目的适当配合作为化妆品或准药品而通常使用的成分,例如油分、润湿剂、保湿剂、乳化剂、紫外线吸收剂、表面活性剂、抗氧化剂、稳定剂、助溶剂、增稠剂、填充剂、金属离子封端剂、防晒剂、消泡剂、柔软剂、着色剂、防腐剂、推进剂、酸化剂或碱化剂、有机硅、维生素、染料、颜料、纳米颜料、香料、醇等有机溶剂、水等。
作为化妆品或准药品的优选形态,可以列举皮肤外用剂。皮肤外用剂可以列举液剂、霜剂、软膏剂、凝胶剂、气溶剂等剂型,只要是适合外用的剂型,则不限定于这些。
皮肤外用剂中可以根据需要配合水、低级醇、助溶剂、表面活性剂、乳化稳定剂、凝胶化剂、粘合剂、以及为了得到所期望的剂型而通常使用的基剂成分,也可以根据使用目的在不损害本发明效果的范围内适当配合血管扩张剂、肾上腺皮质激素、保湿剂、杀菌剂、清凉剂、维生素类、香料、色素等。
在本发明的育发剂为药品的方式的情况下,可以将上述本发明的肽作为有效成分,适当配合药学上可接受的载体或添加剂进行制剂化。剂型没有特别限定,可以制成例如:片剂(包括糖衣片)、包覆片剂、丸剂、散剂、颗粒剂、胶囊剂、液剂、悬浮剂、乳剂等经口剂;注射剂(例如皮下注射剂、静脉内注射剂、肌肉内注射剂、腹腔内注射剂)、输液、点滴剂、外用剂(例如经鼻给药制剂、经皮制剂、软膏剂)、栓剂(例如直肠栓剂、阴道栓剂)、软膏、贴片剂、液剂等非经口剂。优选为外用剂。
作为非经口剂,可以列举例如皮肤外用剂。皮肤外用剂可以应用于液剂、霜剂、软膏剂、凝胶剂、气溶胶剂等,但只要是适合外用的剂型,则不限定于这些。
皮肤外用剂中可以根据需要配合水、低级醇、助溶剂、表面活性剂、乳化稳定剂、凝胶化剂、粘合剂、以及为了得到期望的剂型而通常使用的基剂成分,也可以根据使用目的在不损害本发明效果的范围内适当配合血管扩张剂、肾上腺皮质激素、保湿剂、杀菌剂、清凉剂、维生素类、香料、色素等。
经口用的固体剂(片剂、丸剂、胶囊剂、散剂、颗粒剂等)可以将有效成分与赋形剂(乳糖、甘露醇、葡萄糖、微晶纤维素、淀粉等)、粘结剂(羟丙基纤维素、聚乙烯基吡咯烷酮、硅酸铝镁等)、崩解剂(纤维素乙醇酸钙等)、润滑剂(硬脂酸镁等)、稳定剂、助溶剂(谷氨酸、天冬氨酸等)等混合,按照常规方法进行制剂化。可以根据需要用包衣剂(白糖、明胶、羟丙基纤维素、羟丙基甲基纤维素邻苯二甲酸酯等)进行包覆,另外也可以用两层以上的层进行包覆。
经口用的液剂(水剂、悬浮剂、乳剂、糖浆剂、酏剂等)通过将有效成分溶解、悬浮或乳化在通常使用的稀释剂(纯水、乙醇或它们的混合液等)中进行制剂化。该液剂可以进一步含有润湿剂、助悬剂、乳化剂、甜味剂、风味剂、芳香剂、防腐剂、缓冲剂等。
作为非经口剂,可以列举例如注射剂。注射剂包含溶液、悬浮液、乳浊液和使用时溶解或悬浮在溶剂中使用的固体的注射剂。注射剂通过将有效成分溶解、悬浮或乳化在溶剂中进行制剂化。作为溶剂,可以使用例如:注射用蒸馏水、生理盐水、植物油、丙二醇、聚乙二醇、乙醇之类的醇类等和它们的组合。该注射剂可以进一步含有稳定剂、助溶剂(谷氨酸、天冬氨酸、聚山梨酯80(注册商标)等)、助悬剂、乳化剂、无痛剂、缓冲剂、防腐剂等。这些注射剂在最终工序中灭菌或者通过无菌操作法来制造。另外也可以制造无菌的固体剂、例如冷冻干燥品,在其使用前进行无菌化或溶解在无菌的注射用蒸馏水或其他溶剂中来使用。
关于本发明的药品的制剂化中使用的载体或添加剂的配合比例,基于药品领域中通常采用的范围适当设定即可。可以配合的载体或添加剂没有特别限制,可以列举例如:水、生理盐水、其他水性溶剂、水性或油性基剂等各种载体;赋形剂、粘结剂、pH调节剂、崩解剂、吸收促进剂、润滑剂、着色剂、矫味剂、香料等各种添加剂。
作为在片剂、胶囊剂等中可以混合的添加剂,可以使用例如:明胶、玉米淀粉、黄蓍胶、阿拉伯树胶之类的粘结剂;结晶性纤维素之类的赋形剂;玉米淀粉、明胶、海藻酸等之类的膨化剂;硬脂酸镁之类的润滑剂;蔗糖、乳糖或糖精之类的甜味剂、薄荷、白株树油或樱桃之类的香味剂等。在制剂单元形态为胶囊的情况下,上述类型的材料中可以进一步含有油脂之类的液态载体。用于注射的无菌组合物可以按照通常的制剂方法(例如将有效成分溶解或悬浮在注射用水、天然植物油等溶剂中等)来制备。作为注射用的水性液,可以使用例如含有生理盐水、葡萄糖或其他辅助药剂的等渗液(例如D-山梨醇、D-甘露醇、氯化钠等)等,可以与适当的助溶剂、例如醇(例如乙醇)、多元醇(例如丙二醇、聚乙二醇)、非离子性表面活性剂(例如聚山梨酯80TM、HCO-50)等并用。作为油性液,可以使用例如芝麻油、大豆油等,可以与作为助溶剂的苯甲酸苄酯、苄醇等并用。另外,可以与缓冲剂(例如磷酸盐缓冲液、乙酸钠缓冲液)、无痛剂(例如苯扎氯铵、盐酸普鲁卡因等)、稳定剂(例如人血清白蛋白、聚乙二醇等)、防腐剂(例如苄醇、苯酚等)、抗氧化剂等配合。
如此得到的制剂例如可以对人或其他哺乳动物(例如大鼠、小鼠、兔、山羊、猪、牛、猫、犬、猴等)进行给药。
给药量根据给药对象、对象疾病、给药途径等而不同,例如在以皮肤外用剂的形态给药的情况下,通常对于成人(以体重60kg计)而言,每天给药约0.01mg~约30mg、优选约0.1mg~约20mg、更优选约0.1mg~约10mg的有效成分。在经口给药的情况下,通常对于成人(以体重60kg计)而言,每天给药约0.1mg~约100mg、优选约1.0mg~约50mg、更优选约1.0mg~约20mg的有效成分。例如,在以注射剂的形态非经口给药的情况下,通常对于成人(以体重60kg计)而言,每天静脉内给药约0.01mg~约30mg、优选约0.1mg~约20mg、更优选约0.1mg~约10mg的有效成分。每天的总给药量可以为单次给药量,也可以多次给药量。
在本发明的育发剂为饮食品的方式的情况下,饮食品包括健康食品、功能性食品、特定保健用食品、患者用食品、食品添加剂等。饮食品的形态没有特别限定。可以列举例如:茶饮料、清凉饮料、碳酸饮料、营养饮料、果实饮料、乳酸饮料等饮料、荞麦面、乌冬面、中华面、速食面等面类、糖、糖果、口香糖、巧克力、零食点心、饼干、果冻、果酱、奶油、烘焙糕点、面包等糕点和面包类、鱼糕、火腿、香肠等水产/畜产加工食品、加工乳、发酵乳等乳产品、色拉油、天妇罗油、人造黄油、蛋黄酱、起酥油、生奶油、调味品等油脂和油脂加工食品、调味酱、调味汁等调味料、咖喱、炖菜、盖饭、粥、杂烩粥等蒸煮袋食品、冰激凌、沙冰、刨冰等冷饮等。
在本发明的育发剂为营养补充剂的方式的情况下,例如可以以片剂、颗粒剂、散剂、饮料剂等的形态提供。
在制造营养补充剂时,可以添加例如:糊精、淀粉等糖类;明胶、大豆蛋白、玉米蛋白等蛋白质;丙氨酸、谷氨酰胺、异亮氨酸等氨基酸类;纤维素、阿拉伯树胶等多糖类;大豆油、中链脂肪酸甘油三酸酯等油脂类等任意的助剂,制剂化成任意的剂型。
本发明的肽通过与为了育发或生发促进而使用的其他有效成分组合使用,可以期待相加或协同地提高育发或生发促进作用。作为为了育发或生发促进而使用的其他有效成分,可以列举米诺地尔、非那雄胺等。
本发明进一步含有下述发明。
(a)上述本发明的肽在制造疫苗用佐剂、疫苗组合物、免疫激活剂或育发剂中的使用。
(b)用于增强疫苗抗原的免疫原性、用于诱导细胞因子的产生、用于诱导T细胞活化共刺激分子的表达、用于活化炎性小体、用于使毛乳头细胞生长、或用于促进针对毛乳头细胞的生长因子产生的上述本发明的肽。
(c)一种非治疗性的免疫激活或者育发或生发促进方法,其特征在于,对哺乳动物给药有效量的上述本发明的肽。
(d)一种免疫原性增强、免疫激活或者育发或生发促进方法,其特征在于,对哺乳动物给药有效量的上述本发明的肽。
(e)一种疫苗抗原的免疫原性增强方法,其特征在于,包括对需要疫苗给药的哺乳动物给药有效量的上述本发明的肽的步骤。
(f)一种育发或生发促进方法,其特征在于,包括对需要育发或生发促进的哺乳动物给药有效量的上述本发明的肽的步骤。
实施例
以下,通过实施例详细地对本发明进行说明,但本发明并不限定于这些实施例。
[实施例1:肽的合成]
按照文献Solid Phase Peptide Synthesis,pierce(1984)、Fmoc solid synthesis:a practical approach,牛津大学出版社(2000)和第5版实验化学讲座16有机化合物的合成IV等中记载的方法,使用全自动固相合成仪利用Fmoc法合成保护肽树脂。在所得到的保护肽树脂中添加三氟乙酸(TFA)和清除剂(苯甲硫醚、乙二硫醇、苯酚、三异丙基硅烷、水等的混合物),将肽从树脂上切下的同时进行脱保护,得到粗制肽。使用反相HPLC柱(ODS),利用0.1%TFA-H20/CH3CN的体系对该粗制肽进行梯度洗脱,进行纯化。收集包含目标物的级分进行冷冻干燥,得到目标肽。合成的肽的氨基酸序列使用氨基酸测序仪G1000A(Helett Packard)、PPSQ-23A(岛津制作所)或ProciscLC(ABI公司)进行确认,所得到的肽的N末端进行了乙酰化并且C末端进行了酰胺化。合成的肽的序列如下所示。
使用质谱分析装置(Voyager DE-Pro系列号6344)测定所合成的OSK-1的分子量。作为基质,使用二羟基苯甲酸(DHB),将基质0.5μL和样品0.5μL进行点样,并进行干燥。将MS分析的结果示于图13。
利用HPLC装置,在下述分析条件下测定所合成的OSK-1的纯度。
HPLC机型:Waters Alliance 2690
试样溶液:1mg/mL水溶液
注入量:20μL
测定波长:215nm
流量:每分钟1.2mL
柱:Discovery,C18,4.6mm×250mm,5微米
柱温:室温
流动相A:0.1%三氟乙酸水溶液
流动相B:0.1%三氟乙酸乙腈溶液
梯度条件:用20分钟使流动相B的浓度以直线梯度从25%变为45%。
(在20分钟内从25%缓冲液B→45%缓冲液B)
将HPLC分析的结果示于图14。
表1
[实施例2:对人单核细胞系细胞株(THP-1细胞)中的细胞因子产生的影响(1)]
(1)实验方法
将人单核细胞系细胞株THP-1细胞(JCRB注册编号:JCRB0112)以1×106细胞/mL悬浮在含有1μg/mL脂多糖(LPS)和10%FBS的RPMI1640培养基中,在CO2孵箱内静置3小时进行致敏。将细胞悬浮液离心,以1×106细胞/mL再悬浮于RPMI1640培养基(含有10%FBS)中,以500μL/孔接种到24孔板中。以500μL/孔添加另外按照最终浓度的2倍浓度用RPMI1640培养基(10%FBS)制备的OSK-1溶液。约16小时后回收培养上清,通过ELISA测定上清中的细胞因子浓度。
(2)结果
将对培养上清中的IL-1β、IL-18、TNFα和IL-6浓度进行测定的结果示于图1(A)~(D)。
对利用LPS致敏的THP-1细胞添加OSK-1时,确认到以浓度依赖的方式诱导了细胞因子的产生。
[实施例3:对人单核细胞系细胞株(THP-1细胞)中的细胞因子产生的影响(2)]
(1)实验方法
将THP-1细胞以5×105细胞/mL悬浮在含有50ng/mL PMA(佛波醇12-十四酸酯13-乙酸酯)和10%FBS的RPMI1640培养基中,以5×105细胞/孔接种在24孔板中。在CO2孵箱内培养2天,使其分化为巨噬细胞。2天后,除去培养基,在孔内添加用RPMI1640培养基(含有10%FBS)制备的OSK-1溶液,进一步培养一夜。16小时后回收培养上清,通过ELISA测定上清中的细胞因子浓度。
(2)结果
将对培养上清中的IL-1β、IL-18、TNFα和IL-6浓度进行测定的结果示于图2(A)~(D)。
在利用PMA分化的THP-1细胞中添加OSK-1时,在30μg/mL的浓度下确认到强细胞因子产生诱导作用。
[实施例4:对人单核细胞系细胞株(THP-1细胞)中的CD86和CD54表达的影响]
(1)实验方法
将THP-1细胞使用含有10%FBS和0.05mM巯基乙醇的RPMI1640培养基以2.0×105细胞/mL的密度添加50mL至75cm2烧瓶中,进行48小时预培养。
离心回收预培养的THP-1细胞,使用含有10%FBS和0.05mM巯基乙醇的RPMI1640培养基制备2.0×106细胞/mL的细胞悬浮液,在24孔板的各孔中接种500μL。在接种了细胞悬浮液的各孔中添加500μL使用同一培养基制备的肽。
培养一夜后,离心回收细胞,利用含有0.1%BSA的PBS(FACS缓冲液)反复进行两次清洗。然后,分散至600μL含有0.01%人γ-球蛋白溶液(Sigma,G2388)的FACS缓冲液中,在4℃孵育10分钟,进行Fc受体的封闭。
然后,为了用于抗体反应,将细胞悬浮液分成3份各180μL,分注到1.5mL管中,然后,对离心回收的颗粒添加将CD86抗体(Pharmingen;Cat#555657)、CD54抗体(Dako;Cat#F7143)和同种型对照(小鼠IgG)抗体(Dako;Cat#X0927)的各FITC标记抗体液用FACS缓冲液制备成适当浓度而得到的溶液50μL,在4℃下孵育30分钟。30分钟孵育后,离心回收细胞,利用FACS缓冲液反复进行两次清洗。将离心回收的细胞分散至含有0.625μg/mL碘化丙啶的FACS缓冲液200μL中,利用流式细胞仪测定活细胞1×104细胞,测定细胞表面抗原的表达量。不进行基于前向散射和侧向散射的设门,由所测定的平均荧光强度(MFI)利用以下所示的式算出相对荧光强度(RFI)。
(2)结果
将在THP-1细胞中添加OSK-1、AAP-1~AAP-6后的CD86和CD54的表达量示于图3(A)、(B)。
在THP-1细胞中添加OSK-1后,确认到强CD86和CD54表达诱导活性。对于从OSK-1的序列中使C末端的氨基酸(LKRK或KRLKRK)缺失而得到的序列(AAP-2~AAP-3)而言,随着氨基酸数减少,确认到CD86和CD54表达诱导活性大大降低的趋势。在CD54的情况下特别显著。对于从OSK-1的C末端使2个氨基酸缺失而得到的序列(AAP-1)、以及从OSK-1的N末端和C末端各自缺失1个氨基酸而得到的序列(AAP-4~AAP-6),未确认到大幅的活性降低。确认到OSK-1与具有佐剂活性的胞壁酰二肽(MDP)相比具有同等或更高的表达诱导活性(图9和图10)。由以上提示,LHRLKRLRKRL(序列编号1)所表示的氨基酸序列的C末端的“L”是本发明的肽的免疫激活作用所需要的。
将向THP-1细胞添加AAP-6、AAP-11和AAP-12后的CD86和CD54的表达量示于图4(A)、(B)。
对于从OSK-1的序列N末端使7个氨基酸缺失而得到的序列(AAP-12)而言,确认到CD86和CD54表达诱导活性大大降低的趋势。对于从OSK-1的N末端和C末端使3个氨基酸缺失而得到的序列(AAP-6)、从OSK-1的N末端使5个氨基酸缺失并且从C末端使3个氨基酸缺失而得到的序列(AAP-11),未确认到大幅的活性降低(图11和图12)。由以上提示,LHRLKRLRKRL(序列编号1)所表示的氨基酸序列的N末端的“L”是本发明的肽的免疫激活作用所需要的。
[实施例5:由OSK-1产生的炎性小体活化作用(1)]
(1)实验方法
对于THP-1细胞使用转染试剂(6μL/孔、HiPerfect转染试剂、QIAGEN公司制)转染针对作为炎性小体构成分子的NLRP3(NOD样受体家族含pyrin结构域蛋白3)的siRNA(终浓度100nM、Hs_CIAS1_6和Hs_CIAS1_9、QIAGEN公司制)或对照siRNA,培养一夜后,利用蛋白免疫印迹法确认NLRP3的表达水平。
将该THP-1细胞以1×106细胞/mL悬浮在含有1μg/mL LPS和10%FBS的RPMI1640培养基中,在CO2孵箱内静置3小时进行致敏。将细胞悬浮液离心,以1×106细胞/mL再悬浮于RPMI1640培养基(10%FBS)中后,以500μL/孔添加至24孔板中,添加以最终浓度的2倍浓度用RPMI1640培养基(10%FBS)制备的OSK-1溶液500μL。16小时后回收培养上清,通过ELISA测定上清中的IL-1β和TNFα浓度。
(2)结果
将利用蛋白免疫印迹法对NLRP3的表达水平进行确认的结果示于图5。确认了在THP-1细胞中,通过将针对NLRP3的siRNA转染到THP-1细胞中,使NLRP3的表达沉默。
将使用该THP-1细胞以10μg/mL的浓度添加OSK-1后的IL-13和TNFα产生量的比较结果示于图6(A)、(B)。在未使NLRP3表达沉默(转染了对照siRNA)的细胞中确认到由OSK-1引起的IL-1β产生诱导,但在使NLRP3表达沉默的细胞中由OSK-1引起的IL-1β产生诱导受到抑制。另一方面,对于不参与炎性小体的活化的TNFα,无论有无NLRP3表达的沉默,均确认到由OSK-1引起的TNFα产生诱导。
[实施例6:由OSK-1产生的炎性小体活化作用(2)]
(1)实验方法
将THP-1细胞以1×106细胞/mL悬浮在含有1μg/mL LPS和10%FBS的RPMI1640培养基中,在CO2孵箱内静置3小时进行致敏。将细胞悬浮液离心,以1×106细胞/mL再悬浮于RPMI1640培养基(含有10%FBS)中后,以100μL/孔接种到96孔板中。添加作为组织蛋白酶B抑制剂的Ca-074-Me(终浓度10μM)、半胱天冬酶-1抑制剂Z-YVAD-FMK(终浓度10μM)或培养基,进一步添加OSK-1或培养基后,在CO2孵箱内培养。16小时后回收培养上清,通过ELISA测定上清中的细胞因子浓度。
(2)结果
将基于利用LPS对THP-1细胞致敏的有无对OSK-1的IL-1β产生作用进行比较的结果示于图7。仅在利用LPS进行了致敏的情况下,确认到由OSK-1引起的IL-1β的产生。
将基于组织蛋白酶B抑制剂和半胱天冬酶-1抑制剂的有无对OSK-1的IL-1β产生作用进行比较的结果示于图8。确认到由OSK-1引起的IL-1β的产生诱导受到作为使炎性小体活化的组织蛋白酶B的抑制剂的Ca-074-Me、或者作为炎性小体构成分子半胱天冬酶-1的抑制剂的Z-YVAD-FMK的抑制。
由以上提示,通过LPS致敏而表达的proIL-1β被由OSK-1活化的作为炎性小体的构成分子的半胱天冬酶-1加工成IL-1β并释放到细胞外。
[实施例7:犬中的OSK-1的佐剂(疫苗抗原的免疫原性增强)效果的确认]
(1)实验方法
将犬中的OSK-1的佐剂效果与现有的弗氏佐剂(Freund’s Adjuvant)的佐剂效果进行比较。作为疫苗,使用AngII-KLH(血管紧张素II钥孔戚血蓝蛋白,Angiotensin II Keyhole limpet hemocyanin)(25μg/只),另外,作为佐剂,使用OSK-1(500μg/只)或弗氏佐剂(250μL/只),以2周的间隔对比格犬进行2次皮内给药(1组2只)。其中,弗氏佐剂组第一次给药使用完全弗氏佐剂,第二次给药使用不完全弗氏佐剂。在给药前和第一次给药起2周后、4周后进行采血,测定针对AngII的抗体效价。
在以AngII-BSA包被的ELISA用96孔板中添加使用5%脱脂奶粉/PBS进行了连续稀释的血清,在4℃下静置一夜。用PBS-T将孔清洗后,添加用5%脱脂奶粉/PBS稀释的HRP标记抗小鼠IgG抗体,在室温下振荡3小时。用PBS-T将孔清洗后,添加TMB溶液,避光静置30分钟,添加0.5N H2SO4使反应停止。测定450nm的吸光度,对抗体效价进行比较。
(2)结果
将结果示于图9。(A)为OSK-1组的结果,(B)为弗氏佐剂(FA)组的结果。在OSK-1组的个体中确认到AngII抗体效价的上升。
[实施例8:小鼠中的OSK-1的佐剂(疫苗抗原的免疫原性增强)效果的确认]
(1)实验方法
将小鼠中的OSK-1的佐剂效果与Alum和弗氏佐剂(Freund’s Adjuvant)的佐剂效果进行比较。作为疫苗,使用AngII-KLH(2μg/只),作为佐剂,使用OSK-1(100μg/只)、Alum(400μg/只)或弗氏佐剂(50μg/只),以2周的间隔对C57/BL6小鼠进行3次皮内给药(1组3只)。其中,弗氏佐剂组第一次给药使用完全弗氏佐剂,第二次和第三次给药使用不完全弗氏佐剂。在给药前和第一次给药起2周后、4周后、6周后、8周后进行采血,测定针对AngII的抗体效价。
抗体效价的测定利用与实施例7同样的方法进行。
(2)结果
将对OSK-1、Alum、弗氏佐剂(FA)的佐剂效果进行比较的结果示于图10。对于OSK-1组而言,尽管不及弗氏佐剂(FA)组,但确认到与Alum组相同程度的针对AngII的抗体效价的上升。
[实施例9:针对毛乳头细胞的生长因子产生促进作用(1)]
(1)实验方法
使用含有10%FBS的DMEM培养基将人毛乳头细胞以3×104细胞/孔接种到24孔板中,在CO2孵箱内培养一夜。次日,除去培养基,添加使用含有1%FBS的DMEM培养基制备的肽溶液,在CO2孵箱内培养5天。回收培养上清,通过ELISA测定KGF、HGF和VEGF的浓度。
(2)结果
将通过ELISA测定使各种肽作用于人毛乳头细胞时的培养上清中的KGF、HGF、VEGF浓度的结果示于图11(A)~(C)。确认到OSK-1以浓度依赖的方式促进各生长因子的产生。对于AAP-1、AAP-4~AAP-6,也与OSK-1同样地以浓度依赖的方式确认到各生长因子的产生作用。对于从OSK-1的序列中使C末端的氨基酸(LKRK或KRLKRK)缺失而得到的序列(AAP-2和AAP-3)而言,各生长因子的产生作用降低。特别是HGF的产生促进作用降低。由以上提示,LHRLKRLRKRL(序列编号1)所表示的氨基酸序列的C末端的“L”是本发明的肽的生长因子产生促进作用所需要的。
[实施例10:OSK-1与类似肽(SR-07和SR-08)的CD54表达诱导作用的比较]
将OSK-1与类似肽(SR-07和SR-08)的CD54表达诱导作用进行比较。实验方法与实施例4同样地进行。SR-07和SR-08为WO2010/137594中记载的肽,序列如下表2所示。
表2
*dK:D型
将试样未处理对照细胞(溶剂处理细胞)的生存率显示为90%以上时作为试验成立,在试验实施时的各试样浓度下的细胞生存率低于50%的情况下,将该浓度下的CD54的值排除在判定之外。
将结果示于图12。与SR-07和SR-08相比较,OSK-1确认到强CD54表达诱导活性。
[实施例11:对人单核细胞系细胞株(THP-1细胞)中的细胞因子产生的影响(3)]
(1)实验方法
利用与实施例3相同的方法进行实验,测定培养上清中的IL-1β、IL-18、TNFα、IL-6、RANTES、MIP-1α和MIP-1β浓度。
(2)结果
将结果示于图15(A)~(G)。在利用PMA进行了分化的THP-1细胞中添加OSK-1时,确认到OSK-1浓度依赖性的趋化因子、细胞因子的产生诱导作用。
[实施例12:对小鼠巨噬细胞(RAW264.7细胞)中的细胞因子产生的影响]
(1)实验方法
将RAW264.7细胞以1×106细胞/mL悬浮在含有50ng/mL LPS和10%FBS的DMEM培养基中,在CO2孵箱内静置3小时进行致敏。将细胞悬浮液离心,以1×106细胞/mL再悬浮在DMEM培养基(含有10%FBS)中,以500μL/孔接种到24孔板中。以500μL/孔添加另外以最终浓度的2倍浓度用DMEM培养基(含有10%FBS)制备的OSK-1溶液。约16小时后回收培养上清,通过ELISA测定上清中的细胞因子浓度。
(2)结果
将对培养上清中的IL-1β、IL-18、TNFα和IL-6浓度进行测定的结果示于图16(A)~(D)。
对利用LPS致敏的RAW264.7细胞添加OSK-1时,确认到OSK-1浓度依赖性的细胞因子的产生诱导。
[实施例13:对小鼠骨髄来源树突细胞中的细胞因子产生的影响]
(1)实验方法
从C57BL/6小鼠的股骨采集骨髄细胞,将骨髄细胞接种到含有20mg/mL GM-CSF(粒细胞-巨噬细胞集落刺激因子,Granulocyte Macrophage colony-stimulating Factor)和10%FBS的RPMI1640培养基中,培养3天。培养3天后追加培养基,进一步培养4天。回收未贴附到培养板上的细胞,作为骨髄来源树突细胞。使用RPMI1640培养基(含有10%FBS)以2×106细胞/mL制备细胞悬浮液,以500μL/孔接种到24孔板中。以500μL/孔添加另外以最终浓度的2倍用RPMI1640培养基(含有10%FBS)制备的OSK-1溶液。约16小时后回收培养上清,通过ELISA测定上清中的细胞因子浓度。
(2)结果
将对培养上清中的IL-1β、IFNγ、TNFα、IL-6和IL-12p70浓度进行测定的结果示于图17(A)~(E)。
对小鼠骨髄来源树突细胞添加OSK-1时,确认到OSK-1浓度依赖性的细胞因子的产生诱导。
[实施例14:对人单核细胞系细胞株(THP-1细胞)中的细胞因子产生的影响(与Alum、CpG核苷酸的比较)]
(1)实验方法
将THP-1细胞以1×106细胞/mL悬浮在含有1μg/mL LPS和10%FBS的RPMI1640培养基中,在CO2孵箱内静置3小时进行致敏。将细胞悬浮液离心,以1×106细胞/mL再悬浮在RPMI1640培养基(含有10%FBS)中,以500μL/孔接种到24孔板中。以500μL/孔添加另外以最终浓度的2倍浓度用RPMI1640培养基(含有10%FBS)制备的OSK-1、Alum(2%Alhydrogel、InvivoGen)或CpG核苷酸(CpG ODN 2006、Novus Biologicals)溶液。约16小时后回收培养上清,通过ELISA测定上清中的细胞因子浓度。
(2)结果
将对培养上清中的IL-1β、IL-18、TNFα、IL-6浓度进行测定的结果示于图18(A)~(D)。
对利用LPS致敏的THP-1细胞添加OSK-1时,与Alum和CpG核苷酸相比,确认到IL-1β、IL-18和TNFα的强产生诱导作用。对于IL-18,虽然弱于Alum,但OSK-1仍确认到显著的产生诱导。
[实施例15:对人单核细胞系细胞株(THP-1细胞)中的CD86和CD54表达的影响(与Alum的比较)]
(1)实验方法
作为肽,使用OSK-1,作为对照,使用Alum,除此以外,通过与实施例4相同的方法进行实验。
(2)结果
将在THP-1细胞中添加OSK-1或Alum时的CD86和CD54的表达量示于图19(A)、(B)。
在THP-1细胞中添加OSK-1时,确认到强CD86和CD54表达诱导活性。另一方面,在THP-1细胞中添加Alum时,未确认到CD86和CD54表达诱导活性。
[实施例16:人单核细胞系细胞株(THP-1细胞)中的由OSK-1引起的NFκB的活化]
(1)实验方法
使用RPMI1640培养基(含有10%FBS)以5×105细胞/500μL制备THP-1细胞,以500μL/孔接种在24孔板中。添加用RPMI1640培养基(含有10%FBS)制备的QNZ(Enzo、最终浓度10μM)、BAY11-7082(Enzo、最终浓度10μM)或RPMI1640培养基(含有10%FBS),培养2.5小时。添加OSK-1使最终浓度为100ng/mL,培养2小时后,回收培养上清,通过ELISA测定上清中的TNFα浓度。
(2)结果
将结果示于图20。OSK-1在THP-1细胞中诱导了TNFα的产生,但添加作为NFκB抑制剂的QNZ或BAY11-7082时,由OSK-1引起的TNFα的产生受到抑制。由该结果确认,OSK-1具有NFκB活化作用。
[实施例17:由OSK-1-血管紧张素II结合疫苗引起的抗体产生]
(1)实验方法
制作将OSK-1肽和血管紧张素II肽以ε-Acp作为间隔物结合而成的“OSK-1-AngII结合疫苗”,使用小鼠对抗体产生作用进行评价。组构成设定为(1)AngII-KLH(5μg/小鼠)+Alum(2%Alhydrogel、InvivoGen、0.4mg/小鼠)、(2)OSK-1-AngII结合疫苗(10μg/小鼠)、(3)OSK-1-AngII结合疫苗(50μg/小鼠)这3组,以2周的间隔对Balb/c小鼠进行3次皮内给药(各组6只)。在给药前和第一次给药起2周后、4周后、6周后、8周后进行采血,通过ELISA测定针对血管紧张素II的抗体效价。此外,通过ELISA对所产生的抗体的IgG亚型进行分析。
(2)结果
将针对血管紧张素II的抗体效价的测定结果示于图21,将所产生的抗体的IgG亚型的分析结果示于图22(A)、(B)。
OSK-1-AngII结合疫苗以浓度依赖的方式诱导了针对血管紧张素II的抗体产生。
IgG亚型的分析中,在由与被视为Th2型佐剂的Alum一同给药的AngII-KLH疫苗产生的抗体中,作为Th2型的IgG1的产生高,而在由OSK-1-AngII结合疫苗产生的抗体中,不仅Th2型的IgG1的产生高,而且作为Th1型的IgG2a、IgG2b和IgG3的产生也高。
[实施例18:由OSK-1-WT1结合疫苗引起的WT1特异的免疫诱导]
(1)实验方法
制作将OSK-1肽和WT1肽以ε-Acp作为间隔物结合而成的“OSK-1-WT1结合疫苗”,使用小鼠对WT1特异性的免疫诱导能力进行评价。组构成设定为(1)生理盐水、(2)WT1肽(15μg/小鼠)+不完全弗氏佐剂(IFA、SIGMA;Cat#F5506、50μL/小鼠)、(3)WT1肽(15μg/小鼠)+OSK-1(100μg/小鼠)、(4)OSK-1-WT1结合疫苗(50μg/小鼠)、(5)OSK-1-WT1结合疫苗(300μg/小鼠)这5组(各组3只)。对C57BL/6小鼠每周1次进行4周疫苗给药,在第4次给药起2周后从免疫的小鼠中摘取脾脏,进行ELISpot分析。即,由摘取的脾脏制备脾细胞,将脾细胞接种到包被有抗IL-4抗体或抗IFNγ抗体的过滤板中。添加WT1肽或OSK-1-WT1肽培养3天后,对过滤板的孔进行染色,测定IL-4或IFNγ产生细胞的点数。
(2)结果
在添加OSK-1作为佐剂的组(3)以及将OSK-1与WT1结合的组(4)和组(5)中,确认到大量对于WT1肽刺激产生IFNγ的细胞。特别是在组(5)中反应性高。另一方面,在添加IFA作为佐剂的组(2)中,确认到大量对于WT1肽的刺激发生反应而产生IL-4的细胞。
[实施例19:针对毛乳头细胞的生长因子产生促进作用(2)]
(1)实验方法
作为肽,使用OSK-1和AAP-11,通过与实施例9相同的方法测定KGF、HGF和VEGF的浓度。
(2)结果
将结果示于图23。AAP-11以浓度依赖的方式促进各生长因子的产生。
[实施例20:OSK-1的育毛作用]
(1)实验方法
对于处于毛静止期的8周龄的雄性C3H/HeN小鼠的背部以不损伤背部的方式进行推剪和剃刀剃毛。剃毛区域的面积设定为2×4cm。从剃毛3天后开始1天1次涂布0.02%(w/v)、0.1%(w/v)或0.5%(w/v)的OSK-1溶液各100μL,涂布14天。对照组涂布生理盐水,阳性对照组涂布3%(w/v)米诺地尔。将剃毛日设为第0天,将第3天、第7天、第10天、第14天和第17天生毛部位的面积相对于小鼠剃毛部的总面积按照“0%:得分0”、“~20%:得分1”、“~40%:得分2”、“~60%:得分3”、“~80%:得分4”、“~100%:得分5”进行得分化。另外,在第17天拔取10根在小鼠的剃毛部生出的被毛,使用实体显微镜测定这些被毛的长度,将其合计值作为各个体的毛的长度(mm)。
(2)结果
将结果示于图24。(A)为第17天的被毛的长度,(B)为生毛面积得分的结果。可知OSK-1以浓度依赖的方式促进育毛。另外,0.5%OSK-1组的生毛得分和毛的长度与3%米诺地尔组基本同等。
需要说明的是,本发明并不限定于上述各实施方式和实施例,可以在权利要求所示的范围内进行各种变更,将不同实施方式中分别公开的技术手段适当组合而得到的实施方式也包含在本发明的技术范围中。另外,本说明书中记载的学术文献和专利文献全部以参考的方式援引到本说明书中。
产业上的可利用性
本发明的肽具有免疫激活作用,因此能够作为免疫激活剂使用。能够适合作为疫苗用佐剂使用。另外,含有本发明的肽的疫苗组合物能够进行更有效的治疗。此外,本发明的肽能够适合作为以育发或生发促进为目的的化妆品、准药品、药品、饮食品、营养补充剂的成分使用。
序列表
<110> 国立大学法人大阪大学(Osaka University)
<120> 新型肽及其用途(New peptide and utilization thereof)
<130> O11F5368
<150> JP 2014-197386
<151> 2014-09-26
<160> 14
<170> PatentIn version 3.1
<210> 1
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> synthesized peptide
<400> 1
Leu His Arg Leu Lys Arg Leu Arg Lys Arg Leu
1 5 10
<210> 2
<211> 20
<212> PRT
<213> Artificial Sequence
<220>
<223> synthesized peptide
<400> 2
Glu Leu Lys Leu Ile Phe Leu His Arg Leu Lys Arg Leu Arg Lys Arg
1 5 10 15
Leu Lys Arg Lys
20
<210> 3
<211> 18
<212> PRT
<213> Artificial Sequence
<220>
<223> synthesized peptide
<400> 3
Glu Leu Lys Leu Ile Phe Leu His Arg Leu Lys Arg Leu Arg Lys Arg
1 5 10 15
Leu Lys
<210> 4
<211> 16
<212> PRT
<213> Artificial Sequence
<220>
<223> synthesized peptide
<400> 4
Glu Leu Lys Leu Ile Phe Leu His Arg Leu Lys Arg Leu Arg Lys Arg
1 5 10 15
<210> 5
<211> 14
<212> PRT
<213> Artificial Sequence
<220>
<223> synthesized peptide
<400> 5
Glu Leu Lys Leu Ile Phe Leu His Arg Leu Lys Arg Leu Arg
1 5 10
<210> 6
<211> 18
<212> PRT
<213> Artificial Sequence
<220>
<223> synthesized peptide
<400> 6
Leu Lys Leu Ile Phe Leu His Arg Leu Lys Arg Leu Arg Lys Arg Leu
1 5 10 15
Lys Arg
<210> 7
<211> 16
<212> PRT
<213> Artificial Sequence
<220>
<223> synthesized peptide
<400> 7
Lys Leu Ile Phe Leu His Arg Leu Lys Arg Leu Arg Lys Arg Leu Lys
1 5 10 15
<210> 8
<211> 14
<212> PRT
<213> Artificial Sequence
<220>
<223> synthesized peptide
<400> 8
Leu Ile Phe Leu His Arg Leu Lys Arg Leu Arg Lys Arg Leu
1 5 10
<210> 9
<211> 12
<212> PRT
<213> Artificial Sequence
<220>
<223> synthesized peptide
<400> 9
Leu His Arg Leu Lys Arg Leu Arg Lys Arg Leu Lys
1 5 10
<210> 10
<211> 12
<212> PRT
<213> Artificial Sequence
<220>
<223> synthesized peptide
<400> 10
Phe Leu His Arg Leu Lys Arg Leu Arg Lys Arg Leu
1 5 10
<210> 11
<211> 13
<212> PRT
<213> Artificial Sequence
<220>
<223> synthesized peptide
<400> 11
His Arg Leu Lys Arg Leu Arg Lys Arg Leu Lys Arg Lys
1 5 10
<210> 12
<211> 20
<212> PRT
<213> Artificial Sequence
<220>
<223> synthesized peptide
<400> 12
Met Leu Lys Leu Ile Phe Leu His Arg Leu Lys Arg Met Arg Lys Arg
1 5 10 15
Leu Lys Arg Lys
20
<210> 13
<211> 19
<212> PRT
<213> Artificial Sequence
<220>
<223> synthesized peptide
<400> 13
Leu Lys Leu Ile Phe Leu His Arg Leu Lys Arg Met Arg Lys Arg Leu
1 5 10 15
Lys Arg Lys
<210> 14
<211> 29
<212> PRT
<213> Artificial Sequence
<220>
<223> synthesized peptide
<400> 14
Glu Leu Lys Leu Ile Phe Leu His Arg Leu Lys Arg Leu Arg Lys Arg
1 5 10 15
Leu Lys Arg Lys Leu Arg Leu Trp His Arg Lys Arg Tyr
20 25
- 还没有人留言评论。精彩留言会获得点赞!