用于预防和/或治疗亨廷顿氏病的物质和方法与流程
亨廷顿氏病是一种具有常染色体显性遗传模式的罕见的单亲疾病(monogenetic disease)。它是由人染色体4上的亨廷顿蛋白(Huntingtin,HTT)基因的编码区内的CAG三核苷酸重复扩增引起的(Novak&Tabrizi,2011)。成因性CAG重复扩增与复制期间的遗传不稳定性和RNA剪接的变化相关。然而,最重要的是,编码的蛋白质由于在蛋白质的N-末端部分中的扩展的聚谷氨酰胺(polyQ)段而在结构上改变,导致结构改变的且修饰的亨廷顿蛋白和蛋白质片段在脑和其他器官或细胞中随时间而积累。该过程类似于其他神经变性性蛋白病(proteinopathy),诸如例如阿尔茨海默氏病或帕金森氏病或多系统萎缩,其中共同特征是形成与蛋白质降解产物组合的聚集体或蛋白质原纤维。在亨廷顿氏病中,病理学标志是主要地纹状体和皮层的进行性神经变性,伴有聚集且降解的亨廷顿蛋白的积累。
亨廷顿氏病的临床症状以可预测的方式进展,微妙地开始于情绪变化或认知问题,随后是不稳定的步态和运动问题。随着时间的推移,身体能力恶化,伴有明显的运动协调问题,加上精神能力的下降,以及精神和行为问题。平均预期寿命是第一次临床表现后约二十年。症状可以显著变化,并且已经充分证明,发病年龄与突变亨廷顿蛋白基因中CAG重复的数量反相关,这证实突变亨廷顿蛋白的成因作用。
没有对亨廷顿氏病的治愈或预防。为了控制症状,在疾病的后期需要全时患者护理,并且患者和他的社会环境的负担是相当大的。症状性治疗如药物和非药物治疗可以缓解一些症状。
根据目前对亨廷顿氏病病因和遗传原因的理解,突变体亨廷顿蛋白被认为是疾病缓解靶向策略的主要靶标,尽管不是以常规方式(Yu等人,2014)。基于临床遗传学和来自动物模型的功能证据(Bard等人,2014),亨廷顿蛋白降低策略被认为是最重要意义的方法,尽管存在与这样的构思相关的分子挑战(Zheng&Diamond,2012)。目前的策略通常受到将治疗剂递送到脑中受影响的神经元内的靶向位点的缺乏阻碍。这使目前正在开发的DNA或mRNA靶向方法变得有价值(Davidson,2012)。一种替代方法由使用由靶向脑内细胞内亨廷顿蛋白的病毒载体提供的胞内抗体(intrabody)组成(Butler等,2012)。尽管在临床前模型中已证明其功能性,这些方法面临针对靶位点的主要递送挑战。此外,“外来”结构例如诸如基于scFv的胞内抗体(Messer&Joshi,2013)带有潜在地构成针对宿主的新表位的风险,从而诱导针对治疗剂的不期望的体液免疫应答或针对表达和呈递“外源”蛋白质的细胞的T细胞应答。
WO 2012/140376A1公开了治疗性肽pep4和pep42,这两种肽都不延伸到HTT的c6切割位点。WO 2010/015592A2公开了用于突变的polyQ蛋白的测定法。Ko等人(Brain Res.Bull.56(2001):319-329)公开了抗HTT单克隆抗体,大多数结合HTT的polyQ结构域。Persichetti等人(Mol.Med.1(1995):374-383)公开了抗体引发肽HP1和HP12。
US 2007/0026029A1公开了用于治疗和预防阿尔茨海默氏病的成分输血装置。Weiss等人(Anal.Biochem.395(2009):8-15)公开了用于动物和人组织中的突变体HTT的检测方法。Butler等人(Prog.Neurobiol.97(2011):190-204)公开了用于HD患者的抗体治疗。US 2010/0233180A1公开了结合HTT的polyP区的抗体。Chen等人(Chem.Biol.18(2011):1113-1125)提示了用于HD治疗的扩增的polyQ类肽。
为了提供用于亨廷顿氏病的替代性治疗方法,本发明提供了包含能够靶向亨廷顿蛋白的抗体的成分输血装置。在亨廷顿氏病中,越来越意识到,该病症伴随着全身化的变化,包括免疫系统、外周组织、外周血淋巴细胞(PBL)和代谢,强调这种疾病的系统性质。作为实例,病理性亨廷顿蛋白积聚不仅仅限于CNS,而且也可以在外周血细胞中检测到(Weiss等人,2012)。通过降低原代人巨噬细胞/单核细胞中的亨廷顿蛋白表达,先天免疫系统的干扰可以通过亨廷顿蛋白靶向性RNA干扰部分逆转(等人2014)。
除了检测血细胞内的亨廷顿蛋白外,可溶性亨廷顿蛋白或亨廷顿蛋白片段在健康供体的人血浆蛋白质组中偶然检测到(Liu等人2007)或通过ELISA在迄今为止与亨廷顿氏病无关的青光眼患者的血浆中检测到,这(Tezel等人2012)。尽管免疫系统在亨廷顿氏病中的重要作用已被公认(Ellrichmann等人,2013),但是胞外亨廷顿蛋白的可能的成因作用已经在很大程度上被忽略。新近,血浆和CSF亨廷顿蛋白仅被建议作为监测疾病进展的潜在生物标志物(Weiss等人,2014)。靶向可能致病的、促进疾病的细胞外亨廷顿蛋白先前被认为不是治疗靶标,也未显示使用例如亨廷顿蛋白抗体进行成分输血是否可提供治疗益处。
本发明的一个目的是提供用于亨廷顿氏病的新的治疗策略,特别是超出仅仅控制症状的策略。另一个目的是提供用于预防或延迟与亨廷顿氏病相关症状的发作的方法(means)。
因此,本发明提供了一种用于捕获HTT以治疗亨廷顿氏病或延迟其临床症状发作的成分输血装置。根据本发明的亨廷顿成分输血是治疗亨廷顿氏病的一种全新的方法,并且通过本发明显示是高度有效的。本发明的成分输血装置使用HTT结合分子(即,特异性结合亨廷顿氏病患者的血浆(全血、血清或其他血液衍生物;在下文中,对“血浆”的提及通常也适用于任何其他体液,特别是来源于血液的那些体液,如血清)或其他体液(潜在含有HTT或HTT片段,如CSF)中含有的HTT和/或HTT片段的分子(“受体”))。因此,根据本发明的“捕获HTT”或“结合HTT”还包括捕获可以被捕获或结合的源自HTT(并且生理学和/或病理学相关)的HTT片段,例如从身体外引导到成分输血装置的血液或血浆流。优选的HTT片段是源自血浆HTT的结构暴露/可接近结构域的那些HTT片段肽,如本文中公开的蛋白酶切割位点或HTT的相当的酶底切物位点。所有这样的HTT片段也非常适合于产生mAb,以便产生根据本发明的HTT-成分输血吸附剂(“HTT结合分子”;“HTT-结合受体”)。
根据本发明的“捕获HTT”或“结合HTT”还包括以与其它分子缔合的形式结合HTT(或其片段)。
根据本发明的“HTT结合分子”可以是特异性结合HTT(或其天然存在的且病理相关的片段)的任何分子。特别优选一组HTT结合分子是基于抗HTT抗体的结合分子,优选单克隆或多克隆抗HTT抗体,其可以容易地固定在固体表面上。特别优选的是这样的抗体的HTT结合片段或衍生物,例如Fab、Fd、Fab'、F(ab')2、Fv或ScFv片段。HTT结合分子也可以根据其就可提供性(providablility)而言的效率选择,例如,基于生产效率、折叠效率、稳定性、蛋白酶抗性、pH抗性、亲和力或固定能力。
根据本发明的优选HTT结合分子(也称为“成分输血吸附剂”)对HTT(及其片段)具有高亲和力和特异性,是稳定的,并且是有蛋白酶抗性的,以防止蛋白水解片段脱落到血液流中(如果脱落是特定成分输血结构的关切,那么人或人源化抗体(或其衍生物)是优选的,因为脱落的人/人源化抗体片段比小鼠片段具有更小的免疫原性;然而,这通常不是主要问题,因为一般排除“不稳定”吸附剂分子,所述“不稳定”吸附剂分子当它与血浆接触时易于蛋白水解)。由于需要大量的HTT结合分子,所以这种HTT结合分子的重组蛋白质的生产是第一选择(而不是从血清中纯化等)。这是划算的,并且其意味着蛋白质在哺乳动物细胞、酵母、细菌或植物蛋白质生产系统中正确折叠和及时高产率生产方面是小的和稳健(robust)的。
由于成分输血装置的适当使用也可能需要可以通过pH休克(pH shock)进行的再循环(解吸附),优选的吸附剂应该是pH耐受的,即HTT结合分子应当正确地重折叠,使得其亲和力和特异性不受阻碍。
优选的HTT结合分子还应该有效地固定在基质支持物上,这优选通过共价、导向/定向固定化(特别是通过分子上的一个确定的反应基团(半胱氨酸、伯胺、人工引入的醛等-参见例如van Vught R等人Comput Struct Biotechnol J.2014;PMID:24757499)的综述),其适用于任何重组蛋白质,如重组mAB或优先地较小的实体,如Fab或scFv等。
在固体表面上进行(身体外)血液或血浆流(任选地含有将从具有亨廷顿氏病的患者的血液中除去的HTT),以通过使HTT结合到根据本发明的成分输血装置的固体表面上的HTT结合分子来特异性地除去HTT。特别地,靶向HTT的特定免疫原性表位(如富含聚脯氨酸的区域)或其它结构暴露的位点,(如先前描述的在亨廷顿蛋白的氨基酸位置586上的蛋白酶切割位点周围的区域)的抗体可以用于根据本发明的成分输血装置中。在下文中,该病原学/功能上重要的切割区域将被称为“胱天蛋白酶(caspase)区域586”。Graham等人,2006已经显示了,通过遗传手段阻止胱天蛋白酶6切割抑制携带突变型人亨廷顿蛋白转基因的小鼠中的表型。Wong等人(Wong 2014)提供了其他蛋白酶也可以接近这个区域的证据。
凭借本发明,第一次提出通过成分输血靶向血浆亨廷顿蛋白来抵抗亨廷顿氏病。到目前为止,(细胞外)血浆HTT尚未被认为是治疗这种疾病的靶标。此外,本发明通过体外吞噬测定和通过在经成分输血治疗的动物中在体内降低HTT水平和动物模型中的表型效应似乎可信地提供了作用模式机制(然而,本发明并不限于这些机制),提供了令人信服的POC(概念证明),显示血浆HTT靶向在人患者中也是有益的。
此外,本发明提供了HTT衍生肽,其提供待用于根据本发明的成分输血装置中的抗体。在本发明的过程中,定义了用于提供这种抗体的最相关肽的核心表位。提供了源自HTT的胱天蛋白酶区的肽,其用于提供和诱导特异性结合HTT的抗体(AB)。这些肽用于产生也可用于通过治疗性成分输血(单独或与疫苗接种组合)来诊断和治疗亨廷顿氏病的各种单克隆抗体(mAB),作为用于在生物标志物评价/发现中测定HTT水平的工具,以及用作用于(伴随)诊断的工具等。
如本文中使用,“亨廷顿蛋白”,“蛋白质亨廷顿蛋白”或“HTT”是指亨廷顿蛋白基因的表达产物。在UniProtKB/Swiss-Prot数据库(版本148,最后修改于2014年5月14日)中,在P42858(HD_HUMAN)下可获得蛋白质详情(并且本文依赖于此)。由于从HTT的氨基酸位置18开始polyQ区域的变异,胱天蛋白酶切割位点在UniProt数据库条目中称为在氨基酸584和585之间。在科学文献中以及也在本文中,胱天蛋白酶切割位点称为在氨基酸残基586和587之间(即在“VLD”之后且在“GTD”之前,即在D和G之间)。因此,根据本发明的“C6切割区”或“C6切割区586”对应于P42858(HD_人)UniProtKB/Swiss-Pro数据库条目中的氨基酸584。
例如,根据本发明的成分输血装置中使用的抗体可以靶向亨廷顿蛋白的第二个功能定义区域,称为PRR结构域(代表富含脯氨酸的区域)。该区域以前已经显示牵涉在与细胞内蛋白质相互作用,诸如例如与PACSIN1(Modregger等人,2002),并使用单链Fv片段评估为潜在的体内抗体靶向区域(Southwell等人,2011)。
在本发明的一个实施方案中,给本发明提供的抗体可以用于血浆成分输血中以降低亨廷顿蛋白的血浆水平,以前未曾提出过的策略,因为先前没有认识到血浆中的亨廷顿蛋白的致病性作用。如实施例6中所示。
本发明公开了源自PRR和c6区的肽。根据本发明的肽具有显著的有益技术关系,其通过若干共同特征反映:(1)根据本发明的所有PRR-和C6-衍生的肽都共享特定的免疫原性;它们的表位是特别可接近的(与例如来自如实施例1中所示的极其N-末端或polyQ区域的肽形成对比);特别地,靶向它们的表位对于实现治疗效果是高度相关的,如下文实施例部分中的功能性体内实施例中所示的。(2)将根据本发明的肽定位到HTT的下述区域,其中已经证明了结构/功能相关性,如蛋白酶可接近性或蛋白质-蛋白质相互作用。(3)最重要的是,这两个表位的组合靶向提供了有效的治疗效果(与使用一个单一表位形成对比)。
在此背景中,必须注意,不是任何HTT衍生的肽可以用于治疗HTT。这也在下面的实施例部分中显示。事实上,某些肽比其它肽更具免疫原性。此外,某些肽的组合显示更强的有效性(例如,在HTT血浆清除率和运动效应方面,PRR区域肽和C6-区域肽的组合)。本发明还提供了用于治疗HTT的肽的有利组合。如已经提到的,凭借本发明,提供了靶向(作为治疗原理)细胞外HTT的治疗性疫苗。这单独已经是一个完全新的策略,因为HTT一直被称为细胞内聚集蛋白。
根据本发明的肽和本疫苗靶向区域根据(1)区域/肽的可接近性和(2)免疫原性来定义。此外,肽的某些组合(如以下体内实施例中所示)提供增强的HTT清除和表型(运动和组织学)变化。这些变化可以通过Fc受体介导的清除机制(吞噬作用)来解释,也如实施例中所示。Fc-受体介导的吞噬作用需要抗原-抗体复合物的多价性,这解释了在两个或多个而不是一个单一表位上靶向HTT的更高的有效性:呈现多个Fc部分的抗原/抗体复合物比由一种单一抗体结合的单个HTT分子更可能被吞噬作用清除。
这没有被现有技术公开或提示。例如,WO2012/140376A1中公开的治疗性肽pep4和pep42或由Miller等人(2003)报道的源自HTT的N端的肽源自与根据本发明的肽不同的HTT区域。甚至更重要的是,例如在WO2012/140376A1中描述的这些肽从未意图或用于任何治疗目的,诸如例如,疫苗(即用于在活生物体中诱导B细胞免疫应答)。相反,WO2012/140376A1公开了可用于聚集抑制(即通过直接干扰HTT或其片段)的肽,其不涉及诱导如疫苗所需的免疫应答。产生WO2010/015592A2中的抗体作为用于通过FRET测定或其它体外分析手段检测HTT(或其聚集体或片段)的探针。再一次,提供这些抗体的目的是实验/分析或诊断的,但不是治疗的。通常,以前从未提出或证明抗HTT抗体可用于治疗亨廷顿氏病的治疗目的。此外,没有来自WO 2010/015592 A2的任何抗体具有与根据本发明的疫苗接种肽的重叠。最后,在Persichetti等人(1995)中引用的肽“HP1”和“HP12”用于产生多克隆抗血清,以便提供分析探针,用于在实验条件下的HTT检测(如通过Western印迹或IHC的HTT检测),但不用于疫苗治疗。对于单克隆抗体也是如此,诸如例如描述在Ko等人,(2001)(例如MW1-8),其由polyQ-HTT-GST融合蛋白产生,但不通过肽免疫产生。
因此,重要的是注意到,根据本发明的肽适合于产生治疗性疫苗,而用于产生多克隆或单克隆抗体的现有技术肽被设计为提供用于分析或诊断用途的探针。
因此,源自PRR和C6区的根据本发明的肽是特别有利的。这两组都是高度免疫原性的,特别是SEQ ID No.1、4、16、19和28;和2、3、6-18和20-50;其中SEQ ID No.1-4由于其在体内实验中的功能性能而是高度优选的。
用于提供在根据本发明的成分输血装置中使用的抗体的HTT蛋白的免疫原性肽包含p6773(LPQPPPQAQPLLPQPQPC,SEQ ID No.1)、p7564(CPSDSSEIVLD,SEQ ID No.2)、p7543(GTDNQYLGLQIGC,SEQ ID No.3)、p7543a(DNQYLGLQIC;SEQ ID No.88),尤其是衍生物p9394(KTDNQYLGLQIGKC;SEQ ID No.91)、p9395(GTDNQYLGLQIGKKC;SEQ ID No.92)、p9396(KTDNQYLGLQIKKGC;SEQ ID No.93)、p9397(KDNQYLGLQIKKGC;SEQ ID No.94);p7543b(TDNQYLGLQIC;SEQ ID No.89)、p7543c(TDNQYLGLQIGC;SEQ ID No.90)、p6771(LPQPPPQAQPLLPC,SEQ ID No.4)、p6776(CSEIVLDGTDNQYL,SEQ ID No.36)、p6777(CSDSSEIVLDGTDN,SEQ ID No.37)、和p8346(CGPAVAEEPLHRP,SEQ ID No.5)。这些序列中的“C”残基总是作为接头使用(并且已经引入);可以存在或不存在或备选在肽的C-或N-末端(即在肽链的备选末端)提供N末端或C末端的此半胱氨酸接头(作为任何其它接头,诸如-GC,-GGC,-KC,-KCC,-KCC,-KKC,-KKG,-KCG,-KGC,-KKGC,-KKCG(及其N-末端变体,诸如CG-,CGG-等)或半胱氨酸与作为间隔区的氨基酸(诸如例如β-丙氨酸或赖氨酸)的类似组合,如例如分别用于肽p6775,p6768,p9394,p9395,p9396或p9397中,或作为提供接头或间隔区功能或改善的肽溶解性而不妨碍免疫学性质的其他化学部分)。例如在赖氨酸衍生物p9394-p9397中提供了接头肽与溶解度改进剂的这种组合。在其它实施方案中,还可以在除N-或C-末端以外的氨基酸位置提供接头,例如,在具有官能团的氨基酸处,如丝氨酸,赖氨酸,精氨酸,酪氨酸,苏氨酸,天冬氨酸或谷氨酸,天冬酰胺或谷氨酰胺,组氨酸,甲硫氨酸等(特别是衍生物p9394(KTDNQYLGLQIGKC;SEQ ID No.91),p9395(GTDNQYLGLQIGKKC;SEQ ID No.92),p9396(KTDNQYLGLQIKKGC;SEQ ID No.93),p9397(KDNQYLGLQIKKGC;SEQ ID No.94));然而,在这样的实施方案中,必须注意肽的免疫学性质不被这种连接严重阻碍。
其它抗体引发性免疫原性肽选自p8855(SDSSEIVLDGTDC,SEQ ID No.6),p8858(EIVLDGTDNQYLC,SEQ ID No.7),p8859(IVLDGTDNQYLGC,SEQ ID No.8),p8860(VLDGTDNQYLGLC,SEQ ID No.9),p8861(LDGTDNQYLGLQC,SEQ ID No.10),p8862(DGTDNQYLGLQIGC,SEQ ID No.11),p8869(CTDNQYLGLQIGQ,SEQ ID No.12),p8868(CGTDNQYLGLQIG,SEQ ID No.13),p8870(CDNQYLGLQIGQP,SEQ ID No.14),p8871(CNQYLGLQIGQPQ,SEQ ID No.15),p6772(CPQLPQPPPQAQPLLP,SEQ ID No.16),p8864(TDNQYLGLQIGQC,SEQ ID No.17),p8865(DNQYLGLQIGQPC,SEQ ID No.18),p6775(PPPQLPQPPPQAQPLLPQPQPaC,SEQ ID No.19),p8854(PSDSSEIVLDGTC,SEQ ID No.20),p8856(DSSEIVLDGTDNC,SEQ ID No.21),p8857(SEIVLDGTDNQYC,SEQ ID No.22),p8866(NQYLGLQIGQPQC,SEQ ID No.23),和p8867(QYLGLQIGQPQDC,SEQ ID No.24),其中N-或C-末端半胱氨酸残基(C)可以存在或不存在或备选地在C-或N-末端提供。
其它合适的抗体引发性免疫原性肽选自p6763(CaMATLEKLMKAFESLKSFQ,SEQ ID No.25),p6764(CaKLMKAFESLKSFQ,SEQ ID No.26),p6765(CEEQQRQQQQQQQ,SEQ ID No.27),p6768(QQQQQQPPPPPPPPaKKKC,SEQ ID No.28),p7541(CSEIVLD,SEQ ID No.29),p7552(CSSEIVLD,SEQ ID No.30),p7562(CDSSEIVLD,SEQ ID No.31),p7563(CSDSSEIVLD,SEQ ID No.32),p7567(CEIVLD,SEQ ID No.33),p7568(CIVLD,SEQ ID No.34),p7605(CSEIVL,SEQ ID No.35),p6776(CSEIVLDGTDNQYL,SEQ ID No.36),p6777(CSDSSEIVLDGTDN,SEQ ID No.37),p6776b(SEIVLDGTDNQYLC,SEQ ID No.38),p7752(CAEIVLDGTDNQYL,SEQ ID No.39),p7753(CSAIVLDGTDNQYL,SEQ ID No.40),p7754(CSEAVLDGTDNQYL,SEQ ID No.41),p7755(CSEIALDGTDNQYL,SEQ ID No.42),p7756(CSEIVADGTDNQYL,SEQ ID No.43),p7757(CSEIVLAGTDNQYL,SEQ ID No.44),p7758(CSEIVLDATDNQYL,SEQ ID No.45),p7745(CSEIVLDGADNQYL,SEQ ID No.46),p7746(CSEIVLDGTANQYL,SEQ ID No.47),p7747(CSEIVLDGTDAQYL,SEQ ID No.48),p7748(CSEIVLDGTDNAYL,SEQ ID No.49),p7749(CSEIVLDGTDNQAL,SEQ ID No.50),和p7750(CSEIVLDGTDNQYA,SEQ ID No.51),其中N-或C-末端半胱氨酸残基(C)可以存在或不存在或备选地在C-或N-末端提供。
根据本发明,免疫原性是特定物质(如抗原或表位)引发针对给定肽的抗体的能力。
优选地,这些肽长至少7个氨基酸,优选的长度可以高达16个,优选高达14或20个氨基酸残基(例如7或8至20,7或8至16等)。SEQ ID NO:1至51的肽的N-或C-末端的“C”已经作为接头提供,其可以或可以不存在或被允许固定到载体的另一种氨基酸或化学接头替换。可以在肽的这个末端,紧接在“C”(半胱氨酸残基)之前或紧接在“C”之后提供其它连接氨基酸。如果不需要“C”进行偶联和/或如果通过除了“C”与载体结合外的方式保护免疫原性,则也可以省略“C”。或者,根据本发明,也可以使用这些肽的片段,优选具有最小长度7个氨基酸残基,其中半胱氨酸残基之前的一个或多个氨基酸被省略。或者,可以使用不影响免疫原性肽的免疫原性和特异性的极性或带电荷的氨基酸来增加肽的溶解度。因此,用于为本发明的成分输血装置提供抗体的肽包含7至30个,更优选7至20个,更优选7至16个,最优选8个氨基酸残基。然而,更长的肽也可以非常好地用作抗HTT-抗体诱导抗原,例如如实施例1中所示。
根据本发明的亨廷顿氏病的预防被定义为预防或延迟个体中亨廷顿氏病相关症状如运动和精神症状的爆发和/或发作或免疫学和代谢变化,所述个体基于他们在至少一个HTT等位基因中CAG重复数的升高具有发展亨廷顿氏病症状的倾向。
根据本发明的亨廷顿氏病的治疗被定义为改善个体中亨廷顿氏病相关的运动症状,如舞蹈症和精神病学或免疫学和代谢变化,所述个体在遗传上鉴定为携带突变的HTT(即在至少一个HTT等位基因中携带多于26个CAG重复的个体),并且基于他们的症状和基因型(诸如通过在用于亨廷顿氏病的动物模型中诱导表型改变所显示的,例如如在实施例2和3中)被诊断为亨廷顿氏病阳性。
待用于根据本发明的成分输血装置中的抗体可以由特异性识别如本文所公开的HTT蛋白的至少一个肽的多克隆抗体血清提供。
可以根据本领域技术人员已知的技术,例如亲和层析例如从抗体血清或杂交瘤上清液中纯化纯化用于根据本发明的成分输血装置中的抗体。要用于根据本发明的本成分输血装置中的抗体也可以通过以下获得:使用哺乳动物细胞表达系统或杆状病毒,酵母,植物或细菌表达系统,或者备选使用偶联的体外转录/翻译系统来获得对体外生产条件下的控制通过在本领域技术人员已知的合适的蛋白质表达载体中过表达相应的cDNA。
例如,包含在所述药理学组合物中的多克隆抗体血清针对选自以下的至少一种肽产生:p6773(LPQPPPQAQPLLPQPQPC,SEQ ID No.1),p7564(CPSDSSEIVLD,SEQ ID No.2),p7543(GTDNQYLGLQIGC,SEQ ID No.3),p7543a(DNQYLGLQIC;SEQ ID No.88),尤其是衍生物p9394(KTDNQYLGLQIGKC;SEQ ID No.91),p9395(GTDNQYLGLQIGKKC;SEQ ID No.92),p9396(KTDNQYLGLQIKKGC;SEQ ID No.93),p9397(KDNQYLGLQIKKGC;SEQ ID No.94);p7543b(TDNQYLGLQIC;SEQ ID No.89),p7543c(TDNQYLGLQIGC;SEQ ID No.90),p6771(LPQPPPQAQPLLPC,SEQ ID No.4),p8346(CGPAVAEEPLHRP,SEQ ID No.5),p8855(SDSSEIVLDGTDC,SEQ ID No.6),p8858(EIVLDGTDNQYLC,SEQ ID No.7),p8859(IVLDGTDNQYLGC,SEQ ID No.8),p8860(VLDGTDNQYLGLC,SEQ ID No.9),p8861(LDGTDNQYLGLQC,SEQ ID No.10),p8862(DGTDNQYLGLQIGC,SEQ ID No.11),p8869(CTDNQYLGLQIGQ,SEQ ID No.12),p8868(CGTDNQYLGLQIG,SEQ ID No.13),p8870(CDNQYLGLQIGQP,SEQ ID No.14),p8871(CNQYLGLQIGQPQ,SEQ ID No.15),p6772(CPQLPQPPPQAQPLLP,SEQ ID No.16),p8864(TDNQYLGLQIGQC,SEQ ID No.17),p8865(DNQYLGLQIGQPC,SEQ ID No.18),p6775(PPPQLPQPPPQAQPLLPQPQPaC,SEQ ID No.19),p8854(PSDSSEIVLDGTC,SEQ ID No.20),p8856(DSSEIVLDGTDNC,SEQ ID No.21),p8857(SEIVLDGTDNQYC,SEQ ID No.22),p8866(NQYLGLQIGQPQC,SEQ ID No.23),p8867(QYLGLQIGQPQDC,SEQ ID No.24),p6763(CaMATLEKLMKAFESLKSFQ,SEQ ID No.25),p6764(CaKLMKAFESLKSFQ,SEQ ID No.26),p6765(CEEQQRQQQQQQQ,SEQ ID No.27),p6768(QQQQQQPPPPPPPPaKKKC,SEQ ID No.28),p7541(CSEIVLD,SEQ ID No.29),p7552(CSSEIVLD,SEQ ID No.30),p7562(CDSSEIVLD,SEQ ID No.31),p7563(CSDSSEIVLD,SEQ ID No.32),p7567(CEIVLD,SEQ ID No.33),p7568(CIVLD,SEQ ID No.34),p7605(CSEIVL,SEQ ID No.35),p6776(CSEIVLDGTDNQYL,SEQ ID No.36),p6777(CSDSSEIVLDGTDN,SEQ ID No.37),p6776b(SEIVLDGTDNQYLC,SEQ ID No.38),p7752(CAEIVLDGTDNQYL,SEQ ID No.39),p7753(CSAIVLDGTDNQYL,SEQ ID No.40),p7754(CSEAVLDGTDNQYL,SEQ ID No.41),p7755(CSEIALDGTDNQYL,SEQ ID No.42),p7756(CSEIVADGTDNQYL,SEQ ID No.43),p7757(CSEIVLAGTDNQYL,SEQ ID No.44),p7758(CSEIVLDATDNQYL,SEQ ID No.45),p7745(CSEIVLDGADNQYL,SEQ ID No.46),p7746(CSEIVLDGTANQYL,SEQ ID No.47),p7747(CSEIVLDGTDAQYL,SEQ ID No.48),p7748(CSEIVLDGTDNAYL,SEQ ID No.49),p7749(CSEIVLDGTDNQAL,SEQ ID No.50),和p7750(CSEIVLDGTDNQYA,SEQ ID No.51),优选p6773(LPQPPPQAQPLLPQPQPC,SEQ ID No.1),p7564(CPSDSSEIVLD,SEQ ID No.2),p7543(GTDNQYLGLQIGC,SEQ ID No.3),p6771(LPQPPPQAQPLLPC,SEQ ID No.4),p6776(CSEIVLDGTDNQYL,SEQ ID No.36),p6777(CSDSSEIVLDGTDN,SEQ ID No.37),p8346(CGPAVAEEPLHRP,SEQ ID No.5),p8855(SDSSEIVLDGTDC,SEQ ID No.6),p8858(EIVLDGTDNQYLC,SEQ ID No.7),p8859(IVLDGTDNQYLGC,SEQ ID No.8),p8860(VLDGTDNQYLGLC,SEQ ID No.9),p8861(LDGTDNQYLGLQC,SEQ ID No.10),p8862(DGTDNQYLGLQIGC,SEQ ID No.11),p8869(CTDNQYLGLQIGQ,SEQ ID No.12),p8868(CGTDNQYLGLQIG,SEQ ID No.13),p8870(CDNQYLGLQIGQP,SEQ ID No.14),p8871(CNQYLGLQIGQPQ,SEQ ID No.15),p6772(CPQLPQPPPQAQPLLP,SEQ ID No.16),p8864(TDNQYLGLQIGQC,SEQ ID No.17),p8865(DNQYLGLQIGQPC,SEQ ID No.18),p6775(PPPQLPQPPPQAQPLLPQPQPaC,SEQ ID No.19),p8854(PSDSSEIVLDGTC,SEQ ID No.20),p8856(DSSEIVLDGTDNC,SEQ ID No.21),p8857(SEIVLDGTDNQYC,SEQ ID No.22),p8866(NQYLGLQIGQPQC,SEQ ID No.23),和p8867(QYLGLQIGQPQDC,SEQ ID No.24),尤其是p6773(LPQPPPQAQPLLPQPQPC,SEQ ID No.1),p7564(CPSDSSEIVLD,SEQ ID No.2),p7543(GTDNQYLGLQIGC,SEQ ID No.3),p6771(LPQPPPQAQPLLPC,SEQ ID No.4),p6776(CSEIVLDGTDNQYL,SEQ ID No.36),p6777(CSDSSEIVLDGTDN,SEQ ID No.37),和p8346(CGPAVAEEPLHRP,SEQ ID No.5)。
针对p6773(SEQ ID No.1)和p6771(SEQ ID No.4)的至少一种肽产生可获得成分输血抗体的多克隆抗体血清。备选或组合地,可针对肽p7543(SEQ ID No.3)产生多克隆抗体血清。
备选或组合地,可针对肽p7564(SEQ ID No.2)产生多克隆抗体血清。
备选或组合地,可针对肽p6776(SEQ ID No.36)产生多克隆抗体血清。
根据另一方面,本发明涉及包含针对HTT或其天然存在的片段的单克隆抗体的成分输血装置。根据本发明的单克隆(以及多克隆)抗体固定在成分输血装置的表面上,作为“分离的抗体”接触具有亨廷顿氏病的患者的血液或血浆流。“分离的”抗体是已经与其天然环境的组分分离的抗体。在一些实施方案中,如通过例如电泳(例如,SDS-PAGE,等电聚焦(IEF),毛细管电泳)或层析法(例如离子交换或反向层析层析)测定的,将抗体纯化至大于95%%或99%的纯度。通常需要这种纯度以保证用于成分输血装置的质量控制的先决条件。对于单克隆抗体,也可获得编码抗体的核酸。编码抗体重链和轻链(或其片段)的此类核酸分子,包括在单个载体或分开的载体中的这样的核酸分子,以及存在于宿主细胞中一个或多个位置处的这样的核酸分子可以用于产生根据本发明的成分输血装置的抗体。
如本文中所用的,术语“单克隆抗体”是指从基本上同质的抗体群体获得的抗体,即构成群体的单个抗体是相同的和/或结合相同的表位,除了可能的变体抗体,例如含有天然发生的突变或在单克隆抗体制剂的生产期间产生,这样的变体通常以少量存在。与通常包括针对不同决定簇(表位)的不同抗体的多克隆抗体制剂相反,单克隆抗体制剂的每种单克隆抗体针对抗原上的单一决定簇。因此,修饰语“单克隆”表示从基本上同质的抗体群获得的抗体特征,并且不应解释为需要通过任何特定方法产生抗体。例如,要根据本发明使用的单克隆抗体可以通过多种技术制备,包括但不限于杂交瘤方法,重组DNA方法,噬菌体,酵母或哺乳动物细胞展示方法,以及使用含有全部或部分人免疫球蛋白基因座的转基因动物的方法,本文描述了用于制备单克隆抗体的此类方法和其他示例性方法。
本发明还提供用于本发明的成分输血装置中的单克隆抗体“PRR13”,其具有能够结合HTT蛋白中具有包含在肽p6773(SEQ ID No.1)内的序列“LLPQP”的表位,特别是核心表位LLPQP(SEQ ID No.77)的结合结构域。凭借本发明,提供了针对已经给根据本发明的实验提供的最小核心表位的mAB,即针对核心表位LLPQP(SEQ ID No.77)。在一个优选的实施方案中,所述单克隆抗体的特征在于是单克隆抗体PRR13,其包含含有肽序列GYSFTDFY(SEQ ID No.54)的重链可变区CDR1,包含IDPKNGDT(SEQ ID No.55)的重链可变区CDR2,包含ATYYGYTMDY(SEQ ID No.56)的重链可变区CDR3,包含SSVTSSY(SEQ ID No.57)的轻链可变区CDR1,包含STS(SEQ ID No.58)的轻链可变区CDR2,和包含HQYRRPPRT(SEQ ID No.59)的轻链可变区,如实施例5中所示。
CDR是互补决定区,并且表示抗体藉以与其特异性表位结合的抗体的可变区。重链的类型和数量决定了抗体的类别,即分别地IgA,IgD,IgE,IgG和IgM抗体。抗体还含有两条相同的轻链,其可以是λ或κ型的。
根据本发明,用于本成分输血装置中的单克隆抗体优选是工程化的抗体,其中非人抗体的CDR转移到人抗体框架中,从而在顺序上改编,使得原始杂交瘤衍生的小鼠抗体的亲和力和特异性至少得到维持,并且使针对新工程化的蛋白质的针对人的T细胞和B细胞免疫原性最小化(人源化单克隆抗体)。如果不需要的、最小量的吸附剂蛋白正泄漏到患者的血液中(可能由于例如通过蛋白水解或影响固定的吸附剂蛋白的其它蛋白质降解过程产生了切割片段),则这是特别需要的。CDR也可以转移到其它工程化形式中,如双特异性或嵌合单克隆抗体,具有增强的稳定功能的抗体。用于本成分输血装置的抗体优选是人抗HTT抗体。
尽管人或人源化抗体在本发明中具有优点,但是其它HTT结合分子,如鼠抗体也可用于根据本发明的成分输血装置中。本发明的一个特别优选的实施方案使用多于单一类型的HTT结合分子,例如,结合HTT的不同区域的至少两种抗HTT抗体(或HTT结合抗体片段)。它们也可以是不同来源的(例如人或人源化抗体和鼠抗体)。HTT结合分子还可以通过它们的稳定性和固定表现(例如它们的可回收性)或通过它们的亲和力和特异性来选择。如由平衡解离常数(KD)定义的这种抗体的亲和力优选在10-7至10-9的范围内,即在提供高得合理的结合速率的纳摩尔(nM)范围内。为了增加特异性和亲合力,通常优选组合两种或更多种抗体。类似于疫苗治疗的体内作用(参见下文),优选两种或更多种抗体的亲合力/组合效应,以实现靶蛋白从血浆中的有效清除。
“人抗体”是这样的抗体,其拥有的氨基酸序列对应于由人或人细胞产生的抗体的氨基酸序列或衍生自利用人抗体全集或其它人抗体编码序列的非人来源的抗体的氨基酸序列。人抗体的这种定义明确排除包含非人抗原结合残基的人源化抗体。“人共有框架”是代表在人免疫球蛋白VL或VH框架序列的选择中最通常存在的氨基酸残基的框架。通常,人免疫球蛋白VL或VH序列的选择来自可变结构域序列的亚组。通常,序列亚组是如在Kabat,E.A.等人,Sequences of Proteins of Immunological Interest,5th ed.,Bethesda MD(1991),NIH Publication 91-3242,Vols.1-3中的亚组。在一个实施方案中,对于VL,亚组是如Kabat等人,同上中的亚组κI。在一个实施方案中,对于VH,亚组是如Kabat等人,同上中的亚组III。
“人源化抗体”指包含来自非人HVR的氨基酸残基及来自人FR的氨基酸残基的嵌合抗体。“框架”或“FR”指除了高变区(HVR)残基以外的可变域残基。可变域的FR通常由四个FR域所组成:FR1、FR2、FR3及FR4。因此,HVR及FR序列在VH(或VL)中通常以下述顺序出现:FR1-H1(L1)-FR2-H2(L2)-FR3-H3(L3)-FR4。在某些实施方案中,人源化抗体会包含至少一个,且通常两个基本上整个可变域,其中全部或基本上全部的HVRs(例如,CDRs)对应于非人抗体的HVRs,且全部或基本上全部的FRs对应于人抗体的FRs。人源化抗体任选地包含衍生自人抗体的抗体恒定区的至少部分。抗体的“人源化变体”,例如非人抗体,指的是已经经历人源化的抗体。在一个优选的实施方案中,将鼠HVR嫁接入人抗体的框架区域中,以制备“人源化抗体”。将鼠可变区的氨基酸序列与人种系抗体V基因的集合对齐,并依据序列同一性及同源性分类。基于高的总体序列同源性和任选地还有已在受体序列中的正确的规范残基的存在选择受体序列。种系V基因仅编码直至重链的HVR3的起始,和直至轻链的HVR3的中间的区域。因此,种系V基因的基因序列并未在整个V结构域里对齐。人源化构建体分别包含该人框架1至3、鼠HVR及衍生自人JK4的人框架4序列,以及轻链及重链的JH4序列。在挑选一个特定的受体序列之前,可以决定供体抗体中所谓的规范环形结构。这些规范环形结构是由出现在所谓的规范位置的残基类型所决定。这些位置(部分)位于HVR区域外,且在最终构建体中应保持功能相等,以维持亲本(供体)抗体的HVR构象。在WO 2004/006955 A1中,报告了将抗体人源化的方法,包含以下步骤:辨识非人成熟抗体的HVR的规范HVR结构类型;获取人抗体可变区的肽序列文库;决定文库中可变区的规范HVR结构类型;及选择在非人与人可变区内的对应位置中,规范HVR结构类型与该非人抗体的规范HVR结构类型相同的人序列。归纳上述,基于高的总体同源性和任选地另外已经在受体序列中的正确的规范残基的存在选择潜在的受体序列。在某些情况下,单纯嫁接HVR将导致仅部分保留非人抗体的结合特异性。已发现至少一些特定的非人框架残基对于重建结合特异性是需要的,且也必须嫁接入人框架中,即,在引入非人HVR外,必须做出所谓的“回复突变”(例如,见Queen等人,PNAS 86(1989),10029-10033)。这些特定的框架氨基酸残基参与FR-HVR相互作用,并稳定HVR的构象(环形)。在某些情况下,也会引入正向突变,以更接近采用人种系序列。因此,“根据本发明的抗体的人源化变体”(例如其是小鼠起源的)指下述的抗体,其以小鼠抗体序列为基础,并藉由如上所述的标准技术以人源化该抗体的VH及VL(包含嫁接HVR及任选地框架区域及HVR-H1、HVR-H2、HVR-L1或HVR-L2中的某些氨基酸的后续诱变,而HVR-H3及HVR-L3则维持未修饰)。
一般而言,用于从鼠或其他主要选择的mAB开发适用于治疗人患者的抗体的技术已被完善地建立(在Safdari等人2013;PMID:24568279中综述)。因此,本文公开的抗体可以经历这样的开发过程,以通过应用此类经验证的技术,特别是基于CDR嫁接的方法(诸如例如由Kim&Hong Methods Mol Biol.2012;907:237-45[PMID:22907355]或Whitelegg,N.&Rees,AR Antibody variable Regions:Towards a Unified modeling method.In:Methods in Molecular Biology,Biotechnology and Medicine,(Ed.Lo,B),2004;248:51-91.)[PMID:14970491]中综述),种系人源化或“超人源化”(例如在Pelat,T.等人,Mini Rev Med Chem.2009Dec;9(14):1633-8.)[PMID:20105119]中综述)和表面重建(如由Mader and Kunert等人,Prot.Eng.Des.Selec.2010,23,947-954所述)[PMID:21037278]或基于这些建立的技术的相关方法,提供改进的抗体。
如本文所用,术语“高变区”或“HVR”是指抗体可变结构域的每个下述区域,其是在序列上(“互补决定区”或“CDR”)高变的和/或形成结构上定义的环(“高变环”)和/或含有抗原接触残基(“抗原接触”)。通常,抗体包含六个HVR:VH中的三个(H1,H2,H3),和VL中的三个(L1,L2,L3)。本文公开了示例性HVR。
根据本发明,下述抗HTT抗体也可用于本成分输血装置中,所述抗体包含重链可变域(VH)序列和/或轻链可变域(VL)序列,其具有与SEQ ID NO:60至65的氨基酸序列具有至少90%,91%,92%,93%,94%,95%,95%,96%,97%,98%,99%或100%的序列同一性的氨基酸序列。在某些实施方案中,具有至少90%,91%,92%,93%,94%,95%,96%,97%,98%或99%同一性的VH序列相对于参考序列包含取代(例如保守取代),插入或缺失,但包含该序列的抗HTT抗体保留结合HTT,特别是给定的表位的能力。在某些实施方案中,在SEQ ID NO:60至65中已经取代,插入和/或缺失总共1至10个氨基酸。在某些实施方案中,取代,插入或缺失发生在HVR外部的区域中(即在FR中)。
根据本发明的抗HTT抗体的优选变体公开于图27中(即变体hPRR13-2至-16和hC6-17-2至-16)。因此,根据本发明,在H/L框架中具有氨基酸交换的抗HTT抗体是特别优选的。此外,这些变体的所有组合也是特别优选的。例如,对于PRR抗体的重链,存在1wt±3个突变,对于轻链,也存在1wt±3个突变。这提供了4×4个变体的可能组合空间,如图27的表中所列出的。对于mAB huC6-17,优选以下组合:轻链:1wt±1mut;重:1wt+7个突变,得到总共16个变体。
相对于参考多肽序列的“百分比(%)氨基酸序列同一性”定义为在对其序列并且在必要时引入缺口以实现最大百分比序列同一性后并且不认为任何保守取代是序列同一性的一部分,与参照多肽序列中的氨基酸残基相同的候选序列中氨基酸残基的百分比。用于确定百分比氨基酸序列同一性的比对可以以本领域技术内的各种方式实现,例如使用公众可获得的计算机软件如BLAST,BLAST-2,ALIGN或Megalign(DNASTAR)软件或EMBOSS软件包中的“针(needle)”配对序列比对应用。本领域技术人员可以确定用于比对序列的适当参数,包括在比较的序列的全长上实现最大比对所需的任何算法。然而,对于本文的目的,使用EMBOSS软件包(可从欧洲分子生物学实验室公开获得;Rice等人,EMBOSS:the European Molecular Biology Open Software Suite,Trends Genet.2000Jun;16(6):276-7,PMID:10827456)的计算机程序“针”的序列比对计算氨基酸序列同一性%的值。
针程序可以在网站http://www.ebi.ac.uk/Tools/psa/emboss_needle/下访问或,从http://emboss.sourceforge.net/,作为EMBOSS包的一部分下载用于本地安装。它在许多广泛使用的UNIX操作系统上,如Linux上运行。
为了比对两种蛋白质序列,针程序优选用以下参数运行:
命令行:needle-auto-stdout-asequence SEQUENCE_FILE_A-bsequence SEQUENCE_FILE_B-datafile EBLOSUM62-gapopen 10.0-gapextend 0.5-endopen 10.0-endextend 0.5-aformat3pair-sprotein1-sprotein2(Align_format:pair Report_file:stdout)。
给定氨基酸序列A对,与,或针对给定氨基酸序列B的%氨基酸序列同一性(其可以备选地表述为具有或包含对,与,或针对给定氨基酸序列B的某一%氨基酸序列同一性的给定氨基酸序列A)计算如下:
分数X/Y的100倍
其中X是在该程序的A和B的比对中通过序列比对程序针评分为相同匹配的氨基酸残基的数目,并且其中Y是B中的氨基酸残基的总数。应当理解,在氨基酸序列A的长度不等于氨基酸序列B的长度时,A与B的%氨基酸序列同一性将不等于B与A的%氨基酸序列同一性。除非另有特别说明,本文中使用的所有%氨基酸序列同一性值是使用ALIGN-2计算机程序如在紧接的前一段落中所描述的那样获得的。
在某些实施方案中,本文提供的抗体是嵌合抗体。某些嵌合抗体描述于例如US 4,816,567A;和Morrison等人,Proc.Natl.Acad.Sci.USA 81(1984)6851-6855)。在一个实例中,嵌合抗体包含非人可变区(例如,源自小鼠,大鼠,仓鼠,兔或非人灵长类动物如猴的可变区)和人恒定区。在另一个实例中,嵌合抗体是“类别转换”抗体,其中类别或亚类已经从亲本抗体的类别或亚类改变。嵌合抗体包括其抗原结合片段。
在某些实施方案中,嵌合抗体是人源化抗体。通常,将非人抗体人源化以降低对人的免疫原性,同时保留亲本非人抗体的特异性和亲和力。通常,人源化抗体包含一个或多个可变结构域,其中HVR,例如CDR,(或其部分)源自非人抗体,并且FR(或其部分)源自人抗体序列。人源化抗体任选地还将包含人恒定区的至少一部分。在一些实施方案中,人源化抗体中的一些FR残基被来自非人抗体(例如,衍生HVR残基的抗体)的相应残基取代,例如,以恢复或改善抗体特异性或亲和力。人源化抗体及其制备方法例如在WO2004/006955A1(通过规范结构的方法)中综述。
在某些实施方案中,本文提供的抗体是人抗体。人抗体可以使用本领域已知的各种技术产生。人抗体可以通过对已经被修饰以响应于抗原攻击产生完整的人抗体或具有人可变区的完整抗体的转基因动物施用免疫原来制备。这样的动物通常包含全部或部分人免疫球蛋白基因座,其替代内源免疫球蛋白基因座,或者存在于染色体外或随机整合到动物的染色体中。在这样的转基因小鼠中,内源免疫球蛋白基因座通常已经失活。关于从转基因动物获得人抗体的方法的综述,参见Lonberg,Nat.Biotech.23(2005)1117-1125,描述了XENOMOUSETM技术的US 6,075,181和6,150,584;描述技术的US 5,770,429A;描述K-M技术的US 7,041,870A,和描述技术的US 2007/0061900A1。来自这样的动物产生的完整抗体的人可变区可以进一步修饰,例如通过与不同的人恒定区组合。
人抗体也可以通过基于杂交瘤的方法制备。已经描述了用于产生人单克隆抗体的人骨髓瘤和小鼠-人异源骨髓瘤细胞系。通过人B细胞杂交瘤技术产生的人抗体也在Li等,PNAS 103(2006)3557-3562中描述。其它方法包括例如在US 7,189,826(描述由杂交瘤细胞系产生单克隆人IgM抗体)或由Trioma技术制备的那些。还可以通过分离选自人衍生的噬菌体展示文库的Fv克隆可变结构域序列来产生人抗体。然后可将这种可变结构域序列与所需的人恒定结构域组合。下文描述了从抗体文库中选择人抗体的技术。
也可以通过对组合文库筛选具有所需的一种或多种活性的抗体来分离待用于根据本发明的成分输血装置中的抗体。例如,本领域已知多种方法用于产生噬菌体展示文库并对此类文库筛选具有所需结合特性的抗体。这样的方法进一步描述于例如Fellouse,PNAS(2004)12467-12472中。
在某些噬菌体展示方法中,通过聚合酶链反应(PCR)分别克隆VH和VL基因的全集并随机重组在噬菌体文库中,然后可以对所述噬菌体文库筛选抗原结合噬菌体。噬菌体通常展示作为单链Fv(scFv)片段或Fab片段的抗体片段。来自经免疫的来源的文库提供对免疫原的高亲和力抗体,而不需要构建杂交瘤。或者,可以(例如从人)克隆未免疫的全集以在不进行任何免疫的情况下提供针对广泛范围的非自身和还有自身抗原的抗体的单一来源。最后,也可以通过从干细胞克隆非重排的V基因区段,并使用含有随机序列的PCR引物编码高度可变的CDR3区并在体外完成重排,来合成性地制备天然文库。描述人抗体噬菌体文库的其它出版物包括例如:US 5,750,373A,US 2005/0079574A1,US 2005/0119455A1,US 2005/0266000A1,US 2007/0117126 A1,US 2007/0160598 A1,US 2007/0237764 A1,US 2007/0292936A1和US 2009/0002360A1。从人抗体文库分离的抗体或抗体片段被认为是本文的人抗体或人抗体片段。
在某些实施方案中,待用于本文的成分输血装置中的抗体是多特异性抗体,例如双特异性抗体。多特异性抗体是对至少两个不同位点具有结合特异性的单克隆抗体。在某些实施方案中,结合特异性的两者都是针对HTT,有助于通过同时结合靶物的多于一个表位来增加对HTT蛋白或其片段的亲合力和/或特异性。在某些实施方案中,如果需要吸附单独的血浆HTT蛋白片段(各自携带不同的表位),那么使用双特异性或多特异性抗体来解决HTT的多于一个表位。例如,一个表位位于一个片段上,而其它表位位于HTT的物理上不同的片段上。如果两个片段都需要从血浆中吸附,则将有必要在吸附剂上布置靶向至少两个表位,每一个表位存在于HTT蛋白的单独片段上。在某些实施方案中,结合特异性之一是针对HTT,而另一个针对也应该从亨廷顿氏病患者的血液中提取的任何其他抗原,诸如例如,存在于血浆中与HTT或其片段物理性缔合的HTT相互作用蛋白。双特异性抗体可以制备为全长抗体或抗体片段。用于制备多特异性抗体的技术包括但不限于具有不同特异性的两种免疫球蛋白重链-轻链对的重组共表达(WO 93/08829A,US 5,731,168A)。也可以如下制备多特异性抗体:工程化改造静电转向(electrostatic steering)效应以制备抗体Fc-异二聚体分子的(WO 2009/089004A);交联两个或更多个抗体或片段(例如US 4,676,980A);使用亮氨酸拉链产生双特异性抗体;使用用于制备双特异性抗体片段的“双抗体”技术(例如,Holliger等人,PNAS 90(1993)6444-6448);以及使用单链Fv(sFv)二聚体;和制备三特异性抗体。本文中还包括具有三个或更多个功能性抗原结合位点的工程化抗体,包括“章鱼抗体”(例如US 2006/0025576 A1)。本文中待使用的抗体或片段还包括包含结合HTT以及另一种不同抗原的抗原结合位点的“双重作用Fab”或“DAF”(例如参见US 2008/0069820 A1)。本文的抗体或片段还包括在WO 2009/080251 A,WO 2009/080252 A,WO 2009/080253 A,WO 2009/080254 A,WO 2010/112193 A,WO 2010/115589 A,WO 2010/136172 A,WO 2010/145792 A,和WO 2010/145793 A中描述的多特异性抗体。
特别优选的双特异性抗体包含超过一个的针对HTT的结合区,特别是如本文所定义的针对PRR和C6两者的结合区。
在某些实施方案中,考虑本文提供的抗体的氨基酸序列变体。例如,可能期望改善抗体的结合亲和力和/或其他生物学性质。抗体的氨基酸序列变体可以通过将适当的修饰引入编码抗体的核苷酸序列中或通过肽合成来制备。这样的修饰包括例如从抗体的氨基酸序列中的残基的缺失和/或插入和/或取代。可以进行缺失,插入和取代的任何组合以得到最终构建体,只要最终构建体具有所需的特征,例如抗原结合。
在某些实施方案中,提供了具有一个或多个氨基酸取代的抗体变体。取代诱变的目的位点包括HVR和FR。保守取代显示在下表中“优选取代”标题下。下面提供了关于氨基酸侧链类别的更实质性的改变。可以将氨基酸取代引入目标抗体,并筛选产物的所需活性,尤其是保留/改善的抗原结合,或改善的稳定性。
氨基酸可以根据共同的侧链特性分组:
(1)疏水性:正亮氨酸,Met,Ala,Val,Leu,Ile;
(2)中性亲水性:Cys,Ser,Thr,Asn,Gln;
(3)酸性:Asp,Glu;
(4)碱性:His,Lys,Arg;
(5)影响链取向的残基:Gly,Pro;
(6)芳香族:Trp,Tyr,Phe。
非保守取代将需要将这些类别之一的成员交换为另一类别。一种类型的取代变体包括取代亲本抗体(例如人源化或人抗体)的一个或多个高变区残基。通常,选择用于进一步研究的所得变体将相对于亲本抗体具有某些生物学性质的修饰(例如,改善)(例如,增加的亲和力,降低的免疫原性)和/或将基本上保留亲本抗体的某些生物学性质。示例性的取代变体是亲和力成熟的抗体,其可以方便地例如使用基于噬菌体展示的亲和力成熟技术(例如本文所述的那些)来产生。简言之,使一个或多个HVR残基突变,并将变体抗体展示在噬菌体上并筛选特定的生物活性(例如结合亲和力)。可以在HVR中进行改变(例如,取代),例如,以改善抗体亲和力。这种改变可在HVR“热点”,即由在体细胞成熟过程期间以高频率经历突变的密码子编码的残基,和/或SDR(a-CDR)中进行,其中测定所得变体VH或VL的结合亲和力。亲和力成熟通过构建二级文库和从二级文库重新选择实现。在亲和力成熟的一些实施方案中,通过多种方法(例如,易错PCR,链改组或寡核苷酸定向诱变)中的任一种将多样性引入选择的用于成熟的可变基因。然后创建二级文库。然后筛选文库以鉴定具有所需亲和力的任何抗体变体。引入多样性的另一种方法涉及HVR定向的方法,其中几个HVR残基(例如,每次4-6个残基)被随机化。例如使用丙氨酸扫描诱变或建模,可以特异性鉴定参与抗原结合的HVR残基。特别地,通常靶向CDR-H3和CDR-L3。
在某些实施方案中,取代,插入或缺失可发生在一个或多个HVR内,只要此类改变不显著降低抗体结合HTT的能力。例如,可以在HVR中进行不显著降低结合亲和力的保守性改变(例如如本文提供的保守性取代)。这样的改变可以在HVR“热点”或SDR之外。在上文提供的变体VH和VL序列的某些实施方案中,每个HVR是未改变的,或含有不超过一个,两个或三个氨基酸取代。用于鉴定可靶向诱变的抗体的残基或区域的有用方法称为“丙氨酸扫描诱变”。在该方法中,鉴定残基或目标残基组(例如,带电荷的残基,如Arg,Asp,His,Lys和Glu),并且用中性或带负电荷的氨基酸(例如,丙氨酸或多聚丙氨酸)替换以确定是否影响抗体与抗原的相互作用。可以在显示对初始取代的功能敏感性的氨基酸位置处引入进一步的取代。或者或另外,抗原-抗体复合物的晶体结构用于鉴定抗体和抗原之间的接触点。此类接触残基和邻近残基可以作为取代的候选物来靶向或消除。可以筛选变体以确定它们是否含有所需的性质。氨基酸序列插入包括长度范围从一个残基到含有一百个或更多个残基的多肽的氨基端和/或羧基端融合物,以及单个或多个氨基酸残基的序列内插入。末端插入的实例包括具有N末端甲硫氨酰基残基的抗体。抗体分子的其它插入变体包括抗体的N-或C-末端与酶(例如针对ADEPT)或增加抗体的血清半衰期的多肽融合。
亨廷顿蛋白的PRR(富含脯氨酸的区域)位点位于蛋白质的poly-Q序列附近。从文献中已知PRR区域与亨廷顿蛋白功能相关(Modregger等人2002)。源自靶向细胞内的亨廷顿蛋白的PRR区的重组scFv文库的胞内抗体显示通过选择性地增加突变形式的HTT蛋白的细胞内周转在亨廷顿氏病的动物模型中是有益的(Southwell等人,2011)。识别PRR区域侧翼的聚脯氨酸区段的单克隆抗体先前已经作为探针公布(由Ko等人2001公开的mAB MW7),然而由于由对于在人蛋白质组内的亨廷顿蛋白而言不独特的聚脯氨酸链组成的其表位的低复杂性,尚未考虑或不能证明在亨廷顿氏病中的治疗用途。更一般地,先前没有考虑通过成分输血靶向亨廷顿蛋白,因为亨廷顿蛋白一直被认为是仅适用于细胞内靶向的细胞内靶物。与结合具有多于5个连续脯氨酸的表位的单克隆抗体MW7(Ko等人,2001)相反,给本发明提供的mAB PRR13具有复合表位,并且特异性且选择性结合包含在p6773上的其核心表位,例如,如实施例5中证明;然而,这两种抗体均可用于根据本发明的成分输血装置中。
根据本发明,特别优选在本成分输血装置中使用固定的抗HTT单克隆抗体。
本发明提供用于本成分输血装置中的单克隆抗体,其具有能够结合HTT蛋白或其含有p7543(SEQ ID No.3)的序列或优选C6-17的核心表位的片段的结合结构域,例如在实施例4中所测定的。在优选的实施方案中,所述单克隆抗体的特征在于是单克隆抗体C6-17,其包含重链可变区CDR1,其包含GYTFTEYT(SEQ ID No.66);重链可变区CDR2,其包含INPNNGGT(SEQ ID No.67);重链可变区CDR3,其包含ASLDGRDY(SEQ ID No.68);轻链可变区CDR1,其包含QSLLNSRTRKNY(SEQ ID No.69);轻链可变区CDR2,其包含WAS(SEQ IDNo.7β)和包含KQSYNLLT(SEQ ID No.71)的轻链可变区,例如实施例5中所示。
根据本发明,胱天蛋白酶区域586指HTT蛋白上围绕亨廷顿蛋白的位置586上的先前定义的胱天蛋白酶切割位点的区域,其易于被胱天蛋白酶6和其他蛋白酶如胱天蛋白酶2、8或10切割(Wong等人2014)。该区域内蛋白酶切割的病原学作用先前由Graham等人2006确立,并且已经认为预防或减少所得的亨廷顿蛋白片段是有益的。在本发明中,证明衍生自该区域的特定肽可以有效地诱导具有与来自相同区域的邻近肽相比强得意料不到的对亨廷顿蛋白的可接近性的抗体,如实施例1和7所示。由这些肽产生的抗体对于在根据本发明的成分输血装置中使用是优选的。
在另一个实施方案中,本发明提供用于本成分输血装置中的单克隆抗体,其具有能够结合具有p7564(SEQ ID No.2)的序列或优选地M1D1的表位的HTT蛋白的肽的结合结构域肽,例如根据实施例5,图17。在一个优选实施方案中,所述单克隆抗体的特征在于是单克隆抗体M1D1,其包含含有GFTFNTYA(SEQ ID No.72)的重链可变区CDR1,含有IRSKSNNYAT(SEQ ID No.73)的重链可变区CDR2,包含VRHGEYGNPWFAY(SEQ ID No.74)的重链可变区CDR3,包含QSLVHSNGNTY(SEQ ID No.75)的轻链可变区CDR1,包含KVS(SEQ ID No.76)的轻链可变区CDR2和包含SQSTHVPYT(SEQ ID No.77)的轻链可变区,例如实施例5中所述。
与源自在人蛋白质组内以高频率出现的肽583IVLD586的现有技术的单克隆和多克隆抗体(Warby等人,2008)相反,抗体M1D1识别由包含游离C-末端的天冬氨酸的亨廷顿蛋白衍生序列SSEIVLD组成的核心表位,所述天冬氨酸在人RefSeq蛋白数据库内是独特的,从而对胱天蛋白酶切割的亨廷顿蛋白提供高特异性,例如如实施例4,图12和实施例5,图17所示。与Warby等人的抗体相反,根据本发明的抗体更具特异性。它还具有与“IVLD”不同的核心表位(参见实施例1,图3)。这种更高的特异性还归因于“IVLD”(根据Warby)在人蛋白质组内出现超过几百次,而根据BLAST-RefSeq分析,M1D1表位仅出现一次。如给本发明提供的M1D1是具有独特CDR--同种型IgM的不同克隆。然而,如已经陈述的,所有这些抗体由于它们对HTT的特异性而可用于根据本发明的成分输血装置中。根据优选实施方案,根据本发明使用mAB的组合。由于组合/亲合力方面,这种组合可以是有益的。M1D1对于通过胱天蛋白酶6切割HTT产生的新表位的特异性对于成分输血是特别有益的,因为其将特异性耗尽先前描述的HTT的毒性N-末端片段(例如Graham等人2006和其中的引文)。
根据优选的实施方案,根据待用于本发明的成分输血装置中的抗体包含以下VH和VL氨基酸序列:
>C6-17VH共有氨基酸序列:
MGWSCIMLFLLSGTAGVLSEVQLQQSGPELVKPGASVKISCKTSGYTFTEYTMHWVKQSHGKSLEWIGGINPNNGGTRYNQKFKGKATLTVDRSSSTAYMELRSLTSEDSAVYYCASLDGRDYWGQGTTLTVSSAKTTAPSVFPLA(SEQ ID No.60)
>C6-17VL共有氨基酸序列:
MVLMLLLLWVSGTCGDIVMSQSPSSLAVSAGEKVTMSCKSSQSLLNSRTRKNYLAWYQQKPGQSPKLLIYWASTRESGVPDRFTGSGSGTDFTLTISSVQAEDLAVYSCKQSYNLLTFGAGTKLELKRADAAPTVSIFPPSSEQLTSGGASVVCFLNNFYPK(SEQ ID No.61)
根据优选的实施方案,根据待用于本发明的成分输血装置中的抗体包含以下VH和VL氨基酸序列:
>PRR13VH共有氨基酸序列:
MGWSWVMLFLLSGTGGVLSEVQLQQSAPELVKPGASVKMSCKASGYSFTDFYMKWVKQSHGKGLEWIGDIDPKNGDTFYNQKFKGRATLTVDKSSSTAYMQLNSLTTEDSAVYYCATYYGYTMDYWGQGTSVTVSSAKTTAPSVYPLAPVCGDTTGSSVTLGCLVKGYF(SEQ ID No.62)
>PRR13VL共有氨基酸序列:
MDFQVQIFSFLLISASVIMSRGQIVLTQSPAIMSASLGERVTMTCTASSSVTSSYLHWYQQKPGSSPKLWIYSTSNLASGVPARFSGSGSGTSYSLTISSMEAEDAATYYCHQYRRPPRTFGGGTKLEIKRADAAPTVSIFPPSSEQLTSGGASVVCFLNNFYPR(SEQ ID No.63)
根据优选的实施方案,根据待用于本发明的成分输血装置中的抗体包含以下VH和VL氨基酸序列:
>M1D1VH共有氨基酸序列:
MDFGLSWVFFVVFYQGVHCEVQLVESGGGLVQPKGSLKLSCAASGFTFNTYAMNWVRQAPGKGLEWVARIRSKSNNYATYYADSVKDRFTISRDDSQSMLYLQMNNLKTEDTAMYYCVRHGEYGNPWFAYWGQGTLVTVSAESQSFPNVFPL(SEQ ID No.64)
>M1D1VL共有氨基酸序列:
MKLPVRLLVLMFWIPASSSDVVMTQTPLSLPVSLGDQASISCRSSQSLVHSNGNTYLHWYLQKPGQSPKLLIYKVSNRFSGVPDRFSGSGSGTDFTLKISRVEAEDLGVYFCSQSTHVPYTFGGGTKLEIKRADAAPTVSIFPPSSEQLTSGGASVVCFLNNFYPK(SEQ ID No.65).
根据优选的实施方案,根据本发明的抗体是人源化抗体,特别是包含以下VH和VL氨基酸序列的抗体:
>hPRR13VL(重链可变区):
EIVLTQSPSSLSASVGDRVTITCTASSSVTSSYLHWYQQKPGKAPKLLIYSTSNLASGVPSRFSGSGSGTDFTFTISSLQPEDIATYYCHQYRRPPRTFGGGTKLEIKR(SEQ ID No.95)
>hPRR13VH(重链可变区):
EVQLVESGPEVKKPGATVKISCKVSGYTFTDFYMKWVQQAPGRGLEWMGDIDPKNGDTFYNQKFKGRVTMTADTSTGTAYMQLSSLTSEDTAVYFCASYYGYTMDYWGQGTTVTVAS(SEQ ID No.96)
>hC6-17VL(轻链可变区):
DIVMTQSPDSLAVSLGERATINCKSSQSLLNSRTRKNYLAWYQQKPGQPPKLLIYWASTRESGVPDRFSGSGSGTDFTLTISSLQAEDVAVYYCKQSYNLLTFGGGTKLEIK(SEQ ID No.97)
>hC6-17VH(重链可变区):
QVQLVQSGAEVKKPGASVKVSCKASGYTFTEYTMHWVRQAPGRGLEWMGGINPNNGGTRYNQKFKGRVTMTRDTSIRTAYVELSRLTSDDTAVYYCASLDGRDYWGQGTLVTVSS](SEQ ID No.98)。
本发明提供了用于预防和/或治疗亨廷顿氏病的抗体或HTT结合分子,其中所述抗体或HTT结合分子或衍生的片段(如其Fab或其F(ab)2)用作吸附剂以在治疗性成分输血中耗尽来自血浆的可溶性或聚集的HTT和HTT衍生的片段。用于成分输血的这种抗体优选是结合HTT的免疫原性肽的多克隆或单克隆抗体。具体地,与免疫原性肽p6773(SEQ ID No.1)或p7543(SEQ ID No.3)或p7564(SEQ ID No.2)结合并如实施例1中所证实的,与免疫可接近区域PRR和胱天蛋白酶切割区域586结合的单克隆抗体或抗体衍生片段对于用于成分输血中是特别优选的,这对mAB PRR13和mAB C6-17证明,例如如在实施例6图18中。也优选使用抗体的组合,例如本文公开的两种或更多种抗体的组合。优选地,根据本发明的抗HTT抗体偶联到适合于与血液流接触,更具体地,与人个体的血浆接触的固体载体。
根据本发明,血浆成分输血被定义为医疗技术,其中患者的血液通过分离出一种特定成分并将剩余部分返回到循环中的装置。根据本发明,使用成分输血通过使用本发明中提供的抗体或其衍生物从血浆中分离出可溶性或聚集的亨廷顿蛋白或其衍生的片段。根据本发明,成分输血装置包括可以与血液或与血浆流接触并且具有结合HTT蛋白的受体的固体柱。无菌且无热原的柱优选用作成分输血载体。本文中,“柱”被定义为任何形状的模块,其具有可以与蛋白质化学偶联的基质材料。结合偶联到柱上的HTT蛋白的特异性受体可以是例如抗原结合分子,例如抗体,Fab、Fd、Fab'、F(ab')2、Fv、或ScFv片段。当与柱的基质材料偶联的受体包含抗体时,抗体可以是通过公知手段在动物例如绵羊,兔,山羊,骆驼(camelid)或鲨鱼中产生的多克隆抗体。或者,与柱结合的抗体可以是通过使用人HTT或其片段作为抗原通过公知手段产生的单克隆抗体。当偶联到柱上的抗原结合分子在动物中产生时,特别重要的是确保存在于动物血清中的任何病毒被灭活,例如,通过热处理(US 5,817,528A)或本领域技术人员已知的任何其它技术。一旦动物血清或抗体或抗原结合分子的其它来源已经被验证为是无病原体的,则优选根据US 5,817,528A纯化它以选择以偶联到治疗柱产品为目的的合适的抗原结合分子。合适地,纯化步骤涉及使抗原结合分子溶液通过含有偶联有白蛋白的基质材料的第一柱(“预柱”),然后通过含有偶联有人亨廷顿蛋白的基质材料的第二柱(“工作柱”)。以偶联到治疗柱为目的的抗原结合分子的溶液经由通过与非期望物质结合的预柱而纯化。然后,将来自预柱的洗脱液通过工作柱,其结合所需的抗原结合分子,同时允许不期望的物质流出柱。对所有过程使用无菌缓冲液。然后,使用例如连续的柠檬酸钠/柠檬酸和乙酸钠/乙酸洗脱缓冲液(如US 5,817,528A所公开的)或本领域技术人员已知的任何其它技术,以功能状态从工作柱洗脱所需的抗原结合分子。然后,将收集的抗原结合分子在无菌条件下偶联至无菌基质材料。优选地,基质材料是基于碳水化合物的材料,如SepharoseTM,葡聚糖,琼脂糖或纤维素。其它合适的基质材料包括可高压灭菌的基质,如珠,纤维和由玻璃或合成聚合物如聚甲基丙烯酸酯,聚苯乙烯和聚酰胺组成的膜或薄膜。在使用珠的情况下,珠的直径不受限制,只要成分输血的液相可循环。但是,为了降低流动阻力,优选使用直径为50至3000μm,特别是200至3000μm的那些珠。根据US 5,817,528A或熟练技术人员已知的任何其它技术,基质材料通过用无菌溶液预漂洗和在低温下另外的蒸汽处理来灭菌。然后如US 5,817,528 A所述的用溴化氰溶液温育或本领域技术人员已知的任何其它技术来活化无菌且无热原的基质材料。连续地,通过温育将所需的抗原结合分子偶联到柱。或者,也可以通过根据US 5,817,528A将抗原结合分子与1,1'-羰基二咪唑一起温育,或本领域技术人员已知的任何其它的技术,同时实现活化和偶联。一旦完成偶联过程,将具有与其偶联的抗体的基质材料充分洗涤,并且测试氰酸酯、无菌性和致热原性。要固定在柱中的抗体的量和柱的大小没有限制。还针对总结合蛋白和偶联蛋白的结合活性,测试偶联的基质材料。然后,将偶联的基质材料在无菌条件下填充到无菌、去热源、经硅烷化的玻璃壳体中,以形成无菌且无热原的偶联有蛋白质的柱。可以通过适当选择回路的管的内径或通过使用辅助泵(US 4,770,774A)来控制通过成分输血装置的流速。本发明的柱可以通过洗脱吸附的HTT蛋白或其片段而重复使用。
此外,本发明提供成分输血装置,其包括能够与血液或血浆流接触的固体载体,所述成分输血装置的特征在于,所述固体载体包括特异性和选择性的HTT结合受体或吸附剂。成分输血装置的载体进一步定义为是无菌和无热原的柱。
根据本发明,本文提供的成分输血装置优先用于提供用于预防和/或治疗亨廷顿氏病的预防和/或治疗装置。
本发明还提供了用于预防和/或治疗亨廷顿氏病的试剂盒,其包含含有亨廷顿蛋白结合受体或吸附剂的固体成分输血载体,其中所述载体再次是无菌且无热原的柱。
在另一个实施方案中,本发明提供了用于体外诊断哺乳动物中的亨廷顿氏病的方法,其包括以下步骤:使用根据本发明的抗体特别是抗体PRR13,M1D1和C6-17,测定哺乳动物样品中游离的,聚集的,复合的或片段化的HTT的水平,以便诊断亨廷顿氏病,监测疾病进展或以其他方式使用HTT作为生物标志物(如果所述样品中的HTT水平与健康者或在遗传学上未受亨廷顿氏病影响的个体的参考样品相比升高)。在本发明的过程中,显示亨廷顿氏病的病理学也与血浆,其他体液和组织材料中存在的HTT的(低)量相关。证明使用根据本发明的抗体测量这样的(低)HTT水平改变是可能的,但是当然在本发明公开HTT水平的变化与疾病和疾病状态相关之后,对于其他技术也能实现。因此,不仅可以用本工具诊断疾病,而且可以监测疾病的治疗。该诊断方面可以与本成分输血技术组合以诊断和监测计划用或用根据本发明的成分输血装置治疗的患者。
因此,本发明提供了一种体外诊断哺乳动物中的亨廷顿氏病的方法,其包括以下步骤:
-使用单独或组合的抗体PRR13,M1D1或C6-17测定哺乳动物样品中野生型或突变的亨廷顿蛋白或其片段的水平;
-如果所述样品中的wt或突变的亨廷顿蛋白的水平与遗传上未受亨廷顿氏病影响的健康个体的参考样品相比升高,则诊断亨廷顿氏病;
-和任选地监测亨廷顿蛋白降低治疗策略在预明显(pre-manifest)或明显亨廷顿氏病患者样品中的效果,其中所述治疗策略优选选自主动或被动疫苗接种。
根据本发明,样品中突变HTT水平的测定涉及优先地基于免疫沉淀或基于捕获的测定,例如酶联免疫吸附测定(ELISA),酶联免疫测定(EIA),在其它表面和载体例如树脂和珠上的免疫沉淀,质谱,western印迹或免疫组织化学和基于免疫荧光的分析,例如基于FRET的测定或合适的成像方法(例如PET,SPECT)和流式细胞术或本领域技术人员已知的任何其它技术。
根据本发明,样品优选获自脑脊液(CSF),血液,血浆,血清,尿液,唾液,汗液或泪液,或其它体液或组织和细胞提取物,特别是脑组织,肌肉组织和血液衍生的细胞,其中(突变体)亨廷顿蛋白的表达和结构是变化的。
根据本发明,哺乳动物优选是人。
此外,本发明提供了一种在哺乳动物中在体外确定亨廷顿氏病的阶段或新的亨廷顿蛋白靶向治疗(例如代表主动或被动疫苗接种方法)的作用的方法,其包括以下步骤:
-使用单独或组合的抗体PRR13,M1D1或C6-17在哺乳动物的样品中测定野生型或突变亨廷顿蛋白或其片段的水平(这些抗体可单独或组合用于捕获和检测亨廷顿蛋白或其片段,随后通过生化手段,质谱或其他分析方法检测);和
-确定亨廷顿氏病的阶段。
这种测定通过给定患者中的HTT水平也是有可能的:这可以通过比较给定患者随着时间的HTT水平(的变化)(相同个体中的相对测定)来监测疾病的发展,而且还用于疾病阶段的初始诊断(与具有已知疾病状态的患者群组相关的绝对测定)。“HTT水平的变化”至少在较长治疗运行中将是HTT水平降低,从而例如根据本发明治疗的患者中的血浆HTT水平将下降(如例如图9所示)。然而,也可能的是,在一些患者中或在疾病的某个阶段(特别是如果与其它治疗策略组合),在治疗开始时可能发生HTT水平的升高。然而,这也指示成功的治疗,因为例如,抗体可以反常地稳定血浆中的蛋白质,但同时它阻断其病理活性。这种现象是例如,见于在抗IgE治疗后反常的IgE增加。另一个实例是针对生长激素的抗体,其由于稳定化而导致出于意料的增加或其生长促进作用。
另外,本发明提供了在哺乳动物中监测亨廷顿氏病的进展或监测亨廷顿氏病治疗有效性的方法,其包括以下步骤:
-使用根据本发明的PRR13,M1D1和C6-17测定哺乳动物样品中突变的HTT的水平,和
-通过将突变HTT的获得水平与第一次测量突变HTT水平中(优选在诊断疾病相关的症状时的测量中)获得的突变HTT水平进行比较,确定亨廷顿氏病的进展或亨廷顿氏病的治疗有效性,其中HTT水平的改变(所述“改变”通常是HTT水平的降低,至少在较长的运行中,如上文解释)指示成功的治疗,并且优选用于预后目的和调节治疗。
再一次,此方法由本发明实现,因为已经第一次显示了耗尽作为治疗靶标的细胞外HTT的有效性。
在根据本发明的成分输血方法中,使用区分“健康”和“病理”HTT(即“野生型”或“突变”HTT)的抗体并不是关键的。这意味着不能区分这两种形式(但结合两种形式)的抗体也可以用于在成分输血装置中(或在根据本发明的诊断方法中)结合HTT,并且在这些方法中通常是优选的。
根据本发明的成分输血装置可以包含特定的亨廷顿蛋白胱天蛋白酶区域586抗体和抗血清及其衍生的结构,例如scFv’s,Fab,Fd,Fab’,F(ab’)2,scFAB,胞内抗体或Fv或任何其他形式,特别是本文公开的任何优选形式(作为单一HTT结合分子种类或作为两种或更多种HTT结合分子的组合以增加亲合力和特异性)。
在本发明的一个特别优选的实施方案中,靶向亨廷顿蛋白(HTT)的胱天蛋白酶区域586的抗体或抗原结合分子用于成分输血装置中,所述抗体或抗原结合通过用上文规定的肽免疫生,所述肽包含如上规定的或组合的亨廷顿蛋白的胱天蛋白酶区域586的至少一种免疫原性肽,例如,如实施例2和3中证明。
本发明通过以下实施例和附图进一步公开,但不限于此。
图1显示与亨廷顿蛋白的免疫原性较低的N末端和poly-Q区域相比源自人亨廷顿蛋白的PRR区和胱天蛋白酶区586(分别指示为PRR和C6)的肽的通过ELISA进行的免疫滴度分析。
图2显示由源自人亨廷顿蛋白的PRR和胱天蛋白酶区域586的肽诱导的小鼠免疫血清。在ELISA设置中从瞬时转染的HEK293细胞的提取物中捕获重组的610个氨基酸N-末端亨廷顿蛋白片段,并与免疫血清一起温育,从而显示诱导的抗体的结合和特异性。
图3显示针对免疫肽p6776产生的单独免疫血清提供了针对免疫肽的可比的抗肽ELISA滴度(指示为logEC50)。
图4显示与图3相同的免疫血清,根据蛋白质捕获ELISA(OD;抗recHTT610)测量显示抗重组亨廷顿蛋白信号的差异,从而证明免疫应答的个体变化。
图5显示当与经KLH-载体或PBS处理的R6/1小鼠或经KLH-载体处理的野生型小鼠相比时,经肽疫苗(p6771,p6773)处理的R6/1小鼠中亨廷顿蛋白信号(EM48)无变化(数字指示使用亨廷顿蛋白特异性mAB EM48校正的光密度[COD];误差条=标准偏差;n=10)。
图6显示与来自图5的结果相反,当与经KLH处理的R6/1小鼠相比时,含有突变的人HTT(由EM48标记)的突触囊泡蛋白标记的突触(使用mAB SY38)的数量在经肽疫苗处理的R6/1小鼠(p6771,p6773)中显著减少(p=0,001),表明肽治疗的有益效果。
图7显示当与用KLH或PBS处理的对照组相比时,使用神经元特异性标记物NeuN,R6/1小鼠在用肽疫苗处理的组(p6771,p6773)中展示基底神经节中的显著的神经保护作用。
图8显示当分别与KLH和PBS对照相比时,基底神经节的GFAP染色在用肽疫苗处理的R6/1动物(p6771,p6773)中显示星形胶质细胞活化的非显著减少。
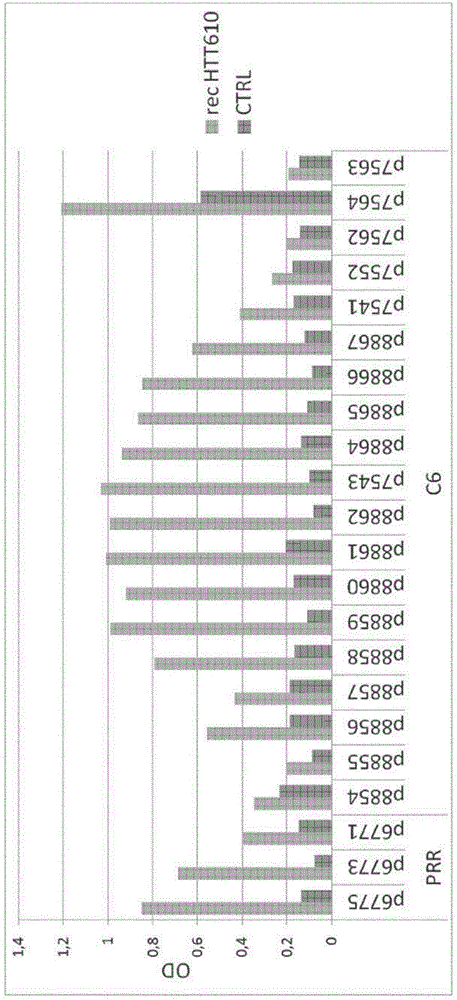
图9分别显示在单一疫苗,组合疫苗或载体对照(KLH)处理后12个月时,在wt和YAC128转基因动物中通过FRET分析进行的血清亨廷顿蛋白的测定。
图10显示在经处理的YAC128小鼠和对照YAC128小鼠中的旋转杆(rotarod)测试,测量下落的等待时间(latency to fall)(以秒表示为平均值;n=25只动物/组),在用如指定的各种单一和组合肽疫苗处理的转基因YAC128小鼠中,在4、6、8、10和12个月进行(指示为“平均M4”-“平均M12”)。
图11显示了通过肽ELISA进行的丙氨酸取代扫描测定的5种p6776疫苗诱导的免疫血清的核心表位,所述肽ELISA使用指示的含有单氨基酸丙氨酸取代的肽进行。
图12显示mAB M1D1特异性识别在C-末端具有游离天冬氨酸586的重组亨廷顿蛋白片段,强于recHTT610。
图13显示当通过肽ELISA测试时,来自源自用肽p6773免疫的小鼠的杂交瘤的上清液在9个预筛选的候选克隆中的7个中提供免疫肽的强识别。
图14显示当通过recHTT610捕获ELISA测试时,图13中所示的9个候选mAB中仅有2个,即PRR13和PRR18,特异性识别重组亨廷顿蛋白。
图15显示源自用肽p7543免疫的小鼠的4种预选择的抗亨廷顿蛋白mAB的特异性分析。
图16显示通过肽ELISA测定针对“切割的”肽p7564的特异性筛选预选的mAB。
图17显示mAB M1D1识别来自至少7AA长度的含有游离C末端天冬氨酸的胱天蛋白酶6切割区的亨廷顿蛋白肽。
图18显示与同种型对照抗体IgG相比,使用mAB PRR13和C6-17自人血清特异性消耗重组亨廷顿蛋白rec HTT610。
图19-21显示了根据本发明使用的抗体的识别能力。
图22-23显示了抗体人源化的实例。
实施例
实施例1:-鉴定靶向亨廷顿蛋白N末端的肽。
动物免疫
使用GMBS作为胺-巯基交联剂(Thermo/Pierce,CatNr.22309),根据用于经由半胱氨酸(Cystein)的肽偶联的标准推荐程序,将抗HTT抗体诱导肽偶联至KLH载体。缀合的肽与氢氧化铝凝胶佐剂(1μg/ml终浓度;Alhydrogel;Brenntag,CatNr.21645-51-2)一起配制,每次注射使用在200μl体积中的30μg偶联肽。使用上述制剂通常在雌性BALB/c小鼠(通常每组5只小鼠,10周龄)中进行免疫。仅用未缀合的KLH和/或PBS和佐剂免疫对照组。动物以2周的定期间隔疫苗接种3-6次,并且在每次加强前一天和最后取血时收集血浆或血清。
肽ELISA
通过ELISA使用肝素作为抗凝血剂来测定小鼠中肽诱导的免疫应答。ELISA板(Nunc Maxisorb)用作为载体的马来酰亚胺活化的BSA包被,所述载体通过稳定的硫醚键与含有半胱氨酸的肽偶联。对于滴定,加入血浆稀释液,并且通过作为检测抗体的生物素化的抗小鼠IgG(Southern Biotech,CatNr.1034-08),组合链霉亲合素-POD(Roche,CatNr.1089153)和使用ABTS进行的随后的颜色反应定量肽特异性抗体。使用GraphPad Prism(GraphPad Software),使用具有4参数逻辑(logistic)的曲线拟合来确定EC 50值。
产生含有N-末端亨廷顿蛋白片段recHTT610的细胞提取物
合成覆盖通过两个C端V5标签延伸的人亨廷顿蛋白的N-末端610个氨基酸的编码区的DNA,并通过XbaI和BamHI限制性位点克隆到真核表达载体pCDH-EF1-MCS IRES Puro(SBI;CatNr.CD532A1)中,产生质粒precHTT610。基本上按照制造商指示根据标准分子生物学程序进行克隆程序,包括限制性消化和连接反应(NEB Quick连接酶试剂盒;CatNr.M2200L),细菌转化,随后进行克隆选择和分析。使用标准DNA纯化试剂盒(Quiagen;CatNr.27106)从琼脂糖凝胶中进行DNA片段制备。使用MAXreagent(Invitrogen;CatNr.16447-100)和Optimem(Gibco;CatNr.31985),将HEK293freestyle细胞(Invitrogen;CatNr.R790-07)培养在如制造商指示的培养基中并用precHTT610(或作为对照的空载体)瞬时转染。在转染后24-48小时,通过用NP-40提取缓冲液(150mM NaCl,1%NP-40,50mM Tris pH8)进行细胞裂解获得HEK细胞裂解物,等分取样并保存在-80℃。使用Qubit(Invitrogen;CatNr.Q32866)根据制造商的说明书测定蛋白质浓度。
通过蛋白质捕获ELISA检测亨廷顿蛋白
如下通过标准蛋白质捕获ELISA程序测定抗体与N-末端片段HTT610的结合:使用包被有50μl 1:5000兔抗V5mAB(Sigma,CatNr.V8137)的MaxisorbTM ELISA板(Thermo;CatNr.439454),用封闭缓冲液(PBS,1%BSA,0.1%Tween 20)封闭,从HEK细胞提取物中捕获重组亨廷顿蛋白(100ng/μl总蛋白),然后与几种小鼠抗HTT血清稀释物(1:100;1:300和1:900)或与作为参考的mAB2166(稀释1:2000;Millipore,Cat Nr.MAB2166)在室温下温育1小时。根据标准程序进行ELISA温育,洗涤和检测程序。
从血浆亲和纯化抗体
根据制造商的方案,将碘乙酰活化的磁珠(BcMagTM;Bioclone CatNr.FG-102)与含半胱氨酸的肽缀合。在室温下用血浆/mAB温育2小时后,用高盐缓冲液(PBS,0.2%Triton X-100,补充至350mM的最终NaCl浓度)洗涤珠子,通过酸洗脱回收结合的抗体(用100mM甘氨酸;pH 2,8进行4个洗脱步骤)。在用终浓度为75mM HEPES pH8中和后,使用Spin-X UF500管(Corning,CatNr.CLS431478)将抗体浓缩至100μl的体积,如针对蛋白质提取物所述测量蛋白质浓度。
结果:
来自经亨廷顿蛋白肽免疫的小鼠的免疫血清显示,从亨廷顿蛋白的富含聚脯氨酸的区域(PRR)和胱天蛋白酶区域586(C6)衍生的肽通常比分别从蛋白质的聚谷氨酰胺(polyQ)或N末端区域(包括前17个氨基酸)衍生的相当的肽提供在肽ELISA分析中的更高滴度(图1)。当通过蛋白质ELISA(图2)分析时,PRR衍生的和胱天蛋白酶区域586衍生的免疫血清随免疫肽的肽序列在抗亨廷顿蛋白信号强度上(图4)和蛋白质的特异性(图2)上显示差异,允许特异性和免疫原性肽候选物的限定。肽p7564诱导特异性识别含有在C末端天门冬氨酸的亨廷顿蛋白序列的免疫血清(图3),从而提供用于解决通过胱天蛋白酶在位置586处切割亨廷顿蛋白产生的疾病特异性亨廷顿蛋白新表位的手段。图1:通过ELISA进行的免疫滴度分析揭示了从人亨廷顿蛋白的PRR区域和胱天蛋白酶586区域(分别指示为PRR和C6)衍生的肽,在经肽免疫的小鼠中在平均上提供高于1:10000的滴度,这与用聚谷氨酰胺区域衍生的或N-末端衍生的肽(分别表示为polyQ和NTER)相反,其中平均滴度低于1:10000。滴度表示为来自5个个体血清的平均EC 50;误差棒显示标准偏差。
图2:通过蛋白质捕获ELISA针对从瞬时转染的HEK细胞的提取物捕获的重组610个氨基酸的N-末端亨廷顿蛋白片段筛选来自源自人亨廷顿蛋白的PRR和胱天蛋白酶区域586的肽的小鼠免疫血清。尽管如肽ELISA中看到,同质的抗肽信号分布(图1所示),抗亨廷顿蛋白(“recHTT610”)和背景信号(“CTRL”)在不同肽之间不同。条表示以1:100的血清稀释度,分别针对重组亨廷顿蛋白(OD[recHTT610提取物];浅灰色柱)或对照提取物(OD[假转染的对照提取物];深灰色柱)测试的5个合并的免疫血清的信号。
图3:针对免疫肽p6776产生的5个个体免疫血清提供了相当的针对免疫肽的抗肽ELISA滴度(指示为logEC50)。
图4:与抗肽滴度(图3所示)相反,如通过蛋白质捕获ELISA(OD;抗recHTT610)测量的,相同的免疫血清显示抗重组亨廷顿蛋白信号中的差异,从而证明免疫应答的个体变化。
实施例2:过表达突变型人亨廷顿蛋白的第一外显子的转基因R6/1小鼠的肽免疫提供了由基底神经节中的神经病理标志物反映的有益变化。
在相对强的启动子下表达人突变亨廷顿蛋白外显子1的R6/1小鼠(参见Bard等人2014和其中的引文)在第8、10、14和24周时进行如实施例1配制的疫苗注射。为了监测滴度,在第8、16、28和32周收集血浆。
免疫组织化学
通过免疫组织化学进行的分析基本上如Mandler等人,2014[PMID:24525765]所述进行,使用用于标志物蛋白质检测基底神经节的抗体EM48,SY38,GFAP和NeuN(分别为Millipore,CatNr.MAB5374,MAB5258,AB5804和MAB377)。
结果:
用肽免疫的6个月龄的转基因R6/1小鼠进行基底神经节的免疫组织化学分析,所述小鼠过表达突变型人亨廷顿蛋白的第一外显子。通过用肽p6771和p6773免疫的组与对照组(KLH,PBS)的组织病理学比较来比较肽免疫的效果。在用PRR衍生的疫苗免疫后观察到突触中的明显的神经保护和亨廷顿蛋白减少作用,从而证明肽诱导的抗HTT抗体能够在体内提供关于HTT表型的有益效果。
图5:当与经KLH-载体或PBS处理的R6/1小鼠或经KLH-载体处理的野生型小鼠(数字指示使用亨廷顿蛋白特异性mAB EM48校正的光密度[COD];误差条=标准偏差;n=10))比较时,经肽疫苗(p6771,p6773)处理的R6/1小鼠中亨廷顿蛋白信号(EM48)无变化。
图6:相比之下,当与经KLH处理的R6/1小鼠相比时,含有突变的人HTT(由EM48标记)的经突触囊泡蛋白标记的突触(使用mAB SY38)的数目在用肽处理的R6/1小鼠(p6771,p6773)中显著减少(p=0,001)(‘学生t检验;每个处理组n=10只动物)。数字表示与EM48信号共定位的SY38阳性突触的比率(以%计)(误差条=标准偏差;COD=校正的光密度)。
图7:在与用KLH或PBS处理的对照组相比时,使用神经元特异性标记物NeuN,R6/1小鼠在肽处理组(p6771,p6773)中显示出在基底神经节中显著的神经保护作用(分别为p=0.002和p=0.01,学生t检验;n=10)。Wt KLH=野生型对照;数字表示校正光密度(COD);误差棒=标准偏差。
图8:基底神经节的GFAP染色显示当与KLH和PBS对照分别相比时,肽处理的R6/1动物(p6771,p6773)中星形胶质细胞活化的非显著性减少(COD=校正的光密度;wt KLH=野生型对照;误差条=标准偏差)。
实施例3:组合疫苗处理导致YAC128转基因小鼠中血浆亨廷顿蛋白水平降低组合运动改善,如在4-12个月龄的动物中通过旋转杆试验测量,由此证明组合的肽诱导的抗HTT抗体在HTT表型方面能够提供有益的体内效果。YAC128小鼠免疫
聚集了表达全长突变体人亨廷顿蛋白的YAC128小鼠(参见Bard等人2014和其中的引文)和WT对照同胞仔畜的5个分组,其由总共150个YAC128和总共25个WT组成。WT小鼠用KLH对照处理。将YAC128小鼠分成6个处理组,包括5个实验性肽处理和KLH对照组。小鼠在1、2、3、6和9个月龄时通过s.c.注射接受处理,如实施例1中。对于组合免疫,通过组合每200μl体积剂量各15μg+15μg的两种肽来保持每剂量30μg的总肽量。
经疫苗处理的YAC128小鼠中血浆亨廷顿蛋白水平的测定
通过基于FRET(共振能量转移)的检测测定法测定血浆亨廷顿蛋白水平,产生两种检测抗体之间的比率,如先前Weiss等人2009[PMID:19664996]描述的。通过抗HTT抗体的血浆HTT减少和YAC128小鼠中的相关表型变化之间的相关性提供了用于血浆HTT减少的基于抗体的治疗策略的有用性的证据。证明通过肽诱导的抗体减少血浆HTT是有益的,因此可以预期,相应的衍生的单克隆抗体对于治疗性成分输血方法是有益的,以便特异性地减少血浆HTT,如本文中证明。
旋转杆测试
将2个月龄的YAC128小鼠在旋转杆(Ugo Basille)上以18转/分钟(RPM)的固定速度在连续3天里训练。小鼠每天接受3次120秒的训练试验,试验间隔(ITI)为1小时。为了试验的持续,立即更换从杆跌倒的小鼠。记录每次训练试验的第一次跌倒的等待时间和跌倒次数。对每只小鼠的3次试验的平均值进行评分。对于2-12个月龄的2个月间隔的纵向旋转杆测试,使用在300s内从5RPM至40RPM的加速程序。小鼠以1小时ITI接受3次试验,并且记录第一次下落的等待时间。对3个测试试验的平均值进行评分。
结果:
图9:在单次免疫,组合免疫或载体对照(KLH)处理后12个月,分别在wt和YAC128转基因动物中通过FRET分析进行血浆亨廷顿蛋白测定。使用来自PRR和胱天蛋白酶区域586区域的肽(分别为p6771和p7564&p7543)。当将血浆亨廷顿蛋白水平与载体对照处理(KLH)进行比较时,血浆亨廷顿蛋白的显著减少可通过使用肽组合p7543+p7564或p7543+p6771的组合处理来实现(分别为p<0,001和p<0,01;学生t检验;n=每个处理组25只动物)。数字指示相对单位(FRET);误差条表示标准偏差。
图10:在经处理的YAC128小鼠和对照YAC128小鼠中的旋转杆测试,测量下落的等待时间(latency to fall)(以秒表示为平均值;n=25只动物/组),在用如指定的各种单一和组合肽疫苗处理的转基因YAC128小鼠中,在4、6、8、10和12个月进行(指示为“平均M4”-“平均M12”)。。值得注意的是,当与单一肽处理组p7543,p6771和7564相比时,组合组“p7543+7564”和“p7543+p6771”在该测试中显示总体上更好的表现。当与载体对照组相比,运动改善在组合组p7543+7564中在M4-M10上显著改善(分别为p<0,03、0,02、0,01;学生t检验,n=25)。该发现与如图9所述的血浆亨廷顿蛋白降低平行,并且显示亨廷顿氏病患者血液流中HTT的减少是有益的。
实施例4:通过用肽p6773,p7564和p7543免疫获得的单克隆和多克隆抗体的表位作图(mapping)
核心表位的确定
通过如实施例1解释的ELISA或者备选通过应用如Stadler等人,2008描述的肽微阵列测定滴度值(OD[EC50]),通过丙氨酸取代扫描进行肽表位作图。简而言之,将肽的每个位置包含单个丙氨酸取代的肽点样在阵列上,并且通过荧光标记的二抗结合LI-COR Biosciences的Odyssey成像系统测定由于单个位置处的取代导致的信号的丢失。这允许评估肽的每个单独的氨基酸对表位的贡献。使用该方法,将待作图的原始免疫肽加上每个单独位置的单一丙氨酸取代的变体或肽点样到微阵列上,并通过待测试的相应的单克隆抗体或免疫血清杂交。当来自丙氨酸取代肽的所得信号减少至来自原始免疫肽的信号的小于70%时,相应的丙氨酸取代的氨基酸位置被定义为核心表位的一部分。以下从个体血清或mAB提供所得核心表位序列。
结果:
多克隆,亲和纯化的抗体和单克隆抗体源自用PRR区衍生肽(包括p6771和p6773)和胱天蛋白酶区586衍生肽(包括p7543和p6776)免疫的单个小鼠。使用丙氨酸扫描定位表位。简而言之,通过使用肽微阵列或常规肽ELISA(如图11中例示)通过针对对于每个位置具有单个氨基酸取代的肽的抗体,来测定个体血清和单克隆抗体的表位。
如通过丙氨酸取代扫描测定,PRR区衍生肽p6771和p6773的肽和表位比对:
LPQPPPQAQPLLPC......免疫肽p6771
LPQPPPQAQPLLPQPQPC..免疫肽p6773
..........LLPQP.....对mABPRR13定位的表位
....PPQAQPL.........对多克隆p6773血清1定位的表位
....PPQAQP..........对多克隆p6773血清2定位的表位
........QPLL........对多克隆p6773血清3定位的表位
.....PQAQPLL........对多克隆p6773血清4定位的表位
(SEQ ID Nos.1,4和77-81)
通过丙氨酸取代扫描测定的p7543疫苗诱导的多克隆免疫血清和mAB C6-17的肽和表位比对:
跨越天冬氨酸586的胱天蛋白酶区域586衍生的肽的肽和表位比对:
图11:通过使用指定的含有单氨基酸丙氨酸取代的肽进行的肽ELISA,通过丙氨酸取代扫描来测定5种p6776诱导的免疫血清的核心表位。5个血清(由暗到亮条表示)与如指定的丙氨酸取代肽杂交(对于肽序列,参见表1)。结果,5个动物中的2个分别在经丙氨酸取代的肽p7754,p7756,p7757和p7758上显示出信号减少,从而描绘出具有氨基酸序列IVLD的核心表位。数字指示滴度OD(logEC 50)比率(ration)[Ala取代肽:wt-肽]。
p7564诱导的抗血清和mAB M1D1的表位作图在实施例5,图17中提供。
图12:mAB M1D1特异性识别在C-末端具的游离天冬氨酸586的重组亨廷顿蛋白片段,,强于recHTT610。使用具有610和586个氨基酸长度的重组亨廷顿蛋白(分别为HTT610和HTT586)进行蛋白质ELISA(如实施例1中所述)。值表示mAB M1D1信号(OD;如实施例1中解释的蛋白质捕获ELISA)与mAB 2166对照抗体信号的比率。将值相对于参考mAB 2166标准化,mAB 2166识别两个片段中都的内部表位作为蛋白质上样对照。
实施例5:单克隆抗体PRR13,C6-17和M1D1的产生和表征。
单克隆抗体
对于单克隆抗体的生产和分离,根据制造商的说明书使用ClonaCell-HY杂交瘤克隆试剂盒(STEMCELL technologies,CatNr.28411)。简言之,在HAT选择下用骨髓瘤细胞系SP2-0进行杂交瘤融合,并且最初分别使用免疫肽和用于背景测定的不相关对照肽通过肽ELISA筛选上清液。在M1D1的情况下,使用针对含有游离C末端天冬氨酸的肽p6776的ELISA,以便测定对具有游离C末端天冬氨酸的经切割肽的特异性,如实施例5中指示。如所述的那样亲和纯化候选mAB,并如实施例1中指示通过蛋白ELISA针对recHTT610进行测试。分别对于每个融合物,筛选的融合克隆的数目通常为500。对于VL和VH区测序,提取来自融合克隆的mRNA,使用Oligo(dT)引物逆转录并使用可变结构域引物进行PCR扩增以扩增VH和VL区两者。使用标准PCR克隆程序(Invitrogen,CatNr.K4560-01)克隆VH和VL产物,转化到TOP10细胞中,并通过PCR筛选阳性转化体。挑取选择的菌落并通过在ABI3130xl遗传分析仪上的DNA测序进行分析。
抗体的亲和纯化
根据制造商的方案分别使用与含有半胱氨酸的肽连接的BcMagTM碘乙酰活化磁珠(Bioclone,FG-102)从杂交瘤上清液(SN)和血浆中分离mAB和多克隆抗体。在室温下温育血浆/SN达2小时后,用高盐缓冲液(PBS,0.2%Triton X-100,补充NaCl至终浓度为350mM)洗涤珠,并用酸性洗脱缓冲液(Thermo,CatNr.21004)洗涤结合的抗体4次。在HEPES pH8(75mM终浓度)中中和后,浓缩洗脱的抗体,并使用Spin-X UF500管(Corning,CLS431478)将缓冲液更换为PBS至体积100μl。使用Qubit系统(Invitrogen,CatNr.Q32866)根据制造商的方案测定抗体浓度。
结果:
通过杂交瘤技术使用肽p6773作为免疫原产生抗体PRR13。如实施例2所示,肽p6773在R6/1转基因动物的主动免疫中显示出有益的神经保护作用,并与p6771重叠。如图11所示的,从识别PRR衍生肽的9个预选的候选mAB中选择PRR13。在图13中列出的候选mAB中,如图12所示的,PRR13基于当与重组HTT610杂交时其有利的信号/噪音比选择。
图13:来自源自用肽p6773免疫的小鼠的杂交瘤的上清液当通过肽ELISA测试时在9种预筛选的候选克隆中的7种中提供免疫肽的强烈识别。
图14:与特异性抗肽信号形成对比(图11),当通过recHTT610捕获ELISA(如实施例1中解释的)测试时,9个mAB候选物中仅2个,即PRR13和PRR18特异性识别重组亨廷顿蛋白。这两个候选物提供了显著的信噪比(即>=4;计算的reHTT610特异性信号:HEK对照提取物),并且选择PRR13用于表位表征(参见实施例4)和可变链测序(参见下文)。将PRR13确定为IgG亚型小鼠IgG2a。
>PRR13VH共有氨基酸序列(SEQ ID No.62):
MGWSWVMLFLLSGTGGVLSEVQLQQSAPELVKPGASVKMSCKASGYSFTDFYMKWVKQSHGKGLEWIGDIDPKNGDTFYNQKFKGRATLTVDKSSSTAYMQLNSLTTEDSAVYYCATYYGYTMDYWGQGTSVTVSSAKTTAPSVYPLAPVCGDTTGSSVTLGCLVKGYF
>PRR13VL共有氨基酸序列(SEQ ID No.63):
MDFQVQIFSFLLISASVIMSRGQIVLTQSPAIMSASLGERVTMTCTASSSVTSSYLHWYQQKPGSSPKLWIYSTSNLASGVPARFSGSGSGTSYSLTISSMEAEDAATYYCHQYRRPPRTFGGGTKLEIKRADAAPTVSIFPPSSEQLTSGGASVVCFLNNFYPR
使用肽p7543作为免疫原,通过杂交瘤技术产生抗体C6-17。如实施例3中证明,肽p7543在YAC128转基因动物中显示出有益的治疗效果。尽管抗recHTT610信号在来自该筛选的4个预选的mAB之间是可比较的。如图13所示,信噪比在这些候选物中显著不同。如图14所示,其中显示recHTT610捕获ELISA(如实施例1中所述进行)。C6-17基于其特异性和IgG亚型(测定为小鼠IgG2a)而选择,用于表位表征(参见实施例4)和可变链测序:
图15:来自肽p7543免疫小鼠的4种预选的抗亨廷顿蛋白mAb的特异性分析。4个mAB候选物的值表示针对对照提取物的重组亨廷顿蛋白特异性OD-信号的信噪比(通过如实施例1中解释的蛋白质捕获ELISA确定)。mAB C6-17提供最佳的信噪比。
>C6-17VH共有氨基酸序列(SEQ ID No.60):
MGWSCIMLFLLSGTAGVLSEVQLQQSGPELVKPGASVKISCKTSGYTFTEYTMHWVKQSHGKSLEWIGGINPNNGGTRYNQKFKGKATLTVDRSSSTAYMELRSLTSEDSAVYYCASLDGRDYWGQGTTLTVSSAKTTAPSVFPLA
>C6-17VL共有氨基酸序列(SEQ ID No.61):
MVLMLLLLWVSGTCGDIVMSQSPSSLAVSAGEKVTMSCKSSQSLLNSRTRKNYLAWYQQKPGQSPKLLIYWASTRESGVPDRFTGSGSGTDFTLTISSVQAEDLAVYSCKQSYNLLTFGAGTKLELKRADAAPTVSIFPPSSEQLTSGGASVVCFLNNFYPK
通过杂交瘤技术使用肽p7564作为免疫原产生抗体M1D1。肽p7564在YAC128转基因动物中显示出有益的处理效果,如实施例3中证明。单克隆抗体M1D1通过相对于含有在序列内包埋的此天冬氨酸残基的肽诸如例如p6776对C-末端包含游离天冬氨酸的肽的结合的差异筛选来选择,如实施例1,图3所示。单克隆抗体M1D1基于其对“切割”序列的特异性选择,用于进一步的表位表征和可变链测序。将其分型为小鼠IgM,并且它结合至人亨廷顿蛋白片段的新表位,所述新表位通过胱天蛋白酶6或任何其它蛋白酶在氨基酸位置D586处切割对蛋白质或相应肽序列切割时产生。
图16:通过肽ELISA(如实施例1中所解释)测定针对“切割”肽p7564的特异性筛选预选的mAB。与例如M1-C2相反,mAB M1D1显示最有利的p7564与p6776OD信号比。M1D1因此对于通过在位置586处的蛋白水解切割产生的新表位是特异性的。p7564的C-末端天冬氨酸对应于由胱天蛋白酶6和可能的其它胱天蛋白酶产生的C-末端切割点。从而,它提供了在该位点的特异性切割检测的手段,类似于用治疗有益的肽p7564产生的多克隆抗血清,如实施例3所示。
图17:mAB M1D1识别来自至少7AA长度的胱天蛋白酶6切割区的含有游离C末端天冬氨酸的亨廷顿蛋白肽。相反,更短的肽或没有游离C末端天冬氨酸的肽没有被M1D1识别或仅被M1D1弱识别,从而证明该单克隆抗体对具有游离COOH末端天冬氨酸的切割序列的特异性,例如经切割的人亨廷顿蛋白的游离氨基酸位置586(柱表示来自肽ELISA的OD,其中mAB浓度为1ng/μl;肽名称从左到右如下:p7564,p7562,p7552,p7541,p7567,p7568,p7605,p6777)。
>M1D1VH共有氨基酸序列(SEQ ID No.64):
MDFGLSWVFFVVFYQGVHCEVQLVESGGGLVQPKGSLKLSCAASGFTFNTYAMNWVRQAPGKGLEWVARIRSKSNNYATYYADSVKDRFTISRDDSQSMLYLQMNNLKTEDTAMYYCVRHGEYGNPWFAYWGQGTLVTVSAESQSFPNVFPL
>M1D1VL共有氨基酸序列(SEQ ID No.65):
MKLPVRLLVLMFWIPASSSDVVMTQTPLSLPVSLGDQASISCRSSQSLVHSNGNTYLHWYLQKPGQSPKLLIYKVSNRFSGVPDRFSGSGSGTDFTLKISRVEAEDLGVYFCSQSTHVPYTFGGGTKLEIKRADAAPTVSIFPPSSEQLTSGGASVVCFLNNFYPK
实施例6-单克隆抗体PRR13和C6-17用于从人血清中消耗亨廷顿蛋白的用途。
亨廷顿蛋白消耗
将100μg顺磁性链霉亲合素包被的珠(Dynabeads T1,CatNr.65601)在50μl的缓冲液体积中与20ng/μl生物素化的mAB在室温下温育1小时。用PBS以1:4稀释人血清,并掺入来自经recHTT610转染的和假转染的细胞的蛋白质提取物,最终提取物浓度为50-100ng/μl,分别如实施例1所示获得。将生物素化的mAB与链霉亲合素珠偶联,并且在室温下与含亨廷顿细胞提取物的血清温育o/n。在严格珠洗涤(50mM Tris,250mM NaCl,0.1%Tween)后,为了确认单克隆抗体对recHTT610的消耗功效,通过如实施例1中的recHTT610捕获ELISA测试输入血清(含有recHTT610),假血清(mock serum)和消耗的含recHTT610的血清。
结果:
为了证明mAb PPR13和C6-17可以用作血浆亨廷顿蛋白的治疗性成分输血的特异性吸附剂,将过量的重组亨廷顿蛋白recHTT610加入到来自健康供体的人血清中,随后分别通过生物素固定的mAB PRR13,C6-17和对照IgG进行离体消耗。如图18所示,单克隆抗体PRR13和C6-17而不是IgG有效地从人血浆中消耗过量的亨廷顿蛋白。因此,这些抗体为用于处理亨廷顿蛋白的治疗性成分输血提供了方便的吸附剂。这些抗体在亨廷顿氏病中对于治疗性成分输血处理的有用性得到以下事实的支持:mAB PPR13和C6-17是通过使用p6773和p7543作为免疫肽产生的。如分别在实施例2和3中所示的,来自这些靶定区的肽能够诱导在转基因动物模型中减少亨廷顿氏病表型的抗体。类似地,预期相应的mAB通过消耗HTT提供类似的益处,如图18中证明。
图18:与同种型对照抗体IgG相比,使用mAB PRR13和C6-17从人血清中特异性消耗重组亨廷顿蛋白recHTT610。如通过血浆中的亨廷顿蛋白信号的减少(通过如在实施例1中的蛋白质ELISA测定)所反映的,这些mAb可以有效地吸附和减少亨廷顿蛋白,如治疗性成分输血所需要的。该图表示在消耗之前(输入),在通过特异性抗体(mAB PRR13和C6-17)消耗之后和通过同种型对照抗体(IgG)消耗之后,检测到的亨廷顿蛋白信号(作为OD;通过蛋白质捕获ELISA测量)的量。
表1:优选的肽的使用(肽名称/肽区域/肽序列(C用于偶联到载体蛋白;可以在肽的N-或C-端提供),除了p7564,p7541,p7552,p7562,p7563,p7567或p7568之外,其中表位需要游离C末端天冬氨酸);肽表,指示名称命名,作图到蛋白质区域(区域:Nter=N-末端,polyQ=多聚谷氨酰胺段,PRR=富含多脯氨酸的区域,Ex1=作图到外显子1,C6=胱天蛋白酶切割586区域)和氨基酸序列(单字母代码;Nter>Cter;a=β-丙氨酸;b=生物素)。
实施例7:mAB PRR13或mAB C6-17作为用于治疗性成分输血的吸附剂的用途。
将生物素化的抗HTT抗体mAB PRR13,mAB C6-17和不相关的对照抗体(“对照mAB”)固定在磁性链霉亲合素珠上,并与用PBS以1:1稀释的人血清一起温育,所述血清掺入了来自表达重组HTT610的瞬时转染的HEK细胞的细胞提取物(由“HTT”表示)或来自未转染的HEK细胞的对照提取物(表示为“对照”)。由mAB PRR13或mAB C6-17包被的吸附剂珠分别显示recHTT捕获(图19;指示“PRR13和C6-17”;y轴显示由抗抗V5检测捕获的recHTT610蛋白产生的OD)。不相关的对照提取物(对照)或由不相关抗体(对照mAB)包被的珠提供了背景对照。作为结论,这提供了使用这些抗体作为吸附剂用于存在于血清或其它液体中的HTT的实例,如例如治疗性成分输血所需要的。方法:HTT消耗
将100μg顺磁性链霉亲合素珠(Dynabeads T1,CatNr.65601)在50μl的缓冲液体积中与20ng/μl生物素化的mAB在室温下温育1小时。将人血清用PBS以1:4稀释,并掺有最终提取物浓度为50-100ng/μl的来自经recHTT610转染的和假转染的HEK293细胞的蛋白质提取物,如实施例1中制备。将生物素化的mAB与链霉亲合素珠偶联,并随后与含有recHTT610-提取物的血清在室温下温育o/n。为了证实recHTT610消耗功效,输入血清(含有recHTT610),假血清和recHTT610消耗的血清用于如实施例1中的recHTT610捕获ELISA。使用如下设置的珠上(on-beads)ELISA定量通过抗体包被的珠对血清的Rec HTT610消耗:为了检测结合的recHTT610,使用50mM Tris,250mM NaCl,0.1%Tween缓冲液严格清洗珠,然后用兔V5抗体(1:5000)温育。
实施例8-补充实施例#1b的使用:来自本发明的单克隆或多克隆抗体还识别含有延伸的82个氨基酸长的多聚Q段的突变HTT(mutHTT)(mutHTT610Q82)。
将源自瞬时表达重组mutHTT610Q82的HEK细胞的上清液直接包被在ELISA板上,随后与mAB PRR13(5ng/μl),多克隆p9395血清混合物(1:100稀释;源自5只免疫的动物)和不相关的mAB(5ng/μl)一起温育。在图20中描绘了结果。Y轴显示从使用mAB PRR13,来自五个p9395免疫动物的合并血清和不相关mAB的合并血清的ELISA获得的OD值,如标示的,由此应用与实施例1相同的ELISA方案。为了测定ELISA测定的背景信号,如所指示的,将mAB PRR13和合并的p9395血清与1,25ng/ml细胞提取物一起温育。
实施例9:分别基于mAB PRR13和C6-17的序列信息衍生化重组Fab。
将PRR13FAB和C6-17FAB瞬时转染到HEK细胞中,并使用来自HTT610转染的HEK细胞的细胞提取物如上所示通过HTT捕获ELISA进行测试。mAB 2166(1:2000)用作阳性对照抗体。结果描述于图21中。显示了FAB PRR13和FAB C6-17的结合信号(y轴上的OD值,浅灰色柱),与x-轴上指示的抗HTT参考抗体mAB 2166直接比较。背景信号使用源自未转染的HEK细胞的对照提取物(对照提取物)测定,由深灰色条表示。这例证了mAB的衍生物也可以用作吸附剂。
方法-FAB表达:
将抗体PRR13和C6-17的轻链和重链(有/无IgG的铰链区)克隆到CMV驱动的基因表达载体中,以在上清液(SN)中获得重组FAB。在转染后24至48小时收集SN,并且通过肽ELISA和rec HTT610ELISA证实这些构建体的表达和结合功能性。
实施例10-抗体人源化
a)原始抗体PRR13和hC6-17的抗体人源化分别如下进行:重链和轻链可变区的原型框架分别用于产生hPRR13-1至-16系列和hC6-17-1至-16系列。系列包括在重链(称为框架H)和/或轻链(称为框架L)的一个或几个氨基酸位置含有修饰的原型变体,如图22所示。数字反映下文对人源化抗体指定的框架区内的氨基酸位置。
hPRR13系列轻链可变区
[EIVLTQSPSSLSASVGDRVTITCTASSSVTSSYLHWYQQKPGKAPKLLIYSTSNLASGVPSRFSGSGSGTDFTFTISSLQPEDIATYYCHQYRRPPRTFGGGTKLEIKR];
hPRR13重链可变区
[EVQLVESGPEVKKPGATVKISCKVSGYTFTDFYMKWVQQAPGRGLEWMGDIDPKNGDTFYNQKFKGRVTMTADTSTGTAYMQLSSLTSEDTAVYFCASYYGYTMDYWGQGTTVTVAS];
hC6-17轻链可变区
[DIVMTQSPDSLAVSLGERATINCKSSQSLLNSRTRKNYLAWYQQKPGQPPKLLIYWASTRESGVPDRFSGSGSGTDFTLTISSLQAEDVAVYYCKQSYNLLTFGGGTKLEIK];
hC6-17重链可变区
[QVQLVQSGAEVKKPGASVKVSCKASGYTFTEYTMHWVRQAPGRGLEWMGGINPNNGGTRYNQKFKGRVTMTRDTSIRTAYVELSRLTSDDTAVYYCASLDGRDYWGQGTLVTVSS]
方法:合成人vLC和vHC序列并克隆到表达载体pFUSE2ss CLg-hk(EcoRI/NheI)和pFUSEss CHIg-hG1(EcoRI/BsiWI)中。基本上如制造商所示根据标准分子生物学程序进行克隆程序,包括限制性消化和连接反应(NEB Quick连接酶试剂盒;CatNr.M2200L),细菌转化,然后是克隆选择和分析。使用标准DNA纯化试剂盒(Quiagen;CatNr.27106)从琼脂糖凝胶中进行DNA片段制备。如制造商指示,将HEK293freestyle细胞(Invitrogen;CatNr.R790-07)培养在培养基中,并用表中所示的hu AB重链和轻链载体的不同组合瞬时共转染。在转染后24-48小时收集细胞培养SN,并以1:30浓缩,随后使用Spin-X UF500管(Corning,CLS431478)进行缓冲液交换(PBS)。使用ELISA(如实施例1)通过体外肽和蛋白质结合测试浓缩的人抗体-SN。贯穿本实施例9指示进行进一步表征。
b)作为实例,与对照提取物(深灰色柱)相比,如a)中指示的含有框架突变的人源化mAB PRR13衍生物hPRR13-10,hPRR13-12和hPRR13-14(浅灰色条)对recHTT610蛋白的识别(参见图22)可以通过蛋白质ELISA证明(如实施例1中所述进行;参见图23,y轴反映了rec Htt610结合活性[OD])。
特别优选用于主动疫苗接种(“++活性疫苗”)
优选用于主动疫苗接种(“+活性疫苗”)
优选用于mAB产生(“mAB产生”)
优选用于C6切割抑制(“C6抑制”)
文献
Bard et al.,2014,Journal of Biomolecular Screening,Volume 19(2),191-204
Butler et al.,2012,Progress in Neurobiology,Volume 97(2):190-204
Davidson,2012,Molecular Therapy,Volume 20(10):1838
Ellrichmann et al.,2013,ClinDevImmunol.,2013;2013:541259
Graham et al.,2010,J Neurosci.,Volume 30(45):15019-29
Ko et al.,2001,Brain Research Bulletin,Volume 56(3/4):319-329
Liu,2007,Journal of the American Society for Mass Spectrometry.Volume 18(7):1249-64
Mandler et al.;ActaNeuropathologica127(2014):861-879
Messer&Joshi,2013,Neurotherapeutics,Volume 10:447-458
Modreggeret al.,2002,Human Molecular Genetics,Volume 11(21):2547-58
Novak&Tabrizi,2011,International Review of Neurobiology,Volume 98:297-323
O'Hagan&Valiante,2003,Nature Reviews Drug Discovery,Volume 2(9):727-35
Singh&O'Hagan,1999,Nature Biotechnology,Volume 17(11):1075-81
Southwell et al.,2011,PloS ONE,Volume 6(1):e16676
Stadler et al.;AngewandteChemie International Edition England 2008;Vol 47(37):7132-5Tezel et al.,2012,Investigative Ophthalmology&Visual Science Volume 53(13):8222-31
et al.,2014,Brain,Volume 137(3):819-33
Warby et al.,2008,Human Molecular Genetics,Volume 17(15):2390-2404
Weiss et al.,Analytical Biochemistry 2009;Vol 395(1):8-15
Weiss et al.,2012,The Journal of Clinical Investigation,Volume 122(10):3731-3736
Weiss et al.2014,9th Annual Huntington's Disease Therapeutics Conference(CHDI);Palm Springs USA,Abstract.
Wong et al.2014;9th Annual Huntington's Disease Therapeutics Conference(CHDI);Palm Springs USA,Abstract.
Yu et al.,2014,Trends in Pharmacological Sciences,Volume 35(2):53-62
Zhang et al.;Current Protocols in Immunology 2008;Chapter:Unit–14.1
Zheng&Diamond,2012,Progress in Molecular Biology and Translational Science,Volume 107:189-214.
序列表
<110> 阿费里斯股份公司
<120> 用于预防和/或治疗亨廷顿氏病的物质和方法
<130> R 67859
<150> EP 14176609.7
<151> 2014-07-10
<160> 98
<170> PatentIn 版本 3.5
<210> 1
<211> 18
<212> PRT
<213> 人工序列
<220>
<223> 亨廷顿蛋白肽
<400> 1
Leu Pro Gln Pro Pro Pro Gln Ala Gln Pro Leu Leu Pro Gln Pro Gln
1 5 10 15
Pro Cys
<210> 2
<211> 11
<212> PRT
<213> 人工序列
<220>
<223> 亨廷顿蛋白肽
<400> 2
Cys Pro Ser Asp Ser Ser Glu Ile Val Leu Asp
1 5 10
<210> 3
<211> 13
<212> PRT
<213> 人工序列
<220>
<223> 亨廷顿蛋白肽
<400> 3
Gly Thr Asp Asn Gln Tyr Leu Gly Leu Gln Ile Gly Cys
1 5 10
<210> 4
<211> 14
<212> PRT
<213> 人工序列
<220>
<223> 亨廷顿蛋白肽
<400> 4
Leu Pro Gln Pro Pro Pro Gln Ala Gln Pro Leu Leu Pro Cys
1 5 10
<210> 5
<211> 13
<212> PRT
<213> 人工序列
<220>
<223> 亨廷顿蛋白肽
<400> 5
Cys Gly Pro Ala Val Ala Glu Glu Pro Leu His Arg Pro
1 5 10
<210> 6
<211> 13
<212> PRT
<213> 人工序列
<220>
<223> 亨廷顿蛋白肽
<400> 6
Ser Asp Ser Ser Glu Ile Val Leu Asp Gly Thr Asp Cys
1 5 10
<210> 7
<211> 13
<212> PRT
<213> 人工序列
<220>
<223> 亨廷顿蛋白肽
<400> 7
Glu Ile Val Leu Asp Gly Thr Asp Asn Gln Tyr Leu Cys
1 5 10
<210> 8
<211> 13
<212> PRT
<213> 人工序列
<220>
<223> 亨廷顿蛋白肽
<400> 8
Ile Val Leu Asp Gly Thr Asp Asn Gln Tyr Leu Gly Cys
1 5 10
<210> 9
<211> 13
<212> PRT
<213> 人工序列
<220>
<223> 亨廷顿蛋白肽
<400> 9
Val Leu Asp Gly Thr Asp Asn Gln Tyr Leu Gly Leu Cys
1 5 10
<210> 10
<211> 13
<212> PRT
<213> 人工序列
<220>
<223> 亨廷顿蛋白肽
<400> 10
Leu Asp Gly Thr Asp Asn Gln Tyr Leu Gly Leu Gln Cys
1 5 10
<210> 11
<211> 14
<212> PRT
<213> 人工序列
<220>
<223> 亨廷顿蛋白肽
<400> 11
Asp Gly Thr Asp Asn Gln Tyr Leu Gly Leu Gln Ile Gly Cys
1 5 10
<210> 12
<211> 13
<212> PRT
<213> 人工序列
<220>
<223> 亨廷顿蛋白肽
<400> 12
Cys Thr Asp Asn Gln Tyr Leu Gly Leu Gln Ile Gly Gln
1 5 10
<210> 13
<211> 13
<212> PRT
<213> 人工序列
<220>
<223> 亨廷顿蛋白肽
<400> 13
Cys Gly Thr Asp Asn Gln Tyr Leu Gly Leu Gln Ile Gly
1 5 10
<210> 14
<211> 13
<212> PRT
<213> 人工序列
<220>
<223> 亨廷顿蛋白肽
<400> 14
Cys Asp Asn Gln Tyr Leu Gly Leu Gln Ile Gly Gln Pro
1 5 10
<210> 15
<211> 13
<212> PRT
<213> 人工序列
<220>
<223> 亨廷顿蛋白肽
<400> 15
Cys Asn Gln Tyr Leu Gly Leu Gln Ile Gly Gln Pro Gln
1 5 10
<210> 16
<211> 16
<212> PRT
<213> 人工序列
<220>
<223> 亨廷顿蛋白肽
<400> 16
Cys Pro Gln Leu Pro Gln Pro Pro Pro Gln Ala Gln Pro Leu Leu Pro
1 5 10 15
<210> 17
<211> 13
<212> PRT
<213> 人工序列
<220>
<223> 亨廷顿蛋白肽
<400> 17
Thr Asp Asn Gln Tyr Leu Gly Leu Gln Ile Gly Gln Cys
1 5 10
<210> 18
<211> 13
<212> PRT
<213> 人工序列
<220>
<223> 亨廷顿蛋白肽
<400> 18
Asp Asn Gln Tyr Leu Gly Leu Gln Ile Gly Gln Pro Cys
1 5 10
<210> 19
<211> 23
<212> PRT
<213> 人工序列
<220>
<223> 亨廷顿蛋白肽
<220>
<221> misc_feature
<222> (22)..(22)
<223> Xaa 可以是任何天然存在的氨基酸
<400> 19
Pro Pro Pro Gln Leu Pro Gln Pro Pro Pro Gln Ala Gln Pro Leu Leu
1 5 10 15
Pro Gln Pro Gln Pro Xaa Cys
20
<210> 20
<211> 13
<212> PRT
<213> 人工序列
<220>
<223> 亨廷顿蛋白肽
<400> 20
Pro Ser Asp Ser Ser Glu Ile Val Leu Asp Gly Thr Cys
1 5 10
<210> 21
<211> 13
<212> PRT
<213> 人工序列
<220>
<223> 亨廷顿蛋白肽
<400> 21
Asp Ser Ser Glu Ile Val Leu Asp Gly Thr Asp Asn Cys
1 5 10
<210> 22
<211> 13
<212> PRT
<213> 人工序列
<220>
<223> 亨廷顿蛋白肽
<400> 22
Ser Glu Ile Val Leu Asp Gly Thr Asp Asn Gln Tyr Cys
1 5 10
<210> 23
<211> 13
<212> PRT
<213> 人工序列
<220>
<223> 亨廷顿蛋白肽
<400> 23
Asn Gln Tyr Leu Gly Leu Gln Ile Gly Gln Pro Gln Cys
1 5 10
<210> 24
<211> 13
<212> PRT
<213> 人工序列
<220>
<223> 亨廷顿蛋白肽
<400> 24
Gln Tyr Leu Gly Leu Gln Ile Gly Gln Pro Gln Asp Cys
1 5 10
<210> 25
<211> 20
<212> PRT
<213> 人工序列
<220>
<223> 亨廷顿蛋白肽
<220>
<221> misc_feature
<222> (2)..(2)
<223> Xaa 可以是任何天然存在的氨基酸
<400> 25
Cys Xaa Met Ala Thr Leu Glu Lys Leu Met Lys Ala Phe Glu Ser Leu
1 5 10 15
Lys Ser Phe Gln
20
<210> 26
<211> 15
<212> PRT
<213> 人工序列
<220>
<223> 亨廷顿蛋白肽
<220>
<221> misc_feature
<222> (2)..(2)
<223> Xaa 可以是任何天然存在的氨基酸
<400> 26
Cys Xaa Lys Leu Met Lys Ala Phe Glu Ser Leu Lys Ser Phe Gln
1 5 10 15
<210> 27
<211> 13
<212> PRT
<213> 人工序列
<220>
<223> 亨廷顿蛋白肽
<400> 27
Cys Glu Glu Gln Gln Arg Gln Gln Gln Gln Gln Gln Gln
1 5 10
<210> 28
<211> 19
<212> PRT
<213> 人工序列
<220>
<223> 亨廷顿蛋白肽
<220>
<221> MOD_RES
<222> (15)..(15)
<223> bAla
<400> 28
Gln Gln Gln Gln Gln Gln Pro Pro Pro Pro Pro Pro Pro Pro Xaa Lys
1 5 10 15
Lys Lys Cys
<210> 29
<211> 7
<212> PRT
<213> 人工序列
<220>
<223> 亨廷顿蛋白肽
<400> 29
Cys Ser Glu Ile Val Leu Asp
1 5
<210> 30
<211> 8
<212> PRT
<213> 人工序列
<220>
<223> 亨廷顿蛋白肽
<400> 30
Cys Ser Ser Glu Ile Val Leu Asp
1 5
<210> 31
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 亨廷顿蛋白肽
<400> 31
Cys Asp Ser Ser Glu Ile Val Leu Asp
1 5
<210> 32
<211> 10
<212> PRT
<213> 人工序列
<220>
<223> 亨廷顿蛋白肽
<400> 32
Cys Ser Asp Ser Ser Glu Ile Val Leu Asp
1 5 10
<210> 33
<211> 6
<212> PRT
<213> 人工序列
<220>
<223> 亨廷顿蛋白肽
<400> 33
Cys Glu Ile Val Leu Asp
1 5
<210> 34
<211> 5
<212> PRT
<213> 人工序列
<220>
<223> 亨廷顿蛋白肽
<400> 34
Cys Ile Val Leu Asp
1 5
<210> 35
<211> 6
<212> PRT
<213> 人工序列
<220>
<223> 亨廷顿蛋白肽
<400> 35
Cys Ser Glu Ile Val Leu
1 5
<210> 36
<211> 14
<212> PRT
<213> 人工序列
<220>
<223> 亨廷顿蛋白肽
<400> 36
Cys Ser Glu Ile Val Leu Asp Gly Thr Asp Asn Gln Tyr Leu
1 5 10
<210> 37
<211> 14
<212> PRT
<213> 人工序列
<220>
<223> 亨廷顿蛋白肽
<400> 37
Cys Ser Asp Ser Ser Glu Ile Val Leu Asp Gly Thr Asp Asn
1 5 10
<210> 38
<211> 14
<212> PRT
<213> 人工序列
<220>
<223> 亨廷顿蛋白肽
<400> 38
Ser Glu Ile Val Leu Asp Gly Thr Asp Asn Gln Tyr Leu Cys
1 5 10
<210> 39
<211> 14
<212> PRT
<213> 人工序列
<220>
<223> 亨廷顿蛋白肽
<400> 39
Cys Ala Glu Ile Val Leu Asp Gly Thr Asp Asn Gln Tyr Leu
1 5 10
<210> 40
<211> 14
<212> PRT
<213> 人工序列
<220>
<223> 亨廷顿蛋白肽
<400> 40
Cys Ser Ala Ile Val Leu Asp Gly Thr Asp Asn Gln Tyr Leu
1 5 10
<210> 41
<211> 14
<212> PRT
<213> 人工序列
<220>
<223> 亨廷顿蛋白肽
<400> 41
Cys Ser Glu Ala Val Leu Asp Gly Thr Asp Asn Gln Tyr Leu
1 5 10
<210> 42
<211> 14
<212> PRT
<213> 人工序列
<220>
<223> 亨廷顿蛋白肽
<400> 42
Cys Ser Glu Ile Ala Leu Asp Gly Thr Asp Asn Gln Tyr Leu
1 5 10
<210> 43
<211> 14
<212> PRT
<213> 人工序列
<220>
<223> 亨廷顿蛋白肽
<400> 43
Cys Ser Glu Ile Val Ala Asp Gly Thr Asp Asn Gln Tyr Leu
1 5 10
<210> 44
<211> 14
<212> PRT
<213> 人工序列
<220>
<223> 亨廷顿蛋白肽
<400> 44
Cys Ser Glu Ile Val Leu Ala Gly Thr Asp Asn Gln Tyr Leu
1 5 10
<210> 45
<211> 14
<212> PRT
<213> 人工序列
<220>
<223> 亨廷顿蛋白肽
<400> 45
Cys Ser Glu Ile Val Leu Asp Ala Thr Asp Asn Gln Tyr Leu
1 5 10
<210> 46
<211> 14
<212> PRT
<213> 人工序列
<220>
<223> 亨廷顿蛋白肽
<400> 46
Cys Ser Glu Ile Val Leu Asp Gly Ala Asp Asn Gln Tyr Leu
1 5 10
<210> 47
<211> 14
<212> PRT
<213> 人工序列
<220>
<223> 亨廷顿蛋白肽
<400> 47
Cys Ser Glu Ile Val Leu Asp Gly Thr Ala Asn Gln Tyr Leu
1 5 10
<210> 48
<211> 14
<212> PRT
<213> 人工序列
<220>
<223> 亨廷顿蛋白肽
<400> 48
Cys Ser Glu Ile Val Leu Asp Gly Thr Asp Ala Gln Tyr Leu
1 5 10
<210> 49
<211> 14
<212> PRT
<213> 人工序列
<220>
<223> 亨廷顿蛋白肽
<400> 49
Cys Ser Glu Ile Val Leu Asp Gly Thr Asp Asn Ala Tyr Leu
1 5 10
<210> 50
<211> 14
<212> PRT
<213> 人工序列
<220>
<223> 亨廷顿蛋白肽
<400> 50
Cys Ser Glu Ile Val Leu Asp Gly Thr Asp Asn Gln Ala Leu
1 5 10
<210> 51
<211> 14
<212> PRT
<213> 人工序列
<220>
<223> 亨廷顿蛋白肽
<400> 51
Cys Ser Glu Ile Val Leu Asp Gly Thr Asp Asn Gln Tyr Ala
1 5 10
<210> 52
<211> 43
<212> PRT
<213> 人工序列
<220>
<223> 亨廷顿蛋白肽
<220>
<221> misc_feature
<222> (1)..(1)
<223> Xaa 可以是任何天然存在的氨基酸
<400> 52
Xaa Gly Gly Gly Asp Tyr Lys Asp Asp Asp Asp Lys Gly Ala Val Thr
1 5 10 15
Pro Ser Asp Ser Ser Glu Ile Val Leu Asp Gly Thr Asp Asn Gln Tyr
20 25 30
Leu Gly Leu Gln Ile Gly Gln Pro Gln Asp Gly
35 40
<210> 53
<211> 35
<212> PRT
<213> 人工序列
<220>
<223> 亨廷顿蛋白肽
<220>
<221> misc_feature
<222> (1)..(1)
<223> Xaa 可以是任何天然存在的氨基酸
<400> 53
Xaa Gly Gly Gly Asp Tyr Lys Asp Asp Asp Asp Lys Gly Pro Pro Pro
1 5 10 15
Gln Leu Pro Gln Pro Pro Pro Gln Ala Gln Pro Leu Leu Pro Gln Pro
20 25 30
Gln Pro Gly
35
<210> 54
<211> 8
<212> PRT
<213> 人工序列
<220>
<223> 抗体序列
<400> 54
Gly Tyr Ser Phe Thr Asp Phe Tyr
1 5
<210> 55
<211> 8
<212> PRT
<213> 人工序列
<220>
<223> 抗体序列
<400> 55
Ile Asp Pro Lys Asn Gly Asp Thr
1 5
<210> 56
<211> 10
<212> PRT
<213> 人工序列
<220>
<223> 抗体序列
<400> 56
Ala Thr Tyr Tyr Gly Tyr Thr Met Asp Tyr
1 5 10
<210> 57
<211> 7
<212> PRT
<213> 人工序列
<220>
<223> 抗体序列
<400> 57
Ser Ser Val Thr Ser Ser Tyr
1 5
<210> 58
<211> 4
<212> PRT
<213> 人工序列
<220>
<223> 抗体序列
<220>
<221> MOD_RES
<222> (4)..(4)
<400> 58
Ser Thr Ser Xaa
1
<210> 59
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 抗体序列
<400> 59
His Gln Tyr Arg Arg Pro Pro Arg Thr
1 5
<210> 60
<211> 146
<212> PRT
<213> 人工序列
<220>
<223> 抗体序列
<400> 60
Met Gly Trp Ser Cys Ile Met Leu Phe Leu Leu Ser Gly Thr Ala Gly
1 5 10 15
Val Leu Ser Glu Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys
20 25 30
Pro Gly Ala Ser Val Lys Ile Ser Cys Lys Thr Ser Gly Tyr Thr Phe
35 40 45
Thr Glu Tyr Thr Met His Trp Val Lys Gln Ser His Gly Lys Ser Leu
50 55 60
Glu Trp Ile Gly Gly Ile Asn Pro Asn Asn Gly Gly Thr Arg Tyr Asn
65 70 75 80
Gln Lys Phe Lys Gly Lys Ala Thr Leu Thr Val Asp Arg Ser Ser Ser
85 90 95
Thr Ala Tyr Met Glu Leu Arg Ser Leu Thr Ser Glu Asp Ser Ala Val
100 105 110
Tyr Tyr Cys Ala Ser Leu Asp Gly Arg Asp Tyr Trp Gly Gln Gly Thr
115 120 125
Thr Leu Thr Val Ser Ser Ala Lys Thr Thr Ala Pro Ser Val Phe Pro
130 135 140
Leu Ala
145
<210> 61
<211> 162
<212> PRT
<213> 人工序列
<220>
<223> 抗体序列
<400> 61
Met Val Leu Met Leu Leu Leu Leu Trp Val Ser Gly Thr Cys Gly Asp
1 5 10 15
Ile Val Met Ser Gln Ser Pro Ser Ser Leu Ala Val Ser Ala Gly Glu
20 25 30
Lys Val Thr Met Ser Cys Lys Ser Ser Gln Ser Leu Leu Asn Ser Arg
35 40 45
Thr Arg Lys Asn Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ser
50 55 60
Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val Pro
65 70 75 80
Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile
85 90 95
Ser Ser Val Gln Ala Glu Asp Leu Ala Val Tyr Ser Cys Lys Gln Ser
100 105 110
Tyr Asn Leu Leu Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys Arg
115 120 125
Ala Asp Ala Ala Pro Thr Val Ser Ile Phe Pro Pro Ser Ser Glu Gln
130 135 140
Leu Thr Ser Gly Gly Ala Ser Val Val Cys Phe Leu Asn Asn Phe Tyr
145 150 155 160
Pro Lys
<210> 62
<211> 169
<212> PRT
<213> 人工序列
<220>
<223> 抗体序列
<400> 62
Met Gly Trp Ser Trp Val Met Leu Phe Leu Leu Ser Gly Thr Gly Gly
1 5 10 15
Val Leu Ser Glu Val Gln Leu Gln Gln Ser Ala Pro Glu Leu Val Lys
20 25 30
Pro Gly Ala Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Ser Phe
35 40 45
Thr Asp Phe Tyr Met Lys Trp Val Lys Gln Ser His Gly Lys Gly Leu
50 55 60
Glu Trp Ile Gly Asp Ile Asp Pro Lys Asn Gly Asp Thr Phe Tyr Asn
65 70 75 80
Gln Lys Phe Lys Gly Arg Ala Thr Leu Thr Val Asp Lys Ser Ser Ser
85 90 95
Thr Ala Tyr Met Gln Leu Asn Ser Leu Thr Thr Glu Asp Ser Ala Val
100 105 110
Tyr Tyr Cys Ala Thr Tyr Tyr Gly Tyr Thr Met Asp Tyr Trp Gly Gln
115 120 125
Gly Thr Ser Val Thr Val Ser Ser Ala Lys Thr Thr Ala Pro Ser Val
130 135 140
Tyr Pro Leu Ala Pro Val Cys Gly Asp Thr Thr Gly Ser Ser Val Thr
145 150 155 160
Leu Gly Cys Leu Val Lys Gly Tyr Phe
165
<210> 63
<211> 165
<212> PRT
<213> 人工序列
<220>
<223> 抗体序列
<400> 63
Met Asp Phe Gln Val Gln Ile Phe Ser Phe Leu Leu Ile Ser Ala Ser
1 5 10 15
Val Ile Met Ser Arg Gly Gln Ile Val Leu Thr Gln Ser Pro Ala Ile
20 25 30
Met Ser Ala Ser Leu Gly Glu Arg Val Thr Met Thr Cys Thr Ala Ser
35 40 45
Ser Ser Val Thr Ser Ser Tyr Leu His Trp Tyr Gln Gln Lys Pro Gly
50 55 60
Ser Ser Pro Lys Leu Trp Ile Tyr Ser Thr Ser Asn Leu Ala Ser Gly
65 70 75 80
Val Pro Ala Arg Phe Ser Gly Ser Gly Ser Gly Thr Ser Tyr Ser Leu
85 90 95
Thr Ile Ser Ser Met Glu Ala Glu Asp Ala Ala Thr Tyr Tyr Cys His
100 105 110
Gln Tyr Arg Arg Pro Pro Arg Thr Phe Gly Gly Gly Thr Lys Leu Glu
115 120 125
Ile Lys Arg Ala Asp Ala Ala Pro Thr Val Ser Ile Phe Pro Pro Ser
130 135 140
Ser Glu Gln Leu Thr Ser Gly Gly Ala Ser Val Val Cys Phe Leu Asn
145 150 155 160
Asn Phe Tyr Pro Arg
165
<210> 64
<211> 152
<212> PRT
<213> 人工序列
<220>
<223> 抗体序列
<400> 64
Met Asp Phe Gly Leu Ser Trp Val Phe Phe Val Val Phe Tyr Gln Gly
1 5 10 15
Val His Cys Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln
20 25 30
Pro Lys Gly Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe
35 40 45
Asn Thr Tyr Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu
50 55 60
Glu Trp Val Ala Arg Ile Arg Ser Lys Ser Asn Asn Tyr Ala Thr Tyr
65 70 75 80
Tyr Ala Asp Ser Val Lys Asp Arg Phe Thr Ile Ser Arg Asp Asp Ser
85 90 95
Gln Ser Met Leu Tyr Leu Gln Met Asn Asn Leu Lys Thr Glu Asp Thr
100 105 110
Ala Met Tyr Tyr Cys Val Arg His Gly Glu Tyr Gly Asn Pro Trp Phe
115 120 125
Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ala Glu Ser Gln
130 135 140
Ser Phe Pro Asn Val Phe Pro Leu
145 150
<210> 65
<211> 166
<212> PRT
<213> 人工序列
<220>
<223> 抗体序列
<400> 65
Met Lys Leu Pro Val Arg Leu Leu Val Leu Met Phe Trp Ile Pro Ala
1 5 10 15
Ser Ser Ser Asp Val Val Met Thr Gln Thr Pro Leu Ser Leu Pro Val
20 25 30
Ser Leu Gly Asp Gln Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu
35 40 45
Val His Ser Asn Gly Asn Thr Tyr Leu His Trp Tyr Leu Gln Lys Pro
50 55 60
Gly Gln Ser Pro Lys Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser
65 70 75 80
Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr
85 90 95
Leu Lys Ile Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Phe Cys
100 105 110
Ser Gln Ser Thr His Val Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu
115 120 125
Glu Ile Lys Arg Ala Asp Ala Ala Pro Thr Val Ser Ile Phe Pro Pro
130 135 140
Ser Ser Glu Gln Leu Thr Ser Gly Gly Ala Ser Val Val Cys Phe Leu
145 150 155 160
Asn Asn Phe Tyr Pro Lys
165
<210> 66
<211> 8
<212> PRT
<213> 人工序列
<220>
<223> 抗体序列
<400> 66
Gly Tyr Thr Phe Thr Glu Tyr Thr
1 5
<210> 67
<211> 8
<212> PRT
<213> 人工序列
<220>
<223> 抗体序列
<400> 67
Ile Asn Pro Asn Asn Gly Gly Thr
1 5
<210> 68
<211> 8
<212> PRT
<213> 人工序列
<220>
<223> 抗体序列
<400> 68
Ala Ser Leu Asp Gly Arg Asp Tyr
1 5
<210> 69
<211> 12
<212> PRT
<213> 人工序列
<220>
<223> 抗体序列
<400> 69
Gln Ser Leu Leu Asn Ser Arg Thr Arg Lys Asn Tyr
1 5 10
<210> 70
<211> 4
<212> PRT
<213> 人工序列
<220>
<223> 抗体序列
<220>
<221> misc_feature
<222> (4)..(4)
<223> Xaa 可以是任何天然存在的氨基酸
<400> 70
Trp Ala Ser Xaa
1
<210> 71
<211> 8
<212> PRT
<213> 人工序列
<220>
<223> 抗体序列
<400> 71
Lys Gln Ser Tyr Asn Leu Leu Thr
1 5
<210> 72
<211> 8
<212> PRT
<213> 人工序列
<220>
<223> 抗体序列
<400> 72
Gly Phe Thr Phe Asn Thr Tyr Ala
1 5
<210> 73
<211> 10
<212> PRT
<213> 人工序列
<220>
<223> 抗体序列
<400> 73
Ile Arg Ser Lys Ser Asn Asn Tyr Ala Thr
1 5 10
<210> 74
<211> 13
<212> PRT
<213> 人工序列
<220>
<223> 抗体序列
<400> 74
Val Arg His Gly Glu Tyr Gly Asn Pro Trp Phe Ala Tyr
1 5 10
<210> 75
<211> 11
<212> PRT
<213> 人工序列
<220>
<223> 抗体序列
<400> 75
Gln Ser Leu Val His Ser Asn Gly Asn Thr Tyr
1 5 10
<210> 76
<211> 4
<212> PRT
<213> 人工序列
<220>
<223> 抗体序列
<220>
<221> misc_feature
<222> (4)..(4)
<223> Xaa 可以是任何天然存在的氨基酸
<400> 76
Lys Val Ser Xaa
1
<210> 77
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 抗体序列
<400> 77
Ser Gln Ser Thr His Val Pro Tyr Thr
1 5
<210> 78
<211> 5
<212> PRT
<213> 人工序列
<220>
<223> 核心表位
<400> 78
Leu Leu Pro Gln Pro
1 5
<210> 79
<211> 7
<212> PRT
<213> 人工序列
<220>
<223> 核心表位
<400> 79
Pro Pro Gln Ala Gln Pro Leu
1 5
<210> 80
<211> 6
<212> PRT
<213> 人工序列
<220>
<223> 核心表位
<400> 80
Pro Pro Gln Ala Gln Pro
1 5
<210> 81
<211> 4
<212> PRT
<213> 人工序列
<220>
<223> 核心表位
<400> 81
Gln Pro Leu Leu
1
<210> 82
<211> 7
<212> PRT
<213> 人工序列
<220>
<223> 核心表位
<400> 82
Pro Gln Ala Gln Pro Leu Leu
1 5
<210> 83
<211> 8
<212> PRT
<213> 人工序列
<220>
<223> 核心表位
<400> 83
Gln Tyr Leu Gly Leu Gln Ile Gly
1 5
<210> 84
<211> 7
<212> PRT
<213> 人工序列
<220>
<223> 核心表位
<400> 84
Tyr Leu Gly Leu Gln Ile Gly
1 5
<210> 85
<211> 10
<212> PRT
<213> 人工序列
<220>
<223> 核心表位
<400> 85
Asp Asn Gln Tyr Leu Gly Leu Gln Ile Gly
1 5 10
<210> 86
<211> 7
<212> PRT
<213> 人工序列
<220>
<223> 核心表位
<400> 86
Asp Asn Gln Tyr Leu Gly Leu
1 5
<210> 87
<211> 7
<212> PRT
<213> 人工序列
<220>
<223> 核心表位
<400> 87
Tyr Leu Gly Leu Gln Ile Gly
1 5
<210> 88
<211> 10
<212> PRT
<213> 人工序列
<220>
<223> 免疫原性肽
<400> 88
Asp Asn Gln Tyr Leu Gly Leu Gln Ile Cys
1 5 10
<210> 89
<211> 11
<212> PRT
<213> 人工序列
<220>
<223> 免疫原性肽
<400> 89
Thr Asp Asn Gln Tyr Leu Gly Leu Gln Ile Cys
1 5 10
<210> 90
<211> 12
<212> PRT
<213> 人工序列
<220>
<223> 免疫原性肽
<400> 90
Thr Asp Asn Gln Tyr Leu Gly Leu Gln Ile Gly Cys
1 5 10
<210> 91
<211> 14
<212> PRT
<213> 人工序列
<220>
<223> 免疫原性肽
<400> 91
Lys Thr Asp Asn Gln Tyr Leu Gly Leu Gln Ile Gly Lys Cys
1 5 10
<210> 92
<211> 15
<212> PRT
<213> 人工序列
<220>
<223> 免疫原性肽
<400> 92
Gly Thr Asp Asn Gln Tyr Leu Gly Leu Gln Ile Gly Lys Lys Cys
1 5 10 15
<210> 93
<211> 15
<212> PRT
<213> 人工序列
<220>
<223> 免疫原性肽
<400> 93
Lys Thr Asp Asn Gln Tyr Leu Gly Leu Gln Ile Lys Lys Gly Cys
1 5 10 15
<210> 94
<211> 14
<212> PRT
<213> 人工序列
<220>
<223> 免疫原性肽
<400> 94
Lys Asp Asn Gln Tyr Leu Gly Leu Gln Ile Lys Lys Gly Cys
1 5 10
<210> 95
<211> 109
<212> PRT
<213> 人工序列
<220>
<223> 人源化的抗体序列
<400> 95
Glu Ile Val Leu Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Thr Ala Ser Ser Ser Val Thr Ser Ser
20 25 30
Tyr Leu His Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Ser Thr Ser Asn Leu Ala Ser Gly Val Pro Ser Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Leu Gln
65 70 75 80
Pro Glu Asp Ile Ala Thr Tyr Tyr Cys His Gln Tyr Arg Arg Pro Pro
85 90 95
Arg Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg
100 105
<210> 96
<211> 117
<212> PRT
<213> 人工序列
<220>
<223> 人源化的抗体序列
<400> 96
Glu Val Gln Leu Val Glu Ser Gly Pro Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Thr Val Lys Ile Ser Cys Lys Val Ser Gly Tyr Thr Phe Thr Asp Phe
20 25 30
Tyr Met Lys Trp Val Gln Gln Ala Pro Gly Arg Gly Leu Glu Trp Met
35 40 45
Gly Asp Ile Asp Pro Lys Asn Gly Asp Thr Phe Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Arg Val Thr Met Thr Ala Asp Thr Ser Thr Gly Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Thr Ala Val Tyr Phe Cys
85 90 95
Ala Ser Tyr Tyr Gly Tyr Thr Met Asp Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Val Thr Val Ala Ser
115
<210> 97
<211> 112
<212> PRT
<213> 人工序列
<220>
<223> 人源化的抗体序列
<400> 97
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Lys Ser Ser Gln Ser Leu Leu Asn Ser
20 25 30
Arg Thr Arg Lys Asn Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Lys Gln
85 90 95
Ser Tyr Asn Leu Leu Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 98
<211> 115
<212> PRT
<213> 人工序列
<220>
<223> 人源化的抗体序列
<400> 98
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Glu Tyr
20 25 30
Thr Met His Trp Val Arg Gln Ala Pro Gly Arg Gly Leu Glu Trp Met
35 40 45
Gly Gly Ile Asn Pro Asn Asn Gly Gly Thr Arg Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Arg Val Thr Met Thr Arg Asp Thr Ser Ile Arg Thr Ala Tyr
65 70 75 80
Val Glu Leu Ser Arg Leu Thr Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ser Leu Asp Gly Arg Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr
100 105 110
Val Ser Ser
115
- 还没有人留言评论。精彩留言会获得点赞!