与胎儿绒毛外滋养层细胞测定有关的方法和组合物与流程
相关申请的引用
本申请要求于2014年10月10日提交的美国临时专利申请序列号62/062,433的优先权,所述临时专利申请的全部内容以引用的方式纳入本文。
本公开内容总体上涉及经分离的胎儿绒毛外滋养层细胞以及遗传变异和病理状况的产前检测和诊断的测定方法。根据本公开内容的具体方面,本文记载了分离和测定来自妊娠中胎儿的胎儿绒毛外滋养层细胞的rna的方法,以及来自妊娠中胎儿的胎儿绒毛外滋养层细胞的蛋白的质谱测定方法。
背景技术:
遗传变异和病理状况的产前检测和诊断适用于监测并维持母亲和胎儿的健康和幸福。缺少无创性方法用于获得并测定通常数量较少的胎儿细胞。持续需要这样的测定,其向临床医生警示妊娠中的异常状况,例如唐氏综合征和其他染色体数目疾病、遗传病的诊断以及将发展先兆子痫或子宫内生长受限的妊娠中的胎儿的病理状况。
技术实现要素:
根据本发明的方面,测定来自胎儿绒毛外滋养层细胞的rna的方法包括:从妊娠受试者获得母体子宫颈内样品;从所述母体子宫颈内样品中移除胎儿绒毛外滋养层细胞;通过用醛固定剂处理来固定胎儿绒毛外滋养层细胞,产生醛固定的胎儿绒毛外滋养层细胞;清洗所述醛固定的胎儿绒毛外滋养层细胞以促使除去由醛固定剂引入的交联,产生经清洗的胎儿绒毛外滋养层细胞;从所述经清洗的胎儿绒毛外滋养层细胞中提取胎儿绒毛外滋养层细胞rna;以及测定所述胎儿绒毛外滋养层细胞rna以确定所述胎儿绒毛外滋养层细胞rna的一个或更多个特征。
根据本发明的方面,测定来自胎儿绒毛外滋养层细胞的rna的方法包括:从妊娠受试者获得母体子宫颈内样品;从所述母体子宫颈内样品中移除胎儿绒毛外滋养层细胞,产生经分离的胎儿绒毛外滋养层细胞;通过用醛固定剂处理来固定经分离的胎儿绒毛外滋养层细胞,产生醛固定的经分离的胎儿绒毛外滋养层细胞;裂解所述醛固定的经分离的胎儿绒毛外滋养层细胞,产生裂解物;清洗所述裂解物以促使除去由醛固定剂引入的交联,产生经清洗的裂解物;从所述经清洗的裂解物中提取胎儿绒毛外滋养层细胞rna;以及测定所述胎儿绒毛外滋养层细胞rna以确定所述胎儿绒毛外滋养层细胞rna的一个或更多个特征。
根据本发明的方面,测定来自胎儿绒毛外滋养层细胞的rna的方法包括:从妊娠受试者获得母体子宫颈内样品;从所述母体子宫颈内样品中移除胎儿绒毛外滋养层细胞;通过用醛固定剂处理来固定胎儿绒毛外滋养层细胞,产生醛固定的胎儿绒毛外滋养层细胞,其中所述用醛固定剂处理在从母体子宫颈内样品中移除胎儿绒毛外滋养层细胞之前和/或之后进行;清洗所述醛固定的胎儿绒毛外滋养层细胞以促使除去由醛固定剂引入的交联,产生经清洗的胎儿绒毛外滋养层细胞;从所述经清洗的胎儿绒毛外滋养层细胞中提取胎儿绒毛外滋养层细胞rna;以及测定所述胎儿绒毛外滋养层细胞rna以确定所述胎儿绒毛外滋养层细胞rna的一个或更多个特征。
根据本发明的方面,测定来自胎儿绒毛外滋养层细胞的rna的方法包括:从妊娠受试者获得母体子宫颈内样品;从所述母体子宫颈内样品中移除胎儿绒毛外滋养层细胞,产生经分离的胎儿绒毛外滋养层细胞;通过用醛固定剂处理来固定胎儿绒毛外滋养层细胞,产生醛固定的胎儿绒毛外滋养层细胞,其中所述用醛固定剂处理在从母体子宫颈内样品中移除胎儿绒毛外滋养层细胞之前和/或之后进行;在醛固定之后裂解经分离的胎儿绒毛外滋养层细胞,产生裂解物,清洗所述裂解物以促使除去由醛固定剂引入的交联,产生经清洗的裂解物;从所述经清洗的裂解物中提取胎儿绒毛外滋养层细胞rna;以及测定所述胎儿绒毛外滋养层细胞rna以确定所述胎儿绒毛外滋养层细胞rna的一个或更多个特征。
根据本发明的方面,测定来自胎儿绒毛外滋养层细胞的rna的方法包括:从妊娠受试者获得母体子宫颈内样品;从所述母体子宫颈内样品中移除胎儿绒毛外滋养层细胞,产生经分离的胎儿绒毛外滋养层细胞;通过用醛固定剂处理来固定胎儿绒毛外滋养层细胞,产生醛固定的胎儿绒毛外滋养层细胞,其中在从妊娠受试者获得样品之后立即将母体子宫颈内样品在醇固定剂中固定,并且该在醇固定剂中的固定在通过用醛固定剂处理来固定胎儿绒毛外滋养层细胞产生醛固定的胎儿绒毛外滋养层细胞之前进行,并且其中所述用醛固定剂处理在从母体子宫颈内样品中分离出胎儿绒毛外滋养层细胞之前和/或之后进行;清洗所述醛固定的胎儿绒毛外滋养层细胞以促使除去由醛固定剂引入的交联,产生经清洗的胎儿绒毛外滋养层细胞;从所述经清洗的胎儿绒毛外滋养层细胞中提取胎儿绒毛外滋养层细胞rna;以及测定所述胎儿绒毛外滋养层细胞rna以确定所述胎儿绒毛外滋养层细胞rna的一个或更多个特征。
根据本发明的方面,测定来自胎儿绒毛外滋养层细胞的rna的方法包括:从妊娠受试者获得母体子宫颈内样品;从所述母体子宫颈内样品中移除胎儿绒毛外滋养层细胞;通过用醛固定剂处理来固定胎儿绒毛外滋养层细胞,产生醛固定的胎儿绒毛外滋养层细胞,其中在从妊娠受试者获得样品之后立即将母体子宫颈内样品在醇固定剂中固定,并且该在醇固定剂中的固定在通过用醛固定剂处理来固定胎儿绒毛外滋养层细胞产生醛固定的胎儿绒毛外滋养层细胞之前进行,并且其中所述用醛固定剂处理在从母体子宫颈内样品中分离出胎儿绒毛外滋养层细胞之前和/或之后进行;在醛固定之后裂解经分离的胎儿绒毛外滋养层细胞,产生裂解物,清洗所述裂解物以促使除去由醛固定剂引入的交联,产生经清洗的裂解物;从所述经清洗的裂解物中提取胎儿绒毛外滋养层细胞rna;以及测定所述胎儿绒毛外滋养层细胞rna以确定所述胎儿绒毛外滋养层细胞rna的一个或更多个特征。
根据本发明的方面,测定来自胎儿绒毛外滋养层细胞的rna的方法包括:从妊娠受试者获得母体子宫颈内样品;从所述母体子宫颈内样品中移除胎儿绒毛外滋养层细胞;通过用醛固定剂处理来固定胎儿绒毛外滋养层细胞,产生醛固定的胎儿绒毛外滋养层细胞,其中在从妊娠受试者获得样品之后立即将母体子宫颈内样品在醇固定剂中固定,并且该在醇固定剂中的固定在通过用醛固定剂处理来固定胎儿绒毛外滋养层细胞产生醛固定的胎儿绒毛外滋养层细胞之前进行;清洗所述醛固定的胎儿绒毛外滋养层细胞以促使除去由醛固定剂引入的交联,产生经清洗的胎儿绒毛外滋养层细胞;从所述经清洗的胎儿绒毛外滋养层细胞中提取胎儿绒毛外滋养层细胞rna;以及测定所述胎儿绒毛外滋养层细胞rna以确定所述胎儿绒毛外滋养层细胞rna的一个或更多个特征。
根据本发明的方面,测定来自胎儿绒毛外滋养层细胞的rna的方法包括:从妊娠受试者获得母体子宫颈内样品;从所述母体子宫颈内样品中移除胎儿绒毛外滋养层细胞,产生经分离的胎儿绒毛外滋养层细胞;通过用醛固定剂处理来固定胎儿绒毛外滋养层细胞,产生醛固定的胎儿绒毛外滋养层细胞,其中在从妊娠受试者获得样品之后立即将母体子宫颈内样品在醇固定剂中固定,并且该在醇固定剂中的固定在通过用醛固定剂处理来固定胎儿绒毛外滋养层细胞产生醛固定的胎儿绒毛外滋养层细胞之前进行;在醛固定之后裂解经分离的胎儿绒毛外滋养层细胞,产生裂解物,清洗所述裂解物以促使除去由醛固定剂引入的交联,产生经清洗的裂解物;从所述经清洗的裂解物中提取胎儿绒毛外滋养层细胞rna;以及测定所述胎儿绒毛外滋养层细胞rna以确定所述胎儿绒毛外滋养层细胞rna的一个或更多个特征。
根据本发明的方面,测定来自胎儿绒毛外滋养层细胞的rna的方法包括:从妊娠受试者获得母体子宫颈内样品;在从妊娠受试者获得样品之后立即将所述母体子宫颈内样品中的细胞在醛固定剂中固定;从所述母体子宫颈内样品中移除胎儿绒毛外滋养层细胞;清洗所述醛固定的胎儿绒毛外滋养层细胞以促使除去由醛固定剂引入的交联,产生经清洗的胎儿绒毛外滋养层细胞;从所述经清洗的胎儿绒毛外滋养层细胞中提取胎儿绒毛外滋养层细胞rna;以及测定所述胎儿绒毛外滋养层细胞rna以确定所述胎儿绒毛外滋养层细胞rna的一个或更多个特征。
根据本发明的方面,测定来自胎儿绒毛外滋养层细胞的rna的方法包括:从妊娠受试者获得母体子宫颈内样品;在从妊娠受试者获得样品之后立即将所述母体子宫颈内样品中的细胞在醛固定剂中固定;从所述母体子宫颈内样品中移除胎儿绒毛外滋养层细胞;在醛固定之后裂解经分离的胎儿绒毛外滋养层细胞,产生裂解物,清洗所述裂解物以促使除去由醛固定剂引入的交联,产生经清洗的裂解物;从所述经清洗的裂解物中提取胎儿绒毛外滋养层细胞rna;以及测定所述胎儿绒毛外滋养层细胞rna以确定所述胎儿绒毛外滋养层细胞rna的一个或更多个特征。
根据本发明的方面,测定来自胎儿绒毛外滋养层细胞的rna的方法包括:从妊娠人受试者获得母体子宫颈内样品;从所述母体子宫颈内样品中移除胎儿绒毛外滋养层细胞;通过用醛固定剂处理来固定胎儿绒毛外滋养层细胞,产生醛固定的胎儿绒毛外滋养层细胞;清洗所述醛固定的胎儿绒毛外滋养层细胞以促使除去由醛固定剂引入的交联,产生经清洗的胎儿绒毛外滋养层细胞;从所述经清洗的胎儿绒毛外滋养层细胞中提取胎儿绒毛外滋养层细胞rna;以及测定所述胎儿绒毛外滋养层细胞rna以确定所述胎儿绒毛外滋养层细胞rna的一个或更多个特征。
根据本发明的方面,测定来自胎儿绒毛外滋养层细胞的rna的方法包括:从妊娠人受试者获得母体子宫颈内样品;从所述母体子宫颈内样品中移除胎儿绒毛外滋养层细胞;通过用醛固定剂处理来固定胎儿绒毛外滋养层细胞,产生醛固定的胎儿绒毛外滋养层细胞;在醛固定之后裂解经分离的胎儿绒毛外滋养层细胞,产生裂解物,清洗所述裂解物以促使除去由醛固定剂引入的交联,产生经清洗的裂解物;从所述经清洗的裂解物中提取胎儿绒毛外滋养层细胞rna;以及测定所述胎儿绒毛外滋养层细胞rna以确定所述胎儿绒毛外滋养层细胞rna的一个或更多个特征。
根据本发明的方面,测定来自胎儿绒毛外滋养层细胞的rna的方法包括:从妊娠人受试者获得母体子宫颈内样品;从所述母体子宫颈内样品中移除胎儿绒毛外滋养层细胞;通过用醛固定剂处理来固定胎儿绒毛外滋养层细胞,产生醛固定的胎儿绒毛外滋养层细胞,其中所述用醛固定剂处理在从母体子宫颈内样品中分离胎儿绒毛外滋养层细胞之前和/或之后进行;清洗所述醛固定的胎儿绒毛外滋养层细胞以促使除去由醛固定剂引入的交联,产生经清洗的胎儿绒毛外滋养层细胞;从所述经清洗的胎儿绒毛外滋养层细胞中提取胎儿绒毛外滋养层细胞rna;以及测定所述胎儿绒毛外滋养层细胞rna以确定所述胎儿绒毛外滋养层细胞rna的一个或更多个特征。
根据本发明的方面,测定来自胎儿绒毛外滋养层细胞的rna的方法包括:从妊娠人受试者获得母体子宫颈内样品;从所述母体子宫颈内样品中移除胎儿绒毛外滋养层细胞;通过用醛固定剂处理来固定胎儿绒毛外滋养层细胞,产生醛固定的胎儿绒毛外滋养层细胞,其中所述用醛固定剂处理在从母体子宫颈内样品中分离胎儿绒毛外滋养层细胞之前和/或之后进行;在醛固定之后裂解经分离的胎儿绒毛外滋养层细胞,产生裂解物,清洗所述裂解物以促使除去由醛固定剂引入的交联,产生经清洗的裂解物;从所述经清洗的裂解物中提取胎儿绒毛外滋养层细胞rna;以及测定所述胎儿绒毛外滋养层细胞rna以确定所述胎儿绒毛外滋养层细胞rna的一个或更多个特征。
根据本发明的方面,测定来自胎儿绒毛外滋养层细胞的rna的方法包括:从妊娠人受试者获得母体子宫颈内样品;从所述母体子宫颈内样品中移除胎儿绒毛外滋养层细胞;通过用醛固定剂处理来固定胎儿绒毛外滋养层细胞,产生醛固定的胎儿绒毛外滋养层细胞,其中在从妊娠受试者获得样品之后立即将母体子宫颈内样品在醇固定剂中固定,并且该在醇固定剂中的固定在通过用醛固定剂处理来固定胎儿绒毛外滋养层细胞产生醛固定的胎儿绒毛外滋养层细胞之前进行,并且其中所述用醛固定剂处理在从母体子宫颈内样品中分离胎儿绒毛外滋养层细胞之前和/或之后进行;清洗所述醛固定的胎儿绒毛外滋养层细胞以促使除去由醛固定剂引入的交联,产生经清洗的胎儿绒毛外滋养层细胞;从所述经清洗的胎儿绒毛外滋养层细胞中提取胎儿绒毛外滋养层细胞rna;以及测定所述胎儿绒毛外滋养层细胞rna以确定所述胎儿绒毛外滋养层细胞rna的一个或更多个特征。
根据本发明的方面,测定来自胎儿绒毛外滋养层细胞的rna的方法包括:从妊娠人受试者获得母体子宫颈内样品;从所述母体子宫颈内样品中移除胎儿绒毛外滋养层细胞;通过用醛固定剂处理来固定胎儿绒毛外滋养层细胞,产生醛固定的胎儿绒毛外滋养层细胞,其中在从妊娠受试者获得样品之后立即将母体子宫颈内样品在醇固定剂中固定,并且该在醇固定剂中的固定在通过用醛固定剂处理来固定胎儿绒毛外滋养层细胞产生醛固定的胎儿绒毛外滋养层细胞之前进行,并且其中所述用醛固定剂处理在从母体子宫颈内样品中分离胎儿绒毛外滋养层细胞之前和/或之后进行;清洗所述醛固定的胎儿绒毛外滋养层细胞以促使除去由醛固定剂引入的交联,产生;在醛固定之后裂解经分离的胎儿绒毛外滋养层细胞,产生裂解物,清洗所述裂解物以促使除去由醛固定剂引入的交联,产生经清洗的裂解物;从所述经清洗的裂解物中提取胎儿绒毛外滋养层细胞rna;以及测定所述胎儿绒毛外滋养层细胞rna以确定所述胎儿绒毛外滋养层细胞rna的一个或更多个特征。
根据本发明的方面,测定来自胎儿绒毛外滋养层细胞的rna的方法包括:从妊娠人受试者获得母体子宫颈内样品;从所述母体子宫颈内样品中移除胎儿绒毛外滋养层细胞;通过用醛固定剂处理来固定胎儿绒毛外滋养层细胞,产生醛固定的胎儿绒毛外滋养层细胞,其中在从妊娠受试者获得样品之后立即将母体子宫颈内样品在醇固定剂中固定,并且该在醇固定剂中的固定在通过用醛固定剂处理来固定胎儿绒毛外滋养层细胞产生醛固定的胎儿绒毛外滋养层细胞之前进行;清洗所述醛固定的胎儿绒毛外滋养层细胞以促使除去由醛固定剂引入的交联,产生经清洗的胎儿绒毛外滋养层细胞;从所述经清洗的胎儿绒毛外滋养层细胞中提取胎儿绒毛外滋养层细胞rna;以及测定所述胎儿绒毛外滋养层细胞rna以确定所述胎儿绒毛外滋养层细胞rna的一个或更多个特征。
根据本发明的方面,测定来自胎儿绒毛外滋养层细胞的rna的方法包括:从妊娠人受试者获得母体子宫颈内样品;从所述母体子宫颈内样品中移除胎儿绒毛外滋养层细胞;通过用醛固定剂处理来固定胎儿绒毛外滋养层细胞,产生醛固定的胎儿绒毛外滋养层细胞,其中在从妊娠受试者获得样品之后立即将母体子宫颈内样品在醇固定剂中固定,并且该在醇固定剂中的固定在通过用醛固定剂处理来固定胎儿绒毛外滋养层细胞产生醛固定的胎儿绒毛外滋养层细胞之前进行;在醛固定之后裂解经分离的胎儿绒毛外滋养层细胞,产生裂解物,清洗所述裂解物以促使除去由醛固定剂引入的交联,产生经清洗的裂解物;从所述经清洗的裂解物中提取胎儿绒毛外滋养层细胞rna;以及测定所述胎儿绒毛外滋养层细胞rna以确定所述胎儿绒毛外滋养层细胞rna的一个或更多个特征。
根据本发明的方面,测定来自胎儿绒毛外滋养层细胞的rna的方法包括:从妊娠人受试者获得母体子宫颈内样品;在从妊娠受试者获得样品之后立即将母体子宫颈内样品中的细胞在醛固定剂中固定;从所述母体子宫颈内样品中移除胎儿绒毛外滋养层细胞;清洗所述醛固定的胎儿绒毛外滋养层细胞以促使除去由醛固定剂引入的交联,产生经清洗的胎儿绒毛外滋养层细胞;从所述经清洗的胎儿绒毛外滋养层细胞中提取胎儿绒毛外滋养层细胞rna;以及测定所述胎儿绒毛外滋养层细胞rna以确定所述胎儿绒毛外滋养层细胞rna的一个或更多个特征。
根据本发明的方面,测定来自胎儿绒毛外滋养层细胞的rna的方法包括:从妊娠人受试者获得母体子宫颈内样品;在从妊娠受试者获得样品之后立即将母体子宫颈内样品中的细胞在醛固定剂中固定;从所述母体子宫颈内样品中移除胎儿绒毛外滋养层细胞;在醛固定之后裂解经分离的胎儿绒毛外滋养层细胞,产生裂解物,清洗所述裂解物以促使除去由醛固定剂引入的交联,产生经清洗的裂解物;从所述经清洗的裂解物中提取胎儿绒毛外滋养层细胞rna;以及测定所述胎儿绒毛外滋养层细胞rna以确定所述胎儿绒毛外滋养层细胞rna的一个或更多个特征。
根据本发明的方面,测定来自胎儿绒毛外滋养层细胞的rna的方法包括通过测序、pcr、定量pcr、实时pcr或其任意两种或更多种的组合来测定胎儿绒毛外滋养层细胞rna。
根据本发明的方面,包括从母体子宫颈内样品中移除胎儿绒毛外滋养层细胞的测定来自胎儿绒毛外滋养层细胞的rna的方法,其包括使胎儿绒毛外滋养层细胞与特异地针对胎儿绒毛外滋养层细胞的抗体接触,其中所述抗体不与母体子宫颈内样品中的母体细胞结合。
根据本发明的方面,包括从母体子宫颈内样品中移除胎儿绒毛外滋养层细胞的测定来自胎儿绒毛外滋养层细胞的rna的方法,其包括使胎儿绒毛外滋养层细胞与特异地针对胎儿绒毛外滋养层细胞的抗体接触,其中所述抗体不与母体子宫颈内样品中的母体细胞结合,并且其中所述特异地针对胎儿绒毛外滋养层细胞的抗体连接于支持体(support)。
根据本发明的方面,记载了测定来自胎儿绒毛外滋养层细胞的rna的方法,其中没有蛋白a或蛋白g连接于支持体。
根据本发明的方面,包括从母体子宫颈内样品中移除胎儿绒毛外滋养层细胞的测定来自胎儿绒毛外滋养层细胞的rna的方法,其包括使胎儿绒毛外滋养层细胞与特异地针对胎儿绒毛外滋养层细胞的抗体接触,其中所述抗体不与母体子宫颈内样品中的母体细胞结合,并且其中所述特异地针对胎儿绒毛外滋养层细胞的抗体连接于支持体,其中所述支持体为多个磁性颗粒,并且从母体子宫颈内样品中移除胎儿绒毛外滋养层细胞的步骤包括将所述磁性颗粒暴露于磁体。
根据本发明的方面,记载了测定来自胎儿绒毛外滋养层细胞的rna的方法,其中未用溶粘蛋白剂处理所述母体子宫颈内样品。
根据本发明的方面,测定胎儿绒毛外滋养层细胞的方法包括从妊娠受试者获得母体子宫颈内样品;使所述母体子宫颈内样品与第一抗体接触,所述第一抗体特异地针对胎儿绒毛外滋养层细胞,其中所述第一抗体不与母体子宫颈内样品中的母体细胞结合;使所述母体子宫颈内样品与一种或更多种另外的抗体接触,其中采用不同的标签可区分地标记所述第一抗体和每种另外的抗体,所述不同的标签可通过电感耦合等离子体质谱检测;将所述母体子宫颈内样品喷成雾状以分离细胞;以及对细胞进行电感耦合等离子体质谱,从而测定胎儿绒毛外滋养层细胞。
根据本发明的方面,测定胎儿绒毛外滋养层细胞的方法包括从妊娠受试者获得母体子宫颈内样品;使所述母体子宫颈内样品与第一抗体接触,所述第一抗体特异地针对胎儿绒毛外滋养层细胞,其中所述第一抗体特异地针对主要组织相容性复合物i类g(hla-g);使所述母体子宫颈内样品与一种或更多种另外的抗体接触,其中采用不同的标签可区分地标记所述第一抗体和每种另外的抗体,所述不同的标标签可通过电感耦合等离子体质谱检测;将所述母体子宫颈内样品喷成雾状以分离细胞;以及对细胞进行电感耦合等离子体质谱,从而测定胎儿绒毛外滋养层细胞。
根据本发明的方面,测定胎儿绒毛外滋养层细胞的方法包括从妊娠受试者获得母体子宫颈内样品;使所述母体子宫颈内样品与第一抗体接触,所述第一抗体特异地针对胎儿绒毛外滋养层细胞,其中所述第一抗体不与母体子宫颈内样品中的母体细胞结合;使所述母体子宫颈内样品与一种或更多种另外的抗体接触,其中所述一种或更多种另外的抗体是特异地针对选自以下的蛋白的抗体:半乳糖凝集素13、半乳糖凝集素14、胎盘生长因子、妊娠相关血浆蛋白a、甲胎蛋白、内皮因子(endoglin)、fms相关酪氨酸激酶1和角蛋白7,其中采用不同的标签可区分地标记所述第一抗体和每种另外的抗体,所述不同的标签可通过电感耦合等离子体质谱检测;将所述母体子宫颈内样品喷成雾状以分离细胞;以及对细胞进行电感耦合等离子体质谱,从而测定胎儿绒毛外滋养层细胞。
根据本发明的方面,测定胎儿绒毛外滋养层细胞的方法包括从妊娠受试者获得母体子宫颈内样品;使所述母体子宫颈内样品与第一抗体接触,所述第一抗体特异地针对胎儿绒毛外滋养层细胞,其中所述第一抗体特异地针对主要组织相容性复合物i类g(hla-g);使所述母体子宫颈内样品与一种或更多种另外的抗体接触,其中所述一种或更多种另外的抗体是特异地针对选自以下的蛋白的抗体:半乳糖凝集素13、半乳糖凝集素14、胎盘生长因子、妊娠相关血浆蛋白a、甲胎蛋白、内皮因子、fms相关酪氨酸激酶1和角蛋白7,其中采用不同的标签可区分地标记所述第一抗体和每种另外的抗体,所述不同的标签可通过电感耦合等离子体质谱检测;将所述母体子宫颈内样品喷成雾状以分离细胞;以及对细胞进行电感耦合等离子体质谱,从而测定胎儿绒毛外滋养层细胞。
根据本发明的方面,记载了测定胎儿绒毛外滋养层细胞和/或来自胎儿绒毛外滋养层细胞的rna的方法,其中未用溶粘蛋白剂处理所述母体子宫颈内样品。
根据本发明的方面,在妊娠中受孕后约3周(孕龄5周)直至妊娠约20周(妊娠中点)或更晚时采集样品。
附图说明
图1是表示来自19份母体子宫颈内样品的rna回收的图,从“粗制”的thinprep样品、经分离的胎儿绒毛外滋养层细胞(evt)或含有母体细胞但缺乏(depleted)胎儿绒毛外滋养层细胞的样品中分离的rna;
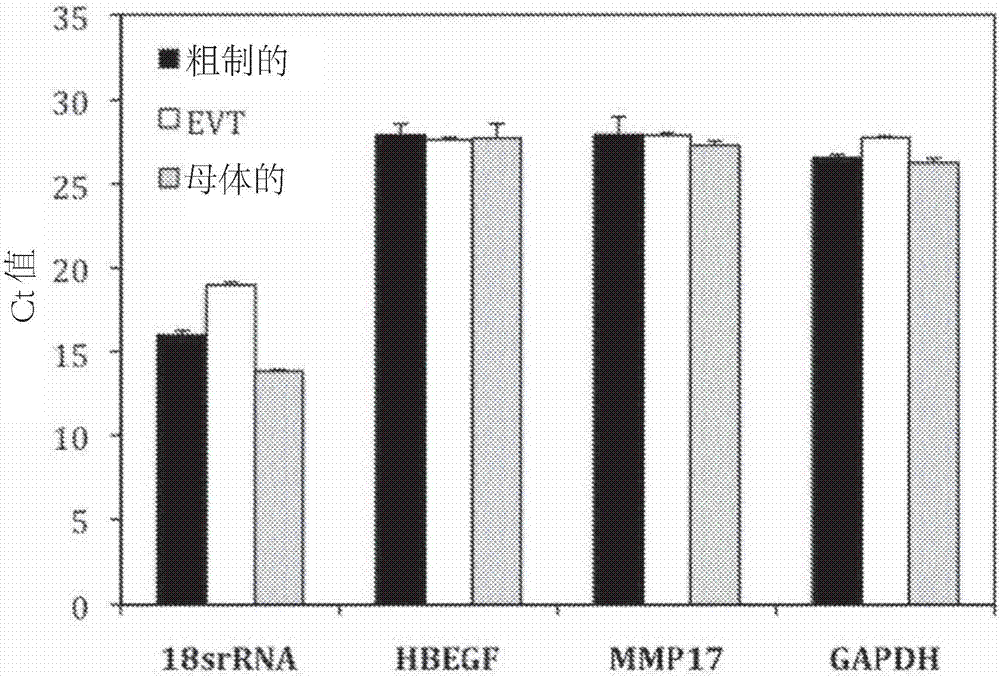
图2是表示来自粗制的thinprep样品、经分离的胎儿绒毛外滋养层细胞(evt)和缺乏胎儿绒毛外滋养层细胞的母体细胞(母体)的四种不同已知丰度的rna的定量pcr(qpcr)的ct值的图;
图3是凝胶图,其表示从来自单一母体子宫颈内样品的3份胎儿制品和3份母体制品中分离的rna的电泳结果;
图4a是表示两份母体样品中rna测序和rna表达水平的比较结果的图,其为“每100万比对的(mapped)读段(reads)中每1千碱基的转录产物的读段”(rpkm)数值,表明两份母体rna样品的相似性。
图4b是表示两份胎儿样品中rna测序和rna表达水平的比较结果的图,其为rpkm数值,表明两份胎儿rna样品的相似性;
图4c是表示胎儿和母体样品中rna测序和rna表达水平的比较结果的图,其为rpkm数值,表明胎儿和母体样品之间的差异;
图5a是表示在tmt10plex标记的hrt-8/svneo细胞的同步化前体选择(sps)分析中m/z829.01离子的ms2测序谱的图;
图5b是表示在tmt10plex标记的hrt-8/svneo细胞的同步化前体选择(sps)分析中,在中等分辨率下报告离子126至131的ms2测序谱的图;
图5c是表示tmt10plex标记的hrt-8/svneo细胞的同步化前体选择(sps)分析中,在高分辨率下报告离子126至131的ms2测序谱的图,其中从m/z126至m/z131的波道(channel)包含所示数目的hrt细胞;
图6是表示通过根据本发明的方面的方法而获得的胎儿绒毛外滋养层细胞中生物标记的表达的图;在箱线图中示出了中位荧光强度(rfu),其中水平线为中值,箱描绘出偏离中值的第一四分位数,条棒表示偏离中值的第二四分位数,以及离群值表示为点。根据wilcoxon符号秩检验,除krt7以外,每一对对照和不良妊娠是显著不同的;以及
图7是表示从子宫颈(tric)分离的绒毛外滋养层(evt)细胞的滋养层回收和分离中的生物标记表达的定量的图;使采用针对所示蛋白的抗体标记的evt细胞成像以获得相对荧光单位(rfu)值,如实施例中所述。使用非参数wilcoxon检验来比较对照组(白色)和早期流产(epl)组(黑色)之间各蛋白标记的表达;通过对照/epl对上方的条棒和星号来表示显著性差异(p<.05);箱=第25至第75百分位数;箱内水平线=中值;箱须(whisker)=1.5x四分位距(第三四分位数至第一四分位数);点代表单独的离群值。
具体实施方式
本文使用的科学和技术术语意欲具有本领域普通技术人员通常理解的含义。许多标准文献的文中定义和使用了这类术语,所述文献示例性地包括j.sambrookandd.w.russell,molecularcloning:alaboratorymanual,coldspringharborlaboratorypress;3rded.,2001;f.m.ausubel,ed.,shortprotocolsinmolecularbiology,currentprotocols;5thed.,2002;b.albertsetal.,molecularbiologyofthecell,4thed.,garland,2002;d.l.nelsonandm.m.cox,lehningerprinciplesofbiochemistry,4thed.,w.h.freeman&company,2004;engelke,d.r.,rnainterference(rnai):nutsandboltsofrnaitechnology,dnapressllc,eagleville,pa,2003;herdewijn,p.(ed.),oligonucleotidesynthesis:methodsandapplications,methodsinmolecularbiology,humanapress,2004;a.nagy,m.gertsenstein,k.vintersten,r.behringer,manipulatingthemouseembryo:alaboratorymanual,3rdedition,coldspringharborlaboratorypress;december15,2002,isbn-10:0879695919;kursadturksen(ed.),embryonicstemcells:methodsandprotocolsinmethodsmolbiol.2002;185,humanapress;currentprotocolsinstemcellbiology.isbn:9780470151808。
单数术语“一”、“一个”和“所述”不意欲进行限制并且包括复数指代对象,除非另外明确地说明或上下文另外清楚地指明。
根据本发明的方面,提供了与来自妊娠中的胎儿的胎儿细胞的分离和测定相关的组合物和方法。
胎儿细胞的分析提供了关于胎儿的信息,例如性别,并允许检测胎儿异常,包括染色体非整倍性以及妊娠相关疾病,包括先兆子痫、子宫内生长受限、自然流产和早产。
胎儿细胞的分析允许检测妊娠相关疾病(包括先兆子痫、子宫内生长受限、自然流产和早产)的生物标记。
本文所述的测定为任选地对胎儿绒毛外滋养层细胞表达的一种或更多种生物标记的测定,以检测指示异常胎盘功能(例如先兆子痫、子宫内生长受限、自然流产和早产)的改变。
尽管本文所述的组合物和方法特别地涉及人类女性和人类胎儿,但它们并不限于人类,其他物种的胎儿细胞可被类似地分离和分析。
分离胎儿绒毛外滋养层细胞的方法
根据本发明的方面,提供了分离胎儿绒毛外滋养层细胞的方法,其包括从妊娠受试者获得包含胎儿绒毛外滋养层细胞的母体子宫颈内样品;采用核酸酶处理所述胎儿绒毛外滋养层细胞;以及从所述母体子宫颈内样品中移除胎儿绒毛外滋养层细胞,从而分离所述胎儿绒毛外滋养层细胞。
从妊娠约1周至约45周(例如妊娠的第一个三个月、第二个三个月和/或第三个三个月)的孕妇收集母体子宫颈内样品。
根据本发明的方面,从妊娠受试者中在受孕后约3周(孕龄5周)直至妊娠约20周(妊娠中点)或更晚时采集样品。
使用任何有效裂解dna和/或rna的核酸酶来完成采用核酸酶对胎儿绒毛外滋养层细胞的处理。这类核酸酶包括内切核酸酶和外切核酸酶。可用于处理胎儿绒毛外滋养层细胞的核酸酶的非限制性实例包括脱氧核糖核酸酶(dnase),包括但不限于:dnasei,dnaseii,λ外切核酸酶,核酸酶bal-31,外切核糖核酸酶,大肠杆菌(e.coli)外切核酸酶i、ii、iii、iv、v、vi、vii和viii,限制性内切核酸酶例如aatii、acci、acui、afliii、agei、alei、alui、alwi、alw44i、apai、apoi、asci、asei、asni、avai、avaii、baei、bamhi、bani、banii、bcli、bgli、bglii、blni、blpi、bmri、bmti、bpmi、bsgi、bsmi、bsri、bsshii、bsteii、btgi、btsi、cfoi、clai、ddei、dpni、dpnii、drai、drdi、eaei、eagi、eari、ecii、eclxi、ecori、ecorii、ecorv、fati、faui、foki、fsei、haeii、haeii、hgai、hhai、hincii、hindiii、hpai、hpaii、kasi、kpn1、kspi、mboi、mboii、mfei、mlui、mluni、mlyi、mmei、mnli、msci、msei、mspi、mwoi、naei、nari、ncii、ncoi、ndei、ndeii、nhei、noti、nrui、nsii、nspi、paci、pcii、plei、pmei、pmli、psii、pspi、psti、pvui、pvuii、rsai、saci、sali、sapi、sbfi、sau3ai、scai、scrfi、sfci、sfii、sfoi、smai、smli、spei、sphi、sspi、stui、styi、swai、taqi、xbai、xhoixmai和xmni、大肠杆菌内切核酸酶i或ii、t7内切核酸酶、t4内切核酸酶、微球菌核酸酶、recbcd内切核酸酶、s1核酸酶、p1核酸酶和绿豆核酸酶。可用于处理胎儿绒毛外滋养层细胞的核酸酶的非限制性实例包括核糖核酸酶(rnase),包括内切核糖核酸酶和外切核糖核酸酶,例如rnasea、rnased、rnaseh、rnasel、rnasep、rnaseph、rnasephym、rnaser、rnaset1、rnaset2、rnaseu2、多聚核苷酸磷酸化酶、寡核糖核酸酶、外切核糖核酸酶i、外切核糖核酸酶ii、rnasei、rnaseii和rnaseiii。
任选地,采用两种或更多种核酸酶处理胎儿绒毛外滋养层细胞。
在核酸酶反应条件下,通常在生理ph和温度下的生理缓冲液中,进行胎儿绒毛外滋养层细胞的核酸酶处理。
根据本发明的方面,在不固定细胞的情况下、在固定细胞之前或固定细胞之后进行胎儿绒毛外滋养层细胞的核酸酶处理。
根据本发明的方面,在从母体子宫颈内样品中分离胎儿绒毛外滋养层细胞之前或在从母体子宫颈内样品中分离胎儿绒毛外滋养层细胞之后进行胎儿绒毛外滋养层细胞的核酸酶处理。应理解,在从母体子宫颈内样品中分离胎儿绒毛外滋养层细胞之前进行的胎儿绒毛外滋养层细胞的核酸酶处理也是采用核酸酶对母体子宫颈内样品的处理。
根据本发明的方面,在不固定样品的情况下、在固定样品之前或固定样品之后进行母体子宫颈内样品的核酸酶处理。
任选地,一种或更多种核酸酶连接于支持体,并且在核酸酶反应条件下,通过使胎儿绒毛外滋养层细胞与一种或更多种连接于支持体的核酸酶接触来采用一种或更多种核酸酶处理胎儿绒毛外滋养层细胞。调整支持体的大小以防止其进入胎儿绒毛外滋养层细胞和/或母体子宫颈内样品的母体细胞。在一个优选的选项中,采用一种或更多种连接于支持体的核酸酶处理的胎儿绒毛外滋养层细胞是固定的胎儿绒毛外滋养层细胞。
支持体是固体的或半固体的并且不溶于水溶液中。所述支持体可以为任何材料,例如玻璃、硅、硅胶、粘土、纸,合成或天然存在的聚合物,例如聚乙烯、聚酯、聚酰胺、聚氨基甲酸酯、聚环氧化物、聚苯乙烯、聚碳酸酯、聚丙烯、聚氯乙烯、聚乙烯乙酸酯、pvdf、聚甲基丙烯酸酯、尼龙、纤维素、纤维素酯、混合纤维素酯、纤维素醚、交联的海藻酸、取代和交联的瓜尔胶、琼脂、琼脂糖、凝胶、葡聚糖和聚丙烯酰胺,这类聚合物或可连接核酸酶的任何其他材料的混合物、共聚物和三元共聚物。
所使用的支持体可包含用于连接核酸酶的官能团,例如但不限于羧基、胺、氨基、羧化物、卤化物、酯、醇、脲、醛、氯甲基、氧化硫、氧化氮、环氧树脂和/或甲苯磺酰基官能团。通过多种方法中的任何一种(示例性地包括吸附和化学键合)来实现核酸酶与支持体的连接。在一个实施例中,1-乙基-3-[3-二甲基氨基丙基]碳二亚胺氢氯化物、edc或edac化学品可用于将核酸酶连接于支持体。核酸酶可直接或间接地与支持体材料键合,例如经由与布置在支持体上的包膜或接头键合。官能团、其修饰以及蛋白与支持体的连接是本领域已知的,例如记载于fitch,r.m,polymercolloids:acomprehensiveintroduction,academicpress,1997。
用于连接核酸酶的支持体可以为多种形式和形状中的任何一种,包括但不限于微滴定板、微滴定孔、针、纤维、珠、载片、硅芯片和膜,例如硝酸纤维素膜或pvdf膜。
任选地,将核酸酶连接于颗粒形式的支持体。这类支持体可以是多种形状和大小中任何一种的固体或半固体颗粒。颗粒示例性地为有机或无机颗粒,例如玻璃或金属,并且可以为合成或天然存在的聚合物颗粒,例如聚苯乙烯、聚碳酸酯、硅、尼龙、纤维素、琼脂糖、葡聚糖、聚丙烯酰胺,以及乳胶小珠(latexbead)。
支持体及所连接的核酸酶尺寸可阻止其进入固定的细胞,例如直径大于10nm的颗粒尺寸。
根据本发明的方面,通过使胎儿绒毛外滋养层细胞与特异地针对胎儿绒毛外滋养层细胞的抗体接触并捕获结合至所述抗体的胎儿绒毛外滋养层细胞,来实现从母体子宫颈内样品中移除胎儿绒毛外滋养层细胞,其中所述抗体不与母体子宫颈内样品中的母体细胞结合。
根据本发明的方法的特定方面,所述抗体特异地针对主要组织相容性复合物i类g(hla-g)。
任选地,将特异地针对胎儿绒毛外滋养层细胞的抗体连接于不溶于水溶液的任何固体或半固体,例如本文所描述的用于连接核酸酶的那些。通过多种方法中的任何一种实现抗体与支持体的连接,所述方法示例性地包括本文所描述的用于连接核酸酶的吸附和化学键合。
任选地,将特异地针对胎儿绒毛外滋养层细胞的抗体直接连接于支持体。术语“直接连接”用于表示所述支持体共价或非共价地连接于特异地针对胎儿绒毛外滋养层细胞的抗体,并且所述支持体不通过第二抗体连接于所述抗体。
在另一个选项中,在没有插入蛋白a或蛋白g分子的情况下将特异地针对胎儿绒毛外滋养层细胞的抗体连接于支持体。因此,根据本发明的方法的特定方面,没有蛋白a或蛋白g连接于支持体。
将特异地针对胎儿绒毛外滋养层细胞的抗体连接于任何不溶性支持体。
根据本发明的方法的特定方面,所述支持体为多个磁性颗粒,并且从母体子宫颈内样品中移除胎儿绒毛外滋养层细胞的步骤包括将所述磁性颗粒暴露于磁体。
与特异性结合至胎儿抗原的抗体直接偶联的磁性纳米颗粒通常具有10nm-1μm范围的尺寸,尽管可使用更小或更大的磁性纳米颗粒。
根据本发明的方法的特定方面,hla-g抗体连接于磁性纳米颗粒。
任选地,分离胎儿绒毛外滋养层细胞的方法还包括:通过采用固定剂处理来固定母体子宫颈内样品的细胞,其中所述采用固定剂的处理在从母体子宫颈内样品中分离胎儿绒毛外滋养层细胞之前或之后进行。
采用核酸酶处理胎儿绒毛外滋养层细胞的步骤任选地在从母体子宫颈内样品中移除胎儿绒毛外滋养层细胞之前或之后进行。
所使用的固定剂可以为戊二醛、甲醛、多聚甲醛,或其任意两种或更多种的组合物。根据本发明的方法的特定方面,所述醛固定剂为多聚甲醛。
任选地,首先将母体子宫颈内样品固定在非醛固定剂中。然后用醛固定剂来固定胎儿绒毛外滋养层细胞。任选地,通过用生理液体或缓冲剂(例如与哺乳细胞相容的盐水或缓冲剂)清洗母体子宫颈内样品以除去或部分除去非醛固定剂。
非醛固定剂示例性地包括丙酮、乙酸和醇类,例如乙醇和甲醇。任选地使用两种或更多种非醛固定剂的组合。根据本发明的方面,将甲醇和乙酸的混合物用作非醛固定剂。
根据本发明的方法的特定方面,用蛋白酶和/或糖胺聚糖降解酶(gagase)来进一步处理胎儿绒毛外滋养层细胞,其中用蛋白酶和/或gagase处理胎儿绒毛外滋养层细胞的步骤在从母体子宫颈内样品中移除胎儿绒毛外滋养层细胞之前或之后并且在用核酸酶处理胎儿绒毛外滋养层细胞之前或之后进行。
糖胺聚糖降解酶包括,例如透明质酸酶、肝素酶和软骨素酶。
根据本发明的方法的特定方面,未用溶粘蛋白剂处理母体子宫颈内样品。根据本发明的方法的特定方面,未用选自n-乙酰-l-半胱氨酸、dtt、胰蛋白酶和胰蛋白酶/edta的溶粘蛋白剂处理母体子宫颈内样品。根据本发明的方法的特定方面,未用胶原酶、蛋白酶、liberaseblendzyme和溶粘蛋白剂中的一种或更多种处理母体子宫颈内样品。
任选地,在分离胎儿绒毛外滋养层细胞之前对母体子宫颈内样品进行酸化。任选地,将酸化剂添加到样品中,使样品的ph至约ph5-6。酸化剂可以是例如任何酸或酸性缓冲剂。
根据本发明的方面的方法任选地还包括测定经分离的胎儿绒毛外滋养层细胞。根据本发明的方面,分离并分析胎儿绒毛外滋养层细胞以辅助诊断和治疗胎儿和/或孕育胎儿的孕妇,以促进胎儿和/或孕育胎儿的孕妇的健康。
这类测定包括胎儿绒毛外滋养层细胞的一种或更多种蛋白或肽的测定和/或胎儿绒毛外滋养层细胞的一种或更多种核酸的测定。
根据本发明的方面,将结合测定任选地用于胎儿绒毛外滋养层细胞测定中。
结合测定是通过与结合伴侣的结合来检测靶分析物(例如生物标记)的测定。术语“结合伴侣”指能够特异性地结合至靶分析物的生物分子。结合伴侣的非限制性实例包括靶分析物的抗体、适体(aptamer)、受体、配体和酶反应底物。结合伴侣也可以是核酸探针。技术人员能够常规地鉴定、分离和/或制备结合伴侣并将它们用于结合测定中。这样的技术是本领域普通技术人员公知的。
可根据允许通过结合至结合伴侣来检测一种或更多种靶分析物的多种方法中的任何一种,进行结合测定。可直接或间接地(例如通过使用可检测的标签)检测靶分析物和结合试剂的结合。
核酸测定,例如测序、扩增测定和/或杂交测定,可用于检测经分离的胎儿绒毛外滋养层细胞的靶分析物(例如生物标记)的表达。根据标准dna提取步骤,从胎儿绒毛外滋养层细胞分离dna。优选从胎儿绒毛外滋养层细胞分离rna,如本文中根据本发明的方面所描述的。
核酸测定包括但不限于扩增反应,例如聚合酶链反应(pcr),例如rt-pcr;斑点印迹法;原位杂交;rna印迹法;和rnase保护。这类测定的详细内容例如记载于j.sambrookandd.w.russell,molecularcloning:alaboratorymanual.coldspringharborlaboratorypress;3rded.,2001;和f.m.ausubel,ed.,shortprotocolsinmolecularbiology,currentprotocols;5thed.,2002。
在核酸测定中可使用核酸探针或引物,其能够与靶分析物mrna或cdna杂交以检测和/或对mrna或cdna进行定量。核酸探针可以是长度至少为10、15、30、50或100个核苷酸并且足以在严格条件下与靶mrna或cdna或其互补序列特异性杂交的寡核苷酸。核酸引物可以是长度至少为10、15或20个核苷酸并且足以在严格条件下与mrna或cdna或其互补序列特异性杂交的寡核苷酸。术语“特异性杂交”和“特异性地杂交”是指特定的核酸与靶核酸的杂交,并且基本上不与样品中靶核酸以外的核酸杂交。
杂交严格度和清洗条件取决于若干因素,包括探针和靶标的tm,以及杂交和清洗条件的离子强度,如技术人员公知的。杂交和实现所需杂交严格度的条件记载于,例如sambrooketal.,molecularcloning:alaboratorymanual,coldspringharborlaboratorypress,2001;和ausubel,f.etal.,(eds.),shortprotocolsinmolecularbiology,wiley,2002。
根据本发明的方法,任选地纯化来自非人类动物的样品用于测定。
术语“核酸”是指具有多于一个核苷酸的rna或dna分子,其为任何形式,包括单链、双链的寡核苷酸或多聚核苷酸。术语“核苷酸序列”是指在核酸的单链形式中寡核苷酸或多聚核苷酸中的核苷酸的排序。
术语“扩增测定”是指复制模板核酸,从而产生包含全部或部分模板核酸的副本的核酸的方法。
扩增测定包括下述测定,其包括使用位于靶核酸侧翼的一对引物通过核酸聚合酶催化的模板引导的引物延伸,所述测定示例性地包括但不限于聚合酶链反应(pcr)、逆转录pcr(rt-pcr)、连接介导的pcr(lm-pcr)、phi-29pcr和其他核酸扩增方法,例如c.w.dieffenbachetal.,pcrprimer:alaboratorymanual,coldspringharborlaboratorypress,2003;和v.demidovetal.,dnaamplification:currenttechnologiesandapplications.taylor&francis,2004中所描述的。术语“引物”是指长度通常为约9-60个核苷酸的单链寡核苷酸,其可以更长或更短,并且作为模板引导的dna合成的起始点而起作用。
体外核酸扩增方法的适合的反应条件包括存在适合的反应组分,其包括但不限于聚合酶和三磷酸核苷酸。本领域技术人员使用本发明的引物,仅通过常规实验就能够确定适于靶核酸扩增的条件,包括选择因素例如缓冲剂、核苷酸、ph、mg盐浓度、引物浓度和温度。扩增方法的核酸产物任选地包括另外的材料,例如但不限于非靶核酸序列、用于化学反应的官能团和存在于引物中且不存在于原始dna模板中的可检测的标签。所进行的pcr也可以为定量pcr(q-pcr),也称为实时pcr或动力学pcr(kpcr)。q-pcr也用于扩增并且同时对靶dna分子进行定量。
术语“定量pcr”或“q-pcr”是指用于对聚合酶链反应的结果进行定量的多种方法。q-pcr方法通常测定或比较扩增因子,例如测定循环阈值(ct),或为共扩增方法,其比较从靶标和标准模板同时扩增而产生的产物的量。许多q-pcr技术包括报告探针、插入剂染料或二者。报告探针包括但不限于
对于dna样品中的一个或更多个特异性序列,实时pcr能够进行检测和定量两者。当归一化至dna输入或另外的归一化基因时,所述量可以是绝对拷贝数或相对量。两种用于检测实时pcr产物的常规方法为:(1)插入任何双链dna的非特异性荧光染料,和(2)由用荧光报告物标记的寡核苷酸组成的序列特异性dna探针,所述荧光报告物仅在所述探针与其互补dna靶标杂交之后才能检测。例如,使用taqman探针。在与互补靶序列杂交和基于荧光团检测过程中,taqman探针原理依赖于taq聚合酶的5′-3′外切核酸酶活性以切开双标记探针。如在其他实时pcr方法中,产生的荧光信号允许定量测量pcr指数阶段的产物累积;然而,taqman探针显著提高检测特异性。taqman探针由共价连接到寡核苷酸探针5’-末端的荧光团和位于3’-末端的猝灭剂组成。可使用若干不同的荧光团(例如6-羧基荧光素,首字母缩略词:fam,或四氯荧光素,首字母缩略词:tet)和猝灭剂(例如,四甲基罗丹明,首字母缩略词:tamra,或二氢环吡咯并吲哚三肽小沟结合物,首字母缩略词:mgb)。猝灭剂分子猝灭荧光团经由fret(荧光共振能量转移)被循环光源激发时发出的荧光。只要荧光团和猝灭剂位置接近,猝灭反应即能抑制任何荧光信号。
设计taqman探针以使它们在由特定引物组扩增的dna区域内退火。由于taq聚合酶使引物延伸并合成新产生的链(同样,在单链模板上,但是在与图中所示方向相反的方向上,即从互补链的3’-末端至5’-末端),所述聚合酶的5’至3’外切核酸酶活性降解已退火至模板的探针。探针的降解从其中释放荧光团并且使与猝灭团的紧密接近断裂,因此解除猝灭效应并使荧光团发出荧光。因此,在实时pcr热循环仪中检测到的荧光与所释放的荧光团和pcr中存在的dna模板的量直接成比例。
根据本发明的方面,pcr用于全基因组扩增。
靶核酸的杂交测定包括但不限于斑点印迹法、核酸杂交、珠测定、原位杂交、rna印迹法、dna印迹法和微阵列测定。这些测定的具体内容记载于例如j.sambrookandd.w.russell,molecularcloning:alaboratorymanual,coldspringharborlaboratorypress;3rded.,2001;和f.m.ausubel,ed.,shortprotocolsinmolecularbiology,currentprotocols;5thed.,2002。
核酸杂交测定包括使用核酸探针,所述探针在确定的杂交和清洗条件下与靶核酸特异性杂交。术语“探针”包括各种长度的核酸序列,通常长度至少为约9至约8000个核苷酸,但可以更短或更长,只要在核酸杂交测定中探针能够与靶核酸特异性杂交即可。探针可以是单链或双链的,并且可以通过重组方法、化学合成、从天然来源分离或这些方法中的两种或更多种的组合而产生。
适用于多种测定(例如比较转录组和鉴定生物标记)的测序方法包括例如大规模平行信号测序、单分子实时测序、聚合酶克隆测序(polonysequencing)、离子半导体(iontorrent测序)、焦磷酸测序(454)、合成测序(illumina)、连接测序(solid测序)、链终止测序(sanger测序)。
根据本发明的方面,从胎儿绒毛外滋养层细胞分离胎儿rna用于测定。
根据本发明的方面,提供了从胎儿绒毛外滋养层细胞分离和/或测定rna的方法,其包括:从妊娠受试者获得母体子宫颈内样品;用dnase处理胎儿绒毛外滋养层细胞;从母体子宫颈内样品中移除胎儿绒毛外滋养层细胞;通过用醛固定剂处理来固定胎儿绒毛外滋养层细胞,产生醛固定的胎儿绒毛外滋养层细胞;清洗醛固定的胎儿绒毛外滋养层细胞以促使除去由醛固定剂引入的交联,产生经清洗的胎儿绒毛外滋养层细胞;以及从所述经清洗的胎儿绒毛外滋养层细胞中提取胎儿绒毛外滋养层细胞rna。
根据本发明的方面,提供了从胎儿绒毛外滋养层细胞分离和/或测定rna的方法,其中在裂解胎儿绒毛外滋养层细胞之前不用dnase处理胎儿绒毛外滋养层细胞,所述方法包括:从妊娠受试者获得母体子宫颈内样品;从母体子宫颈内样品中移除胎儿绒毛外滋养层细胞;通过用醛固定剂处理来固定胎儿绒毛外滋养层细胞,产生醛固定的胎儿绒毛外滋养层细胞;清洗醛固定的胎儿绒毛外滋养层细胞以促使除去由醛固定剂引入的交联,产生经清洗的胎儿绒毛外滋养层细胞;以及从所述经清洗的胎儿绒毛外滋养层细胞中提取胎儿绒毛外滋养层细胞rna。从所述经清洗的胎儿绒毛外滋养层细胞中提取胎儿绒毛外滋养层细胞rna的步骤包括裂解经清洗的胎儿绒毛外滋养层细胞,产生裂解的胎儿绒毛外滋养层细胞。
用dnase和蛋白酶处理所述裂解的胎儿绒毛外滋养层细胞以降解胎儿绒毛外滋养层细胞dna和蛋白。
测定胎儿绒毛外滋养层细胞rna以确定胎儿绒毛外滋养层细胞rna的一个或更多个特征,并且任选地将所述rna与标准物进行比较。
在从母体子宫颈内样品中分离胎儿绒毛外滋养层细胞之前和/或之后,任选地用醛固定剂处理胎儿绒毛外滋养层细胞。
在另一个选项中,在从妊娠受试者获得样品之后立即将母体子宫颈内样品固定。进一步任选地,在从妊娠受试者获得样品之后立即将母体子宫颈内样品在非醛固定剂中固定,并且该在非醛固定剂中的固定在通过用醛固定剂处理来固定胎儿绒毛外滋养层细胞产生醛固定的胎儿绒毛外滋养层细胞之前进行。在又一个选项中,在从妊娠受试者获得样品之后立即通过用醛固定剂处理来固定母体子宫颈内样品。
在从母体子宫颈内样品中分离之前或之后,任选地用dnase处理胎儿绒毛外滋养层细胞。
根据优选的方面,在将完整的胎儿绒毛外滋养层细胞从母体宫颈内样品分离之前或之后,不用dnase处理所述完整的胎儿绒毛外滋养层细胞。在分离胎儿绒毛外滋养层细胞rna的过程中,用dnase处理裂解的胎儿绒毛外滋养层细胞以除去胎儿绒毛外滋养层细胞dna。
可用醛固定剂来固定细胞,所述醛固定剂选自戊二醛、甲醛、多聚甲醛和其任意两种或更多种的混合物。根据本发明的方面,采用多聚甲醛来固定细胞。
在醛固定条件下进行胎儿绒毛外滋养层细胞的固定。醛固定条件包括醛固定剂浓度、任选的缓冲剂、时间和温度。
所使用的醛固定剂的浓度取决于待使用的所需固定时间和温度。所使用的醛固定剂的浓度通常为0.1至10%(w/v)的水溶液,例如0.5至6重量%(w/v)的水溶液或1至4%(w/v)的水溶液。
可通过将醛固定剂溶解于水溶液中来制备醛固定剂。所述水溶液任选地为缓冲液,例如生理ph下的生理缓冲液。
固定温度可发生变化,例如,根据所需的固定时间而变化。固定温度通常为约4℃-40℃。
通过下述方法至少部分地除去由醛固定剂引入的交联:通过在确定的热和盐的条件下在水清洗液中清洗来处理醛固定的胎儿绒毛外滋养层细胞。通过下述方法来实现由醛固定引入的交联的去除:在4℃-80℃的温度下,在约ph7.0-8.0的生理ph范围下的生理缓冲剂(例如但不限于磷酸盐缓冲液如pbs、tris缓冲液如tris-hcl、hepes或三乙醇胺缓冲液)中在清洗液中清洗细胞,清洗时间为几天(针对低于室温的温度)至15分钟(针对高于约60℃的温度)。可通过例如下述方法来实现由醛固定引入的交联的去除:在具有高于生理盐浓度(例如160mm-300mm的nacl浓度)的溶液中清洗细胞,清洗时间为几天至15分钟。可使用热和高于生理盐浓度的组合。
在清洗液中任选地包含稳定剂,例如但不限于edta。edta任选地以0.1mm-20mm、0.5mm-10mm或0.75-5mm的量存在。
至少部分去除由醛固定引入的交联的具体条件以及对去除醛交联的评估记载于darlingetal.,anal.chem.,86:5678-5681,2014和niranjanakumaris.etal.,methods2002;26:182-190中。
通过多种方法中的任何一种来实现细胞裂解,所述方法示例性地包括超声处理或用洗涤剂处理。
根据本发明的方面,在裂解前清洗经分离的胎儿绒毛外滋养层细胞以至少部分去除由醛固定引入的交联。
进一步处理经清洗的胎儿绒毛外滋养层细胞以分离rna。这样的处理包括裂解胎儿绒毛外滋养层细胞,以及将胎儿绒毛外滋养层细胞dna和蛋白与rna分离。通过多种方法中的任何一种来实现胎儿绒毛外滋养层细胞dna和蛋白与rna的分离,所述方法示例性地包括:通过裂解细胞的dnase处理来降解胎儿绒毛外滋养层细胞dna,和/或通过裂解细胞的蛋白酶处理来降解蛋白。任选地,在清洗液中包含蛋白酶。
然后通过多种方法中的任何一种(例如沉淀和清洗)可进一步纯化rna以除去dnase和/或蛋白酶和降解的dna和/或蛋白。
或者,根据本发明的方面,裂解经分离的胎儿绒毛外滋养层细胞并清洗胎儿绒毛外滋养层细胞裂解物以至少部分除去由醛固定引入的交联,产生经清洗的胎儿绒毛外滋养层细胞裂解物。
根据本发明的方面,通过在清洗液中包含洗涤剂来同时进行经分离的胎儿绒毛外滋养层细胞的裂解和清洗以至少部分除去由醛固定引入的交联。例如,洗涤剂任选地以清洗液的0.1-5%w/v、0.25-2.5%w/v或0.5-1.5%w/v的量而包含在清洗液中。所包含的洗涤剂例如但不限于sds、nonidetp-40、tween-20和triton-x100。同时裂解的清洗液的实例为200mmnacl、10mmtris-hclph8.0、1mmedta和1%sds。同时裂解的清洗液的另一个实例为200mmnacl、10mmtris-hclph8.0、1mmedta、1%sds和蛋白酶,例如50-1500mg/ml的蛋白酶k。
进一步处理经清洗的胎儿绒毛外滋养层细胞裂解物以分离rna。这样的处理包括将胎儿绒毛外滋养层细胞dna和蛋白与rna分离。胎儿绒毛外滋养层细胞dna和蛋白与rna的分离可通过多种方法中的任何一种来实现,所述方法示例性地包括:通常通过裂解细胞的dnase处理和/或裂解细胞的蛋白酶处理来降解胎儿绒毛外滋养层细胞dna。dnase通常以约50-500kunitiz单位/毫升裂解物的量使用。然后通过多种方法中的任何一种(例如沉淀、离心和清洗)可进一步纯化rna以除去dnase以及降解的dna和/或蛋白。
测定胎儿绒毛外滋养层细胞rna包括任何适用的核酸测定。
经分离的rna任选地用于构建“下一代测序”文库,该文库通过使用scriptseqv2rna-seq文库制备试剂盒(epicentre)产生条码文库而构建。
可对从胎儿和母体细胞分离的rna进行测序以鉴定胎儿和母体细胞中的基因产物。不同细胞群中的基因产物的比较用于鉴定共性和差异,所述共性和差异指示出胎儿和/或母亲的健康以及妊娠相关的病理状态,例如先兆子痫、子宫内生长受限、早产和流产。
使用qpcr可将rna反转录为cdna用于分析。根据本发明的方面,本发明的方法可用于鉴定具有正常结果的妊娠与具有不良结果的妊娠(先兆子痫、子宫内生长受限、早产、流产及其他)在5至20孕周中由胎儿绒毛外滋养层细胞差异化表达的基因。一旦鉴定,经分离的rna可用于核酸测定,例如定量rt-pcr,例如来前瞻性地筛选患者以评估她们产生不良结果的风险。
免疫测定方法可用于测定靶分析物(例如样品中的生物标记),所述方法包括但不限于酶联免疫吸附测定(elisa)、酶联免疫过滤测定(elifa)、流式细胞术、免疫印迹法、免疫沉淀、免疫组织化学、免疫细胞化学、发光免疫测定(lia)、荧光免疫测定(fia)和放射性免疫测定。测定方法可用于获得定性和/或定量结果。同时适于样品的定性和定量测定的测定方法的具体内容记载于标准文献中,示例性地包括e.harlowandd.lane,antibodies:alaboratorymanual,coldspringharborlaboratorypress,1988;f.breitlingands.dubel,recombinantantibodies,johnwiley&sons,newyork,1999;h.zola,monoclonalantibodies:preparationanduseofmonoclonalantibodiesandengineeredantibodyderivatives,basics:frombackgroundtobench,biosscientificpublishers,2000;b.k.c.lo,antibodyengineering:methodsandprotocols,methodsinmolecularbiology,humanapress,2003;f.m.ausubeletal.,eds.,shortprotocolsinmolecularbiology,currentprotocols,wiley,2002;s.klussman,ed.,theaptamerhandbook:functionaloligonucleotidesandtheirapplications,wiley,2006;ormerod,m.g.,flowcytometry:apracticalapproach,oxforduniversitypress,2000;givan,a.l.,flowcytometry:firstprinciples,wiley,newyork,2001;gorczyca,w.,flowcytometryinneoplastichematology:morphologic-immunophenotypiccorrelation,taylor&francis,2006;crowther,j.r.,theelisaguidebook(methodsinmolecularbiology),humanapress,2000;wild,d.,theimmunoassayhandbook,3rdedition,elsevierscience,2005,和j.sambrookandd.w.russell,molecularcloning:alaboratory′manual,coldspringharborlaboratorypress,3rded.,2001。
抗体和制备抗体的方法是本领域公知的。本文使用的术语“抗体”包括单克隆抗体、多克隆抗体、双特异性抗体、多特异性抗体、人抗体、人源化抗体、嵌合抗体、骆驼化抗体、单区抗体、单链fvs(scfv)、单链抗体、二硫化物连接的fvs(sdfv)和抗独特型(抗id)抗体,以及上述任何一种的抗原结合片段。特别地,抗体包括免疫球蛋白分子和免疫球蛋白分子的免疫活性片段,即包含抗原结合位点的分子。免疫球蛋白分子为任何类型(例如igg、ige、igm、igd、iga和igy)、类别(例如igg1、igg2、igg3、igg4、iga1和iga2)或子类别。
本文使用的术语“抗体片段”和“抗原结合片段”定义了与靶分析物免疫特异性结合的抗体片段。可通过本领域技术人员已知的任何技术产生抗体片段。例如,使用酶例如木瓜蛋白酶(以产生fab片段)或胃蛋白酶(以产生f(ab′)2片段),通过免疫球蛋白分子的蛋白水解裂解可产生fab和f(ab′)2片段。也可通过重组dna技术产生抗体片段。
抗体、抗原结合片段、它们的产生方法和在产生的抗体中筛选与抗原基本上特异性结合的抗体的方法是本领域已知的,并且这样的抗体、抗原结合片段和方法进一步详细记载于例如antibodyengineering,kontermann,r.anddubel,s.(eds.),springer,2001;harlow,e.andlane,d.,antibodies:alaboratorymanual,coldspringharborlaboratorypress,1988;f.breitlingands.dubel,recombinantantibodies,johnwiley&sons,newyork,1999;h.zola,monoclonalantibodies:preparationanduseofmonoclonalantibodiesandengineeredantibodyderivatives,basics:frombackgroundtobench,biosscientificpublishers,2000;ausubel,f.etal.,(eds.),shortprotocolsinmolecularbiology,wiley,2002;j.d.pound(ed.)immunochemicalprotocols,methodsinmolecularbiology,humanapress,2nded.,1998;b.k.c.lo(ed.),antibodyengineering:methodsandprotocols,methodsinmolecularbiology,humanapress,2003;和kohler,g.andmilstein,c,nature,256:495-497(1975)。针对靶分析物(例如生物标记)的抗体可在动物中产生,合成,通过重组方法产生,和/或从商业上获得。
适体可用于测定靶分析物。术语“适体”是指与特定物质基本上特异性结合的肽和/或核酸。在核酸适体的情况下,所述适体的特征在于除watson/crick碱基配对以外与靶标的结合相互作用或与第二和/或第三核酸的三螺旋结合。这样的结合相互作用可包括例如范德华相互作用、疏水相互作用、氢键和/或静电相互作用。类似地,基于肽的适体的特征在于与靶标的特异性结合,其中所述适体不是靶标的天然存在的配体。鉴定和产生肽和核酸适体的技术以及它们的用途是本领域已知的,例如f.m.ausubeletal.,eds.,shortprotocolsinmolecularbiology,currentprotocols,wiley,2002;s.klussman,ed.,theaptamerhandbook:functionaloligonucleotidesandtheirapplications,wiley,2006;和j.sambrookandd.w.russell,molecularcloning:alaboratorymanual.coldspringharborlaboratorypress,3rded.,2001中记载的。
通过本领域已知的多种方法中的任何一种来实现检测样品中存在的靶分析物和结合伴侣之间的结合,所述方法示例性地包括检测直接或间接地连接于靶分析物或结合伴侣的可检测的标签。术语“可检测的标签”是指通过任何适合的方法能够产生指示存在可检测的标签的信号的材料,所述方法示例性地包括光谱法、光学法、光化学法、生物化学法、酶法、电学法和/或免疫化学法。可检测的标签的实例示例性地包括荧光基团、化学发光基团、生物发光基团、电子致密颗粒、磁性颗粒、酶、底物、放射性同位素和生色团。
所使用的具体的可检测的标签取决于所使用的检测方法。这样的检测方法被并入特定的测定形式中,示例性地包括elisa、蛋白质印迹法、免疫沉淀、免疫细胞化学、免疫荧光测定、液相色谱法、流式细胞术、本领域已知的其他检测方法,或它们的组合。
结合测定可包括连接于支持体的结合伴侣。在结合测定中使用的连接了结合伴侣的支持体可以是固体或半固体的,并且可以是多种材料中的任何一种,例如玻璃、硅、纸、合成或天然存在的聚合物,例如聚苯乙烯、聚碳酸酯、聚丙烯、pvdf、尼龙、纤维素、琼脂糖、葡聚糖和聚丙烯酰胺,或可稳定连接结合伴侣以用于结合测定的任何其他材料。
所使用的支持体可包含用于结合至结合伴侣的官能团,例如但不限于羧基、胺、氨基、羧化物、卤化物、酯、醇、脲、醛、氯甲基、氧化硫、氧化氮、环氧树脂和/或甲苯磺酰基官能团。通过多种方法中的任何一种(示例性地包括吸附和化学键合)来实现结合伴侣与支持体的连接。在一个实施例中,1-乙基-3-[3-二甲基氨基丙基]碳二亚胺氢氯化物、edc或edac化学可用于将结合伴侣连接于颗粒。结合伴侣可直接或间接地与支持体材料键合,例如通过与布置在支持体上的包膜或接头键合。官能团、其修饰和结合伴侣与支持体的连接是本领域已知的,例如记载于fitch,r.m,polymercolloids:acomprehensiveintroduction,academicpress,1997中。
这类支持体可以是多种形式和形状中的任何一种,包括但不限于微滴定板、微滴定孔、针、纤维、珠、载片、硅芯片和膜,例如硝酸纤维素膜或pvdf膜。
根据本发明的实施方案,多种光谱法的任何一种可用于测定靶分析物,例如生物标记,所述方法包括但不限于气相色谱法、液相色谱法、离子迁移谱、质谱、液相色谱-质谱(lc-ms或hplc-ms)、离子迁移谱-质谱、串联质谱、气相色谱-质谱、基质辅助解析电离飞行时间(maldi-tof)质谱、表面增强激光解析电离(seldi)和核磁共振光谱,这些都是本领域技术人员公知的。
任选地,光谱分析用于测定样品中的靶分析物,例如生物标记。质谱分析可用于根据本发明的方面的测定中。使用例如飞行时间
(tof)质谱或傅立叶变换离子回旋共振质谱来进行质量分析。质谱技术是本领域已知的,并且蛋白质和/或肽测定方法的示例性详细描述记载于lij.,etal.,clinchem.,48(8):1296-304,2002;hortin,g.l.,clinicalchemistry52:1223-1237,2006;a.l.burlingame,etal.(eds.),massspectrometryinbiologyandmedicine,humanapress,2000;和d.m.desiderio,massspectrometry0fpeptides,crcpress,1990中。
使用分离细胞的质谱法
用于不良妊娠结果的生物标记之前被局限于可在母体循环中检测到的那些,其通常为由胎盘或其他受影响的器官分泌的蛋白。胎盘释放的蛋白需要达到某一阈值(在第二个和第三个三个月),以在母体血液中检测。
根据本发明的方法的方面,经分离的胎儿绒毛外滋养层细胞的质谱(ms)分析提供了少量细胞的灵敏的分析。典型的母体子宫颈内样品产生500-2000个胎儿evt细胞。根据本发明的方法的方面,ms方法能够进行少量细胞的分析。
使用质谱的高分辨率表型分析
根据本发明的方面,提供了测定胎儿绒毛外滋养层细胞的方法,其包括从妊娠受试者获得母体子宫颈内样品;使母体子宫颈内样品与第一抗体接触,所述第一抗体特异地针对胎儿绒毛外滋养层细胞,其中所述第一抗体不与母体子宫颈内样品中的母体细胞结合;使母体子宫颈内样品与一种或更多种另外的抗体接触,其中采用不同的标签可区分地标记所述第一抗体和每种另外的抗体,所述不同的标签可通过电感耦合等离子体质谱检测;将所述母体子宫颈内样品喷成雾状以分离细胞;以及对细胞进行电感耦合等离子体质谱,从而测定胎儿绒毛外滋养层细胞。
根据本发明的方面,使用靶向质谱用于蛋白、肽和翻译后修饰的灵敏的和定量的检测。为了增加灵敏度和对特定蛋白进行定量,可将肽引入质谱生物标记中,其可用于对小样品量进行蛋白定量。
根据本发明的方面,任选地使用“cytotof”用于胎儿绒毛外滋养层细胞特异性蛋白的深度表型分析。“cytotof”将质谱和细胞上的蛋白的抗体标记相结合。采用不同同位素标记针对特异性靶标的抗体,这使得可通过质谱方法区分所述抗体。将待测定的细胞用抗体标记,将细胞喷成雾状,并且测量各质量/金属标记的抗体的飞行时间并进行定量。这种方法使得能够分析一个单独细胞上最多达100种标记。在该方法中,不需要纯化胎儿绒毛外滋养层细胞。hla-g阳性可用作深度表型分析方法和高单细胞分辨率中的标识。
标准
适用于测定的标准是本领域熟知的,并且所使用的标准可以为任意适合的标准。
在一个实施例中,标准是来自对照动物的可比较的样品中的生物标记的测定结果。
标准可以是之前在单独的对照动物或对照动物群体的样品中测定的一个或更多个生物标记的参照水平,并且存储在印刷品或电子媒介中,以用于检索并与给予测试化合物的动物中的一个或更多个生物标记的测定结果进行比较。
标准可以是在不同的时间在可比较的动物样品中的一个或更多个生物标记的测定结果。例如,标准可以是在不同的时间(给予测试化合物之前或之后)从相同动物获得的可比较样品中的一个或更多个生物标记的测定结果。第一样品可在第一时间从个体动物获得,以获得所述第一样品中一个或更多个生物标记的动物特异性基线水平。第二样品可在第二时间时从个体动物获得,并测定一个或更多个生物标记以监测与第一样品相比一个或更多个生物标记的水平差异。其他样品可在其他时间点从动物获得,并测定一个或更多个指示物以监测与第一样品、第二样品或其他样品相比一个或更多个指示物的水平差异。
标准可以是在从一个或更多个群体获得的可比较样品中的一个或更多个生物标记的平均水平。通过测定从群体的各动物获得的可比较的样品中一个或更多个指示物来确定“平均水平”。术语“可比较的样品”用于表示样品为相同类型,即例如可比较的样品的每一种都是血清样品。
与标准相比,本发明的测定中检测到的一个或更多个生物标记的水平或表达的差异可以是所述一个或更多个生物标记的水平或表达的升高或降低。升高或降低的范围可以为,例如标准水平的至少5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、99%或更高。
通过多种方法的任何一种,使用统计分析可分析测定结果,所述方法例如参数检验或非参数检验、方差分析、协方差分析、多元分析的对数回归、fisher精确检验、卡方检验、学生t检验、mann-whitney检验、wilcoxon符号秩检验、mcnemar检验、friedman检验和page′sl趋势检验。这些和其他统计学检验是本领域公知的,如hicks,cm,researchmethodsforclinicaltherapists:appliedprojectdesignandanalysis,churchilllivingstone(publisher);5thed.,2009;和freund,rjetal.,statisticalmethods,academicpress;3rded.,2010中详细记载的。
任选地,本文所述的测定为由胎儿绒毛外滋养层细胞表达的一个或更多个生物标记的测定。例如,测定半乳糖凝集素13(lgals13,又称为pp13)、半乳糖凝集素14(lgals14)、胎盘生长因子(pgf)、妊娠相关血浆蛋白a(pappa)、α胎儿蛋白(afp)、内皮因子(eng)或fms相关酪氨酸激酶1(flt-1)中的一个或更多个以检测指示异常胎盘功能(例如先兆子痫、子宫内生长受限、自然流产和早产)的改变。
任选地,本文所述的测定为由妊娠的第一个和第二个三个月的胎儿的胎儿绒毛外滋养层细胞表达的一个或更多个生物标记的测定,所述生物标记例如半乳糖凝集素13(lgals13,又称为pp13)、半乳糖凝集素14(lgals14)、胎盘生长因子(pgf)、妊娠相关血浆蛋白a(pappa)、α胎儿蛋白(afp)、内皮因子(eng)或fms相关酪氨酸激酶1(flt-1)中的一个或更多个。
本发明的组合物和方法的实施方案在以下实施例中举例说明。提供这些实施例为示例性的目的,不应认为这些实施例限制了本发明的组合物和方法的范围。
实施例
实施例1
分离未固定的胎儿绒毛外滋养层细胞,以及从未固定的胎儿绒毛外滋养层细胞分离dna
使用细胞刷采集母体子宫颈内样品,并在冰冷的培养基或pbs(137mmnacl,10mm磷酸缓冲液)中漂洗所述细胞刷。
将细胞离心,并重新悬浮于升温至室温的10mlpbs加2.7mmcacl2,1mmmgcl2中。
通过将1mgdnasei粉末(worthingtoncat#2138,>2000kunitz单位/mg)溶于10mlpbs加0.9mmmgcl2中来制备dnasei。
将dnase溶液的100μl等分部分加到细胞中并在室温下孵育15min。然后用含有30mmedta的10mlpbs清洗细胞3次,然后再用pbs清洗两次。
通过250微米的滤器将细胞离心,并将细胞在4℃重新悬浮于10mlpbs中。然后将细胞在10mlpbs中清洗2次并使最终细胞团的的体积为1ml于pbs中。
通过以下方法开始磁性分离步骤以移除胎儿细胞:在将细胞重新悬浮于1mlpbs之后,将20μl与抗-hla-g抗体缀合的250nm磁性纳米颗粒添加到经清洗的细胞中并在4℃振荡孵育1至24小时。
使用dynamagtm自旋磁体(lifetechnologies),将母体细胞(hla-g阴性)与磁化的(hla-g阳性)胎儿绒毛外滋养层细胞分离。
然后使用磁体将胎儿绒毛外滋养层细胞清洗3次以除去残留的母体细胞。
将经分离的胎儿绒毛外滋养层细胞重新悬浮于50-100μlpbs/10mmedta溶液中。任选地,将经分离的母体细胞重新悬浮于50-100μlpbs/10mmedta溶液中。如果需要,取出15μl的等分溶液用于胎儿细胞和如果需要任选的母体细胞的细胞计数和质量控制。
将经分离的母体细胞和经分离的胎儿绒毛外滋养层细胞各50μl的等分溶液用于dna分离。
将3x浓缩的dna提取缓冲液(90mmtris、90mmedta、1.5%edta,ph8.0,3mg/ml蛋白酶k)的25微升等分溶液加到50微升经分离的母体细胞或经分离的胎儿绒毛外滋养层细胞中,用于dna分离。然后将这些混合物在65℃孵育3小时,之后在95℃孵育10min。将所提取的dna冷冻用于pcr测定,或可通过在微量离心机中高速离心5分钟来进一步纯化所提取的dna。任选地,仍然进一步纯化dna,例如使用市售的dna纯化和浓缩试剂盒,例如zymresearchdna10浓缩试剂盒。类似试剂的picogreen可用于dna定量。
在小珠上或在溶液中,在含有或不含有dnase的情况下孵育未固定的细胞。采用可溶的dnase处理的新鲜细胞平均产生3-6ng总dna。
使用zymresearchdna浓缩试剂盒的少量dna的dna纯化导致30-50%的dna损失。从采用细胞刷取出的母体子宫颈内材料的单一样品中分离平均2-4ng纯的高品质dna。
实施例2
分离固定的胎儿绒毛外滋养层细胞,以及从固定的胎儿绒毛外滋养层细胞分离dna
使用细胞刷,通过将其插入子宫颈内管约2cm并在将其取出时旋转2或3次,来采集母体子宫颈内样品。在所述刷中也采集了子宫颈内管中存在的粘液。例如使用thinprep试剂盒,将细胞刷在固定剂中漂洗。冷冻或在室温下保存样品,并将其运送到实验室以进行进一步处理。可将样品在4℃保存至少一周,而不损失rna或hla-g蛋白。
为了分离胎儿绒毛外滋养层细胞和任选的母体细胞,在将母体子宫颈内样品酸化之后用pbs清洗所有细胞两次,所述酸化通过将0.6ml乙酸添加到20ml包含细胞的thinprep中而使最终浓度为3%乙酸。
通过250微米滤器来将细胞离心并在4℃将细胞重新悬浮于10mlpbs中。然后将细胞在10mlpbs中再清洗两次,最终细胞团的体积为1ml于pbs中。
为了避免核dna被进入固定的可渗透的细胞中的核酸酶降解,将dnase连接(例如通过共价连接)至一个或更多个支持体(例如无法透过固定的细胞的小珠或颗粒)。在本实施例中,将共价连接于非磁性小珠的dnase——5微升f7(mobiotec,德国)——添加到细胞中,并在室温下孵育10min。
开始磁性分离步骤以移除胎儿细胞,振荡1小时至24小时,如bolrticketal.,fertil.steril.,102:135-142.e6,2014中所述。
使用dynamagtm自旋磁体(lifetechnologies)将母体细胞(hla-g阴性)与磁化的(hla-g阳性)胎儿绒毛外滋养层细胞分离。
然后将胎儿绒毛外滋养层细胞在含有30mmedta的pbs中清洗3次。
任选地,使用15微米的网孔来纯化母体细胞,然后清洗和浓缩细胞。
将经分离的胎儿绒毛外滋养层细胞重新悬浮于50-100μlpbs/10mmedta溶液中。任选地,将经分离的母体细胞重新悬浮于50-100μlpbs/10mmedta溶液中。如果需要,取出15微升等分溶液用于胎儿细胞和如果需要任选的母体细胞用于细胞计数和质量控制。
将3x浓缩的dna提取缓冲液(90mmtris、90mmedta、1.5%edta,ph8.0,3mg/ml蛋白酶k)的25微升等分溶液加到50微升经分离的母体细胞或经分离的胎儿绒毛外滋养层细胞中用于dna分离。然后将这些混合物在65℃孵育3小时,之后在95℃孵育10min。将所提取的dna冷冻用于pcr测定,或可通过在微量离心机中高速离心5分钟来进一步纯化所提取的dna。任选地,仍然进一步纯化dna,例如使用市售的dna纯化和浓缩试剂盒,例如zymresearchdna10浓缩试剂盒。类似试剂的picogreen用于dna定量。
在小珠上或在溶液中,在含有或不含有dnase的情况下孵育固定的细胞。采用结合于小珠的dnasei处理的固定的母体细胞或胎儿细胞(500-1000)平均产生3-6ng总dna。
采用zymresearchdna浓缩试剂盒的少量dna的dna纯化导致30-50%的dna损失。从采用细胞刷取出的母体子宫颈内材料的单一样品中分离平均2-4ng纯的高品质dna。
实施例3
从胎儿绒毛外滋养层细胞分离rna
使用细胞刷,通过将其插入子宫颈内管约2cm并在将其取出时旋转2或3次,来采集母体子宫颈内样品。在所述刷中也采集了子宫颈内管中存在的粘液。将细胞刷在固定剂(例如缓冲甲醇溶液)中漂洗。将样本在冷冻或室温下保存,并将其运送到实验室以进行进一步处理。可将样品在4℃保存至少一周,而不损失rna或hla-g蛋白。
为了从胎儿绒毛外滋养层细胞中分离rna,在将母体子宫颈内样品酸化之后用pbs清洗全部细胞两次,所述酸化通过将0.6ml乙酸添加到20ml包含细胞的缓冲甲醇溶液而使最终浓度为3%乙酸。
通过250微米滤器来离心细胞,除去上清液并将细胞团迅速地重新悬浮于4%多聚甲醛/pbs中10分钟,然后再次使细胞成团并用pbs或tris缓冲剂冲洗细胞。甲醛固定防止了高度可溶的核酸的损失并有效地使内源rnase失活。
通过免疫磁性分离来移除hla-g阳性的胎儿绒毛外滋养层细胞,所述免疫磁性分离包括将细胞与附着于磁珠的抗hla-g抗体孵育的步骤,如bolnicketal.,fertil.steril.,102:135-142.e6,2014所述,并且使用dynamagtm自旋磁体(lifetechnologies)将母体细胞(hla-g阴性)与磁化的(hla-g阳性)胎儿绒毛外滋养层细胞分离。
然后在含有30mmedta的pbs中清洗胎儿绒毛外滋养层细胞3次。
在胎儿绒毛外滋养层细胞的免疫磁性分离之后,将它们去交联化,然后通过在56℃在200mmnacl、10mmtris-hclph8.0、1mmedta和1%sds以及1300μg/ml蛋白酶k中孵育15min和在80℃孵育15min来进行rna分离。清洗之后用180kunitz单位dnase/ml处理裂解物以除去dna。然后使用离心柱(spincolumn)来纯化裂解物中的rna并使用不含rnase的水洗脱。使用agilent2100电泳微流体分析仪、使用rnapico试剂盒(agilenttechnologies)来对经分离的rna进行定量并评估纯度。
在细胞裂解之前的任选的dnase处理在提取rna之前消除了dna污染,所述rna在去交联过程中被片段化。
使用agilent2100电泳微流体分析仪采用rnapico试剂盒(agilenttechnologies),对经分离的rna进行定量并评估其纯度。使用cfx384biorad热循环仪(lifetechnologies)通过半定量实时pcr来验证片段化的rna的性质。对于粗制的thinprep样品、经分离的胎儿绒毛外滋养层细胞和缺乏胎儿绒毛外滋养层细胞的母体细胞,评估来自19份母体子宫颈内样品的rna回收,如图1所示,四种不同已知丰度的rna的qpcr的ct值示于图2。对于图2,采用用于所示rrna或mrna的引物,通过qpcr来测定从等量rna所制备的cdna。在胎儿绒毛外滋养层细胞和母体分离物中回收的rna的量与粗制的未分离的子宫颈样品相当。将来自经分离的胎儿绒毛外滋养层细胞(evt)的rna与从母体样品中分离的rna进行比较,所述母体样品不需要醛固定,因为直接使用细胞而不进行evt分离。尽管分析表明分离物中的rna是高度片段化的,但是当通过qpcr测定四种不同rna的等量rna时,分离物中的rna产生与粗制细胞相当的ct值。发现使用该方法回收了约50ng有用的rna。对本发明的经分离的胎儿绒毛外滋养层细胞进行的rna分离产生了足量的来自胎儿绒毛外滋养层细胞的rna,以用于qpcr分析。
然后通过使用scriptseqv2rna-seq文库制备试剂盒(epicentre)产生条码化的文库,将经分离的rna用于构建rna测序文库(图3)。在illumina基因组分析ii测序仪上,对从单一样品中的胎儿和母体细胞分离的rna进行测序,测序平行进行三次。测序后,使用多路解编软件(demultiplexingsoft)处理rna数据。使用生物信息学工具novoalign,将测序数据与人类基因组构建(hg19)和核糖体序列18s和28s进行比对。获得95%比对,表明rna文库制备和多路解编均成功。在每种样品中鉴定了超过20000种基因产物。将如此产生的读段转化为bed.文件并输入genomatix比对站(gms)。gms产生rpkm(每100万比对的片段中每一千碱基外显子的读段)形式的数据用于数据库中的25000个基因。样品中rpkm值的比较表明母体样品之间或胎儿样品之间的紧密比对,但是当将胎儿样品和母体样品进行比对时出现明显的离群值。各比较的实例示于图4a-4c中。使用通过在evt细胞分离过程中将其与多聚甲醛交联而获得的rna,通过下一代测序分析产生了高质量的数据。
实施例4
对于罕见细胞群中的深度蛋白质组分析,根据本发明的方面,多路化的(multiplexed)分析包含了来自紧密相关的htr-8/svneo(htr)细胞滋养层细胞系的参照样品。样品中的每个通道包含100至1000个细胞。在ms1中离子选择的信号和ms2中这些离子的测序是加和的,提供在100个细胞的样品中结合其他多路化的样品中的肽信号的扩增。使用同步化前体选择(sps)——其中将10个ms2离子结合以产生用于定量的ms3光谱——以增加特异性和灵敏度,如tingetal.,natmethods2011;8:937-940;和mcalisteretal.,analchem2012;84:7469-7478中所述。在ms3光谱中发生个体样品中蛋白质的指认和相对定量,如图5a-5c所示出的,图5a-5c表示ms2光谱(图5a)和相应的定量ms3光谱(图5b-5c)。在此处,滋养层细胞被等分为1000、500、250或100个细胞/管。采用proteasemax洗涤剂裂解细胞,该洗涤剂为有利于质谱的洗涤剂,其不需要从样品中除去。在采用最小浓度的tcep和碘乙酰胺(iaa)将经裂解的细胞还原并烷基化之后,采用胰蛋白酶/lys-c消化所述经裂解的细胞。过夜消化之后,采用对于5毫克蛋白而言足量的tmt10plex试剂(thermoscientific)来标记肽。将被标记的肽混合,通过speed-vac浓缩,并使用sps直接在orbitrapfusion上运行以获得定量光谱。通过与包含1000个细胞的‘126’通道相比的信号比来确定更小的细胞样品的定量。对于三个其他的1000个细胞的样品,这些比例为0.99、1.031和1.031;对于500个细胞的样品,这些比例为0.523和0.559;对于250个细胞的样品,这些比例为0.226和0.232;对于100个细胞的样品,这些比例为0.124和0.141(图5c)。在从2至30%乙腈的90分钟梯度中,鉴定并定量了931种蛋白,其代表了宽范围的细胞器和生物化学活动。所有被鉴定的蛋白在全部10个通道中被定量,这表明对100个细胞的样品的分析达到与1000个细胞的样品的分析相同的深度。注意到在生殖和生殖过程分类中有109种蛋白的显著表征,如对于滋养层细胞所期望的那样。这些数据代表了罕见细胞群的定量蛋白质组分析中的重要突破。相同的步骤用于分析胎儿绒毛外滋养层细胞以鉴定患者组之间的差异。
实施例5
先兆子痫(pe)和子宫内生长受限(iugr)的生物标记
根据实施例的细胞分离
通过半定量免疫细胞化学筛选从妊娠第一个和第二个三个月获得的胎儿绒毛外滋养层细胞,结果显示7种与先兆子痫和子宫内生长受限相关的蛋白——半乳糖凝集素13(lgals13,又称为pp13)、半乳糖凝集素14(lgals14)、胎盘生长因子(pgf)、妊娠相关血浆蛋白a(pappa)、α胎儿蛋白(afp)、内皮因子(eng)或fms相关酪氨酸激酶1(flt-1)——显著改变。特别地,在后来发展先兆子痫或子宫内生长受限的妊娠中三种蛋白显著增加(afp、flt1、eng)并且四种蛋白减少(pappa、pgf、lgals13、lgals14),而在这两组中角蛋白-7(krt7)水平相似(图6)。查看医学记录以选择存档的样本,用于对具有正常结果的妊娠(n=20)或发生子宫胎盘功能不足(先兆子痫或子宫内生长受限;n=12)的妊娠进行分析。在5至20周之间的相似(p=0.34)孕龄(ga)(对于正常组,平均ga=10.9周;对于pe/iugr,平均ga=12.7周)时通过tric获得样本。使用免疫细胞化学和图像分析(simplepci,hamamatsu)来对个体细胞的免疫荧光密度进行半定量,如wangetal.,devbiol2007;302:143-153;和routetal.,devbiol2004;268:135-151中所述。分别滴定抗体以确保带有标记的荧光信号是线性的。使用相似的相机曝光时间,采用相同批次的抗体一起评估信号的降低(slide)以优化信号定量。测定平均10个细胞,减去由非免疫igg产生的背景染色。未改变的krt7(图6)提供了非特异性变化的对照。对于各推定的生物标记蛋白,发现在正常组和pe/iugr组之间存在表达的显著差异(t检验,经过校正以适用等方差和不等方差)(图6)。在正常组内染色强度和ga之间没有关联,尽管权威性(power)很可能不充分。对各蛋白所构建的接受者操作特征(roc)曲线具有如下表i中所示的曲线下面积(auc)。
实施例6
自然流产和早产的生物标记
使用7种蛋白——afp、flt1、eng、pappa、pgf、lgals13和lgals14——的小组,通过定量免疫细胞化学来分析从已知自然流产的8名患者和无并发症的足月妊娠的13名患者的妊娠第一个和第二个三个月收集的胎儿绒毛外滋养层细胞。在自然流产患者中,平均孕龄为7.2周,对照患者的平均孕龄为10.9周。自然流产患者相比对照患者,观察到eng、flt-1和afp显著升高,并且lgals14显著降低(表ii)。在自然流产患者中,妊娠早期胎儿绒毛外滋养层细胞中具有明显的异常蛋白表达。
表ii详述了在具有正常妊娠结果的患者(对照)中和具有自然流产的患者中蛋白生物标记的表达。示出了平均荧光强度±sem和来自对各蛋白进行的t检验的p值以比较对照组和自然流产患者组。
条目
1.测定来自胎儿绒毛外滋养层细胞的rna的方法,包括:
从妊娠受试者获得母体子宫颈内样品;
从所述母体子宫颈内样品中移除胎儿绒毛外滋养层细胞,产生经分离的胎儿绒毛外滋养层细胞;
通过用醛固定剂处理来固定胎儿绒毛外滋养层细胞,产生醛固定的胎儿绒毛外滋养层细胞;
清洗所述醛固定的胎儿绒毛外滋养层细胞或清洗经分离的醛固定的胎儿绒毛外滋养层细胞的裂解物以促使除去由醛固定剂引入的交联,产生经清洗的胎儿绒毛外滋养层细胞或经清洗的裂解物;
从经清洗的胎儿绒毛外滋养层细胞或经清洗的裂解物中提取胎儿绒毛外滋养层细胞rna;以及
测定所述胎儿绒毛外滋养层细胞rna以确定胎儿绒毛外滋养层细胞rna的一个或更多个特征。
2.条目1的方法,其中所述用醛固定剂处理在从母体子宫颈内样品中移除胎儿绒毛外滋养层细胞之前和/或之后进行。
3.条目1的方法,其中在从妊娠受试者获得样品之后立即固定所述母体子宫颈内样品。
4.条目1-3中任一项的方法,其中在从妊娠受试者获得样品之后立即将所述母体子宫颈内样品在醇固定剂中固定,并且该在醇固定剂中的固定在通过用醛固定剂处理来固定胎儿绒毛外滋养层细胞产生醛固定的胎儿绒毛外滋养层细胞之前进行。
5.条目1-3中任一项的方法,其中在从妊娠受试者获得样品之后立即通过用醛固定剂处理来固定所述母体子宫颈内样品。
6.条目1-5中任一项的方法,其中测定所述胎儿绒毛外滋养层细胞rna的方法包括测序、pcr、定量pcr、实时pcr或其任意两种或更多种的组合。
7.条目1-6中任一项的方法,其中所述妊娠受试者是人。
8.条目1-7中任一项的方法,其中从所述母体子宫颈内样品中移除胎儿绒毛外滋养层细胞的步骤包括使胎儿绒毛外滋养层细胞与特异地针对胎儿绒毛外滋养层细胞的抗体接触,其中所述抗体不与所述母体子宫颈内样品中的母体细胞结合。
9.条目1-8中任一项的方法,其中所述特异地针对胎儿绒毛外滋养层细胞的抗体连接于支持体。
10.条目1-9中任一项的方法,其中没有蛋白a或蛋白g连接于支持体。
11.条目1-10中任一项的方法,其中所述支持体是多个磁性颗粒。
12.条目1-11中任一项的方法,其中从所述母体子宫颈内样品中移除胎儿绒毛外滋养层细胞的步骤包括将磁性颗粒暴露于磁体。
13.条目1-12中任一项的方法,其中所述母体子宫颈内样品未用溶粘蛋白剂处理。
14.测定胎儿绒毛外滋养层细胞的方法,包括:
从妊娠受试者获得母体子宫颈内样品;
将所述母体子宫颈内样品与第一抗体接触,所述第一抗体特异地针对胎儿绒毛外滋养层细胞,其中所述第一抗体不与所述母体子宫颈内样品中的母体细胞结合;
使所述母体子宫颈内样品与一种或更多种另外的抗体接触,其中采用不同的标签可区分地标记所述第一抗体和每种另外的抗体,所述不同的标签可通过电感耦合等离子体质谱检测;
将所述母体子宫颈内样品喷成雾状以分离细胞;以及
对所述细胞进行电感耦合等离子体质谱,从而测定胎儿绒毛外滋养层细胞。
15.条目14的方法,其中所述第一抗体特异地针对主要组织相容性复合物i类g(hla-g)。
16.条目14或15的方法,其中所述一种或更多种另外的抗体是特异地针对选自以下的蛋白的抗体:半乳糖凝集素13、半乳糖凝集素14、胎盘生长因子、妊娠相关血浆蛋白a、甲胎蛋白、内皮因子、fms相关酪氨酸激酶1和角蛋白7。
17.条目14-16中任一项的方法,其中所述母体子宫颈内样品未用溶粘蛋白剂处理。
18.条目1-17中任一项的方法,其中在妊娠中受孕后约3周(孕龄5周)或更晚时从妊娠受试者采集母体子宫颈内样品。
18.测定经分离的胎儿绒毛外滋养层细胞的方法,其基本上如本文所述。
19.测定经分离的胎儿绒毛外滋养层细胞rna的方法,其基本上如本文所述。
本说明书中提及的任何专利或公开出版物以引用的方式纳入本文,引用的程度等同于具体且单独地指明各个出版物以引用的方式纳入。
本文当前所述的组合物和方法代表示例性的优选实施方案,并且不意欲限制本发明的范围。本领域技术人员将想到其中的改变和其他用途。可在不偏离权利要求中阐述的本发明的范围的条件下作出这样的改变和其他用途。
- 还没有人留言评论。精彩留言会获得点赞!