使用CRISPR‑CAS系统的多核苷酸扩增的制作方法
本公开内容大体涉及用于扩增多核苷酸的方法,且更具体地涉及使用crispr-cas系统扩增多核苷酸的方法及其应用。
背景
核酸扩增为许多基于核酸的方法诸如核酸测序的关键步骤。目前,使用的大多数核酸扩增方法,例如在下一代测序中用于簇产生的那些,都需要温度循环和流体交换两者。在另一方面,等温扩增可以通过消除温度斜坡(temperatureramp)和平衡时间而是时间和能量有效的。已经开发了几种等温扩增方法,例如基于重组酶聚合酶扩增(rpa)的等温扩增。这些等温扩增系统通常缺乏理想地适于一些应用的期望的速度和效率。此外,一些系统要求另外的酶和试剂,包括atp。因此,本领域对方便、快速和有效的等温核酸扩增方法仍存在需求。本公开内容通过提供使用crispr-cas系统扩增核酸的方法来解决该需求。还提供了相关优势。
成簇的规律间隔的短回文重复(clusteredregularlyinterspacedshortpalindromicrepeats)(crispr)牵涉许多细菌和古生菌(archaea)中保护细胞免受噬菌体和结合型质粒(conjugativeplasmid)影响的干扰途径(marraffini和sontheimer,2010,natrevgenet.11(3):181-190)。crispr由通常起源于噬菌体或质粒dna的相似尺寸的称作间隔子的独特可变dna序列间隔的短重复序列的阵列组成(barrangou等,2007,science315:1709-12;bolotin等,2005,microbiology151:2551-61;mojica等,2005,jmolevol60:174-82)。因此,crispr序列提供过去的感染的适应性遗传记录,并且可以被转录为crisprrna(crrna)-靶向侵入性核酸的小rna(marraffini和sontheimer,2010,natrevgenet11(3):181-190)。crispr通常与编码与crispr相关蛋白的crispr相关(cas)基因缔合。cas蛋白可以提供破坏被crrna靶向的入侵外来核酸的机制。crispr连同cas(crispr相关)基因一起构成提供针对细菌和古生菌的侵入性外来核酸的获得性耐受性的适应性免疫系统(barrangou等,2007,science315:1709-12)。
概述
本公开内容提供了用于扩增多核苷酸的方法,且更具体地涉及使用crispr-cas系统扩增靶dna序列的方法及其应用。
在一方面,本文提供了一种用于扩增靶双链核酸的方法,所述方法包括:(a)提供一种系统,所述系统具有:成簇的规律间隔的短回文重复(crispr)rna(crrna)或其衍生物、以及crispr相关(cas)蛋白或其变体,其中crrna或其衍生物包含与靶双链核酸的第一链的区域互补的靶特异性核苷酸区域;(b)使靶双链核酸与系统接触以形成复合物;(c)使引物与靶双链核酸的第二链杂交,所述引物包含与靶双链核酸的第二链的区域互补的序列,以及(d)使用聚合酶从引物延伸与靶双链核酸的第二链互补的核酸。
在一些实施方案中,本文提供的方法还包括重复步骤(c)至步骤(d)一次或更多次,例如,直至达到期望的扩增程度。在一些实施方案中,本文提供的方法还包括重复步骤(a)至步骤(d)直至达到期望的扩增程度。
在一些实施方案中,本文提供的靶核酸为双链dna(dsdna)。在一些实施方案中,靶核酸为双链rna(dsrna)。
在一些实施方案中,系统为i型crispr-cas系统或其衍生物。在一些实施方案中,系统为ii型crispr-cas系统或其衍生物。在一些实施方案中,系统为iii型crispr-cas系统或其衍生物。
在一些实施方案中,系统还包含反式作用crrna(tracrrna)或其衍生物。在一些实施方案中,crrna或其衍生物为包含与tracrrna多核苷酸融合的crrna多核苷酸的多核苷酸。
在一些实施方案中,靶双链核酸的第一链包含与5’-ngg前间区(protospacer)相邻基序(pam)互补的序列。
在一些实施方案中,靶双链核酸的第一链包含通用序列,并且其中crrna或其衍生物包含与通用序列的区域互补的序列。在一些实施方案中,引物包含通用序列的区域的序列。
在一些实施方案中,通用序列具有seqidno.3的序列。在一些实施方案中,crrna包含seqidno.7的序列。在一些实施方案中,通用序列具有seqidno.5的序列。
在一些实施方案中,通用序列具有seqidno.4的序列。在一些实施方案中,crrna包含seqidno.8的序列。在一些实施方案中,通用序列具有seqidno.6的序列。
在一些实施方案中,cas蛋白或其变体为cas9蛋白或其变体。在一些实施方案中,cas9蛋白包含两个失活的核酸酶结构域。在一些实施方案中,两个失活的核酸酶结构域包含切割与crrna互补的链的结构域中的第一突变以及切割与crrna不互补的链的结构域中的第二突变。在一些实施方案中,第一突变为d10a,且第二突变为h840a。在一些实施方案中,cas蛋白或其变体为级联(cascade)蛋白或其变体。在一些实施方案中,cas蛋白或其变体为cas3蛋白或其变体。
在一些实施方案中,聚合酶为链置换聚合酶。在一些实施方案中,聚合酶选自由以下组成的组:bst、bsu和phi29。
在一些实施方案中,本文提供的方法还包括:在靶核酸和包含转移链的至少一种转座子末端组合物经历转座反应的条件下,将至少一种转座酶和转座子末端组合物应用于包含靶核酸的样品以产生混合物,其中靶核酸被片段化以产生多个靶核酸片段,并将通用引物序列掺入到多个靶核酸片段的每一个中,其中crrna或其衍生物包含与通用引物的区域互补的靶特异性核苷酸区域。
在一些实施方案中,通用引物通过pcr反应被掺入到多个靶核酸片段中。在一些实施方案中,通用引物具有与5’-ngg前间区相邻基序(pam)互补的序列。
在一些实施方案中,通用序列具有seqidno.3的序列。在一些实施方案中,crrna包含seqidno.7的序列。在一些实施方案中,通用序列具有seqidno.5的序列。
在一些实施方案中,通用引物具有seqidno.4的序列。在一些实施方案中,crrna包含seqidno.8的序列。在一些实施方案中,通用序列具有seqidno.6的序列。
在一些实施方案中,两种通用引物被掺入到多个靶核酸片段的每一个的两个末端中。在一些实施方案中,两种通用引物具有seqidno.3和seqidno.4的序列。在一些实施方案中,两种通用引物具有seqidno.5和seqidno.6的序列。
在一些实施方案中,靶双链核酸被线性地扩增。在一些实施方案中,靶双链核酸被指数地扩增。
在一些实施方案中,本文提供了一种用于扩增靶双链核酸的方法,所述方法包括:(a)提供第一系统,所述第一系统具有:第一成簇的规律间隔的短回文重复(crispr)rna(crrna)或其衍生物、以及第一crispr相关(cas)蛋白或其变体,其中所述第一crrna或其衍生物包含与靶双链核酸的第一链的区域互补的靶特异性核苷酸区域;(b)提供第二系统,所述第二系统具有:
第二成簇的规律间隔的短回文重复(crispr)rna(crrna)或其衍生物、以及第二crispr相关(cas)蛋白或其变体,其中所述第二crrna或其衍生物包含与靶双链核酸的第二链的区域互补的靶特异性核苷酸区域;(c)使靶双链核酸与第一系统和第二系统接触;
(d)使第一引物与靶双链核酸的第二链杂交,第一引物包含与靶双链核酸的第二链的区域互补的序列,并使第二引物与靶双链核酸的第一链杂交,第二引物包含与靶双链核酸的第一链的区域互补的序列,以及(e)用一种或更多种聚合酶延伸第一引物和第二引物的3’末端,以产生第一和第二双链靶核酸。在一些实施方案中,本文提供的方法还包括重复步骤(a)和步骤(e)一次或更多次,例如,直至达到期望的扩增程度。
在一些实施方案中,靶核酸为双链dna(dsdna)。在一些实施方案中,靶核酸为双链rna(dsrna)。
在一些实施方案中,第一系统或第二系统为i型crispr-cas系统或其衍生物。在一些实施方案中,第一系统或第二系统为ii型crispr-cas系统或其衍生物。在一些实施方案中,第一系统或第二系统为iii型crispr-cas系统或其衍生物。
在一些实施方案中,第一系统或第二系统还包含反式作用crrna(tracrrna)或其衍生物。在一些实施方案中,第一系统或第二系统的crrna或其衍生物为包含与tracrrna多核苷酸融合的crrna多核苷酸的多核苷酸。在一些实施方案中,靶双链核酸的第一链和第二链包含与5’-ngg前间区相邻基序(pam)互补的序列。
在一些实施方案中,靶双链核酸的第一链包含第一通用序列,并且其中第一系统的crrna或其衍生物包含与第一通用序列的区域互补的序列,并且靶双链核酸的第二链包含第二通用序列,并且其中第二系统的crrna或其衍生物包含与第二通用序列的区域互补的序列。
在一些实施方案中,第一引物包含第一通用序列的区域的序列,且第二引物包含第二通用序列的区域的序列。在一些实施方案中,第一通用序列(其包含第一引物)具有seqidno.3的序列,第一系统的crrna或其衍生物包含seqidno.7的序列,且第一引物包含seqidno.5的序列,并且第二通用序列(其包含第二引物)具有seqidno.4的序列,第二系统的crrna或其衍生物包含seqidno.8的序列,且第二引物包含seqidno.6的序列。
在一些实施方案中,第一系统或第二系统的cas蛋白或其变体为cas9蛋白或其变体。在一些实施方案中,cas9蛋白包含两个失活的核酸酶结构域。在一些实施方案中,两个失活的核酸酶结构域包含切割与crrna互补的链的结构域中的第一突变、以及切割与crrna不互补的链的结构域中的第二突变。在一些实施方案中,第一突变为d10a,且第二突变为h840a。在一些实施方案中,第一系统或第二系统的cas蛋白或其变体为级联蛋白(cascadeprotein)或其变体。在一些实施方案中,第一系统或第二系统的cas蛋白或其变体为cas3蛋白或其变体。
在一些实施方案中,聚合酶为链置换聚合酶。在一些实施方案中,聚合酶选自由以下组成的组:bst、bsu和phi29。
在一些实施方案中,靶核酸为基因组dna。在一些实施方案中,靶核酸包含染色体dna或其片段。在一些实施方案中,靶核酸包括基因组或部分基因组。
在一些实施方案中,本文提供的方法还包括对靶核酸或靶核酸片段测序。在一些实施方案中,测序包括使用合成测序、桥式pcr、链终止测序、杂交测序、纳米孔测序和连接测序中的一个或更多个。
附图简述
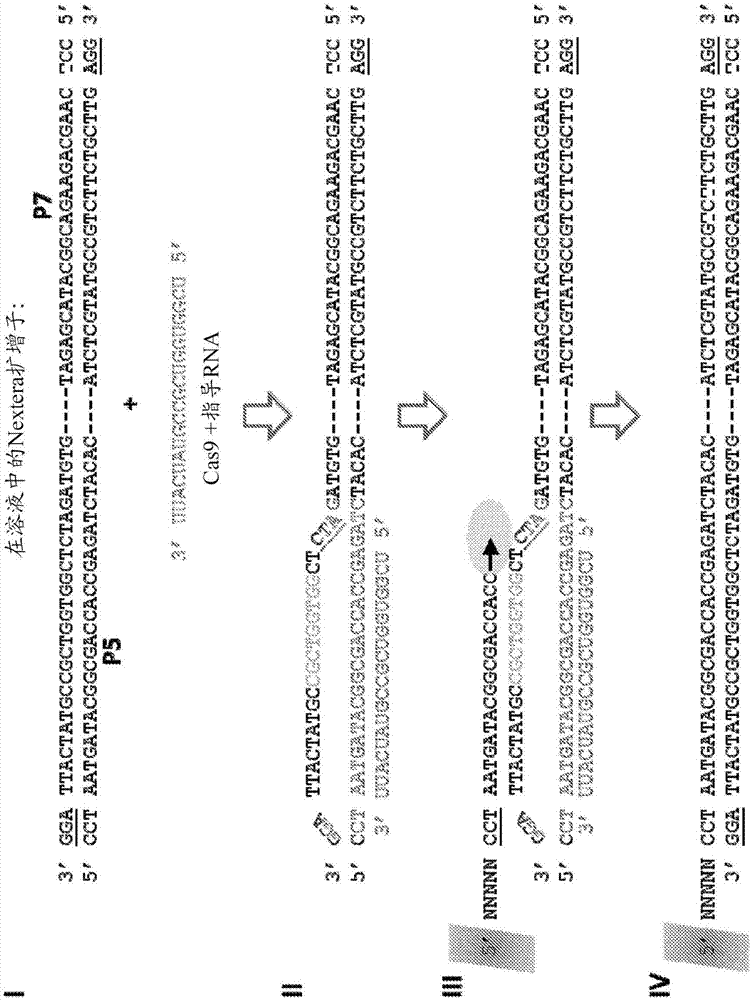
图1a示出了根据本方法设计的用于扩增dna片段的引物,该引物包含illumina通用测序引物衔接子(adaptor)p5和p7的全部或部分。可以使用nextera(illumina,inc.)文库制备方法来添加引物。图1b阐释了使用靶向修饰的p5引物的crrna的一轮cas9介导的线性扩增。2b(i)描绘了具有适当引物序列p5和p7的待扩增dna。与cas9结合的靶向p5的指导rna(guiderna)也显示为p5'。1b(ii)示出了在指导rna与第一链杂交之后由cas9创建的r环。1b(iii)阐释了被固定的p5引物与置换的第二链杂交,随后是聚合酶延伸。1b(iv)示出了所得的被延伸的引物p5。如步骤1b(ii)中示出的,所得到的扩增子可以被cas9+crrna重新靶向。图1c阐释了使用靶向修饰的p7引物的crrna的一轮cas9介导的线性扩增。1c(i)描绘了具有适当引物序列p5和p7的待扩增dna。与cas9结合的靶向p7的指导rna也显示为p7'。1c(ii)示出了在指导rna与第一链杂交之后由cas9创建的r环。1c(iii)阐释了被固定的p7引物与置换的第二链杂交,随后是聚合酶延伸。1c(iv)示出了所得的被延伸的引物p7。如步骤1c(ii)中示出的,所得到的扩增子可以被cas9+crrna重新靶向。随着扩增子的两侧经历扩增(图1b和1c),可以实现指数扩增。
详细描述
本公开内容提供了使用crispr-cas系统快速且有效扩增靶核酸的方法。
核酸扩增是许多基于核酸的方法诸如下一代测序测序的一个步骤。目前,聚合酶链式反应(pcr)为用于,例如检测和鉴定传染病、遗传性疾患和其他研究目的dna扩增的最广泛使用的方法。pcr反应通常使用与双链体靶核酸序列的3’末端杂交的两个寡核苷酸引物和可以通过添加脱氧核糖核苷三磷酸(dntp)来延伸退火的引物以产生双链核酸产物的dna聚合酶。gill和ghaemi,nucleosides,nucleotides,和nucleicacids,2008,27:224-243。然而,pcr反应需要热循环以分离两条dna链。类似地,许多目前使用的核酸扩增方法,例如在下一代测序中用于簇产生的那些,都需要温度循环和流体交换两者。
已经开发了几种等温扩增方法,以消除温度斜坡和平衡时间,诸如在gill和ghaemi,nucleosides、nucleotides、和nucleicacids,2008,27:224-243中描述的基于重组酶聚合酶扩增(rpa)的等温扩增、转录介导的扩增、基于核酸序列的扩增、信号介导的rna扩增、链置换扩增、滚环扩增、环介导的dna扩增、等温多重置换扩增、解旋酶依赖性扩增、单引物等温扩增和环状解旋酶依赖性扩增(circularhelicase-dependentamplification)。
例如,在转录介导的扩增(tma)中,rna聚合酶用于由构建在引物区域中的启动子制备rna,并且然后逆转录酶由该引物合成cdna。然后,可以使用第三种酶,例如,核糖核酸酶h,以降解来自cdna的靶rna而无需热变性步骤。这种扩增技术非常类似于自持续序列复制(self-sustainedsequencereplication)(3sr)和基于核酸序列的扩增(nasba),但采用的酶不同。同上。另举例,解旋酶依赖性扩增(hda)利用热稳定解旋酶(tte-uvrd)而不加热来解开dsdna以创建单链,然后该单链可用于通过聚合酶杂交和延伸引物。已显示,扩增长度为70-120个碱基对的产物的反应时间超过1小时。同上。又另举例,环介导的扩增(lamp)采用具有链置换能力的热稳定聚合酶和一组四种或更多种特别设计的引物。每一种引物被设计为具有发夹末端,在被置换后[li1][li2]扣成发夹(snapintoahairpin)以促进自引发和进一步的聚合酶延伸。在lamp反应中,尽管反应在等温条件下进行,但双链靶需要初始热变性步骤。另外,扩增产生梯形模式的各种长度的产物。同上。又另举例,链置换扩增(sda)结合了限制性内切核酸酶使其靶dna的未修饰的链缺口的能力与外切核酸酶缺陷型dna聚合酶在切口处延伸3’末端并置换下游dna链的能力。同上。其他示例性等温扩增方法包括,但不限于,以下中描述的那些:craw和balachandran,labchip,2012,12:2469-2486。
然而,这些目前开发的等温扩增系统通常缺乏理想地适于一些应用的期望的速度和效率。此外,一些系统要求另外的酶和试剂,包括atp。因此,本领域对方便、快速和有效的等温核酸扩增方法仍存在需求。本公开内容通过提供使用crispr-cas系统扩增核酸的方法来解决该需求。例如,本方法提供的一个优势为,cas蛋白识别靶核酸而不需要消耗atp或能量投入,并且因此本文中的方法提供了成本和时间上有效的等温扩增方法。
定义
如本文使用的,术语“包括(includes)”、“包括(including)”、“包括(includes)”、“包括(including)”、“包含(contains)”、“包含(containing)”、“具有(have)”、“具有(having)”及其任何词形变化被旨在覆盖非排除性包含对象,以使得包括(includes)、包括(includes)或包含(contains)一个要素或要素列表的所述及的方法(process)、方法(method)、方法限定的产品或组合物不仅包括那些元素,还可包括未明确列出的其他要素或对于所述及的此类方法(process)、方法(method)、方法限定的产品或组合物而言是固有的其他元素。
如本文使用的,除非上下文另外清楚指明,否则单数形式"一(a)"、"一(an)"和"该(the)"包括复数指代物。因此,例如,提及“一种蛋白”包括两种或更多种蛋白的混合物等。
如本文使用的,术语“约”或“大约”意指在给定的值或范围的5%以内。
如本文使用的,术语“核酸”意指核苷酸单体的单链聚合物和双链聚合物,包括通过核苷酸间磷酸二酯键键合或核苷酸间类似物连接的2’-脱氧核糖核苷酸(dna)和核糖核苷酸(rna),以及缔合的抗衡离子,例如h+、nh4+、三烷基铵、四烷基铵、mg2+、na+等。核酸可以为多核苷酸或寡核苷酸。核酸可完全由脱氧核糖核苷酸,完全由核糖核苷酸构成,或可以是其嵌合混合物。核苷酸单体单位可以包括本文描述的任何核苷酸,包括但不限于天然存在的核苷酸和核苷酸类似物。核酸的尺寸范围通常从几个单体单元例如5-40个到几千个单体核苷酸单元。核酸包括但不限于基因组dna、cdna、hnrna、mrna、rrna、trna、片段化的核酸、从亚细胞细胞器诸如线粒体或叶绿体获得的核酸、以及从可能存在于生物样品上或生物样品中的微生物或dna或rna病毒获得的核酸。
如本文使用的,术语“靶核酸”被旨在意指为分析或作用的目标物的核酸。分析或作用包括使核酸经历拷贝、扩增、测序和/或用于核酸询问(interrogation)的其他程序。靶核酸可以包括除了待被分析的靶序列以外的核苷酸序列。例如,靶核酸可以包含一个或更多个衔接子(adapter),包括在待被分析的靶核酸序列的侧翼作为引物结合位点发挥作用的衔接子。与捕获寡核苷酸或捕获引物杂交的靶核酸可以包含延伸超过捕获寡核苷酸的5'或3'末端的核苷酸,这种方式使得并不是所有的靶核酸都适于延伸。
如本文使用的术语“靶特异性”当提及指导rna、crrna或其衍生物或其他核苷酸使用时,旨在意指这样的多核苷酸,其包含对靶多核苷酸序列特异性的核苷酸序列,即能够选择性退火至靶多核苷酸(例如,靶dna)的鉴定区域的核苷酸序列。靶特异性核苷酸可以具有单一种类的寡核苷酸,或者靶特异性核苷酸可以包括具有不同序列的两个或更多个种类的寡核苷酸。因此,靶特异性核苷酸可以为两种或更多种序列,包括3种、4种、5种、6种、7种、8种、9种或10种或更多种不同的序列。在一个实施方案中,crrna或其衍生物包含与靶dna序列的区域互补的靶特异性核苷酸区域。在一个实施方案中,crrna或其衍生物可以包含除靶特异性核苷酸区域以外的其他核苷酸序列。在一个实施方案中,其他核苷酸序列可以来自tracrrna序列。
如本文使用的,当提及多核苷酸使用时,术语“互补”旨在意指包括能够在某些条件下选择性退火至靶多核苷酸的鉴定区域的核苷酸序列的多核苷酸。如本文使用的,术语“基本上互补”和语法等同物旨在意指包括能够在某些条件下特异性退火至靶多核苷酸的鉴定区域的核苷酸序列的多核苷酸。退火指一种核酸与另一种核酸的核苷酸碱基配对相互作用,该相互作用导致形成双链体、三链体或其他更高等级的结构。通过沃森-克里克(watson-crick)和hoogsteen型氢键键合,主要的相互作用通常为核苷酸碱基特异性的,例如,a:t、a:u、和g:c。在某些实施方案中,碱基堆积和疏水相互作用也可以有助于双链体稳定性。多核苷酸与靶核酸的互补或基本上互补的区域退火的条件为本领域熟知的,例如,如在以下中描述的条件:nucleicacidhybridization,apracticalapproach,hames和higgins,编著,irlpress,washington,d.c.(1985)以及wetmur和davidson,mol.biol.31:349(1968)。退火条件将取决于特定应用,并且可以由本领域技术人员常规地确定,而无需过度的实验。
如本文使用的,术语“杂交”指两个单链多核苷酸非共价结合以形成稳定的双链多核苷酸的过程。所得的双链多核苷酸为“杂交体(hybrid)”或“双链体”。杂交条件通常将包括小于约1m,更通常地小于约500mm,并且可以小于约200mm的盐浓度。杂交缓冲液包括缓冲盐溶液诸如5%sspe或本领域已知的其他此类缓冲液。杂交温度可以低至5℃,但通常大于22℃,且更通常大于约30℃,且通常超过37℃。杂交通常在严格条件,即探针将与其靶序列杂交,但将不与其他非互补序列杂交的条件下进行。严格条件为序列依赖性的,并且在不同情况下为不同的,并且可以由本领域技术人员常规地确定。
在“多核苷酸”的上下文中,如本文使用的术语“变体”和“衍生物”指这样的多核苷酸,其包含通过引入核苷酸取代、缺失或添加而改变的多核苷酸的核苷酸序列或多核苷酸片段。多核苷酸的变体或衍生物可以为包含多核苷酸的核苷酸序列的一部分的融合多核苷酸。如本文使用的术语“变体”或“衍生物”还指例如,通过任何类型的分子与多核苷酸共价附接而被化学修饰的多核苷酸或其片段。例如,但不限于,多核苷酸或其片段可以化学修饰,例如通过乙酰化、磷酸化、甲基化等等。变体或衍生物被以在附接的分子的类型或位置不同于天然存在的或起始核苷酸或多核苷酸的方式被修饰。变体或衍生物还包括天然存在于核苷酸或多核苷酸上的一个或更多个化学基团的缺失。多核苷酸或多核苷酸片段的变体或衍生物可以使用本领域技术人员已知的技术,包括,但不限于特异性化学切割、乙酰化、甲酰化等等通过化学改变而化学修饰。此外,多核苷酸或多核苷酸片段的变体或衍生物可以包含一个或更多个dntp或核苷酸类似物。多核苷酸变体或衍生物可以具有与本文描述的多核苷酸或多核苷酸片段相似或相同的功能。与本文描述的多核苷酸或多核苷酸片段相比,多核苷酸变体或衍生物可以具有另外或不同的功能。
如本文使用的,术语“dntp”指脱氧核苷三磷酸。ntp指核糖核苷三磷酸,诸如用于合成crrna或tracrrna的那些。嘌呤碱基(pu)包括腺嘌呤(a)、鸟嘌呤(g)及其衍生物和类似物。嘧啶碱基(py)包括胞嘧啶(c)、胸腺嘧啶(t)、尿嘧啶(u)及其衍生物和类似物。通过说明而非限制的方式,此类衍生物或类似物的实例为用报告基团修饰的、生物素化的、胺修饰的、放射性标记的、烷基化等修饰的那些衍生物或类似物,并且还包括硫代磷酸酯、亚磷酸酯、环原子修饰的衍生物等。报告物基团可以为荧光基团诸如荧光素、化学发光基团诸如鲁米诺,铽螯合物诸如能够通过延迟荧光检测的n-(羟乙基)乙二胺三乙酸等。
如本文使用的,术语“核苷酸类似物”指具有修饰的核苷酸碱基部分、修饰的戊糖部分和/或修饰的磷酸部分的合成类似物,并且在多核苷酸的情况下,修饰的核苷酸间键合,如其他地方通常描述的(例如,scheit,nucleotideanalogs,johnwiley,newyork,1980;englisch,angew.chem.int.ed.engl.30:613-29,1991;agarwal,protocolsforpolynucleotidesandanalogs,humanapress,1994;以及s.verma和f.eckstein,ann.rev.biochem.67:99-134,1998)。示例性磷酸酯类似物包括但不限于硫代磷酸酯、二硫代磷酸酯、硒代磷酸酯(phosphoroselenoate)、二硒代磷酸酯(phosphorodiselenoate)、phosphoroanilothioate、phosphoranilidate、氨基磷酸酯(phosphoramidate)、二羟硼基磷酸酯(boronophosphate),包括缔合的抗衡离子,例如h+、nh4+、na+(如果存在此类抗衡离子)。示例性修饰的核苷酸碱基部分包括但不限于5-甲基胞嘧啶(5mc);c-5-丙炔基类似物,包括但不限于c-5丙炔基-c和c-5丙炔基-u;2,6-二氨基嘌呤,也称为2-氨基腺嘌呤或2-氨基-da);次黄嘌呤,假尿苷,2-硫代嘧啶(2-thiopyrimidine),异胞嘧啶(isoc),5-甲基isoc和异鸟嘌呤(isog;参见,例如,美国专利号5,432,272)。示例性修饰的戊糖部分包括但不限于,锁核酸类似物包括但不限于bz-a-lna、5-me-bz-c-lna、dmf-g-lna、和t-lna(参见,例如,theglenreport,16(2):5,2003;koshkin等,tetrahedron54:3607-30,1998)和2’-或3’-修饰,其中2’-或3’-位为氢、羟基、烷氧基(例如,甲氧基、乙氧基、烯丙氧基(allyloxy)、异丙氧基、丁氧基、异丁氧基(isobutoxy)和苯氧基)、叠氮基、氨基、烷基氨基、氟代、氯代或溴代。修饰的核苷酸间键合包括磷酸酯类似物,具有非手性和不带电荷的亚基间键合的类似物(例如,sterchak,e.p.等,organicchern.,52:4202,1987)和具有非手性亚基间键合的不带电荷的基于吗啉的聚合物(参见,例如,美国专利号5,034,506)。一些核苷酸间键合类似物包括morpholidate、缩醛和聚酰胺连接的杂环。
如本文使用的术语“聚合酶链式反应”或“pcr”指其中少量核酸例如,rna和/或dna被扩增的程序,如例如在属于mullis的美国专利号4,683,195中描述的。通常,来自感兴趣区域末端或以外的序列信息需要是可获得的,使得可以设计寡核苷酸引物;这些引物在序列上将与待扩增的模板的相对链相同或相似。两个引物的5’末端核苷酸可以与扩增的材料的末端一致。pcr可以用于扩增特定rna序列、来自总基因组dna的特定dna序列、以及从总细胞rna转录的cdna、噬菌体或质粒序列等等。一般参见mullis等,coldspringharborsymp.quant.biol.,51:263(1987);erlich,编著,pcrtechnology,(stocktonpress,ny,1989)。
如本文使用的,术语“连接(ligation)”、“连接(ligating)”及其语法等同物旨在意指通常在模板驱动反应中在两个或更多个核酸(例如,寡核苷酸和/或多核苷酸)的末端之间形成共价键或键合。键或键合的性质可以广泛变化,且连接可以通过酶法或化学法进行。如本文使用的,连接通常通过酶法进行以在一个寡核苷酸的5’碳末端核苷酸与另一个核苷酸的3'碳之间形成磷酸二酯键合。模板驱动的连接反应在以下参考文献中被描述:美国专利号4,883,750;5,476,930;5,593,826;和5,871,921,通过引用以其整体并入本文。术语“连接”还包括磷酸二酯键的非酶促形成、以及寡核苷酸的末端之间的非磷酸二酯共价键的形成,诸如硫代磷酸酯键、二硫键等。
如本文使用的,术语“衔接子”为可以与其他核酸的末端连接的单链或双链核酸分子。在一个实施方案中,衔接子为短的化学合成的可以用于连接两个其他核酸分子的末端的双链核酸分子。在一个实施方案中,衔接子为在5’和/或3’末端包含单链核苷酸突出端的双链核酸(例如寡核苷酸)。在一些实施方案中,单-链突出端为1个、2个或更多个核苷酸。在一些实施方案中,衔接子包含用于克隆或分析“插入物(inserts)”的另外的核酸序列。在一些实施方案中,衔接子包括用于分析或纯化“插入物”的标记物或亲和标签。术语“插入物”指感兴趣的核酸序列。在一些实施方案中,插入物为在5’末端和/或3’末端包含单链核苷酸突出端的双链dna。在一些实施方案中,单链突出端为1个、2个或更多个核苷酸。
如本文使用的,术语“crispr-cas系统”指包括包含与靶多核苷酸的区域互补或基本上互补的核苷酸序列的指导rna序列和具有核酸酶活性的蛋白质的酶系统。crispr-cas系统包括i型crispr-cas系统、ii型crispr-cas系统、iii型crispr-cas系统及其衍生物。crispr-cas系统包括源自天然存在的crispr-cas系统的工程化和/或编程的核酸酶系统。crispr-cas系统可以包含工程化和/或突变的cas蛋白。crispr-cas系统可以包含工程化和/或编程的指导rna。
如本文使用的,术语“指导rna”指包含与靶dna序列的区域互补或基本上互补的序列的rna。指导rna可以包含除了与靶dna序列的区域互补或基本互补的区域以外的核苷酸序列。指导rna可以为crrna或其衍生物,例如,crrna:tracrrna嵌合体。
如本文使用的,术语“核酸酶”指能够切割核酸的核苷酸亚基之间的磷酸二酯键的酶;术语“内切核酸酶”指能够切割多核苷酸链内的磷酸二酯键的酶;且术语“切口酶”指仅切割dna双链体的单链的内切核酸酶。术语“cas9切口酶”指通常通过使cas9蛋白的一个核酸酶结构域失活的从cas9蛋白获得的切口酶。
在多肽的上下文中,如本文使用的术语“变体”和“衍生物”指包含已经通过引入氨基酸残基取代、缺失或添加而被改变的多肽或多肽片段的氨基酸序列的多肽。多肽的变体或衍生物可以为包含多肽的氨基酸序列的一部分的融合蛋白。如本文使用的术语“变体”或“衍生物”还指例如,通过任何类型的分子与多肽共价附接而被化学修饰的多肽或多肽片段。例如,但非限制性地,多肽或多肽片段可以被化学修饰,例如,通过糖基化、乙酰化、聚乙二醇化、磷酸化、酰胺化,通过已知保护/封闭基团的衍生化、蛋白水解切割、与细胞配体或其他蛋白键合等等。变体或衍生物以在附接的分子的类型或位置上不同于天然存在的或起始的肽或多肽的方式进行修饰。变体或衍生物还包括天然存在于肽或多肽上的一个或更多个化学基团的缺失。多肽或多肽片段的变体或衍生物可以使用本领域技术人员已知的技术通过化学修饰被化学修饰,本领域技术人员已知的技术包括,但不限于特异性化学切割、乙酰化、甲酰化、衣霉素的代谢合成等等。此外,多肽或多肽片段的变体或衍生物可以包含一种或更多种非经典氨基酸。多肽变体或衍生物可以具有与本文描述的多肽或多肽片段相似或相同的功能。与本文描述的多肽或多肽片段相比,多肽变体或衍生物可以具有另外或不同的功能。
如本文使用的,术语“检测”核酸分子或其片段指通常当核酸分子或其片段与样品或组合物的其他组分完全或部分分离时,确定核酸分子的存在,并且还可以包括确定核酸分子或其片段的荷质比(charge-to-massratio)、质量、量、吸光度、荧光或其他性质。
如本文使用的,术语“引物”指当被置于引物延伸(不限于延伸碱基的数目)被启动的条件下时能够充当核酸合成的起始点的天然或合成的寡核苷酸引物。引物可以为单链寡脱氧核糖核苷酸。引物的长度范围可以从约10个至50个核苷酸,例如10个、11个、12个、13个、14个、15个、16个、17个、18个、19个、20个、21个、22个、23个、24个、25个、26个、27个、28个、29个、30个、31个、32个、33个、34个、35个、36个、37个、38个、39个、40个、41个、42个、43个、44个、45个、46个、47个、48个、49个或50核苷酸。引物不需要反映模板的准确序列,但必须充分互补,以与模板杂交,以便引物延伸发生。如果期望的话,可以通过例如光谱学、光化学、生物化学、免疫化学或化学手段(means)通过掺入可检测的标记物来标记引物。示例性标记物包括,但不限于生物素、胺、放射性标记物(例如,32p)、荧光染料、电子致密试剂、酶(通常用于elisas)或生物素。
如本文使用的,术语“线性扩增”指使用多个循环的引物延伸反应扩增靶核酸的扩增过程。随着线性扩增,转录物的丰度随循环数目成比例增加并线性放大。线性扩增程序的实例为lcr、上文的phillips和eberwine的arna方法、以及本文描述的线性扩增方法。与指数扩增不同,扩增产物的量不呈指数增长。例如,在拷贝比率为2000个拷贝/分钟的理想的4小时线性扩增反应中,2000个拷贝的模板dna将产生960,000,000个拷贝。
如本文使用的,术语“指数扩增”指其中产物(即,扩增子)随每个反应循环加倍的扩增程序。“指数扩增”为非线性扩增,其导致存在的核酸拷贝数目呈指数增长。例如,当在一个扩增循环中引物延伸起始于扩增子的两端时,指数扩增可以发生。例如,pcr为指数扩增程序。例如,在具有30个循环的理想pcr反应中,2个拷贝的模板dna将产生2^30或1,073,741,824个拷贝。
如本文使用的,术语“聚合酶”指能够催化核苷酸的特异性掺入以针对核酸靶序列延伸引物分子(诸如,例如,模板寡核苷酸)的3’羟基末端的蛋白。聚合酶可以为例如嗜热的,使得其在升高的反应温度下是有活性的。例如,它也可以具有链置换能力。
扩增多核苷酸的方法
在一方面,本公开内容提供了一种用于crispr-cas系统介导的扩增的方法。本文提供的方法部分地基于指导rna与靶双链核酸的区域的结合破坏靶核酸的两条链之间的相互作用,并且从而创建环结构(也称为“r-环“),暴露与指导rna不互补的链。该暴露的链可以经历与引物杂交,以便例如,在核酸扩增过程中通过合适的聚合酶延伸。如实施例1中阐释的,由crispr-cas系统(例如包含cas9或级联蛋白的系统)创建的该环结构可以被其他酶接近。因此,环结构可以进一步用作模板以启动引物杂交并与聚合酶相互作用以用于扩增。
在一些实施方案中,本公开内容提供了一种用于扩增靶双链核酸的方法,所述方法包括提供一种系统,所述系统具有:成簇的规律间隔的短回文重复(crispr)rna(crrna)或其衍生物、以及crispr相关(cas)蛋白或其变体,其中crrna或其衍生物包含与靶双链核酸的第一链的区域互补的靶特异性核苷酸区域;使靶双链核酸与系统接触以形成复合物;使引物与靶双链核酸的第二链杂交,所述引物包含与靶双链核酸的第二链的区域互补的序列,以及使用聚合酶从引物延伸与靶双链核酸的第二链互补的核酸。
本文提供的方法可以用于多种扩增方法,包括但不限于,线性核酸扩增和指数核酸扩增。
在一些实施方案中,根据本文提供的方法线性扩增靶核酸。例如,在一些实施方案中,本文提供的方法还包括重复以下一次或更多次,例如直至实现期望的扩增量:使引物与靶双链核酸的第二链杂交,并使用聚合酶从引物延伸与靶双链核酸的第二链互补的核酸。
在其他实施方案中,靶核酸被指数地扩增。在示例性指数核酸扩增中,产物(即,扩增子)随每个反应循环加倍。“指数扩增”为非线性扩增,其导致存在的核酸拷贝数目呈指数增长。通常,在指数扩增中,引物延伸(或拷贝)从扩增子的两端发生。为了确保新创建的链在两个末端具有引物结合位点,在指数扩增中,新合成的核酸的3’末端包含引物的反向互补物,并且模板的末端通常在每一个扩增循环中被拷贝。
根据本方法的反应的循环数目取决于应用和期望的扩增产物量。在一些实施方案中,循环数目为5至100。在一些实施方案中,循环数目为10至90。在一些实施方案中,循环数目为20至80。在一些实施方案中,循环数目为30至70。在一些实施方案中,循环数目为40至60。示例性循环数目包括10、15、20、25、30、35、40、45和50。循环不需要在扩增子之间同步,因为它们处于其中通过改变温度来控制每一个循环的发动的pcr反应中。因此,如本文使用的循环指扩增子经历的扩增轮的平均数目。
在一些实施方案中,初始化步骤包括向靶核酸提供多个crispr-cas系统,以在两个或更多个靶向序列处打开双链核酸结构并形成两个或更多个r环结构。初始化步骤不要求如pcr反应中需要的加热反应,因为该初始化步骤是酶驱动的。根据本方法的下一步骤牵涉提供靶向r环区域的引物并退火引物以形成相对稳定的核酸-核酸相互作用,例如,dna-dna杂交体。通常,当引物序列具有模板序列的基本互补性时,形成稳定的核酸-核酸杂交体。然后一种或更多种聚合酶结合引物-模板杂交体,并在延伸(extension)/延长(elongation)步骤中开始核酸合成。在一些实施方案中,该延伸/延长步骤的温度取决于所使用的聚合酶。在该步骤时,通过添加与模板互补的dntp,聚合酶合成与模板链互补的新的核酸链。在一些实施方案中,当使用dna聚合酶时,反应将dntp的5’-磷酸基团与新生(延伸的)dna链的末端处的3’-羟基基团缩合。延伸时间取决于所使用的聚合酶和待扩增的核酸片段的长度两者。这些步骤的一个或更多个可以重复一次或更多次,例如,直至实现期望的扩增量。
为了允许扩增产物的指数生长,在每一个循环中新创建的核酸产物在两个末端包含引物结合位点是有利的。在一些实施方案中,新合成的分子的3’末端为引物的反向补体。在一些实施方案中,各自靶向靶核酸的一个末端的两条引物可以用于指数扩增。在一些实施方案中,引物以这样的方式设计是有益的:其可以被本文提供的crispr-cas系统靶向-即引物可以被crispr-cas系统的指导rna,例如,crrna靶向使得crispr-cas系统可被重复地用于结合靶核酸以启动新一轮扩增。
因此,在一些实施方案中,两个或更多个crispr-cas系统用于启动引物在靶核酸两个末端处结合。在一些实施方案中,本文提供了一种用于扩增靶双链核酸的方法,所述方法包括:(a)提供第一系统,所述第一系统具有:第一成簇的规律间隔的短回文重复(crispr)rna(crrna)或其衍生物,以及第一crispr相关(cas)蛋白或其变体,其中第一crrna或其衍生物包含与靶双链核酸的第一链的区域互补的靶特异性核苷酸区域;(b)提供第二系统,所述第二系统具有:第二成簇的规律间隔的短回文重复(crispr)rna(crrna)或其衍生物,以及第二crispr相关(cas)蛋白或其变体,其中第二crrna或其衍生物包含与靶双链核酸的第二链的区域互补的靶特异性核苷酸区域;(c)使靶双链核酸与第一系统和第二系统接触;(d)使第一引物与靶双链核酸的第二链杂交,第一引物包含与靶双链核酸的第二链的区域互补的序列,并使第二引物与靶双链核酸的第一链杂交,第二引物包含与靶双链核酸的第一链的区域互补的序列,和(e)用一种或更多种聚合酶延伸第一引物和第二引物引物的3’末端,以产生第一和第二双链靶核酸。在一些实施方案中,引物杂交通过聚合酶的延伸步骤被重复一次或更多次,例如,直至达到期望的扩增程度。
在其他实施方案中,本文提供的方法用于多重扩增。如本文使用的,术语“多重扩增”指多于一个感兴趣的核酸的扩增,例如对来自同一样品的多个序列的扩增。术语“多重扩增”还指同时或以逐步扩增的方式扩增存在于多个样品中的一个或多个序列。因此,在一些实施方案中,在扩增反应中扩增两种或更多种靶核酸序列,并且扩增反应包含适当的模板和酶以扩增至少两种靶核酸序列。本文提供的多重扩增的一个应用为检测样品中的两种或更多种靶序列,因为多重扩增能够扩增两种或更多种靶序列。当靶序列中仅一种实际上存在于受试样品中时,多重扩增的结果可能是对存在的仅一种序列的扩增。多重扩增可以利用相同的引物对来扩增一种或更多种间插(intervening)扩增子序列。可选择地,多重扩增可以利用一个或更多个引物对。
在一些实施方案中,本文提供的双链核酸为双链dna。在其他实施方案中,本文提供的双链核酸为双链rna。在一些实施方案中,靶核酸为基因组dna。在其他实施方案中,靶核酸包含染色体dna或其片段。又在其他实施方案中,靶核酸包括基因组或部分基因组。
在一些实施方案中,本文提供的系统源自crispr-cas系统。crispr-cas系统通常可以分为三种主要类型(i-iii型),其基于核心元件含量和序列被进一步细分为十个亚型(makarova等,2011,natrevmicrobiol9:467-77)。这些crispr-cas系统的两个关键元件为cas蛋白和crisprrna(crrna)。crrna由散布着源自侵入dna的间隔区序列的短重复序列组成。cas蛋白具有多种活性,例如核酸酶活性。因此,crispr-cas系统提供了靶向特定序列以及对该序列的某些酶活性的机制。
典型的i型crispr-cas系统包含具有独立解旋酶和dna酶活性的cas3蛋白。例如,在i-e型系统中,将crrna掺入到称为级联体的多亚基效应复合物(用于抗病毒防御的crispr相关复合物)(brouns等,2008,science321:960-4),其结合靶dna并通过cas3蛋白触发降解(sinkunas等,2011,emboj30:1335-1342;beloglazova等,2011,emboj30:616-627)。
ii型crispr-cas系统包括签名cas9蛋白,一种能够产生crrna并切割靶dna的蛋白(约160kda)。cas9蛋白通常包含两个核酸酶结构域,氨基末端附近的ruvc样核酸酶结构域和蛋白中间附近的hnh(或mcra样)核酸酶结构域。cas9蛋白的每一个核酸酶结构域专门用于切割双螺旋的一条链(jinek等,2012,science337(6096):816-821)。
iii型crispr-cas系统包含聚合酶和ramp模块。iii型系统可以被进一步分为iii-a和iii-b亚型。已经显示iii-a型crispr-cas系统靶向质粒,且iii-a型系统的聚合酶样蛋白牵涉靶dna的切割(marraffini和sontheimer,2008,science322:1843–1845)。还显示iii-b型crispr-cas系统靶向rna(hale等,2009,cell139:945–956)。
因此,在一些实施方案中,所述系统为i型crispr-cas系统或其衍生物。在其他实施方案中,所述系统为ii型crispr-cas系统或其衍生物。又在其他实施方案中,所述系统为iii型crispr-cas系统或其衍生物。
crispr-cas系统的关键要素包括指导rna,例如crrna和cas蛋白。crrna或其衍生物包含与靶核酸的区域互补或基本上互补的靶特异性核苷酸区域。在一些实施方案中,crrna或其衍生物包含允许酶特异性靶向互补双链dna的使用者可选择的rna序列。在一些实施方案中,使用者可选择的rna序列包含与靶dna序列的区域互补或基本上互补的20-50个核苷酸。在一些实施方案中,使用者可选择的rna序列包含与靶dna序列的区域互补或基本上互补的小于20个核苷酸。示例性使用者可选择的rna序列包含与靶dna序列的区域互补或基本上互补的1个、2个、3个、4个、5个、6个、7个、8个、9个、10个、11个、12个、13个、14个、15个、16个、17个、18个、或19个核苷酸。在一些实施方案中,crrna的靶特异性核苷酸区域具有与靶核酸的区域100%碱基对匹配。在一些实施方案中,crrna的靶特异性核苷酸区域具有与靶核酸的区域90%-100%、80%-100%、或70%-100%碱基对匹配。在一些实施方案中,在crrna的靶特异性核苷酸区域和靶核酸的区域之间存在一个碱基对错配。在一些实施方案中,在crrna的靶特异性核苷酸区域和靶核酸的区域之间存在两个碱基对错配。在一些实施方案中,在crrna的靶特异性核苷酸区域和靶核酸的区域之间存在三个碱基对错配。在一些实施方案中,在crrna的靶特异性核苷酸区域和靶核酸的区域之间存在四个碱基对错配。在一些实施方案中,在crrna的靶特异性核苷酸区域和靶核酸的区域之间存在五个碱基对错配。
在一些实施方案中,本文提供的系统还包括反式作用crrna(tracrrna)或其衍生物。
本文提供的crispr-cas系统包括源自天然存在的crispr-cas系统的工程化和/或编程的核酸酶系统。crispr-cas系统可以包括包含工程化和/或突变的cas蛋白。crispr-cas系统还可以包含工程化和/或编程的指导rna。在一些实施方案中,本文提供的crrna或其衍生物为具有与tracrrna多核苷酸融合的crrna多核苷酸的多核苷酸。在以其整体并入本文的jinek等,2012,science337,816-821中描述了嵌合的单一指导rna(sgrna)。在一个实施方案中,本文提供的cas蛋白或其变体可以通过嵌合sgrna被引导至后面是5’-ngg前间区相邻基序(pam)的任何基因组基因座。例如,在一些实施方案中,使用包含t7启动子的合成双链dna模板,通过体外转录合成crrna和tracrrna。tracrrna具有固定的序列,而靶序列指示crrna序列的一部分。将等摩尔浓度的crrna和tracrrna混合并在55℃加热30秒。在37℃下以相同的摩尔浓度添加cas9,并与rna混合物一起孵育10分钟。然后将10-20倍摩尔过量的cas9复合物添加至靶dna中。结合反应可以在15分钟内发生。
在一些实施方案中,cas蛋白或其变体为cas9蛋白或其变体。来自嗜热链球菌(s.thermophilus)crispr-cas系统的分离的cas9-crrna复合物以及由单独的组分体外组装的复合物证明它与携带与crrna互补的核苷酸序列的合成的寡脱氧核苷酸和质粒dna两者结合。已经显示cas9具有两个核酸酶结构域-rvvc-和hnh-活性位点/核酸酶结构域,并且这两个核酸酶结构域负责切割相对的dna链。在一些实施方案中,cas9蛋白源自嗜热链球菌crispr-cas系统的cas9蛋白。在一些实施方案中,cas9蛋白为具有约1,409个氨基酸残基的多结构域蛋白。
在一些实施方案中,cas9蛋白或其变体为cas9蛋白的无核酸酶变体(nuclease-nullvariant),其中ruvc-和hnh-活性位点/核酸酶结构域两者都被突变。cas9蛋白的无核酸酶变体与双链dna结合,但不切割dna,并且因此其也可以用于靶特异性dna富集。在一些实施方案中,cas9蛋白具有两个失活的核酸酶结构域,所述两个失活的核酸酶结构域具有切割与crrna互补的链的结构域中的第一突变、以及切割与crrna不互补的链的结构域中的第二突变。在一些实施方案中,cas9蛋白具有第一突变d10a和第二突变h840a。
在一些实施方案中,cas蛋白或其变体为级联蛋白或其变体。大肠杆菌中(e.coli)的级联复合物以序列特异性方式识别双链dna(dsdna)靶。大肠杆菌级联复合物为包含五个功能必需的crispr相关(cas)蛋白(casa1b2c6d1e1,也称为级联蛋白)和61个核苷酸的crrna的405-kda复合物。crrna通过与互补dna链形成碱基对来将级联复核物指导至dsdna靶序列,同时置换非互补链以形成r-环。级联体识别靶dna而不消耗atp,这表明持续的侵入物dna监视在没有能量投入的情况下进行。matthijs等,naturestructural&molecularbiology,2011,18,529–536。
在一些实施方案中,cas蛋白或其变体为cas3蛋白或其变体。大肠杆菌cas3可以催化rna与dna的atp非依赖性退火,形成r环以及rna碱基配对到双链体dna的杂交体。cas3蛋白可以使用比cas9的grna长的grna。howard等,biochemj.,2011,439(1):85-95。此类较长的rna可以允许其他元件更容易地接近靶dna,例如,接近待被聚合酶延伸的引物。cas3蛋白提供的另一个优势为,cas3蛋白不像cas9需要pam序列,因此为靶向期望的序列提供了更多的灵活性。通过cas3形成r环可能要求镁作为辅助因子。howard等,biochemj.,2011,439(1):85-95。因此,在一些实施例中,本文提供的系统还包括镁。
应该理解,可以在本方法中使用能够破坏双链核酸并创建环结构的任何crispr-cas系统。例如,本文提供的cas蛋白可以包括但不限于,haft等,ploscomputbiol.,2005,1(6):e60,和zhang等,nucl.acidsres.,2013,10.1093/nar/gkt1262中描述的cas蛋白。这些crispr-cas系统中的一些要求,针对这些crispr-cas系统存在识别和结合靶序列的特异性序列。例如,cas9要求存在5’-ngg前间区相邻基序(pam)。因此,在一些实施方案中,将pam序列或与pam序列互补的序列工程化到靶核酸中,以用于启动crispr-cas系统与靶核酸的结合。
在一些实施方案中,本文提供的引物为单链寡脱氧核糖核苷酸。在一些实施方案中,引物长度范围为从约10个至约50个核苷酸。本文提供的示例性引物长度为10个、11个、12个、13个、14个、15个、16个、17个、18个、19个、20个、21个、22个、23个、24个、25个、26个、27个、28个、29个、30个、31个、32个、33个、34个、35个、36个、37个、38个、39个、40个、41个、42个、43个、44个、45个、46个、47个、48个、49个、或50个核苷酸。
在一些实施方案中,本文提供的引物具有与靶核酸的区域100%碱基对匹配。在一些实施方案中,本文提供的引物具有与靶核酸的区域90%-100%、80%-100%、或70%-100%碱基对匹配。在一些实施方案中,在引物和靶核酸的区域之间存在一个碱基对错配。在一些实施方案中,在引物和靶核酸的区域之间存在两个碱基对错配。在一些实施方案中,在引物和靶核酸的区域之间存在三个碱基对错配。在一些实施方案中,在引物和靶核酸的区域之间存在四个碱基对错配。在一些实施方案中,在引物和靶核酸的区域之间存在五个碱基对错配。
在一些实施方案中,本文提供的引物被标记,例如,用于扩增产物的富集或检测。在一些实施方案中,本文提供的引物被标记以便通过光谱学、光化学、生物化学、免疫化学或化学手段检测。在一些实施方案中,引物用生物素、胺、放射性标记物(例如,32p)、荧光染料、电子致密试剂、酶(通常用于elisas)或生物素来标记。
在一些实施方案中,本文提供的聚合酶催化核苷酸的掺入以使引物分子的3’羟基末端相对于核酸靶序列延伸。在一些实施方案中,通过本文提供的聚合酶的反应在等温条件下进行。在一些实施方案中,聚合酶为链置换聚合酶。示例性聚合酶包括但不限于bstdna聚合酶、9°nmdna聚合酶、phi29dna聚合酶、dna聚合酶i(大肠杆菌)、dna聚合酶i(大片段(large))m、(klenow)片段、klenow片段(3’-5‘外切-(exo-))、t4dna聚合酶、t7dna聚合酶、deepventrtm(外切-)dna聚合酶、deepventrtmdna聚合酶、dynazymetmextdna、dynazymetmii热启动dna聚合酶、phusiontm高保真dna聚合酶、therminatortmdna聚合酶、therminatortmiidna聚合酶、ventr
如讨论的,通过本文提供的线性或指数扩增提供的一个优势为,可以在恒定温度或等温条件下进行扩增。如本文使用的,术语“恒定温度”、“等温条件”或“等温地”指在扩增反应过程期间反应温度被保持基本恒定的一组反应条件。然而,不必将温度精确地维持在一个温度。如果用于维持升高温度的设备允许反应混合物的温度变化几度,这对扩增反应无害,并且仍然可被认为是等温反应。在一些实施方案中,扩增反应在20℃至70℃之间的恒定温度下进行。在一些实施方案中,扩增反应在25℃至60℃之间的恒定温度下进行。在一些实施方案中,扩增反应在40℃至55℃之间的恒定温度下进行。在一些实施方案中,扩增反应在30℃至40℃之间的恒定温度下进行。示例性扩增反应温度包括30℃、31℃、32℃、33℃、34℃、35℃、36℃、37℃、38℃、39℃、40℃、41℃、42℃、43℃、44℃、45℃、46℃、47℃、48℃、49℃、50℃、51℃、52℃、53℃、54℃、55℃、56℃、57℃、58℃、59℃和60℃。在一个实施方案中,扩增反应温度为约37℃。
在一些实施方案中,扩增反应运行的时间可以从例如1分钟至数小时变化,直至实现期望的扩增量。在一些实施方案中,扩增反应的时间为5分钟至1小时。示例性扩增反应时间包括5分钟、10分钟、15分钟、20分钟、30分钟、40分钟、50分钟和60分钟。
在一些实施方案中,本方法可以用于期望检测和/或定量扩增的核酸产物的某些应用中。可以通过本领域普通技术人员已知的任何方法检测扩增的靶序列。
在一些实施方案中,特异性染色双链dna的染料可以用于检测或定量扩增产物。在一些实施方案中,嵌入染料在结合dna或rna后展现出增强的荧光。在一些实施方案中,染料可以为,例如dna或rna嵌入荧光团。示例性dna或rna嵌入荧光团包括但不限于吖啶橙、溴化乙锭、hoechst染料、picogreen、碘化丙啶、sybri(不对称花青染料)、sybrii,toto(噻唑橙二聚体)和yoyo(噁唑黄二聚体)。
在一些实施方案中,可以通过凝胶电泳检测具有特定尺寸的扩增产物。在一些实施方案中,扩增反应中使用的核苷酸可以用例如生物素标记。生物素标记的扩增序列可以使用与信号产生酶,例如过氧化物酶结合的抗生物素蛋白来捕获。
在一些实施方案中,标记的核苷酸可以被直接掺入到靶序列或到包含感兴趣靶的互补序列的引物中。此类标记物本质上可以为放射性的和/或荧光的,并且可以以本文讨论的任何方式来分辨。
检测和/或连续监测核酸产物扩增的方法也为本领域技术人员熟知的。例如,在一些实施方案中,靶核酸和核酸序列的产生或存在可以由分子信标(molecularbeacon)进行检测和监测。分子信标为包含在一端上的荧光团和在相对端上的猝灭染料的发夹形寡核苷酸。发夹的环包含与靶序列互补的探针序列,而茎通过位于探针序列任一侧上的互补臂序列的退火形成。当分子信标遇到靶分子时,杂交发生;环结构被转化为稳定的更为刚性的构象,引起荧光团和猝灭物分子的分离,产生荧光。tyagi等,naturebiotechnology,1996,303-308。因此,荧光的产生表明预期的扩增产物的合成。另举例,在一些实施方案中,靶核酸和核酸序列的产生或存在可以通过荧光共振能量转移(fret)来检测和监测。例如在dna-dna相互作用中,fret为定量分子动力学的有用工具。为了监测特定产物的产生,探针可以在一个末端上用供体分子而在另一个末端上用受体分子标记。探针-靶杂交导致供体和受体的距离或取向发生变化,并且观察到fret变化。lakowicz,“principlesoffluorescencespectroscopy,”plenumpublishingcorporation,第2版(jul.1,1999)。用于检测和/或连续监测核酸产物扩增的其他示例性方法包括但不限于本领域技术人员已知的质谱、毛细管凝胶电泳、测序和多种表面捕获方法。在一些实施方案中,以不对称量的引物运行扩增反应(即一条引物以比另一条高的浓度存在)将允许以偏向一条链的扩增。过量的单链可以促进通过如检测ssdna的分子信标的方式的检测。
本文提供的扩增方法可以用于多种应用。例如,在一些实施方案中,本文提供的方法可以用于通过选择性扩增特定的dna区域来从基因组dna分离dna片段。
对于另一个实例,在一些实施方案中,本文提供的扩增方法可以用于基于与特定疾病相关的靶核酸的产生或存在来诊断多种疾病。在一些实施方案中,本文提供的方法可以用于早期诊断恶性疾病例如白血病和淋巴瘤。在其他实施方案中,本文提供的方法可以直接用于基因组dna样品,以扩增和检测易位特异性恶性细胞。
在其他实施方案中,本文提供的方法可以用于诊断传染病,包括由细菌或病毒引起的传染病。例如,本方法可以用于检测感染原(infectiousagent),并通过特异性核酸序列区分非致病菌株与致病菌株。在一些实施方案中,本文提供的扩增方法可以扩增和鉴定来自组织培养测定和动物模型的不可培养或缓慢生长的微生物,例如分枝杆菌(mycobacteria)、厌氧细菌或病毒。在其他实施方案中,本文提供的扩增方法可以扩增和鉴定来自个体的样品中的病毒dna。
又在其他实施方案中,本扩增方法可以用于产生核酸材料以增强其他程序。例如,在一些实施方案中,本扩增方法可以用来产生用于要求相对较大量的代表特定dna区域的dna的dna杂交或rna杂交和dna克隆的杂交探针。又举例,本文提供的方法可以用于核酸测序。
在特定实施方案中,本文提供的crispr-cas介导的核酸扩增方法可以用于扩增例如,使用文库制备方法和/或从illumina,inc.(sandiego,ca)购得的试剂盒产生的核酸片段文库。
在一些实施方案中,本文提供的方法可以用于扩增由基因组dna产生的核酸片段文库。在特定实施方案中,使用标签化(tagmentation)产生核酸片段文库。在特定实施方案中,使用illumina的nextera文库制备方法和试剂盒(从illumina,inc,sandiego,ca购得)由基因组dna产生核酸片段文库。
因此,在一些实施方案中,本文提供的方法还包括:在靶核酸和包含转移链的至少一种转座子末端组合物经历转座反应的条件下,将至少一种转座酶和转座子末端组合物应用于包含靶核酸的样品以产生混合物,其中靶核酸被片段化以产生多个靶核酸片段,并因此将通用引物序列掺入到多个靶核酸片段的每一个中,其中crrna或其衍生物包含与通用引物的区域互补的靶特异性核苷酸区域。
在一些实施方案中,靶核酸经历转座酶介导的标签化,所述标签化导致靶核酸的片段化,以及衔接子与双链dna片段的两条链的5'末端的连接。任选地,使用美国公布号2010/0120098(其通过引用以其整体并入本文)中描述的标签化或转座可将靶核酸片段化,并将衔接子添加至5’和3’末端。简言之,“转座反应”为其中一个或更多个转座子在随机位点处被插入到靶核酸的反应。转座反应中的基本组分为转座酶和展现转座子的核苷酸序列的dna寡核苷酸(包括转移的转座子序列及其互补物(即,未转移的转座子末端序列))以及形成功能性转座复合物或转座体复合物需要的其他组分。dna寡核苷酸还可以根据需要或期望包含另外的序列(例如衔接子或引物序列)。适于在本文提供的方法中使用的示例性转座复合物包括,但不限于,由超活性tn5转座酶和tn5型转座子末端形成的那些、或通过mua转座酶和包含r1和r2末端序列的mu转座子末端形成的那些(参见,例如,goryshinandreznikoff,j.biol.chem.273:7367,1998;和mizuuchi,cell35:785,1983;savilahti等,emboj.14:4893,1995;其通过引用以其整体并入本文)。然而,能够将转座子末端以足够的效率插入至标签靶核酸用于其预期的目的的任何转座系统可以用于所提供的方法中。可以用于所提供的方法中的已知转座系统的其他实例包括,但不限于,金黄色葡萄球菌(staphylococcusaureus)tn552、tyl、转座子tn7、tn/o和is10、mariner转座酶、tel、p元件、tn3、细菌插入序列、逆转录病毒和酵母的逆转录转座子(参见,例如,colegio等,2001,j.bacteriol.183:2384-8;kirby等,2002,mol.microbiol.43:173-86;devine和boeke,1994,nucleicacidsres.,22:3765-72;国际专利申请号wo95/23875;craig,1996,science271:1512;craig,1996,综述于:currtopmicrobiolimmunol.204:27-48;kleckner等,1996,currtopmicrobiolimmunol.204:49-82;lampe等,1996,emboj.15:5470-9;plasterk,1996,currtopmicrobiolimmunol204:125-43;gloor,2004,methodsmol.biol.260:97-114;ichikawa和ohtsubo,1990,jbiol.chem.265:18829-32;ohtsubo和sekine,1996,curr.top.microbiol.immunol.204:1-26;brown等,1989,procnatlacadsciusa86:2525-9;boeke和corces,1989,annurevmicrobiol.43:403-34;其通过引用以其整体并入本文)。在一些实施方案中,本公开内容的方法还包括去除转座酶,并通过pcr添加至适合的dna片段的末端。
如本文使用的术语“标签化(tagmentation)”、“标签化(tagment)”或“标签化(tagmenting)”指在溶液中将核酸(例如,dna)转化为衔接子修饰的模板,准备用于通过使用转座酶介导的片段化和加标签进行簇形成和测序。该方法通常牵涉通过包含与包含转座子末端序列的衔接子复合的转座酶的转座体复合物来修饰核酸。标签化导致同时的核酸片段化和衔接子与双链体片段的两条链的5’末端的连接。纯化步骤去除转座酶之后,另外的序列通过pcr被添加至衔接的片段的末端。
如本文使用的术语“转座体复合物”指与双链核酸非共价地结合的转座酶。例如,复合物可以是在支持非共价复合物形成的条件下与双链转座子dna一起预孵育的转座酶。双链转座子dna可包括但不限于tn5dna、tn5dna的部分、转座子末端组合物、转座子末端组合物或能与转座酶诸如超活性tn5转座酶相互作用的其他双链dna的混合物。
“转座酶”意指这样的酶,其能与包含转座子末端的组合物(例如,转座子、转座子末端、转座子末端组合物)形成功能性复合物,且例如能在体外转座反应中催化含转座子末端的组合物插入或转座到与其一起孵育的双链靶核酸。如本文所示的转座酶还可以包括来自逆转录转座子和逆转录病毒的整合酶。转座酶、转座体和转座体复合物通常为本领域技术人员已知的,如由us2010/0120098的公开内容所示例的,其内容通过引用以其整体并入本文。尽管本文描述的很多实施方案涉及tn5转座酶和/或超活性tn5转座酶,但将理解,能够为了其预期的目的以足够的效率将转座子末端插入5’-标签并片段化靶核酸的任何转座系统可以用于本发明。在特定的实施方案中,优选的转座系统能以随机或几乎随机的方式将转座子末端插入至5’-标签并片段化靶核酸。
如本文使用的,术语“转座反应”指其中一个或更多个转座子在例如随机位点或几乎随机位点处被插入到靶核酸中的反应。转座反应中的基本组分为转座酶和展现转座子的核苷酸序列的dna寡核苷酸(包括转移的转座子序列及其互补物(即,未转移的转座子末端序列))以及形成功能性转座复合物或转座体复合物需要的其他组分。根据需要或期望,dna寡核苷酸还可包含另外的序列(例如,衔接子或引物序列)。在一些实施方案中,本文提供的方法通过采用通过超活性tn5转座酶和tn5型转座子末端形成的转座复合物(goryshin和reznikoff,1998,j.biol.chem.,273:7367)或通过mua转座酶和包含r1和r2末端序列的mu转座子末端(mizuuchi,1983,cell,35:785;savilahti等,1995,emboj.,14:4893)来例示。然而,能够将转座子末端以随机或几乎随机的方式以足够的效率插入到靶dna的5’标签和片段用于其预期的目的的任何转座系统可以用于本发明。可用于本方法的本领域已知的转座系统的实例包括但不限于金黄色葡萄球菌tn552(colegio等,2001,jbacterid.,183:2384-8;kirby等,2002,moimicrobiol,43:173-86)、tyi(devine和boeke,1994,nucleicacidsres.,22:3765-72和国际专利申请号wo95/23875)、转座子tn7(craig,1996,science.271:1512;craig,1996,综述于:currtopmicrobiolimmunol,204:27-48)、tnio和islo(kleckner等,1996,currtopmicrobiolimmunol,204:49-82)、mariner转座酶(lampe等,1996,emboj.,15:5470-9)、tci(plasterk,1996,currtopmicrobiolimmunol,204:125-43)、pelement(gloor,2004,methodsmoibiol,260:97-114)、tnj(ichikawaandohtsubo,1990,jbiolchem.265:18829-32)、细菌插入序列(ohtsubo和sekine,1996,curr.top.microbiol.immunol.204:1-26)、逆转录病毒(brown等,1989,procnatlacadsciusa,86:2525-9)和酵母的逆转录转座子(boeke和corces,1989,annurevmicrobiol.43:403-34)。用于将转座子末端插入到靶序列中的方法可以使用任何合适的转座子系统在体外进行,对于所述合适的转座子系统存在合适的体外转座系统可用或所述合适的转座子系统可以基于本领域的知识开发。通常,用于本文提供的方法的合适的体外转座系统最少要求:具有足够纯度、足够浓度和足够的体外转座活性的转座酶;转座酶与其一起形成功能性复合物的转座子末端,所述功能性复合物具有各自的能够催化转座反应的转座酶。可以用于本发明的合适的转座酶转座子末端序列包括但不限制于,与转座酶形成复合物的野生型转座子末端序列、衍生的转座子末端序列或突变的转座子末端序列,所述转座酶选自野生型转座酶、衍生形式的转座酶、或突变形式的转座酶中。
术语“转座子末端”(te)指仅展现对于与在体外转座反应中为功能性的转座酶或整合酶形成复合物为必要的核苷酸序列(“转座子末端序列”)的双链核酸,例如,双链dna。在一些实施方案中,转座子末端能在转座反应中与转座酶形成功能性的复合物。作为非限制性实例,转座子末端可包括19-bp外末端(“oe”)转座子末端、内末端(“ie”)转座子末端、或被野生型或突变tn5转座酶识别的“马赛克(mosaic)末端”(“me”)转座子末端、或如在us2010/0120098的公开内容中描述的r1和r2转座子末端,其内容通过引用将其全部并入本文。转座子末端可以包括适于在体外转座反应中与转座酶或整合酶一起形成功能性复合物的任何核酸或核酸类似物。例如,转座子末端可以包括dna、rna、修饰的碱基、非天然碱基、修饰的骨架,并且可在一条或两条链中包含切口。尽管术语“dna”在本公开内容中有时与转座子末端的组合物相连使用,但应理解任何合适的核酸或核酸类似物可以在转座子末端中被利用。
通过体外转座反应,靶核酸片段被在5'末端加标签。在一些实施方案中,本文提供的方法还包括将3’末端标签掺入至5'加标签的核酸片段以制备加双标签的核酸片段的文库的步骤。添加3’末端标签可以通过多种方法进行,例如如在wo2010/048605中描述的通过使用dna聚合酶、末端转移酶和/或连接酶进行,其内容通过引用以其整体并入。
在一些实施方案中,加双标签的核酸片段通过使用具有链置换或5’核酸酶活性的聚合酶例如dna聚合酶来产生。在一些实施方案中,本文提供的方法包括:在无热循环且其中退火的5’加标签的核酸片段未变性的条件下,使退火的5’加标签的核酸片段的群体与具有链置换或5’核酸酶活性的dna聚合酶一起孵育,其中dna聚合酶使用互补链作为模板延伸退火的5’加标签的核酸片段的每一条链的3’末端,并置换或消化非转移链,从而产生加双标签的双链dna片段的文库。
在其他实施方案中,,在其中末端转移酶将第二标签连接至5’加标签的核酸片段的3’末端,从而产生加双标签的核酸片段的文库的条件下,将5’加标签的核酸片段与由末端转移酶组成的dna聚合酶和该末端转移酶的至少一种底物一起孵育并持续足够的时间。在一些实施方案中,构成转座子末端组合物的非转移的转座子末端的3'末端被封闭(例如,通过使用具有双脱氧核苷酸或3'-o-甲基核苷酸作为3'末端核苷酸的非转移的转座子末端)。
又在其他的实施方案中,加双标签的核酸片段通过使用模板依赖性连接酶和连接加标签寡核苷酸来产生。在一些实施方案中,在其中第二标签被连接至退火的5’加标签的dna片段,从而生成包括退火的加双标签的dna片段的dna片段的文库的条件下,使5’加标签的核酸片段与模板依赖性dna连接酶和具有3’部分和5’部分的连接加标签寡脱氧核苷酸一起孵育并持续足够的时间,其中3’部分展现第二标签,所述第二标签展现被期望连接至5'加标签的dna片段的3'末端的任何序列,并且5'部分具有5'单磷酸基团并展现随机序列。
在一些实施方案中,产生的核酸片段在核酸片段两个末端处包含通用序列。例如在文库中,在核酸片段两个末端处的通用序列可以根据本文提供的方法被crispr-cas系统靶向,并且如此,这些片段可以例如在簇形式反应中被扩增。
此类通用序列可以通过pcr或nextera转座子反应被引入到文库中核酸片段的两个末端。在一些实施方案中,在产生加标签的核酸片段的文库之后,可以例如使用有限循环聚合酶链式反应(pcr)扩增加标签的核酸片段,以引入其他的末端序列或衔接子,例如索引物(index)、通用引物以及簇形成和测序所需的其他序列。在特定实施方案中,进行有限循环pcr扩增以将索引物1(p7)和索引物2(p5)(从illumina,inc,sandiego,ca购得)添加至核酸片段的两个末端。
在一些实施方案中,对5’加标签的核酸片段的文库进行此类扩增。在一些实施方案中,对加双标签的核酸片段的文库进行此类扩增。示例性扩增方法包括:聚合酶链式反应(pcr)、链置换扩增反应、滚环扩增反应、连接酶链式反应、转录介导的扩增反应和环介导的扩增反应。
在一些实施方案中,本文提供的方法包括使用pcr扩增加双标签核酸片段的文库。在一些实施方案中,本文提供的方法包括使用本文提供的cas9介导的扩增方法扩增加双标签的核酸片段的文库。在一些实施方案中,本文提供的方法使用单引物pcr扩增加双标签的dna片段的文库。在一些实施方案中,扩增加双标签的dna片段的步骤包括使用dna聚合酶和与第二标签互补的至少一种引物。在一些实施方案中,扩增加双标签的dna片段的文库的步骤包括通过使用展现转移链的至少一部分的序列的仅一种寡脱氧核糖核苷酸作为pcr引物并使用加双标签的dna片段作为模板的pcr来扩增加标签的dna片段的文库。在一些实施方案中,引物包含5'部分,所述5'部分包含另外的序列,例如衔接子序列。
在一些实施方案中,使用两种不同的pcr引物,每一种所述pcr引物展现构成转座子末端组合物的转移的转座子末端的至少一部分的序列。在一些实施方案中,每一种pcr引物包含3’部分和5’部分,其中3’部分展现各个转移的转座子末端序列,并且5’部分展现用于特定目的的各个标签结构域或衔接子(例如,用于下一代测序或扩增的测序标签结构域/衔接子或扩增标签结构域/衔接子,和任选地寻址标签结构域/衔接子)的序列。例如,当在体外转座反应中使用单一转座子末端组合物以使用具有链置换或5’核酸酶活性的dna聚合酶产生加双标签的dna片段的文库时,加双标签的dna片段可以使用两种不同的pcr引物通过pcr来扩增。每种pcr引物包含3’部分和5’部分,其中3’部分展现各个转移的转座子末端序列,并且5’部分展现用于特定目的的各个标签结构域/衔接子(例如,用于下一代测序或扩增的测序标签结构域/衔接子或扩增标签结构域/衔接子,和任选地寻址标签结构域/衔接子)的序列。在一些实施方案中,每一种pcr引物的5’部分与另一种引物的5’部分不同,并且如此pcr产物的两个末端的序列不同。例如,一个末端包含一个索引物和/或通用引物序列,并且另一个末端包含不同的索引物和/或通用引物序列。
在一些实施方案中,加双标签的核酸片段的两个末端源自两个不同的转移链序列。例如,在一些实施方案中,在体外转座反应中可以使用两种不同的转座体,并且两种转座体的每一种包含相同的转座酶但转座子末端组合物不同。在一些实施方案中,使用两种不同的转座体,并且两种不同的转座体各自包含相同的转座酶而转座子末端组合物包含不同的转移链。在一些实施方案中,使用两种不同的转座体,并且两种转座体中的每一种包含不同的转座酶和不同的转座子末端组合物,所述不同的转座子末端组合物中的每一种与各自的转座酶一起形成功能性复合物。在一些实施方案中,其中在体外转座反应中使用两种不同的转座子末端组合物,并且加双标签的单链核酸片段的文库使用具有链置换或5’核酸酶活性的dna聚合酶来产生,第一标签展现一种转座子末端组合物的转移链的序列并且第二标签展现另一种转座子末端组合物的非转移链的序列。
在以上提及的实施方案和其中两种不同的转移链被连接至双链核酸的每一条相对链的5’末端的其他实施方案中,本文提供的方法还可以包括使用两种不同的pcr引物通过pcr扩增加双标签的核酸片段的步骤。pcr引物中的一条展现构成一种转座子末端组合物的一条转移链的至少一部分的序列,而pcr引物中的另一条展现构成另一种转座子末端组合物的另一条转移链的至少一部分的序列。
在其中使用两条引物的一些实施方案中,每一条pcr引物包含3’部分和5’部分,其中3’部分展现各个转移的转座子末端序列,并且5’部分展现用于特定目的的各个标签结构域/衔接子(例如,用于下一代测序或扩增的测序标签域或扩增标签域,和任选地寻址标签域)的序列。在一些实施方案中,每一种pcr引物的5’部分与另一种引物的5’部分不同,并且如此将不同的序列引入至pcr产物的两个末端。在一些实施方案中,第一pcr引物的5’部分或第二pcr引物的5’部分,或第一pcr引物和第二pcr引物两者的5’部分分别包含第一测序标签/衔接子或第二测序标签/衔接子,用于针对特定的测序平台产生用于下一代测序的模板(例如,用于illuminanextera测序平台的测序标签)。在一些实施方案中,第一pcr引物的5’部分或第二pcr引物的5’部分另外包含寻址标签域/衔接子或用于特定目的的另一种标签域/衔接子。
如本领域技术人员已知的,很多种酶和试剂盒为可用于通过pcr进行扩增反应,。例如,在一些实施方案中,使用来自epicentrebiotechnologies,madison,wi的failsafetmpcr系统或masteramptmextra-longpcr系统,如制造商描述的进行pcr扩增。然而,本公开内容不限于使用那些产品或条件用于扩增反应,而可以使用允许在退火至靶序列的引物和退火至转座子的引物之间的序列扩增的任何合适的热稳定dna聚合酶和反应混合物。
本文提供的方法不限于使用pcr来扩增加标签的核酸片段的文库。扩增同一序列并产生用于预期目的的合适组成和量的扩增产物的任何合适的扩增方法(例如,滚环扩增、riboprimer扩增(例如美国专利号7,413,857)、ican、ucan、ribospia、末端加标签(美国专利申请号20050153333)、eberwine-typearna扩增或链置换扩增)可以用于本发明的实施方案中。例如,可以使用的一些链置换方法在以下中被描述:takarashuzocompany,kyoto,japan的pct专利申请号wo02/16639;wo00/56877;和au00/29742;bectondickinsonandcompany的美国专利号5,523,204;5,536,649;5,624,825;5,631,147;5,648,211;5,733,752;5,744,311;5,756,702;和5,916,779;nanogen/bectondickinsonpartnership的美国专利号6,238,868;6,309,833;和6,326,173;biomerieux的美国专利号5,849,547;5,874,260;和6,218,151;gen-probe,inc.的美国专利号5,786,183;6,087,133;和6,214,587;wick等的美国专利号6,063,604;kurn的美国专利号6,251,639;eikenkagakukabushikikaishi,tokyo,日本的美国专利号6,410,278;和pct申请号wo00/28082;auerbach的美国专利号5,591,609;5,614,389;5,773,733;5,834,202;和6,448,017;以及lizardi的美国专利号6,124,120;和6,280,949。在一些实施方案中,本文提供的cas介导的扩增用于扩增靶核酸片段的文库。
在一些实施方案中,当靶核酸具有例如,如使用以上提供的方法产生的通用引物序列时,指导rna,例如crrna可以靶向文库中核酸片段的该通用引物序列,以等温扩增核酸片段的文库。
图1阐释了一种根据本公开内容扩增由nextera文库制品(从illumina,inc.,sandiego,ca购得)产生核酸片段的方法。在一些实施方案中,本文提供的cas蛋白需要pam序列以识别靶。例如,cas9蛋白要求与靶序列相邻的基序ngg的序列。可以将与pam序列互补的序列掺入到被添加至文库插入物的流动池(flowcell)引物(例如,p5和p7)以产生能够靶向包含pam的序列的pam修饰的p5和p7引物。标准通用引物p5和p7的序列示于图1a中(seqidno.1和seqidno.2)。pam修饰的引物p5和p7的序列也示于图1a中(seqidno.3和seqidno.4)。因此,在一些实施方案中,将pam修饰的引物p5和p7添加至文库中的核酸片段。在特定实施方案中,使用有限循环pcr将pam修饰的引物p5和p7添加至核酸片段中。
如图1b-c中示出的,dna片段(例如溶液中的nextera扩增子)在扩增子的末端包含p5和p7引物序列(seqidno.1和seqidno.2)。添加包含靶向p5引物序列的区域的seqidno.7的指导rna的crispr-cas9系统(参见图1b)和包含靶向p7引物序列的区域的seqidno.8的指导rna的crispr-cas9系统(参见图1c)。crispr-cas9系统打开双链dna的一些区域,通过使crrna与引物序列结合,在dna片段的两个末端附近创建r-环结构。然后可以使用截短的pam修饰的p5和p7引物(seqidno.5和seqidno.6)来扩增dna片段。
因此,在一些实施方案中,靶双链核酸的第一链包含通用序列,并且其中crrna或其衍生物包含与通用序列的区域互补的序列。在一些实施方案中,引物包含通用序列的区域的序列。
在一些实施方案中,通用引物具有seqidno.3的序列。在一些实施方案中,crrna包含seqidno.7的序列。在一些实施方案中,引物包含seqidno.5的序列。
在一些实施方案中,通用引物序列具有seqidno.4的序列。在一些实施方案中,crrna包含seqidno.8的序列。在一些实施方案中,引物包含seqidno.6的序列。
在一些实施方案中,靶双链核酸的第一链包含第一通用序列,并且其中第一系统的crrna或其衍生物包含与第一通用序列的区域互补的序列,并且靶双链核酸的第二链包含第二通用序列,并且其中第二系统的crrna或其衍生物包含与第二通用序列的区域互补的序列。在一些实施方案中,第一引物包含第一通用序列的区域的序列,且第二引物包含第二通用序列的区域的序列。在特定实施方案中,第一通用序列具有seqidno.3的序列,第一系统的crrna或其衍生物包含seqidno.7的序列,且第一引物包含seqidno.5的序列,并且第二通用序列具有seqidno.4的序列,第二系统的crrna或其衍生物包含seqidno.8的序列,且第二引物包含seqidno.6的序列。
本文提供的方法可以用于等温扩增以用于例如,在由illumina,inc.(sandiego,ca)开发的簇扩增中测序。在一些实施方案中,本方法的靶核酸可以被固定化在表面上以用于扩增。例如,在一些实施方案中,固定化的核酸片段使用簇扩增方法来扩增,如由美国专利号7,985,565和号7,115,400的公开内容所示例的,其每一个的内容均被通过引用以整体并入本文。美国专利号7,985,565和7,115,400的并入的材料描述了固相核酸扩增的方法,其允许扩增产物被固定化在固体支持物上,以形成包括固定的核酸分子的簇或“集群”的阵列。在此类阵列上的每一个簇或集群由多个相同的固定的多核苷酸链和多个相同的固定的互补多核苷酸链形成。如此形成的阵列本文中通常地被称作“成簇的阵列”。固相扩增反应诸如在美国专利号7,985,565和7,115,400中描述的那些反应的产物是通过成对的固定的多核苷酸链和固定的互补的链的退火形成的所谓的“桥式”结构,两条链在5’末端优选地经由共价附接被固定化在固体支持物上。簇扩增方法为其中固定的核酸模板被用来产生固定的扩增子的方法的实例。其他合适的方法也可以被用来从根据本文提供的方法产生的固定的核酸片段产生固定的扩增子。例如,无论每一对扩增引物中的一个或两个引物是否被固定,一个或更多个簇或集群可以经由固相pcr来形成。
如本文使用的,本文中的术语“固体表面”、“固体支持物”和其他语法等同物指适于或可以被修饰以适于附接多核苷酸的任何材料。可能的基底包括但不限于:玻璃和修饰的或功能化的玻璃、塑料(包括丙烯酸树脂、聚苯乙烯以及苯乙烯和其他材料的共聚物、聚丙烯、聚乙烯、聚丁烯、聚氨酯、teflontm等等)、多糖、尼龙或硝酸纤维素、陶瓷、树脂、二氧化硅或基于二氧化硅的材料包括硅和修饰的硅、碳、金属、无机玻璃、塑料、光学纤维束、和很多其他聚合物。在一些实施方案中,固体支持物和固体表面位于流动池装置内。在一些实施方案中,固体支持物包括适于以有序的模式固定分子的模式化的表面。“模式化的表面”指不同区域在固体支持物的暴露层中或暴露层上的排列。在一些实施方案中,固体支持物包括表面中的孔或凹的阵列。固体支持物的组成和几何结构可以随其使用而变化。在一些实施方案中,固体支持物是平面结构,诸如载玻片、芯片、微芯片和/或阵列。如此,基底的表面可以是平面层的形式。在一些实施方案中,固体支持物包括流动池的一个或更多个表面。如本文使用的术语“流动池”指包含固体表面的室,一种或更多种流体试剂可流动穿过所述室。可以在本公开内容的方法中容易地使用的流动池和相关流体系统和检测平台的实例被描述于以下中:例如bentley等,nature456:53-59(2008);wo04/018497;us7,057,026;wo91/06678;wo07/123744;us7,329,492;us7,211,414;us7,315,019;us7,405,281和us2008/0108082,其每一个通过引用并入本文。在一些实施方案中,固体支持物或其表面是非平面的,诸如管或容器的内表面或外表面。在一些实施方案中,固体支持物包括微球或珠。在本文中“微球”、“珠”、“颗粒”或语法等同物被旨在意指由多种材料包括但不限于塑料、陶瓷、玻璃和聚苯乙烯制成的小的分散的颗粒。在某些实施方案中,微球为磁性微球或珠。可选择地或另外地,珠可以为多孔的。珠的尺寸范围从纳米例如,100nm至毫米,例如1mm。
在其他的实施方案中,在溶液中扩增固定的核酸片段。例如,在一些实施方案中,固定的核酸片段被裂解或者以其他方式从固体支持物释放,并且然后扩增引物在溶液中与释放的分子杂交。在其他实施方案中,对于一个或更多个初始扩增步骤,使扩增引物与固定的片段杂交,接着是随后在溶液中的扩增步骤。因此,在一些实施方案中,固定的核酸模板可以用来产生溶液相扩增子。将领会的是,本文描述的任何扩增方法可以通过通用的或靶特异的引物利用以扩增固定的核酸片段。
根据本文提供的方法扩增的核酸可以根据任何合适的测序方法来测序,诸如直接测序,包括合成测序、连接测序、杂交测序、纳米孔测序等。在一些实施方案中,在固体支持物上测序固定的dna片段。在一些实施方案中,用于测序的固体支持物是与于其上扩增发生的固体支持物相同的固体支持物。
在一些实施方案中,在本文提供的方法中使用的测序方法为合成测序(sbs)。在sbs中,监测核酸引物沿着核酸模板(例如,靶核酸或其扩增子)的延伸以确定模板中核苷酸的序列。潜在的化学过程可以是聚合(例如,如被聚合酶催化)。在特定的基于聚合酶的sbs实施方案中,荧光标记的核苷酸以模板依赖模式被添加至引物(从而延伸引物),以使得检测添加至引物的核苷酸的顺序和类型可被用来确定模板的序列。
可以利用使用循环反应的其他测序程序,诸如焦磷酸测序。焦磷酸测序检测无机焦磷酸(ppi)随着特定核苷酸被掺入到新生核酸链的释放(ronaghi,等,1996,analyticalbiochemistry242(1),84-9;ronaghi,2001,genomeres.11(1),3-11;ronaghi等,1998,science281(5375),363;us6,210,891;us6,258,568和us.6,274,320,其每一个通过引用并入本文)。在焦磷酸测序中,释放的ppi可以通过立即被atp硫酸化酶转化的腺苷三磷酸(atp)来检测,并且产生的atp的水平可以经由荧光素酶产生的质子来检测。因此,测序反应可以经由发光检测系统来监测。用于基于荧光的检测系统的激发放射源对于焦磷酸测序程序不是必需的。可被调整以应用于根据本公开内容产生的扩增子的焦磷酸测序的有用的流体系统、检测器和程序在以下中被描述:例如,wipo专利申请系列号pct/us11/57111、us2005/0191698a1、us7,595,883、和us7,244,559,其每一个通过引用并入本文。
一些实施方案可以利用牵涉dna聚合酶活性的实时监测的方法。例如,核苷酸并入可以通过携带荧光团的聚合酶和γ-磷酸标记的核苷酸之间的荧光共振能量转移(fret)相互作用,或用零模波导(zmw)来检测。用于基于fret的测序的技术和试剂在以下中被描述:例如levene等,2003,science299,682–686;lundquist等,2008,opt.lett.33,1026–1028;korlach等,2008,proc.natl.acad.sci.usa105,1176–1181,其公开内容通过引用并入本文。
一些sbs实施方案包括检测将核苷酸掺入到延伸产物后释放的质子。例如,基于检测释放的质子的测序可以使用电子检测器和从iontorrent(guilford,ct,alifetechnologiessubsidiary)商购的相关技术,或在us2009/0026082a1、us2009/0127589a1、us2010/0137143a1或us2010/0282617a1中描述的测序方法和系统,其每一个通过引用并入本文。本文列出的使用动力学排除扩增靶核酸的方法可以容易地应用于被用来检测质子的基底。更具体地,本文列出的方法可以用来产生用于检测质子的扩增子的克隆群体。
另一种有用的测序技术为纳米孔测序(参见,例如deamer等,2000,trendsbiotechnol.18,147–151;deamer等,2002,acc.chem.res.35:817-825;li等,2003,nat.mater.2:611–615),其公开内容通过引用并入本文。在一些纳米孔实施方案中,将靶核酸或从靶核酸去除的单个核苷酸通过纳米孔。随着核酸或核苷酸通过纳米孔,每一个核苷酸类型可以通过测量孔的电导率波动来鉴定。(美国专利号7,001,792;soni等,2007,clin。chem.,53,1996–200;healy,2007,nanomed.2,459–481;cockroft等,2008,j.am.chem.soc.,130,818–820,其公开内容通过引用并入本文。在其他纳米孔测序实施方案中,待测序的dna片段使用γ磷酸修饰的核苷酸创建独特的纳米孔电流特征(signature)。
从前面的描述将明显的是,可以对本文描述的发明进行变化和改变,以使其适应多种用途和条件。此类实施方案也在以下权利要求书的范围内。
在本文的任何的变量的定义中对一列要素的叙述包括那个变量做为任一单个要素或所列要素的组合(或子组合)的定义。本文中对实施方案的叙述包括作为那个实施方案作为任一单独的实施方案与任何其他实施方案或其部分组合。
在该说明书中提到的所有专利和出版物通过引用并入本文,其程度如同每一个单独专利和出版物被特别地和单独地指明通过引用并入的相同程度。
序列表
<110>伊鲁米那股份有限公司
<120>使用crispr-cas系统的多核苷酸扩增
<130>12957-170-228
<140>待分配
<141>2015-11-10
<150>62/078,355
<151>2014-11-11
<160>8
<170>patentinversion3.5
<210>1
<211>29
<212>dna
<213>人工序列
<220>
<223>标准p5序列
<400>1
aatgatacggcgaccaccgagatctacac29
<210>2
<211>24
<212>dna
<213>人工序列
<220>
<223>标准p7序列
<400>2
caagcagaagacggcatacgagat24
<210>3
<211>32
<212>dna
<213>人工序列
<220>
<223>pam-修饰的p5序列
<220>
<221>misc_feature
<222>(3)..(3)
<223>nisa,c,g,ort
<400>3
ccnaatgatacggcgaccaccgagatctacac32
<210>4
<211>27
<212>dna
<213>人工序列
<220>
<223>pam-修饰的p7序列
<220>
<221>misc_feature
<222>(3)..(3)
<223>nisa,c,g,ort
<400>4
ccncaagcagaagacggcatacgagat27
<210>5
<211>21
<212>dna
<213>人工序列
<220>
<223>截短的pam-修饰的p5序列
<220>
<221>misc_feature
<222>(3)..(3)
<223>nisa,c,g,ort
<400>5
ccnaatgatacggcgaccacc21
<210>6
<211>21
<212>dna
<213>人工序列
<220>
<223>截短的pam-修饰的p7序列
<220>
<221>misc_feature
<222>(3)..(3)
<223>nisa,c,g,ort
<400>6
ccncaagcagaagacggcata21
<210>7
<211>20
<212>rna
<213>人工序列
<220>
<223>靶向p5的指导rna
<400>7
ucgguggucgccguaucauu20
<210>8
<211>20
<212>rna
<213>人工序列
<220>
<223>靶向p7的指导rna
<400>8
cguaugccgucuucugcuug20
- 还没有人留言评论。精彩留言会获得点赞!
- CYP2C9*3基因多态性快速检测的引物、分子信标、试剂盒及其检测方法与流程
- 一种单核苷酸多态性位点在辅助鉴定大豆花叶病毒抗性中的应用的制造方法与工艺
- DHFR基因多态性检测体系及其试剂盒的制造方法与工艺
- ERCC1基因多态性检测体系及其试剂盒的制造方法与工艺
- 一种判定中国人群rs125055单核苷酸多态性与儿童IBD之间的相关性的方法与制造工艺
- 黄牛ADNCR基因单核苷酸多态性的四引物扩增受阻突变体系PCR检测方法及其应用与制造工艺
- 使用PNA探针的熔解曲线分析、使用熔解曲线分析用于分析核苷酸多态性的方法和试剂盒与制造工艺
- 人KRAS中单核苷酸多态性的检测的制造方法与工艺
- 一种InDel位点基因型分型的方法与制造工艺
- 单核苷酸多态性rs145562243在筛查麻风患者中的应用的制造方法与工艺