一种氧气氧化醇或醛制备酸的方法与流程
本发明涉及一种以氧气或空气中的氧气为氧化剂氧化醇或醛生产酸的方法,具体涉及一种以铁催化的,通过氧气或空气氧化醇或醛制备酸的方法。
背景技术:
羧酸是重要的一类有机化合物,在工业、农业、医药和人们的日常生活中有着广泛应用。从醇到酸的氧化反应是有机化学中一种基本的、重要的化学反应。在工业和制药领域,羧酸的生产常通过氧化的方法获得。因此,寻找一种高效、价格低廉、条件温和、官能团兼容性好、环境友好的催化氧化体系具有良好的应用前景。从醇到酸转化的难点在于从醛到酸的氧化。传统上,酸的合成是通过利用当量或过量的氧化剂来氧化相应的醇而获得,如kmno4氧化、jone’s氧化及其他基于cro3的氧化方法等。此类方法的缺点是氧化剂含重金属,价格昂贵,废液污染环境,反应常需要强酸性,条件苛刻,对设备要求高,不适用于大规模工业生产(oxidationofprimaryalcoholstocarboxylicacids,springer:berlin,2007;mahmood,a.;robinson,g.e.;powell,l.org.processres.dev.1999,3,363-364;thottathil,j.k.;moniot,j.l.;mueller,r.h.;wong,m.k.y.;kissick,t.p.j.org.chem.1986,51,3140-3143)。氧气是一种廉价易得、清洁、高原子经济性、环境友好的氧化剂。空气是更为理想的氧化剂,无需制备和运输,在工业生产中更为安全。目前,以氧气为氧化剂实现从醇到酸的氧化方法非常有限,且集中在贵金属催化领域,空气氧化的报道更为少见。如1940-年代发展的pt催化的heyns氧化,然而pt昂贵的价格和易于毒化的特点限制了heyns氧化在工业生产上的应用;姜标小组在2014年以ag(nhc)/koh体系实现了利用干燥的空气氧化卞醇生成酸;davis等人报道了au/h2o界面催化乙醇和丙三醇生成酸;张泽会等人报道了负载的磁性pd纳米催化剂催化氧气氧化5-羟甲基糠醛生成2,5-呋喃二甲酸;buffin等人报道了pd催化下,醇可被氧气氧化为羧酸和酯的混合物,卞醇可被氧化为醛和酸的混合物;2015年,李朝军小组报道了在ago2/ipr体系中,由氧气氧化醛生成酸。ag、au、ru、pd等金属催化的氧化反应也有一定报道,但底物局限性强,大多需要纳米技术或负载实现(dalmer,o.;heyns,k.u.s.pat.1940,2,190,377;han,l.;xing,p.;jiang,b.org.lett.2014,16,3428-3431;zope,b.n.;hibbitts,d.d.;neurock,m.;davis,r.j.science,2010,330,74-78;kerdi,f.;rass,h.a.;pinel,c.;besson,m.;peru,g.;leger,b.;rio,s.;monflier,e.;ponchel,a.appl.catal.a.2015,506,206-219;buffin,b.p.;clarkson,j.p.;belitz,n.l.;kundu,a.j.mol.catal.a.2005,225,111-116;eliu,m.x.;wang,h.n.;zeng,h.y.;li,c.j.sci.adv.2015,1,e1500020)。tempo能提供一种稳定的氧自由基,在与fe或者cu协同催化氧化醇得到醛或酮的过程中发挥了重要的作用(stahls.s.;ryland,b.l.angew.chem.int.ed.2014,53,8824-8838;cao,q.;dornan,l.m.;rogan,l.;hughes,n.l.;muldoon,m.j.chem.commun.,2014,50,4524-4543)。但在此类体系中还未能实现氧气氧化醇或醛生成酸的报道。
技术实现要素:
本发明克服了现有技术中使用当量重金属为氧化剂或贵金属为催化剂、反应条件比较苛刻、底物官能团兼容性差、反应需高温高压等缺陷,提供了一种通过室温常压下,由氧气或空气氧化醇或醛来生成酸的方法,以工业易得的硝酸铁、tempo、无机卤化物作为共催化剂,以来源广泛的氧气或空气作为氧化剂,降低了成本,减少了反应过程中产生的废物污染,具有高效、温和、反应规模易于放大的优势。
本发明的目的在于提供一种反应条件温和、高效、低成本、绿色环保的催化氧气氧化醇或醛制备酸的方法。
本发明提供的一种氧气氧化醇或醛制备酸的方法,在室温下,在有机溶剂中,以氧气或空气中的氧气作为氧化剂,以醇、二醇或醛为原料,以硝酸铁、2,2,6,6-四甲基哌啶氮氧化物(tempo)、无机卤化物作为催化剂,在中性条件下反应时间为1-48小时,醇或醛氧化生成酸,二醇氧化生成内酯或二酸。
本发明方法中,所述醇、二醇或醛、硝酸铁、2,2,6,6-四甲基哌啶氮氧化物、无机卤化物的摩尔比为100:1~10:1~20:1~10;优选地,所述醇(或醛)、硝酸铁、2,2,6,6-四甲基哌啶氮氧化物、无机卤化物的摩尔比为100:10:20:10。
本发明还提供了一种氧气氧化醇或醛制备酸的方法,在室温下,在有机溶剂中,以氧气或空气中的氧气作为氧化剂,以醛为原料,以硝酸铁作为催化剂,在中性条件下反应,醛氧化生成酸和过氧酸。本发明方法中,所述原料醛、硝酸铁摩尔比为100~10:1,生成相应的酸和过氧酸。
本发明方法中,所述醇是r1ch2oh。
其中,r1是指c1-c16的碳链,c3-c8的碳环或杂环,含有卤素、芳基、杂环、酯基、醚键、炔基、双键等官能团的烷基,萜类、甾体等结构;
所述卤素为氟、氯、溴、碘;
所述芳基为苯基、烷氧基苯基、硝基苯基、卤代苯基、呋喃基或萘基;其中,所述烷氧基苯基为甲氧基苯基、乙氧基苯基,所述卤代苯基为氟代苯基、氯代苯基、溴代苯基、碘代苯基;
所述杂环为呋喃环、噻吩环。
优选地,所述r1为c2-c16的碳链,c3-c8的碳环或杂环,含有卤素、苯基、杂环、酯基、醚键、炔基、双键等官能团的烷基,萜类、甾体等结构。
进一步地,r1为c2-c16的碳链,c3-c8的碳环,含硫、氧脂杂环,含有卤素、苯基、噻吩基、呋喃基、酯基、醚键、炔基、双键等官能团的烷基,萜类、甾体等结构。
更进一步地,所述原料醇为辛醇、十二醇、苯丙醇、十六烷基醇、6-羟基己酸甲酯、8-乙酰氧基辛醇、四氢呋喃-2-甲醇、噻吩-2-乙醇、9-溴-1-壬醇、2-己氧基乙醇、7-炔-1-辛醇、4-戊炔-1-醇、10-十一炔-1-醇、3-三甲基硅基丙炔醇、环己-3-烯-1-甲醇、辛二醇、香紫苏二醇、(3α,5β)-3,24-胆二醇、邻苯二醇。
本发明方法中,所述醛是r2cho。
其中,所述r2是指c1-c16的碳链,c3-c8的碳环或杂环,含有卤素、芳基、杂环、酯基、醚键、炔基、双键等官能团的烷基、萜类、甾体等结构;
其中,所述卤素为氟、氯、溴、碘;
所述芳基为苯基、烷氧基苯基、硝基苯基、卤代苯基、噻吩基、呋喃基或萘基,其中,所述烷氧基苯基为甲氧基苯基、乙氧基苯基,所述卤代苯基为氟代苯基、氯代苯基、溴代苯基、碘代苯基;
所述杂环为呋喃环、噻吩环。
优选地,所述r2为c2-c16的碳链,c3-c8的碳环或杂环,含有卤素、苯基、杂环、酯基、醚键、炔基、双键等官能团的烷基,萜类、甾体等结构。
进一步地,所述r2为c2-c16的碳链,c3-c8的碳环,含硫、氧脂杂环,含有卤素、苯基、噻吩基、呋喃基、酯基、醚键、炔基、双键等官能团的烷基,萜类、甾体等结构。
更进一步地,所述原料醛为辛醛、十二醛、环己基甲醛、苯丙醛。
本发明方法中,所述二醇包括1,4-二醇和1,5-二醇及1,8-二醇。
本发明方法中,所述有机溶剂为乙酸乙酯、二氯甲烷、1,2-二氯乙烷、1,1-二氯乙烷、1,2-二氯丙烷、1,3-二氯丙烷、硝基甲烷、乙二醇二甲醚、二氧六环、四氢呋喃、乙腈、苯或甲苯中的一种或多种混合;优选地,所述有机溶剂为1,2-二氯乙烷。
本发明方法中,所述无机卤化物为卤化锂、卤化钠、卤化钾、卤化铷、卤化铯,卤原子为氟、氯、溴、碘。优选为氯化钾、氯化钠。进一步优选为氯化钾。
本发明方法中,当氧气为氧化剂时,所述反应时间优选地为12小时;当空气中的氧气为氧化剂时,所述反应时间优选地为16小时。
本发明方法中,硝酸铁为路易斯酸,所述中性条件是指无质子酸或碱参与,即不添加质子酸或碱。
进一步地,本发明中以空气中的氧气为氧化剂将反应放大时,还可采用两种技术手段,解决工业生产中反应放大的问题:一种方法是以空气袋作为氧气的主要来源,反应1.5小时后,增加氧气球作为补充;另一种方法是通过缓慢空气流方法,使空气缓慢流过反应容器,实现氧化目的。这些技术手段避免了工业上纯氧气条件下反应可能带来的危险,满足设备要求,便于工业上的应用。
本发明的反应机理为:int1,tempo和fe3+结合的产物,与醇反应生成int2。int2通过β-消除和还原消除得到了醛,tempoh,fe2+。在反应体系中,fe2+可以在no2作用下重新被氧化为fe3+,而no2被还原为no。no2通过no与o2的反应再生。tempoh通过和fe3+的反应被转化回到tempo。醛的水合物int3通过h2o在fe3+的调节下进攻醛生成。醛的水合物int3经历一个相似的过程得到羧酸,如图1所示。
本发明公开了在室温下,在有机溶剂中,以fe(no3)3.9h2o、tempo(2,2,6,6-四甲基哌啶氮氧化物)、和无机卤化物(如kcl)为催化剂,以氧气或空气作为氧化剂,氧化醇或醛生成相应的酸的方法。本发明还公开了在室温下,在有机溶剂中,以氧气作为氧化剂,以醛为原料,以硝酸铁作为催化剂,在中性条件下反应,原料醛氧化生成酸和过氧酸的方法。本发明方法,通过常压下纯氧气或空气,可将含有碳碳单键,碳碳双键,碳碳三键、卤素、酯基等多种官能团的醇或醛选择性地氧化,将一级醇氧化生成相应的酸。本发明具有反应条件温和、产率高、操作简单、分离纯化方便、底物官能团兼容性好、节能、绿色、环境友好等诸多优点,是一种适合工业化生产的方法。
本发明具有底物普适性广的优点,既可催化氧化普通醇,又可用于催化氧化结构比较复杂的醇,如含有酯基、醚、卤素、苯环、杂环、炔基、双键等官能团的醇等,甚至萜类、甾体结构亦可在本发明条件下兼容,适用于药物研发领域。本发明具有产率高、反应条件温和、操作简单、分离纯化方便等优点。本发明克服了现有技术中使用当量重金属为氧化剂或贵金属为催化剂、反应条件比较苛刻、底物官能团兼容性差、反应需高温高压等缺陷。本发明的方法,既可用于小规模实验室合成,也适用于大规模工业生产。
本发明采用廉价、来源广泛的氧气或空气作为氧化剂,替代传统氧化剂体系中所使用的化学氧化剂。所用催化剂硝酸铁、tempo和无机卤化物均为工业易得试剂。由于本发明催化氧化条件极为温和,因此,只需在室温、常压、中性的条件下就可以进行,操作极为便利且易于控制。由于反应过程中所用氧化剂是氧气或空气,副产物是水,因此,整个反应过程几乎对环境不会造成任何污染,是一种绿色化学合成方法。本发明后处理简单,产品收率高,可有效降低生产制造成本。
在本发明条件下,二醇可生成内酯或二酸。具体的说,部分1,4-二醇和1,5-二醇可生成内酯。而1,8-二醇可生成二酸。这为内酯和二酸产品的合成也提供了一种绿色环保、成本低的新方法。
本发明还提出了所述酸在实验室制备、药物合成、工业生产中的应用。
本发明还提出了所述二酸在实验室制备、药物合成、工业生产中的应用。
本发明还提出了所述内酯,在实验室制备、药物合成、工业生产中的应用。
本发明还提出了一种合成式(i)所示(ra)-7,8-二十联烯酸(phlomicacid)的方法,所述方法包括:
(1)以7-辛炔-1-醇为原料,以硝酸铁、2,2,6,6-四甲基哌啶氮氧化物、无机卤化物为催化剂,发生氧化反应得到7-辛炔酸;
(2)对步骤(1)制备的7-辛炔酸进行甲基化反应,得到7-辛炔酸甲酯;
(3)通过溴化铜、二甲基脯氨醇催化步骤(2)制备的7-辛炔酸甲酯,发生eata反应(炔烃的不对称联烯基反应),得到联烯酸甲酯;
(4)在氢氧化钾存在下,在甲醇/水体系中,水解步骤(3)制备的联烯酸甲酯,得到式(i)所示轴手性联烯酸(ra)-7,8-二十联烯酸。
其中,所述步骤(1)制备7-辛炔酸所采用的是本发明提出的氧气氧化醇或醛制备酸的方法,所述原料为7-辛炔-1-醇。
所述反应过程如路线(a)所示:
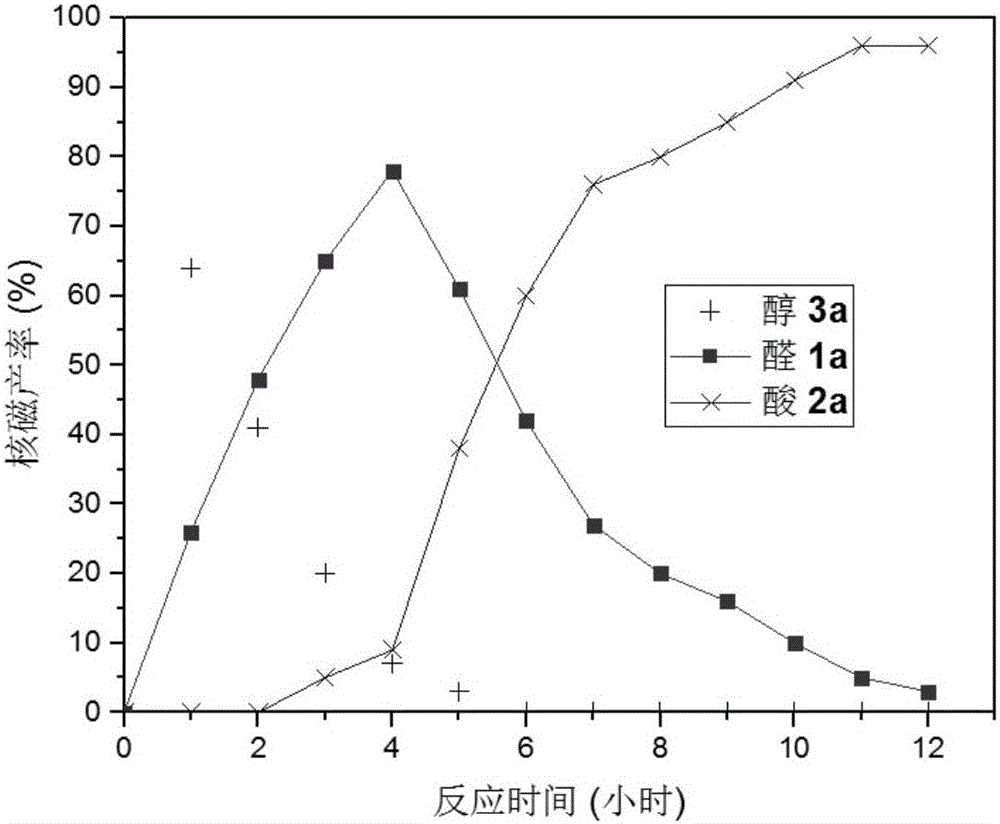
在一个具体的实验方案中,如反应式(i)所示,以十二醇3a为原料,以硝酸铁(fe(no3)3·9h2o)、2,2,6,6-四甲基哌啶氮氧化物和kcl作为催化剂时,以核磁内标方法监测反应中醇、醛、酸的含量。其中,kcl的用量为10mol%时,首先生成初始产物十二醛1a,2小时后生成十二酸2a,十二醇在六小时内消耗完全(如图2a所示);而用10mol%nacl替代10mol%的kcl时,十二醇在4小时仍不能生成十二酸2a(如图2b所示)。
附图说明
图1为本发明反应机理的示意图。
图2中图2a为本发明以kcl作为催化剂时由原料十二醇生成产物十二酸;图2b为本发明以nacl作为催化剂时由原料十二醇生成产物十二酸。
具体实施方式
结合以下具体实施例和附图,对本发明作进一步的详细说明。实施本发明的过程、条件、实验方法等,除以下专门提及的内容之外,均为本领域的普遍知识和公知常识,本发明没有特别限制内容。
实施例1:十二酸的合成
其中,rt为室温。
在氧气氛围(氧气球)下,将fe(no3)3·9h2o(40.4mg,0.10mmol),2,2,6,6-四甲基哌啶氮氧化物(tempo,15.5mg,0.10mmol),kcl(7.5mg,0.10mmol),十二醇(189.0mg,98%纯度,1.0mmol)和1,2-二氯乙烷(dce,4ml)加入到50mlschlenk管中。室温搅拌12h,tlc监测直至反应完成。反应液粗硅胶短柱过滤,乙醚(75ml)淋洗,浓缩得粗产品。该粗产品通过硅胶柱层析(石油醚:乙酸乙酯=5:1)得到相应的十二酸(199.2mg,100%)。1hnmr(400mhz,cdcl3)δ11.68(brs,1h,cooh),2.35(t,j=7.6hz,2h,ch2),1.63(quint,j=7.3hz,2h,ch2),1.39-1.21(m,16h,8×ch2),0.88(t,j=7.0hz,3h,ch3);13cnmr(100mhz,cdcl3)δ180.7,34.1,31.9,29.6,29.4,29.3,29.2,29.0,24.6,22.7,14.1.
实施例2:辛酸的合成
其他操作参考实施例1,所用原料为辛醇,反应时间为12小时,得到辛酸(122.1mg,85%)。1hnmr(400mhz,cdcl3)δ11.47(brs,1h,cooh),2.35(t,j=7.4hz,2h,ch2),1.63(quint,j=7.4hz,2h,ch2),1.39-1.21(m,8h,4×ch2),0.88(t,j=7.0hz,3h,ch3);13cnmr(100mhz,cdcl3)δ180.6,34.1,31.6,29.0,28.9,24.6,22.6,14.0.
实施例3:苯丙酸的合成
其他操作参考实施例1,所用原料为苯丙醇(138.4mg,98%纯度,1.0mmol),反应时间为12小时,得到苯丙酸(147.1mg,98%)。1hnmr(400mhz,cdcl3)δ11.48(brs,1h,cooh),7.33-7.15(m,5h,ar-h),2.95(t,j=8.0hz,2h,ch2),2.67(t,j=7.8hz,2h,ch2);13cnmr(100mhz,cdcl3)δ179.6,140.1,128.5,128.2,126.3,35.6,30.5.
实施例4:十六烷基酸的合成
其他操作参考实施例1,所用原料为十六烷基醇(247.4mg,98%纯度,1.0mmol),反应时间为12小时,得到十六烷基酸(254.2mg,99%)。熔点:62-63℃(石油醚/乙酸乙酯=100/1重结晶)(文献值:62.2–63.3℃);1hnmr(400mhz,cdcl3)δ11.60(brs,1h,cooh),2.35(t,j=7.4hz,2h,ch2),1.63(quint,j=7.4hz,2h,ch2),1.38-1.19(m,24h,12×ch2),0.88(t,j=6.8hz,3h,ch3);13cnmr(100mhz,cdcl3)δ180.7,34.1,31.9,29.71,29.69,29.68,29.66,29.65,29.60,29.44,29.37,29.2,29.1,24.7,22.7,14.1;ir(neat,cm-1):3300-2300,1698,1471,1430,1310,1293,1271,1250,1228,1207,1188;ms(ei)m/z(%):256(m+,60.14),73(100).
实施例5:6-甲氧基-6-羰基己酸的合成
其他操作参考实施例1,所用原料为6-羟基己酸甲酯(146.5mg,1.0mmol),反应时间为12小时,得到6-甲氧基-6-羰基己酸(138.4mg,94%)(石油醚:乙酸乙酯=5:1到2:1)。1hnmr(400mhz,cdcl3)δ9.21(brs,1h,cooh),3.68(s,3h,ch3),2.43-2.31(m,4h,2×ch2),1.75-1.62(m,4h,2×ch2);13cnmr(100mhz,cdcl3)δ179.4,173.8,51.6,33.6,24.2,24.0;ir(neat,cm-1):3400-2700,1736,1707,1438,1416,1367,1259,1199,1175,1143,1080,1016.ms(esi,neg)m/z(%):159(m-1)-.
实施例6:8-乙酰氧基辛酸的合成
其他操作参考实施例1,所用原料为8-乙酰氧基辛醇(187.8mg,1.0mmol),反应时间为12小时,得到8-乙酰氧基辛酸(188.3mg,93%)(石油醚:乙酸乙酯=5:1到2:1)。1hnmr(400mhz,cdcl3)δ9.58(brs,1h,cooh),4.05(t,j=6.6hz,2h,ch2),2.35(t,j=7.4hz,2h,ch2),2.05(s,3h,ch3),1.69-1.57(m,4h,2×ch2),1.42-1.30(m,6h,3×ch2);13cnmr(100mhz,cdcl3)δ179.9,171.4,64.5,33.9,28.81,28.78,28.4,25.6,24.5,20.9;ir(neat,cm-1):3600-2400,1706,1464,1413,1391,1366,1234,1100,1036;ms(ei)m/z(%):202(m+,2.51),55(100).
实施例7:四氢呋喃-2-甲酸的合成
其他操作参考实施例1,所用原料为四氢呋喃-2-甲醇(103.7mg,99%纯度,1.0mmol),反应时间为12小时,得到四氢呋喃-2-甲酸(82.0mg,70%)(石油醚:乙酸乙酯=5:1到2:1)。1hnmr(400mhz,cdcl3)δ9.82(brs,1h,cooh),4.52(dd,j1=8.6hz,j2=5.4hz,1h,ch),4.09-4.00(m,1h,oneprotonofch2),3.99-3.90(m,1h,oneprotonofch2),2.38-2.27(m,1h,oneprotonofch2),2.16-2.06(m,1h,oneprotonofch2);2.04-1.89(m,2h,ch2);13cnmr(100mhz,cdcl3)δ177.8,76.2,69.6,30.1,25.2;ir(neat,cm-1):3400-2600,1722,1449,1411,1351,1310,1203,1176,1072,1037;ms(ei)m/z(%):116(m+,1.09),71(100).
实施例8:噻吩-2-乙酸的合成
其他操作参考实施例1,所用原料为噻吩-2-乙醇(130.7mg,98%纯度,1.0mmol),反应时间为12小时,得到噻吩-2-乙酸(120.1mg,85%)(石油醚:乙酸乙酯=5:1到2:1)(132.0mg,1.0mmol),反应时间为2.3小时,得到噻吩-2-乙酸(111.9mg,86%)。熔点:61.3-62.4℃(石油醚/乙酸乙酯重结晶)(文献值:61-62.5℃);1hnmr(400mhz,cdcl3)δ10.89(brs,1h,cooh),7.24-7.20(m,1h,ar-h),6.98-6.94(m,2h,ar-h),3.87(s,2h,ch2);13cnmr(100mhz,cdcl3)δ177.0,134.0,127.2126.9,125.3,35.0;ir(neat,cm-1):3300-2300,1692,1438,1417,1399,1362,1331,1222,1188,1148,1128,1081,1040;ms(ei)m/z(%):142(m+,48.52),97(100).
实施例9:9-溴-1-壬酸的合成
其他操作参考实施例1,所用原料为9-溴-1-壬醇(228.0mg,98%纯度,1.0mmol),反应时间为12小时,得到9-溴-1-壬酸(232.6mg,98%)(石油醚:乙酸乙酯=5:1到3:1)。熔点:35.3-36.5℃(石油醚/乙酸乙酯重结晶)(文献值:35-36.5℃);1hnmr(400mhz,cdcl3)δ11.54(brs,1h,cooh),3.41(t,j=6.8hz,2h,ch2),2.36(t,j=7.6hz,2h,ch2),1.85(quint,j=7.2hz,2h,ch2),1.63(quint,j=7.3hz,2h,ch2),1.48-1.28(m,8h,4×ch2);13cnmr(100mhz,cdcl3)δ180.4,34.0,33.9,32.7,29.0,28.8,28.5,28.0,24.5;ir(neat,cm-1):3100-2500,1689,1468,1427,1406,1338,1303,1275,1241,1211,1188,1097,1043;ms(ei)m/z(%):238(m(81br)+,1.16),236(m(79br)+,1.16),60(100).
实施例10:2-己氧基乙酸的合成
其他操作参考实施例1,所用原料为2-己氧基乙醇(149.8mg,98%纯度,1.0mmol),反应时间为12小时,得到2-己氧基乙酸(147.7mg,92%)(石油醚:乙酸乙酯=5:1到2:1)。1hnmr(400mhz,cdcl3)δ10.14(brs,1h,cooh),4.13(s,2h,ch2),3.56(t,j=6.8hz,2h,ch2),1.67-1.59(m,2h,ch2),1.41-1.24(m,6h,3×ch2),0.88(t,j=7.0hz,3h,ch3);13cnmr(100mhz,cdcl3)δ175.6,72.1,67.6,31.5,29.3,25.5,22.5,13.9.ir(neat,cm-1):3600-2500,2930,2862,1729,1462,1431,1239,1126,298,807,727,676;ms(ei)m/z(%):160(m+,2.82),83(100).
实施例11:7-辛炔酸的合成
其他操作参考实施例1,所用原料为7-炔-1-辛醇(126.0mg,1.0mmol),反应时间为12小时,得到7-辛炔酸(111.7mg,80%)(石油醚:乙酸乙酯=5:1到2:1)。1hnmr(400mhz,cdcl3)δ11.41(brs,1h,cooh),2.38(t,j=7.4hz,2h,ch2),2.20(td,j1=6.9hz,j2=2.5hz,2h,≡cch2),1.95(t,j=2.6hz,2h,≡ch),1.71-1.61(m,2h,ch2),1.60-1.42(m,4h,2×ch2);13cnmr(100mhz,cdcl3)δ180.3,84.2,68.4,33.9,28.02,27.98,24.1,18.2.
实施例12:4-戊炔酸的合成
其他操作参考实施例1,所用原料为4-戊炔-1-醇(89.3mg,95%纯度,1.0mmol),反应时间为12小时,得到4-戊炔酸(59.3mg,60%)(石油醚:乙酸乙酯=5:1到2:1)。1hnmr(400mhz,cdcl3)δ11.29(brs,1h,cooh),2.66-2.60(m,2h,ch2),2.56-2.48(m,2h,ch2),2.01(t,j=2.8hz,1h,≡ch);13cnmr(100mhz,cdcl3)δ178.2,82.1,69.2,33.1,14.0.
实施例13:10-十一炔酸的合成
其他操作参考实施例1,所用原料为10-十一炔-1-醇(182.6mg,1.0mmol),反应时间为12小时,得到10-十一炔酸(186.5mg,95%)(石油醚:乙酸乙酯=5:1到2:1)。1hnmr(400mhz,cdcl3)δ11.18(brs,1h,cooh),2.35(t,j=7.6hz,2h,ch2),2.15-2.08(m,2h,ch2),1.78(t,j=2.6hz,3h,ch3),1.63(quint,j=7.3hz,2h,ch2),1.46(quint,j=7.2hz,2h,ch2),1.41-1.24(m,8h,4×ch2);13cnmr(100mhz,cdcl3)δ180.5,79.3,75.3,34.1,29.1,28.98,28.95,28.91,28.8,24.6,18.7,3.4.
实施例14:3-三甲基硅基丙炔酸的合成
其他操作参考实施例1,所用原料为3-三甲基硅基丙炔醇(128.8mg,1.0mmol),反应时间为36小时,得到3-三甲基硅基丙炔酸(93.7mg,66%)(石油醚:乙酸乙酯=5:1)。1hnmr(400mhz,cdcl3)δ9.91(brs,1h,cooh),0.26(s,9h,3×ch3);13cnmr(100mhz,cdcl3)δ157.6,97.4,93.8,-1.0;ir(neat,cm-1):3600-2500,2964,2176,1687,1400,1252,913,840,760;ms(ei)m/z(%):142(m+,12.82),75(100).
实施例15:环己-3-烯-1-甲酸的合成
其他操作参考实施例1,所用原料为环己-3-烯-1-甲醇(114.7mg,98%纯度,1.0mmol),反应时间为48小时,得到环己-3-烯-1-甲酸(102.5mg,81%)(石油醚:乙酸乙酯=5:1)。1hnmr(400mhz,cdcl3)δ11.01(brs,1h,cooh),5.74-5.64(m,2h,ch=ch),2.65-2.56(m,1h,ch),2.35-2.25(m,2h,ch2),2.20-1.99(m,3h,ch2),1.78-1.65(m,1h,ch2);13cnmr(100mhz,cdcl3)δ182.5,126.6,124.8,39.0,27.0,24.7,24.2.ms(ei)m/z(%):126(m+,27.78),79(100).
实施例16:辛二酸的合成
其他操作参考实施例1,所用原料为辛二醇(149.8mg,98%纯度,1.0mmol),反应时间为48小时,得到辛二酸(150.8mg,86%)(乙酸乙酯/正己烷重结晶)。熔点:138.6-139.7℃(文献值:144℃);1hnmr(400mhz,dmso-d6)δ12.00(s,3h,ch3),2.19(t,j=7.2hz,4h,2×ch2),1.54-1.42(m,4h,2×ch2),1.31-1.20(m,4h,2×ch2);13cnmr(100mhz,d6-dmso)δ174.5,33.6,28.3,24.4.ir(neat,cm-1):3500-2200,1688,1466,1408,1332,1252,1190,1065,1011.ms(ei)m/z(%):174(m+,0.23),138(100).
实施例17:(+)-香紫苏内酯的合成
其他操作参考实施例1,所用原料为香紫苏二醇(254.4mg,1.0mmol),反应时间为12小时,得到(+)-香紫苏内酯(230.1mg,92%)(石油醚:乙酸乙酯=20:1到5:1)。熔点:123.7-124.5℃(石油醚/乙酸乙酯重结晶)(文献值:121-124℃);比旋光[α]d28.7=47.9(c=1.01,chcl3)(文献值:[α]d20=47(c=1.01,chcl3));1hnmr(400mhz,cdcl3)δ2.41(dd,j1=16.0hz,j2=14.8hz,1h,oneprotonofch2),2.23(dd,j1=16.4hz,j2=6.4hz,1h,ch2),2.08(dt,j1=11.6hz,j2=3.2hz,1h),1.97(dd,j1=14.8hz,j2=6.6hz,1h,ch2),1.92-1.84(m,1h,ch2),1.74-1.60(m,2h,ch2),1.50-1.31(m,7h),1.20(dt,j1=14.0hz,j2=4.0hz,1h,ch2),1.10-1.00(m,2h),0.91(s,3h,ch3),0.89(s,3h,ch3),0.84(s,3h,ch3);13cnmr(100mhz,cdcl3)δ176.8,86.3,59.0,56.5,42.0,39.3,38.6,35.9,33.05,32.99,28.6,21.4,20.8,20.4,18.0,14.9;ir(neat,cm-1):2928,2897,2869,1766,1460,1390,1223,1178,1122,1017;ms(ei)m/z(%):250(m+,3.96),123(100).
实施例18:3-羰基-5β-胆烷酸的合成
其他操作参考实施例1,所用原料为(3α,5β)-3,24-胆二醇(362.6mg,1.0mmol),反应时间为24小时,得到3-羰基-5β-胆烷酸(272.4mg,73%)(石油醚:乙酸乙酯=2:1)。熔点:139.9-142.1℃(石油醚/乙酸乙酯重结晶)(文献值:137.7℃);比旋光[α]d25.3=28.7(c=1.02,chcl3)(文献值:[α]d25.3=28.1(c=0.01,chcl3));1hnmr(400mhz,cdcl3)δ11.45(brs,1h,cooh),2.70(t,j=14.2hz,1h,ch2),2.46-2.22(m,3h),2.21-2.13(m,1h),2.08-1.98(m,3h),1.94-1.76(m,4h),1.65-1.55(m,1h),1.55-1.04(m,15h),1.02(s,3h,ch3),0.93(d,j=6.4hz,3h,ch3),0.69(s,3h,ch3);13cnmr(100mhz,cdcl3)δ213.9,180.4,56.3,55.8,44.2,42.7,42.2,40.5,39.9,37.1,36.9,35.4,35.2,34.8,31.0,30.6,28.1,26.5,25.7,24.1,22.6,21.1,18.2,12.0.ir(neat,cm-1):3400-2500,1699,1448,1412,1380,1304,1262,1225,1182,1099.ms(ei)m/z(%):374(m+,12.22),55(100).
实施例19:苯酞的合成
其他操作参考实施例1,所用原料为邻苯二醇(141.3mg,98%纯度,1.0mmol),反应时间为12小时,得到苯酞(82.7mg,62%)(石油醚:乙酸乙酯=15:1到10:1)。熔点:72.0-73.4℃(石油醚/乙酸乙酯重结晶)(文献值:72-74℃).1hnmr(400mhz,cdcl3)δ7.94(d,j=7.6hz,1h,ar-h),7.70(td,j1=7.6hz,j2=0.8hz,1h,ar-h),7.57-7.48(m,2h,ar-h),5.34(s,2h,ch2);13cnmr(100mhz,cdcl3)δ171.0,146.5,133.9,128.9,125.6,125.6,122.1,69.6;ir(neat,cm-1):2944,2924,1745,1615,1593,1466,1436,1364,1317,1286,1191,1108,1047;ms(ei)m/z(%):134(m+,46.06),105(100).
实施例20:十二酸的合成(空气氧化)
在100ml圆底瓶中加入fe(no3)3·9h2o(40.5mg,0.1mmol)和dce(4.0ml),接着加入tempo(15.7mg,0.1mmol),kcl(7.8mg,0.1mmol),十二醇(189.3mg,98%纯度,1.0mmol)和dce(1.0ml)。圆底瓶通过抽气阀与空气气球相连。反应在室温下搅拌16小时,直到tlc监测反应完成(石油醚:乙酸乙酯=5:1)。反应混合物经过粗硅胶短柱过滤,乙醚(75ml)淋洗.真空旋干溶剂后,硅胶柱层析(石油醚:乙酸乙酯=5:1)纯化得到十二酸(189.7mg,95%)。1hnmr(400mhz,cdcl3)δ11.68(brs,1h,cooh),2.35(t,j=7.6hz,2h,ch2),1.63(quint,j=7.3hz,2h,ch2),1.39-1.21(m,16h,8×ch2),0.88(t,j=6.8hz,3h,ch3);13cnmr(100mhz,cdcl3)δ180.7,34.1,31.9,29.6,29.4,29.3,29.2,29.0,24.6,22.7,14.1.ir(neat,cm-1):3400-2500,1694,1466,1429,1351,1301,1278,1247,1218,1192;ms(ei)m/z(%):200(m+,21.87),73(100).
实施例21:辛酸的合成(空气氧化)
其他操作参考实施例20,所用原料为辛醇(132.0mg,99%纯度,1.0mmol),反应时间为16小时,得到辛酸(128.6mg,89%)(石油醚:乙酸乙酯=5:1)。1hnmr(400mhz,cdcl3)δ10.26(brs,1h,cooh),2.35(t,j=7.6hz,2h,ch2),1.63(quint,j=7.4hz,2h,ch2),1.39-1.22(m,8h,4×ch2),0.88(t,j=6.8hz,3h,ch3);13cnmr(100mhz,cdcl3)δ180.5,34.1,31.6,29.0,28.9,24.6,22.6,14.0;ir(neat,cm-1):2925,2857,1707,1462,1413,1277,1231,1203,1109,933,725;ms(ei)m/z(%):144(m+,3.74),60(100).
实施例22:苯丙酸的合成
其他操作参考实施例20,所用原料为苯丙醇(138.6mg,98%纯度,1.0mmol),反应时间为16小时,得到苯丙酸(149.0mg,99%)(石油醚:乙酸乙酯=5:1到2:1)。熔点:46.6-47.6℃(石油醚/乙酸乙酯重结晶);1hnmr(400mhz,cdcl3)δ10.35(brs,1h,cooh),7.33-7.16(m,5h,ar-h),2.95(t,j=7.8hz,2h,ch2),2.68(t,j=7.8hz,2h,ch2);13cnmr(100mhz,cdcl3)δ179.4,140.1,128.5,128.2,126.3,35.6,30.5;ir(neat,cm-1):3400-2400,1693,1448,1427,1300,1216,928,785,753,723,698;ms(ei)m/z(%):150(m+,38),91(100).
实施例23:十六烷基酸的合成
其他操作参考实施例20,所用原料为十六烷基醇(247.0mg,98%纯度,1.0mmol),反应时间为16小时,得到十六烷基酸(250.5mg,98%)。1hnmr(400mhz,cdcl3)δ11.43(brs,1h,cooh),2.35(t,j=7.4hz,2h,ch2),1.63(quint,j=7.4hz,2h,ch2),1.36-1.21(m,24h,12×ch2),0.88(t,j=6.8hz,3h,ch3);13cnmr(100mhz,cdcl3)δ180.6,34.1,31.9,29.70,29.68,29.66,29.65,29.60,29.44,29.37,29.2,29.1,24.7,22.7,14.1.
实施例24:6-甲氧基-6-羰基己酸的合成
其他操作参考实施例20,所用原料为6-羟基己酸甲酯(146.5mg,1.0mmol),反应时间为16小时,得到6-甲氧基-6-羰基己酸(138.2mg,86%)(石油醚:乙酸乙酯=5:1到2:1)。1hnmr(400mhz,cdcl3)δ9.10(brs,1h,cooh),3.68(s,3h,ch3),2.43-2.30(m,4h,2×ch2),1.75-1.62(m,4h,2×ch2);13cnmr(100mhz,cdcl3)δ179.3,173.8,51.6,33.6,24.2,24.0.
实施例25:8-乙酰氧基辛酸的合成
其他操作参考实施例20,所用原料为8-乙酰氧基辛醇(187.7mg,1.0mmol),反应时间为16小时,得到8-乙酰氧基辛酸(188.9mg,93%)(石油醚:乙酸乙酯=5:1到2:1)。1hnmr(400mhz,cdcl3)δ10.62(brs,1h,cooh),4.05(t,j=6.6hz,2h,ch2),2.35(t,j=7.6hz,2h,ch2),2.05(s,3h,ch3),1.69-1.57(m,4h,2×ch2),1.42-1.30(m,6h,3×ch2);13cnmr(100mhz,cdcl3)δ180.0,171.4,64.5,33.9,28.82,28.78,28.4,25.6,24.5,20.9.
实施例26:四氢呋喃-2-甲酸的合成
其他操作参考实施例20,所用原料为四氢呋喃-2-甲醇(103.0mg,99%纯度,1.0mmol),反应时间为16小时,得到四氢呋喃-2-甲酸(85.0mg,73%)(石油醚:乙酸乙酯=5:1到2:1)。1hnmr(400mhz,cdcl3)δ9.74(brs,1h,cooh),4.51(dd,j1=8.6hz,j2=5.4hz,1h,ch),4.09-4.01(m,1h,oneprotonofch2),3.99-3.91(m,1h,oneprotonofch2),2.38-2.27(m,1h,oneprotonofch2),2.17-2.06(m,1h,oneprotonofch2);2.04-1.89(m,2h,ch2);13cnmr(100mhz,cdcl3)δ177.8,76.3,69.6,30.1,25.2.
实施例27:噻吩-2-乙酸的合成
其他操作参考实施例20,所用原料为噻吩-2-乙醇(130.5mg,98%纯度,1.0mmol),反应时间为16小时,得到噻吩-2-乙酸(114.7mg,81%)(石油醚:乙酸乙酯=5:1到2:1)(132.0mg,1.0mmol)。1hnmr(400mhz,cdcl3)δ10.90(brs,1h,cooh),7.25-7.21(m,1h,ar-h),6.98-6.93(m,2h,ar-h),3.87(s,2h,ch2);13cnmr(100mhz,cdcl3)δ177.0,133.9,127.2126.9,125.3,35.0.
实施例28:9-溴-1-壬酸的合成
其他操作参考实施例20,所用原料为9-溴-1-壬醇(228.0mg,98%纯度,1.0mmol),反应时间为16小时,得到9-溴-1-壬酸(233.5mg,98%)(石油醚:乙酸乙酯=5:1到3:1)。1hnmr(400mhz,cdcl3)δ11.59(brs,1h,cooh),3.41(t,j=6.8hz,2h,ch2),2.35(t,j=7.4hz,2h,ch2),1.85(quint,j=7.2hz,2h,ch2),1.63(quint,j=7.3hz,2h,ch2),1.48-1.27(m,8h,4×ch2);13cnmr(100mhz,cdcl3)δ180.5,34.0,33.9,32.7,29.0,28.9,28.5,28.0,24.5.
实施例29:2-己氧基乙酸的合成
其他操作参考实施例20,所用原料为2-己氧基乙醇(148.5mg,98%纯度,1.0mmol),反应时间为16小时,得到2-己氧基乙酸(147.7mg,84%)(石油醚:乙酸乙酯=5:1到2:1)。1hnmr(400mhz,cdcl3)δ8.83(brs,1h,cooh),4.12(s,2h,ch2),3.56(t,j=6.6hz,2h,ch2),1.68-1.58(m,2h,ch2),1.41-1.24(m,6h,3×ch2),0.88(t,j=6.8hz,3h,ch3);13cnmr(100mhz,cdcl3)δ175.7,72.1,67.6,31.5,29.3,25.5,22.5,13.9.
实施例30:7-辛炔酸的合成
其他操作参考实施例20,所用原料为7-炔-1-辛醇(126.2mg,1.0mmol),反应时间为16小时,得到7-辛炔酸(112.2mg,80%)(石油醚:乙酸乙酯=5:1到2:1)。1hnmr(400mhz,cdcl3)δ11.01(brs,1h,cooh),2.38(t,j=7.6hz,2h,ch2),2.21(td,j1=6.9hz,j2=2.5hz,2h,≡cch2),1.95(t,j=2.6hz,1h,≡ch),1.71-1.62(m,2h,ch2),1.61-1.42(m,4h,2×ch2);13cnmr(100mhz,cdcl3)δ180.1,84.2,68.4,33.9,28.04,27.99,24.1,18.2.ir(neat)ν(cm-1)3298,2940,2864,2117,1707,1461,1413,1278,1225,1141,1085;ms(esi,neg)m/z(%):139(m-1)-.
实施例31:4-戊炔酸的合成
其他操作参考实施例20,所用原料为4-戊炔-1-醇(89.1mg,95%纯度,1.0mmol),反应时间为16小时,得到4-戊炔酸(67.0mg,68%)(石油醚:乙酸乙酯=5:1到2:1)。熔点:55.9-57.0℃(石油醚/乙酸乙酯重结晶);1hnmr(400mhz,cdcl3)δ11.37(brs,1h,cooh),2.66-2.60(m,2h,ch2),2.56-2.49(m,2h,ch2),2.01(t,j=2.6hz,1h,≡ch);13cnmr(100mhz,cdcl3)δ178.3,82.0,69.2,33.1,14.0.ir(neat)ν(cm-1)3500-2000,3276,2927,2627,2119,1694,1426,1353,1299,1217,1024,890.ms(ei)m/z(%):98(m+,3.7),70(100)
实施例32:10-十一炔酸的合成
其他操作参考实施例20,所用原料为10-十一炔-1-醇(182.8mg,1.0mmol),反应时间为16小时,得到10-十一炔酸(176.2mg,90%)(石油醚:乙酸乙酯=5:1到2:1)。熔点:51.3-52.2℃(石油醚/乙酸乙酯重结晶);1hnmr(400mhz,cdcl3)δ9.57(brs,1h,cooh),2.35(t,j=7.6hz,2h,ch2),2.15-2.08(m,2h,ch2),1.78(t,j=2.6hz,3h,ch3),1.63(quint,j=7.3hz,2h,ch2),1.46(quint,j=7.1hz,2h,ch2),1.41-1.24(m,8h,4×ch2);13cnmr(100mhz,cdcl3)δ180.4,79.3,75.3,34.1,29.1,28.98,28.96,28.91,28.8,24.6,18.7,3.4.ir(neat)ν(cm-1)3500-2400,1693,1464,1434,1410,1347,1321,1293,1260,1226,1193.ms(ei)m/z(%):196(m+,0.57),68(100).
实施例33:3-三甲基硅基丙炔酸的合成
其他操作参考实施例20,所用原料为3-三甲基硅基丙炔醇(128.6mg,1.0mmol),反应时间为48小时,得到3-三甲基硅基丙炔酸(92.9mg,65%)(石油醚:乙酸乙酯=5:1)。1hnmr(400mhz,cdcl3)δ6.78(brs,1h,cooh),0.26(s,9h,3×ch3);13cnmr(100mhz,cdcl3)δ157.4,97.4,93.7,-1.0.
实施例34:环己-3-烯-1-甲酸的合成
其他操作参考实施例20,所用原料为环己-3-烯-1-甲醇(115.9mg,98%纯度,1.0mmol),反应时间为48小时,得到环己-3-烯-1-甲酸(89.9mg,70%)(石油醚:乙酸乙酯=5:1)。1hnmr(400mhz,cdcl3)δ11.63(brs,1h,cooh),5.75-5.60(m,2h,ch2),2.68-2.55(m,1h,ch),2.36-2.00(m,5h,ch2),1.78-1.65(m,1h,ch2);13cnmr(100mhz,cdcl3)δ182.7,126.7,124.9,39.1,27.1,24.8,24.3.
实施例35:辛二酸的合成
其他操作参考实施例20,所用原料为辛二醇(148.8mg,98%纯度,1.0mmol),反应时间为48小时,得到辛二酸(144.4mg,83%)(乙酸乙酯/正己烷重结晶)。1hnmr(400mhz,dmso-d6)δ12.00(s,3h,ch3),2.19(t,j=7.4hz,4h,2×ch2),1.54-1.41(m,4h,2×ch2),1.31-1.21(m,4h,2×ch2);13cnmr(100mhz,d6-dmso)δ174.5,33.6,28.3,24.4.
实施例35:(+)-香紫苏内酯的合成
其他操作参考实施例20,所用原料为香紫苏二醇(254.8mg,1.0mmol),反应时间为16小时,得到(+)-香紫苏内酯(233.5mg,93%)(石油醚:乙酸乙酯=20:1到5:1)。比旋光[α]d28.7=46.9(c=1.00,chcl3)(文献值:[α]d20=47(c=1.01,chcl3));1hnmr(400mhz,cdcl3)δ2.41(dd,j1=15.6hz,j2=15.6hz,1h,ch2),2.23(dd,j1=15.0hz,j2=6.4hz,1h,ch2),2.08(dt,j1=11.6hz,j2=3.3hz,1h),1.97(dd,j1=14.8hz,j2=6.6hz,1h,ch2),1.92-1.84(m,1h,ch2),1.74-1.63(m,2h,ch2),1.50-1.31(m,7h),1.20(dt,j1=13.5hz,j2=4.3hz,1h,ch2),1.10-1.00(m,2h),0.91(s,3h,ch3),0.89(s,3h,ch3),0.84(s,3h,ch3);13cnmr(100mhz,cdcl3)δ176.7,86.2,59.0,56.5,42.0,39.4,38.6,35.9,33.05,32.99,28.6,21.5,20.8,20.4,18.0,14.9.
实施例36:苯酞的合成
其他操作参考实施例20,所用原料为邻苯二醇(141.3mg,98%纯度,1.0mmol),反应时间为16小时,得到苯酞(88.3mg,66%)(石油醚:乙酸乙酯=15:1到10:1)。1hnmr(400mhz,cdcl3)δ7.92(d,j=7.6hz,1h,ar-h),7.70(td,j1=7.6hz,j2=1.2hz,1h,ar-h),7.58-7.49(m,2h,ar-h),5.34(s,2h,ch2);13cnmr(100mhz,cdcl3)δ171.1,146.5,134.0,129.0,125.62,125.57,122.1,69.6.
实施例37:7-辛炔酸的合成
氧气氛围下(氧气球),向schlenk管中依次加入fe(no3)3·9h2o(202.8mg,0.5mmol),tempo(78.3mg,4.0mmol),nacl(29.3mg,0.5mmol),7-辛炔-1-醇(631.4mg,5.0mmol)和1,2-二氯乙烷(dce,20.0ml)。反应在室温下搅拌20小时,tlc监测(石油醚:乙酸乙酯=5:1)直至反应完成。反应混合物经过粗硅胶短柱过滤,乙醚(3×40ml)淋洗。真空旋干溶剂,硅胶柱层析(石油醚:乙酸乙酯=5:1到2:1)得到产品7-辛炔酸(599.1mg,85%)。1hnmr(400mhz,cdcl3)δ11.29(brs,1h,cooh),2.38(t,j=7.6hz,2h,ch2),2.20(td,j1=7.0hz,j2=2.8hz,2h,c≡cch2),1.95(t,j=2.8hz,1h,c≡ch),1.71-1.61(m,2h,ch2),1.60-1.41(m,4h,2×ch2);13cnmr(100mhz,cdcl3)δ180.3,84.2,68.4,33.9,28.02,27.99,24.1,18.2.
实施例38:十六烷基酸的合成(氧气)
氧气氛围下(氧气球),向500ml三口瓶中依次加入fe(no3)3·9h2o(1.6164g,4.0mmol),tempo(625.3mg,4.0mmol),kcl(298.4mg,4.0mmol)和dce(4.0ml)。接着,加入十六烷基醇(9.8191g,98%纯度,40.0mmol)。反应在室温下搅拌16小时,tlc监测(石油醚:乙酸乙酯=5:1)直至反应完成。反应混合物经过粗硅胶短柱过滤,乙醚(4×120ml)淋洗.真空旋干溶剂后,粗产品重结晶纯化(第一次石油醚:乙酸乙酯=10:1重结晶得8.5404g产品,滤液旋干后石油醚:乙酸乙酯=18:1重结晶得1.1413g产品)得到十六烷基酸(9.6817g,94%)。1hnmr(400mhz,dmso-d6)δ11.99(brs,1h,cooh),2.18(t,j=7.4hz,2h,ch2),1.53-1.42(m,2h,ch2),1.32-1.16(m,24h,12×ch2),0.85(t,j=6.6hz,3h,ch3);13cnmr(100mhz,cdcl3)δ180.8,34.1,31.9,29.69,29.67,29.66,29.59,29.43,29.37,29.2,29.0,24.6,22.7,14.1.
实施例39:十六烷基酸的合成(空气+氧气)
向一1l三口瓶中依次加入fe(no3)3·9h2o(1.6162g,4.0mmol),dce(120ml),tempo(625.3mg,4.0mmol),kcl(298.6mg,4.0mmol)和十六烷基醇(9.8968g,98%纯度,40.0mmol)。接着,三口瓶通过抽气阀与一70l空气袋相连。室温下搅拌1.5h后,另一口通过抽气阀与一2l氧气球相连作为氧气补充。反应在室温下继续搅拌,tlc监测(石油醚:乙酸乙酯=5:1)直至反应完成,共经过21.5小时。反应混合物经过粗硅胶短柱过滤,乙醚(4×120ml)淋洗.真空旋干溶剂后,粗产品重结晶(石油醚:乙酸乙酯=15:1)纯化得到十六烷基酸(9.0540g,88%)。1hnmr(400mhz,dmso-d6)δ11.99(brs,1h,cooh),2.18(t,j=7.4hz,2h,ch2),1.52-1.43(m,2h,ch2),1.30-1.19(m,24h,12×ch2),0.85(t,j=6.8hz,3h,ch3);13cnmr(100mhz,cdcl3)δ180.6,34.1,31.9,29.70,29.69,29.67,29.66,29.65,29.59,29.44,29.37,29.24,29.1,24.7,22.7,14.1.
实施例40:十六烷基酸的合成(缓慢空气流)
向一2l三口瓶中依次加入fe(no3)3·9h2o(9.6952g,24.0mmol),tempo(3.7514g,24.0mmol),kcl(1.7885g,24.0mmol)和1,2-二氯乙烷(dce,400ml)。室温搅拌10分钟后,加入十六烷基醇(59.3883g,98%纯度,40.0mmol)和dce(100ml)。三口瓶通过抽气阀通入缓慢空气流,反应在室温下搅拌,tlc监测(石油醚:乙酸乙酯=5:1)直至24小时后反应完成。反应混合物经过粗硅胶短柱过滤,乙醚(3×500ml)淋洗.真空旋干溶剂后,粗产品重结晶(石油醚:乙酸乙酯=20:1)纯化得到十六烷基酸(55.0232g,89%)。1hnmr(400mhz,dmso-d6)δ11.99(brs,1h,cooh),2.18(t,j=7.4hz,2h,ch2),1.52-1.43(m,2h,ch2),1.31-1.18(m,24h,12×ch2),0.85(t,j=6.6hz,3h,ch3);13cnmr(100mhz,cdcl3)δ180.5,34.1,31.9,29.67,29.65,29.64,29.62,29.57,29.42,29.35,29.2,29.0,24.7,22.7,14.1.
实施例41:十二酸的合成
在氧气氛围(氧气球)下,将fe(no3)3·9h2o(40.4mg,0.10mmol),2,2,6,6-四甲基哌啶氮氧化物(tempo,15.5mg,0.10mmol),kcl(7.5mg,0.10mmol),十二醛(184.3mg,1.0mmol)和1,2-二氯乙烷(dce,4ml)加入到schlenk管中。室温搅拌12h,tlc监测直至反应完成。反应混合物经粗硅胶短柱过滤,乙醚(75ml)淋洗,浓缩得粗产品。该粗产品通过硅胶柱层析(石油醚:乙酸乙酯=5:1)得到相应的十二酸(187.9mg,94%)。熔点:43-44℃(石油醚/乙酸乙酯重结晶)(文献值:43-44℃);1hnmr(400mhz,cdcl3)δ=11.56(brs,1h,cooh),2.35(t,j=7.4hz,2h,ch2),1.63(quint,j=7.1hz,2h,ch2),1.40-1.18(m,16h,8×ch2),0.88(t,j=6.6hz,3h,ch3);13cnmr(100mhz,cdcl3)δ180.6,34.1,31.9,29.6,29.4,29.3,29.2,29.0,24.7,22.7,14.1;ms(ei)m/z(%):200(m+,20.99),73(100);ir(neat):v=2954,2916,2871,2848,1697,1470,1429,1411,1351,1328,1302,1277,1248,1220,1193,1084cm-1.
实施例42:环己基甲酸的合成
其他操作参考实施例41,所用原料为环己醛,反应时间为12小时,得到环己基甲酸(115.4mg,90%)(石油醚:乙酸乙酯=5:1)。1hnmr(400mhz,cdcl3)δ=11.43(brs,1h,cooh),2.33(tt,j=11.2,3.6hz,1h,ha),2.00-1.88(m,2h,hb),1.84-1.70(m,2h,he),1.70-1.58(m,1h,hf),1.55-1.38(m,2h,hc),1.37-1.18(m,3h,hdandhg);13cnmr(100mhz,cdcl3)δ=182.9,42.9,28.7,25.6,25.3;ms(ei)m/z(%):128(m+,53.29),55(100);ir(neat):v=2930,2855,1698,1451,1417,1311,1295,1256,1212,1182,1136,1021cm-1.
实施例43:辛酸的合成
其他操作参考实施例41,所用原料为辛醛(128.1mg),反应时间为12小时,得到辛酸(138.4mg,96%)(石油醚:乙酸乙酯=5:1)。1hnmr(400mhz,cdcl3)δ11.33(brs,1h,cooh),2.35(t,j=7.4hz,2h,ch2),1.63(quint,j=7.3hz,2h,ch2),1.38-1.22(m,8h,4×ch2),0.88(t,j=6.8hz,3h,ch3);13cnmr(100mhz,cdcl3)δ=180.6,34.1,31.6,29.0,28.9,24.6,22.6,14.0;ms(ei)m/z(%):144(m+,2.09),60(100);ir(neat,cm-1)=2956,2925,2857,1706,1459,1412,1379,1275,1230,1203,1108cm-1.
实施例44:苯丙酸的合成
其他操作参考实施例41,所用原料为苯丙醛(141.3mg,98%纯度,1.0mmol),反应时间为12小时,得到苯丙酸(144.9mg,96%)(石油醚:乙酸乙酯=5:1到2:1)。1hnmr(400mhz,cdcl3)δ11.56(brs,1h,cooh),7.32-7.25(m,2h,ar-h),7.23-7.16(m,2h,ar-h),2.95(t,j=7.8hz,2h,ch2),2.67(t,j=7.8hz,2h,ch2);13cnmr(100mhz,cdcl3)δ179.6,140.1,128.5,128.2,126.3,35.6,30.5;ms(ei)m/z(%):150(m+,50.1),91(100);ir(neat,cm-1)3030-2620,1693,1602,1497,1448,1427,1407,1358,1300,1216,1158,1082cm-1.
实施例45:十二酸的合成
在100ml圆底瓶中加入fe(no3)3·9h2o(40.5mg,0.1mmol)和dce(4.0ml),接着加入tempo(15.6mg,0.1mmol),kcl(7.5mg,0.1mmol),十二醛(183.8mg,1.0mmol)和dce(1.0ml)。圆底瓶通过抽气阀与空气气球相连。反应在室温下搅拌16小时,直到tlc监测反应完成(石油醚:乙酸乙酯=5:1)。反应混合物经过粗硅胶短柱过滤,乙醚(75ml)淋洗.真空旋干溶剂后,硅胶柱层析(石油醚:乙酸乙酯=5:1)纯化得到十二酸(176.5mg,88%)。1hnmr(400mhz,cdcl3)δ11.49(brs,1h,cooh),2.35(t,j=7.6hz,2h,ch2),1.63(quint,j=7.3hz,2h,ch2),1.40-1.18(m,16h,8×ch2),0.88(t,j=6.8hz,3h,ch3);13cnmr(100mhz,cdcl3)δ=180.5,34.1,31.9,29.6,29.4,29.3,29.2,29.0,24.6,22.7,14.1.
实施例46:环己基甲酸的合成
其他操作参考实施例45,所用原料为环己基甲醛(112.7mg,1.0mmol),反应时间为16小时,得到环己基甲酸(106.4mg,83%)(石油醚:乙酸乙酯=5:1)。1hnmr(400mhz,cdcl3)δ=11.42(brs,1h,cooh),2.33(tt,j=11.2,3.6hz,1h,ha),2.00-1.88(m,2h,hb),1.84-1.70(m,2h,he),1.70-1.60(m,1h,hf),1.55-1.38(m,2h,hc),1.37-1.18(m,3h,hdandhg);13cnmr(100mhz,cdcl3)δ=182.9,42.9,28.7,25.6,25.3.
实施例47:辛酸的合成
其他操作参考实施例45,所用原料为辛醛(128.7mg,1.0mmol),反应时间为16小时,得到辛酸(139.7mg,97%)(石油醚:乙酸乙酯=5:1)。1hnmr(400mhz,cdcl3)δ=11.02(brs,1h,cooh),2.35(t,j=7.6hz,2h,ch2),1.63(quint,j=7.4hz,2h,ch2),1.38-1.18(m,8h,4×ch2),0.88(t,j=6.8hz,3h,ch3);13cnmr(100mhz,cdcl3)δ=180.6,34.1,31.6,29.0,28.9,24.6,22.6,14.0.
实施例48:苯丙酸的合成
其他操作参考实施例45,所用原料为苯丙醛(141.5mg,98%纯度,1.0mmol),反应时间为16小时,得到苯丙酸(147.7mg,98%)(石油醚:乙酸乙酯=5:1到2:1)。1hnmr(400mhz,cdcl3)δ11.09(brs,1h,cooh),7.32-7.25(m,2h,ar-h),7.24-7.17(m,2h,ar-h),2.95(t,j=7.8hz,2h,ch2),2.67(t,j=7.8hz,2h,ch2);13cnmr(100mhz,cdcl3)δ179.5,140.1,128.5,128.2,126.3,35.6,30.5.
实施例49:(ra)-7,8-二十联烯酸(天然产物phlomicacid)的合成
7-辛炔酸合成参考实施例30。
7-辛炔酸甲酯的合成
向一圆底瓶中加入底物7-辛炔酸(981.7mg,7.0mmol)和et2o/meoh混合溶剂(4/1,35ml)。体系降至0℃,滴加tmschn2(2.0m,5.25ml),自然恢复至室温搅拌。tlc显示2小时后反应完全。旋去溶剂。硅胶柱层析纯化(石油醚/乙醚=30/1)得到7-辛炔酸甲酯(898.3mg,83%):1hnmr(400mhz,cdcl3)δ3.67(s,3h,ome),2.33(t,j=7.4hz,2h,ch2),2.20(td,j1=6.9hz,j2=2.5hz,2h,≡cch2),1.95(t,j=2.6hz,1h,≡ch),1.70-1.60(m,2h,ch2),1.60-1.50(m,2h,ch2),1.49-1.39(m,2h,ch2);13cnmr(100mhz,cdcl3)δ174.0,84.2,68.3,51.4,33.8,28.1,28.0,24.3,18.1;ir(neat)ν(cm-1)3296,2943,2863,2117,1738,1460,1436,1364,1325,1263,1205,1174,1145,1087,1071,1008.ms(esi)m/z(%):155.1(m+1)-.
(ra)-7,8-二十联烯酸甲酯的合成:
氩气氛下,在烘干的封管中依次加入cubr2(134.1mg,0.6mmol),(s)-二甲基脯氨醇(387.2mg,3.0mmol),7-辛炔酸甲酯(694.2mg,4.5mmol)/dioxane(4.5ml)和十二醛(830.1mg,4.5mmol)/dioxane(4.5ml).将封管用聚四氟乙烯塞子封紧,置于预先加热好的130℃油浴中搅拌12小时。tlc点板监测(石油醚/乙醚=5/1)。所得的混合物用90mlet2o稀释,用60ml3m的盐酸溶液洗涤。分液,水相用30×3mlet2o萃取。有机相合并,饱和nacl溶液洗涤,无水naso4干燥。过滤、旋干,硅胶柱层析(石油醚/乙醚=100/1)分离得到(ra)-7,8-二十联烯酸甲酯(565.2mg,58%)。95%ee(hplcconditions:chiralcelpa-hcolumn,hexane/i-proh=100/0,1.0ml/min,λ=214nm,tr(major)=17.2min,tr(minor)=22.1min);[α]d30.6=-36.8(c=1.015,chcl3);1hnmr(400mhz,cdcl3)δ5.11-5.00(m,2h,ch=c=ch),3.66(s,3h,ch3),2.30(t,j=7.6hz,2h,ch2),2.02-1.93(m,4h,2×ch2),1.63(quint,j=7.5hz,2h,ch2),1.46-1.20(m,22h,11×ch2),0.88(t,j=6.8hz,3h,ch3);13cnmr(100mhz,cdcl3)δ203.8,174.2,91.1,90.5,51.4,34.0,31.9,29.65,29.63,29.62,29.5,29.3,29.2,29.1,29.0,28.73,28.71,28.6,24.8,22.7,14.1;ir(neat)ν(cm-1)2923,2853,1962,1742,1462,1437,1362,1255,1199,1170,1087,1012;ms(ei)m/z(%)322(m+,6.73),150(100);hrmscalcd.forc21h38o2(m+):322.2872;found:322.2876.
产物(ra)-7,8-二十联烯酸(phlomicacid)的合成:
在圆底瓶中依次加入koh(141.0mg,2.5mmol),混合溶剂(5ml,meoh/h2o=4/1),和(ra)-7,8-二十联烯酸甲酯(322.0mg,1mmol)/混合溶剂(5ml,meoh/h2o=4/1)。体系在60℃下搅拌,tlc监测,2h后反应完全。体系置于冰浴中,滴加3mhcl(ca.1ml)。旋去meoh,加入30mlch2cl2和25ml水。分液,有机相分离,水相用ch2cl2(15ml×3)萃取。合并有机相,饱和nacl溶液洗涤,无水naso4干燥。过滤、旋干,硅胶柱层析(石油醚/乙醚=10/1到2/1)分离得到天然产物phlomicacid(283.6mg,92%)。1hnmr(400mhz,cdcl3)δ11.7(brs,1h,cooh),5.11-5.01(m,2h,ch=c=ch),2.35(t,j=7.6hz,2h,ch2),2.02-1.93(m,4h,2×ch2),1.65(quint,j=7.5hz,2h,ch2),1.49-1.20(m,22h,11×ch2),0.88(t,j=6.8hz,3h,ch3);13cnmr(100mhz,cdcl3)δ203.8,180.5,91.1,90.5,34.1,31.9,29.67,29.66,29.64,29.5,29.4,29.2,29.1,29.0,28.71,28.69,28.5,24.5,22.7,14.1;ir(neat)ν(cm-1)2915,2849,1964,1708,1683,1458,1415,1331,1285,1246,1200.ms(ei)m/z(%):308(m+,5.91),168(100);hrmscalcd.forc20h36o2(m+):308.2715;found:308.2717.
甲酯化衍生测定产物(ra)-7,8-二十联烯酸(phlomicacid)的ee值:
向一圆底瓶中加入天然产物phlomicacid(55.9mg,0.2mmol)和混合溶剂(5ml,et2o/meoh=4/1)。体系降温至0℃后,滴加0.2mltmschn2(2minhexane,0.4mmol)。撤去冰浴,反应混合物自然恢复室温。tlc监测反应,2.5h后反应完全。旋去溶剂,硅胶柱层析(石油醚/乙醚=100/1)分离得到液体(ra)-7,8-二十联烯酸甲酯(63.1mg,97%)。96%ee(hplcconditions:chiralcelpa-hcolumn,hexane/i-proh=100/0,1.0ml/min,λ=214nm,tr(major)=23.7min,tr(minor)=32.3min);[α]d30.5=-39.9(c=0.99,chcl3);1hnmr(400mhz,cdcl3)δ5.11-5.01(m,2h,ch=c=ch),3.67(s,3h,ch3),2.36(t,j=7.6hz,2h,ch2),2.03-1.92(m,4h,2×ch2),1.63(quint,j=7.5hz,2h,ch2),1.46-1.20(m,22h,11×ch2),0.88(t,j=6.8hz,3h,ch3);13cnmr(100mhz,cdcl3)δ203.8,174.2,91.1,90.6,51.4,34.0,31.9,29.66,29.63,29.5,29.3,29.2,29.1,29.0,28.73,28.71,28.6,24.8,22.7,14.1.
实施例50:十二酸(十二过氧酸)的合成
在氧气氛围(氧气球)下,将fe(no3)3·9h2o(40.7mg,0.10mmol),十二醛(184.2mg,1.0mmol)和1,2-二氯乙烷(dce,4ml)加入到schlenk管中。室温搅拌12h,tlc监测直至反应完成。反应混合物经粗硅胶短柱过滤,乙醚(75ml)淋洗,浓缩得粗产品。加入二溴甲烷35μl作内标,核磁定量氢谱(1hnmr)测得十二酸的产率为78%,十二过氧酸的产率为11%。该粗产品通过硅胶柱层析(石油醚:乙酸乙酯=20:1到5:1)得到十二酸和十二过氧酸。十二酸:1hnmr(400mhz,cdcl3)δ11.49(brs,1h,cooh),2.35(t,j=7.6hz,2h,ch2),1.63(quint,j=7.2hz,2h,ch2),1.38-1.21(m,16h,8×ch2),0.88(t,j=6.6hz,3h,ch3);13cnmr(100mhz,cdcl3)δ=180.6,34.1,31.9,29.6,29.4,29.3,29.2,29.0,24.6,22.7,14.1.十二过氧酸:1hnmr(400mhz,cdcl3)δ11.38(brs,1h,co3h),2.42(t,j=7.6hz,2h,ch2),1.70(quint,j=7.3hz,2h,ch2),1.39-1.19(m,16h,8×ch2),0.88(t,j=6.8hz,3h,ch3);13cnmr(100mhz,cdcl3)δ=174.7,31.9,30.4,29.54,29.51,29.32,29.29,29.0,28.9,24.6,22.7,14.1.
- 还没有人留言评论。精彩留言会获得点赞!