一种兼具抗肿瘤和抗肿瘤转移活性的二甲双胍偶联物及其应用的制作方法
本发明涉及药物领域,具体的涉及一种兼具抗肿瘤和抗转移活性的二甲双胍偶联物的制备及其应用。
背景技术:
恶性肿瘤是严重危害人类健康的重大疾病之一,约80%的肿瘤患者主要的死亡原因是局部复发和远处转移近。统计资料显示直肠癌在手术切除后5年内,尚有50%的患者发生肝转移,肝癌在根治性切除后5年内,仍有60%-70%的患者出现转移,60%的宫颈癌患者存在盆腔转移,60%-70%的卵巢癌患者也存在多处转移。肿瘤转移的过程涉及到细胞从原发灶点脱落、浸润相邻组织、降解细胞外基质、迁移运动以及新生血管生成等过程。从理论上来说,只要能够有效干预以上这些环节中的某个或某些过程,就有望对肿瘤转移产生显著的抑制作用。随着对肿瘤转移过程的了解和深入,近年来人们一直致力于新型抗肿瘤药物的研究,其中有效抑制肿瘤细胞转移的药物是一个新的药物开发方向。相对于传统化学合成药物, 开发天然药物具有资金投入少、研究周期短、筛选效率高等优点。因此越来越多的新的化学实体和各种天然化合物被广大科研工作者所发现,并应用到抑制肿瘤细胞转移的发生发展过程中。
熊果酸(ursolicacid, UA)即3β-羟基-熊果-12-烯-28-酸(3β-hydroxy-urs-12-en-28-oic acid,UA),又名乌索酸,是一种五环三萜类化合物,其相对分子量为456.68,分子式为C30H48O3,具有抗癌、肝损伤保护、抗菌消炎和抗病毒等多方面的药理学活性,综述了近十年来熊果酸在癌的化学预防和治疗领域的新进展。熊果酸毒性小,抗肿瘤谱广,资源丰富,很可能会成为新的抗肿瘤药。但是UA的水溶性差,导致其制剂制备困难和体内生物利用低等问题,因此通过对UA的结构进行修饰,以提高难溶性UA的溶解度,从而进一步提高其抗癌活性,并有效改善其生物利用度,正日益成为科研工作者研究的热点和难点。过去的十年中,熊果酸及其衍生物在抗肿瘤转移中的研究越来越深入,研究表明熊果酸可以通过抑制肿瘤血管新生、降低肿瘤细胞外基质降解、削弱癌细胞的粘附能力以及影响转移过程中的信号转导等多个层面来抑制肿瘤细胞的侵袭转移,因此熊果酸及其衍生物可以被用来控制多种肿瘤转移的发生。本课题组专利N 201510466210.4首次公开了将熊果酸及其衍生物和阿司匹林偶联物ASP-UA,对熊果酸进行改性并将用ASP-UA于治疗预防乳腺癌转移中。本课题组专利N 201410189256.1也公开了熊果酸衍生物(US597)对肿瘤细胞的增殖、粘附、迁移等具有显著的抑制作用。
UA1,结构如式III所示,该化合物可明显改善UA的溶解度,理化性质更加稳定;此外跟UA对比,其对不同种类肿瘤细胞均具有更显著的增殖抑制作用,且对正常细胞毒性较低,提示其具有安全、高效和低毒的特点,可望将其应用于肿瘤转移的早期预防和治疗中。
二甲双胍(Metformin,简称Met),其相对分子量为129.10,分子式为C4H11N5,被认为是胰岛素增敏剂之一,二甲双胍作为治疗Ⅱ糖尿病经典而有效的药物,已有近50年的临床应用历史,还用于治疗多囊卵巢综合症、假性黑棘病等。二甲双胍为强水溶性性药物,口服后主要在小肠吸收,生物利用度为50-60%左右。目前二甲双胍在各国的糖尿病治疗指南中均被推荐为首选用药,且无禁忌症,它的作用机理不同于其他类型的口服抗血糖药,它可减少肝糖的产生,降低小肠对糖的吸收,并且还可增加外周糖的摄取和利用,从而提高胰岛素的敏感性,它在糖尿病治疗中的威望也与日俱增,成为全球抗击糖尿病的核心药物。专利N201310069025.2首先公开了一种二甲双胍的新用途,证明了二甲双胍能够抑制子宫内膜癌细胞的增殖。
本发明首次将以熊果酸及其衍生物为先导物,利用化学修饰的方法对熊果酸及其衍生物的C-28位进行结构修饰,选用兼具多种生物学效应的含胍基类的药物进行偶联反应,制得抗癌前药:二甲双胍-熊果酸及其衍生物,期望得到的新化合物能起到全面的、两者协同的抗肿瘤转移作用,提高熊果酸及其衍生物的抗肿瘤转移活性,提高熊果酸及其衍生物的生物利用度,同时能够降低两者的毒副作用,为抗肿瘤转移方面的应用提供两者协同作用理论研究基础。以A549、HepG2、LO2和HELF细胞作为研究对象,通过二甲双胍和熊果酸的偶联及二甲双胍和UA1的偶联,对A549、HepG2、LO2和HELF进行体外抗转移、侵袭、增殖等活性测试,结果表明,UA-Met及UA1-Met均能有效癌症的迁移。
技术实现要素:
一种兼具抗肿瘤和抗转移活性的二甲双胍偶联物的制备及其应用,其特征在于其结构如式I或II所示:
I;
II。
UA-Met偶联物(式I)的制备方法如下:
a)UA和DCC用四氢呋喃搅拌溶解;
b)NHS用乙腈搅拌溶解,于冰浴上逐滴加入到a溶液中;
c)反应24h后,待UA反应完全后,过滤除去不溶物,过柱纯化的活化后的UA纯品;
d)活化后的UA和盐酸二甲双胍用乙醇搅拌溶解,于室温下反应24h,过柱纯化得到UA-Met偶联物纯品。
UA1-Met偶联物(式II)的制备方法如下:
a)二氯甲烷,吡啶,熊果酸,醋酸酐,少量DMAP,室温磁力搅拌过夜;
b)向a中补充加入二氯甲烷,用1N HCl溶液萃取有机层两次,收集有机层;
c)与b步骤相同,用饱和NaHCO3溶液萃取b得到的有机层2次,最后分出有机层。
d)向c中得到的有机层中加入无水硫酸钠充分搅拌干燥),过滤;
e)旋转蒸发仪蒸除溶剂,得粗品。
f)柱层析纯化得纯白色粉末UA1。
g)UA1和DCC用四氢呋喃搅拌溶解;
h)NHS用乙腈搅拌溶解,于冰浴上逐滴加入到g溶液中;
i)反应24h后,待UA1反应完全后,过滤除去不溶物,过柱纯化的活化后的UA1纯品;
j)活化后的UA1和盐酸二甲双胍用乙醇搅拌溶解,于室温下反应24h,过柱纯化得到UA1-Met偶联物纯品。
附图说明
图1.偶联物UA-Met红外表征图谱;
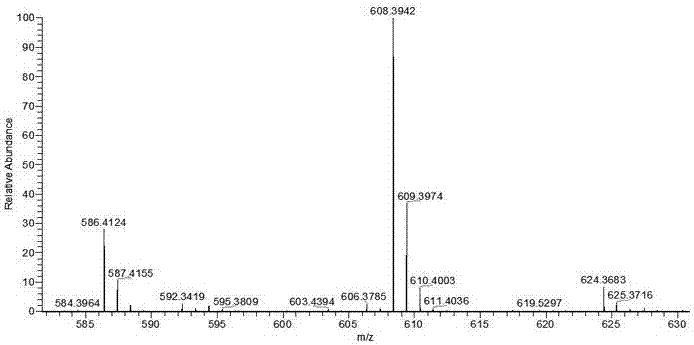
图2.偶联物UA-Met质谱图谱;
图3.偶联物UA-Met作用24h后对不同细胞株的增殖抑制作用;
图4.偶联物UA-Met作用48h后对不同细胞株的增殖抑制作用;
图5.偶联物UA-Met作用72h后对不同细胞株的增殖抑制作用;
图6.偶联物UA1-Met作用24h后对不同细胞株的增殖抑制作用;
图7.偶联物UA-Met作用24h对非小细胞肺癌A549侵袭能力的影响;
图8.偶联物UA-Met作用24h对非小细胞肺癌A549侵袭的抑制率;
图9.偶联物UA1-Met作用24h对非小细胞肺癌A549侵袭能力的影响;
图10.偶联物UA1-Met作用24h对非小细胞肺癌A549侵袭的抑制率;
图11.偶联物UA-Met作用24、48、72h后对非小细胞肺癌A549迁移能力的影响;
图12.偶联物UA-Met作用24h对非小细胞肺癌A549迁移的抑制率;
图13.偶联物UA-Met作用48h对非小细胞肺癌A549迁移的抑制率;
图14.偶联物UA-Met作用72h对非小细胞肺癌A549迁移的抑制率。
具体实施方式
为了使本发明所述的内容更加便于理解,下面结合具体实施方式对本发明所述的技术方案做进一步的说明,但是本发明不仅限于此。
实施例1
室温下,200mg的UA(熊果酸)和181mg的DCC用3ml的THF搅拌溶解;反应瓶在冰浴上逐滴加入事先用1.7ml乙腈溶解的101mg NHS。室温下搅拌反应24h,待UA反应完全后,过滤除去不溶物,减压蒸除溶剂,柱层析得活化后的UA纯品。取100mg活化后的UA纯品和30mg的Met用5 ml的甲醇搅拌溶解,室温下反应24 h后,减压蒸除溶剂,柱层析得UA-Met纯品。
结果如图1-2所示。
实施例2
①250mL圆底烧瓶,加入二氯甲烷20ml,吡啶20ml,熊果酸1g,醋酸酐3.5mL。加少量DMAP,室温磁力搅拌过夜;
②向①瓶中补充加入100ml二氯甲烷,分别用100mL 1N HCl 溶液萃取②得到的有机层2次,收集有机层;
③与②步骤相同,分别用饱和NaHCO3溶液萃取②得到的有机层2次,每次用量100mL,最后分出有机层;
④向③中得到的有机层中加入无水硫酸钠充分搅拌干燥(约4勺),过滤;
⑤旋转蒸发仪蒸除溶剂,得粗品;
⑥柱层析纯化得纯白色UA1;
⑦室温下,200mg的UA1和170.9mg的DCC用3ml的THF搅拌溶解;反应瓶在冰浴上逐滴加入事先用1.7ml乙腈溶解的95.5mg NHS,室温下搅拌反应24h;
⑧待UA1反应完全后,过滤除去不溶物,减压蒸除溶剂,柱层析得活化后的UA1纯品;
⑨取100mg活化后的UA1纯品和28.6mg的Met用5ml的甲醇搅拌溶解,室温下反应24h后;
⑩减压蒸除溶剂,柱层析得UA1-Met纯品。
实施例3
将实施例1 所得的纯品进行氢谱1H NMR检查为UA-Met
1H NMR(400MHz,Chloroform-d,ppm):δ=8.53(s,1H),5.32(s,1H),4.02(s,1H),3.60 (pd,J=7.0,5.0Hz,1H),2.87(s,6H),2.09-1.86(m,2H),1.84-1.39(m,10H),1.37-1.26(m,2H),1.31-1.18(m,3H),1.22-1.00(m,3H),1.04-0.89(m,16H),0.83(s,3H),0.78(s,3H).
实施例4
抗癌活性实验通过细胞毒性来实现,采用标准MTT 比色法测定了偶联药UA-Met对不同细胞株增殖抑制活性。具体步骤为:将对数期的细胞,用胰酶消化后,细胞计数,配成5×104-1×105/ml的细胞浓度,将制得的细胞悬液,每孔100 μL接种到96孔板,放于37℃、5% CO2培养箱中培养24 h,弃掉旧的培养基,加入配制好的不同浓度样品,药物作用24、48和72 h 后,吸弃含药培养基,于每孔中加入100 μL稀释好的MTT溶液(0.5 mg/ml MTT的母液:无血清无酚红培养基=1:9),继续孵育4 h后,终止培养;小心吸弃96孔板孔内上清液,每孔加入100 μL DSMO,振荡10 min,于570 nm 波长处在酶标仪上测定各孔光吸收值(OD值),计算细胞成活率(%)=(用药组平均OD值/空白对照组平均OD值)×100%。用GraphPad Prism 软件进行数据处理,结果见下图3-5。
实验结果如图3-5所示,熊果酸给药组、二甲双胍给药组、UA-Met给药组作用于多种细胞株24、48和72 h之后,熊果酸给药组对多种细胞株具有不同程度的增殖抑制作用,并呈浓度依赖性和时间依赖性,在>25 μM的条件下能有效的抑制A549和HepG2两株癌细胞的增殖,细胞死伤达一半,但对HELF和LO2两株正常细胞株表现出很大的细胞毒性,杀伤癌细胞的同时也杀伤了正常的组织细胞;二甲双胍在≤100 μM的条件下,对多种细胞株没有杀伤,不能抑制细胞的增殖;UA-Met给药组对多种细胞株也有不同程度的增殖抑制作用,并呈浓度依赖性和时间依赖性,但在>50 μM的条件下能有效的抑制A549和HepG2两株癌细胞的增殖,细胞死伤达一半;但与熊果酸相比明显的降低了对HELF和LO2两株正常细胞株的细胞毒性。综上结果可以发现,UA-Met能够明显降低UA对正常细胞株的毒副作用,且呈浓度依赖性和时间依赖性的抑制癌细胞的增殖。
实施例5
抗癌活性实验通过细胞毒性来实现,采用标准MTT 比色法测定了偶联药UA1-Met对不同细胞株的增殖抑制活性。步骤如实施例4,结果如图6所示。
实验结果如图6所示,当UA1给药组、二甲双胍给药组、UA1-Met给药组作用于多种细胞株24、48、72 h之后,UA1给药组熊果酸给药组对多种细胞株具有不同程度的增殖抑制作用,并呈浓度依赖性和时间依赖性,在>25 μM的条件下能有效的抑制A549和HepG2两株癌细胞的增殖,细胞死伤达一半,但对HELF和LO2两株正常细胞株表现出很大的细胞毒性,杀伤癌细胞的同时也杀伤了正常的组织细胞;二甲双胍在≤100 μM的条件下,对多种细胞株没有杀伤,不能抑制细胞的增殖;UA1-Met给药组对多种细胞株也有不同程度的增殖抑制作用,并呈浓度依赖性和时间依赖性,但在>50 μM的条件下能有效的抑制A549和HepG2两株癌细胞的增殖,细胞死伤达一半;但与UA1相比明显的降低了对HELF和LO2两株正常细胞株的细胞毒性。综上结果可以发现,UA1-Met能够明显降低UA1对正常细胞株的毒副作用,且呈浓度依赖性和时间依赖性的抑制癌细胞的增殖。
实施例6
熊果酸和二甲双胍单独使用以及UA-Met的使用对非小细胞肺癌A549侵袭能力的影响。
A549细胞先加无血清无酚红培养基饥饿过夜,消化、离心收集的细胞用空白培养基悬浮。取12孔板,在小室的上室中加入500 μL用空白的培养基配制好的不同浓度样品的细胞悬浮液 (约5×105/孔),下室加500 μL含10%小牛血清的培养基,药物作用24 h后,取出小室,用4%的多聚甲醛固定20 min,用棉签擦掉上层未迁移细胞,用PBS洗3次,用0.1%结晶紫染色30 min,用PBS洗三次,将小室的底膜取下,用甘油封片保存,倒置显微镜下随机5个视野下拍照,结果见下图7、8。
实验结果如图7、8 所示熊果酸和二甲双胍单独使用以及UA-Met作用24 h后对A549细胞侵袭能力的检测,结果表明,空白对照组、熊果酸和二甲双胍单独使用组,穿过微孔滤膜的细胞数明显高于UA-Met给药组且呈浓度依赖性的抑制细胞的侵袭,特别是在UA-Met≥20 μM的条件下,穿过微孔滤膜的细胞数明显的减少很多,UA-Met可以明显的抑制细胞的侵袭能力。
实施例7
UA1和二甲双胍单独使用以及UA1-Met的使用对非小细胞肺癌A549侵袭能力的影响。
步骤如实施例6所示,结果如图9、10所示。
实验结果如图9、10 所示UA1和二甲双胍单独使用以及UA1-Met作用24 h后对A549细胞侵袭能力的检测,结果表明,空白对照组、熊果酸和二甲双胍在低浓度的条件下,穿过微孔滤膜的细胞数明显高于UA1-Met给药组且呈浓度依赖性的抑制细胞的侵袭,UA1-Met可以明显的抑制细胞侵袭能力。
实施例8
UA-Met药物对非小细胞肺癌A549细胞迁移能力的影响。
先用记号笔在12孔板板背部1/4、1/2和3/4处水平划3条直线再进行细胞接种,取对数生长期的A549细胞(约4×106/孔)接种于该板中,置于37℃,5% CO2 的培养箱中培养24 h,待细胞接近融合后,用200 μl移液枪枪头垂直于三条平行线方向划线,用PBS清洗细胞3次;加入用无血清无酚红培养基(含2%胎牛)配制好的不同浓度样品,药物作用24、48和72 h并拍照,记录下所拍图片的坐标轴,培养24、48、72 h后,同一部位再次拍照,测定迁移距离,对比各组两次拍照的迁移距离,结果见下图11-14。
实验结果如图11-14所示熊果酸和二甲双胍单独使用以及UA-Met作用24、48和72 h后对A549细胞迁移抑制率检测,结果表明:在0h,给药干预组与空白对照组对比迁移距离无明显影响;经给药24 h后,空白对照组,熊果酸和二甲双胍单独使用时,细胞明显发生了迁移,划痕距离变窄;UA-Met作用组,在1 μM的条件下,细胞的划痕愈合也发生了明显的迁移,但随着药物浓度的增大,细胞的迁移能力受到了显著抑制,划痕距离明显没那么窄;经给药48 h后,24 h的结果相比,空白对照组,熊果酸和二甲双胍单独使用时,划痕宽度也明显减小很多;UA-Met作用组在≥5 μM的条件下可以明显的抑制了A549细胞的迁移,而且表现出浓度依赖性,随着药物浓度的增大迁移距离明显减少;经给药72 h后,空白对照组,熊果酸和二甲双胍单独使用时,细胞划痕距离已经趋于闭合,划痕宽度发生了很明显的变化,而UA-Met给药组在≥5 μM的条件下也能够明显抑制了A549细胞的迁移,且表现出浓度依赖性,特别是当UA-Met在20 μM的条件下的细胞划痕宽度和0 h的空白对照组相比,迁移距离变化不明显,细胞间的间隙增大,细胞零零散散的分布,细胞数明显的减少很多。
- 还没有人留言评论。精彩留言会获得点赞!