与BM1表型有关的基因和变异、分子标志物、及其用途的制作方法
优先权要求
本申请要求2011年1月3日提交的美国临时专利申请流水号61/429,390关于“GENE AND VARIATIONS ASSOCIATED WITH BM1PHENOTYPE,MOLECULAR MARKERS,AND THEIR USE”的提交日权益。
发明领域
本公开内容涉及玉米褐色中脉(bm)表型。在具体的实施方案中,本公开内容关注玉米中特定的改变的CAD2基因、包含改变的CAD2基因的核酸分子、和/或源自此类核酸分子翻译的蛋白质产物,所述改变的基因促成一些玉米品种的bm1表型。
发明背景
木质素是植物中与碳水化合物,诸如细胞壁中的半纤维素形成交联的通用组分。木质素和纤维素是植物细胞壁的两种主要成分。植物细胞壁提供一种针对胞外环境的天然屏障。许多研究已经表明植物对生物应激(例如,病原性感染)或非生物应激(例如,干旱、机械应激,等等)的响应之一由植物细胞壁的加强(特别是通过增加植物细胞壁中的木质素含量实现)组成。许多农艺学或工业应用关注期望的植物产物(例如,用于纸生产、青贮饲料生产、和产生例如生物燃料形式的能量的产物),其产量与植物细胞壁中木质素的含量和/或组成直接相联系。
木质素聚合物限制玉米植物中纤维的消化率(digestibility)。木质素聚合物在反刍类中降低纤维消化,并且木质化的程度可以与饲料作物消化率成反比。Cherney等(1991)Adv.Agron.46:157-98。调控木质素含量和组成对于提高草料的消化率可以是期望的。木质素含量调控例如对于加强植物壁,并且由此改善对应激的抗性;或相反地,减弱植物壁以促进纤维素或其它化学化合物的提取也可以是期望的。Baucher等(1998)Plant Mol.Biol.39:437-47。
然而,难以知道如何修饰木质素生物合成途径,以及预测修饰的后果会是什么。这至少部分是因为木质素生物合成途径是一种牵涉大量酶促反应的复杂途径。参见例如Dixon等(2001)Phytochemistry 57(7):1069-84。可以在生理学上改变所述途径,例如以补充通过对该途径的修饰引入的变化的可能的机制是未知的。
木质素是一种3种醇单体或单体木质醇(monolignols):对香豆醇(H亚单位)、松柏醇(G亚单位)、和芥子醇(S亚单位)(其源自类苯丙烷(phenylpropanoid)途径)的不溶性聚合物。Neish(1968)Constitution and Biosynthesis of Lignin,eds.New York,Springer Verlag 1-43。每类亚单元可以与其它亚单元形成多种键,并且由此构成木质素。也可以与其它同壁化合物(例如多糖和蛋白质)建立其它键,从而形成复杂的三维网络。
复杂的木质素生成途径中的步骤包括羟基化、芳香环的O-甲基化、和羧基侧链转化成醇官能。目前关于单体木质醇生物合成途径的假说包括在代谢网络中在侧链的多个氧化水平上的连续羟基化和O-甲基化反应,由此导致S和G亚单位的形成。网络的酶包括咖啡酸3-O-甲基转移酶(COMT);羟基肉桂酸(hydroxyxinamate)辅酶A连接酶(4CL);细胞色素P450依赖性阿魏酸5-羟化酶(F5H);和肉桂酰CoA还原酶(CCR)的和肉桂醇脱氢酶(CAD)的几种同等型。
几年来,已经尝试通过过表达或表达不足木质素生物合成途径的一种或多种基因来修饰植物的木质素含量和组分。Anterola and Lewis(2002)Phytochemistry 61:221-94。虽然已经设想各种策略,但是木质素生物合成途径中的一种或多种酶的过表达或表达不足不总是给出可靠且可预测的结果。
另一种策略由在选择方案中使用木质素生物合成途径中靶定基因的突变体构成。含有褐色中脉(bmr)突变的植物展现出改变的木质素组成和消化率。在玉米中,已经鉴定出至少四处独立的褐色中脉突变。Kuc等(1968)Phytochemistry 7:1435-6。在与对照玉米相比时,这些突变(称作“bm1、bm2、bm3和bm4”)都展现出降低的木质素含量。褐色中脉玉米植物的特征在于V4至V6阶段的叶中脉中的褐色色素沉着和抽穗后髓的浅褐色着色。一种表征的bmr突变是COMT酶中的插入突变(bm3)。
成熟的bm1玉米植物具有降低10-20%的木质素含量、阿魏酸酯的略微减少、和实质性降低的对香豆酯和阿魏酸酯含量(约40%)。Provan等(1997)J.Agric.Food 73:133-42;Barriére等(2004)Comptes Rendus Biologie 327:847-60。对羟基苯基、愈创木基、和紫丁香基(syringyl)硫代酸解(thioacidolysis)单体的频率在bm1和野生型植物中是相似的,显示了bm1突变没有特异性影响单一类型的木质素亚单位。Guillaumie等(2007)Planta 226(1):235-50。bm1植物的木质素似乎确实实质性富含碳-碳亚单位间连接(Halpin等(1998)Plant J.14(5):545-53;Barriére等(2004),见上文),并且bm1木质素具有松柏醛(coniferaldehyde)和在较小程度上芥子醛的实质性掺入。Kim等(2002)J.Biol.Chem.277:47412-9。
玉米(玉蜀黍)的农业上重要的用途包括青贮饲料。青贮饲料是可以喂养反刍类的发酵的、高水分的草料。它在称作饲料青贮或青贮的方法中发酵并贮存,并且通常使用整个绿色植物自玉米或其它禾本科作物,包括高粱或其它谷类生成。通常给奶牛喂养散装青贮饲料,而倾向于对肉牛、绵羊和马使用捆装青贮饲料。因为青贮饲料经历发酵过程,所以能量被发酵性细菌使用以生成保护草料的挥发性脂肪酸,诸如乙酸盐、丙酸盐、乳酸盐和丁酸盐。结果是青贮饲料比初始草料在能量上更低,因为发酵性细菌使用一些碳水化合物来生成挥发性脂肪酸。玉米青贮饲料是反刍类动物的一种普遍草料,这是因为它在能量和消化率上较高,而且容易适合于从站立植物(stand-crop)至喂养时的机械化。一般地,玉米青贮饲料在颜色上为略微褐色至深绿色的,并且具有轻度的、令人愉快的气味。
褐色中脉玉米(bm玉米)中降低的木质素生成具有比正常的玉米更可消化并且展现出改善的生物燃料转化率的纤维的青贮饲料。已经显示了给泌乳的奶牛喂养bmr玉米青贮饲料增加干物质摄取(DMI)和牛奶产量。Grant等(1995)J.Dairy Sci.78:1970-80;Oba和Allen(2000)J.Dairy Sci.83:1333-41;Oba和Allen(1999)J.Dairy Sci.82:135-42。然而,与来自常规玉米品种的玉米青贮饲料相比,BMR玉米青贮饲料在肉牛中降低平均日增重与饲料效率(gain and feed efficiency,G:F)。Tjardes等(2000)J.Anim.Sci.78:2957-65。通常还发现褐色中脉杂种玉米系是低产量的。通常还已经将褐色中脉杂种玉米与草料倒伏和缺乏可竖立性(standability)联系起来。
发明概述
本文中描述了包含促成玉米(玉蜀黍)中的bm1表型的突变体CAD2基因的核酸分子。还描述了与突变体玉米CAD2基因连锁的或驻留于突变体玉米CAD2基因内的分子标志物。令人惊讶地,木质素生物合成的复杂途径在存在突变体CAD2基因的情况下明显改变,使得含有突变体CAD2基因的植物具有比存在于野生型植物中的那些木质素水平低的木质素水平。突变体CAD2基因的表征和与突变体CAD2基因连锁的标志物的鉴定可以大大促进植物种质中降低的木质素表型的开发和部署。在一些实施方案中,可以使用与突变体玉米CAD2基因连锁的或驻留于突变体玉米CAD2基因内的标志物,或突变体玉米CAD2基因序列自身来将突变体玉米CAD2基因导入其它生物体,例如植物、酵母和原生生物中。
在具体的实施方案中,依照本公开内容的突变体CAD2基因可以包含编码截短的CAD2蛋白的核苷酸序列。例如,在CAD2基因的外显子(例如外显子3)或内含子(例如内含子1)中包含插入突变的突变体CAD2基因可以引入提前终止密码子,这生成较短的基因产物。在一些实施方案中,依照本公开内容的突变体CAD2基因可以包含一种或多种玉米系中的天然存在突变。在一些实施方案中,从已知的bmr玉米品种;例如515Dbm1分离突变体CAD2基因。在其它实施方案中,从先前未知的bmr玉米品种;例如DASbm1克隆突变体CAD2基因。在植物中表达时,依照本公开内容的突变体CAD2基因可以导致植物中的表型,例如植物组织中降低的CAD2RNA水平,和/或植物组织中降低的木质素含量。
本文中还描述了使用与依照本公开内容的突变体玉米CAD2基因连锁的或驻留于依照本公开内容的突变体玉米CAD2基因内的核酸分子标志物的方法,例如但不限于:用以鉴定具有降低的木质素表型的植物;以将突变体玉米CAD2基因引入新植物基因型(例如,经由标志物辅助育种或遗传转化进行);以区别野生型CAD2基因和依照本公开内容的特定的突变体CAD2基因;以及以自第一植物和第二植物的杂交生成植物和植物种子,所述第一植物包含与依照本公开内容的突变体玉米CAD2基因连锁的或驻留于依照本公开内容的突变体玉米CAD2基因内的核酸分子标志物,所述第二植物任选地携带突变体玉米CAD2基因。在一些实施方案中,将突变体玉米CAD2基因工程化改造入与玉米不同的植物物种中。
进一步描述了用于生成包含突变体玉米CAD2基因的经遗传修饰的植物(例如玉米)的手段,和用于鉴定携带突变体玉米CAD2基因的植物(例如玉米)的手段。用于生成包含突变体玉米CAD2基因的经遗传修饰的植物的手段是与依照本公开内容的突变体玉米CAD2基因连锁的或驻留于依照本公开内容的突变体玉米CAD2基因内的标志物。用于鉴定携带突变体玉米CAD2基因的植物的手段是与标志物特异性杂交的探针,所述标志物与依照本公开内容的突变体玉米CAD2基因连锁或驻留于依照本公开内容的突变体玉米CAD2基因内。
公开了用于提高青贮饲料喂养动物的肉量的方法,其例如通过提高玉米青贮饲料的增重饲料比(gain to feed ratio,G:F)进行。在一些实施方案中,用于提高青贮饲料喂养动物的肉量的方法可以包括提供自包含依照本公开内容的突变体玉米CAD2基因的玉米获得的植物材料,使用该植物材料生产玉米青贮饲料,并将玉米青贮饲料在肥育给粮(finishing ration)中掺入以给反刍类喂养。如此,还提供了从以依照本公开内容或依照方法的肥育给粮喂养的动物生产的肉类和肉类产品。
具体而言,本公开提供:
1.一种分离的核酸分子,其包含编码与SEQ ID NO:3具有至少90%氨基酸同一性的突变体肉桂醇脱氢酶2蛋白的核苷酸序列。
2.一种分离的核酸分子,其包含编码与SEQ ID NO:25具有至少90%氨基酸同一性的突变体肉桂醇脱氢酶2蛋白的核苷酸序列。
3.一种分离的核酸分子,其包含与SEQ ID NO:1至少80%相同的核苷酸序列。
4.一种分离的核酸分子,其包含与SEQ ID NO:23至少80%相同的核苷酸序列。
5.一种分离的核酸分子,其包含与SEQ ID NO:2至少80%相同的核苷酸序列。
6.一种分离的核酸分子,其包含与SEQ ID NO:24至少80%相同的核苷酸序列。
7.一种分离的核酸分子,其包含与SEQ ID NO:62至少80%相同的核苷酸序列。
8.一种分离的核酸分子,其包含与SEQ ID NO:63至少80%相同的核苷酸序列。
9.项7的核酸分子,其进一步包含与SEQ ID NO:63至少80%相同的核苷酸序列。
10.项7的核酸分子,其中所述核酸分子编码缺乏NADPH结合域和C端催化域的截短的CAD2蛋白。
11.一种分离的核酸分子,其由SEQ ID NO:1的突变体肉桂醇脱氢酶2(CAD2)基因组成。
12.一种分离的核酸分子,其由SEQ ID NO:23的突变体肉桂醇脱氢酶2(CAD2)基因组成。
13.一种突变体肉桂醇脱氢酶2蛋白,其由与SEQ ID NO:3具有至少90%同一性的氨基酸序列组成。
14.一种突变体肉桂醇脱氢酶2蛋白,其由与SEQ ID NO:25具有至少90%同一性的氨基酸序列组成。
15.一种突变体肉桂醇脱氢酶2蛋白,其由SEQ ID NO:3组成。
16.一种突变体肉桂醇脱氢酶2蛋白,其由SEQ ID NO:25组成。
17.一种用于生成转基因玉米植物的方法,包括将提前终止密码子引入所述玉米植物中的CAD2基因中。
18.依照项16的方法,其中通过将AC二核苷酸插入引入所述玉米植物中的所述CAD2基因的外显子3中来引入所述提前终止密码子。
19.依照项16的方法,其中通过将插入引入所述玉米植物中的所述CAD2基因的内含子1中来引入所述提前终止密码子。
20.一种植物,其包含项1的核酸分子。
21.一种植物,其包含项2的核酸分子。
22.项20的植物,其中所述植物是玉蜀黍(Zea mays)。
23.项21的植物,其中所述植物是玉蜀黍。
24.一种用于鉴定包含突变体肉桂醇脱氢酶2(CAD2)基因的植物的方法,该方法包括:
从植物分离核酸分子;并
对分离的核酸分子筛选在与野生型CAD2基因的核苷酸3994对应的位置处包含AC二核苷酸插入的核酸分子,其中在与野生型CAD2基因的核苷酸3994对应的位置处存在AC二核苷酸插入指示突变体CAD2基因。
25.一种用于鉴定包含突变体肉桂醇脱氢酶2(CAD2)基因的植物的方法,该方法包括:
从植物分离核酸分子;并
对分离的核酸分子筛选在与野生型CAD2基因的核苷酸2786对应的位置处包含转座子插入的核酸分子,其中在与野生型CAD2基因的核苷酸2786对应的位置处存在转座子插入指示突变体CAD2基因。
26.依照项24的方法,其中筛选所述分离的核酸分子包括聚合酶链式反应。
27.依照项25的方法,其中筛选所述分离的核酸分子包括聚合酶链式反应。
28.依照项26的方法,其中使用至少两个能够与SEQ ID NO:1特异性杂交的引物实施聚合酶链式反应。
29.依照项28的方法,其中所述引物包含选自下组的引物:SEQ ID NO:43,SEQ ID NO:44,SEQ ID NO:52,SEQ ID NO:54,和SEQ ID NO:55。
30.依照项27的方法,其中使用至少两个能够与SEQ ID NO:23特异性杂交的引物实施聚合酶链式反应。
31.依照项30的方法,其中所述引物包含选自下组的引物:SEQ ID NO:47,SEQ ID NO:49,和SEQ ID NO:50。
32.一种通过依照项24的方法鉴定的植物。
33.项32的植物,其中所述植物是玉蜀黍。
34.一种通过依照项25的方法鉴定的植物。
35.项34的植物,其中所述植物是玉蜀黍。
36.依照项32的植物,其中所述植物具有褐色中脉表型。
37.依照项34的植物,其中所述植物具有褐色中脉表型。
38.依照项36的植物,其中所述玉蜀黍植物具有至少一种选自下组的性状:降低的木质素、升高的消化率、和乙醇产量。
39.依照项37的植物,其中所述玉蜀黍植物具有至少一种选自下组的性状:降低的木质素、升高的消化率、和乙醇产量。
40.一种用于在玉米中引入褐色中脉1(bm1)表型的方法,所述方法包括:
将具有所述bm1表型的玉米植物与缺乏所述bm1表型的玉米植物杂交以生成F1玉米植物;
使用标志物辅助选择来鉴定在与野生型CAD2基因的核苷酸3994对应的位置处包含AC二核苷酸插入的F1玉米植物;并
繁殖鉴定的F1玉米植物,由此在玉米中引入所述褐色中脉1(bm1)表型。
41.一种用于在玉米中引入褐色中脉1(bm1)表型的方法,所述方法包括:
将具有所述bm1表型的玉米植物与缺乏所述bm1表型的玉米植物杂交以生成F1玉米植物;
使用标志物辅助选择来鉴定在与野生型CAD2基因的核苷酸2786对应的位置处包含转座子插入的F1玉米植物;并
繁殖鉴定的F1玉米植物,由此在玉米中引入所述褐色中脉1(bm1)表型。
42.一种生成遗传工程化生物体的方法,包括将项1的核酸分子导入生物体中。
43.依照项42的方法,其中所述生物体是植物。
44.依照项43的方法,其中所述植物是玉蜀黍。
45.依照项44的方法,其中通过与包含项1的核酸分子的玉蜀黍植物杂交将项1的核酸分子导入所述玉蜀黍植物中。
46.依照项42的方法,其中通过遗传转化将项1的核酸分子导入所述生物体中。
47.依照项46的方法,其中将项1的核酸稳定整合入所述生物体的基因组中。
48.依照项46的方法,其中所述生物体是植物。
49.依照项48的方法,其中所述植物是玉蜀黍。
50.一种生成遗传工程化生物体的方法,包括将项2的核酸分子导入生物体中。
51.依照项50的方法,其中所述生物体是植物。
52.依照项51的方法,其中所述植物是玉蜀黍。
53.依照项52的方法,其中通过与包含项2的核酸分子的玉蜀黍植物杂交将项2的核酸分子导入所述玉蜀黍植物中。
54.依照项50的方法,其中通过遗传转化将项2的核酸分子导入所述生物体中。
55.依照项54的方法,其中将项2的核酸稳定整合入所述生物体的基因组中。
56.依照项54的方法,其中所述生物体是植物。
57.依照项56的方法,其中所述植物是玉蜀黍。
58.一种用于鉴定包含突变体肉桂醇脱氢酶2(CAD2)基因的植物的方法,该方法包括:
从植物分离核酸分子;并
使分离的核酸分子与用于鉴定携带突变体CAD2基因的玉米植物的手段接触以生成可检测信号,其指示所述植物中突变体CAD2基因的存在。
59.一种用于转移玉米突变体肉桂醇脱氢酶2(CAD2)基因的方法,该方法包括:
(a)用探针分析第一植物的基因组DNA和第二植物的基因组DNA,所述探针与至少一种与CAD2基因连锁的标志物特异性可杂交;
(b)将所述第一和第二植物有性杂交以获得后代群体;
(c)对所述后代群体分析所述至少一种与CAD2基因连锁的标志物的存在;
(d)将来自包含所述至少一种与CAD2基因连锁的标志物的后代群体的个体与所述第一或第二植物回交以生成下一代群体;
(e)测定所述下一代群体的成员是否包含来自所述第一或第二植物的期望性状和所述CAD2基因;并
(f)若所述下一代群体没有成员包含来自所述第一或第二植物的期望性状和所述CAD2基因,则重复步骤(d)和(e),直到鉴定出包含来自所述第一或第二植物的期望性状和所述CAD2基因的个体。
60.项59的方法,其中通过在每个世代的CAD2标志物分析选择每个杂交和回交步骤中获得的个体后代。
61.一种通过遗传转化将玉米突变体肉桂醇脱氢酶2(CAD2)基因导入宿主生物体中的方法,该方法包括:
用探针分析玉米植物的基因组DNA以鉴定所述玉米植物中的所述突变体CAD2基因,所述探针与同所述突变体CAD2基因连锁的标志物特异性可杂交;
分离所述玉米植物的基因组DNA中与探针特异性杂交的区段,所述探针与同所述突变体CAD2基因连锁的标志物特异性可杂交;
将基因组DNA的分离的区段导入所述宿主生物体中;并
用探针分析所述宿主生物体的DNA以鉴定所述宿主生物体中所述突变体CAD2基因,所述探针与同所述突变体CAD2基因连锁的标志物特异性可杂交。
62.一种喂养青贮饲料喂养动物的方法,该方法包括:
提供从项33的玉米植物生成的青贮饲料;并
用从项33的玉米植物生成的青贮饲料喂养所述动物。
63.一种喂养青贮饲料喂养动物的方法,该方法包括:
提供从项35的玉米植物生成的青贮饲料;并
用从项35的玉米植物生成的青贮饲料喂养所述动物。
64.依照项62的方法,其中所述青贮饲料喂养动物是反刍类。
65.依照项64的方法,其中所述青贮饲料喂养动物是母牛(cow)。
66.依照项63的方法,其中所述青贮饲料喂养动物是反刍类。
67.依照项66的方法,其中所述青贮饲料喂养动物是母牛。
68.项62的方法,其中所述从项33的玉米植物生成的青贮饲料占动物饲料中干物质的大于15%。
69.项68的方法,其中所述从项33的玉米植物生成的青贮饲料占动物饲料中干物质的至少约25%。
70.一种肉类产品,其从依照项62的方法喂养的动物制备。
71.一种肉牛肥育给粮,其包含从项33的玉米植物生成的玉米青贮饲料。
72.项71的肉牛肥育给粮,其中所述玉米青贮饲料是bm1玉米青贮饲料。
73.项63的方法,其中所述从项35的玉米植物生成的青贮饲料占动物饲料中干物质的大于15%。
74.项73的方法,其中所述从项35的玉米植物生成的青贮饲料占动物饲料中干物质的至少约25%。
75.一种肉类产品,其从依照项63的方法喂养的动物制备。
76.一种肉牛肥育给粮,其包含从项35的玉米植物生成的玉米青贮饲料。
77.项76的肉牛肥育给粮,其中所述玉米青贮饲料是bm1玉米青贮饲料。
上述和其它特征从几个实施方案的以下详细描述及其进行所参照的附图看会变得更加显而易见。
附图简述
图1包括的图显示了7种重叠的515Dbm1 CAD2 PCR片段的相对长度和位置。图1还包括的图显示了13种重叠的DASbm1 CAD2 PCR片段的相对长度和位置。
图2包括的图显示了DASbm1 CAD2中插入的基因组结构。仅显示CAD2的前两种内源外显子。
图3包括使用来自公共登录AC230031的B73序列比对ZmCAD2基因组序列。鉴定出15种SNP和8处插入/缺失,以及DASbm1中的转座子插入。AC插入仅存在于外显子3中的515Dbm1突变体中。以大写字体显示外显子。以小写字体显示内含子和启动子区。
图4包括预测的ZmCAD2 cDNA序列,包括从DASbm1、515Dbm1、和野生型6XN442通过引物对CVF/CVR扩增的cDNA(加下划线)的比对。DASbm1含有409bp插入。
图5包括预测的ZmCAD2蛋白序列的比对,例示了来自515Dbm1的CAD2由于产生移码和提前终止密码子的AC插入而仅具有147个氨基酸。与来自6XB442的CAD2中的367个氨基酸相比,来自DASbm1的CAD2仅具有48个氨基酸。以粗体字体显示同一性区。B73 CAD2氨基酸序列与6XN422 CAD2的氨基酸序列相同,并且因此没有显示。
图6包括的数据显示了野生型、515Dbm1、和DASbm1玉米中脉和叶中CAD2 RNA的相对表达水平。将数据相对于野生型玉米6XN442的中脉中的RNA水平标准化。数据代表3个植物的均值数值,且误差棒指示标准差。
图7包含的数据显示了野生型、515Dbm1、和DASbm1玉米中总木质素的相对量。数据代表3个植物的均值数值,其中从叶和节间两者获得每个植物的5份样品。误差棒指示标准差,而P值通过Student氏T检验产生。
图8包含用引物和模板序列进行的KASPar测定系统的图。显示了515Dbm1(SEQ ID NO:45)和6XN442(SEQ ID NO:46)的模板序列。
图9包含的数据显示了KASPar测定法bm1等位基因测定。使用KBioscience实验室信息管理系统(KLIMS)分析来自读板仪的原始荧光强度数据。也使用KLIMS产生如下的图,其显示了相对于来自VIC的RFU绘图的FAM的RFU。基于簇分离实施基因型测定,如簇视图(cluster view)中展示的。
图10包含的数据显示了TaqMan CAD2等位基因测定。使用iCycler光学系统软件用y轴上展示的VIC的相对荧光单位(RFU)和x轴上展示的FAM的RFU计算等位区别。
序列表
所附序列表中所列的核酸序列使用核苷酸碱基的标准字母缩写显示,如在37C.F.R.§1.822中限定的。仅显示每个核酸序列的一条链,但是应当理解通过对展示链的任何提及而包括互补链。在所附序列表中:
SEQ ID NO:1显示了515Dbm1 CAD2的5924bp基因组序列。
SEQ ID NO:2显示了515Dbm1 CAD2的1512bp预测cDNA序列。
SEQ ID NO:3显示了515Dbm1 CAD2的147个氨基酸的预测的截短蛋白质序列。
SEQ ID NO:4显示了6XN442 CAD2的5898bp基因组序列。
SEQ ID NO:5显示了6XN442 CAD2的1510bp预测的cDNA序列。
SEQ ID NO:6显示了6XN442 CAD2的367个氨基酸的预测的蛋白质序列。
SEQ ID NO:7显示了B73 CAD2的5916bp基因组序列。
SEQ ID NO:8显示了B73 CAD2的1510bp预测的cDNA序列。
SEQ ID NO:9-22显示了用于从515Dbm1突变体和野生型6XN442玉米两者扩增7种重叠CAD2片段的正向和反向引物。
SEQ ID NO:23显示了DASbm1 CAD2的9360bp基因组序列。
SEQ ID NO:24显示了通过引物对CVF/CVR扩增的DASbm1 CAD2的部分cDNA序列。
SEQ ID NO:25显示了DASbm1 CAD2的48个氨基酸的预测的截短的蛋白质序列。
SEQ ID NO:26-34显示了用于从DASbm1突变体扩增部分CAD2片段的正向和反向引物。
SEQ ID NO:35和36显示了用于扩增部分CAD2 cDNA片段的正向和反向引物。
SEQ ID NO:37-39显示了用于从DASbm1突变体扩增部分CAD2片段的正向和反向引物。
SEQ ID NO:40显示了DASbm1 CAD2中的3444bp转座子插入。
SEQ ID NO:41显示了来自CAD2的第一内含子的DASbm1转座子插入中重复的11bp序列:TACTGATATCT。
SEQ ID NO:42-44显示了在KASParTM测定法中使用以区别515Dbm1等位基因与其它bm1和野生型CAD2等位基因的引物。
SEQ ID NO:45和46显示了在KASPar测定法中与引物退火的模板序列。SEQ ID NO:45是来自515Dbm1的基因组序列。SEQ ID NO:46是来自6XN442的基因组序列。
SEQ ID NO:47显示了对突变体DASbm1特异性的探针。
SEQ ID NO:48显示了对野生型CAD2等位基因特异性的探针。
SEQ ID NO:49-51显示了在KASParTM测定法中使用以区别DASbm1和野生型CAD2等位基因的引物。
SEQ ID NO:52显示了对突变体515Dbm1特异性的探针。
SEQ ID NO:53显示了对野生型CAD2等位基因特异性的探针。
SEQ ID NO:54和55显示了在KASParTM测定法中使用以区别515Dbm1和野生型CAD2等位基因的引物。
SEQ ID NO:56-61显示了用于CAD2和对照的qRT-PCR的引物和探针。
SEQ ID NO:62显示了CAD2的第一外显子的核苷酸序列。
SEQ ID NO:63显示了CAD2的第二外显子的核苷酸序列。
SEQ ID NO:64显示了CAD2的第三外显子的核苷酸序列。
发明详述
I.几个实施方案的概述
bm1突变体牵涉与CAD基因座共定位的先前未描述的突变。Halpin等(1998),见上文;Guillaumie等(2007),见上文。本文中描述了玉蜀黍CAD2编码序列内促成bm1表型的特定突变的鉴定。一些实施方案包括从公共bm1玉米系515Dbm1克隆的突变体CAD2基因,其在第三个外显子中含有AC插入,这生成截短的CAD2蛋白。一些实施方案包括从新发现的bmr玉米系DASbm1克隆的突变体CAD2基因,其含有转座子插入,这生成独特的截短的CAD2蛋白。DASbm1植物比野生型植物具有显著更低的CAD2 RNA表达水平,而且还展现出降低的木质素含量。还描述了与每种特定突变连锁的高通量标志物的开发、确认和应用。
bm1表型的分子基础不如例如bm3一样充分了解。Halpin等(1998),见上文显示了CAD活性、蛋白质水平、和转录物丰度在bm1基因型中都显著降低,而后来鉴定为CAD2的CAD基因与bm1基因座紧密连锁定位。由于一些CAD蛋白和mRNA可以在突变体植物中检出,作者提出bm1不是CAD2的无效突变,而且取而代之经由调节元件影响其表达。Halpin等(1998),见上文。使用微阵列的后续基因表达研究显示了除了仅CAD2之外的许多基因在bm1植物中表达不足。Guillaumie等(2007),见上文。此众多表达不足的基因包括许多木质素生物合成途径基因和转录因子,导致进一步的推断,即或许转录因子之一是bm1的根本基因。
新近,已经显示了高粱SbCAD2基因中的无义突变是一些品种中高粱bmr突变体bmr6的根本机制。Saballos等(2009)Genetics 181:783-95;Sattler等(2009)Plant Physiology 150:584-95。无义突变含有C至T取代,这创建提前终止密码子,并且生成确定NADPH结合和C端催化域的截短的SbCAD2蛋白。
同上。
鉴于前述内容,挑战公认的理论,即bm1表型可归因于转录因子或基因调节元件中的突变,并且进行调查以测定玉米CAD2中的突变是否可以产生bm1表型。bm1和CAD2基因座的区域中玉米遗传/物理图谱的紧密检查揭示玉米CAD2非常接近染色体5上的着丝粒定位。此接近性由于围绕着丝粒区的已知重组阻抑而对高分辨率遗传定位提出重大考验。因此,传统的基因定位方法的成功是至少不可预测的,若不是完全不可能的话,并且基于PCR的候选基因克隆方法设计为鉴定ZmCAD2中可以造成主题玉米品种中bm1表型的特定突变。
如此,在一些实施方案中,可以使用基于PCR的基因克隆方法实施特定CAD2突变体的鉴定。在一些实施方案中,可以从bm1和野生型种质两者克隆玉蜀黍CAD2以鉴定来自bm1种质的CAD2中的特定突变。在具体的实施方案中,在bm1种质鉴定出导致移码的AC二核苷酸插入突变。在其它实施方案中,在bm1种质内鉴定出CAD2的第一内含子中的3444个碱基对的转座子插入。导致本文中描述的玉米中bm1表型的特定突变体CAD2基因包含从bm1品种515Dbm1克隆的CAD2基因的第三外显子中的AC二核苷酸插入。
导致本文中描述的玉米中bm1表型的别的突变体CAD2基因包含新bm1品种DASbm1的CAD2基因中的转座子插入。鉴定的插入的长度是3444个碱基对,并且其剪接成三个外显子(409个碱基对),其与CAD2形成嵌合mRNA。嵌合mRNA在编码区中引起移码和提前终止密码子,这生成仅48个氨基酸的截短的CAD2蛋白。此截短的蛋白质缺乏NADPH结合和C端催化域两者,并且因此最可能是非功能性的,即使其在细胞中生成。
与515Dbm1一样,DASbm1植物具有显著降低的CAD2RNA水平,和降低的总木质素含量。CAD2确定为这些天然存在的突变体中玉米bm1表型的根本基因,并且提供观察到的bmr表型的分子基础。基于DASbm1中的转座子插入和515Dbm1中的AC插入,已经测定并评估用于检测这些特定的CAD2等位基因并区别它们与野生型等位基因的高通量KASPar和TaqMan测定法。可以使用该测定法进行bm1种质鉴定,以加速bm1性状的渐渗,以及便于具有例如改善的青贮饲料消化率和/或用于生物燃料的乙醇产量的植物的分子育种。可以使用转基因方法使用突变的CAD2基因序列来将bm1表型引入新的玉米基因型或其它作物,例如高粱和柳枝稷中。bm1和其它bmr表型在与DAS’EXZACT Precision Technology组合时也可以作为转基因的可见选择标志物使用。
高通量PCR标志物可以用于:在生物体中鉴定促成玉米中bm1表型的CAD2突变;将促成玉米中bm1表型的CAD2突变引入生物体(例如,植物)中;以及便于bm1玉米的标志物辅助育种,等等。如此,还描述了基于CAD2中的特定突变(例如,移码突变,和转座子插入)的特定高通量PCR标志物的开发、确认和应用。
II.缩写
4CL 羟基肉桂酸辅酶A连接酶
ABC转运蛋白 ATP结合盒转运蛋白
AGO ARGONAUTE
APL 改变的韧皮部发育
bmr 褐色中脉
bZIP 碱性区/亮氨酸拉链基序
CAD 肉桂醇脱氢酶
CAD1 肉桂醇脱氢酶1
CAD2 肉桂醇脱氢酶2
CCR 肉桂酰-CoA还原酶
COMT 咖啡酸3-O-甲基转移酶
COV1 连续导管环(CONTINUOUS VASCULAR RING)
DFR 二氢黄酮类化合物还原酶
EgCAD1型ZmCAD1 EgCAD1型玉米肉桂醇脱氢酶1
EST 表达序列标签
F5H 细胞色素P450依赖性阿魏酸5-羟化酶
FAM 荧光团6-羧基荧光素
HCT 羟基肉桂酰-CoA转移酶2
KLIMS KBioscience实验室信息管理系统
LIM LIM同源域(homeodomain)
MADS框 保守MADS序列基序(MCM1,AGAMOUS,DEFICIENS,SRF)
MP 单翅的(MONOPTEROUS)
OMT O-甲基转移酶
ORF 可读框
PAL 苯丙氨酸氨裂解酶
PCR 聚合酶链式反应
RFU 相对荧光单元
SAD 芥子醇脱氢酶
SAMS3 S-腺苷-甲硫氨酸合酶3
荧光团(Applied Biosystems)
III.术语
回交:回交方法可以用于将核酸序列导入植物中。几十年以来已经广泛使用回交技术来将新性状引入植物中。Jensen,N.,Ed.Plant Breeding Methodology,John Wiley&Sons,Inc.,1988.。在一个典型的回交方案中,将感兴趣的初始品种(回归亲本)与携带要转移的感兴趣基因的第二品种(非回归亲本)杂交。然后,将来自此杂交的所得后代与回归亲本再次杂交,并重复该过程,直到获得如下的植物,其中在来自非回归亲本的转移基因外,在转化植物中恢复回归植物的基本上所有期望的形态学和生理学特征。
作物植物:如本文中使用的,术语“作物植物”指物种玉蜀黍(Zea mays,maize)的植物。
BM玉米:如本文中使用的,术语“BM玉米”(或“BMR玉米”)指含有褐色中脉突变的玉米品种。BM玉米品种通常展现出叶中脉的微红的褐色色素沉着。BM玉米通常还以较低的木质素含量、较高的纤维消化率、和较高的干物质摄取为特征。BM玉米品种的非限制性例子包括bm1玉米品种;例如515Dbm1。
bm1表型:如本文中使用的,术语“bm1表型”可以指已经在bm1玉米中观察到的改变的木质素含量和/或组成的概况(profile)。例如但不限于,bm1表型可以以下列一项或多项特征为特征:在与相同物种的野生型植物的木质素含量相比时降低10-20%的木质素含量(Guillaumie等(2007),见上文);阿魏酸酯的降低(同上);阿魏酸酯的含量降低(同上);对香豆酸酯的含量降低(Marita等(2003)J.Agric.Food Chem.51:1313-21);升高的醛水平(同上);碳-碳单元间亚单位连接的木质素的富集(Halpin等(1998),见上文;Barriére等(2004),见上文);及松柏醛和/或芥子醛(sinapaldehyde)实质性掺入木质素中(Kim等(2002),见上文;及Barriére等(2004),见上文)。
干物质:如本文中所使用的,术语“干物质”指任何饲料,包括草料。
KBiosciences竞争性等位基因同源性PCR SNP基因型分型系统(KASParTM):KASParTM是一种用于测定SNP基因型的商品化同质荧光系统(KBiosciences Ltd.,Hoddesdon,UK)。KASParTM测定法包含SNP特异性“测定混合物”(其含有三种未标记的引物)和“反应混合物”(其含有所有其它需要的组分,例如通用荧光报告系统)。在这些混合物外,用户提供有FRET能力的读板仪、微量滴定板、和含有约5ng/L DNA的DNA样品,等等。
典型的KASParTM测定法包括下列步骤:等位基因特异性引物设计(例如,使用PrimerPickerTM进行,其是一项在KBiosciences网站经由因特网可用的免费服务);制备包含等位基因特异性引物的反应混合物;在微量滴定板中混合反应混合物与DNA样品;热循环;在荧光读板仪中读板;以及对荧光数据绘图并评分。将来自每份样品的数据在二维图像上一起绘图,其中x和y轴对应于FAM和VIC荧光数值。具有相同SNP基因型的样品在图上聚簇在一起(即,A/A、A/a、和a/a)。关于KASPar系统(包括针对常见问题的解决办法的指导)的更多技术信息可获自KBiosciences Ltd.(例如,KASPar SNP基因型分型系统试剂手册)。
连锁的、紧密连锁的、和极端紧密连锁的:如本文中所使用的,基因或标志物间的连锁可以指染色体上的基因或标志物显示一起传递到下一代个体的可测量概率的现象。两种基因或标志物彼此越接近,此概率变得越接近(1)。如此,术语“连锁的”可以指以大于0.5的概率(其从独立分类预期,其中标志物/基因位于不同染色体上)与某个基因一起传递的一种或多种基因或标志物。在基因的存在促成个体中的表型时,与该基因连锁的标志物可以说成与该表型连锁。如此,术语“连锁的”可以指标志物和基因之间,或者标志物和表型之间的关系。
因为染色体上的两种基因或标志物的接近性与基因或标志物会一起传递到下一代个体的概率正相关,所以术语“连锁的”在本文中也可以指同一玉米染色体上位于在彼此的约2.0Mb内的一种或多种基因或标志物。如此,两种“连锁的”基因或标志物可以相隔约约2.1Mb;2.00Mb;约1.95Mb;约1.90Mb;约1.85Mb;约1.80Mb;约1.75Mb;约1.70Mb;约1.65Mb;约1.60Mb;约1.55Mb;约1.50Mb;约1.45Mb;约1.40Mb;约1.35Mb;约1.30Mb;约1.25Mb;约1.20Mb;约1.15Mb;约1.10Mb;约1.05Mb;约1.00Mb;约0.95Mb;约0.90Mb;约0.85Mb;约0.80Mb;约0.75Mb;约0.70Mb;约0.65Mb;约0.60Mb;约0.55Mb;约0.50Mb;约0.45Mb;约0.40Mb;约0.35Mb;约0.30Mb;约0.25Mb;约0.20Mb;约0.15Mb;约0.10Mb;约0.05Mb;约0.025Mb;和约0.01Mb。与玉米中的bm1表型“连锁的”标志物的具体例子包括玉米基因组的染色体5L上的核苷酸序列。
如本文中使用的,术语“紧密连锁的”可以指同一玉米染色体上位于在彼此的约0.5Mb内的一种或多种基因或标志物。如此,两种“紧密连锁的”基因或标志物可以相隔约约0.6Mb;约0.55Mb;0.5Mb;约0.45Mb;约0.4Mb;约0.35Mb;约0.3Mb;约0.25Mb;约0.2Mb;约0.15Mb;约0.1Mb;和约0.05Mb。可以与玉米中的bm1表型“紧密连锁的”标志物的具体例子包括玉米基因组的CAD2基因座附近或之内的核苷酸序列。
如本文中使用的,术语“极端紧密连锁的”可以指同一玉米染色体上位于在彼此的约100kb内的一种或多种基因或标志物。如此,两种“极端紧密连锁的”基因或标志物可以相隔约125kb,约120kb,约115kb,约110kb,约105kb,100kb,约95kb,约90kb,约85kb,约80kb,约75kb,约70kb,约65kb,约60kb,约55kb,约50kb,约45kb,约40kb,约35kb,约30kb,约25kb,约20kb,约15kb,约10kb,约5kb,和约1kb。与大豆中的SCN表型“极端紧密连锁的”标志物的具体例子包括rhg1-3995、BARC_010889_01691、和NCSB_004074。约125kb;约120kb;约115kb;约110kb;约105kb;100kb;约95kb;约90kb;约85kb;约80kb;约75kb;约70kb;约65kb;约60kb;约55kb;约50kb;约45kb;约40kb;约35kb;约30kb;约25kb;约20kb;约15kb;约10kb;约5kb;和约1kb。与玉米中的bm1表型“极端紧密连锁的”标志物的具体例子包括CAD2基因的内含子和外显子内的核苷酸序列。
鉴于前述内容,应当领会与特定基因或表型连锁的标志物包括与基因或表型紧密连锁的那些标志物,和与基因或表型极端紧密连锁的那些标志物。bm1表型的连锁的、紧密连锁的、和极端紧密的遗传标志物可用于标志物辅助育种程序以鉴定具有降低的木质素含量和改善的消化率的玉米品种,以及以将这些性状育种到其它玉米品种中。
基因座:如本文中使用的,术语“基因座”指基因组上与可测量的特征(例如,性状)对应的位置。SNP基因座通过与基因座内含有的DNA杂交的探针限定。
标志物:如本文中使用的,标志物指可以用于鉴定具有特定等位基因的植物的基因或核苷酸序列。标志物可以描述为给定基因组基因座处的变异。遗传标志物可以是短的DNA序列,诸如单碱基对变化(单核苷酸多态性,或“SNP”)周围的序列。或长的DNA序列,例如小卫星/简单序列重复(“SSR”)。“标志物等位基因”指特定个体中存在的标志物型式。
如本文中所使用的,术语标志物可以指玉米染色体DNA的克隆区段(例如,玉米基因组的CAD2基因座附近或之间的核苷酸序列),并且也或备选地可以指与玉米染色体DNA的克隆区段互补的DNA分子(例如,与玉米基因组的CAD2基因座附近或之间的核苷酸序列互补的DNA)。玉米中bm1标志物的具体例子包括但不限于包含CAD2基因的核苷酸66的核酸序列;包含CAD2基因的核苷酸284的核酸序列;包含CAD2基因的核苷酸415的核酸序列;包含CAD2基因的核苷酸443的核酸序列;包含CAD2基因的核苷酸735的核酸序列;包含CAD2基因的核苷酸760的核酸序列;包含CAD2基因的核苷酸1345的核酸序列;包含CAD2基因的核苷酸1408的核酸序列;包含CAD2基因的核苷酸1585的核酸序列;包含CAD2基因的核苷酸1627-1640和/或1642-1648之任一的核酸序列;包含CAD2基因的核苷酸2252的核酸序列;包含CAD2基因的核苷酸2269的核酸序列;包含CAD2基因的核苷酸2786的核酸序列;包含CAD2基因的核苷酸2966的核酸序列;包含CAD2基因的核苷酸3205的核酸序列;包含CAD2基因的核苷酸3719的核酸序列;包含CAD2基因的核苷酸3783的核酸序列;包含CAD2基因的核苷酸3798的核酸序列;包含CAD2基因的核苷酸3800的核酸序列;包含CAD2基因的核苷酸3994的核酸序列;包含CAD2基因的核苷酸4141的核酸序列;包含CAD2基因的核苷酸4338的核酸序列;包含CAD2基因的核苷酸4583的核酸序列;和包含CAD2基因的核苷酸5403的核酸序列。前述标志物通过野生型玉米品种B73中的核苷酸位置鉴定。
在一些实施方案中,可以经由使用核酸探针检测植物中的标志物存在。探针可以是DNA分子或RNA分子。可以通过本领域中已知的手段,例如使用DNA分子模板合成RNA探针。探针可以含有标志物的整个或部分的核苷酸序列和来自植物基因组的额外的、连续的核苷酸序列。这在本文中称为“连续探针”。所述额外的、连续的核苷酸序列称为初始标志物的“上游”或“下游”,这取决于来自植物染色体的连续核苷酸序列是在初始标志物的5’还是3’侧,如按照惯例理解的。如本领域普通技术人员公认的,可以几乎无限重复获得标志物中包含的额外的、连续的核苷酸序列的方法(仅受限于染色体的长度),由此沿着染色体鉴定其它标志物。可以在本发明的一些实施方案中使用所有上文所描述的标志物。
可以合成或通过克隆制备寡核苷酸探针序列。合适的克隆载体是本领域技术人员公知的。寡核苷酸探针可以是标记的或未标记的。存在用于标记核酸分子的极其多种技术,包括例如但不限于:通过缺口平移的放射性标记;随机引发;用末端脱氧转移酶(deoxytransferase)的加尾;等等,其中采用的核苷酸例如用放射性32P标记。可以使用的其它标记物包括例如但不限于:荧光团(例如FAM和VIC)、酶、酶底物、酶辅因子、酶抑制剂,等等。或者,自身或与其它反应剂一起提供可检测信号的标记物的使用可以用受体结合的配体替换,其中受体是标记的(例如,通过上文指定的标记物进行),从而自身或与其它试剂一起提供可检测信号。参见例如Leary等(1983)Proc.Natl.Acad.Sci.USA 80:4045-9。
探针可以含有与初始标志物的核苷酸序列不连续的核苷酸序列;此探针在本文中称为“非连续探针”。非连续探针的序列与基因组上的初始标志物的序列足够接近地定位,从而非连续探针与相同基因或性状(例如bm1/降低的木质素含量)遗传连锁。例如,在一些实施方案中,非连续探针可以位于玉米基因组上的初始标志物的500kb;450kb;400kb;350kb;300kb;250kb;200kb;150kb;125kb;100kb;0.9kb;0.8kb;0.7kb;0.6kb;0.5kb;0.4kb;0.3kb;0.2kb;或0.1kb内。
探针可以是要检测的标志物的精确拷贝。探针也可以是包含核苷酸序列或由核苷酸序列组成的核酸分子,所述核苷酸序列与主题生物体的(例如,玉米)染色体DNA的克隆区段是基本上相同的。如本文中使用的,术语“基本上相同的”可以指超过85%相同的核苷酸序列。例如,基本上相同的核苷酸序列与参照序列可以是85.5%;86%;87%;88%;89%;90%;91%;92%;93%;94%;95%;96%;97%;98%;99%或99.5%相同的。
探针也可以是与要检测的标志物的精确拷贝(“DNA靶物”)“特异性可杂交”或“特异性互补”的核酸分子。“特异性可杂交”和“特异性互补”是如下的术语,其指示足够的互补性程度,使得核酸分子和DNA靶物之间发生稳定的且特异性的结合。核酸分子与要特异性可杂交的其靶序列不需要是100%互补的。在存在有足够的互补性程度以避免核酸在期望特异性结合的条件下,例如在严格杂交条件下对非靶序列的非特异性结合时,核酸分子是特异性可杂交的。
产生特定严格性程度的杂交条件会随选择的杂交方法的性质及杂交核酸序列的组成和长度而有所变化。一般地,杂交的温度和杂交缓冲液的离子强度(尤其是Na+和/或Mg++浓度)会决定杂交严格性,尽管清洗次数也影响严格性。关于获得特定严格性程度需要的杂交条件的计算是本领域普通技术人员已知的,并且例如在Sambrook等(编)Molecular Cloning:A Laboratory Manual,第2版,卷1-3,Cold Spring Harbor Laboratory Press,Cold Spring Harbor,NY,1989,第9章和第11章;及Hames和Higgins(编)Nucleic Acid Hybridization,IRL Press,Oxford,1985中讨论。关于核酸杂交的更为详细的指示和指导可以参见例如Tijssen,“Overview of principles of hybridization and the strategy of nucleic acid probe assays,”于Laboratory Techniques in Biochemistry and Molecular Biology-Hybridization with Nucleic Acid Probes,部分I,第2章,Elsevier,NY,1993;及Ausubel等编,Current Protocols in Molecular Biology,第2章,Greene Publishing and Wiley-Interscience,NY,1995。
如本文中所使用的,“严格条件”涵盖仅在杂交分子与DNA靶物之间存在有小于50%错配时会发生杂交的条件。“严格条件”包括其它特定的严格性水平。如此,如本文中使用的,“中等严格性”条件是具有超过50%序列错配的分子不会杂交的那些条件;“高严格性”条件是具有超过20%错配的序列不会杂交的那些条件;而“非常高严格性”的条件是具有超过10%错配的序列不会杂交的那些条件。
在具体的实施方案中,严格条件可以包括于60℃在依照制造商的用法说明书稀释的基因型分型主混合物(Applied Biosystems,Foster City,CA,产品目录编号4371355)中杂交。
以下内容是代表性的非限制性杂交条件。
非常高的严格性(检测共享至少90%序列同一性的序列):于65℃在5x SSC缓冲液中杂交16小时;在2x SSC缓冲液中于室温清洗两次,各15分钟;并在0.5x SSC缓冲液中于65℃清洗两次,各20分钟。
高严格性(检测共享至少80%序列同一性的序列):在5x-6x SSC缓冲液中于65-70℃杂交16-20小时;于室温在2x SSC缓冲液中清洗两次,各5-20分钟;并在1x SSC缓冲液中于55-70℃清洗两次,各30分钟。
中等严格性(检测共享至少50%序列同一性的序列):在6x SSC缓冲液中于室温至55℃杂交16-20小时;于室温至55℃在2x-3x SSC缓冲液中清洗至少两次,各20-30分钟。
就上文讨论的所有探针而言,探针可以包含其它核酸序列,例如启动子、转录信号、和/或载体序列。可以使用上文讨论的任何探针来限定与牵涉bm表型(例如bm1)的基因紧密连锁的其它标志物,并且如此鉴定的标志物可以等同于本公开内容中命名的例示性标志物,并且如此在本发明的范围内。
标志物辅助育种:如本文中使用的,术语“标志物辅助育种”可以指在一种或多种复杂性状(例如bm1/降低的木质素含量)方面直接育种的方法。在当前的实践中,植物育种人员尝试鉴定与农艺学期望的性状连锁的容易地可检出的性状,诸如花颜色、种皮外观、或同工酶变体。植物育种人员然后通过追踪容易地可检出的性状的分离来追踪分离的育种群体中的农艺学性状。然而,存在着可用于植物育种中使用的非常少的这些连锁关系。
标志物辅助育种提供了用于改善植物品种的时间和成本有效的方法。应用标志物辅助育种的几个例子牵涉使用同工酶标志物。参见例如Tanksley和Orton编(1983)Isozymes in Plant Breeding and Genetics,Amsterdam:Elsevier。一个例子是与番茄中对线虫有害生物的抗性的基因关联的同工酶标志物。受到称作Mi的基因控制的抗性位于番茄的染色体6上,并且与Aps1(即一种酸性磷酸酶同工酶)非常紧密连锁。Aps1同工酶标志物间接选择Mi基因的用途提供如下的优点,即可以用标准的电泳技术明确测定群体中的分离;可以在幼苗组织中对同工酶标志物评分,消除对将植物维持至成熟的需要;以及同工酶标志物等位基因的共显性容许区别纯合子和杂合子。参见Rick(1983)于Tanksley和Orton,见上文。
肉类:如本文中所使用的,术语“肉类”指作为例如食物使用的动物组织。术语“肉类”通常指骨骼肌和关联的脂肪,但是也可以指非肌肉器官,包括肺、肝、皮肤、脑、骨髓、肾、睾丸、肠,等等。
中性去污剂纤维:如本文中所使用的,术语“中性去污剂纤维”(NDF)指在一大批饲料间缓慢消化的物质的测量。草料中的NDF水平随植物成熟而增加。禾本科青贮饲料中NDF的平均水平可以是约55%DM(550g/kg DM)。总给粮中NDF的含量可以是35-50%DM。具有小于32%NDF的饮食可以引起酸中毒问题。含有超过50%NDF的饮食在其摄取潜力上可能是受限的。
核酸分子:如本文中所使用的,术语“核酸分子”可以指核苷酸的聚合形式,其可以包括RNA的有义和反义链两者、cDNA、基因组DNA、和上述物质的合成形式和混合聚合物。核苷酸可以指核糖核苷酸、脱氧核糖核苷酸、或任一类核苷酸的经修饰形式。如本文中使用的“核酸分子”与“核酸”和“多核苷酸”是同义的。核酸分子的长度通常是至少10个碱基,除非另有规定。该术语包括单链和双链形式的DNA。核酸分子可以包括通过天然存在的和/或非天然存在的核苷酸连接连接在一起的天然存在的和经修饰的核苷酸之任一或两者。
核酸分子可以是化学或生物化学修饰的,或者可以含有非天然的或衍生化的核苷酸碱基,如本领域技术人员会容易领会的。此类修饰包括例如标记物、甲基化、用类似物取代一种或多种天然存在的核苷酸、核苷酸间修饰(例如,不带电荷的连接:例如,膦酸甲酯、磷酸三酯、氨基磷酸酯、氨基甲酸酯,等等;带电荷的连接:例如,硫代磷酸酯、二硫代磷酸酯,等等;悬垂模块:例如,肽;插入剂:例如,吖啶、补骨脂素,等等;螯合剂;烷化剂;和经修饰的连接:例如,alpha异头核酸等)。术语“核酸分子”还包括任何拓扑构象,包括单链、双链、部分双链体的、三链体的、发夹的、环状的、和挂锁的构象。
序列同一性:如本文中在两种核酸或多肽序列的背景中所使用的,术语“序列同一性”或“同一性”可以指两种序列中在规定的比较窗里为了实现最大对应性而比对时相同的残基。
如本文中所使用的,术语“序列同一性百分比”可以指通过在比对窗里比较两个最佳比对序列(例如,核酸序列)测定的数值,其中为了两个序列的最佳比对,比较窗中序列的部分与参照序列(其不包含添加或缺失)相比可以包含添加或缺失(即,缺口)。通过测定两个序列中存在相同核苷酸或氨基酸残基的位置的数目以产生匹配位置数目,将匹配位置的数目除以比较窗中位置的总数,并将结果乘以100以产生序列同一性百分比来计算百分比。
用于比对序列进行比较的方法是本领域中公知的。各种程序和比对算法记载于例如:Smith和Waterman(1981)Adv.Appl.Math.2:482;Needleman和Wunsch(1970)J.Mol.Biol.48:443;Pearson和Lipman(1988)Proc.Natl.Acad.Sci.U.S.A.85:2444;Higgins和Sharp(1988)Gene 73:237-44;Higgins和Sharp(1989)CABIOS 5:151-3;Corpet等(1988)Nucleic Acids Res.16:10881-90;Huang等(1992)Comp.Appl.Biosci.8:155-65;Pearson等(1994)Methods Mol.Biol.24:307-31;Tatiana等(1999)FEMS Microbiol.Lett.174:247-50。序列比对方法和同源性计算的详细考虑可以参见例如Altschul等(1990)J.Mol.Biol.215:403-10。
国立生物技术信息中心(NCBI)基本局部比对搜索工具(BLASTTM;Altschul等(1990))可获自几个来源,包括国立生物技术信息中心(Bethesda,MD)以及在因特网上,其与几种序列分析程序结合使用。如何使用此程序来测定序列同一性的描述在因特网上在BLASTTM的“帮助”部分下可得到。为了比较核酸序列,可以采用BLASTTM(Blastn)程序的“对2种序列Blast”功能,其使用设置为缺省参数的缺省BLOSUM62矩阵进行。与参照序列具有甚至更大相似性的核酸序列在通过此方法评估时会显示增加的百分比同一性。
单核苷酸多态性:如本文中使用的,术语“单核苷酸多态性”(SNP)可以指在基因组(或其它共享序列)中的单核苷酸在物种成员或个体中的配对染色体间有所不同时发生的DNA序列变异。在群体内,可以给SNP指派较小等位基因频率,其是特定群体中观察到的某个基因座处的最低等位基因频率。这仅是在单核苷酸多态性方面两种等位基因频率中的较小者。预期不同群体展现出至少略微不同的等位基因频率。特定群体可以展现出显著不同的等位基因频率。在一些例子中,与bm1表型连锁的标志物是SNP标志物。
SNP可以落入基因的编码序列、基因的非编码区内,或基因间的基因间区中。编码序列内的SNP由于遗传密码的简并性可以,但是不会必然改变生成的蛋白质的氨基酸序列。两种形式都生成相同多肽序列的SNP称作“同义的”(有时称作沉默突变)。若生成不同多肽序列,则它们称作“非同义的”。非同义变化可以是错义或无义,其中错义变化导致不同氨基酸,而无义变化导致提前终止密码子。不在蛋白质编码区中的SNP可以仍然具有基因剪接、转录因子结合、或非编码RNA序列的后果。SNP通常是双等位基因的,并且如此容易在植物和动物中测定。Sachidanandam(2001)Nature 409:928-33。
青贮饲料:如本文中所使用的,术语“青贮饲料”指某种类型的贮存草料。一般地,青贮饲料在称作饲料青贮的方法中自植物(例如,玉米植物)生成。在此方法期间,植物或植物部分经历由固有微生物(例如,乳酸细菌的一种或多种菌株,例如,乳杆菌属(Lactobacillus)的种)引起的厌氧发酵,所述固有微生物将糖转化成酸,并耗尽存在于作物材料中的任何氧,该氧消减与细菌生成的挥发性脂肪酸,诸如乙酸盐、丙酸盐、乳酸盐和丁酸盐一起保护草料。青贮饲料广泛用于喂养产乳和产肉动物,诸如奶牛和肉牛。
术语“生产青贮饲料”描述如何获得适合于喂养产肉动物的青贮饲料的方法。一般地,青贮饲料自植物,例如,玉米植物生产,其通过用草料收获机切碎收获的植物生物量来进行。
纤维源:如本文中所使用的,术语“纤维源”指自植物或微生物来源获得的材料,该材料含有可食用的纤维。纤维源的实际的,但非限制性的例子包括农业种子产品诸如来自大豆,或来自谷物诸如稻、小麦、玉米、大麦的壳;来自此类谷物的杆(stalk)(谷草);基于蔬菜/植物的肥皂原料(soap stock),玉米干草(其通常包括来自收获的玉米植物的杆、外壳和叶);农业产品中富含纤维的经加工组分级分,例如玉米黄浆饲料;来自任何植物来源的叶材料,和具有或没有其上干燥的可溶物的干燥酒糟。如此,在具体的例子中,纤维源可以包括例如下列各项的混合物:苜蓿、大麦产物(例如,谷草)、甜菜浆(beet pulp)、大豆壳、柳枝稷、玉米纤维、大豆纤维、可可果(cocoa)壳、玉米穗轴、玉米壳、玉米秣草(corn stove)、麦秸、小麦壳、稻草、亚麻壳(flax hull)、大豆粉、玉米粉、小麦胚、玉米胚、灌木和禾本科。出于本公开内容中清楚的目的,干燥酒糟(具有或没有可溶物)和酒糟(具有或没有可溶物)含有纤维,但是认为不是“纤维源”。认为干燥酒糟(具有或没有可溶物)和酒糟(具有或没有可溶物)是“玉米副产物”,如下文所列的。
玉米副产物:如本文中所使用的,术语“玉米副产物”指仍然遵循玉米的湿磨或干磨的产物。玉米副产物的非限制性例子包括玉米黄浆、酒糟、酒糟加可溶物、干燥酒糟、具有可溶物的干燥酒糟、浓缩的酒糟可溶物(condensed distillers solubles)、糠麸饼(bran cake)、改良的酒糟、改良的酒糟加可溶物。
补充物:如本文中所使用的,术语“补充物”指饲料混合物中包含的增强饲料混合物的营养价值的任何成分。通常使用的补充物包括蛋白质(例如,大豆粉或尿素)、矿物质(例如,骨粉)、能量(例如,动物脂肪)和维生素。
性状或表型:术语“性状”和“表型”在本文中可互换使用。出于本公开内容的目的,特别感兴趣的性状是bm1/降低的木质素含量。
IV.与bm1表型有关的基因和基因变异及其用途
本公开内容提供了促成玉米中的bm1表型的新突变体CAD2基因。包含本文中描述的突变体CAD2基因的植物(例如,玉米)具有的细胞壁可以具有比存在于相同品种的野生型植物中那些木质素水平低的木质素水平。在一些实施方案中,可以将包含依照本公开内容的突变体CAD2基因的核酸分子导入生物体中,例如以参与形成降低的木质素表型。在具体的实施方案中,生物体可以是植物(例如玉米)。然而,可以将包含依照本公开内容的突变体CAD2基因的核酸分子导入不是植物的生物体,例如酵母或原核生物中。在一些实施方案中,可以使用依照本公开内容的突变体CAD2基因来鉴定包含突变体CAD2基因的植物,或可能具有bm1或其它降低的木质素表型的植物。例如,可以使用依照本公开内容的突变体CAD2基因的序列来设计探针,该探针检测植物中,或自植物制备的样品中突变体CAD2基因的存在。在具体的例子中,提供了如下的核酸探针,其与突变体CAD2基因而非特定的野生型CAD2基因的核苷酸序列杂交。
在一些实施方案中,本发明还包括包含与依照本公开内容的突变体CAD2基因基本上相同的序列的那些核酸分子,所述序列可以包含或不包含如本文中描述的AC二核苷酸插入和/或转座子插入。例如,在一些实施方案中,核酸分子可以包含与依照本公开内容的突变体CAD2基因至少约85%相同的序列。如此,核酸分子可以包含与依照本公开内容的突变体CAD2基因基本上相同的序列,其与依照本公开内容的突变体CAD2基因是86%;87%;88%;89%;90%;91%;92%;93%;94%;95%;96%;97%;98%;99%或99.5%相同的。例如,可以从本领域技术人员容易可用的多种生物体的任何完整或部分基因组鉴定并分离与依照本公开内容的突变体CAD2基因基本上相同的此类核酸分子。
一些实施方案还包括依照本公开内容的突变体CAD2基因的功能性变体。依照本公开内容的突变体CAD2基因的功能性变体可以包括例如包含一处或多处核苷酸取代、缺失、或插入的依照本公开内容的突变体CAD2基因,其中所述功能性变体促成bm1或其它降低的木质素表型,如可以通过本领域普通技术人员公知的常规技术测量的。例如,依照本公开内容的突变体CAD2基因的功能性变体可以包含如本文中描述的AC二核苷酸插入和/或转座子插入。可以通过将突变或片段常规引入植物中,接着对植物常规观察降低的木质素含量或bm1表型的其它特征测定依照本公开内容的突变体CAD2基因的特定变体降低木质素含量或促成bm1表型的能力。可以通过定点诱变,即诱导的突变创建依照本公开内容的突变体CAD2基因的功能性变体,或者它们可以以等位变体(多态性,例如SNP)出现。
因此,在一些实施方案中,依照本公开内容的突变体CAD2基因的功能性变体可以包含CAD2基因的额外突变、比依照本公开内容的突变体CAD2基因的序列小的片段、和/或包含依照本公开内容的突变体CAD2基因的嵌合蛋白,该功能性变体保留突变体CAD2基因的特性。因此,认为此类突变和片段在本发明的范围内。本领域普通技术人员可以容易地确定依照本公开内容的突变体CAD2基因的额外突变或片段是否保留突变体CAD2基因的特性。
在一些实施方案中,将依照本公开内容的突变体CAD2基因导入植物中,并在植物中检测依照本公开内容的突变体CAD2基因的能力可以促成具有突变体CAD2基因的植物的标志物辅助育种和选择,该植物也可以有可能具有bm1或其它降低的木质素表型。在具体的例子中,可以将依照本公开内容的突变体CAD2基因导入植物中(例如,通过遗传转化,或传统的育种技术诸如杂交进行),然后,可以通过使用检测植物中突变体CAD2基因存在的探针选择包含突变体CAD2基因的植物。可以将已经接受本公开内容的突变体CAD2基因导入的植物与也可以包含或不包含突变体CAD2基因的植物杂交,然后可以通过使用检测植物中本公开内容的突变体CAD2基因存在的探针选择后代。可以进行进一步杂交以获得期望基因型的植物。
在将核酸序列(例如,依照本公开内容的突变体CAD2基因)“导入”生物体诸如植物中时,用于导入包含特定序列的核酸分子的技术或方法对于本发明不是必需的,并且可以通过本领域技术人员已知的任何技术或方法发生。例如,可以通过直接转化方法,诸如土壤杆菌介导的植物组织转化;微粒轰击;电穿孔;等等导入核酸分子。或者,可以如下导入核酸分子,即将具有特定核苷酸序列的植物与另一植物杂交,使得后代具有整合入其基因组中的核苷酸序列。此类育种技术是本领域技术人员公知的。如本文中公开的标志物辅助育种技术可以大大促进经由此类杂交掺入依照本公开内容的突变体CAD2基因。
在将依照本公开内容的突变体CAD2基因导入生物体的实施方案中,可以期望以如下的方式导入突变体CAD2基因,使得突变体CAD2基因与一种或多种调节序列可操作连接,例如,经由使用质粒的导入,所述质粒包含与期望的调节序列可操作连接的依照本公开内容的突变体CAD2基因。可用于表达异源核酸序列的调节序列是本领域中公知的,并且包括例如但不限于:启动子(例如,组成性启动子;组织特异性启动子;和发育阶段特异性启动子);终止序列;增强子序列;亚细胞靶向序列;稳定化或前导序列;和内含子。
可以将依照本公开内容的突变体CAD2基因与一种或多种与调节元件(例如启动子)可操作连接的标志物基因一起导入生物体中,所述标志物基因容许含有标志物的经转化细胞通过负选择(即,抑制不含选择标志物基因的细胞生长)或通过正选择(即,筛选由遗传标志物编码的产物)回收。许多用于转化的选择标志物基因是转化领域中公知的,并且包括例如编码使可以为抗生素或除草剂的选择性化学剂在代谢上解毒的酶的基因,或编码可以对抑制剂不敏感的经改变的靶物的基因。少数正选择方法也是本领域中已知的。适合于在植物细胞中使用的标志物基因的例子可以包括例如但不限于:新霉素磷酸转移酶II(nptII)基因(Fraley等(1983)Proc.Natl.Acad.Sci.USA 80:4803);潮霉素磷酸转移酶基因(Vanden Elzen等(1985)Plant Mol.Biol.5:299);庆大霉素乙酰转移酶、链霉素磷酸转移酶、氨基糖苷-3’-腺苷酰转移酶、和博来霉素抗性决定子(参见,例如Hayford等(1988)Plant Physiol.86:1216;Jones等(1987)Mol.Gen.Genet.210:86);Svab等(1990)Plant Mol.Biol.14:197;及Hille等(1986)Plant Mol.Biol.7:171);赋予对除草剂诸如草甘膦(glyphosate)、草铵膦(glufosinate)或溴苯腈(bromoxynil)的抗性的选择标志物基因(见例如Comai等(1985)Nature 317:741-744;Gordon-Kamm等(1990)Plant Cell 2:603-618;及Stalker等(1988)Science 242:419-423);小鼠二氢叶酸还原酶(Eichholtz等(1987)Somatic Cell Mol.Genet.13:67);植物5-烯醇丙酮酰莽草酸(enolpyruvylshikimate)-3-磷酸合酶(Shah等(1986)Science 233:478);植物乙酰乳酸合酶(Charest等(1990)Plant Cell Rep.8:643)。
另一类适合于植物转化的标志物基因采用筛选据推测经转化的植物细胞,而不对经转化的细胞直接遗传选择对毒性物质诸如抗生素的抗性。这些基因特别可用于量化或显现基因在特定组织中表达的空间样式,并且通常称为“报告基因”,因为它们可以与基因或基因调节序列融合以调查基因表达。通常用于筛选经转化的细胞的基因包括β-葡糖醛酸糖苷酶(GUS)、β-半乳糖苷酶、萤光素酶和氯霉素乙酰转移酶。见例如Jefferson(1987)Plant Mol.Biol.Rep.5:387;Teeri等(1989)EMBO J.8:343;Koncz等(1987)Proc.Natl.Acad.Sci U.S.A.84:131;及DeBlock等(1984)EMBO J.3:1681。
最近,已经可用用于显现GUS活性的体内方法,其不需要破坏植物组织。Molecular Probes publication 2908,Imagene Green.TM.,第1-4页,1993;及Naleway等(1991)J.Cell Biol.115:151a。此外,已经利用编码荧光蛋白(例如,GFP,EGFP,EBFP,ECFP,和YFP)的基因作为原核和真核细胞中基因表达的标志物。见Chalfie等(1994)Science 263:802。可以使用荧光蛋白和荧光蛋白的突变作为可筛选标志物
在一些实施方案中,可以使用依照本公开内容的突变体CAD2基因和/或依照本公开内容的突变体CAD2基因的片段或区段来鉴定来自与玉米不同的生物体的同源突变体CAD2基因序列(例如,通过序列比较进行)。与依照本公开内容的突变体CAD2基因同源的来自与玉米不同的生物体的序列可以例如基于其与依照本公开内容的突变体CAD2基因的序列同源性依照公知的技术鉴定并分离。
如此,在一些实施方案中,可以使用整个或部分的来自依照本公开内容的突变体CAD2基因的编码序列作为探针,该探针与存在于依照常规技术自生物体克隆的基因组DNA片段群体(即,基因组文库)中的其它序列特异性杂交。如此,在一些实施方案中,本发明包括与依照本公开内容的突变体CAD2基因特异性杂交的那些核苷酸序列。
在其它实施方案中,可以通过序列比较鉴定并分离与依照本公开内容的突变体CAD2基因同源的来自与玉米不同的生物体的序列。例如,可以依照常规技术用依照本公开内容的突变体CAD2基因的序列搜索生物体的完整或部分测序基因组以鉴定生物体基因组内与突变体CAD2基因共享高度序列同一性,并且因此可能是突变体CAD2基因的同源物的基因。
例如,可以使用整个或部分的依照本公开内容的突变体CAD2基因作为“参照序列”。一般地,与参照序列比较的核酸序列(例如,基因组文库的克隆或基因组DNA片段)包含“比较窗”,其是核酸序列的特定连续区段。比较窗与参照序列(其不包含添加或缺失)相比可以包含添加或缺失(即,缺口)以实现两个序列的最佳比对。通常,比较窗的长度为至少20个连续核苷酸,但是长度可以是30,40,50,100,或200个核苷酸,或更长。为了避免由于多核苷酸序列比较窗中包含缺失而与参照序列的高度相似性,可以引入“缺口罚分”以从核苷酸匹配数目扣除。
比对序列进行比较的方法是本领域中公知的。可以使用可用的数学算法来实现任何两种序列间百分比序列同一性的测定。此类数学算法的非限制性例子是Myers和Miller(1988),CABIOS 4:11-7的算法;Smith等(1981)Adv.Appl.Math.2:482的局部比对算法;Needleman和Wunsch(1970),J.Mol.Biol.48:443-53的全局比对算法;Pearson和Lipman(1988),Proc.Natl.Acad.Sci.USA 85:2444-8的搜索局部比对法;Karlin和Altschul(1990),Proc.Natl.Acad.Sci.USA 87:2264,及Karlin和Altschul(1993)Proc.Natl.Acad.Sci.USA 90:5873-7的算法。
本领域普通技术人员可以在计算机上执行这些数学算法以比较序列,从而测定序列同一性,或依照与参照序列的共享序列同一性搜索包含多个序列的数据库(例如,生物体基因组数据库)。此类实现包括但不限于PC/Gene程序(Intelligenetics,Mountain View,CA)中的CLUSTAL;和GCG Wisconsin遗传学软件包,v.10(Accelrys Inc.,San Diego,CA)中的ALIGN程序和GAP、BESTFIT、BLAST、FASTA、和TFASTA。使用这些程序的序列比对可以使用其缺省参数实施。或者,可以期望在一些搜索中修改缺省参数(例如,改变缺口罚分的数值)。选择数学算法的特定计算机实现以计算序列同一性,以及选择在选定的算法中使用的参数数值在本领域技术人员的判断内。
在一些实施方案中,可以通过杂交将依照本公开内容的突变体CAD2基因导入包含别的期望基因(例如,突变体基因或次要等位基因)或表型的植物中。或者,可以例如通过遗传转化将依照本公开内容的突变体CAD2基因导入包含别的期望基因或表型的植物中。在某些实施方案中,可以将依照本公开内容的突变体CAD2基因导入植物中,所述植物在一个或多个牵涉木质素生物合成或代谢的其它基因中包含突变。例如但不限于,可以将依照本公开内容的突变体CAD2基因导入植物中,所述植物在例如下列基因中包含突变:不同CAD基因;COMT;4CL;F5H;EgCAD1型ZmCAD1;SAD;分支酸变位酶基因;PAL;HCT;OMT;细胞色素P450基因;SAMS3;CCR;DFR;查耳酮合酶基因;漆酶基因;过氧化物酶基因;ALDH基因(例如,记载于Skibbe等(2002)Plant Mol.Biol.48:751-64中的六种玉米ALDH基因之一);AGO;MYB转录因子基因(例如ZmMYB38;和玉米APL);LIM转录因子基因;玉米bZIP因子基因;MADS框基因(例如ZmZAG5);MP基因;ABC转运蛋白基因; -葡糖苷酶基因;谷胱甘肽S-转移酶基因(例如ZmGST17);根瘤素MtN21样基因;PINOID直向同源基因;组氨酸激酶(例如ZmHK1,ZmHK2,和ZmHK3);和/或COV1直向同源基因。在一些实施方案中,可以将依照本公开内容的突变体CAD2基因导入包含一种或多种不牵涉木质素生物合成或代谢的期望性状的植物中,从而生成具有bm1或其它降低的木质素表型和一种或多种不牵涉木质素生物合成或代谢的期望性状两者的植物。
预期在木质素生物合成或代谢途径中含有多个突变体基因的这些和其它实施方案的植物会展现出有用的新表型,例如其它bm表型,和/或其它木质素表型。参见,例如Marita等(2003),见上文。例如,我们已经观察到叠加bm1性状与bm3性状导致青贮饲料消化率的进一步增加,以及在没有预处理的情况下生物量水解中可发酵糖类产量的非常显著的改善。
一些实施方案利用用于生成包含突变体玉米CAD2基因的经遗传修饰的植物的手段,和/或用于鉴定携带突变体玉米CAD2基因的植物的手段。在一些例子中,用于生成包含突变体玉米CAD2基因的经遗传修饰的植物的手段可以是位于依照本公开内容的突变体玉米CAD2基因内的标志物。在一些例子中,用于鉴定携带突变体玉米CAD2基因的植物的手段可以是与位于依照本公开内容的突变体玉米CAD2基因内的标志物特异性杂交的探针。依照本公开内容的突变体CAD2基因(就用于生成包含突变体玉米CAD2基因的经遗传修饰的植物的手段,和/或用于鉴定携带突变体玉米CAD2基因的植物的手段而言)是促成玉米近交系515Dbm1,或品系DASbm1中的bm1表型的那些突变体CAD2基因。这些突变体CAD2基因的特征在于,CAD2基因的第三个外显子中的移码突变,其生成截短的CAD2蛋白,或CAD2基因的第一个内含子中的3444个碱基对的转座子插入,其生成截短的CAD2蛋白。如此,在一些实施方案中,突变体CAD2基因可以包含基因组ZmCAD2基因序列的第一个外显子和/或基因组ZmCAD2基因序列的第二个外显子,但是可以不包含基因组ZmCAD2基因序列的整个或部分的第三个外显子。
本文中公开的突变体CAD2基因与先前描述的可以牵涉bmr表型的CAD2突变不同。例如,依照本公开内容的突变体CAD2基因可以具有下列一项或多项特征:ZmCAD2基因的外显子(例如外显子3)中的二核苷酸插入;产生移码的突变;ZmCAD2基因的内含子中的转座子插入,其生成截短的蛋白质;生成截短的ZmCAD2酶的突变;导致ZmCAD2 NADPH结合和/或C端催化域失活(例如通过除去实现)的突变;促成近交玉米系515Dbm1中的bm1表型的突变;和促成近交玉米系DASbm1中的bm1表型的突变。比较而言,先前描述的天然存在的突变体CAD2基因的特征在于,基因的第一个内含子中的转座子插入(美国专利申请US 2010/0203196A1);降低的全长CAD蛋白表达(Halpin等(1998),见上文);导致高粱(Sorghum bicolor)CAD2酶截短的点突变(Saballos等(2009),见上文;Sattler等(2009),见上文;高粱CAD2中辅因子结合位点中的点突变(同上);高粱CAD2中活性位点外部的受到破坏的二级结构(同上);和生成截短的酶的火炬松(Pinus taeda L.)CAD基因中的二个碱基对的腺苷插入(美国专利6,921,643)。
V.与同bm1表型有关的基因和基因变异连锁的分子标志物及其用途
提供了与依照本公开内容的突变体CAD2基因连锁(例如,紧密连锁)的分子标志物。与依照本公开内容的突变体CAD2基因连锁的分子标志物可以部分以其在玉米染色体5L上的特定区域中的位置描述。与依照本公开内容的突变体CAD2基因连锁的分子标志物可以包括突变体CAD2基因内或者存在于突变体CAD2基因附近的SNP标志物。例如,在一些实施方案中,位于来自bm1玉米系515Dbm1的CAD2基因中的核苷酸位置5410,及bm1玉米系DASbm1中的核苷酸位置8903的G/A SNP(或其等同的标志物)可以是与依照本公开内容的突变体CAD2基因连锁的分子标志物。在一些实施方案中,位于来自bm1玉米系515Dbm1的CAD2基因中的核苷酸位置5410的G/A SNP可以是与依照本公开内容的突变体CAD2基因连锁的分子标志物。
例如,可以通过测定别的标志物和依照本公开内容的CAD2突变,或与依照本公开内容的突变体CAD2基因连锁的分子标志物(例如,位于bm1玉米系515Dbm1中的核苷酸位置5410的G/A SNP)之间的重组频率鉴定其它标志物。此类测定可以利用基于Mather(1931),The Measurement of Linkage in Heredity,Methuen&Co.,London的方法的正交比较,接着是测定重组频率的最大似然检验的改善的方法。Allard(1956)Hilgardia 24:235-78。若重组频率的数值在生物体(例如玉米)中小于或等于0.10(即10%),则认为别的标志物与突变体CAD2基因连锁,并且出于本公开方法中使用的目的,等同于特定的参照标志物。
使用与依照本公开内容的突变体CAD2基因连锁的或存在于依照本公开内容的突变体CAD2基因内的核酸分子标志物来鉴定具有bm1或其它降低的木质素表型的植物的方法可以使植物开发人员节约成本,因为此类方法可以消除对杂交包含突变体CAD2基因的植物与其它植物系,然后对杂交后代测定表型的需要。
用于生成包含突变体玉米CAD2基因的经遗传修饰的植物的手段是与依照本公开内容的突变体CAD2基因连锁的标志物。如此,用于生成包含突变体玉米CAD2基因的经遗传修饰的植物的手段包括来自玉米植物的核酸序列,任何所述核酸序列的检出至少提供强烈的指示,即包含该核酸序列的植物包含依照本公开内容的突变体CAD2基因。
用于鉴定携带突变体玉米CAD2基因的植物的手段是与标志物特异性杂交的探针,所述标志物与依照本公开内容的突变体玉米CAD2基因连锁或存在于依照本公开内容的突变体玉米CAD2基因内。核酸的特异性杂交是可检测信号,并且因此,与标志物特异性杂交的核酸探针在对自携带依照本公开内容的突变体CAD2基因的植物获得的样品添加时呈现可检测信号,所述标志物与依照本公开内容的突变体玉米CAD2基因连锁或存在于依照本公开内容的突变体玉米CAD2基因内。
在一些实施方案中,可以使用生物体基因组中在依照本公开内容的突变体CAD2基因侧翼的连锁标志物来转移供体亲本DNA中明确含有突变体CAD2基因的区段。在一些实施方案中,使用在依照本公开内容的突变体CAD2基因侧翼的连锁标志物来转移供体亲本DNA中明确含有突变体CAD2基因的区段的方法可以包括用与同突变体CAD2基因连锁的标志物特异性可杂交的探针分析两个亲本植物的基因组DNA;有性杂交两个亲本植物基因型以获得后代群体,并对那些后代分析与突变体CAD2基因连锁的标志物的存在;将含有与突变体CAD2基因连锁的标志物的后代与接受基因型回交以产生第一回交群体,然后继续回交程序,直到获得包含由亲本基因型展现的任何期望的性状和突变体CAD2基因的最终后代。在具体的实施方案中,通过在每个世代的连锁标志物分析选择每个杂交和回交步骤中获得的个体后代。在一些实施方案中,用与同突变体CAD2基因连锁的标志物特异性可杂交的探针分析两个亲本植物的基因组DNA揭示亲本植物之一包含较少的与探针特异性杂交的连锁标志物,或无一与探针特异性杂交的连锁标志物。
在一些实施方案中,可以使用与依照本公开内容的突变体CAD2基因连锁的或存在于依照本公开内容的突变体CAD2基因内的标志物,或突变体CAD2基因序列自身通过遗传转化将依照本公开内容的突变体CAD2基因导入玉米植物中。在具体的实施方案中,标志物包括但不限于位于bm1玉米系515Dbm1中的核苷酸位置5410,及bm1玉米系DASbm1中的核苷酸位置8903的G/A SNP,或其等同的标志物。在一些实施方案中,通过遗传重组将依照本公开内容的突变体CAD2基因导入玉米植物中的方法可以包括用与同突变体CAD2基因连锁的标志物或突变体CAD2基因自身特异性可杂交的探针分析植物(例如,玉米植物)的基因组DNA以鉴定植物中的突变体CAD2基因;例如通过提取基因组DNA,并用一种或多种酶限制性内切核酸酶消化基因组DNA分离植物基因组DNA中包含突变体CAD2基因的区段;任选地,扩增分离的DNA区段;将分离的DNA区段导入宿主玉米植物的细胞或组织中;并用与同突变体CAD2基因连锁的标志物或突变体CAD2基因自身特异性可杂交的探针分析宿主玉米植物的DNA以鉴定宿主玉米植物中的突变体CAD2基因。在具体的实施方案中,可以将分离的DNA区段导入宿主玉米植物中,使得它稳定整合入宿主玉米植物的基因组中。
在一些实施方案中,可以使用与依照本公开内容的突变体CAD2基因连锁的或存在于依照本公开内容的突变体CAD2基因内的标志物,或突变体CAD2基因序列自身来将依照本公开内容的突变体CAD2基因导入其它生物体,例如植物中。在具体的实施方案中,标志物包括但不限于位于bm1玉米系515Dbm1中的核苷酸位置5410,及bm1玉米系DASbm1中的核苷酸位置8903的G/A SNP,或其等同的标志物。在一些实施方案中,用于将依照本公开内容的突变体CAD2基因导入与玉米不同的生物体(例如大豆;苜蓿;小麦;油菜籽;稻;和高粱)中的方法可以包括用探针分析与玉米植物不同的植物的基因组DNA以鉴定植物中的突变体CAD2基因,所述探针与同依照本公开内容的突变体CAD2基因连锁的标志物或突变体CAD2基因自身特异性可杂交;例如通过提取基因组DNA,并用一种或多种酶限制性内切核酸酶消化基因组DNA分离植物基因组DNA中包含突变体CAD2基因的区段;任选地,扩增分离的DNA区段;将分离的DNA区段导入与玉米不同的生物体中;并用探针分析与玉米不同的生物体的DNA以鉴定生物体中的突变体CAD2基因,所述探针与同依照本公开内容的突变体CAD2基因连锁的标志物或突变体CAD2基因自身特异性可杂交。在具体的实施方案中,可以将分离的DNA区段导入生物体中,使得它稳定整合入生物体的基因组中。
在一些实施方案中,可以使用与依照本公开内容的突变体CAD2基因连锁的或存在于依照本公开内容的突变体CAD2基因内的标志物,或突变体CAD2基因序列自身来鉴定具有bm1或其它降低的木质素表型的植物。在具体的实施方案中,植物是玉米植物。在一些实施方案中,可以从植物提取核酸分子(例如,基因组DNA或mRNA)。然后,可以使提取的核酸分子与一种或多种探针接触,所述探针与同依照本公开内容的突变体CAD2基因连锁的标志物或突变体CAD2基因自身特异性可杂交。一种或多种探针与提取的核酸分子的特异性杂交指示植物中bm1或其它降低的木质素表型的存在。
引物设计和连锁筛选。
寡核苷酸探针(例如引物)可以设计为特异性检测标志物,该标志物在物理上位于与bm1突变连锁的CAD2之中、附近、或之间。一般地,可以设计与标志物的仅一个等位基因特异性杂交的寡核苷酸探针。在一些实施方案中,两种寡核苷酸探针设计为检测bm1标志物,使得一种与同另一探针不特异性杂交的bm1等位基因特异性杂交,而另一种与同另一探针不特异性杂交的野生型CAD2等位基因(或不同bm1等位基因)特异性杂交。如本领域技术人员理解的,针对特定标志物的寡核苷酸探针的长度或组成在不使探针对标志物的一个等位基因非特异性的情况下可以随建立的原则而变化。
在一些实施方案中,寡核苷酸探针可以是引物。在具体的实施方案中,引物可以设计为在KASParTM基因型分型测定法中检测标志物。在具体的实施方案中,引物可以设计为使用KASParTM基因型分型测定法检测与玉米中的bm1表型连锁的标志物。在这些和其它实施方案中,检测系统可以提供用于对定位群体中的个体测定基因型的高通量且方便的形式,其可以大大促进携带特定基因或性状的个体的鉴定,并且也可以大大促进标志物辅助选择程序的实现或执行。
在具体的实施方案中,寡核苷酸探针可以是设计为在基因型分型测定法中检测标志物的引物。此方法利用扩增含有与bm1突变紧密连锁的标志物的DNA区的特异性引物和经荧光标记的对标志物特异性的探针。可以用荧光染料诸如FAM标记与bm1等位基因特异性杂交的探针,而可以用不同荧光染料诸如VIC标记与野生型CAD2等位基因(或不同bm1等位基因)特异性杂交的探针。以荧光染料信号的存在或缺乏分析数据。检测系统可以提供高通量且方便的形式,诸如用于对定位群体中个体测定基因型的多重化(multiplexing),其可以大大促进携带特定基因或性状的个体的鉴定,并且也可以大大促进标志物辅助选择程序的实现或执行。
如此,本文中还描述了基因特异性端点PCR测定法,其一般可用于对bm1玉米或推定的bm1玉米的接合性分析。在具体的实施方案中,可以使用基因特异性端点PCR测定法来在bm1突变方面分析玉米的接合性。
基因特异性端点PCR测定法中使用的引物和探针可以基于感兴趣基因中的已知突变设计。例如,用于bm1特异性测定法的引物和探针可以基于CAD2基因的第一个内含子中的3444bp插入设计。在二重(biplex)反应中,其中在同一测定法中使用对突变(例如bm1)和未破坏的野生型基因(例如CAD2)特异性的寡核苷酸,特异性寡核苷酸会从基因组DNA样品中存在的突变基因和/或野生型基因之任一或两者选择性扩增序列。
在一些实施方案中,bm1特异性测定法扩增对于插入野生型基因组CAD2基因中的3444bp核苷酸序列独特的片段。在一些实施方案中,野生型CAD2基因特异性测定法扩增CAD2基因的片段,其包含对野生型CAD2基因中插入3444bp核苷酸序列的接合位点。在某些实施方案中,靶物特异性寡核苷酸探针在高严格性条件下与基因组DNA样品中在两个PCR引物间的靶序列杂交。
例如,可以用荧光染料(例如FAM,VIC,和MGBNFQ)标记靶物特异性寡核苷酸,这可以容许靶物特异性荧光信号的快速量化。可以在预先确定数目的循环后,例如,在反应处于早期指数期中时测量PCR产物。阴性对照样品可以包含来自例如没有bm1突变的任何玉米品种的基因组DNA。阳性对照样品可以包含来自具有BMR突变,诸如CAD2基因中的bm1插入突变的玉米品种的基因组DNA。对照半合子样品可以包含来自预先测定为在bm1突变方面半合子的玉米品种的基因组DNA;或者半合子样品可以包含等比例的阴性对照DNA与来自预先测定为在bm1突变方面纯合的玉米品种的DNA。
可以通过本领域技术人员已知的方法从玉米植物组织将DNA分离(例如提取并纯化)。用于DNA分离的商业试剂盒可获自例如Qiagen,Inc。在一些实施方案中,将来自特定植物的叶盘冲孔,并转移至收集管中。在每次取样后可以用70%酒精清洁冲孔器,在水中漂洗,并干燥。可以依照制造商的推荐制备DNA提取缓冲液。然后,可以依照制造商的用法说明书使用试剂盒分离DNA。最终,可以使用例如Quant-iTTM量化试剂盒(Invitrogen,Carlsbad,CA)和分光光度计,或者通过任何其它合适的技术测定分离的DNA的浓度。
一旦制备好或以其它方式可用引物、探针、和基因组DNA样品,可以进行PCR反应以鉴定基因组DNA样品中感兴趣的核酸序列(例如,BMR突变特有的序列)。在具体的实施方案中,制备个别的PCR反应混合物,其含有除了基因组DNA样品外的所有反应组分。对于包含针对bm1突变体和野生型CAD2玉米的引物和基因特异性探针的二重反应,反应混合物可以包含酶、反应缓冲液、针对bm1突变的正向和反向引物、针对野生型CAD2基因的正向和反向引物、针对bm1突变的基因特异性探针、针对CAD2基因的基因特异性探针、和水。在一些PCR测序系统(例如PCR测定法)中,酶和缓冲液可以存在于单一试剂盒组分(例如基因型分型主混合物;Applied Biosystems,Foster City,CA,产品目录编号4371355)中。
一旦以其它方式制备反应混合物,可以添加基因组DNA样品,并开始反应。没有必要标准化样品中基因组DNA的量。然而,熟练技术人员可以通过使用具有相对相等浓度的基因组DNA样品获得最好的结果。
在一些实施方案中,可以用合适的对照设置PCR测定法(例如PCR测定法)。例如,可以用对照孔实施多孔板中的反应,所述对照孔包括:(1)具有试剂但没有DNA样品的阴性对照;(2)包含bm1玉米基因组DNA的纯合阳性对照;(3)和半合子阳性对照,如上文所描述的。然后,在合适的循环条件下通过PCR扩增DNA。例如,在使用PCR系统9700的一些实施方案中,可以有于95℃持续15分钟的单一初始变性循环,接着是变性(92℃持续15秒)和退火/延伸(60℃持续60秒)的30个循环。本领域技术人员了解,PCR循环条件可以随从业人员的判断而变化,并且获得相当的结果。
可以使用PCR测定法(例如端点PCR测定法)对BMR玉米或推定的BMR玉米进行基因型和/或接合性分析。在一些实施方案中,可以用报告物(例如荧光模块)标记基因特异性寡核苷酸探针。对于使用荧光计量检测的测定法,可以使用适合于检测探针的激发和发射波长设置在荧光分光光度计(例如Tecan GENiosTM;Switzerland)中分析PCR反应产物。例如,可以用激发波长485nm,和发射波长535nm测量荧光染料FAM。或者,可以用激发波长525nm,和发射波长560nm测量荧光染料VIC。
在完成PCR反应和探针检测后,可以使用例如任何合适的计算机图形学软件产生表和分布图。用相似基因型背景的野生型、半合子、和纯合DNA获得的结果可以充当阴性和阳性对照。在分离的群体中,可以获得3个数据点簇,容许将样品结果视觉测定为可能属于分离簇之一。或者,可以使用数据分析计算机软件来计算样品结果属于每个分离簇的概率,其中最可能的簇充当样品名称。在进行视觉测定时,每个簇的边界例如在3个数据点簇明显可见时可以是任意的。
也可以使用合适的分析包,诸如KLIMSTM(KBioscience实验室信息管理系统)从读板仪直接分析原始荧光强度数据。可以产生图,该图具有在一个轴上绘制的由针对突变体等位基因的特异性探针产生的荧光信号的相对荧光单元(RFU),和在另一轴上绘制的由针对野生型等位基因的特异性探针产生的荧光信号的RFU。然后,可以基于数据的图形显示中的簇分离进行接合性测定。
不含突变体基因组DNA(例如BMR突变)的样品仅可以产生野生型PCR产物的荧光读数。含有半合子或纯合突变体基因组DNA的样品可以比阴性背景对照产生更高的突变体特异性探针的RFU读数。若样品不产生足够的结果,则样品中的基因组DNA可能不是足够质量和/或数量的,并且应当实施新的DNA制备和/或新的PCR反应。优选地,不含DNA样品的阴性对照样品显示非常低的基因特异性探针检出。还优选的是,已知的纯合对照仅显示对照中突变体或野生型DNA的高检出,且已知的半合子对照显示突变体和野生型DNA两者的高检出。
可以在筛选样品前用所有合适的对照实施PCR方法的“测试运行”和基因型和/或接合性测定。方法的进一步优化可以是可在使用间有所不同的组分(例如,基因组DNA制备的方法、Taq DNA聚合酶、寡核苷酸、实验室设备,等等)期望的。可以建立PCR和热循环条件,其以可接受的探针检测水平(例如对于经荧光标记的寡核苷酸探针可接受的RFU)扩增已知基因组DNA模板中的突变体和/或野生型序列两者。
VI.具有降低的CAD2活性的生物体及其用途
A.具有降低的CAD2活性的生物体
本发明的一些实施方案还提供了包含含有依照本公开内容的突变体CAD2基因的核酸分子、与依照本公开内容的突变体CAD2基因特异性可杂交的核酸序列、或依照本公开内容的突变体CAD2基因的功能性变体的生物体。合适的生物体可以是任何合适的植物、酵母、或细菌。作为非限制性例子,包含前述序列的植物可以是农艺学价值的植物,例如但不限于:玉米;大豆;苜蓿;小麦;油菜籽;稻;高粱;甜菜;各种蔬菜,包括黄瓜、番茄、胡椒等;各种树,包括苹果树、梨树、桃树、樱桃树、红杉、松、橡树等等;和各种开花观赏植物。在具体的实施方案中,生物体可以是用于生成青贮饲料的植物。
可以将包含依照本公开内容的突变体CAD2基因、与依照本公开内容的突变体CAD2基因特异性可杂交的核酸序列、或依照本公开内容的突变体CAD2基因的功能性变体的植物细胞培养,并以植物组织培养细胞保持,或者可以将本领域中已知的某些植物激素添加至培养基,由此引起植物组织培养细胞分化并形成新的植物品种,该新的植物品种可以展现出bm1或其它降低的木质素表型。可用于这些和其它实施方案的此类植物培养方法是本领域中常规且公知的。
本发明的一些实施方案提供了包含依照本公开内容的突变体CAD2基因、与依照本公开内容的突变体CAD2基因特异性可杂交的核酸序列、或依照本公开内容的突变体CAD2基因的功能性变体的病毒(例如,噬菌体、或植物病毒)。
B.从具有降低的CAD2活性的植物生成的青贮饲料
本文中公开了用于增加青贮饲料喂养动物的肉量的方法,其使用自展现出降低的木质素含量的植物品种生成的青贮饲料以在与肥育给粮中的常规玉米青贮饲料相比时改善每日增重和饲料效率。此类青贮饲料可以有效替换肉牛肥育给粮中的谷物玉米。在一些实施方案中,所述方法包括提供从包含依照本公开内容的突变体CAD2基因的植物品种生成的青贮饲料,给动物喂养从包含依照本公开内容的突变体CAD2基因的植物品种生成的青贮饲料,并从动物生产肉或肉产品。在这些和其它实施方案中,青贮饲料喂养动物可以是反刍类。在具体的实施方案中,青贮饲料喂养动物可以是任何青贮饲料喂养动物,例如,牛、绵羊、猪、马、山羊、野牛(bison)、牦牛、水牛、和鹿。
在一些实施方案中,为了增加青贮饲料喂养动物的肉量提供的方法进一步包括选自下组的行为:将青贮饲料在配置用于运输的容器中放置,并将标记与青贮饲料联系起来,其中所述标记能够指导最终用户如何对动物施用青贮饲料。如此,提供了包含青贮饲料的试剂盒,使得该试剂盒容许最终用户增加青贮饲料喂养动物的肉量。
还公开了肉牛肥育给粮,其中所述肉牛肥育给粮包含玉米青贮饲料,其包含依照本公开内容的突变体CAD2基因。还公开了从已经喂养此类青贮饲料的动物制备的肉类和肉类产品。
从具有降低的CAD2活性的植物(例如玉米)生产青贮饲料。
在青贮期间,植物的细胞仍然是活的且有代谢活性,并且压缩的青贮饲料中植物细胞和微生物正在进行的代谢通过使用青贮植物材料中捕获的空气形成二氧化碳和热。厌氧代谢条件随青贮饲料中二氧化碳水平升高而形成。期望的细菌在植物呼吸停止时开始发酵过程。若存在太多空气,或者若二氧化碳逃脱,则厌氧条件可能不能形成。在此情况中,可以继续呼吸,并且呼吸的植物细胞可以使用太多的糖和碳水化合物。这可能消耗期望的细菌保护作为青贮饲料的植物材料需要的营养物,并且可以产生劣等的青贮饲料。为了避免此不想要的效果,在填充后立即包装并覆盖青贮饲料可以是重要的。
一旦植物细胞的呼吸停止,乙酸和乳酸由以青贮玉米中可用的淀粉和单糖为食的细菌生成。为了促进期望的细菌生长,青贮饲料可以含有少量的空气、80°-100°F的温度、和用于食物的淀粉和糖。可以继续发酵,直至青贮饲料的酸度高得足以使细菌生长停止。在一些例子中,期望的酸度程度是pH约4.2。此酸度程度可以在填充青贮仓后3周内发生。
若草料中的水分高得过度,则可能发生渗出。渗出牵涉青贮饲料排出浸出液(来自青贮饲料和浆状物(pulp)的过量水分),其一般作为严重污染物进入环境。经由渗出,可能损失青贮饲料的期望组分(例如,含氮化合物,诸如蛋白质;和矿物质)。渗出一般在青贮后约第四天达到其峰值。因此,为了避免例如损失来自青贮饲料的期望的青贮饲料组分,进入青贮仓中的草料的水分含量可以选择为低得足以降低或阻止渗出损失。然而,太干的青贮饲料不能充分包装,而且还可以由于过度发酵和发霉而展现出期望的组分自青贮饲料的高损失。
可以以约30-40%的干物质含量青贮植物以实现最佳的发酵过程,并且使发酵期间的损失最小化。为了达到约30-40%的干物质含量,可以期望让植物材料在收割后且在用例如草料收获机切碎前在田间全部弄干。在制备青贮饲料时,谷物可以与植物的剩余部分一起收获。为了提高青贮饲料喂养动物肠道中摄取的青贮饲料中营养物的利用度,可以期望在切碎过程期间压碎谷物。
可以将收获的植物材料(例如,玉米植物材料)转移到青贮仓中。可以用于青贮饲料制备的青贮仓的非限制性例子包括:槽式青贮仓(bunker silo)、青贮饲料堆、混凝土块(concrete stave)青贮仓、或塔式青贮仓。植物材料在青贮仓中压紧以自植物材料除去空气,并且实现无氧发酵。可以期望用塑料青贮饲料膜密封青贮仓,这取决于使用的青贮仓类型。在壕式(trench)青贮仓、槽式青贮仓、或大直径塔式青贮仓上使用塑料覆盖物可以实质上削减饲料损失。通常,覆盖物在将最后一担植物材料在青贮仓中包装后立即应用,并且使塑料覆盖物加重以将它们稳固地保持于青贮饲料的表面上。或者,可以在青贮期间通过捆包植物材料,并将各捆在青贮饲料膜中包裹以进行密封为发酵制备植物材料。在壕式或槽式青贮仓上,可以期望将草料堆起或加顶。这可以便于将雨水排出青贮仓。
任选地,可以将添加剂添加至植物材料以改善发酵。特定应用中可能期望的植物材料添加剂的例子包括微生物添加剂,诸如乳杆菌属的种和其它接种物;酸诸如丙酸、乙酸或甲酸;或糖。如本领域技术人员应当容易理解的,也可以使用与本文中明确叙述的方法不同的用于生产青贮饲料的其它方法。
青贮饲料生产的一个优点是该方法对用于生产青贮饲料的植物材料内含有的添加物质的组成、量或利用度可以没有影响。相反,方法自身的目的一般是保持植物材料在使用此类材料生产青贮饲料前的质量,和将植物材料的正面特性保持一段延长的时间两者。这样,可以在已经收获植物材料很久以后使用植物材料作为草料。
可以在穗完全凹陷后,但在叶干燥至它们变成褐色的点前收获玉米用于青贮饲料。在此生长阶段时,穗可以已经积累其大部分潜在的饲养价值,但是也可以已经有自叶和杆的很少的损失。如此,玉米青贮饲料的数量和质量在植物材料在此阶段期间收获时可以处于其峰值。穗在穗为32-35%水分时通常会是完全凹陷的。在穗变为完全凹陷后随着时间流逝,植物材料的喂养价值可以降低,而田间损失可以升高。在乳熟期(谷物头部在打开时释放白色液体)或蜡熟(谷物头部开始转为半熟一致性)时为青贮饲料收获的玉米可以比若其后来收获产生每英亩更少的饲料营养物。如果来自玉米的植物材料收获太久,那么它在青贮仓中也可以不适当发酵。
成熟通常指穗已经积累几乎全部其干物质生成潜力的时间。生长期间的温度可以影响谷物的成熟率,特别在秋季期间。例如,若有过凉的温度和/或多云天气,则不能实现穗的完全干物质潜力。晚期切割并且具有褐色且死亡的叶和杆的玉米青贮饲料可以生成足够的青贮饲料,但是可能急剧降低每英亩的总产量。已经在晚期进入秋季或冬季早期生成青贮饲料时发现显著田间损失。还有,可以在晚期切割的青贮饲料方面发现青贮仓中贮存的干物质量的降低。
可以挽救已经例如通过干旱、高温、枯萎病、霜冻或冰雹损伤的玉米,供青贮饲料用。然而,此类挽救的青贮饲料的质量可能没有自已经达到凹陷阶段的未损伤玉米生成的青贮饲料高。青贮饲料的喂养价值可以取决于玉米发育的状态和玉米在其已经受到损伤后如何处理两者。来自未成熟的玉米的青贮饲料的常见观察结果包括:较高的水分;以与成熟玉米不同的方式发酵;酸味;和升高的轻泻药效果。具有来自霜冻的经历的玉米通常具有较低的胡萝卜素含量。它会快速变干并丧失叶。如此,可以期望对已经结霜并变得太干的玉米添加水。也可以期望对干旱玉米添加水。
可以期望不立即青贮已经通过极高温度损伤的未成熟玉米。未成熟的、热损伤的玉米可以从不生成穗,但是一些额外的杆生长可以源自延迟的收获。额外的杆生长会导致额外的饲料。若玉米在植物已经被热大面积损伤后太久收获以供青贮饲料用,则杆可以具有太多水分以致不能生成高质量青贮饲料。具有太多水分的在大面积热损伤后太久收获的玉米也可以经由渗出损失营养物。
自挽救的玉米生成的青贮饲料可能的问题包括其由于降低的谷物形成而缺乏能含量、和源自受损伤的植物的过度干燥的不适当发酵。如本领域技术人员已知的,可以分别通过补充别的能源,和添加水分至少部分改正这些问题。
玉米青贮饲料可以切成长度1/2”至3/4”的颗粒。此大小的颗粒可以更坚固地包装,并且另外,对于青贮饲料喂养动物而言可以是更美味的。长度短于1/2”的切得非常细的青贮饲料可以用再切割机(recutter)生成。切得非常细的青贮饲料的使用增加可以贮存于例如青贮仓中的干物质量。然而,切得非常细的青贮饲料对于要喂养青贮饲料的动物而言可能是不太美味的。
若青贮饲料太干,则可以期望添加水,例如以建立密封条件。一般地,对于水分含量期望升高每1%,每0.90公吨青贮饲料可以添加3.79升水。应当理解,可以需要或多或少的水,并且可以在青贮过程期间采取措施来确保添加足够,但不太多的水。水可以在填充青贮仓时添加。若在填充青贮仓后添加水,则它可能渗出青贮仓壁,并且因此不渗入青贮饲料质量。此渗出可以引起青贮饲料营养物的淋洗,而且可以破坏气封并导致不适当的发酵。
高质量青贮饲料可以在不添加任何添加剂或防腐剂的情况中生成。然而,可以将添加剂添加至青贮饲料以增加青贮饲料的一项或多项特征。例如,可以在青贮时对玉米草料添加糖蜜和谷物。
凭借大容量青贮仓和高速填充方法,应当监测青贮饲料在青贮仓中的分配和包装。不正确的分配和包装可以引起过多的渗出、较差的发酵、和/或贮存容量的损失。圆柱形青贮仓的容量的一半在青贮仓的最外边缘中。例如,对于直径14’的圆柱形青贮仓,其容量的一半在其直径的最外的2’中。若此外部区中的材料包装得太松,则青贮仓的容量可能显著降低。如此,塔式青贮仓可以装备有便于正确的青贮饲料分配和包装的分配器(distributor)。
由于实施发酵过程的活微生物的存在,在青贮过程期间在所有青贮饲料中发生营养物损失。在青贮过程期间损失的营养价值量取决于填充期间排除空气、和阻止二氧化碳损失等。二氧化碳是阻滞青贮植物细胞呼吸;和阻止渗出损失、不想要的发酵和/或由于暴露植物材料表面所致的酸败必需的。因此,良好的青贮实践一般导致具有最大营养含量的较高质量的青贮饲料。
Silage from plants(e.g.,maize)having reduced CAD2 activity in a finishing ration.
来自具有降低的CAD2活性的植物的青贮饲料在与相同品种的野生型植物相比时具有降低的木质素含量,并且可以切成比正常玉米青贮饲料(无论它加工与否)更长的颗粒。bm1青贮饲料的NDF消化率可以高于正常青贮饲料的NDF消化率。新鲜生成的青贮饲料的组成不必然反映青贮饲料喂养动物会食用的饲料的组成。因此,可以在青贮仓中在一段时间后分析发酵的样品。例如,可以在青贮仓中在至少两周,或至少两个月后分析样品。
一旦制备好来自具有降低的CAD2活性的植物的青贮饲料,并且青贮饲料已经确定准备好喂养动物,可以将青贮饲料纳入要喂养会用于肉或肉产品生产的动物的肥育给粮中。在一些例子中,包含青贮饲料的肥育给粮可以不包含谷物玉米,例如,干滚压玉米(dry rolled corn)、或碾碎的玉米。典型的肥育给粮包含至少约11%蛋白质、约60MCal净能量、约0.5%钙、约0.35%磷和约0.6%钾。在一些例子中,肥育给粮展现出较高的饲料效率(G:F)正是一项优点。在具体的例子中,不包含谷物玉米的肥育给粮可以导致喂养该肥育给粮的动物中与会源自使用谷物玉米作为能源的正常肥育给粮的平均日增重相当的平均日增重。
在一些例子中,使用来自包含依照本公开内容的突变体CAD2基因的植物(例如玉米)的青贮饲料生成肥育给粮,其中该肥育给粮包含约15%-约30%玉米青贮饲料。如此,肥育给粮可以包含例如13%、14%、15%、16%、17%、18%、19%、20%、21%、22%、23%、24%、25%、26%、27%、28%、29%、30%、31%、32%或33%青贮饲料。在具体的例子中,使用bm1玉米青贮饲料生成肥育给粮。在一些例子中,生成包含至少一种纤维源的肥育给粮。如此,肥育给粮可以包含例如1、2、3、4或超过4种纤维源。在一些例子中,生成包含至少一种玉米副产物的肥育给粮。如此,肥育给粮可以包含例如1、2、3、4或超过4种玉米副产物。在一些例子中,生成包含小于60%干物质的肥育给粮。在其它例子中,肥育给粮包含小于55%干物质。在一些具体的例子中,肥育给粮包含小于50%干物质。如此,肥育给粮可以包含例如59%、58%、57%、56%、55%、54%、53%、52%、51%、50%、49%、48%、47%、46%、45%、44%、43%、42%、41%、或40%干物质。
C.叠加突变体CAD2基因与一种或多种别的性状
在一些实施方案中,可以将依照本公开内容的突变体CAD2基因导入包含一种或多种期望性状的植物中,以生成具有bm1或其它降低的木质素表型,和一种或多种期望的性状两者的植物。将依照本公开内容的突变体CAD2基因导入包含一种或多种期望性状的植物中的过程(通过导入现有的植物系中,或者通过与提供期望性状的别的核酸分子同时将突变体CAD2基因导入植物中进行)在本文中称为“叠加”。在一些例子中,通过叠加突变体CAD2基因与一种或多种期望的性状,bm1或其它降低的木质素表型可以与一种或多种期望的性状组合。例如,叠加bm1性状与bm3性状可以导致青贮饲料消化率的进一步增加,以及在没有预处理的情况下生物量水解中可发酵糖类产量的非常显著的改善。
对于与bm1或其它降低的木质素表型的组合可以期望的性状的例子包括但不限于:细胞质雄性不育;植物疾病抗性基因(参见例如Jones等(1994)Science 266:789(对叶霉菌(Cladosporium fulvum)的抗性的番茄Cf-9基因);Martin等(1993)Science 262:1432(对丁香假单胞菌(Pseudomonas syringae)的抗性的番茄Pto基因);及Mindrinos等(1994)Cell 78:1089(对丁香假单胞菌的抗性的RSP2基因));赋予对有害生物的抗性的基因;苏云金芽孢杆菌(Bacillus thuringiensis)蛋白、其衍生物或以其为模型的合成多肽(参见例如Geiser等(1986)Gene 48:109(Btδ-内毒素基因;编码δ-内毒素基因的DNA分子可以例如以ATCC保藏号40098;67136;31995;和31998购自美国典型培养物保藏中心(Manassas,VA)));凝集素(参见例如Van Damme等(1994)Plant Molec.Biol.24:25(君子兰(Clivia miniata)甘露糖结合凝集素基因));维生素结合蛋白,例如亲合素(参见国际PCT公开文本US93/06487(使用亲合素和亲合素同系物作为针对昆虫有害生物的杀幼虫剂));酶抑制剂;蛋白酶或蛋白水解酶抑制剂(参见例如Abe等(1987)J.Biol.Chem.262:16793(稻半胱氨酸蛋白酶抑制剂);Huub等(1993)Plant Molec.Biol.21:985(烟草蛋白酶抑制剂I;及美国专利No.5,494,813);淀粉酶抑制剂(参见Sumitani等(1993)Biosci.Biotech.Biochem.57:1243(硝孢链霉菌(Streptomyces nitrosporeus)alpha-淀粉酶抑制剂));昆虫特异性激素或信息素,例如蜕化类固醇(ecdysteroid)或保幼激素、其变体、基于其的模拟物,或其拮抗剂或激动剂(参见例如Hammock等(1990)Nature 344:458(保幼激素的灭活剂));昆虫特异性肽或神经肽,其破坏受到影响的有害生物的生理学(参见例如Regan(1994)J.Biol.Chem.269:9(昆虫利尿激素受体);Pratt等(1989)Biochem.Biophys.Res.Comm.163:1243(来自太平洋折翅蠊(Diploptera puntata)的抑咽侧体神经肽(allostatin));美国专利No.5,266,317(昆虫特异性麻痹性神经毒素));在自然界中由蛇、黄蜂、或任何其它生物体生成的昆虫特异性毒液(参见例如Pang等(1992)Gene 116:165(蝎昆虫毒性肽));负责超积累单萜、倍半萜、类固醇、氧肟酸、类苯丙烷衍生物或另一种具有杀虫活性的非蛋白质分子的酶;牵涉生物学活性分子修饰(包括翻译后修饰)的酶,例如糖酵解酶;蛋白水解酶;脂肪分解酶;核酸酶;环化酶;转氨酶;酯酶;水解酶;磷酸酶;激酶;磷酸化酶;聚合酶;弹性蛋白酶;几丁质酶;或葡聚糖酶,无论是天然的还是合成的(参见国际PCT公开文本WO 93/02197(纤维二糖酶(callase)基因);含有几丁质酶编码序列的DNA分子(例如来自ATCC,在保藏号Nos.39637和67152下);Kramer等(1993)Insect Biochem.Molec.Biol.23:691(烟草天蛾幼虫(hornworm)几丁质酶);及Kawalleck等(1993)Plant Molec.Biol.21:673(欧芹ubi4-2多聚泛素基因);刺激信号转导的分子(参见例如Botella等(1994)Plant Molec.Biol.24:757(钙调蛋白);及Griess等(1994)Plant Physiol.104:1467(玉米钙调蛋白);疏水矩肽(hydrophobic moment peptide)(参见例如国际PCT公开文本WO 95/16776(Tachyplesin的肽衍生物,其抑制真菌植物病原体);和国际PCT公开文本WO 95/18855(赋予疾病抗性的合成的抗微生物肽));膜通透酶、通道形成剂、或通道阻断剂(参见例如Jaynes等(1993)Plant Sci 89:43(使转基因植物对青枯假单胞菌(Pseudomonas solanacearum)有抗性的杀菌肽-β溶胞肽类似物(cecropin-βlytic peptide analog);病毒侵入蛋白或自其衍生的复合毒素(参见例如Beachy等(1990)Ann.rev.Phytopathol.28:451(针对苜蓿花叶病毒、黄瓜花叶病毒、烟草线条病毒、马铃薯X病毒、马铃薯Y病毒、烟草蚀刻病毒、烟草脆裂病毒和烟草花叶病毒的外壳蛋白介导的抗性));昆虫特异性抗体或自其衍生的免疫毒素(参见例如Taylor等,摘要#497,Seventh Int’l Symposium on Molecular Plant-Microbe Interactions(Edinburgh,Scotland)(1994)(经由生成单链抗体片段进行的酶促失活);病毒特异性抗体(参见例如Tavladoraki等(1993)Nature 366:469(用于针对病毒攻击提供保护的重组抗体基因));在自然界由病原体或寄生物生成的发育阻滞蛋白(developmental-arrestive protein)(参见例如Lamb等(1992)Bio/Technology 10:1436(真菌内α-l,4-D-多聚半乳糖醛酸酶通过溶解植物细胞壁同-α-1,4-D-半乳糖醛酸酶(galacturonase)来促进真菌定殖(colonization)和植物营养物释放;Toubart等(1992)Plant J.2:367(内多聚半乳糖醛酸酶抑制蛋白));和在自然界由植物生成的发育阻滞蛋白(参见例如Logemann等(1992)Bio/Technology 10:305(大麦核糖体失活基因,其提供升高的对真菌疾病的抗性))。
对于与bm1或其它降低的木质素表型的组合可以期望的性状的其它例子包括但不限于:赋予对除草剂的抗性的基因(Lee等(1988)EMBO J.7:1241(突变体ALS酶);Miki等(1990)Theor.Appl.Genet.80:449(突变体AHAS酶);美国专利No.4,940,835和6,248,876(提供草甘膦抗性的突变体5-烯醇丙酮酰莽草酸(enolpyruvylshikimate)-3-磷酸合酶(EPSP)基因);美国专利No.4,769,061和ATCC保藏号39256(aroA基因);草甘膦乙酰基转移酶基因(草甘膦抗性);来自链霉菌属物种(Streptomyces species),包括吸水链霉菌(Streptomyces hygroscopicus)和绿色产色链霉菌(Streptomyces viridichromogenes)的其它膦酰基化合物),诸如那些记载于欧洲申请No.0 242 246和DeGreef等(1989)Bio/Technology 7:61的(提供草甘膦抗性的草铵膦膦丝菌素乙酰基转移酶(PAT)基因);吡啶氧基或苯氧基丙酸和环己酮(草甘膦抗性);欧洲专利申请No.0 333 033和美国专利No.4,975,374(提供对除草剂诸如L-膦丝菌素的抗性的谷氨酰胺合成酶基因);Marshall等(1992)Theor.Appl.Genet.83:435(Acc1-S1,Acc1-S2,和Acc1-S3基因,其提供对苯氧基丙酸和环己酮,诸如稀禾定(sethoxydim)和吡氟氯禾灵(haloxyfop)的抗性);WO 2005012515(提供草甘膦抗性的GAT基因);WO 2005107437(赋予对2,4-D、fop和吡啶基氧基生长素除草剂的抗性的基因);和抑制光合作用的除草剂,诸如三嗪(psbA和gs+基因)或苯基氰(腈水解酶基因)(参见例如Przibila等(1991)Plant Cell 3:169(突变体psbA基因);腈水解酶基因的核苷酸序列披露于美国专利No.4,810,648,且含有这些基因的DNA分子以ATCC保藏号53435,67441,和67442可获得;及Hayes等(1992)Biochem.J.285:173(谷胱甘肽S-转移酶))。
对于与bm1或其它降低的木质素表型的组合可以期望的性状的其它例子包括但不限于:赋予或促成增值(value-added)性状的基因,例如,经修饰的脂肪酸代谢(参见例如Knultzon等(1992)Proc.Natl.Acad.Sci.U.S.A.89:2624(增加植物的硬脂酸含量的硬脂酰-ACP去饱和酶的反义基因));降低的肌醇六磷酸盐含量(参见例如Van Hartingsveldt等(1993)Gene 127:87(黑曲霉(Aspergillus niger)肌醇六磷酸酶基因增强肌醇六磷酸的分解,对经转化的植物添加更多游离的磷酸根);及Raboy等(1990)Maydica 35:383(与负责具有低水平的肌醇六磷酸的玉米突变体的等位基因有关的DNA的克隆和再导入));和例如通过用编码改变淀粉分支样式的酶的基因转化植物来实现的经修饰的碳水化合物组成(参见例如Shiroza等(1988)J.Bacteol.170:810(链球菌(Streptococcus)突变体果糖基转移酶基因);Steinmetz等(1985)Mol.Gen.Genet.20:220(果聚糖蔗糖酶(levansucrase)基因);Pen等(1992)Bio/Technology 10:292(α-淀粉酶);Elliot等(1993)Plant Molec.Biol.21:515(番茄转化酶基因);Sogaard等(1993)J.Biol.Chem.268:22480(大麦α-淀粉酶基因);及Fisher等(1993)Plant Physiol.102:1045(玉米胚乳淀粉分支酶II))。D.具有降低的CAD2活性的植物的其它用途
除了青贮饲料生产外的许多农艺学或产业应用关注期望的植物产物,其产量与植物细胞壁中木质素的含量和/或组成直接相联系。此类产物和应用的例子包括但不限于:纸生产,和产生例如生物燃料形式的能量中使用的产物。包含依照本公开内容的突变体CAD2基因的植物可以具有bm1或其它降低的木质素表型。如本领域技术人员会领会的,可以预期自此类植物衍生的植物产物具有与相同品种的野生型植物区别的特征,该区别的特征可以是期望的。如此,利用植物中预期的bm1或其它降低的木质素表型的包含依照本公开内容的突变体CAD2基因的植物的任何用途在本公开内容的范围内。
提供以下实施例以例示某些具体的特征和/或实施方案。实施例不应解释为将公开内容限制于例示的具体特征或实施方案。
实施例
实施例1:对来自两种bm1系的CAD2基因的克隆和测序
使用来自近交系515Dbm1(bm1突变体)、6XN442(野生型)、和DASbm1的玉米叶样品。DASbm1是一种在CV5123/GR8207遗传背景中发现的、新颖的、天然存在的bmr突变体。在2003年夏季通过使用GR8207作为雄性,并将其与雌性CV5123杂交在育种杂交区组中创建使DASbm1突变起源的初始F1世代。将此杂交在2003年的冬季苗圃中自花传粉,然后,将F2穗散装以产生F2种子。在2004年夏季种植F2群体,并选择60个自花传粉的穗以推进到谷物测试。将这60个穗送到2004年的冬季苗圃以自花传粉,从而创建前进(go-forward)S2穗选择。然后,在2006年夏季苗圃中种植S2穗。
在走过苗圃时进行bmr突变体发现,查看近交系。鉴定显示明显的BMR表型的行。此行是选自CV5123/GR8207-B群体的60个穗中的31个,并且除了具有BMR性状外显示了在植物结构上与选择的其它59个穗的非常接近的相似性。最初,不能确定突变体是否是bm3、bm1、或其它突变。然后,将S2植物自花传粉,并将种子收集并保存。在2007年夏季,将S3种子种植,并且所有植物仍显示BMR性状。将S3植物自花传粉以创建S4穗,并且该品系记录为青贮饲料生产可能感兴趣的。在2008年夏季,对已知的bm1和bm3近交系两者进行测试杂交以测定bmr突变体的背景。在2009年夏季,在后代测试中使测试杂交种子发芽,并确定突变是新的bm1突变,因为用bm1近交物的后代测试中的所有植物表达BMR性状,而bm3后代显示所有植物是非BMR。然后,从CV5123/GR8207NIL(即515Dbm1近交物),及来自各种遗传背景的杂合的和空的植物对叶组织取样,并进行分子遗传分析,包括标志物工作,以测定DASbm1bmr突变体的确切性质。
使用Genogrinder 2000(SPEX CertiPrep,Metuchen,NJ)将玉米叶样品研磨成精细的粉末。用标准的2.5%CTAB(溴代十六烷基三甲胺)DNA提取方案提取DNA。在PCR前,用Quant-it PicoGreen量化试剂盒(Invitrogen,Carlsbad,CA)依照制造商的用法说明书量化DNA样品。
从Genbank检索来自玉米近交系玉米B73的CAD2基因组序列(Genbank登录号AC230031)。此序列的长度是约5.9kb,并且包括1.7kb启动子、4个外显子、3个内含子和短的终止子。引物基于B73序列设计,并且使用ABI GeneAmp PCR系统9700(Applied Biosystems,Foster City,CA)实施PCR反应。反应含有2.5个单位的TaKaRa LA Taq(Takara Bio Inc.,Shiga,Japan)、400nM dNTP、200nM正向和反向引物、和30ng基因组DNA。使用以下PCR程序:PCR以94℃持续2分钟的变性步骤开始;接着是94℃持续45秒,55℃持续45秒和72℃持续2分钟的30个循环。将PCR产物在2%E-凝胶上显现,然后使用PURELINKTM快速凝胶提取试剂盒(Invitrogen,Carlsbad,CA)提取。然后,将纯化的PCR产物送到Eurofins MWG Operon(Huntsville,AL)以直接测序。使用测序仪4.8(Ann Arbor,MI)分析序列。通过比较自bmr突变体和6XN442扩增的CAD2序列与对玉米B73列出的序列鉴定突变。
由于3个相当大的内含子和一些罕见的序列特征(例如,内含子3中的82bp TA简单重复)的存在,最初扩增一个5.9kb片段中的CAD2基因的尝试失败。因此,设计一系列巢式PCR引物(参见表1),并用于从515Dbm1和野生型品系成功扩增7个重叠CAD2片段。图1。从7个片段装配515Dbm1和野生型品系的全长CAD2序列。515Dbm1和4XN442的基因组、预测的cDNA和蛋白质序列以SEQ ID NO:1-6列出。
表1:关于7个重叠的基因组CAD2 PCR片段的引物和长度信息。
515Dbm1突变体CAD2与野生型(6XN442)和bm1(B73)的那些CAD2的比较揭示了15个SNP和8处插入/缺失的存在。除了位于bm1突变体的外显子3中的AC二核苷酸插入(515Dbm1中的核苷酸3994-3995),和位于第4个外显子中的G/A SNP(515Dbm1中的核苷酸5410)外,大多数这些变化位于启动子区或内含子中。参见图3和4。515Dbm1中的AC插入产生移码和在插入下游52bp的提前终止密码子,这生成短得多的CAD2蛋白(对于515Dbm1 CAD2的147个氨基酸,对对于野生型CAD2的367个氨基酸。图4。截短的515Dbm1 CAD2蛋白即使其被生成也最可能是非功能性的,因为它缺乏NADPH结合和C端催化域。
使用表1中显示的相同的7个引物对来尝试从DASbm1扩增重叠的CAD2片段,并且6对扩增出预期的片段。然而,F5/R5对即使在多次尝试后不能扩增预期的3327bp片段,或者甚至任何特异性PCR产物。因此,设计别的巢式PCR引物(参见表2),并用于成功扩增缺少的3327bp片段的5’端2757bp。然而,我们不能使用许多引物对和PCR条件扩增3’端(约570bp)。除了缺少的570bp缺口外,从DASbm1扩增的5346bp CAD2基因组序列与B73的相同。我们怀疑这是含有BMR表型的分子变化的区域。
表2:针对缺少的DASbm1基因组CAD2 PCR片段的5’端的引物。
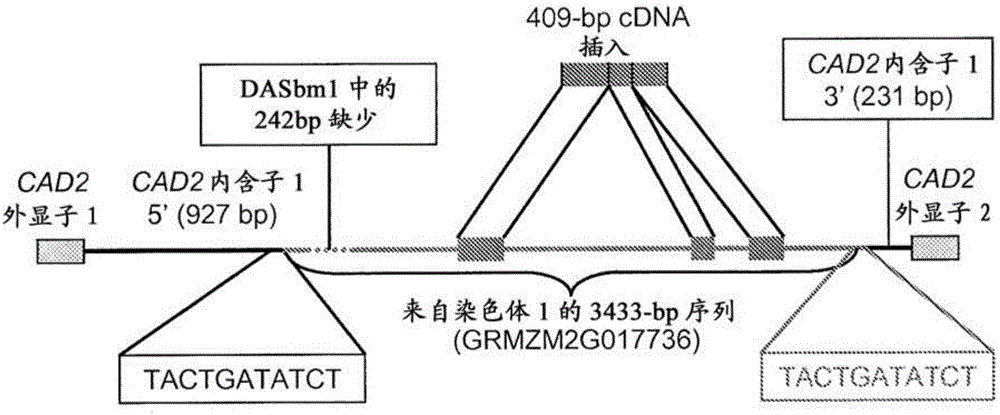
设计涵盖预测的外显子1和外显子3的引物(CVF:GTCCGAGAGGAAGGTGGTC(SEQ ID NO:35);和CVR:GGCCGTCCATCAGTGTAGA(SEQ ID NO:36)),然后用于从DASbm1、515Dbm1和6XN442扩增CAD2 cDNA片段。如预期的,从515Dbm1和6XN442扩增375bp的片段。另一方面,发现来自DASbm1的PCR产物是显著较大的。测序结果揭示了来自DASbm1的CAD2 cDNA含有内源外显子1和外显子2之间的精确409bp插入。图4。针对B73基因组的BLAST搜索提示了DASbm1中的409bp cDNA插入最可能是自位于染色体1上的推定转座子/重复基因(GRMZM2G017736)中含有几个内含子的部分的RNA剪接的结果。
基于DASbm1中观察到的409bp cDNA插入和其可能的基因组来源,设计别的PCR引物(参见表3),并且用于从DASbm1扩增CAD2的嵌合基因组区。图1。测序结果揭示了基因组插入的长度是3444bp,并且从DASbm1扩增的总基因组CAD2是9360bp。图3中显示了来自DASbm1、B73、515Dbm1、和6XN442的基因组CAD2的比对。除了3444bp插入外,剩余的来自DASbm1的CAD2序列与B73的相同。3444bp DASbm1转座子插入在本文中以SEQ ID NO:40列出。
表3:针对DASbm1 CAD2的嵌合基因组区的PCR引物
DASbm1中插入的基因组性质。
如图2中显示的,DASbm1中的插入位点位于CAD2的内源内含子1中。3444bp插入序列的更紧密检查揭示了具有序列TACTGATATCT(SEQ ID NO:41)的最后11个碱基是直接位于插入上游的来自CAD2的内含子1的11bp序列的直接复制。图2。这些直接重复指示插入可能是由于DNA终止子活性所致。
针对B73基因组序列使用3433bp插入(没有11bp直接重复)的BLAST搜索结果显示了不同染色体上的许多同源命中,指示序列的重复性质。然而,除了DASbm1插入物中的242bp缺少的缺口外,染色体1上仅一个命中(玉米B73 RefGen_v1,核苷酸位置148086176-148089850)在整个长度里是100%相同的。图4。其它命中是小于100%相同的,并且仅匹配插入物的一部分。由于CAD2位于染色体5上,DASbm1中的插入物最可能从其在染色体1中的初始位置切割,并且经由转座子活性再插入CAD2中。242bp缺少的缺口可以反映B73和DASbm1(CV5123/GR8207)基因组之间的差异,或者它可以是由于转座过程中的缺失所致。
预测的基因(GRMZM2G017736)位于3433bp插入序列内,并且明显在正常玉米植物中转录,因为在数据库中找到不少相应的全长EST(例如EU976746和EU976335)。GRMZM2G017736中预测的ORF编码与通常为较大蛋白质的许多hAT(以来自果蝇(Drosophila)的hobo、来自玉米的Ac、和来自金鱼草的Tam3命名)转座酶家族显示高度同源性的167个氨基酸的小蛋白质。因为截短的167个氨基酸的蛋白质缺乏通常存在于全长转座酶中的BED锌指DNA结合域(Pfam02892),3433bp片段更可能是Ds元件,其需要别处存在Ac元件以实现转座。
一旦在染色体5上的CAD2基因座中,插入和CAD2形成嵌合基因。插入被剪接成3个409bp的外显子,并且与内源CAD2外显子形成嵌合mRNA。图2和4。前1158bp插入片段与CAD2的第一个内含子的5’端927bp作为嵌合内含子一起剪接,GRMZM2G017736的整个预测的ORF作为1204bp内含子的一部分剪接,并且最后463bp插入片段与CAD2的第一个内含子的3’端231bp作为嵌合内含子一起剪接。图2。
转座子插入在DASbm1 CAD2中产生提前停止。
如上文所描述的,DASbm1中的转座子插入创建嵌合基因,其以在内源CAD2外显子1和外显子2之间具有额外的409bp的嵌合mRNA转录。图4。预测此额外的409bp序列产生移码和提前终止密码子,其生成仅48个氨基酸(对野生型蛋白质的367个氨基酸)的短得多的CAD2蛋白。图5。与515Dbm1的截短的CAD2蛋白相似,48个氨基酸的DASbm1 CAD2即使其被生成也最可能是非功能性的,因为它缺乏NADPH结合和C端催化域。
实施例2:基于CAD2等位基因特异性PCR的高通量测定法设计和确认
基于515Dbm1 ZmCAD2的外显子3中的AC插入设计KASParTM测定法以区别突变体等位基因与野生型等位基因。遵循从制造商(KBioSciences,Hoddesdon,Hertfordshire,UK)获得的方案测试没有bm1突变的32个野生型近交系,及含有bm1突变的分离群体。
基于AC插入周围的序列,设计三种寡聚物(SEQ ID NO:42(AC_R1);TCAGTCTCAAGAACTCACTTCTGG,SEQ ID NO:43(AC_A1);GAAGGTGACCAAGTTCATGCTACTGATGGACGGCCCACA和SEQ ID NO:44(AC_A2);GAAGGTCGGAGTCAACGGATT ACTGATGGACGGCCCACG)以进行高通量KASParTM标志物测定法,其可以用于区别515Dbm1 CAD2等位基因与其它bm1和野生型CAD2等位基因。图8。
首先用一组32个野生型近交物和bm1突变体系515Dbm1验证KASParTM测定法。此分析指示非bm1系不含AC插入。然后,在拥有三种基因型:纯合野生型;半合子bm1(含有515Dbm1 AC插入);和杂合之一的bm1玉米系的分离群体中验证测定法。图9。KASPar标志物检出纯合bm1和杂合群体内的bm1AC插入。此外,此高通量测定法将纯合bm1、杂合、和纯合野生型群体彼此区别。因而,可以使用诸如这些的标志物来快速提供怀疑含有来自515Dbm1的bm1的植物中bm1基因型的接合性的精确鉴定。因此,可以使用该测定法来鉴定bm1种质,加速bm1性状的渐渗和使用bm1的分子育种以改善青贮饲料消化率或提高乙醇产量。
我们还开发出新的TaqManTM测定法来区别所有DASbm1、515Dbm1、和野生型CAD2等位基因。表4和表5中分别列出用于DASbm1和515Dbm1的引物和探针。因为DASbm1具有较大的转座子插入,所以用于DASbm1(DASbm1_F)和野生型(Wt CAD2_F)的分开的正向引物设计为使得在标准的TaqManTM测定条件下扩增合适的PCR产物。基于DASbm1中的转座子插入、515Dbm1中的AC插入、和野生型CAD2序列,使用Primer Express 3.0设计用于TaqManTM测定法的引物和探针。引物和用FAM或VIC和小沟结合非荧光淬灭剂TMI(MGBNFQ)染料双重标记的探针由Applied Biosystems(Foster City,CA)合成。将寡聚物在1x Tris-EDTA中溶解至100μM。对所有PCR反应使用TaqManTM基因型分型主混合物(Applied Biosystems,Foster City,CA,产品目录编号4371355)。在iCyclerTM光学系统(BioRad,Hercules,CA)上使用96孔板设立25μl体积中的实时PCR反应,根据推荐以于95℃变性15分钟开始,接着是92℃持续15秒,和60℃持续1分钟的50个循环。在每个循环结束时记录荧光信号。
表4:用于TaqManTM测定法以区别DASbm1和野生型的引物和探针。
表5:用于TaqManTM测定法以区别515Dbm1和野生型的引物和探针。
图10中显示了使用表4和5中列出的引物的等位区别测定法的结果。因为这些测定法和KASParTM标志物直接基于CAD2中的bm1突变,所以它们会比可用的间接bm1标志物提供更精确的基因型分型。
实施例3:表征具有截短CAD2突变的bm1玉米。
由于DASbm1代表一种新颖的bm1突变,除了其具有BMR表型外关于DASbm1一无所知。我们决定调查DASbm1植物中的RNA表达水平和木质素含量,并且将它们与515Dbm1和野生型(6XN442)植物的RNA表达水平和木质素含量比较。预期515Dbm1和DASbm1植物由于这两种玉米系的CAD2基因中的突变,及随之发生的CAD2的提前终止而具有显著降低的CAD活性。另外,假设515Dbm1和DASbm1植物具有降低的CAD2转录物丰度。
将DASbm1、515Dbm1、和6XN442植物在温室中种植。从4周龄植物收获叶组织,并将中脉组织分开。将样品在液氮中研磨成精细的粉末,并用Qiagen的RNeasyTM植物微型试剂盒提取。使用来自Invitrogen的SuperScriptTMIII一步RT-PCR试剂盒和BioRad的iCyclerTM进行定量RT-PCR以测定RNA表达水平。基于CAD2的第四个外显子设计CAD2特异性寡聚物,并使用玉米转化酶作为对照,用于Delta-Delta CT计算。
为了比较CAD2 RNA表达水平,设计基于CAD2的第四个外显子和玉米转化酶的下列引物/探针,用于定量RT-PCR。表6。
表6。用于CAD2 qRT-PCR的引物和探针。
如图6中显示的,不管根本的突变如何,bm1植物比叶组织的剩余部分具有高得多的CAD2表达水平。对于6XN442、515Dbm1、和DASbm1,差异分别是4.1、8.0、和3.4倍。DASbm1和515Dbm1系两者都具有显著较小的CAD2表达,对于DASbm1,中脉中平均降低91%,及叶中降低89%;而对于515Dbm1,中脉中降低87%,且叶中降低93%。然而,两种bm1突变体之间没有显著差异。图6。这些结果与已经在文献中对玉米bm1(Halpin等(1998),见上文),及高粱突变体bmr6(Saballos等(2009),见上文)报告的事情一致。RNA表达降低最可能是由于由在515Dbm1和DASbm1突变体中产生提前的CAD2蛋白的无义突变介导的RNA降解(即一种先前在植物和其它物种中观察到的机制)所致。Conti和Izaurralde(2005)Curr Opin Cell Biol.17:316-25。
为了比较突变体和野生型植物的相对木质素含量,将经研磨的叶和节间进行FTIR分光术分析。
使用具有含金刚石晶体的衰减全反射(ATR)Miracle取样配件(Pike Technologies,Madison,WI)的Bruker Vertex分光光度计(Bruker Optics Inc,19Fortune Drive,Manning Park,Billerica MA 01821)实施傅里叶变换红外线测量。分光计装备有氘化的硫酸三甘氨酸(DTGS)检测仪,以4cm-1分辨率(resolution)和0.32cm/s镜速度(mirror velocity)运行。在傅里叶变换前共添加256个干涉图。在获得光谱前容许用氮气(1级)将该仪器扫气5分钟,以使由于大气二氧化碳和水蒸气所致的光谱贡献最小化。ATR Miracle池取样配件(cell sampling accessory)具有为了在FTIR分光计中使用设计的单次反弹金刚石(single-bounce diamond)。红外线束的穿透深度是1.46微米。此配件的主要优点在于与多次反弹HATR配件相比,它需要更小的样品体积。
刚好在抽穗丝后从温室种植的玉米植物收集叶(第7和第8、第9和第10个)和节间(第1和第2、第7和第8、第9和第10个),将其冻干,并研磨成精细的粉末。将小部分的样品直接在ATR的金刚石晶体上放置以获得数据。在800-1800cm-1的指纹区中收集光谱。获得所有样品的单束光谱,并且光谱数据以吸光度单位以空气的背景光谱比率呈现。在每次测量后,将ATR晶体彻底清洁并干燥,并且检查其光谱以确保晶体表面上没有保留来自先前获得的样品残留。将所有光谱进行基线校正,并将面积标准化以消除任何光谱伪像。
样品中的木质素含量与FTIR相对吸光度成正比。如预期的,这两种突变体中CAD2 RNA表达降低导致显著降低的木质素含量。图7。平均地,在与野生型6XN442相比时,总木质素含量降低在DASbm1中是约24%(P=0.03),而在515Dbm1中是30%(P=0.006)。两种bm1突变体间没有显著差异(P=0.4)。
玉米中的bm1突变展现出与显著降低的木质素含量和改变的木质素组成有关的叶中脉微红褐色色素沉着。此表型在新形成的叶和其它组织中从V6到后期阶段是可见的。我们现在已经鉴定两种独立的bm1突变体(DASbm1和515Dbm1)的分子基础。基于特定的突变,我们还已经开发用于检测不同等位基因的高通量PCR测定法。前述结果表明ZmCAD2是515Dbm1和DASbm1中bm1突变的根本基因,并且为观察到的表型提供分子基础。由于bmr突变在许多单子叶植物物种间是常见的,上文所描述的突变和标志物也可以在其它作物,例如高粱、甘蔗、黍(millet)、稻、和生物能物种诸如柳枝稷中使用。
实施例4:褐色中脉1(bm1)作为转基因的视觉选择标志物
EXZACT Precision Technology是一种锌指工程化技术,其已经显示了精确靶向任何DNA序列,并且经由基因破坏、编辑或基因添加来正确修饰基因组。基于EXZACT Precision Technology和最近的bm1发现,可以执行两种备选办法来创建视觉选择标志物以区别转基因植物与其空分离子。视觉标志物会使该领域中的育种人员和科学家能够快速鉴定分离群体中的转基因个体(例如T1),并且在没有详述分子工作情况下将它们与空值比较,并加速转基因流水线筛选过程。也可用高通量测定法,并且在需要时可以用于确认视觉观察。
在第一种代表性的方法中,可以使用突变体bm1玉米(DASbm1或515Dbm1)作为靶种质进行转化。经由分子育种,可以使用基于CAD2的标志物将bm1突变引入目前的转化种质(B104)中。通过EXZACT Precision Technology将相同构建体中的Wt CAD2和感兴趣的基因(GOI)靶向内源突变体cad2基因座。由于bm1突变是隐性的,杂合的或GOI-WtCAD2方面纯合的植物具有正常的色素沉着,而空分离子具有褐色中脉表型。这在没有EXZACT Precision Technology的情况下也起作用,但是基因组中的转基因插入位点是随机的。一个备选的实施方案包括一个或多个锌指蛋白的工程化改造,其删除内源突变体cad2基因座中DASbm1中的转座子插入或515Dbm1中的AC插入,并且同时将GOI插入邻近的基因座中(以防止GOI和bm1标志物的显著分离)。这消除对转基因构建体中Wt CAD2的需要。
在第二个代表性的办法中,使用Wt植物作为靶种质进行转化。可以使用EXZACT Precision Technology将GOI靶向至内源Wt CAD2基因座。插入位点可以与DASbm1中的转座子插入、515Dbm1中的AC插入或CAD2基因座内使蛋白质非功能性的任何位置(公知的CAD2功能域)相同。在此情况中,在转基因方面纯合的植物具有褐色中脉表型,而杂合子和空值具有正常的色素沉着。褐色中脉及相关表型是有益的,并且可以使用EXZACT Precision Technology来靶向BM1(CAD2)和/或BM3(咖啡酸O-甲基转移酶)基因座。
- 还没有人留言评论。精彩留言会获得点赞!