一种fruC基因过表达的重组梭菌、其构建方法及应用与流程
本发明涉及一种提高丁醇产量的重组梭菌、构建方法与应用,尤其是涉及一种可用于生产丁醇的重组梭菌、其构建方法及应用。
背景技术:
人类社会的发展与能源的利用密切相关。在远古时期,人类开始使用火,从而进入文明时代;第一次工业革命又将人类带入以煤炭为能源的时代;第二次工业革命后,人类开始利用石油等自然。而石油、煤炭等都属于不可再生能源,储量有限而且污染严重。能源问题已经属于迫切需要解决的问题。
新型绿色环保、可持续发展的能源,已经成为世界各国共同的需求。其中一种理想的可再生资源是生物质资源,生物质资源具有年产量大,可再生,绿色环保等优点。利用生物质资源进行生物燃料的生产则是一种新型的解决能源危机的方法。
生物燃料主要包括生物乙醇,生物丁醇。其中,生物丁醇比生物乙醇具有更多的优点,如能量密度高;可以与汽油任意比例混合;而且运输方便,不需对现有的运输管道做技术修改等。实际上,生物丁醇具有数十亿美元的市场,而且全世界对丁醇的需求以3%的比例增长,预计到2020年具有接近百亿美元的市场。利用传统的化工合成丁醇需要以石油为原料,投资高,设备技术复杂。因此利用生物质资源发酵生产丁醇成为可再生绿色能源开发利用的热点。但生物质资源存在利用率低的缺点,因此开发新工艺或研究工程菌株提高对生物质资源的利用以及成为目前的热点研究。
对于丁醇发酵,葡萄糖基、淀粉基的生物质资源最易被菌体利用,但价格较高;而非葡萄糖基的物料,存在诸多问题,如原料利用率低,发酵周期长,丁醇产量及产率低。在丁醇发酵生产中,丁醇的产量和产率是评价发酵性能的重要参数,提高丁醇产量有利于后续分离操作和降低提纯成本,而产率对资本投入具有很大影响,提高一倍产率,能够降低20%固定投入。所以,就需要进行工艺改造或菌株改造,从而提高丁醇产量,最终满足工业化指标。
随着分子生物学的发展,菌株改造技术愈来愈成熟,丙酮丁醇梭菌基因组的测序工作也已完成,研究工作者可以对丁醇发酵菌株进行分子水平调控。关于转录组学、代谢组学及蛋白组学的相关研究进展有着广泛报道,对丙酮丁醇梭菌生理代谢途径以及调控机制的认识已经取得很大进展。但通过菌株改造来提高丁醇发酵底物利用效率及生产强度的研究进展却不大,主要原因是缺少有效的靶标基因进行代谢工程的定向改造。
技术实现要素:
本发明所要解决的技术问题是,克服现有技术的不足,首先公开一种用于构建高产丁醇重组菌的fruc基因片段(locus_tag="ca_c0233"),其具有如seqidno.1所示的核苷酸序列。所述fruc基因编码的蛋白质fruc的氨基酸序列为seqidno.2。其中,该fruc蛋白质全长147个氨基酸,其分子量为16.56kda。
本发明还涉及上述fruc基因片段相关的生物材料,具体为下述一种:
(1)含有上文所述的fruc基因的表达盒;
(2)含有上文所述的fruc基因的重组载体或含有(1)所述表达盒的重组载体;
(3)含有(2)所述重组载体的重组菌。
本发明还公开了通过在梭菌内过表达fruc基因,来提高重组菌对果糖、混合糖(葡萄糖:果糖=1:4)以及菊芋水解液的利用率及提高重组菌的丁醇产量。所述重组梭菌含有核苷酸序列为seqidno.1的fruc基因。
对于上述技术方案中所述的高效生产丁醇的重组梭菌,具体的,还含有核苷酸序列为seqidno.3的硫解酶的启动子或其他能使fruc基因在梭菌内过表达的强启动子。
在优选的技术方案中,上文所述梭菌选自产丁醇的丙酮丁醇梭菌(clostridiumacetobutylicum),拜氏梭菌(clostridiumbeijerinckii),糖乙酸多丁醇梭菌(clostridiumsaccharoperbutylacetonicum)及糖丁酸梭菌(clostridiumsaccharobutylicum);可以为野生型菌株,也可为将上述所列举的梭菌经过诱变或遗传改造后的菌株。
本发明的另一个目的是,提供一种能提高丁醇发酵果糖、葡萄糖与果糖的混合糖以及菊芋水解液利用率及丁醇产量的梭菌的构建方法。具体包括以下步骤:
(1)fruc基因过表达重组质粒的构建:
将核苷酸序列为seqidno.3的硫解酶的启动子序列经psti和sali酶切后与pimp1质粒连接,得到载体质粒pimp1-pthl,以丙酮丁醇梭菌c.acetobutylicumatcc824基因组作为模板,利用pcr扩增核苷酸序列为seqidno.1的fruc基因,再将其与pimp1-pthl质粒进行连接从而构建pimp1-pthl-fruc质粒;
(2)过表达重组质粒的甲基化:
将重组质粒转入e.colidh10b(pan1)中进行甲基化,得到甲基化质粒pimp1-pthl-fruc;
(3)fruc基因过表达重组菌株的构建:
通过电转化法,将步骤(2)所得甲基化质粒pimp1-pthl-fruc转化至丙酮丁醇梭菌c.acetobutylicumatcc824中,通过涂布于含有红霉素抗性的固体tgy培养基上,培养、筛选获得含有fruc基因过表达质粒pimp1-pthl-fruc的重组梭菌。
更为具体的,上文所述的fruc基因过表达重组菌株的构建过程如下:厌氧条件下,取50-100ml梭菌活化培养基(tgy)培养的对数中期(od6201.0~1.5左右)的丙酮丁醇梭菌c.acetobutylicumatcc824细胞液,4℃、3000rpm离心10min,去除上清液,加入50ml预冷的电转缓冲液,洗涤两次,并重悬至1.5ml的电转缓冲液中,然后取80~100μl转入0.4cm的电转杯中,放置冰浴中用于电转化,加入10~20μl步骤(2)所得甲基化质粒pimp1-pthl-fruc,置于冰浴中2~3min,采用1.8kv脉冲电压和25μf的电容进行电转化,随后将电转液加入到梭菌活化培养基tgy中,37℃培养4h,2000~3000rpm离心10min收集菌体细胞,将收集的细胞涂布于含有红霉素抗性的tgy琼脂平板培养基上,培养36~40h后,获得含有fruc基因过表达质粒pimp1-pthl-fruc的丙酮丁醇梭菌,命名为丙酮丁醇梭菌c.acetobutylicumatcc824(pimp1-fruc)。
本发明进一步的目的是,提供一种利用上文所述的梭菌在生产丙酮丁醇中的应用:
步骤(3)获得的丙酮丁醇梭菌接种于含有红霉素抗性的发酵培养基及菊芋水解液培养基中进行厌氧发酵,发酵温度37~38℃,搅拌转速为150rpm,发酵培养基初始ph调至5.5,发酵72~168h。
对于上述技术方案中所述的重组梭菌的构建方法,所述电转缓冲液含有270mmol/l蔗糖,5mmol/lnah2po4,ph为7.4。
本发明中使用的活化培养基、种子培养基及发酵培养基应理解为现有技术中任何可实现丙酮丁醇梭菌所适用的常规培养基;菊芋水解液培养基应理解为实际物料培养基,除去菊芋水解液外,其他成分均为常规实验试剂。本发明实施例中所使用的配方如下:
活化培养基(g/l):葡萄糖20,胰蛋白胨30,酵母粉10。
种子培养基(g/l):葡萄糖70,乙酸铵3.22,酵母粉2.0,mgso4·7h2o0.2,kh2po40.5,k2hpo40.5,feso4·7h2o0.01,mnso4·7h2o0.01,生物素0.01,对氨基苯甲酸0.01。
发酵培养基(g/l):果糖或混合糖(葡萄糖:果糖=1:4)70,乙酸铵3.22,酵母粉2,mgso4·7h2o0.2,kh2po40.5,k2hpo40.5,feso4·7h2o0.01,mnso4·7h2o0.01,生物素0.01,对氨基苯甲酸0.01。
菊芋水解液培养基(g/l):乙酸铵3.22,酵母粉2,mgso4·7h2o0.2,kh2po40.5,k2hpo40.5,feso4·7h2o0.01,mnso4·7h2o0.01,生物素0.01,对氨基苯甲酸0.01;加菊芋水解液(含葡萄糖约15g/l,果糖约60g/l)定容。
菊芋水解液制备:将菊芋块茎切片晒干,称量500g至烧杯中,加入纯净水定容至4l;用硫酸调节ph为2;用八层纱布封口放入灭菌锅105℃酸解1h;用纱布滤除残渣,得到菊芋水解液,置于冰箱待用。
本发明另一方面涉及上述高效生产丁醇的重组梭菌的应用,即所述重组梭菌在提高丁醇发酵果糖、混合糖以及菊芋水解液的利用率,以及提高丁醇产量方面的应用。
通过本发明后文所述的具体发酵实验证明,本发明将fruc基因在丙酮丁醇梭菌c.acetobutylicumatcc824中过表达能显著提高菌株的丁醇发酵果糖、葡萄糖与果糖的混合糖以及菊芋水解液利用率及丁醇产量。由于丁醇对菌体具有毒害作用,导致丁醇产量十分有限,传统技术手段使菌体产丁醇浓度每提高1g/l都显得十分困难。而重组菌株相比对照组菌体,糖利用率提高了1.4倍以上,丁醇产量提高了约1.4~3.5倍。丁醇产率以及转化率也有一定量的提高。
附图说明
图1为重组质粒pimp1-pthl的结构示意图;
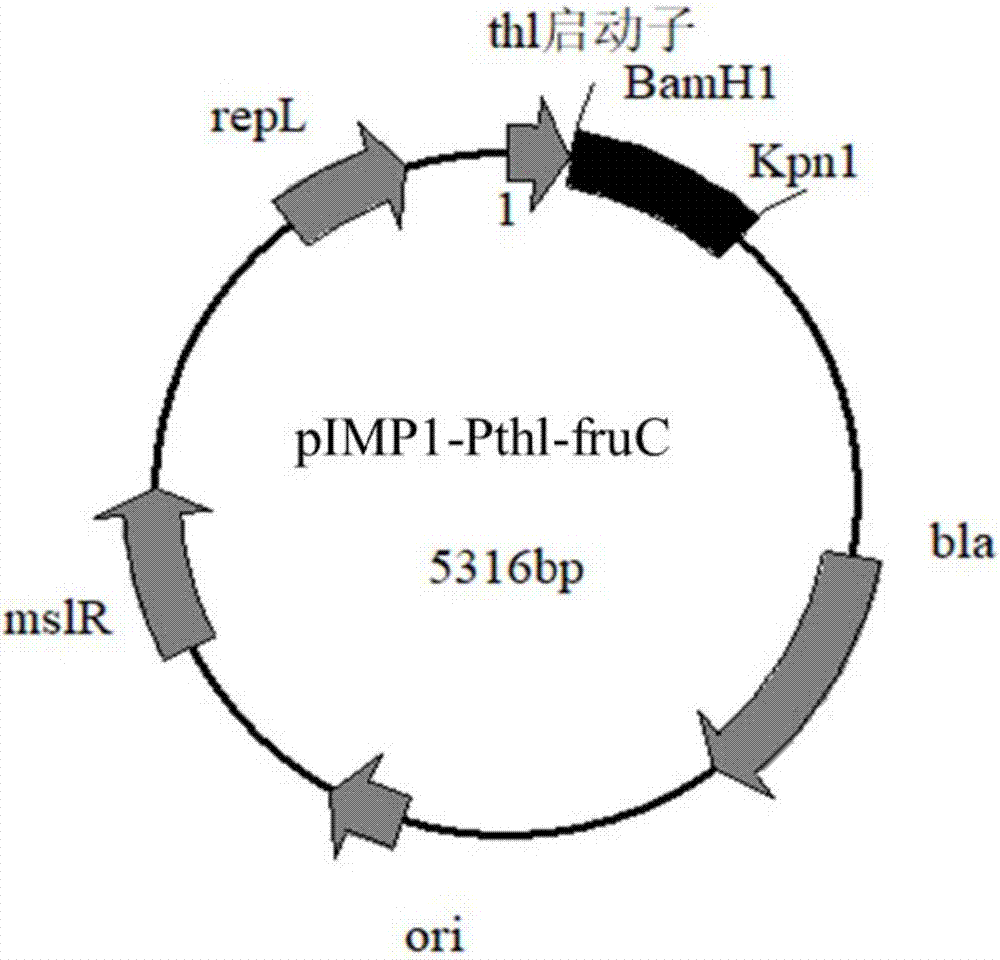
图2为重组表达质粒pimp1-pthl-fruc的结构示意图;
图3为野生型菌株c.acetobutylicumatcc824、空载质粒菌株c.acetobutylicumatcc824(pimp1)、fruc基因过表达重组菌株c.acetobutylicumatcc824(pimp1-fruc)在70g/l果糖中的发酵动力学曲线;
图4为野生型菌株c.acetobutylicumatcc824、空载质粒菌株c.acetobutylicumatcc824(pimp1)、fruc基因过表达重组菌株c.acetobutylicumatcc824(pimp1-fruc)在70g/l混合糖(果糖:葡萄糖=4:1)中的发酵动力学曲线;
图5为野生型菌株c.acetobutylicumatcc824、空载质粒菌株c.acetobutylicumatcc824(pimp1)、fruc基因过表达重组菌株c.acetobutylicumatcc824(pimp1-fruc)在菊芋水解液中的发酵动力学曲线。
具体实施方式
以下结合具体实施例对本发明作进一步详细说明。
以下实施例中所使用的实验方法如无特殊说明,均为常规方法,所用的材料、试剂等,无特殊说明,均可从商业途径获取,活化培养基、种子培养基及发酵培养基应理解为现有技术中任何可实现丙酮丁醇梭菌所适用的常规培养基,菊芋水解液培养基应理解为实际物料培养基,除去菊芋水解液外,其他成分均为常规实验试剂。
实施例1
本实施例包括以下步骤:
(1)fruc基因过表达重组质粒的构建
采用sangonbiotech(上海生工)ezup柱式细菌基因组dna抽提试剂盒(货号:b518255)提取丙酮丁醇梭状芽孢杆菌c.acetobutylicumatcc824(购自美国标准生物品收藏中心)基因组dna,利用引物:pthl-f:gacacctgcagtttttaacaaaatatattga(划线部分为psti酶切位点)和pthl-r:gacacgtcgacttctttcattctaactaacctc(划线部分为sali酶切位点)扩增硫解酶的启动子序列(具体序列见seqidno.3),将pcr扩增的硫解酶启动子dna用psti和sali进行双酶切,与使用psti和sali双酶切后的pimp1质粒[mermelsteinl.d.,welkern.e.,bennettg.n.,papoutsakise.t.expressionofclonedhomologousfermentativegenesinclostridiumacetobutylicumatcc824.naturebiotechnology,1992,10(2):190-5.]载体进行连接,从而构建载体质粒pimp1-pthl;图1为重组质粒pimp1-pthl的结构示意图;利用引物:fruc-f:5’-cgcggatccatgtcaactaaggatatg(划线部分为bamhi酶切位点);fruc-r:5’-cggggtaccttattcgaaaactgttat(划线部分为kpni酶切位点),从基因组dna中进行pcr扩增930bp的fruc基因(具体序列见seqidno.1),pcr产物经bamhi和kpni进行两次酶切,与使用bamhi和kpni进行两次酶切后的pimp1-pthl质粒载体进行连接,从而构建重组质粒pimp1-pthl-fruc;图2为重组表达质粒pimp1-pthl-fruc的结构示意图;
(2)过表达重组质粒的甲基化
将重组质粒转入e.colidh10b(pan1)[mermelstein,l.d.&papoutsakis,e.t.invivomethylationinescherichiacolibythebacillussubtilisphagephi3timethyltransferasetoprotectplasmidsfromrestrictionupontransformationofclostridiumacetobutylicumatcc824.appliedandenvironmentalmicrobiology,1993,59(4),1077-1081.]中进行甲基化,得到甲基化重组质粒pimp1-pthl-fruc;
(3)fruc基因过表达重组菌株的构建
厌氧条件下,取50-100ml梭菌活化培养基(tgy)培养的对数中期(od6201.0左右)的丙酮丁醇梭菌c.acetobutylicumatcc824细胞液,4℃、3000rpm离心10min,去除上清液,加入50ml预冷的电转缓冲液(270mmol/l蔗糖,5mmol/lnah2po4,ph7.4),洗涤两次,并重悬至1.5ml的电转缓冲液中,然后取100μl转入0.4cm的电转杯中,放置冰浴中用于电转化,加入10μl步骤(2)所得甲基化质粒pimp1-pthl-fruc,置于冰浴中2min,采用2000v脉冲电压和25μf的电容进行电转化,随后将电转液加入到梭菌活化培养基tgy中,37℃培养4h,2000~3000rpm离心10min收集菌体细胞,将收集的细胞涂布于含有红霉素抗性的tgy琼脂培养基上,培养36h后,获得含有fruc基因过表达质粒pimp1-pthl-fruc的丙酮丁醇梭菌,命名为丙酮丁醇梭菌c.acetobutylicumatcc824(pimp1-fruc)。
实施例2
重组菌株发酵生产丁醇,本实施例包括以下步骤:
将实施例1中所得重组菌株丙酮丁醇梭菌c.acetobutylicumatcc824(pimp1-fruc)和对照空载质粒菌株c.acetobutylicumatcc824(pimp1)及其出发野生型菌株c.acetobutylicumatcc824分别接种至活化培养基中(含10μg/ml红霉素抗性),置于厌氧环境中静置培养,培养温度为37.5℃,活化培养20h用于种子培养;将活化的菌种按10%(v/v)接种量接种于种子培养基中(含10μg/ml红霉素抗性),置于厌氧环境中摇瓶培养,培养温度为37.5℃,转速为150rpm,培养24~30h用于厌氧发酵培养;采用biotec-3bg-4发酵罐(上海保兴生物设备工程有限公司)进行厌氧发酵,3l发酵罐培养时发酵培养基(含10μg/ml红霉素抗性)装液量为1.1l,发酵温度控制在37~38℃,搅拌转速为150rpm,通过添加稀硫酸或氢氧化钾溶液将接种后发酵培养基初始ph调至5.5,接种前发酵罐通入n2以除去发酵培养基中的溶氧,发酵72~168h,期间定时取样检测溶剂(丙酮、乙醇和丁醇)及糖含量。
本实施例中所涉及培养基分别按照如下方法制备:
活化培养基(g/l):葡萄糖20,胰蛋白胨30,酵母粉10。
种子培养基(g/l):葡萄糖70,乙酸铵3.22,酵母粉2.0,mgso4·7h2o0.2,kh2po40.5,k2hpo40.5,feso4·7h2o0.01,mnso4·7h2o0.01,生物素0.01,对氨基苯甲酸0.01。
发酵培养基(g/l):果糖70,乙酸铵3.22,酵母粉2,mgso4·7h2o0.2,kh2po40.5,k2hpo40.5,feso4·7h2o0.01,mnso4·7h2o0.01,生物素0.01,对氨基苯甲酸0.01。
溶剂(丙酮、乙醇和丁醇)含量测定:发酵样品10000×g离心5min,取上清液,上清液组分浓度采用气相色谱法测定,色谱分离条件:色谱柱:毛细管色谱柱agilenthp-innowax(30m×0.25mm×0.50μm);柱温:100℃;进样口温度:250℃;fid检测器温度:300℃;h2流速:40ml/min;空气流速:400ml/min;载气n2流速:30ml/min;进样量:0.2μl;分流比:50:1;采用内标法进行定量分析,内标物使用异丁醇。
果糖含量测定:发酵样品10000×g离心5min,取上清液,上清液果糖浓度稀释至小于2g/l,采用dns法测定,通过计算得出发酵液中果糖浓度。
图3为野生型菌株c.acetobutylicumatcc824、空载质粒菌株c.acetobutylicumatcc824(pimp1)、fruc基因过表达重组菌株c.acetobutylicumatcc824(pimp1-fruc)在70g/l果糖中的发酵动力学曲线;结果表明空载菌株c.acetobutylicumatcc824(pimp1)生产丁醇3.4g/l,野生型菌株生产丁醇4.5g/l。fruc基因过表达重组菌株c.acetobutylicumatcc824(pimp1-fruc)对果糖的利用率、丁醇产量增加,丁醇产量达到9.6g/l。相比空载对照组菌体,果糖利用率提高约2.8倍,丁醇产量提高了约3.5倍。
发酵结果如下表1所示:
表1重组菌株、对照菌株及野生菌株果糖发酵性能比较
本实施例实验结果表明,本发明将fruc基因在丙酮丁醇梭菌c.acetobutylicumatcc824中过表达能显著提高菌株对果糖的利用率以及丁醇产量。
实施例3
重组菌株发酵生产丁醇,本实施例包括以下步骤:
将实施例1中所得重组菌株丙酮丁醇梭菌c.acetobutylicumatcc824(pimp1-fruc)和对照空载质粒菌株c.acetobutylicumatcc824(pimp1)及其出发野生型菌株c.acetobutylicumatcc824分别接种至活化培养基中(含10μg/ml红霉素抗性),置于厌氧环境中静置培养,培养温度为37.5℃,活化培养20h用于种子培养;将活化的菌种按10%(v/v)接种量接种于种子培养基中(含10μg/ml红霉素抗性),置于厌氧环境中摇瓶培养,培养温度为37.5℃,转速为150rpm,培养24~30h用于厌氧发酵培养;采用biotec-3bg-4发酵罐(上海保兴生物设备工程有限公司)进行厌氧发酵,3l发酵罐培养时发酵培养基(含10μg/ml红霉素抗性)装液量为1.1l,发酵温度控制在37~38℃,搅拌转速为150rpm,通过添加稀硫酸或氢氧化钾溶液将接种后发酵培养基初始ph调至5.5,接种前发酵罐通入n2以除去发酵培养基中的溶氧,发酵72~120h,期间定时取样检测溶剂(丙酮、乙醇和丁醇)及糖含量。
本实施例中所涉及培养基分别按照如下方法制备:
活化培养基(g/l):葡萄糖20,胰蛋白胨30,酵母粉10。
种子培养基(g/l):葡萄糖70,乙酸铵3.22,酵母粉2.0,mgso4·7h2o0.2,kh2po40.5,k2hpo40.5,feso4·7h2o0.01,mnso4·7h2o0.01,生物素0.01,对氨基苯甲酸0.01。
发酵培养基(g/l):混合糖(葡萄糖:果糖=1:4)70,乙酸铵3.22,酵母粉2,mgso4·7h2o0.2,kh2po40.5,k2hpo40.5,feso4·7h2o0.01,mnso4·7h2o0.01,生物素0.01,对氨基苯甲酸0.01。
溶剂(丙酮、乙醇和丁醇)含量测定:发酵样品10000×g离心5min,取上清液,上清液组分浓度采用气相色谱法测定,色谱分离条件:色谱柱:毛细管色谱柱agilenthp-innowax(30m×0.25mm×0.50μm);柱温:100℃;进样口温度:250℃;fid检测器温度:300℃;h2流速:40ml/min;空气流速:400ml/min;载气n2流速:30ml/min;进样量:0.2μl;分流比:50:1;采用内标法进行定量分析,内标物使用异丁醇。
葡萄糖及果糖含量测定:发酵样品10000×g离心5min,取上清液,葡萄糖及果糖浓度采用waters1525高效液相色谱测定。色谱分离条件:色谱柱:有机酸分析柱aminexhpx-87h(300mm×7.8mm;bio-rad,hercules);流动相:5mmol/lh2so4;流速:0.5ml/min;进样量:20μl;柱温:50℃;pda检测器检测波长:210nm。
图4为野生型菌株c.acetobutylicumatcc824、空载质粒菌株c.acetobutylicumatcc824(pimp1)、fruc基因过表达重组菌株c.acetobutylicumatcc824(pimp1-fruc)在70g/l混合糖中的发酵动力学曲线;结果表明野生型c.acetobutylicumatcc824消耗30.6g/l的混合糖,产生5.3g/l丁醇,空载质粒菌株c.acetobutylicumatcc824(pimp1)消耗混合糖45.9g/l,产生丁醇5.6g/l,fruc基因过表达重组菌株c.acetobutylicumatcc824(pimp1-fruc)对果糖的利用率及丁醇产量更高,至发酵结束利用了65.8g/l的混合糖,产生丁醇13.1g/l;相比空载对照组菌体,混合糖利用率提高了接近1.8倍,丁醇产量提高了约2.3倍,丁醇的产率与转化率也分别提高约1.4、1.3倍。
发酵结果如下表2所示:
表2重组菌株、对照菌株及野生菌株混合糖发酵性能比较
本实施例实验结果表明,本发明将fruc基因在丙酮丁醇梭菌c.acetobutylicumatcc824中过表达能显著提高菌株混合糖利用率及丁醇发酵产量。
实施例4
重组菌株发酵生产丁醇,本实施例包括以下步骤:
将实施例1中所得重组菌株丙酮丁醇梭菌c.acetobutylicumatcc824(pimp1-fruc)和对照空载质粒菌株c.acetobutylicumatcc824(pimp1)及其出发野生型菌株c.acetobutylicumatcc824分别接种至活化培养基中(含10μg/ml红霉素抗性),置于厌氧环境中静置培养,培养温度为37.5℃,活化培养20h用于种子培养;将活化的菌种按10%(v/v)接种量接种于种子培养基中(含10μg/ml红霉素抗性),置于厌氧环境中摇瓶培养,培养温度为37.5℃,转速为150rpm,培养24~30h用于厌氧发酵培养;采用biotec-3bg-4发酵罐(上海保兴生物设备工程有限公司)进行厌氧发酵,3l发酵罐培养时发酵培养基(含10μg/ml红霉素抗性)装液量为1.1l,发酵温度控制在37~38℃,搅拌转速为150rpm,通过添加稀硫酸或氢氧化钾溶液将接种后发酵培养基初始ph调至5.5,接种前发酵罐通入n2以除去发酵培养基中的溶氧,发酵80~104h,期间定时取样检测溶剂(丙酮、乙醇和丁醇)及糖含量。
本实施例中所涉及培养基分别按照如下方法制备:
活化培养基(g/l):葡萄糖20,胰蛋白胨30,酵母粉10。
种子培养基(g/l):葡萄糖70,乙酸铵3.22,酵母粉2.0,mgso4·7h2o0.2,kh2po40.5,k2hpo40.5,feso4·7h2o0.01,mnso4·7h2o0.01,生物素0.01,对氨基苯甲酸0.01。
菊芋水解液培养基(g/l):乙酸铵3.22,酵母粉2,mgso4·7h2o0.2,kh2po40.5,k2hpo40.5,feso4·7h2o0.01,mnso4·7h2o0.01,生物素0.01,对氨基苯甲酸0.01;加菊芋水解液(含葡萄糖约15g/l,果糖约60g/l)定容。
溶剂(丙酮、乙醇和丁醇)含量测定:发酵样品10000×g离心5min,取上清液,上清液组分浓度采用气相色谱法测定,色谱分离条件:色谱柱:毛细管色谱柱agilenthp-innowax(30m×0.25mm×0.50μm);柱温:100℃;进样口温度:250℃;fid检测器温度:300℃;h2流速:40ml/min;空气流速:400ml/min;载气n2流速:30ml/min;进样量:0.2μl;分流比:50:1;采用内标法进行定量分析,内标物使用异丁醇。
葡萄糖及果糖含量测定:发酵样品10000×g离心5min,取上清液,葡萄糖及果糖浓度采用waters1525高效液相色谱测定。色谱分离条件:色谱柱:有机酸分析柱aminexhpx-87h(300mm×7.8mm;bio-rad,hercules);流动相:5mmol/lh2so4;流速:0.5ml/min;进样量:20μl;柱温:50℃;pda检测器检测波长:210nm。
图5为野生型菌株c.acetobutylicumatcc824、空载质粒菌株c.acetobutylicumatcc824(pimp1)、fruc基因过表达重组菌株c.acetobutylicumatcc824(pimp1-fruc)在菊芋水解液(葡萄糖约15g/l,果糖约60g/l)中的发酵动力学曲线;结果表明野生型c.acetobutylicumatcc824利用糖34.7g/l,生产丁醇5.0g/l,空载质粒菌株c.acetobutylicumatcc824(pimp1)利用糖35.1g/l,生产丁醇5.4g/l。fruc基因过表达重组菌株c.acetobutylicumatcc824(pimp1-fruc)对菊芋水解液中糖的利用率以及丁醇产量均有较高提升。发酵终止,过表达重组菌株c.acetobutylicumatcc824(pimp1-fruc)利用了50.1g/l糖,产生7.7g/l的丁醇;相比空载对照组菌体,糖利用率提高了约1.4倍,丁醇产量提高了1.4倍以上,丁醇的产率提高约1.4倍。
发酵结果如下表3所示:
表3重组菌株、对照菌株及野生菌菊芋水解液发酵性能比较
本实施例实验结果表明,本发明将fruc基因在丙酮丁醇梭菌c.acetobutylicumatcc824中过表达能显著提高菌株对菊芋水解液中糖的利用率及丁醇发酵产量。
序列表
<110>大连理工大学
<120>一种fruc基因过表达的重组梭菌、其构建方法及应用
<130>2011
<160>3
<170>patentinversion3.3
<210>1
<211>444
<212>dna
<213>fruc基因的核苷酸序列
<400>1
atgtcaactaaggatatgttttcaaaagaaagggtcacatttaatcttaaagctaaaact60
aaggaagaagccataaatgagcttatagaaattttatataatgacggaaaggttactgat120
aaggaagaattaaaaagagctgtattaaaaagagaagaggaattctctactggtataggt180
atgggaatagctattccgcatggtaaatgtagtgcagttaaagaggctgctataacattt240
ggattaagcaaagagggaatagactatcagtcaatggatgataaaccagcgcatttattc300
tttttaatagctgttccagaagaatctagtgacatacatcttaaggctttaagtgaaata360
tcaagaaaacttatgcatacagaagtaagagaaaaaataaagaatgcccaaagttttgaa420
gagtttataacagttttcgaataa444
<210>2
<211>147
<212>protein
<213>fruc基因编码的蛋白质fruc的氨基酸序列
<400>2
mstkdmfskervtfnlkaktkeeainelieilyndgkvtdkeelkravlkreeefstgig60
mgiaiphgkcsavkeaaitfglskegidyqsmddkpahlffliavpeessdihlkalsei120
srklmhtevrekiknaqsfeefitvfe147
<210>3
<211>153
<212>dna
<213>硫解酶的启动子基因的核苷酸序列
<400>3
tttttaacaaaatatattgataaaaataataatagtgggtataattaagttgttagagaa60
aacgtataaattagggataaactatggaacttatgaaatagattgaaatggtttatctgt120
taccccgtatcaaaatttaggaggttagttaga153
- 还没有人留言评论。精彩留言会获得点赞!