一种白藜芦醇的组合生物合成方法与流程
本发明属于生物工程领域,特别涉及一种白藜芦醇的组合生物合成方法。
背景技术:
白藜芦醇的化学名为(E)-5-[2-(4-羟苯基)-乙烯基]-1,3-苯二酚,英文名为Resveratrol,属非黄酮类多酚化合物中的一种,分子式为C14H12,相对分子质量为228.25,作为植物抗逆物质被首次发现于葡萄树中。随着各国学者对白藜芦醇药理学的深入研究,白藜芦醇的反式异构体被指出具有延缓衰老、保护心血管和减少脂质积累等多种与改善人类健康有关的生物活性。也正因此,反式结构的白藜芦醇被开发应用在保健食品、护肤化妆品及辅助药品等领域中。市场需求的日益增大,使人们开始关注白藜芦醇的生产问题。目前,白藜芦醇的获取主要通过从植物虎杖或葡萄的组织中进行分离提取。然而,白藜芦醇在植物中的含量非常低下,传统的获取方式在提倡环境友好型社会发展的当今有着诸多的弊端。其次,植物中的多种白藜芦醇类似物难以通过低成本和无公害的方式进行去除。虽然,活性物质的分离纯化技术在国内外的科学研究推动下不断地进步,但是环境破坏的问题仍然未能有效解决。因此,合成白藜芦醇的研究方向慢慢转移到了有机化学合成和生物技术合成上。化学合成现今面临反应时间长,高能耗、毒副产品及环境污染等难题未能解决。而生物技术合成方面主要利用重组微生物工程菌株的发酵来实现,微生物菌株能简便地从实验室到工业化的大规模生产,且具有生产周期短、培养成本低、产物提纯简便和环境污染少等优势,相比起来,具有更广阔的应用前景。
近年来,利用基因工程技术改造大肠杆菌,使其合成白藜芦醇的研究已有所报道,合成策略主要分为两种。第一种为构建携带一个或两个载体共表达对香豆酰辅酶A连接酶(4CL,EC 6.2.1.12)和白藜芦醇合酶(RS,EC 2.3.1.95)编码基因的工程菌株,外源添加前体物对香豆酸,发酵培养生产白藜芦醇。第二种为构建携带一个或两个载体共表达酪氨酸解氨酶(TAL,EC 4.3.1.23)、4CL和RS编码基因的工程菌株,外源添加前体物L-酪氨酸或不添加任何底物,发酵培养生产白藜芦醇。
根据上述关于白藜芦醇在国内外的研究状况,对本发明的必要性作其总结。
其一,反式白藜芦醇因其特殊的化学结构而具备多种的生物活性,是一种高价值和功效强的天然产物,在食品医药和化妆品等工业领域有着十分庞大的需求量。
其二,国内的白藜芦醇的保健品市场已落后于美国及欧美国家,在白藜芦醇的制备技术上,国内仍以牺牲自然植物资源为代价进行生产,不利于国家长远的发展。合成生物学在天然产物的生产应用所带来的价值是十分巨大的,未来的活性物质合成方式必将转移到合成生物工程上来。
其三,白藜芦醇等芪类物质的微生物制备仍处在起步阶段,有许多问题有待解决,能完善和优化出一套白藜芦醇的合成制备体系,定将对白藜芦醇的产业有重要的推动作用。
技术实现要素:
为了克服现有技术的缺点与不足,本发明的目的在于提供一种白藜芦醇的组合生物合成方法。
本发明立足于白藜芦醇微生物制备的现存问题,提出以下几个拟解决的科学问题和相应的解决策略。
其一,有毒诱导物的使用,大肠杆菌体内蛋白表达系统较为成熟,如Invitrogen公司的pET系统,该系统基本使用毒物异丙基硫代半乳糖苷(IPTG)进行蛋白诱导,而现阶段大多数代谢工程的研究仍沿用此套系统。为此,本发明提供一种不需诱导物且高效的组成型表达系统来解决此问题。
其二,表达元件缺乏标准化,原核表达元件包括了启动子、终止子、核糖体结合序列、载体复制区域和宿主等元件的组装,至今未有标准化的商业系统。为此,本发明经不同元件的组装测试后,给出最佳的可应用于白藜芦醇合成的表达元件组合来解决此问题。
其三,昂贵前体物的使用。现阶段,在重组大肠杆菌中,产量最高的白藜芦醇生产方式是通过外源添加前体物对香豆酸而实现的。对香豆酸大多来源于石油化学工业,对食品和药品领域而言并不合适,而且对香豆酸价格相对昂贵,大大增加了白藜芦醇合成成本。为此,本发明给出分步发酵的合成方式,先让工程菌生产大量的对香豆酸,再以此物作为添加物继续白藜芦醇的发酵生产,从而解决此问题。
本发明的目的通过下述技术方案实现:
一种白藜芦醇的组合生物合成方法,包括如下步骤:
(1)构建含有表达框1的表达载体,并将其转入宿主菌A中,得到工程菌A;所述的表达框1为组成型启动子+RBS+酪氨酸解氨酶编码基因+终止子;
(2)对工程菌A进行发酵,并从发酵产物中分离纯化,得到对香豆酸提取物;
(3)构建含有表达框2和表达框3且表达方向相反的表达载体,并将其转入宿主菌B中,制备工程菌B;所述的表达框2为组成型启动子+RBS+对香豆酰辅酶A连接酶编码基因+终止子;所述的表达框3为组成型启动子+RBS+白藜芦醇合酶编码基因+终止子;
(4)用含有步骤(2)的对香豆酸提取物的培养基对工程菌B进行发酵,并从发酵产物中分离纯化,得到白藜芦醇。
步骤(1)中所述的表达载体是拷贝数为15~20的表达载体,优选为pQE-30;
所述的宿主菌A为高产L-酪氨酸的大肠杆菌,优选为E.coli ATCC31884;
所述的酪氨酸解氨酶编码基因是来源于粘红酵母(Rhodotorula glutinis)的酪氨酸解氨酶(Tyrosine ammonia-lyase,TAL)编码基因,Genebank登录号为KF770992;
步骤(3)中所述的表达载体是拷贝数为15~20的表达载体,优选为pQE-30;
所述的宿主菌B为K12系列大肠杆菌,优选为E.coli DH5α、E.coli BL21(DE3)、E.coli MG1665、E.coli MC1061或E.coli M15;
所述的E.coli BL21(DE3)、E.coli MG1665、E.coli MC1061或E.coli M15均为市售菌株。
所述的对香豆酰辅酶A连接酶编码基因为来源于拟南芥(Arabidopsis thaliana)的对香豆酰辅酶A连接酶(p-Coumaroyl CoA ligase,4CL)编码基因,Genebank登录号为NM_104046.2;
所述的白藜芦醇合酶编码基因为来源于葡萄(Vitis vinifera)的白藜芦醇合酶(Resveratrol synthase,RS)编码基因,Genebank登录号为KC417319.1;
所述的组成型启动子的序列为:
5′-GTCGCGTAATGCTTAGGCACAGGATTGATTTGTCGCAATGATTGACACGATTCCGCTTGACGCTGCGTAAGGTTTTTGTAATTTTACAGGCAACCTTTTATTCACTA-3′。
所述的RBS的序列为:5′-GAAGGAGATATACAT-3′。
所述的终止子的序列为:
5′-AGGCATCAAATAAAACGAAAGGCTCAGTCGAAAGACTGGGCCTTT CGTTTTAT-3′。
所述的含有步骤(2)的对香豆酸提取物的培养基中对香豆酸的浓度大约为80~100mg/L;优选为82mg/L。
本发明的机理是:首先,分别构建两大生产模块。第一生产模块中重组大肠杆菌能利用已构建好的组成型表达系统表达酪氨酸解氨酶,并从头合成对香豆酸。第二生产模块中重组大肠杆菌能利用已构建好的组成型表达系统表达对香豆酰辅酶A连接酶和白藜芦醇合酶,利用第一模块生产的对香豆酸,合成白藜芦醇。
本发明相对于现有技术,具有如下的优点及效果:
分步培养的好处是两个生产模块能单独进行调节,理论上更有利于使各模块达到其最大的产值。从头合成白藜芦醇降低了生产成本,更有利于工业生产。
附图说明
图1是构建的表达载体pA的结构示意图。
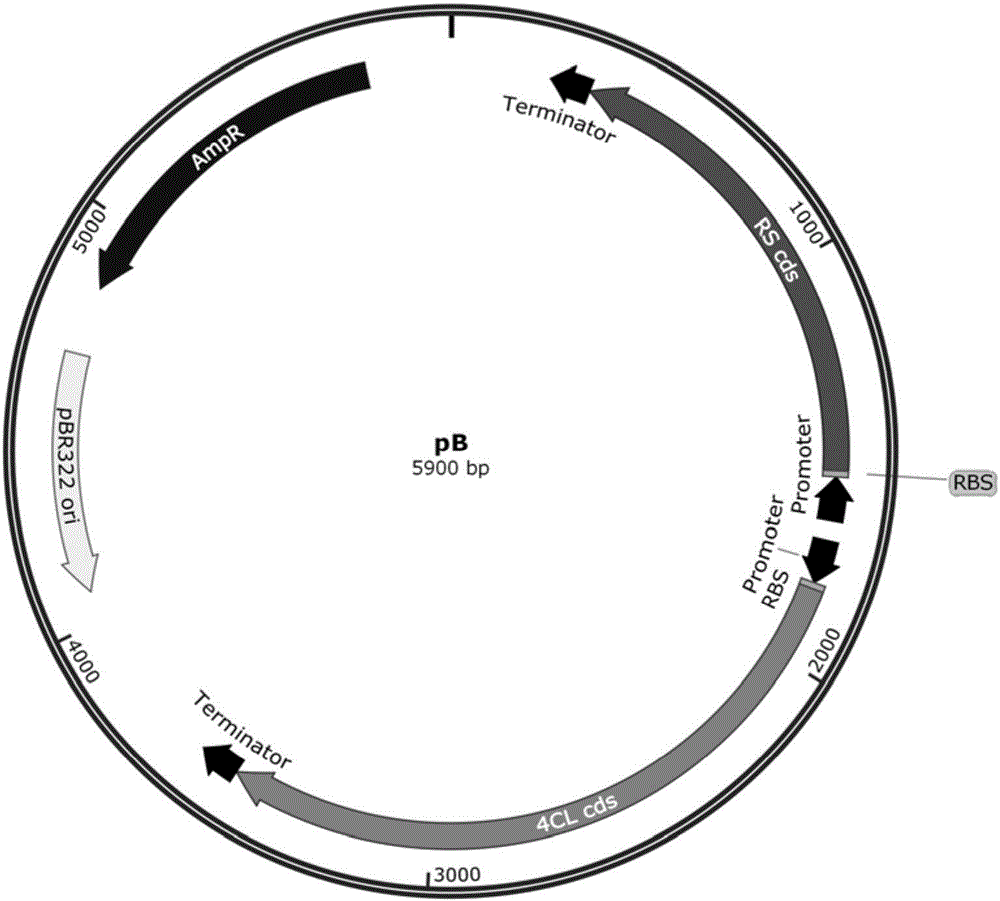
图2是构建的表达载体pB的结构示意图。
图3是白藜芦醇组合生物合成策略。
图4是HPLC测定对香豆酸标准品。
图5是HPLC测定白藜芦醇标准品。
图6是HPLC测定发酵液中白藜芦醇生产量和对香豆酸残余量。
具体实施方式
下面结合实施例及附图对本发明作进一步详细的描述,但本发明的实施方式不限于此。
下列实施例中未注明具体条件的实验方法,通常按照常规条件。
本发明的白藜芦醇组合生物合成策略如图3所示。
实施例1
1、构建表达载体pQE-30-启动子-RBS-TAL编码基因-终止子,简称pA,如图1所示;并将其转入宿主菌A(E.coli ATCC31884,购自美国菌种保藏中心,https://www.atcc.org/Products/All/31884.aspx)中,得到工程菌A;其中,载体pQE-30购自QIAGEN公司;所述的TAL编码基因的Genebank登录号为KF770992。
所述的启动子的序列为:
5′-GTCGCGTAATGCTTAGGCACAGGATTGATTTGTCGCAATGATTGACACGATTCCGCTTGACGCTGCGTAAGGTTTTTGTAATTTTACAGGCAACCTTTTATTCACTA-3′。
所述的RBS的序列为:5′-GAAGGAGATATACAT-3′。
所述的终止子的序列为:
5′-AGGCATCAAATAAAACGAAAGGCTCAGTCGAAAGACTGGGCCTTTCGTTTTAT-3′。
2、挑取工程菌A单菌落至装有100mL YM9培养液(1L YM9配方:17.1g Na2HPO4·12H2O,3g KH2PO4,0.5g NaCl,1g NH4Cl,10g酵母提取物,50mL甘油,42g Morpholinepropanesulfonic acid(MOPS,3-吗啉丙磺酸),pH 7.0)的250mL三角瓶中,并加入终浓度为100μg/mL的氨苄青霉素在37℃,200r/min摇床培养12h。
3、把工程菌A的预培养液离心收集菌体后,加入到装有100mL YM9培养液的500mL三角瓶中,并加入终浓度为100μg/mL的氨苄青霉素,发酵培养12h,所有样品用2倍体积的乙酸乙酯抽提30min,12000r/min离心8min,取上层液体,用旋转蒸发仪把乙酸乙酯去除后,用2mL 1mmol/L Tris-HCl溶解浓缩物,即对香豆酸提取物。
4、构建含有表达框2和表达框3且表达方向相反的表达载体,简称pB,如图2所示;并将转入宿主菌B(E.coli DH5α,购自Novagen公司)中,制备工程菌B;所述的表达框2为启动子+RBS+4CL编码基因+终止子;所述的表达框3为启动子+RBS+RS编码基因+终止子;其中,所述的表达载体为pQE-30;所述的4CL编码基因的Genebank登录号为NM_104046.2;所述的RS编码基因的Genebank登录号为KC417319.1。
所述的启动子、RBS、终止子的序列同步骤1。
5、挑取工程菌B单菌落至装有100mL YM9培养液的250mL三角瓶中,并加入终浓度为100μg/mL的氨苄青霉素在37℃,200r/min摇床培养12h。
6、把工程菌B的预培养液离心收集菌体后加入到装有100mL YM9培养液的500mL三角瓶中,并加入终浓度为100μg/mL的氨苄青霉素和步骤2的对香豆酸提取物(对香豆酸的浓度大约为82mg/L),发酵培养24h,发酵液用2倍体积的乙酸乙酯抽提30min,12000r/min离心8min,取上层液体,用旋转蒸发仪把乙酸乙酯去除后,用2mL甲醇溶解浓缩物。
7、采用高效液相色谱法同时测定样品中对香豆酸和白藜芦醇的含量,色谱条件如下:C18反相柱(5μm,250mm×4.6mm),检测波长为306nm;流速:1mL/min;柱温:室温;进样量:20μL;流动相:乙腈:水(30:60)。制作此HPLC条件下,对香豆酸和白藜芦醇的标准曲线。以色谱峰面积对质量浓度作图,得工作标准曲线,白藜芦醇标准品的线性回归方程为Y=8.94×X-6-1.282,相关系数R2=0.9986。其中Y为白藜芦醇标准品浓度,单位为mg/L;X为峰面积,单位为μAU*s(图5)。对香豆酸标准品的线性回归方程为Y=6.8×X-6+0.035,相关系数R2=0.9997。其中Y为对香豆酸标准品浓度,单位为mg/L;X为峰面积,单位为μAU*s(图4)。菌体生长情况检测使用紫外分光光度计,检测波长为600nm,以YM9培养液作为空白。
8、结果如图6所示,最终测得甲醇浓缩物中白藜芦醇的含量为60.35±3.54mg/L,对香豆酸剩余量为23.77±2.45mg/L,菌体浓度OD600为6.35±0.14,共耗时48h。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!