一种采用毕赤酵母制备白藜芦醇二聚体的方法与流程
本发明涉及基因工程和微生物发酵技术领域,特别涉及一种采用毕赤酵母制备白藜芦醇二聚体提取物的方法。
背景技术:
白藜芦醇二聚体(viniferins)是白藜芦醇被4-羟基芪过氧化物酶(4-trihydroxy-trans-stilbene)氧化所形成的;是植物在恶劣环境中或遭到病原体侵染时所分泌的植物抗毒素;比白藜芦醇具有更强的抗氧化性能,能够有效清除和抑制自由基的产生,同时还能抑制脂质过氧化和DNA损失;可改善血小板的活性达到舒缓过敏症状和抗炎的作用。
白藜芦醇二聚体存在于葡萄叶表皮、浆果果皮和葡萄籽中,含量极低。虽然采取如紫外线照射、真菌感染、机械损伤等方法会刺激白藜芦醇二聚体的合成,但效果不佳。当前对白藜芦醇二聚体的制备方法主要是化学全合成法,有研究应用1,1-二苯基-2-三硝基苯肼(DPPH)处理白藜芦醇,合成白藜芦醇二聚体,产量为15%,缺点是合成产率低,应用大量强刺激性、有毒的DPPH,危险性高、环境负荷重;有研究应用FeCl3处理白藜芦醇,得到白藜芦醇二聚体,产量为2.7%,缺点是重金属富集,难以直接应用;有研究应用白藜芦醇化学氧化聚合产生白藜芦醇二聚体,缺点是工艺复杂,副产物多,且反应方向不可控。
目前国内外尚未有应用毕赤酵母制备白藜芦醇二聚体的方法,也未有应用毕赤酵母表达4-羟基芪过氧化物酶蛋白的相关报道。
技术实现要素:
本发明的目的在于提供一种采用毕赤酵母制备白藜芦醇二聚体的方法,以解决当前白藜芦醇二聚体产量低、工艺复杂、反应方向不可控、环境负荷重的问题。
为解决上述技术问题,本发明采用以下技术方案:一种采用毕赤酵母制备白藜芦醇二聚体的方法,其特征在于包括如下步骤:
1)含4-羟基芪过氧化物酶基因的pPU19质粒载体的构建:分别应用限制性内切酶EcoP1和EcoP15酶切4-羟基芪过氧化物酶基因片段和pPU19质粒,得到酶切后的4-羟基芪过氧化物酶基因片段4TTS(+)和pPU19质粒基因片段pPU19(+);采用T4连接酶将上述酶切产物进行连接,得到重组质粒pPU19-4TTS,然后通过PCR技术扩增以pPU19质粒DNA为PCR扩增模板的4-羟基芪过氧化物酶基因,得PCR扩增后的重组质粒表达载体pPU19-4TTS;所述4-羟基芪过氧化物酶基因片段4TTS(+)的基因序列为:
GAAGAGCTGTCGACAGTCGCATGCCAGCTAAATTAAGAAAACCTTCACTTGCTTCAAGTAAAGCATGTCGATCCTTCAACGAATTCTATATCACTTGGATGGAAAACTAAGTGTTCAGTATTTCACAGGTGACAAACCAGACAAGAAGCGTACATTCATTTGACCGAAGAAGCTTGAGGAGCACCCAAACATGGTGCTTATATGGCTCCATCTCTTAACACGCCAAGAGATCAC;
2)通过热激法将PCR扩增后的重组质粒表达载体pPU19-4TTS转入保藏编号为638632的Komagataella pastoris DSMZ 70382毕赤酵母菌株中,获得表达4-羟基芪过氧化物酶的毕赤酵母,命名为Pichia pastoris\pPU19\4TTS,其核苷酸序列:
TCGCTGGTAATCCCGGCTTTTGCTGCTTACAAGCTTTACGGATTATTTCTAGGAGGTAGNCAATTATTGGGTGGTCGCAGCAGTTTCAAAGAGGAGGAGCCAGCTTCTGGGTCAAAAGAAAAGGGACAGAGCAAGAGACAACAGAAACTAGAAAAGAGAGGACAAAAGGTGAGATACAGATAGAATCTTTGCGAGTGAACCAAGGTAGCTGAAAAACATAACTTGCAAGGATGCTATTGGACAATTTTAGGTGATAAACTCGATTGCTATCACTGGGCTCTGCCACATGGAAGCTTTAGTGAGAAGAGCTGTCGACAGTCGCATGCCAGCTAAATTAAGAAAACCTTCACTTGCTTCAAGTAAAGCATGTCGATCCTTCAACGAATTCTATATCACTTGGATGGAAAACTAAGTGTTCAGTATTTCACAGGTGACAAACCAGACAAGAAGCGTACATTCATTTGACCGAAGAAGCTTGAGGAGCACCCAAACATGGTGCTTATATGGCTCCATCTCTTAACACGCCAAGAGATCACAGCTCTTGCGCACTATTCGAGTCGTTTACTTTTTTTTTGGTTTTTGCTAGGCCTTCCATTACTTCTTTACTTCGTTAGTGACAAGTGACTTAAGGCCAATGTATTCTTGAATCAAAAGAAGGCTGTGTCAATTCCTAAGCCCTACTAGCTCTACTTTCGGAGTGACCTACCGATAAGTTCGCATACGCGAATCTGGACCATTTTTATAATACCAAGTAGAAATTCAATAGCCATCTAGCTGTTTCTACATGATGACAGCCCATAACCATAAAGAAAACTGCAAACGATTGCTGAGCTTGTAGAGCGTCCAGTAAGTAGCGCAATCTCCAGTGAGCAACGTAATATCATATTTTCTTCTCTCTCTTTCATTCTCCTCCGAGAATTACAGAAGCATCATAGTAGTGTACCCACCAATGGTTGTGAGCGACTGCGCGATTCCATGGATGCTACTGAAACCAATGAATGAAACTTGTCAAGTTTCCTCGCTTCCTTTTACATAACGGATCTTTTAACTTAGAAACAGTTTAGTAAAAGAAATTCATCAATACAATGGACGGAGGTAAGTCAGCTCTTTCAGCAAGGGAGCATGGAATCAGATTGGCAACGACTTCTGCGATTCTTATTCTTCCGATTGATTCAACAGTAGATTTGCGAGTGGTTGGCCAAACACACAGTTTCGATGCGATCTCCGTTTGATTTGTATGAATACGCAGTCATCTCATTGGTGGAGCATTTTATACGGATTGATTGAGTGGAAGCATGGTACTGAGAGTATCTACATGTGCATTTCTGTTGGTTGTCCTCGGTTGAGTTTTCGTATCTGTTTGTCCCCCCAATTTTGTCCACTCCTTTTGGCAATCTGCCGAATCCAAGCTCATAATACTAACTCCCATTTTAGAAGACGTTGCAGCAGTAAGTACCCTTACATGTAATCCATGAAAGCAAATGTGGCGCAGTCAATCGAAGTCACTGTCTGATTGATTCTTCCCTCAGTGGCGGT;
3)对步骤(2)得到的Pichia pastoris\pPU19\4TTS菌株通过划线和继代培养,经初筛、复筛,进行液培发酵,选取代谢产物含量高或是活性高的菌液划线于固体筛选培养基上,分离纯化,得到复筛菌种;
4)制备含白藜芦醇二聚体的发酵产物:配置含有15-20g/L的白藜芦醇的LB发酵培养基,从平板上挑取Pichia pastoris\pPU19\4TTS单菌落于LB培养基的摇瓶中,发酵,得到含白藜芦醇二聚体的发酵产物;
5)白藜芦醇二聚体的分离:将步骤(4)所述含白藜芦醇二聚体的发酵产物液体经树脂纯化,得固型物即为白藜芦醇二聚体提取物。
进一步地,步骤(3)中液培发酵的条件为:发酵温度37℃,振荡速度160r/min,pH为7,发酵时间24h。
步骤(4)中摇瓶发酵的条件为:温度为31-35℃,振荡速度180-220r/min,起始pH控制在6-8,发酵时间控制在32-40h。
步骤(5)中白藜芦醇二聚体的分离方法具体为:将步骤4)所述含白藜芦醇二聚体的发酵产物液体经H103型大孔树脂富集纯化,柱内径4mm,高度1m,装柱体积为2L,上样液的质量浓度为0.7-0.8mg/mL,上样流速为2-4BV/h,先用3-5倍柱体积的蒸馏水洗涤,然后用8BV 75%的乙醇水溶液洗脱,回收乙醇水溶液洗出液,使用旋转蒸发仪去除乙醇,得固型物即为白藜芦醇二聚体提取物。
本发明保藏号为638632的Komagataella pastoris DSMZ 70382毕赤酵母菌株保藏于NCBI(美国国立生物技术信息中心)。4-羟基芪过氧化物酶购于上海信裕生物科技有限公司;pPU19质粒购于澳大利亚pCambia公司;限制性内切酶EcoP1和EcoP15酶购于上海斯泰尔生物科技有限公司;T4连接酶购于Thermo Fisher Scientific;液培发酵设备购于南京润泽生物工程设备有限公司,型号RZY-XGX;固体筛选培养基购于上海哈灵生物科技有限公司;LB培养基购于Sigma Aldrich;白藜芦醇购买于帝斯曼(中国)有限公司;H103型大孔树脂购于天津浩聚树脂;旋转蒸发仪为德国艾卡RV10型旋转蒸发仪。
本发明首次在毕赤酵母表达系统中分泌表达了4-羟基芪过氧化物酶,成功将影响白藜芦醇二聚体生成的4-羟基芪过氧化物酶导入Komagataella pastoris DSMZ 70382毕赤酵母,获得能够表达4-羟基芪过氧化物酶的重组毕赤酵母。
本发明首次应用毕赤酵母,通过基因工程法将能够产生白藜芦醇二聚体的关键性4-羟基芪过氧化物酶基因导入毕赤酵母,筛选获得一种高通量表达4-羟基芪过氧化物酶毕赤酵母菌种。选择毕赤酵母是因为毕赤酵母基因表达系统为真核表达系统,且具有调控机理严格的醇氧化酶AOX基因启动子;表达水平高,即可在胞内表达,又可以进行分泌型表达;且发酵工艺成熟,易工业化生产;培养成本低,产物容易分离;外援蛋白基因遗传稳定,不易丢失。微生物发酵法制备白藜芦醇二聚体,选用的方法绿色环保、不受气候影响、成本低、产物可控,且适宜工业化生产。
经本发明方法分离得到的白藜芦醇二聚体纯度为45-60%,其中白藜芦醇转化白藜芦醇二聚体的转化率为35%-45%。远远高于当前文献报道值,且操作工艺简单,选用的方法绿色环保、不受气候影响、成本低、产物可控,且适宜工业化生产。
附图说明
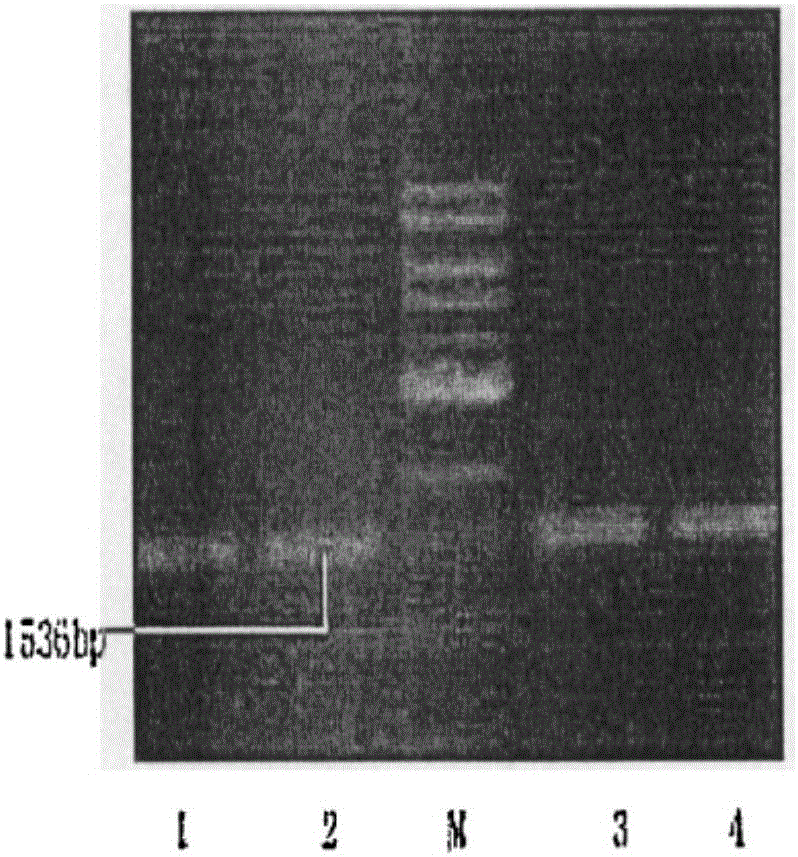
图1为表达4-羟基芪过氧化物酶基因的毕赤酵母的琼脂糖电泳检测结果图。
图2为表达4-羟基芪过氧化物酶基因的毕赤酵母的核苷酸序列。
具体实施例
以下结合实施例1~5对本发明公开的技术方案作进一步的说明:
实施例1:
采用毕赤酵母制备白藜芦醇二聚体提取物的方法,包括以下步骤:
1)在灭菌的离心管内加入1g 4-羟基芪过氧化物酶基因、2g pPU19质粒基因、0.3mL限制性酶缓冲液、10U限制性内切酶EcoP1和10U EcoP15和100mL纯水,在30℃下进行温浴10min,经旋涡震荡10s,在12000r/min的转速下,离心2min,过滤,得到含酶切后的4-羟基芪过氧化物酶基因片段4TTS(+)和pPU19质粒基因片段pPU19(+)的混合液。其中4-羟基芪过氧化物酶基因片段4TTS(+)的基因序列为:
GAAGAGCTGTCGACAGTCGCATGCCAGCTAAATTAAGAAAACCTTCACTTGCTTCAAGTAAAGCATGTCGATCCTTCAACGAATTCTATATCACTTGGATGGAAAACTAAGTGTTCAGTATTTCACAGGTGACAAACCAGACAAGAAGCGTACATTCATTTGACCGAAGAAGCTTGAGGAGCACCCAAACATGGTGCTTATATGGCTCCATCTCTTAACACGCCAAGAGATCAC。
2)在灭菌的离心管内,加入5μL的步骤1)得到的含4-羟基芪过氧化物酶基因片段4TTS(+)和pPU19质粒基因片段pPU19(+)的混合液、0.5μL的T4连接酶、1μL连接酶缓冲液、5μL的ddH2O,然后经漩涡振荡1min,在12000r/min的转速下,离心15s后,置于16℃水中保温过夜,即得含4-羟基芪过氧化物酶基因的pPU19质粒载体,可置于4℃的冰箱中备用。
3)通过PCR技术对重组后的质粒载体进行扩增,于95℃预变性5min,1个循环;94℃变性40s,57℃复性40s,35个循环;72℃延伸2min,72℃最后延伸10min,即得到扩增后的含4-羟基芪过氧化物酶基因的pPU19质粒载体;
4)将重组表达载体pPU19-4TTS用热激法转入Komagataella pastoris DSMZ 70382毕赤酵母感受态细胞内,通过琼脂糖电泳检测结果如图1所示,核苷酸序列如图2,在DNA分子量标准的306bp处检测出4-羟基芪过氧化物酶基因,酶切产物的目的条带为234bp,符合酶切4-羟基芪过氧化物酶基因的碱基数,证明重组Komagataella pastoris DSMZ 70382毕赤酵母成功表达4-羟基芪过氧化物酶基因,将其命名为Pichia pastoris\pPU19\4TTS;
5)从平板上挑取Pichia pastoris\pPU19\4TTS单菌落于装有LB培养基的摇瓶中,培养基成分为蛋白胨1g/L、酵母膏1.5g/L、蔗糖6g/L、MgSO4 0.3g/L、CaCl2 0.2g/L、K2HPO40.2g/L、白藜芦醇15g/L,控制温度为31℃,振荡速度180r/min,起始pH控制在6,发酵时间控制在32h,得到含白藜芦醇二聚体的发酵产物;
6)将白藜芦醇二聚体的发酵产物液体经H103型大孔树脂富集纯化,柱内径4mm,高度1m,装柱体积为2L,上样液的质量浓度为0.7mg/mL,上样流速为2BV/h,先用3倍柱体积的蒸馏水洗涤,然后用8BV 75%的乙醇水溶液洗脱,回收乙醇水溶液。使用旋转蒸发仪祛除乙醇,所得固形物即为白藜芦醇二聚体提取物,经HPLC测试,其纯度为45%,其中白藜芦醇转化白藜芦醇二聚体的转化率为35%。
实施例2:
采用毕赤酵母制备白藜芦醇二聚体提取物的方法,包括以下步骤:
1)在灭菌的离心管内加入1g 4-羟基芪过氧化物酶基因、2g pPU19质粒基因、0.3mL限制性酶缓冲液、10U限制性内切酶EcoP1和10U EcoP15和100mL纯水,在32℃下进行温浴13min,经旋涡震荡12s,在12000r/min的转速下,离心2min,过滤,得到含酶切后的4-羟基芪过氧化物酶基因片段4TTS(+)和pPU19质粒基因片段pPU19(+)的混合液。其中4-羟基芪过氧化物酶基因片段4TTS(+)的基因序列为:
GAAGAGCTGTCGACAGTCGCATGCCAGCTAAATTAAGAAAACCTTCACTTGCTTCAAGTAAAGCATGTCGATCCTTCAACGAATTCTATATCACTTGGATGGAAAACTAAGTGTTCAGTATTTCACAGGTGACAAACCAGACAAGAAGCGTACATTCATTTGACCGAAGAAGCTTGAGGAGCACCCAAACATGGTGCTTATATGGCTCCATCTCTTAACACGCCAAGAGATCAC。
2)在灭菌的离心管内,加入5μL的步骤1)得到的含4-羟基芪过氧化物酶基因片段4TTS(+)和pPU19质粒基因片段pPU19(+)的混合液、0.5μL的T4连接酶、1μL连接酶缓冲液、5μL的ddH2O,然后经漩涡振荡1.3min,在12000r/min的转速下,离心12s后,置于16℃水中保温过夜,即得含4-羟基芪过氧化物酶基因的pPU19质粒载体,可置于4℃的冰箱中备用。
3)通过PCR技术对重组后的质粒载体进行扩增,于95℃预变性5min,1个循环;94℃变性40s,57℃复性40s,35个循环;72℃延伸2min,72℃最后延伸10min,即得到扩增后的含4-羟基芪过氧化物酶基因的pPU19质粒载体;
4)将重组表达载体pPU19-4TTS用热激法转入Komagataella pastoris DSMZ 70382毕赤酵母感受态细胞内,获得表达4-羟基芪过氧化物酶基因的Komagataella pastoris DSMZ 70382毕赤酵母,命名为Pichia pastoris\pPU19\4TTS;
5)从平板上挑取Pichia pastoris\pPU19\4TTS单菌落于装有LB培养基的摇瓶中,培养基成分为蛋白胨2g/L、酵母膏1.5g/L、蔗糖6.5g/L、MgSO4 0.4g/L、CaCl2 0.25g/L、K2HPO4 0.3g/L、白藜芦醇16g/L,控制温度为32℃,振荡速度190r/min,起始pH控制在6.5,发酵时间控制在33h,得到含白藜芦醇二聚体的发酵产物;
6)将白藜芦醇二聚体的发酵产物液体经H103型大孔树脂富集纯化,柱内径4mm,高度1m,装柱体积为2L,上样液的质量浓度为0.75mg/mL,上样流速为2.5BV/h,先用3倍柱体积的蒸馏水洗涤,然后用8BV 75%的乙醇水溶液洗脱,回收乙醇水溶液。使用旋转蒸发仪祛除乙醇,所得固形物即为白藜芦醇二聚体提取物,经HPLC测试,其纯度为50%,其中白藜芦醇转化白藜芦醇二聚体的转化率为38%。
实施例3:
采用毕赤酵母制备白藜芦醇二聚体提取物的方法,包括以下步骤:
1)在灭菌的离心管内加入1g 4-羟基芪过氧化物酶基因、2g pPU19质粒基因、0.3mL限制性酶缓冲液、10U限制性内切酶EcoP1和10U EcoP15和100mL纯水,在33℃下进行温浴15min,经旋涡震荡14s,在13000r/min的转速下,离心3min,过滤,得到含酶切后的4-羟基芪过氧化物酶基因片段4TTS(+)和pPU19质粒基因片段pPU19(+)的混合液。其中4-羟基芪过氧化物酶基因片段4TTS(+)的基因序列为:
GAAGAGCTGTCGACAGTCGCATGCCAGCTAAATTAAGAAAACCTTCACTTGCTTCAAGTAAAGCATGTCGATCCTTCAACGAATTCTATATCACTTGGATGGAAAACTAAGTGTTCAGTATTTCACAGGTGACAAACCAGACAAGAAGCGTACATTCATTTGACCGAAGAAGCTTGAGGAGCACCCAAACATGGTGCTTATATGGCTCCATCTCTTAACACGCCAAGAGATCAC。
2)在灭菌的离心管内,加入5μL的步骤1)得到的含4-羟基芪过氧化物酶基因片段4TTS(+)和pPU19质粒基因片段pPU19(+)的混合液、0.5μL的T4连接酶、1μL连接酶缓冲液、5μL的ddH2O,然后经漩涡振荡2min,在12000r/min的转速下,离心16s后,置于16℃水中保温过夜,即得含4-羟基芪过氧化物酶基因的pPU19质粒载体,可置于4℃的冰箱中备用。
3)通过PCR技术对重组后的质粒载体进行扩增,于95℃预变性5min,1个循环;94℃变性40s,57℃复性40s,35个循环;72℃延伸2min,72℃最后延伸10min,即得到扩增后的含4-羟基芪过氧化物酶基因的pPU19质粒载体;
4)将重组表达载体pPU19-4TTS用热激法转入Komagataella pastoris DSMZ 70382毕赤酵母感受态细胞内,获得表达4-羟基芪过氧化物酶基因的Komagataella pastoris DSMZ 70382毕赤酵母菌,命名为Pichia pastoris\pPU19\4TTS;
5)从平板上挑取Pichia pastoris\pPU19\4TTS单菌落于装有LB培养基的摇瓶中,培养基成分为蛋白胨2.5g/L、酵母膏2g/L、蔗糖7g/L、MgSO4 0.35g/L、CaCl2 0.25g/L、K2HPO4 0.25g/L、白藜芦醇15g/L,控制温度为33℃,振荡速度195r/min,起始pH控制在6.5,发酵时间控制在34h,得到含白藜芦醇二聚体的发酵产物;
6)将白藜芦醇二聚体的发酵产物液体经H103型大孔树脂富集纯化,柱内径4mm,高度1m,装柱体积为2L,上样液的质量浓度为0.78mg/mL,上样流速为3.0BV/h,先用4倍柱体积的蒸馏水洗涤,然后用8BV 75%的乙醇水溶液洗脱,回收乙醇水溶液。使用旋转蒸发仪祛除乙醇,所得固形物即为白藜芦醇二聚体提取物,经HPLC测试,其纯度为48%,其中白藜芦醇转化白藜芦醇二聚体的转化率为40%。
实施例4:
采用毕赤酵母制备白藜芦醇二聚体提取物的方法,包括以下步骤:
1)在灭菌的离心管内加入1g 4-羟基芪过氧化物酶基因、2g pPU19质粒基因、0.3mL限制性酶缓冲液、10U限制性内切酶EcoP1和10U EcoP15和100mL纯水,在33℃下进行温浴15min,经旋涡震荡20s,在14000r/min的转速下,离心3min,过滤,得到含酶切后的4-羟基芪过氧化物酶基因片段4TTS(+)和pPU19质粒基因片段pPU19(+)的混合液。其中4-羟基芪过氧化物酶基因片段4TTS(+)的基因序列为:
GAAGAGCTGTCGACAGTCGCATGCCAGCTAAATTAAGAAAACCTTCACTTGCTTCAAGTAAAGCATGTCGATCCTTCAACGAATTCTATATCACTTGGATGGAAAACTAAGTGTTCAGTATTTCACAGGTGACAAACCAGACAAGAAGCGTACATTCATTTGACCGAAGAAGCTTGAGGAGCACCCAAACATGGTGCTTATATGGCTCCATCTCTTAACACGCCAAGAGATCAC。
2)在灭菌的离心管内,加入5μL的步骤1)得到的含4-羟基芪过氧化物酶基因片段4TTS(+)和pPU19质粒基因片段pPU19(+)的混合液、0.5μL的T4连接酶、1μL连接酶缓冲液、5μL的ddH2O,然后经漩涡振荡1.6min,在12000r/min的转速下,离心14s后,置于16℃水中保温过夜,即得含4-羟基芪过氧化物酶基因的pPU19质粒载体,可置于4℃的冰箱中备用。
3)通过PCR技术对重组后的质粒载体进行扩增,于95℃预变性5min,1个循环;94℃变性40s,57℃复性40s,35个循环;72℃延伸2min,72℃最后延伸10min,即得到扩增后的含4-羟基芪过氧化物酶基因的pPU19质粒载体;
4)将重组表达载体pPU19-4TTS用热激法转入Komagataella pastoris DSMZ 70382毕赤酵母感受态细胞内,获得表达4-羟基芪过氧化物酶基因的Komagataella pastoris DSMZ 70382毕赤酵母菌,命名为Pichia pastoris\pPU19\4TTS;
5)从平板上挑取Pichia pastoris\pPU19\4TTS单菌落于装有LB培养基的摇瓶中,培养基成分为蛋白胨3g/L、酵母膏2g/L、蔗糖8g/L、MgSO4 0.3g/L、CaCl2 0.3g/L、K2HPO40.3g/L、白藜芦醇18g/L,控制温度为33℃,振荡速度200r/min,起始pH控制在7.5,发酵时间控制在36h,得到含白藜芦醇二聚体的发酵产物;
6)将白藜芦醇二聚体的发酵产物液体经H103型大孔树脂富集纯化,柱内径4mm,高度1m,装柱体积为2L,上样液的质量浓度为0.80mg/mL,上样流速为3BV/h,先用4倍柱体积的蒸馏水洗涤,然后用8BV 75%的乙醇水溶液洗脱,回收乙醇水溶液。使用旋转蒸发仪祛除乙醇,所得固形物即为白藜芦醇二聚体提取物,经HPLC测试,其纯度为60%,其中白藜芦醇转化白藜芦醇二聚体的转化率为45%。
实施例5:
采用毕赤酵母制备白藜芦醇二聚体提取物的方法,包括以下步骤:
1)在灭菌的离心管内加入1g 4-羟基芪过氧化物酶基因、2g pPU19质粒基因、0.3mL限制性酶缓冲液、10U限制性内切酶EcoP1和10U EcoP15和100mL纯水,在35℃下进行温浴20min,经旋涡震荡25s,在15000r/min的转速下,离心4min,过滤得到含酶切后的4-羟基芪过氧化物酶基因片段4TTS(+)和pPU19质粒基因片段pPU19(+)的混合液。其中4-羟基芪过氧化物酶基因片段4TTS(+)的基因序列为:
GAAGAGCTGTCGACAGTCGCATGCCAGCTAAATTAAGAAAACCTTCACTTGCTTCAAGTAAAGCATGTCGATCCTTCAACGAATTCTATATCACTTGGATGGAAAACTAAGTGTTCAGTATTTCACAGGTGACAAACCAGACAAGAAGCGTACATTCATTTGACCGAAGAAGCTTGAGGAGCACCCAAACATGGTGCTTATATGGCTCCATCTCTTAACACGCCAAGAGATCAC。
2)在灭菌的离心管内,加入5μL的步骤1)得到的含4-羟基芪过氧化物酶基因片段4TTS(+)和pPU19质粒基因片段pPU19(+)的混合液、0.5μL的T4连接酶、1μL连接酶缓冲液、5μL的ddH2O,然后经漩涡振荡1.6min,在12000r/min的转速下,离心13s后,置于16℃水中保温过夜,即得含4-羟基芪过氧化物酶基因的pPU19质粒载体,可置于4℃的冰箱中备用。
3)通过PCR技术对重组后的质粒载体进行扩增,于95℃预变性5min,1个循环;94℃变性40s,57℃复性40s,35个循环;72℃延伸2min,72℃最后延伸10min,即得到扩增后的含4-羟基芪过氧化物酶基因的pPU19质粒载体;
4)将重组表达载体pPU19-4TTS用热激法转入Komagataella pastoris DSMZ 70382毕赤酵母感受态细胞内,获得表达4-羟基芪过氧化物酶基因的Komagataella pastoris DSMZ 70382毕赤酵母菌,命名为Pichia pastoris\pPU19\4TTS;
5)从平板上挑取Pichia pastoris\pPU19\4TTS单菌落于装有LB培养基的摇瓶中,培养基成分为蛋白胨5g/L、酵母膏4g/L、蔗糖12g/L、MgSO4 0.5g/L、CaCl2 0.4g/L、K2HPO40.6g/L、白藜芦醇20g/L,控制温度为35℃,振荡速度220r/min,起始pH控制在8,发酵时间控制在40h,得到含白藜芦醇二聚体的发酵产物;
6)将白藜芦醇二聚体的发酵产物液体经H103型大孔树脂富集纯化,柱内径4mm,高度1m,装柱体积为2L,上样液的质量浓度为0.80mg/mL,上样流速为4.0BV/h,先用5倍柱体积的蒸馏水洗涤,然后用8BV 75%的乙醇水溶液洗脱,回收乙醇水溶液。使用旋转蒸发仪祛除乙醇,所得固形物即为白藜芦醇二聚体提取物,经HPLC测试,其纯度为50%,其中白藜芦醇转化白藜芦醇二聚体的转化率为42%。
SEQUENCE LISTING
<110> 珀莱雅化妆品股份有限公司
<120> 一种采用毕赤酵母制备白藜芦醇二聚体的方法
<130>
<160> 2
<170> PatentIn version 3.3
<210> 1
<211> 234
<212> DNA
<213> 4-羟基芪过氧化物酶基因片段4TTS(+)
<400> 1
gaagagctgt cgacagtcgc atgccagcta aattaagaaa accttcactt gcttcaagta 60
aagcatgtcg atccttcaac gaattctata tcacttggat ggaaaactaa gtgttcagta 120
tttcacaggt gacaaaccag acaagaagcg tacattcatt tgaccgaaga agcttgagga 180
gcacccaaac atggtgctta tatggctcca tctcttaaca cgccaagaga tcac 234
<210> 2
<211> 1536
<212> DNA
<213> 表达4-羟基芪过氧化物酶的毕赤酵母
<220>
<221> misc_feature
<222> (60)..(60)
<223> n is a, c, g, or t
<400> 2
tcgctggtaa tcccggcttt tgctgcttac aagctttacg gattatttct aggaggtagn 60
caattattgg gtggtcgcag cagtttcaaa gaggaggagc cagcttctgg gtcaaaagaa 120
aagggacaga gcaagagaca acagaaacta gaaaagagag gacaaaaggt gagatacaga 180
tagaatcttt gcgagtgaac caaggtagct gaaaaacata acttgcaagg atgctattgg 240
acaattttag gtgataaact cgattgctat cactgggctc tgccacatgg aagctttagt 300
gagaagagct gtcgacagtc gcatgccagc taaattaaga aaaccttcac ttgcttcaag 360
taaagcatgt cgatccttca acgaattcta tatcacttgg atggaaaact aagtgttcag 420
tatttcacag gtgacaaacc agacaagaag cgtacattca tttgaccgaa gaagcttgag 480
gagcacccaa acatggtgct tatatggctc catctcttaa cacgccaaga gatcacagct 540
cttgcgcact attcgagtcg tttacttttt ttttggtttt tgctaggcct tccattactt 600
ctttacttcg ttagtgacaa gtgacttaag gccaatgtat tcttgaatca aaagaaggct 660
gtgtcaattc ctaagcccta ctagctctac tttcggagtg acctaccgat aagttcgcat 720
acgcgaatct ggaccatttt tataatacca agtagaaatt caatagccat ctagctgttt 780
ctacatgatg acagcccata accataaaga aaactgcaaa cgattgctga gcttgtagag 840
cgtccagtaa gtagcgcaat ctccagtgag caacgtaata tcatattttc ttctctctct 900
ttcattctcc tccgagaatt acagaagcat catagtagtg tacccaccaa tggttgtgag 960
cgactgcgcg attccatgga tgctactgaa accaatgaat gaaacttgtc aagtttcctc 1020
gcttcctttt acataacgga tcttttaact tagaaacagt ttagtaaaag aaattcatca 1080
atacaatgga cggaggtaag tcagctcttt cagcaaggga gcatggaatc agattggcaa 1140
cgacttctgc gattcttatt cttccgattg attcaacagt agatttgcga gtggttggcc 1200
aaacacacag tttcgatgcg atctccgttt gatttgtatg aatacgcagt catctcattg 1260
gtggagcatt ttatacggat tgattgagtg gaagcatggt actgagagta tctacatgtg 1320
catttctgtt ggttgtcctc ggttgagttt tcgtatctgt ttgtcccccc aattttgtcc 1380
actccttttg gcaatctgcc gaatccaagc tcataatact aactcccatt ttagaagacg 1440
ttgcagcagt aagtaccctt acatgtaatc catgaaagca aatgtggcgc agtcaatcga 1500
agtcactgtc tgattgattc ttccctcagt ggcggt 1536
- 还没有人留言评论。精彩留言会获得点赞!