一种利用微生物发酵生产DHA的方法与流程
本发明属于发酵工程领域,涉及一种利用微生物发酵生产DHA的方法,具体地,涉及利用裂殖壶菌菌株工业化发酵生产含二十二碳六稀酸(DHA)混合油脂的方法。
背景技术:
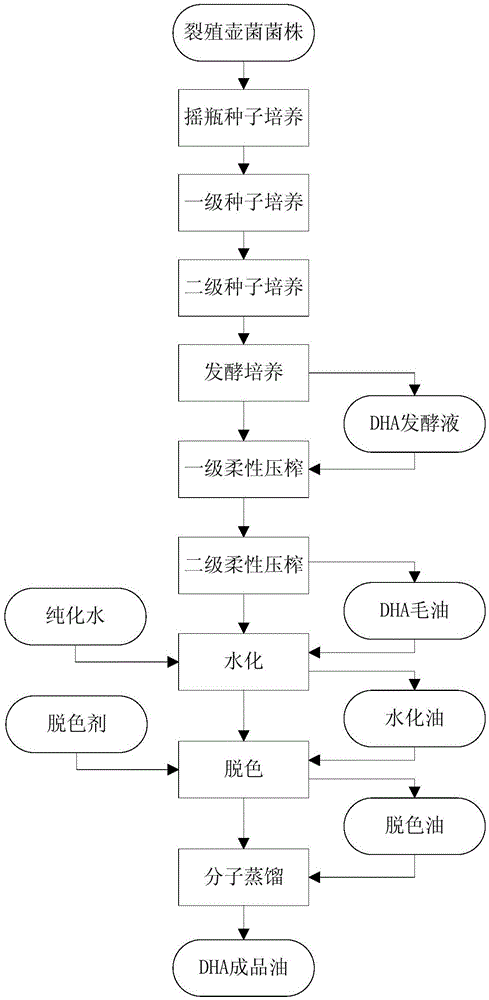
:DHA,全名二十二碳六烯酸(cis-4,7,10,13,16,19-docosahexaenoicacid,DHA),是一种多元不饱和脂肪酸。人体自身难以合成,必须从外界摄取。DHA属于人体必需脂肪酸之一,有重要的生理调节功能和保健作用,缺乏时会引发一系列病症,包括生长发育迟缓、皮肤异常、鳞屑、不育、智力障碍等,另外还对心血管疾病有特殊的预防和治疗效果。有关研究还表明,DHA能作用于许多不同类型的组织和细胞,具有抑制炎症及免疫作用,包括减少炎症因子的产生、抑制淋巴细胞增殖等,DHA还具有预防老年痴呆、神经性疾病等多重功效。目前DHA的商业来源主要是鱼油和微藻。传统深海鱼油提取的DHA受鱼的品种、季节及地理位置的影响而不稳定,且胆固醇和其他不饱和脂肪酸含量高,脂肪酸链的长度和不饱和度差异均较大,导致DHA产量有限、含量不高、分离纯化困难,成本较高等问题。随着鱼油原料来源日渐紧缺,难以实现DHA这种高附加值产品在食品和医药等行业中的广泛应用。微生物发酵法生产DHA可克服传统鱼油提取的缺陷,可用于大量生产DHA,不断满足人们的需求,具有广阔的应用前景,备受国内外学者关注。微生物发酵法采用真菌及微藻等产油微生物发酵生产含DHA藻油,经精制提取得DHA含量高的精油。国家卫生部许可的DHA生产菌种包括裂殖壶菌(Schizochytriumsp.)、吾肯氏壶藻(Ulkeniaamoeboida)和寇氏隐甲藻(Crypthecodiniumcohnii)。微生物发酵法生产DHA的市场份额在逐年快速上升,有取代鱼油DHA的趋势,提高微藻DHA生产技术及品质,进军微藻DHA市场前景广阔。公开号为CN103882072A的专利公开了一种利用裂殖壶菌生产二十二碳六烯酸的方法,其所公开的最高产量为细胞干重61.2g/L、DHA含量55.07%、DHA产量22.17g/L。公开号为CN101812484A的专利公开了一种高密度培养裂殖壶菌发酵生产DHA的方法,其所公开的产量为细胞干重120-150g/L、DHA产量26-30g/L,这也是目前报道的采用裂殖壶菌(Schizochytriumsp.)生产DHA的最高生产水平。虽然其DHA生产率较之前的研究有了较大提高,但对于利用微藻进行工业化生产二十二碳六烯酸,大大降低其生产成本,提高单位产量,使微生物发酵产DHA的方法能够得到大力推广和普及使用还是远远不够的。现有从裂殖壶菌发酵液中提取DHA的方法主要有三种,一是离心法,二是有机溶剂萃取法,三是超临界萃取法。离心法如公开号为CN101817738B的专利公开了一种从藻类和真菌细胞中破壁提取DHA的方法:将发酵结束后的微藻或真菌发酵液通过分离系统分离收集细胞,用酸调节菌泥pH2.0-4.0,然后控制菌泥温度在10℃-20℃,在菌泥中加入抗氧化剂后通过高压均质机进行高压均质破壁;将破壁后的菌泥加入水,搅拌后将料液通过三相分离机分离得到DHA油脂。该发明采用物理的破壁和物理提取方法,工艺简单,细胞破壁高效,对菌泥的低温和抗氧化剂处理,可有效的保护藻类和真菌细胞内物质的生物活性,且产品绿色无毒无残留。但该发明离心后的油层品质较差,除含油脂外,还含有水分、培养基成分和细胞碎片等杂质,不利于后续的精炼,另外离心后的废水层含有大量菌渣,COD很高,难以处理或处理成本极高。有机溶剂萃取法如公开号为CN101824363B的专利公开了一种提取二十二碳六烯酸油脂的方法:将含有二十二碳六烯酸的发酵液经酶法破壁后,先采用有机溶剂进行一级分水,对菌体进行富集,再用有机溶剂进行二级萃取,得到粗油。该方法操作简单,设备投入低,但该方法使用到有机溶剂进行萃取,最终产品可能会有溶剂残留,且萃取过程存在易燃易爆等安全隐患。超临界萃取方法如公开号为CN102181320B的专利公开了一种生物发酵DHA藻油的提取方法,包括以下步骤:a)将微藻发酵液固液分离后得到的固体物干燥,得到干燥菌体;b)以超临界二氧化碳为萃取剂对所述干燥菌体进行萃取,得到二氧化碳流体;c)对所述二氧化碳流体进行减压分离,得到DHA藻油。实验表明,采用本发明提供的方法得到的DHA藻油中,DHA的含量大于40%,提取收率最高仅为85.23%,且需要加入乙醇作为助萃取剂,存在一定的安全风险,同时超临界设备价格昂贵,萃取收率也不高。现有技术中DHA毛油的精炼多采用化学精炼技术,DHA毛油经过脱胶、碱炼、脱色、脱臭后得到DHA精油。该工艺技术不可避免地存在一些问题,如:碱炼为了达到控制酸价低的要求,通常都会加入过量碱,部分甘油三酯不可避免会被皂化;碱炼产生的高COD废水会污染环境;碱炼需要高温处理时间长,容易造成产品过氧化值、茴香胺值升高;脱臭温度高、时间长易产生反式脂肪酸等缺点。目前,尚需要开发新的DHA生产工艺。技术实现要素:本发明人经过深入的研究和创造性的劳动,得到了一种培养用于生产DHA的微生物的方法。本发明人惊奇地发现,所述培养方法能够大幅度地提高生物量及DHA产量。进一步地,本发明人还发现了一种提取DHA毛油的方法,所述提取方法能够提高DHA毛油的提取收率。进一步地,本发明人还发现了一种纯化DHA毛油的方法,其能够提升DHA成品油的各项技术指标和纯化收率。本发明显著地提高了含DHA的粗油脂产量、DHA产量及DHA生产率。由此提供了下述发明:本发明的一个方面涉及一种培养用于生产DHA(二十二碳六烯酸)的微生物的方法,其中:从发酵罐培养的36-60小时开始(优选地,直至发酵结束),将溶解氧饱和度(DO)控制在5%-10%(例如5%、5.5%、6%、6.5%、7%、7.5%、8%、8.5%、9%、9.5%或10%);和/或从发酵罐培养的36-60小时开始(优选地,直至发酵结束),不再加入氮源或者将氮源的加入量减少50%以上(例如55%以上、60%以上、65%以上、70%以上、75%以上、80%以上、85%以上、90%以上或95%以上)。在本发明的一些实施方式中,所述的培养方法,其中:从发酵罐培养的40-56小时(例如40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55或56小时)、44-52小时、46-50小时或者48小时开始,将溶解氧控制在5%-10%,和/或从发酵罐培养的40-56小时(例如40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55或56小时)、44-52小时、46-50小时或者48小时开始,不再加入氮源。在本发明的一些实施方式中,所述的培养方法,其中,在控制溶解氧饱和度为5%-10%之前,溶解氧饱和度为30%-50%(例如30%-45%、35%-45%、40%-45%、40%-50%、35%、36%、37%、38%、39%、40%、41%、42%、43%、44%或45%)。在本发明的一些实施方式中,所述的培养方法,其中,所述发酵液的pH为6.0-7.0。在本发明的一些实施方式中,所述的培养方法,其中,发酵液中葡萄糖的浓度保持1-5g/L(例如1、1.5、2、2.5、3、3.5、4、4.5或5g/L)。在本发明的一些实施方式中,所述的培养方法,其中,所述氮源为氨水,优选为25%-45%的氨水,更优选为35%-45%或38%-42%的氨水,特别优选为40%的氨水。在本发明的一些实施方式中,所述的培养方法,其中,所述发酵罐培养还包括在发酵罐培养起始的12-36小时(例如16-32小时、18-30小时、20-28小时、22-26小时、24小时),进行分罐培养的步骤;例如,分为两个或更多个发酵罐进行发酵罐培养。在本发明的一些实施方式中,所述的培养方法,其在发酵罐培养之前,还包括接种和种子扩大培养的步骤;优选地,所述种子扩大培养包括一级种子扩大培养和二级种子扩大培养;优选地,所述一级种子扩大培养包括下述步骤:按照0.4%-1%的接种量将摇瓶种子液接入装有灭菌后培养基的一级种子罐中,培养温度25℃-32℃,通气量1-2vvm,罐压0.02-0.05MPa,搅拌转速50-100rpm,培养30-35h,完成一级种子扩大培养;优选地,所述二级种子扩大培养包括下述步骤:按照1%-3%的接种量将一级种子罐的种子液接入装有灭菌后培养基的二级种子罐中,培养温度25℃-32℃,通气量1-2vvm,罐压0.02-0.05MPa,搅拌转速50-100rpm,培养20-25h,完成二级种子扩大培养。在本发明的一些实施方式中,所述的培养方法,还包括在接种之前和扩大培养之前,进行活化培养的步骤;优选地,所述活化培养的温度为25℃-32℃,时间为20-25h。在本发明的一些实施方式中,所述的培养方法,其中,所述发酵罐培养包括下述步骤:按照1%-3%的接种量将二级种子罐的种子液接入装有灭菌后培养基的发酵罐中,培养温度25℃-32℃,通气量1-2vvm,罐压0.02-0.05MPa,搅拌转速50-100rpm,进行发酵罐培养。在本发明的一些实施方式中,所述的培养方法,其中用于生产DHA的微生物为裂殖壶菌(Schizochytriumsp.);优选地,所述裂殖壶菌选自保藏号为CGMCCNo.6843、ATCCNo.20888、ATCCNo.20889、ATCCNo.28209或ATCCMYA-1381的菌株。在本发明一个具体的实施方案中,所述的培养方法,包括下述步骤:1)将裂殖壶菌(Schizochytriumsp.)斜面保藏菌株接入装有400mL种子培养基的2L摇瓶,在25℃-32℃的温度下以200rpm的转速培养20-25h,完成菌株活化培养;2)按照0.4-1%的接种量将摇瓶种子液接入装有灭菌后种子培养基的一级种子罐中,培养温度25℃-32℃,通气量1-2vvm,罐压0.02-0.05MPa,搅拌转速50-100rpm,培养30-35h,完成一级种子扩大培养;3)按照1%-3%的接种量将一级种子罐的种子液接入装有灭菌后种子培养基的二级种子罐中,培养温度25℃-32℃,通气量1-2vvm,罐压0.02-0.05MPa,搅拌转速50-100rpm,培养20-25h,完成二级种子扩大培养;4)按照1%-3%的接种量将二级种子罐的种子液接入装有灭菌后发酵培养基的发酵罐中,培养温度25℃-32℃,通气量1-2vvm,罐压0.02-0.05MPa,搅拌转速50-100rpm,进行发酵罐培养;5)通过溶氧调控策略将发酵48h前DO控制在30%-50%,48h及之后DO控制在5%-10%,过程中以DO为控制指标,调整通气量、罐压及搅拌转速,并适当补入灭菌后新鲜培养基或无菌水;6)发酵48h前流加40%的氨水控制发酵液pH在6.0-7.0,流加氨水补充氮源的同时可以控制发酵液pH稳定,48h后停止流加氨水,进行缺氮培养,pH不再作控制;7)发酵至24h将发酵罐中发酵液按体积一分为二培养,一半发酵液留在主罐中继续培养,另一半发酵液通过压差法转移至无菌保压的副罐中培养,主副罐中分别补入适量灭菌后新鲜培养基或无菌水,分罐培养后主副罐通气量、罐压及搅拌转速均按溶氧调控策略作相应调整;8)发酵过程中葡萄糖浓度随菌体生长不断下降,流加碳源将发酵液中糖点(葡萄糖浓度)维持在1-5g/L;9)发酵培养84-108h,终止发酵,放罐,测定发酵液中生物量达120-180g/L,生物量中粗油脂含量达45%-60%,DHA占总油脂含量为40%-55%,DHA产量最高可达44.9g/L,DHA产率最高可达11.2g/(L·d)。上述步骤1)至步骤3)中所用的种子培养基的配方以及上述的步骤4)中所用的发酵培养基的配方,为本领域技术人员知悉的常规配方。例如,种子培养基配方为:葡萄糖3%,蛋白胨1%,酵母粉0.5%,海水晶2%,pH自然。发酵培养基配方为:葡萄糖12%,蛋白胨1%,酵母粉0.5%,海水晶2%,pH6.5(裂殖壶菌产DHA的工艺研究及高产菌株选育,王申强等,江南大学硕士学位论文,2013年,p13-14)。上述发酵培养基碳源中添加了20%-40%(粗甘油的质量/碳源的质量×100%)预处理后的生物柴油副产物粗甘油。生物柴油是以植物油和动物油脂等可再生油脂为原料制成的可再生能源,经过转酯反应后可生成生物柴油及副产物甘油。粗甘油的预处理过程包括调节pH值至酸性、稀释、水解、分离。在本发明的一个实施方案中,粗甘油的预处理包括下述步骤:i)将粗甘油与去离子水以1:4(体积比)混合;ii)以盐酸调节pH至6.5左右;iii)以5000rpm的转速分离去除沉淀物质。不拘于理论的限制:步骤i)中,稀释后可以降低粘度;步骤ii)中,将粗甘油中可溶性的皂角类物质转化为不溶的游离脂肪酸固体物质;步骤iii)中,沉淀物质包括游离脂肪酸固体和不溶解的重金属杂质。上述步骤8)中,糖点(葡萄糖的浓度)采用本领域技术人员知悉的方法测定,例如生物传感仪测定。上述发酵过程中采用溶氧调控策略将发酵前48hDO控制在30%-50%、发酵48h后DO控制在5%-10%,过程中以DO为控制指标,调整通气量、罐压及搅拌转速,并适当补入灭菌后新鲜培养基或无菌水。上述发酵过程中发酵48h前流加40%的氨水控制发酵液pH在6.0-7.0,流加氨水补充氮源的同时可以控制发酵液pH稳定,48h后停止流加氨水,进行缺氮培养,pH不再作控制。上述发酵过程中发酵至24h将发酵罐中发酵液按体积一分为二培养,一半发酵液留在主罐中继续培养,另一半发酵液通过压差法转移至无菌保压的副罐中培养,主副罐中分别补入适量灭菌后新鲜培养基或无菌水,分罐培养后主副罐通气量、罐压及搅拌转速均按溶氧调控策略作相应调整。上述发酵过程中流加碳源将发酵液中糖点(葡萄糖浓度)维持在1-5g/L。上述发酵培养基中碳源包括葡萄糖、玉米浆粉、糖蜜、甘油和淀粉中的一种或多种;氮源包括大豆粉、酵母提取物、蛋白胨、氨水、硝酸钠、谷氨酸钠、硫酸铵中的一种或多种。上述发酵培养基中添加的微量元素包括丙氨酸、谷氨酸、赖氨酸、泛酸钙、生物素、维生素B1、微生物B6、微生物B12、维生素K中的一种或多种,当为其中一种时,添加量为0.001%-0.01%;当为其中多种时,任意一种组分的添加量为0.001%-0.005%。上述发酵培养基中添加的无机盐包括硫酸镁、氯化钾、氯化钠、氯化钙、磷酸二氢钾、磷酸氢二钾中的一种或多种。对上述发酵所用菌种裂殖壶菌(Schizochytriumsp.)没有特殊的限制,可以是归类于裂殖壶菌属的各种菌类,具体来说,包括但不限于Schizochytriumsp.CGMCCNo.6843、Schizochytriumsp.ATCCNo.20888、Schizochytriumsp.ATCCNo.20889、Schizochytriumsp.ATCCNo.28209、SchizochytriumlimacinumHondaetYokochiATCCMYA-1381,对其来源也无特殊限制,可以从发酵研究所或ATCC、CGMCC、CCTCC等微生物保藏寄存机关获得,还可以使用从自然环境中通过公知的筛选方法获得的裂殖壶菌(Schizochytriumsp.)菌株。本发明的另一方面涉及一种微生物发酵液,其由本发明中任一项所述的培养方法得到。优选地,所述微生物发酵液为裂殖壶菌发酵液。本发明的再一方面涉及一种提取DHA毛油的方法,包括如下步骤:1)将用于生产DHA的微生物的发酵液进行脱水处理;2)将步骤1)的产物进行柔性压榨,得到DHA毛油。在本发明的一些实施方式中,所述的提取方法,其中,步骤1)中,所述发酵液为裂殖壶菌发酵液;优选地,所述发酵液为本发明的微生物发酵液。在本发明的一些实施方式中,所述的提取方法,其中,步骤1)中,所述脱水处理选自如下的任意一种、两种或三种:离心、第一级柔性压榨、干燥例如喷雾干燥;优选地,所述脱水处理依次包括离心和第一级柔性压榨,或者依次包括离心和喷雾干燥;优选地,所述喷雾干燥的喷雾压力为4-8MPa,进风温度160℃-220℃,出风温度80℃-120℃。在本发明的一些实施方式中,所述的提取方法,其中,步骤1)中,所述第一级柔性压榨采用逐步加压方式,设定压力为20-40MPa,加压时间为1-6h,到达设定压力后保压1-4h。在本发明的一些实施方式中,所述的提取方法,其中,步骤2)中,所述柔性压榨采用逐步加压方式,设定压力为50-150MPa,加压时间为1-6h,到达设定压力后保压1-4h。在本发明一个具体的实施方案中,所述的提取方法,包括下述步骤:1)布料:将一定量的DHA发酵液用布料器运送至布料腔中,布料器回到初始位置,待下一步布料。2)一级柔性压榨:采用逐步加压方式,一级柔性压榨的压力范围为20-40MPa,加压时间为1-6h,到达设定压力,保压1-4h至基本无水滴流出,结束后,待物料下降到重压腔中,将物料推入二级柔性压榨位置。3)二级柔性压榨:采用逐步加压方式,压榨的最终压力为50-150MPa,加压时间为1-6h,到达设定压力,保压1-4h至基本无油滴流出,收集压榨出来的DHA毛油,卸压,去掉二级压榨笼,将微藻粕与滤布进行分离。上述DHA发酵液可直接进行一级柔性压榨,也可以先采用离心方法除去一部分水分,提高发酵液的含固量后再进行一级柔性压榨,可缩短压榨时间和提高生产能力。上述发酵液离心方法可采用卧式螺旋离心机、碟式离心机、管式离心机中的一种进行。提取DHA毛油方法也可以采用如下方式:DHA发酵液经喷雾干燥得到微藻粉(是指菌体经干燥去除水分后,得到的干菌体,外观为颗粒状粉末,称之为微藻粉),微藻粉进行柔性压榨(条件等同于前面的二级柔性压榨),得到DHA毛油。上述喷雾干燥喷雾压力为4-8MPa,进风温度160℃-220℃,出风温度80℃-120℃,DHA微藻粉水分控制在10%以内。上述DHA发酵液可直接进行喷雾干燥,也可以喷雾干燥前先采用离心方法除去一部分水分,提高发酵液的含固量后再进行喷雾干燥,可提高产能和节约能耗。上述发酵液离心方法可采用卧式螺旋离心机、碟式离心机、管式离心机中的一种进行。上述柔性压榨包括以下步骤:(1)布料:将一定量的DHA微藻粉用布料器运送至布料腔中,布料器回到初始位置,待下一步布料。(2)柔性压榨,采用逐步加压方式,压榨的最终压力为50-150MPa,加压时间为1-6h,到达设定压力,保压1-4h至基本无油滴流出,收集压榨出来的DHA毛油,卸压,去掉二级压榨笼,将微藻粕与滤布进行分离。本发明的再一方面涉及一种DHA毛油,其由本发明中任一项所述的提取方法制得。本发明的再一方面涉及一种纯化DHA毛油的方法,包括将DHA毛油进行水化、脱色和分子蒸馏的步骤;优选地,所述DHA毛油为本发明的DHA毛油。在本发明的一些实施方式中,所述的纯化方法,其中,所述水化包括如下步骤:将DHA毛油加热至70℃-85℃,按1kg毛油加入50-150g水的比例加入75℃-90℃水,搅拌10-60min,搅拌速度30-90转/min,静置1-6h,分层去掉下层磷脂,得到水化油。在本发明的一些实施方式中,所述的纯化方法,其中,所述脱色包括如下步骤:将水化产物升温至90℃-110℃,控制真空度≤-0.07MPa,真空脱水0.5-2h,然后降温至60℃-80℃,加入脱色剂(例如水化油重量1%-3%的活性炭和2-4%活性白土),搅拌0.5-1h,停止搅拌,过滤去除脱色剂,得到脱色油。在本发明的一些实施方式中,所述的纯化方法,其中,所述分子蒸馏为三级分子蒸馏;优选地,所述分子蒸馏包括如下步骤:将脱色油进入三级分子蒸馏,控制第一级真空度≤100Pa、温度150℃-200℃,去除第一级的轻组分;得到的第一重组分进入第二级分子蒸馏,控制二级真空度≤50Pa、温度180℃-220℃,去除第二级轻组分;得到的第二重组分进入第三级分子蒸馏,控制第三级真空度≤5Pa、温度200℃-250℃,去除第三级轻组分,得到第三重组分,为DHA成品油。优选地,重复分子蒸馏1次或多次。在本发明一个具体的实施方案中,所述的纯化方法,包括下述步骤:DHA毛油经水化、脱色、分子蒸馏等步骤进行精炼,最终得到DHA成品油。精炼具体步骤如下:1)水化:DHA毛油加热至70℃-85℃,按1kg毛油加入50-150g水的比例加入75℃-90℃水,搅拌10-60min,搅拌速度30-90转/min,静置1-6h,分层去掉下层磷脂,得到水化油。2)脱色:水化油移入脱色锅,升温至90℃-110℃,控制真空度≤-0.07MPa,真空脱水0.5-2h,然后降温至60℃-80℃,加入脱色剂(水化油重量1%-3%的活性炭和2%-4%活性白土),搅拌脱色0.5-1h,停止搅拌,过滤去除脱色剂,得到脱色油。3)分子蒸馏:脱色油进入三级分子蒸馏,控制第一级真空度≤100Pa、温度150℃-200℃,去除第一级的轻组分,重组分进入第二级分子蒸馏,控制二级真空度≤50Pa、温度180℃-220℃,去除第二级轻组分,重组分进入第三级分子蒸馏,控制第三级真空度≤5Pa、温度200℃-250℃,去除第三级轻组分,收集重组分,得到分子蒸馏油。分子蒸馏遍数控制1-3遍,至酸价、气味符合标准要求。分子蒸馏完毕,降温至20℃-40℃,添加抗氧化剂,包装,得到DHA成品油。上述步骤1)中,优选地,所述水为纯化水。本发明的再一方面涉及一种DHA成品油,其由本发明中任一项所述的纯化方法制得。本发明的再一方面涉及一种生产DHA或含有DHA的产品(例如DHA成品油)的方法,包括:本发明中任一项所述的培养用于生产DHA的微生物的方法、本发明中任一项所述的提取DHA毛油的方法、和/或本发明中任一项所述的纯化DHA毛油的方法。在本发明的一个实施方式中,所述生产方法的如图1所示。在本发明的另一个实施方式中,所述生产方法的如图2所示。本发明中,术语“柔性压榨”是指采用PLC(可编程逻辑控制器)程序控制来进行加压-保压-加压循环,逐步达到预定压力的一种高压压榨方式。术语“纯化水”是指饮用水经蒸馏法、离子交换法、反渗透法或其他适宜的方法制得的供药用的水,不含任何添加剂。在本发明的一个实施方案中,所述纯化水参照《中国药典》的规定。术语“DHA毛油”是指,从DHA发酵液中制取、没经过精炼加工的初级油。术语“DHA成品油”是指,DHA毛油经过精炼加工得到的精油。术语“发酵罐培养”是指种子扩大培养之后,在发酵罐中进行的用于生产目的产物的发酵培养。本发明的有益效果:本发明提供了一种工业化发酵生产二十二碳六烯酸油脂的方法,该方法能够低成本、高产量生产绿色环保的高品质DHA油脂。本发明具有下述技术效果中的至少一种:(1)本发明的工艺技术指标均明显优于现有的工艺技术指标,所得DHA油脂产量高、纯度高,有利于DHA的大规模工业化生产,粗甘油的添加也降低了DHA发酵生产成本,大幅提高了DHA发酵生产的市场竞争力。(2)本发明采用柔性压榨工艺制备DHA毛油,不需要使用有机溶剂进行提取,整条生产工艺路线无需使用有机溶剂,最终产品不会有溶剂残留,一方面所得产品绿色健康,产品质量好,另一方面生产车间安全环保,是一个绿色的清洁生产工艺。(3)发酵液经一级柔性压榨除去的水溶液,基本不含菌渣,COD比较低,容易生化处理,二级柔性压榨得到毛油后,剩下的微藻粕还含有少量的油脂和大量的蛋白,可以作为饲料添加剂使用,经济环保。(4)本发明采用分子蒸馏一步工艺替代传统脱酸、脱臭两步工艺。分子蒸馏能够在保留物质生理活性的基础上快速去除大量的游离脂肪酸和臭味。对比传统的碱炼脱酸方法,分子蒸馏脱酸工艺简单,降低了过度碱炼的风险,减少从皂脚带走中性油脂的损失,脱酸收率明显提高,脱酸过程在高真空条件下进行且时间短,避免了碱炼脱酸受热时间长造成过氧化值、茴香胺值升高的风险,产品稳定性好;对比传统水蒸气蒸馏脱臭工艺,分子蒸馏脱臭时间短,真空度高,减少了反式脂肪酸的产生,且臭味物质脱除效果好,产品无腥味。(5)生产过程避免了有机溶剂的使用,避免了溶剂消耗和溶剂回收的成本,污水COD低容易处理,精炼收率高,从而大大降低了生产成本。附图说明图1:本发明一个实施方式的生产DHA成品油的工艺流程示意图。图2:本发明另一个实施方式的生产DHA成品油的工艺流程示意图。图3:采用裂殖壶菌Schizochytriumsp.CGMCCNo.6843在不同培养方式下100m3发酵罐发酵生产DHA的结果。具体实施方式下面通过具体实施例对本发明作详细说明。然而,本领域的技术人员容易理解,实施例所描述的具体的物料配比、工艺条件及其结果仅用于说明本发明,而不应当也不会限制权利要求书中所详细描述的本发明。关于本发明涉及的物理量或者指标的测定方法或者计算方法,如果没有特别说明,按照下面所述的方法进行:生物量的测定方法为:取适量发酵液置于扁形称量瓶中,于105℃电热恒温干燥箱中干燥4h后,放入干燥器冷却至室温,称重,减去称量瓶重量,再除以发酵液体积,所得数值即为生物量,单位g/L。粗油脂产量的测定方法:取一定体积发酵液,加入2倍体积的浓盐酸,70℃下恒温搅拌50min至菌体完全消化,加入适量正己烷,静置分层,用滴管取上层有机相至茄型瓶中,连续萃取5-8次,直至上层有机相为无色,通过80℃水浴旋转蒸发除去正己烷,然后将茄型瓶置于105℃电热恒温干燥箱中干燥1h,放入干燥器冷却至室温,称重,减去茄型瓶重量,再除以发酵液体积,所得数值即为粗油脂产量,单位g/L。DHA产量为:以气相色谱法测得粗油脂中DHA的含量,乘以粗油脂产量所得,单位g/L。DHA生产率为:DHA产量除以发酵周期(天数)所得数值,单位g/(L·d)。脂肪酸组成分析的方法和本发明中DHA成品油检测方法依据GB26400-2011食品安全国家标准食品添加剂二十二碳六烯酸油脂(发酵法)。毛油提取收率计算方式:收率=毛油重量g/(发酵液体积L×发酵液粗油脂产量g/L)×100%。发酵培养实施例1为原始培养方式(不采用溶氧调控策略、氮源调控策略及分罐培养策略);实施例2为采用溶氧调控策略;实施例3为采用氮源调控策略;实施例4为采用分罐培养策略;实施例5-13为同时采用溶氧调控策略、氮源调控策略及分罐培养策略。下面的实施例1-13中,如果没有特别说明,所用种子培养基配方为:葡萄糖3%,蛋白胨1%,酵母粉0.5%,海水晶2%,pH自然(其余为水)。发酵培养基配方为:葡萄糖12%,蛋白胨1%,酵母粉0.5%,海水晶2%(其余为水)。实施例1:原始培养方式(不采用溶氧调控策略、氮源调控策略及分罐培养策略)对100m3发酵罐发酵生产DHA的影响分别将裂殖壶菌(Schizochytriumsp.ATCC20888)、裂殖壶菌(SchizochytriumlimacinumHondaetYokochiATCCMYA-1381)、裂殖壶菌(Schizochytriumsp.CGMCCNo.6843)斜面保藏菌株接入装有400mL培养基的2L摇瓶,在25℃的温度下以200rpm的转速培养24h,完成菌株活化培养。按照0.4%的接种量将摇瓶种子液接入装有灭菌后培养基的一级种子罐中,培养温度28℃、通气量1vvm、罐压0.02MPa、搅拌转速50rpm培养30h,完成一级种子扩大培养。按照3%的接种量将一级种子罐的种子液接入装有灭菌后培养基的二级种子罐中,培养温度28℃、通气量1vvm、罐压0.02MPa、搅拌转速75rpm培养24h,完成二级种子扩大培养。按照3%的接种量将二级种子罐的种子液接入装有灭菌后培养基的发酵罐中。发酵过程培养温度28℃、通气量1vvm、罐压0.02MPa、搅拌转速75rpm,流加含30%预处理后粗甘油的碳源,控制葡萄糖浓度在5g/L,流加补入氮源,进行发酵培养。发酵过程中检测发酵液葡萄糖浓度、pH、菌体生物量、粗油脂产量及DHA产量变化。培养96h后终止发酵,下表1为分别测定所述三株菌在原始培养模式下培养后的生物量、粗油脂产量、DHA产量及DHA生产率,下表2为发酵后所得混合油脂脂肪酸组成气相分析结果。CGMCCNo.6843的生物量、粗油脂产量、DHA产量亦如图3所示。表1:不同菌株在原始培养模式下的发酵结果表2:100m3发酵罐原始培养方式发酵后所得混合油脂脂肪酸组成通过表1及表2可见,三株菌在原始培养方式下产量及脂肪酸组成均差异较大,其中裂殖壶菌(Schizochytriumsp.CGMCCNo.6843)各项指标均优于另外两株菌,因此以裂殖壶菌(Schizochytriumsp.CGMCCNo.6843)为出发菌株来进行不同培养方式的优化。实施例2:采用溶氧调控策略对100m3发酵罐发酵生产DHA的影响将裂殖壶菌(Schizochytriumsp.CGMCCNo.6843)斜面保藏菌株接入装有400mL培养基的2L摇瓶,在25℃的温度下以200rpm的转速培养24h,完成菌株活化培养。按照0.4%的接种量将摇瓶种子液接入装有灭菌后培养基的一级种子罐中,培养温度28℃、通气量1vvm、罐压0.02MPa、搅拌转速50rpm培养30h,完成一级种子扩大培养。按照3%的接种量将一级种子罐的种子液接入装有灭菌后培养基的二级种子罐中,培养温度28℃、通气量1vvm、罐压0.02MPa、搅拌转速75rpm培养24h,完成二级种子扩大培养。按照3%的接种量将二级种子罐的种子液接入装有灭菌后培养基的发酵罐中。发酵过程培养温度28℃、通气量1-2vvm、罐压0.02-0.05MPa、搅拌转速50-100rpm,流加含30%预处理后粗甘油的碳源,控制葡萄糖浓度在5g/L,流加补入氮源,进行发酵培养。采用溶氧调控策略将发酵前48hDO控制在40%、发酵48h后DO控制在8%,过程中以DO为控制指标,调整通气量、罐压及搅拌转速,并适当补入灭菌后新鲜培养基或无菌水。发酵过程中检测发酵液葡萄糖浓度、pH、菌体生物量、粗油脂产量及DHA产量变化。培养96h后终止发酵,测定发酵液中生物量为125g/L,粗油脂产量为56.3g/L,DHA产量为29.3g/L,DHA生产率为7.3g/(L·d),如图3。发酵液放罐体积为78m3,整批发酵含DHA粗油脂产量为4391.4kg,比原始培养方式产量提高了0.67倍。以下表3为发酵后所得混合油脂脂肪酸组成气相分析结果:表3:100m3发酵罐溶氧调控策略发酵后所得混合油脂脂肪酸组成实施例3:采用氮源调控策略对100m3发酵罐发酵生产DHA的影响将裂殖壶菌(Schizochytriumsp.CGMCCNo.6843)斜面保藏菌株接入装有400mL培养基的2L摇瓶,在25℃的温度下以200rpm的转速培养24h,完成菌株活化培养。按照0.4%的接种量将摇瓶种子液接入装有灭菌后培养基的一级种子罐中,培养温度28℃、通气量1vvm,罐压0.02MPa、搅拌转速50rpm培养30h,完成一级种子扩大培养。按照3%的接种量将一级种子罐的种子液接入装有灭菌后培养基的二级种子罐中,培养温度28℃、通气量1vvm、罐压0.02MPa、搅拌转速75rpm培养24h,完成二级种子扩大培养。按照3%的接种量将二级种子罐的种子液接入装有灭菌后培养基的发酵罐中。发酵过程培养温度28℃、通气量1vvm、罐压0.02MPa、搅拌转速75rpm,流加含30%预处理后粗甘油的碳源,控制葡萄糖浓度在5g/L,进行发酵培养。发酵过程中发酵48h前流加40%的氨水控制发酵液pH在6.5,流加氨水补充氮源的同时可以控制发酵液pH稳定,48h后停止流加氨水,进行缺氮培养,pH不再作控制。发酵过程中检测发酵液葡萄糖浓度、pH、菌体生物量、粗油脂产量及DHA产量变化。培养96h后终止发酵,测定发酵液中生物量为118g/L,粗油脂产量为64.2g/L,DHA产量为32.6g/L,DHA生产率为8.2g/(L·d),如图3。发酵液放罐体积为78m3,整批发酵含DHA粗油脂产量为5007.6kg,比原始培养方式产量提高了0.91倍。以下表4为发酵后所得混合油脂脂肪酸组成气相分析结果:表4:100m3发酵罐氮源调控策略发酵后所得混合油脂脂肪酸组成脂肪酸组成含量%C12:00.48C14:04.96C16:017.12C16:11.26C18:01.88C18:11.67C20:46.23C20:51.25C22:514.35C22:650.8实施例4:采用分罐培养策略对100m3发酵罐发酵生产DHA的影响将裂殖壶菌(Schizochytriumsp.CGMCCNo.6843)斜面保藏菌株接入装有400mL培养基的2L摇瓶,在25℃的温度下以200rpm的转速培养24h,完成菌株活化培养。按照0.4%的接种量将摇瓶种子液接入装有灭菌后培养基的一级种子罐中,培养温度28℃、通气量1vvm、罐压0.02MPa、搅拌转速50rpm培养30h,完成一级种子扩大培养。按照3%的接种量将一级种子罐的种子液接入装有灭菌后培养基的二级种子罐中,培养温度28℃、通气量1vvm、罐压0.02MPa、搅拌转速75rpm培养24h,完成二级种子扩大培养。按照3%的接种量将二级种子罐的种子液接入装有灭菌后培养基的发酵罐中。发酵过程培养温度28℃、通气量1vvm、罐压0.02MPa、搅拌转速75rpm,流加含30%预处理后粗甘油的碳源,控制葡萄糖浓度在5g/L,流加补入氮源,进行发酵培养。发酵至24h将发酵罐中发酵液按体积一分为二培养,一半发酵液留在主罐中继续培养,另一半发酵液通过压差法转移至无菌保压的副罐中培养,主副罐中分别补入适量灭菌后新鲜培养基或无菌水。发酵过程中检测发酵液葡萄糖浓度、pH、菌体生物量、粗油脂产量及DHA产量变化。培养96h后终止发酵,测定发酵液中生物量为73g/L,粗油脂产量为36.3g/L,DHA产量为16.4g/L,DHA生产率为4.1g/(L·d),如图3。发酵液放罐体积为132m3,整批发酵含DHA粗油脂产量为4791.6kg,比原始培养方式产量提高了0.83倍,虽然放罐生物量、粗油脂产量、DHA产量等指标与原始培养方式比较差异不大,但是由于采用分罐培养,发酵液放罐体积为原始培养方式的1.74倍,所以整批发酵产量较原始培养方式提高了0.83倍。这对于工业化大规模生产含DHA油脂具有重要意义,可以极大的节约成本,提高DHA生产的市场竞争力。以下表5为发酵后所得混合油脂脂肪酸组成气相分析结果:表5:100m3发酵罐发酵后所得混合油脂脂肪酸组成脂肪酸组成含量%C12:00.58C14:04.88C16:020.21C16:11.91C18:01.54C18:11.22C20:46.13C20:51.25C22:517.08C22:645.2实施例5:采用溶氧调控策略、氮源调控策略及分罐培养策略对100m3发酵罐裂殖壶菌(Schizochytriumsp.CGMCCNo.6843)发酵生产DHA的影响将裂殖壶菌(Schizochytriumsp.CGMCCNo.6843)斜面保藏菌株接入装有400mL培养基的2L摇瓶,在25℃的温度下以200rpm的转速培养24h,完成菌株活化培养。按照0.4%的接种量将摇瓶种子液接入装有灭菌后培养基的一级种子罐中,培养温度28℃、通气量1vvm、罐压0.02MPa、搅拌转速50rpm培养30h,完成一级种子扩大培养。按照3%的接种量将一级种子罐的种子液接入装有灭菌后培养基的二级种子罐中,培养温度28℃、通气量1vvm、罐压0.02MPa、搅拌转速75rpm培养24h,完成二级种子扩大培养。按照3%的接种量将二级种子罐的种子液接入装有灭菌后培养基的发酵罐中。发酵过程培养温度28℃、通气量1-2vvm、罐压0.02-0.05MPa、搅拌转速50-100rpm,流加含30%预处理后粗甘油的碳源,控制葡萄糖浓度在5g/L,进行发酵培养。采用溶氧调控策略将发酵48h前DO控制在40%、发酵48h后DO控制在8%,过程中以DO为控制指标,调整通气量、罐压及搅拌转速,并适当补入灭菌后新鲜培养基或无菌水。发酵过程中发酵48h前流加40%的氨水控制发酵液pH在6.5左右,流加氨水补充氮源的同时可以控制发酵液pH稳定,48h后停止流加氨水,进行缺氮培养,pH不再作控制。发酵至24h将发酵罐中发酵液按体积一分为二培养,一半发酵液留在主罐中继续培养,另一半发酵液通过压差法转移至无菌保压的副罐中培养,主副罐中分别补入适量灭菌后新鲜培养基或无菌水,分罐培养后主副罐通气量、罐压及搅拌转速均按溶氧调控策略作相应调整。发酵过程中检测发酵液葡萄糖浓度、pH、菌体生物量、粗油脂产量及DHA产量变化。培养96h后终止发酵,测定发酵液中生物量为145g/L,粗油脂产量为82.6g/L,DHA产量为44.9g/L,DHA生产率为11.2g/(L·d),如图3。发酵液放罐体积为130m3,整批发酵含DHA粗油脂产量为10738kg,比原始培养方式产量提高了3.10倍。同时采用溶氧调控策略、氮源调控策略及分罐培养策略不仅可以高产含DHA的油脂,而且所得DHA油脂中DHA的含量高,具有强势的市场竞争力。以下表6为发酵后所得混合油脂脂肪酸组成气相分析结果:表6:100m3发酵罐发酵后所得混合油脂脂肪酸组成脂肪酸组成含量%C12:00.45C14:04.86C16:014.22C16:11.68C18:01.72C18:11.59C20:46.36C20:51.54C22:513.28C22:654.3实施例6:采用溶氧调控策略、氮源调控策略及分罐培养策略对100m3发酵罐裂殖壶菌(Schizochytriumsp.ATCC20888)发酵生产DHA的影响将裂殖壶菌(Schizochytriumsp.ATCC20888)按实施例5的培养方式进行培养,培养96h后终止发酵,测定发酵液中生物量为65g/L,粗油脂产量为15.2g/L,DHA产量为6.5g/L,比原始培养方式产量提高了2.49倍。同时采用溶氧调控策略、氮源调控策略及分罐培养策略不仅可以高产含DHA的油脂,而且所得DHA油脂中DHA的含量高,具有强势的市场竞争力。以下表7为发酵后所得混合油脂脂肪酸组成气相分析结果:表7:100m3发酵罐发酵后所得混合油脂脂肪酸组成实施例7:采用溶氧调控策略、氮源调控策略及分罐培养策略对100m3发酵罐裂殖壶菌(SchizochytriumlimacinumHondaetYokochiATCCMYA-1381)发酵生产DHA的影响将裂殖壶菌(SchizochytriumlimacinumHondaetYokochiATCCMYA-1381)施例5的培养方式进行培养,培养96h后终止发酵,测定发酵液中生物量为105g/L,粗油脂产量为37g/L,DHA产量为17.2g/L,比原始培养方式产量提高了2.81倍。同时采用溶氧调控策略、氮源调控策略及分罐培养策略不仅可以高产含DHA的油脂,而且所得DHA油脂中DHA的含量高,具有强势的市场竞争力。以下表8为发酵后所得混合油脂脂肪酸组成气相分析结果:表8:100m3发酵罐发酵后所得混合油脂脂肪酸组成脂肪酸组成含量%C12:00.79C14:05.48C16:020.63C16:11.25C18:01.96C18:11.12C20:47.95C20:52.87C22:511.45C22:646.5实施例8:采用溶氧调控策略、氮源调控策略及分罐培养策略对100m3发酵罐裂殖壶菌(Schizochytriumsp.CGMCCNo.6843)发酵生产DHA的影响将裂殖壶菌(Schizochytriumsp.CGMCCNo.6843)斜面保藏菌株接入装有400mL培养基的2L摇瓶,在25℃的温度下以200rpm的转速培养24h,完成菌株活化培养。按照0.4%的接种量将摇瓶种子液接入装有灭菌后培养基的一级种子罐中,培养温度28℃、通气量1vvm、罐压0.02MPa、搅拌转速50rpm培养30h,完成一级种子扩大培养。按照3%的接种量将一级种子罐的种子液接入装有灭菌后培养基的二级种子罐中,培养温度28℃、通气量1vvm、罐压0.02MPa、搅拌转速75rpm培养24h,完成二级种子扩大培养。按照3%的接种量将二级种子罐的种子液接入装有灭菌后培养基的发酵罐中。发酵过程培养温度28℃、通气量1-2vvm、罐压0.02-0.05MPa、搅拌转速50-100rpm,流加含20%预处理后粗甘油的碳源,控制葡萄糖浓度在1g/L,进行发酵培养。采用溶氧调控策略将发酵36h前DO控制在30%、发酵36h后DO控制在5%,过程中以DO为控制指标,调整通气量、罐压及搅拌转速,并适当补入灭菌后新鲜培养基或无菌水。发酵过程中发酵36h前流加25%的氨水控制发酵液pH在6左右,流加氨水补充氮源的同时可以控制发酵液pH稳定,36h后停止流加氨水,进行缺氮培养,pH不再作控制。发酵至12h将发酵罐中发酵液按体积一分为二培养,一半发酵液留在主罐中继续培养,另一半发酵液通过压差法转移至无菌保压的副罐中培养,主副罐中分别补入适量灭菌后新鲜培养基或无菌水,分罐培养后主副罐通气量、罐压及搅拌转速均按溶氧调控策略作相应调整。发酵过程中检测发酵液葡萄糖浓度、pH、菌体生物量、粗油脂产量及DHA产量变化。培养96h后终止发酵,测定发酵液中生物量为140g/L,粗油脂产量为78.5g/L,DHA产量为40.4g/L,DHA生产率为10.1g/(L·d)。以下表9为发酵后所得混合油脂脂肪酸组成气相分析结果:表9:100m3发酵罐发酵后所得混合油脂脂肪酸组成脂肪酸组成含量%C12:00.42C14:04.87C16:015.07C16:11.65C18:01.7C18:11.58C20:46.35C20:51.62C22:515.24C22:651.5实施例9:采用溶氧调控策略、氮源调控策略及分罐培养策略对100m3发酵罐裂殖壶菌(Schizochytriumsp.CGMCCNo.6843)发酵生产DHA的影响将裂殖壶菌(Schizochytriumsp.CGMCCNo.6843)斜面保藏菌株接入装有400mL培养基的2L摇瓶,在25℃的温度下以200rpm的转速培养24h,完成菌株活化培养。按照0.4%的接种量将摇瓶种子液接入装有灭菌后培养基的一级种子罐中,培养温度28℃、通气量1vvm、罐压0.02MPa、搅拌转速50rpm培养30h,完成一级种子扩大培养。按照3%的接种量将一级种子罐的种子液接入装有灭菌后培养基的二级种子罐中,培养温度28℃、通气量1vvm、罐压0.02MPa、搅拌转速75rpm培养24h,完成二级种子扩大培养。按照3%的接种量将二级种子罐的种子液接入装有灭菌后培养基的发酵罐中。发酵过程培养温度28℃、通气量1-2vvm、罐压0.02-0.05MPa、搅拌转速50-100rpm,流加含20%预处理后粗甘油的碳源,控制葡萄糖浓度在5g/L,进行发酵培养。采用溶氧调控策略将发酵60h前DO控制在50%、发酵60h后DO控制在10%,过程中以DO为控制指标,调整通气量、罐压及搅拌转速,并适当补入灭菌后新鲜培养基或无菌水。发酵过程中发酵60h前流加45%的氨水控制发酵液pH在7左右,流加氨水补充氮源的同时可以控制发酵液pH稳定,60h后停止流加氨水,进行缺氮培养,pH不再作控制。发酵至36h将发酵罐中发酵液按体积一分为二培养,一半发酵液留在主罐中继续培养,另一半发酵液通过压差法转移至无菌保压的副罐中培养,主副罐中分别补入适量灭菌后新鲜培养基或无菌水,分罐培养后主副罐通气量、罐压及搅拌转速均按溶氧调控策略作相应调整。发酵过程中检测发酵液葡萄糖浓度、pH、菌体生物量、粗油脂产量及DHA产量变化。培养96h后终止发酵,测定发酵液中生物量为138g/L,粗油脂产量为78.6g/L,DHA产量为39.6g/L,DHA生产率为9.9g/(L·d)。以下表10为发酵后所得混合油脂脂肪酸组成气相分析结果:表10:100m3发酵罐发酵后所得混合油脂脂肪酸组成脂肪酸组成含量%C12:00.41C14:04.88C16:015.32C16:11.64C18:01.71C18:11.6C20:46.38C20:51.58C22:516.08C22:650.4实施例10:采用溶氧调控策略、氮源调控策略及分罐培养策略对100m3发酵罐裂殖壶菌(Schizochytriumsp.CGMCCNo.6843)发酵生产DHA的影响将裂殖壶菌(Schizochytriumsp.CGMCCNo.6843)斜面保藏菌株接入装有400mL培养基的2L摇瓶,在25℃的温度下以200rpm的转速培养24h,完成菌株活化培养。按照0.4%的接种量将摇瓶种子液接入装有灭菌后培养基的一级种子罐中,培养温度28℃、通气量1vvm、罐压0.02MPa、搅拌转速50rpm培养30h,完成一级种子扩大培养。按照3%的接种量将一级种子罐的种子液接入装有灭菌后培养基的二级种子罐中,培养温度28℃、通气量1vvm、罐压0.02MPa、搅拌转速75rpm培养24h,完成二级种子扩大培养。按照3%的接种量将二级种子罐的种子液接入装有灭菌后培养基的发酵罐中。发酵过程培养温度28℃、通气量1-2vvm、罐压0.02-0.05MPa、搅拌转速50-100rpm,流加含20%预处理后粗甘油的碳源,控制葡萄糖浓度在2g/L,进行发酵培养。采用溶氧调控策略将发酵40h前DO控制在35%、发酵40h后DO控制在6%,过程中以DO为控制指标,调整通气量、罐压及搅拌转速,并适当补入灭菌后新鲜培养基或无菌水。发酵过程中发酵40h前流加38%的氨水控制发酵液pH在6.5左右,流加氨水补充氮源的同时可以控制发酵液pH稳定,40h后停止流加氨水,进行缺氮培养,pH不再作控制。发酵至20h将发酵罐中发酵液按体积一分为二培养,一半发酵液留在主罐中继续培养,另一半发酵液通过压差法转移至无菌保压的副罐中培养,主副罐中分别补入适量灭菌后新鲜培养基或无菌水,分罐培养后主副罐通气量、罐压及搅拌转速均按溶氧调控策略作相应调整。发酵过程中检测发酵液葡萄糖浓度、pH、菌体生物量、粗油脂产量及DHA产量变化。培养96h后终止发酵,测定发酵液中生物量为139g/L,粗油脂产量为78.2g/L,DHA产量为38.0g/L,DHA生产率为9.5g/(L·d)。以下表11为发酵后所得混合油脂脂肪酸组成气相分析结果:表11:100m3发酵罐发酵后所得混合油脂脂肪酸组成实施例11:采用溶氧调控策略、氮源调控策略及分罐培养策略对100m3发酵罐裂殖壶菌(Schizochytriumsp.CGMCCNo.6843)发酵生产DHA的影响将裂殖壶菌(Schizochytriumsp.CGMCCNo.6843)斜面保藏菌株接入装有400mL培养基的2L摇瓶,在25℃的温度下以200rpm的转速培养24h,完成菌株活化培养。按照0.4%的接种量将摇瓶种子液接入装有灭菌后培养基的一级种子罐中,培养温度28℃、通气量1vvm、罐压0.02MPa、搅拌转速50rpm培养30h,完成一级种子扩大培养。按照3%的接种量将一级种子罐的种子液接入装有灭菌后培养基的二级种子罐中,培养温度28℃、通气量1vvm、罐压0.02MPa、搅拌转速75rpm培养24h,完成二级种子扩大培养。按照3%的接种量将二级种子罐的种子液接入装有灭菌后培养基的发酵罐中。发酵过程培养温度28℃、通气量1-2vvm、罐压0.02-0.05MPa、搅拌转速50-100rpm,流加含40%预处理后粗甘油的碳源,控制葡萄糖浓度在4g/L,进行发酵培养。采用溶氧调控策略将发酵56h前DO控制在45%、发酵56h后DO控制在9%,过程中以DO为控制指标,调整通气量、罐压及搅拌转速,并适当补入灭菌后新鲜培养基或无菌水。发酵过程中发酵56h前流加42%的氨水控制发酵液pH在7左右,流加氨水补充氮源的同时可以控制发酵液pH稳定,56h后停止流加氨水,进行缺氮培养,pH不再作控制。发酵至28h将发酵罐中发酵液按体积一分为二培养,一半发酵液留在主罐中继续培养,另一半发酵液通过压差法转移至无菌保压的副罐中培养,主副罐中分别补入适量灭菌后新鲜培养基或无菌水,分罐培养后主副罐通气量、罐压及搅拌转速均按溶氧调控策略作相应调整。发酵过程中检测发酵液葡萄糖浓度、pH、菌体生物量、粗油脂产量及DHA产量变化。培养96h后终止发酵,测定发酵液中生物量为140g/L,粗油脂产量为80.8g/L,DHA产量为42.0g/L,DHA生产率为10.5g/(L·d)。以下表12为发酵后所得混合油脂脂肪酸组成气相分析结果:表12:100m3发酵罐发酵后所得混合油脂脂肪酸组成脂肪酸组成含量%C12:00.44C14:04.86C16:014.61C16:11.67C18:01.7C18:11.58C20:46.38C20:51.64C22:515.12C22:652实施例12:采用溶氧调控策略、氮源调控策略及分罐培养策略对100m3发酵罐裂殖壶菌(Schizochytriumsp.CGMCCNo.6843)发酵生产DHA的影响将裂殖壶菌(Schizochytriumsp.CGMCCNo.6843)斜面保藏菌株接入装有400mL培养基的2L摇瓶,在25℃的温度下以200rpm的转速培养24h,完成菌株活化培养。按照0.4%的接种量将摇瓶种子液接入装有灭菌后培养基的一级种子罐中,培养温度28℃、通气量1vvm、罐压0.02MPa、搅拌转速50rpm培养30h,完成一级种子扩大培养。按照3%的接种量将一级种子罐的种子液接入装有灭菌后培养基的二级种子罐中,培养温度28℃、通气量1vvm、罐压0.02MPa、搅拌转速75rpm培养24h,完成二级种子扩大培养。按照3%的接种量将二级种子罐的种子液接入装有灭菌后培养基的发酵罐中。发酵过程培养温度28℃、通气量1-2vvm、罐压0.02-0.05MPa、搅拌转速50-100rpm,流加含40%预处理后粗甘油的碳源,控制葡萄糖浓度在3g/L,进行发酵培养。采用溶氧调控策略将发酵44h前DO控制在38%、发酵44h后DO控制在7%,过程中以DO为控制指标,调整通气量、罐压及搅拌转速,并适当补入灭菌后新鲜培养基或无菌水。发酵过程中发酵44h前流加40%的氨水控制发酵液pH在6.5左右,流加氨水补充氮源的同时可以控制发酵液pH稳定,44h后停止流加氨水,进行缺氮培养,pH不再作控制。发酵至22h将发酵罐中发酵液按体积一分为二培养,一半发酵液留在主罐中继续培养,另一半发酵液通过压差法转移至无菌保压的副罐中培养,主副罐中分别补入适量灭菌后新鲜培养基或无菌水,分罐培养后主副罐通气量、罐压及搅拌转速均按溶氧调控策略作相应调整。发酵过程中检测发酵液葡萄糖浓度、pH、菌体生物量、粗油脂产量及DHA产量变化。培养96h后终止发酵,测定发酵液中生物量为141g/L,粗油脂产量为81.2g/L,DHA产量为42.4g/L,DHA生产率为10.6g/(L·d)。以下表13为发酵后所得混合油脂脂肪酸组成气相分析结果:表13:100m3发酵罐发酵后所得混合油脂脂肪酸组成实施例13:采用溶氧调控策略、氮源调控策略及分罐培养策略对100m3发酵罐裂殖壶菌(Schizochytriumsp.CGMCCNo.6843)发酵生产DHA的影响将裂殖壶菌(Schizochytriumsp.CGMCCNo.6843)斜面保藏菌株接入装有400mL培养基的2L摇瓶,在25℃的温度下以200rpm的转速培养24h,完成菌株活化培养。按照0.4%的接种量将摇瓶种子液接入装有灭菌后培养基的一级种子罐中,培养温度28℃、通气量1vvm、罐压0.02MPa、搅拌转速50rpm培养30h,完成一级种子扩大培养。按照3%的接种量将一级种子罐的种子液接入装有灭菌后培养基的二级种子罐中,培养温度28℃、通气量1vvm、罐压0.02MPa、搅拌转速75rpm培养24h,完成二级种子扩大培养。按照3%的接种量将二级种子罐的种子液接入装有灭菌后培养基的发酵罐中。发酵过程培养温度28℃、通气量1-2vvm、罐压0.02-0.05MPa、搅拌转速50-100rpm,流加含40%预处理后粗甘油的碳源,控制葡萄糖浓度在5g/L,进行发酵培养。采用溶氧调控策略将发酵52h前DO控制在42%、发酵52h后DO控制在8%,过程中以DO为控制指标,调整通气量、罐压及搅拌转速,并适当补入灭菌后新鲜培养基或无菌水。发酵过程中发酵52h前流加40%的氨水控制发酵液pH在6.5左右,流加氨水补充氮源的同时可以控制发酵液pH稳定,52h后停止流加氨水,进行缺氮培养,pH不再作控制。发酵至26h将发酵罐中发酵液按体积一分为二培养,一半发酵液留在主罐中继续培养,另一半发酵液通过压差法转移至无菌保压的副罐中培养,主副罐中分别补入适量灭菌后新鲜培养基或无菌水,分罐培养后主副罐通气量、罐压及搅拌转速均按溶氧调控策略作相应调整。发酵过程中检测发酵液葡萄糖浓度、pH、菌体生物量、粗油脂产量及DHA产量变化。培养96h后终止发酵,测定发酵液中生物量为142g/L,粗油脂产量为80.2g/L,DHA产量为41.2g/L,DHA生产率为10.3g/(L·d)。以下表14为发酵后所得混合油脂脂肪酸组成气相分析结果:表14:100m3发酵罐发酵后所得混合油脂脂肪酸组成脂肪酸组成含量%C12:00.45C14:04.86C16:015.06C16:11.65C18:01.72C18:11.56C20:46.35C20:51.59C22:515.36C22:651.4提取毛油实施例14取实施例5得到的DHA发酵液100L,经加热灭活处理后,用布料器将发酵液运至布料腔中,进行布料包裹,布料完毕后,进行一级压榨,采用逐步加压的方式,在设定的2h内达到设定的30MPa压力,保压2h到基本没有水滴流出。去掉一级压榨笼,换上二级压榨笼,推入二级压榨处,进行二级压榨,采用逐步加压的方式,在设定的2h内达到设定的100MPa压力,保压2h到基本没有油滴流出,收集压榨出来的DHA毛油,共得到DHA毛油6.8kg,发酵液至毛油收率82.3%。去掉二级压榨笼,将压完的微藻粕与滤布进行分离。实施例15取实施例5得到的DHA发酵液100L,经加热灭活处理后,用布料器将发酵液运至布料腔中,进行布料包裹,布料完毕后,进行一级压榨,采用逐步加压的方式,在设定的5h内达到设定的40MPa压力,保压4h到基本没有水滴流出。去掉一级压榨笼,换上二级压榨笼,推入二级压榨处,进行二级压榨,采用逐步加压的方式,在设定的5h内达到设定的150MPa压力,保压4h到基本没有油滴流出,收集压榨出来的DHA毛油,共得到DHA毛油7.3kg,发酵液至毛油收率88.4%。去掉二级压榨笼,将压完的微藻粕与滤布进行分离。实施例16取实施例5得到的DHA发酵液150L,经加热灭活处理后,采用蝶式离心机离心,去除离心轻液,得到95L浓缩后的发酵液,用布料器将浓缩后的发酵液运至布料腔中,进行布料包裹,布料完毕后,进行一级压榨,采用逐步加压的方式,在设定的5h内达到设定的40MPa压力,保压4h到基本没有水滴流出。去掉一级压榨笼,换上二级压榨笼,推入二级压榨处,进行二级压榨,采用逐步加压的方式,在设定的5h内达到设定的150MPa压力,保压4h到基本没有油滴流出,收集压榨出来的DHA毛油,共得到DHA毛油10.8kg,发酵液至毛油收率87.2%。去掉二级压榨笼,将压完的微藻粕与滤布进行分离。实施例17取实施例5得到的DHA发酵液300L,经加热灭活处理后,加入喷雾干燥器中,设定喷雾压力5MPa,进风温度180℃,出风温度80℃,喷雾干燥成粉末,得到DHA微藻粉52.5kg。DHA微藻粉运至布料腔中,进行布料包裹,布料完毕后,进行柔性压榨压榨,采用逐步加压的方式,在设定的2h内达到设定的100MPa压力,保压2h到基本没有油滴流出,收集压榨出来的DHA毛油,共得到DHA毛油22.1kg,发酵液至毛油收率89.2%。实施例18取实施例5得到的DHA发酵液300L,经加热灭活处理后,加入喷雾干燥器中,设定喷雾压力6MPa,进风温度200℃,出风温度100℃,喷雾干燥成粉末,得到DHA微藻粉51.0kg。DHA微藻粉运至布料腔中,进行布料包裹,布料完毕后,进行柔性压榨压榨,采用逐步加压的方式,在设定的4h内达到设定的150MPa压力,保压4h到基本没有油滴流出,收集压榨出来的DHA毛油,共得到DHA毛油22.8kg,发酵液至毛油收率92.0%。实施例19取实施例5得到的DHA发酵液300L,经加热灭活处理后,采用蝶式离心机离心,去除离心轻液,得到200L浓缩后的发酵液,加入喷雾干燥器中,设定喷雾压力8MPa,进风温度220℃,出风温度110℃,喷雾干燥成粉末,得到DHA微藻粉47.5kg。DHA微藻粉运至布料腔中,进行布料包裹,布料完毕后,进行柔性压榨压榨,采用逐步加压的方式,在设定的4h内达到设定的150MPa压力,保压4h到基本没有油滴流出,收集压榨出来的DHA毛油,共得到DHA毛油23.3kg,发酵液至毛油收率94.0%。对比例1取实施例5得到的DHA发酵液300L,经加热灭活处理后,采用蝶式离心机离心,去除离心轻液,得到200L浓缩后的发酵液,加入喷雾干燥器中,设定喷雾压力8MPa,进风温度220℃,出风温度110℃,喷雾干燥成粉末,得到DHA微藻粉47.8kg。双螺杆压榨机先预热至80℃,将DHA微藻粉加入双螺杆压榨机中榨油,得到DHA毛油11.6kg,发酵液至毛油收率46.81%。毛油精炼实施例20取10kg实施例14、15、16合并所得的DHA毛油,按水化、脱色、分子蒸馏步骤进行精炼。水化:10kgDHA毛油,升温至至75℃,加入1kg温度为80℃的纯化水,搅拌30min,搅拌速度30转/min,静置2h,分去下层,得到水化油9.75kg。脱色:水化油升温至100℃,控制真空度-0.075MPa,真空脱水1h,然后降温至70℃,加入脱色剂(191g活性炭和286g活性白土),搅拌脱色0.5h,停止搅拌,过滤去除脱色剂,得到脱色油9.30kg。分子蒸馏:脱色油进入三级分子蒸馏,控制第一级真空度90Pa左右、温度160℃,去除第一级的轻组分,重组分进入第二级分子蒸馏,控制二级真空度40Pa左右、温度200℃,去除第二级轻组分,重组分进入第三级分子蒸馏,控制第三级真空度3Pa左右、温度220℃,去除第三级轻组分,收集重组分,脱臭完毕,降温至30℃,添加抗氧化剂,包装,得到DHA成品油9.10kg,检验结果见表15。表15:DHA成品油检验结果实施例21取10kg实施例14、15、16合并所得的DHA毛油,按水化、脱色、分子蒸馏步骤进行精炼。水化:10kgDHA毛油,升温至至85℃,加入1kg温度为90℃的纯化水,搅拌15min,搅拌速度90转/min,静置4h,分去下层,得到水化油9.70kg。脱色:水化油升温至110℃,控制真空度-0.075MPa,真空脱水0.5h,然后降温至80℃,加入脱色剂(192g活性炭和288g活性白土),搅拌脱色1h,停止搅拌,过滤去除脱色剂,得到脱色油9.31kg。分子蒸馏:脱色油进入三级分子蒸馏,控制第一级真空度90Pa左右、温度200℃,去除第一级的轻组分,重组分进入第二级分子蒸馏,控制二级真空度40Pa左右、温度220℃,去除第二级轻组分,重组分进入第三级分子蒸馏,控制第三级真空度3Pa左右、温度250℃,去除第三级轻组分,收集重组分,分子蒸馏完毕,降温至30℃,添加抗氧化剂,包装,得到DHA成品油9.03kg,检验结果见表16。表16:DHA成品油检验结果实施例22取10kg实施例17、18、19合并所得的DHA毛油,按实施例20的精炼方法进行精炼,得到DHA成品油9.13kg,检验结果见表17。表17:DHA成品油检验结果实施例23取10kg实施例17、18、19合并所得的DHA毛油,按实施例21的精炼方法进行精炼,得到DHA成品油9.08kg,检验结果见表18。表18:DHA成品油检验结果对比例2取10kg实施例17、18、19合并所得的DHA毛油,按传统精炼方法即水化、碱炼、脱色、脱臭步骤进行精炼。水化:10kgDHA毛油,升温至至85℃,加入1kg温度为90℃的纯化水,搅拌15min,搅拌速度90转/min,静置4h,分去下层,得到水化油9.71kg。碱炼:水化油保温在75℃,加入1L浓度10%(质量分数)的NaOH溶液,搅拌30min,搅拌速度30转/min,静置4h,分离掉皂脚,得到碱炼油,碱炼油搅拌情况下喷洒入油重10%的80℃纯化水进行水洗,加水时间控制在10-30min,加完水后采用静置2h,分离水层,重复洗涤2次,得到碱炼油8.92kg。脱色:碱炼油升温至110℃,控制真空度-0.075MPa,真空脱水0.5h,然后降温至80℃,加入脱色剂(186g活性炭和280g活性白土),搅拌脱色1h,停止搅拌,过滤去除脱色剂,得到脱色油8.49kg。脱臭:脱色油移入脱臭锅,通水蒸气进行脱臭,脱臭温度控制在185℃,真空度控制在600Pa以内,脱臭时间2h,脱臭完毕,停止通蒸汽,降温至30℃,添加抗氧化剂,包装,得到DHA成品油8.31kg,检测结果见表19。表19:DHA成品油检验结果当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1