一种利用联烯基醚、胺和二氧化碳合成氨基甲酸烯丙酯的方法与流程
本发明涉及有机合成、医药化工合成技术领域,具体涉及到一种利用联烯基醚、胺和二氧化碳合成氨基甲酸烯丙酯的方法。
背景技术:
二氧化碳是主要的温室气体,同时是地球上储量丰富、价廉易得的可再生一碳资源,具有无毒不燃、性质稳定、易于处理等诸多优点。发展二氧化碳为基本原料的新型原子经济性反应,并推动其产业化应用,将二氧化碳这一温室气体转化为各种有用的有机物质造福于全人类,替代日益枯竭且不可再生的石油资源,是极具挑战性和具有战略意义的研究课题,也是目前绿色化学与化工的研究热点及前沿之一(D’Alessandro,D.M.;Smit,B.;Long,J.R.Angew.Chem.Int.Ed.2010,49,6058-6082;Cokoja,M.;Bruckmeier,C.;Reger,B.;Herrmann,W.A.;Kühn,F.E.Angew.Chem.Int.Ed.2011,50,8510-8537;Sumida,K.;Rogow,D.L.;Mason,J.A.;McDonald,T.M.;Bloch,E.D.;Herm,Z.R.;Bae,T.-H.;Long,J.R.Chem.Rev.2012,112,724-781)。
而利用二氧化碳来合成氨基甲酸酯特别引人关注,因为氨基甲酸酯是一类具有重要生物和药物活性的化合物,不但存在于很多天然产物中,如很早就发现的毒扁豆碱(Espejo,V.R.;Li,X.-B.;Rainier,J.D.J.Am.Chem.Soc.2010,132,8282-8284)。氨基甲酸酯也被广泛用作农药,如杀虫剂克百威(杨华铮,邹小毛,朱有全等编。现代农药化学。北京:化学工业出版社,2013),已成为和有机磷、拟除虫菊酯并驾齐驱的三大类杀虫剂之一,年销售额超过10亿美元。另外,2013年美国处方药销售额前100强的品牌药物中有4个是氨基甲酸酯类化合物,包括Prezista,VESIcare,Lunesta及Xeloda,销售额都在7亿美元以上)。氨基甲酸酯类化合物也是一类重要的原料、中间体,在有机合成中具有重要的用途[19-22](Chedid,R.B.;Brümmer,M.;Wibbeling,B.;R.;Hoppe,D.Angew.Chem.Int.Ed.2007,46,3131-3134)。传统上氨基甲酸酯类物质是以光气或异氰酸酯类物质为原料合成,由于光气或异氰酸酯类物质高毒易爆,使用过程中容易引起的环境污染、严重威胁人的安全(Adams,P.;Baron,F.A.Chem.Rev.1965,65,567-602;Ozaki,S.Chem.Rev.1972,72,457-496)。实现二氧化碳合成氨基甲酸酯无疑具有重要意义。目前已经报道利用二氧化碳与胺及第三种组分反应可以得到相应的氨基甲酸酯类化合物(Peterson,S.L.;Stucka,S.M.;Dinsmore,C.J.Org.Lett.2010,12,1340-1343;Takeda,Y.;Okumura,S.;Tone,S.;Sasaki,I.;Minakata,S.Org.Lett.2012,14,4874-4877;McGhee,W.;Riley,D.;Christ,K.;Pan,Y.;Parnas,B.J.Org.Chem.1995,60,2820-2830)。我国同济大学的赵小明课题组之前报道了以铱和手性膦配体为催化体系催化伯胺、二氧化碳和烯基氯发生三组分反应,可以立体选择性地得到氨基甲酸酯类化合物(Zhang,M.;Zhao,X.;Zheng,S.Chem.Commun.2014,50,4455-4458)。我们之前也报道了分别利用磺酰腙、烃基硼酸、二芳基碘鎓盐与胺和二氧化碳反应合成氨基甲酸酯三种方法(专利CN 104355955A、CN 105037061 A、CN104829493 A;Xiong,W.;Qi,C.;Peng,Y.;Guo,T.;Jiang,H.Chem.Eur.J.2015,21,14314;Xiong,W.;Qi,C.;He,H.;Ouyang,L.;Zhang,M.;Jiang,H.Angew.Chem.Int.Ed.2015,54,3084)。
虽然利用二氧化碳合成氨基甲酸酯取得一定的进展,但还存在反应需要贵金属、条件苛刻、底物少、功能团容忍度差、产率或选择性低等不足。而利用二氧化碳合成氨基甲酸烯丙酯的方法除了上述伯胺、二氧化碳和烯基氯的三组分反应外,尚没有其他方法报道,而这类化合物在氨基甲酸酯类化合物中占有非常独特的地位,也是一类重要的有机合成中间体。因此,发展新型高效的氨基甲酸烯丙酯合成方法具有重要的理论意义及应用价值。
技术实现要素:
本发明提供了一种利用联烯基醚、胺和二氧化碳合成氨基甲酸烯丙酯的方法。
本发明的原理是以二氧化碳、胺和联烯基醚为原料,在银盐催化剂和碱促进剂作用下,联烯基醚中的烯基被活化,与二氧化碳和胺现场生成的氨基甲酸负离子发生亲核加成反应,从而达到一锅法合成氨基甲酸烯丙酯。
本发明的目的通过以下技术方案实现。
一种利用联烯基醚、胺和二氧化碳合成氨基甲酸烯丙酯的方法,在反应釜中,加入联烯基醚、胺和溶剂,再加入催化剂和促进剂,通入二氧化碳,在25~80℃搅拌反应6~24小时;反应结束后冷却至室温,反应液经过滤后减压蒸除溶剂得粗产物,再经柱层析提纯得到系列氨基甲酸烯丙酯化合物;所述催化剂为银盐;所述促进剂为吡啶、三乙胺、1,5,7-三氮杂二环[4.4.0]癸-5-烯、1,4-二氮杂二环[2.2.2]辛烷或1,8-二氮杂二环[5.4.0]十一碳-7-烯;
所述反应如下式所示:
其中,R1包括苯基,4-溴苯基,4-氯苯基,4-氟苯基,4-碘苯基,4-甲基苯基,4-异丙基苯基,4-硝基苯基,4-氰基苯基,3-溴苯基,3-氯苯基,3-氟苯基,3-碘苯基,2-碘苯基,2-溴苯基,2-氯苯基,2-氟苯基或2-联苯基;
R2和R3包括相同或不相同的甲基、乙基、丙基、正丁基、烯丙基、苄基或异丙基;或为四氢吡咯、哌啶、环己亚胺、吗啉、硫代吗啉或1-甲基哌嗪。
上述方法中,所述二氧化碳的压力为0.1~5MPa。
上述方法中,所述联烯基醚与胺的摩尔比为1:(1~5)。
上述方法中,所述银盐为碳酸银、醋酸银、硝酸银、氯化银、溴化银、氟化银或四氟硼酸银。
上述方法中,加入银盐的量与联烯基醚的摩尔比为(0.05~0.5):1。
上述方法中,加入促进剂的量与联烯基醚的摩尔比为(1~3):1。
上述方法中,所述溶剂为乙腈、四氢呋喃、N,N-二甲基甲酰胺、1,4-二氧六环或二甲基亚砜。
上述方法中,反应结束后采用柱层析将产物分离纯化;所述柱层析洗脱液为石油醚和乙酸乙酯的混合溶剂。所述柱层析洗脱液为石油醚和乙酸乙酯的混合溶剂,石油醚和乙酸乙酯之间的体积比为(10~30):1。
本发明相对于现有的技术具有以下优点及效果:
本发明利用联烯基醚、胺和二氧化碳合成氨基甲酸烯丙酯的方法操作安全简单,反应原子经济,反应条件温和,功能团适应性好,底物适应性广,环境友好,有利于工业生产,在有机合成、农药、医药及天然产物合成中具有良好的应用前景。
附图说明
图1是实施例9所得产物氢谱图;
图2是实施例9所得产物碳谱图;
图3是实施例10所得产物氢谱图;
图4是实施例10所得产物碳谱图;
图5是实施例11所得产物氢谱图;
图6是实施例11所得产物碳谱图;
图7是实施例12所得产物氢谱图;
图8是实施例12所得产物碳谱图;
图9是实施例13所得产物氢谱图;
图10是实施例13所得产物碳谱图;
图11是实施例14所得产物氢谱图;
图12是实施例14所得产物碳谱图;
图13是实施例15所得产物氢谱图;
图14是实施例15所得产物碳谱图;
图15是实施例16所得产物氢谱图;
图16是实施例16所得产物碳谱图;
图17是实施例17所得产物氢谱图;
图18是实施例17所得产物碳谱图;
图19是实施例18所得产物氢谱图;
图20是实施例18所得产物碳谱图。
具体实施方式
下面结合具体实施例和附图,对本发明作进一步的详细说明,但本发明的实施方式和适应的底物不限于此。
实施例1
在反应釜中加入0.25毫摩尔对溴苯基丙二烯基醚、0.5毫摩尔二乙胺、0.025毫摩尔醋酸银、0.75毫摩尔1,5,7-三氮杂二环[4.4.0]癸-5-烯(TBD),2毫升甲苯,充入0.1MPa的CO2,在40℃搅拌反应12小时后,停止加热及搅拌,冷却至室温。反应液用乙酸乙酯萃取,过滤,减压蒸馏去除溶剂,得到粗产物,再经过柱层析分离纯化,得到目标产物,所用的柱层析洗脱液为体积比为20:1的石油醚:乙酸乙酯混合溶剂,产率90%。
实施例2
在反应釜中加入0.25毫摩尔对溴苯基丙二烯基醚、0.5毫摩尔二乙胺、0.025毫摩尔醋酸银、0.75毫摩尔1,8-二氮杂二环[5.4.0]十一碳-7-烯(DBU),2毫升甲苯,充入0.1MPa的CO2,在40℃搅拌反应12小时后,停止加热及搅拌,冷却至室温。反应液用乙酸乙酯萃取,过滤,减压蒸馏去除溶剂,得到粗产物,再经过柱层析分离纯化,得到目标产物,所用的柱层析洗脱液为体积比为20:1的石油醚:乙酸乙酯混合溶剂,产率80%。
实施例3
在反应釜中加入0.25毫摩尔对溴苯基丙二烯基醚、0.5毫摩尔二乙胺、0.025毫摩尔醋酸银、0.75毫摩尔三乙胺,2毫升甲苯,充入5MPa的CO2,在80℃搅拌反应12小时后,停止加热及搅拌,冷却至室温,缓慢释放出没反应的二氧化碳至常压。反应液用乙酸乙酯萃取,过滤,减压蒸馏去除溶剂,得到粗产物,再经过柱层析分离纯化,得到目标产物,所用的柱层析洗脱液为体积比为20:1的石油醚:乙酸乙酯混合溶剂,产率78%。
实施例4
在反应釜中加入0.25毫摩尔对溴苯基丙二烯基醚、1.0毫摩尔二乙胺、0.05毫摩尔氟化银、0.75毫摩尔1,5,7-三氮杂二环[4.4.0]癸-5-烯(TBD),2毫升N,N-二甲基甲酰胺(DMF),充入2MPa的CO2,在60℃搅拌反应24小时后,停止加热及搅拌,冷却至室温,缓慢释放出没反应的二氧化碳至常压。反应液用乙酸乙酯萃取,过滤,减压蒸馏去除溶剂,得到粗产物,再经过柱层析分离纯化,得到目标产物,所用的柱层析洗脱液为体积比为20:1的石油醚:乙酸乙酯混合溶剂,产率40%。
实施例5
在反应釜中加入0.25毫摩尔对溴苯基丙二烯基醚、1.25毫摩尔二乙胺、0.025毫摩尔碳酸银、0.75毫摩尔1,5,7-三氮杂二环[4.4.0]癸-5-烯(TBD),2毫升甲苯,充入0.1MPa的CO2,在40℃搅拌反应6小时后,停止加热及搅拌,冷却至室温。反应液用乙酸乙酯萃取,过滤,减压蒸馏去除溶剂,得到粗产物,再经过柱层析分离纯化,得到目标产物,所用的柱层析洗脱液为体积比为20:1的石油醚:乙酸乙酯混合溶剂,产率48%。
实施例6
在反应釜中加入0.25毫摩尔对溴苯基丙二烯基醚、0.5毫摩尔二乙胺、0.025毫摩尔醋酸银、0.75毫摩尔1,5,7-三氮杂二环[4.4.0]癸-5-烯(TBD),2毫升四氢呋喃,充入0.1MPa的CO2,在40℃搅拌反应12小时后,停止加热及搅拌,冷却至室温。反应液用乙酸乙酯萃取,过滤,减压蒸馏去除溶剂,得到粗产物,再经过柱层析分离纯化,得到目标产物,所用的柱层析洗脱液为体积比为20:1的石油醚:乙酸乙酯混合溶剂,产率80%。
实施例7
在反应釜中加入0.25毫摩尔对溴苯基丙二烯基醚、0.5毫摩尔二乙胺、0.025毫摩尔醋酸银、0.75毫摩尔1,5,7-三氮杂二环[4.4.0]癸-5-烯(TBD),2毫升1,4-二氧六环,充入0.1MPa的CO2,在40℃搅拌反应12小时后,停止加热及搅拌,冷却至室温,用乙酸乙酯萃取反应液,减压旋蒸去除溶剂,再通过柱层析分离纯化,得到目标产物,所用的柱层析洗脱液为体积比为20:1的石油醚:乙酸乙酯混合溶剂,产率33%。
实施例8
在反应釜中加入0.25毫摩尔对溴苯基丙二烯基醚、0.25毫摩尔二乙胺、0.0125毫摩尔醋酸银、0.25毫摩尔1,5,7-三氮杂二环[4.4.0]癸-5-烯(TBD),2毫升四氢呋喃,充入0.5MPa的CO2,在40℃搅拌反应12小时后,停止加热及搅拌,冷却至室温,缓慢释放出没反应的二氧化碳至常压。反应液用乙酸乙酯萃取,过滤,减压蒸馏去除溶剂,得到粗产物,再经过柱层析分离纯化,得到目标产物,所用的柱层析洗脱液为体积比为20:1的石油醚:乙酸乙酯混合溶剂,产率22%。
实施例9
在反应釜中加入0.25毫摩尔对溴苯基丙二烯基醚、0.5毫摩尔二乙胺、0.025毫摩尔硝酸银、0.75毫摩尔1,5,7-三氮杂二环[4.4.0]癸-5-烯(TBD),2毫升甲苯,充入2MPa的CO2,在40℃搅拌反应24小时后,停止加热及搅拌,冷却至室温,缓慢释放出没反应的二氧化碳至常压。反应液用乙酸乙酯萃取,过滤,减压蒸馏去除溶剂,得到粗产物,再经过柱层析分离纯化,得到目标产物,所用的柱层析洗脱液为体积比为20:1的石油醚:乙酸乙酯混合溶剂,产率81%。
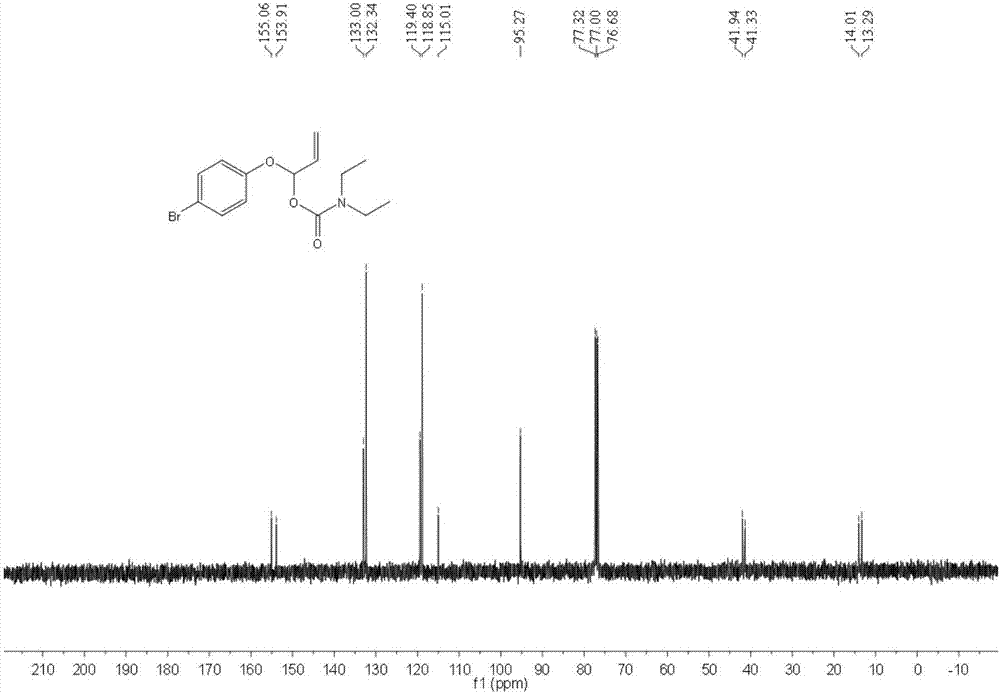
实施例9所得产物的结构表征数据如下所示(核磁谱图如图1和图2所示):
1H NMR(400MHz,CDCl3):δ=7.38(d,J=8.0Hz,2H),6.94(d,J=8.0Hz,2H),6.74(d,J=8.0Hz,1H),6.15–5.93(m,1H),5.58(d,J=20.0Hz,1H),5.41(d,J=12.0Hz,1H),3.31–3.23(m,4H),1.14–1.11(t,J=6.0Hz,3H),1.07–1.04(t,J=6.0Hz,3H).
13C NMR(100MHz,CDCl3):δ=155.1,153.9,133.0,132.3,119.4,118.9,115.0,95.3,41.9,41.3,14.0,13.3.
IR(KBr):3091,2978,1883,1703,1586,1480,1422,1362,1288,1126,1070,962,826,764,700,638,505(cm-1).
MS(EI):m/z(%)=327[M+],283,271,213,131,100(100),72,56.
HRMS-ESI(m/z):calcd for C14H18BrNNaO3(M+Na)+:350.0362,found:350.0368.
根据以上数据推断所得产物的结构如下所示:
实施例10
在反应釜中加入0.25毫摩尔对氟苯基丙二烯基醚、0.5毫摩尔二乙胺、0.025毫摩尔醋酸银、0.75毫摩尔1,5,7-三氮杂二环[4.4.0]癸-5-烯(TBD),2毫升甲苯,充入0.1MPa的CO2,在40℃搅拌反应12小时后,停止加热及搅拌,冷却至室温。反应液用乙酸乙酯萃取,过滤,减压蒸馏去除溶剂,得到粗产物,再经过柱层析分离纯化,得到目标产物,所用的柱层析洗脱液为体积比为20:1的石油醚:乙酸乙酯混合溶剂,产率52%。
实施例10所得产物的结构表征数据如下所示(核磁谱图如图3和图4所示):
1H NMR(400MHz,CDCl3):δ=7.02–6.93(m,4H),6.68(d,J=4.0Hz,1H),6.03–5.99(m,1H),5.56(d,J=16.0Hz,1H),5.39(d,J=12.0Hz,1H),3.29–3.21(m,4H),1.12–1.09(t,J=6.0Hz,3H),1.06–1.03(t,J=6.0Hz,3H).
13C NMR(100MHz,CDCl3):δ=146.4,139.3,127.4,123.1,121.9,35.1,34.7,13.6,9.1,7.2,6.3.
IR(KBr):3081,2979,1707,1506,1427,1276,1275,1214,1159,1056,974,835,773,685,513(cm-1).
MS(EI):m/z(%)=267[M+],222,211,151,100(100),72,55.
HRMS-ESI(m/z):calcd for C14H18FNNaO3(M+Na)+:290.1163,found:290.1168.
根据以上数据推断所得产物的结构如下所示:
实施例11
在反应釜中加入0.25毫摩尔对碘苯基丙二烯基醚、0.5毫摩尔二乙胺、0.025毫摩尔醋酸银、0.75毫摩尔1,5,7-三氮杂二环[4.4.0]癸-5-烯(TBD),2毫升甲苯,充入0.1MPa的CO2,在40℃搅拌反应12小时后,停止加热及搅拌,冷却至室温。反应液用乙酸乙酯萃取,过滤,减压蒸馏去除溶剂,得到粗产物,再经过柱层析分离纯化,得到目标产物,所用的柱层析洗脱液为体积比为20:1的石油醚:乙酸乙酯混合溶剂,产率42%。
实施例11所得产物的结构表征数据如下所示(核磁谱图如图5和图6所示):
1H NMR(400MHz,CDCl3):δ=7.56(d,J=8.0Hz,2H),6.83(d,J=8.0Hz,2H),6.74(d,J=4.0Hz,1H),6.07–5.99(m,1H),5.57(d,J=12.0Hz,1H),5.40(d,J=8.0Hz,1H),3.33–3.21(m,4H),1.14–1.10(t,J=8.0Hz,3H),1.06–1.03(t,J=6.0Hz,3H).
13C NMR(100MHz,CDCl3):δ=155.91,153.92,138.37,133.03,119.47,119.33,95.14,85.33,,42.00,41.39,14.09,13.38.
IR(KBr):3085,2977,1884,1706,1582,1477,1427,1274,1229,1160,1056,973,824,771,698,633,505(cm-1).
MS(EI):m/z(%)=375[M+],319,259,131,100(100),76,72.
HRMS-ESI(m/z):calcd for C14H18INNaO3(M+Na)+:398.0224,found:398.0227.
根据以上数据推断所得产物的结构如下所示:
实施例12
在反应釜中加入0.25毫摩尔对甲基苯基丙二烯基醚、0.5毫摩尔二乙胺、0.025毫摩尔醋酸银、0.75毫摩尔1,5,7-三氮杂二环[4.4.0]癸-5-烯(TBD),2毫升甲苯,充入0.1MPa的CO2,在40℃搅拌反应12小时后,停止加热及搅拌,冷却至室温。反应液用乙酸乙酯萃取,过滤,减压蒸馏去除溶剂,得到粗产物,再经过柱层析分离纯化,得到目标产物,所用的柱层析洗脱液为体积比为20:1的石油醚:乙酸乙酯混合溶剂,产率84%。
实施例12所得产物的结构表征数据如下所示(核磁谱图如图7和图8所示):
1H NMR(400MHz,CDCl3):δ=7.10(d,J=8.0Hz,2H),6.96(d,J=8.0Hz,2H),6.76(d,J=4.0Hz,1H),6.12–6.03(m,1H),5.60(d,J=20.0Hz,1H),5.41(d,J=12.0Hz,1H),3.33–3.26(m,4H),2.30(s,3H),1.16–1.12(t,J=8.0Hz,3H),1.09–1.06(t,J=6.0Hz,3H).
13C NMR(100MHz,CDCl3):δ=154.07,153.82,133.45,131.91,129.88,118.96,116.94,95.68,41.79,41.24,20.50,13.97,13.29.
IR(KBr):2978,2932,1706,1609,1512,1468,1426,1376,1276,1227,1161,1056,973,818,771,690,509(cm-1).
MS(EI):m/z(%)=291[M+],235,175,133,100(100),91,72.
HRMS-ESI(m/z):calcd for C15H21NNaO3(M+Na)+:286.1414,found:286.1419.
根据以上数据推断所得产物的结构如下所示:
实施例13
在反应釜中加入0.25毫摩尔对异丙基苯基丙二烯基醚、0.5毫摩尔二乙胺、0.025毫摩尔醋酸银、0.75毫摩尔1,5,7-三氮杂二环[4.4.0]癸-5-烯(TBD),2毫升甲苯,充入0.1MPa的CO2,在40℃搅拌反应12小时后,停止加热及搅拌,冷却至室温。反应液用乙酸乙酯萃取,过滤,减压蒸馏去除溶剂,得到粗产物,再经过柱层析分离纯化,得到目标产物,所用的柱层析洗脱液为体积比为20:1的石油醚:乙酸乙酯混合溶剂,产率51%。
实施例13所得产物的结构表征数据如下所示(核磁谱图如图9和图10所示):
1H NMR(400MHz,CDCl3):δ=7.16(d,J=8.0Hz,2H),6.70(d,J=8.0Hz,2H),6.78(d,J=4.0Hz,1H),6.12-6.04(m,1H),5.61(d,J=16.0Hz,1H),5.41(d,J=8.0Hz,1H),3.34–3.29(br,4H),2.92–2.85(m,1H),1,24(d,J=8.0Hz,6H),1.16–1.13(t,J=6.0Hz,3H),1.09–1.06(t,J=6.0Hz,3H)
13C NMR(100MHz,CDCl3):δ=154.11,154.06,143.01,133.51,127.27,118.97,116.83,115.06,95.73,41.81,41.27,33.30,24.19,24.08,13.97,13.32.
IR(KBr):2966,1707,1608,1511,1468,1427,1375,1275,1228,1162,1055,973,833,773,548cm-1.
MS(EI):m/z(%)=235[M+],135,100(100),72.
HRMS-ESI(m/z):calcd for C17H25NNaO3(M+Na)+:314.1727,found:314.1730.
根据以上数据推断所得产物的结构如下所示:
实施例14
在反应釜中加入0.25毫摩尔对溴苯基丙二烯基醚、0.5毫摩尔二丙胺、0.025毫摩尔醋酸银、0.75毫摩尔1,5,7-三氮杂二环[4.4.0]癸-5-烯(TBD),2毫升甲苯,充入0.1MPa的CO2,在40℃搅拌反应12小时后,停止加热及搅拌,冷却至室温。反应液用乙酸乙酯萃取,过滤,减压蒸馏去除溶剂,得到粗产物,再经过柱层析分离纯化,得到目标产物,所用的柱层析洗脱液为体积比为20:1的石油醚:乙酸乙酯混合溶剂,产率51%。
实施例14所得产物的结构表征数据如下所示(核磁谱图如图11和图12所示):
1H NMR(400MHz,CDCl3):δ=7.37(d,J=8.0Hz,2H),6.93(d,J=8.0Hz,2H),6.74(d,J=8.0Hz,1H),6.07–5.99(m,1H),5.57(d,J=20.0Hz,1H),5.40(d,J=12.0Hz,1H),3.22–3.12(m,4H),1.58–1.44(m,4H),0.89-0.79(m,6H).
13C NMR(100MHz,CDCl3):δ=155.09,154.39,133.02,132.33,119.36,118.85,115.01,95.30,49.16,48.56,21.73,21.10,11.09.
IR(KBr):2965,2876,1706,1586,1481,1424,1232,1159,1066,962,826,761,701,638,503cm-1.
MS(EI):m/z(%)=355[M+],313,299,282,211,131,128(100),86,75.
HRMS-ESI(m/z):calcd for C16H22BrNNaO3(M+Na)+:378.0675,found:378.0681.
根据以上数据推断所得产物的结构如下所示:
实施例15
在反应釜中加入0.25毫摩尔对溴苯基丙二烯基醚、0.5毫摩尔四氢吡咯、0.025毫摩尔醋酸银、0.75毫摩尔1,5,7-三氮杂二环[4.4.0]癸-5-烯(TBD),2毫升甲苯,充入0.1MPa的CO2,在40℃搅拌反应12小时后,停止加热及搅拌,冷却至室温。反应液用乙酸乙酯萃取,过滤,减压蒸馏去除溶剂,得到粗产物,再经过柱层析分离纯化,得到目标产物,所用的柱层析洗脱液为体积比为20:1的石油醚:乙酸乙酯混合溶剂,产率69%。
实施例15所得产物的结构表征数据如下所示(核磁谱图如图13和图14所示):
1H NMR(400MHz,CDCl3):δ=7.31(d,J=12.0Hz,2H),6.89(d,J=8.0Hz,2H),6.65(d,J=4.0Hz,1H),6.00-5.92(m,1H),5.40(d,J=16.0Hz,1H),5.33(d,J=12.0Hz,1H),3.34–3.22(m,4H),1.78(t,J=4.0Hz,4H).
13C NMR(100MHz,CDCl3):δ=155.00,152.85,133.00,132.31,119.39,118.90,114.97,95.11,46.16,45.77,25.52,24.75.
IR(KBr):2968,2880,1707,1586,1486,1419,1231,1176,1075,968,825,762,701,640,506cm-1.
MS(EI):m/z(%)=325[M+],282,269,211,131,110,98(100),55.
HRMS-ESI(m/z):calcd for C14H16BrNNaO3(M+Na)+:348.0206,found:348.0208.
根据以上数据推断所得产物的结构如下所示:
实施例16
在反应釜中加入0.25毫摩尔对溴苯基丙二烯基醚、0.5毫摩尔哌啶、0.025毫摩尔醋酸银、0.75毫摩尔1,5,7-三氮杂二环[4.4.0]癸-5-烯(TBD),2毫升甲苯,充入0.1MPa的CO2,在40℃搅拌反应12小时后,停止加热及搅拌,冷却至室温。反应液用乙酸乙酯萃取,过滤,减压蒸馏去除溶剂,得到粗产物,再经过柱层析分离纯化,得到目标产物,所用的柱层析洗脱液为体积比为20:1的石油醚:乙酸乙酯混合溶剂,产率69%。
实施例16所得产物的结构表征数据如下所示(核磁谱图如图15和图16所示):
1H NMR(400MHz,CDCl3):δ=7.33–7.29(m,2H),6.88–6.84(m,2H),6.64(d,J=4.0Hz,1H),5.99-5.91(m,1H),5.49(d,J=20.0Hz,1H),5.33(d,J=12.0Hz,1H),3.34(s,4H),1.52–1.40(m,6H).
13C NMR(101MHz,CDCl3):δ=155.04,153.31,132.96,132.35,119.43,118.91,115.06,95.50,44.91,25.72,25.45,24.20.
IR(KBr):2968,2880,1710,1587,1486,1419,1231,1176,1075,968,825,762,701,641,506cm-1.
MS(EI):m/z(%)=340[M+],296,283,211,154,131,124,112(100),75,69.
HRMS-ESI(m/z):calcd for C15H18BrNNaO3(M+Na)+:362.0362,found:362.0371.
根据以上数据推断所得产物的结构如下所示:
实施例17
在反应釜中加入0.25毫摩尔对溴苯基丙二烯基醚、0.5毫摩尔二烯丙基胺、0.025毫摩尔醋酸银、0.75毫摩尔1,5,7-三氮杂二环[4.4.0]癸-5-烯(TBD),2毫升甲苯,充入0.1MPa的CO2,在40℃搅拌反应12小时后,停止加热及搅拌,冷却至室温。反应液用乙酸乙酯萃取,过滤,减压蒸馏去除溶剂,得到粗产物,再经过柱层析分离纯化,得到目标产物,所用的柱层析洗脱液为体积比为20:1的石油醚:乙酸乙酯混合溶剂,产率85%。
实施例17所得产物的结构表征数据如下所示(核磁谱图如图17和图18所示):
1H NMR(400MHz,CDCl3):δ=7.38(d,J=8.0Hz,2H),6.93(d,J=8.0Hz,2H),6.74(d,J=4.0Hz,1H),6.06–5.98(m,1H),5.80–5.63(m,2H),5.58(d,J=16Hz,1H),5.41(d,J=12.0Hz,1H),5.17–5.04(m,4H),3.88(s,2H),3.81(s,2H).
13C NMR(100MHz,CDCl3):δ=154.9,154.2,132.9,132.8,132.3,119.6,119.0,117.3,116.9,115.2,95.6,49.0,48.5.
IR(KBr):3082,2926,1707,1585,1482,1417,1347,1231,1065,937,826,764,712,636,505cm-1.
MS(EI):m/z(%)=351[M+],308,295,211,124(100),96,81.
HRMS-ESI(m/z):calcd for C16H18BrNNaO3(M+Na)+:374.0362,found:374.0366.
根据以上数据推断所得产物的结构如下所示:
实施例18
在反应釜中加入0.25毫摩尔对溴苯基丙二烯基醚、0.5毫摩尔二丁胺、0.025毫摩尔醋酸银、0.75毫摩尔1,5,7-三氮杂二环[4.4.0]癸-5-烯(TBD),2毫升甲苯,充入0.1MPa的CO2,在40℃搅拌反应12小时后,停止加热及搅拌,冷却至室温。反应液用乙酸乙酯萃取,过滤,减压蒸馏去除溶剂,得到粗产物,再经过柱层析分离纯化,得到目标产物,所用的柱层析洗脱液为体积比为20:1的石油醚:乙酸乙酯混合溶剂,产率70%。
实施例18所得产物的结构表征数据如下所示(核磁谱图如图19和图20所示):
1H NMR(400MHz,CDCl3):δ=7.40–7.28(m,2H),6.96–6.92(m,2H),6.76(d,J=8.0Hz,1H),6.08–6.00(m,1H),5.58(d,J=16Hz,1H),5.41(d,J=12Hz,1H),3.26–3.16(m,4H),1.55–1.37(m,4H),1.32–1.19(m,4H),0.93(t,J=8.0Hz,3H),0.85(t,J=6.0Hz,3H).
13C NMR(100MHz,CDCl3):δ=155.00,154.26,132.99,132.26,119.30,118.83,114.95,95.16,47.17,46.52,30.61,29.96,19.88,19.78,13.75,13.67.
IR(KBr):2965,2876,2868,1706,1586,1481,1424,1232,1159,1066,962,826,761,701,639,503cm-1.
MS(EI):m/z(%)=383[M+],339,327,296,211,156,132,100,75,57(100).
HRMS-ESI(m/z):calcd for C18H26BrNNaO3(M+Na)+:406.0988,found:406.0993.
根据以上数据推断所得产物的结构如下所示:
本发明的上述实施例仅仅是为清楚地说明本发明所作的举例,而并非是对本发明的实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动。这里无需也无法对所有的实施方式予以穷举。凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明权利要求的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!
- 工程化酮还原酶多肽及其用于制备(s)-3-(二甲胺基)-1-(噻吩-2-基)-1-丙醇的方法
- 植物生长调节剂对苯二甲酸双二乙胺基乙醇酯柠檬酸盐化合物及其制备方法
- N,n,n’-三甲基-n’-氨丙基双胺基乙基醚的制作方法
- 一种利用微反应装置制备二甲氨基乙基银杏内酯b的方法
- 一种反式-4-二甲胺基巴豆酸盐酸盐的制备方法
- 一种β-胺基乙基膦酰衍生物的制备方法
- Daphmalenine A的O-(二乙胺基)乙基衍生物在制备抗红细胞低下性贫血药物中的应用
- Daphmalenine A的O-(二乙胺基)乙基衍生物在制备预防或治疗胰腺纤维化药物中的应用
- Daphmalenine A的O-(二乙胺基)乙基衍生物在制备升高白细胞的药物中的应用
- Daphmalenine A的O-(二乙胺基)乙基衍生物在制备抗肝纤维化药物中的应用