产桉叶油素的环纹炭团菌菌株及其应用的制作方法
本发明涉及一株分离的能够产生桉叶油素的环纹炭团菌(Annulohypoxylon)菌株,本发明还涉及所述菌株在生产桉叶油素中的应用,属于产桉叶油素菌株的分离及应用领域。
背景技术:
生物质能因其可再生、可循环、来源广泛、效益显著等特征而成为替代化石能源的主要选择。许多国家对生物质进行处理作为生物燃料利用方式的研究逐渐深入,其中最直接的是将植物油用于柴油机上,其热效率可接近矿质柴油。如果将植物油等进行单酯化处理,使其成为单酯类,会更适合于在内燃机上使用。其中,桉叶油素(1,8-cineole,C10H18O)是一种辛烷衍生单萜类化合物,无色液体,有类似樟脑气味。这种油即为“生物柴油”,目前在许多国家已经商品化生产。中国也有人对桉叶油素作为燃料进行研究分析。肖正春等(肖正春,张卫明,张广伦,等.生物柴油植物桉树类叶油的开发利用[J].中国野生植物资源,2008,27(2):19-20.)证明桉叶油素在内燃机中可以很好的使用,并发现蓝桉和大叶桉如果人工栽培,加强管理,l株7-8年生树每年可砍伐400kg鲜枝叶用于蒸油,估计人工栽培lhm2桉树每年可产桉树油20-40吨。管朝旭等(管朝旭,施彬,曾德贤,等.史密斯桉无性系桉叶出油率及成分分析[J].桉树科技,2013(4):15-18.)对中国的史密斯桉无性系桉叶具有燃料性质的桉叶油素的产量进行分析,最高产量为2.92%。
近些年来,如炭团菌(Hypoxylon sp.),茎点霉(Phoma sp.)和多节孢属真菌(Nodulisporium sp.)等真菌的挥发性代谢产物中都含有桉叶油素,这是除植物组织以外桉叶油素的另一种新的生物来源。其中,Tomsheck在2010年发表的文章中提及的炭团菌(Hypoxylon sp),在PDA上培养6天时产生的1,8-cineole为总的挥发性产物的0.5%,即为0.725ppmv(Tomsheck A R,Strobel G A,Booth E,et al.Hypoxylon sp.an Endophyte of Persea indica,Producing 1,8-Cineole and Other Bioactive Volatiles with Fuel Potential[J].Microbial Ecology,2010,60(4):903-14.)。
桉叶油素还具有燃料添加剂的潜在价值,作为乙醇汽油混合燃料的添加剂,可以提高辛烷值,这样就弥补了乙醇的能量密度差的问题;桉叶油素与其他未经酯化处理的植物油脂相比,直接作为内燃机燃料使用有很大优势,即使全部使用1,8-cineole也是可行的。相对于以大体积的粮食谷物为原料的生物质能而言,以农林废弃物为基质产生具有燃料潜能物质的微生物更有利用前景。但是,并不是所有能产生桉叶油素的菌株都能很好的利用纤维素基质,已有研究表明将纤维素降解基因克隆到菌株内从而可以很好地降解利用纤维素基质。
因此,分离出新的能够产生桉叶油素的真菌,利用其挥发性产物以及通过研究该类菌株产生桉叶油素的基因及其表达,利用遗传改良手段优化菌株等,将对第二代生物质能源转化利用具有非常重要的推动意义。
技术实现要素:
本发明所要解决的第一个技术问题是提供一株分离的产桉叶油素的环纹炭团菌菌株;
本发明所要解决的第二个技术问题是将所述环纹炭团菌菌株应用于生产桉叶油素。
为解决上述技术问题,本发明所采取的技术方案是:
本发明从海南尖峰岭樟科植物树枝中分离、纯化得到一株菌株,通过对该菌株4个基因位点(包括ITS、Actin、β-tubulin和EF-1α)的PCR序列在NCBI中blast的结果,确定了该菌株的OTU种为Annulohypoxylon。本发明将分离的菌株命名为环纹炭团菌菌株FPYF3050(Annulohypoxylon sp.FPYF3050)。
本发明通过GC-MS对该环纹炭团菌菌株(Annulohypoxylon sp.FPYF3050)的挥发性产物进行定性分析,结果表明该环纹炭团菌菌株能够产生2种特殊挥发性成分,分别为桉叶油素(1,8-cineole)和3-甲基-1-丁醇(1-Butanol,3-methyl)。本发明进一步对挥发性成分定量分析的结果表明,该环纹炭团菌菌株在生长6天时产生桉叶油素(1,8-cineole)为0.764ppmv。
本发明将分离的环纹炭团菌菌株FPYF3050(Annulohypoxylon sp.FPYF3050)提交专利认可的机构进行保藏,其微生物保藏编号为:CGMCC No.12771;分类命名为:炭团菌Annulohypoxylon sp.。保藏单位:中国微生物菌种保藏管理委员会普通微生物中心;保藏时间是2016年07月07日;保藏地址:北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所。
本发明所分离的环纹炭团菌菌株(Annulohypoxylon sp.FPYF3050)能够在主要以农林废弃物为成分的培养基上进行扩大培养生产桉叶油素。
本发明进一步公开了一种利用所述的环纹炭团菌菌株(Annulohypoxylon sp.FPYF3050)生产桉叶油素的方法,包括以下步骤:(1)培养所述的环纹炭团菌菌株;(2)采用固相微萃取方法从菌株所产生的挥发性气体中萃取桉叶油素。
其中,步骤(1)培养环纹炭团菌菌株的培养基可以为PDA培养基,或者以农林废弃物的粉碎物作为主要成分的培养基;其中所述农林废弃物包括玉米秸秆、小麦秸秆、水稻秸秆、杨树木屑或松树木屑中的任意一种或多种,优选为杨树木屑。本发明对所述杨树木屑的杨树品种没有特殊限制。本发明所述的环纹炭团菌菌株在农林废弃物上能快速生长并产生桉叶油素。
步骤(1)所述培养的温度为室温,所述的室温可以为15-30℃,优选为25℃;所述培养的时间可以为24-240小时;优选的,所述培养的时间120h-240h,更优选为120h-168h。
步骤(2)所述萃取的时间可以为5-120min,优选为40-120min,更优选为60-120min,特别优选为60-90min,最优选为60min。
其中,所述的固相微萃取方法在室温下进行。所述固相微萃取方法所采用的萃取头可以为纤维萃取头,本发明对所述纤维萃取头的型号没有特殊限制。作为参考,所述纤维萃取头可以为50/30μm,DVB/CAR/PDMS,Supelco。
本发明通过在玉米秸秆,小麦秸秆,杨树木屑,水稻秸秆和松树木屑5种农林废弃物等天然木质纤维上接种所述的环纹炭团菌菌株(Annulohypoxylon sp.FPYF3050),通过GC-MS分析,最优的天然木质纤维为杨树木屑。
本发明对环纹炭团菌菌株(Annulohypoxylon sp.FPYF3050)不同培养时间下桉叶油素的产量变化分析结果表明,在培养24-240小时的范围内,环纹炭团菌菌株在培养120h-168h之间桉叶油素的产量达到最高。
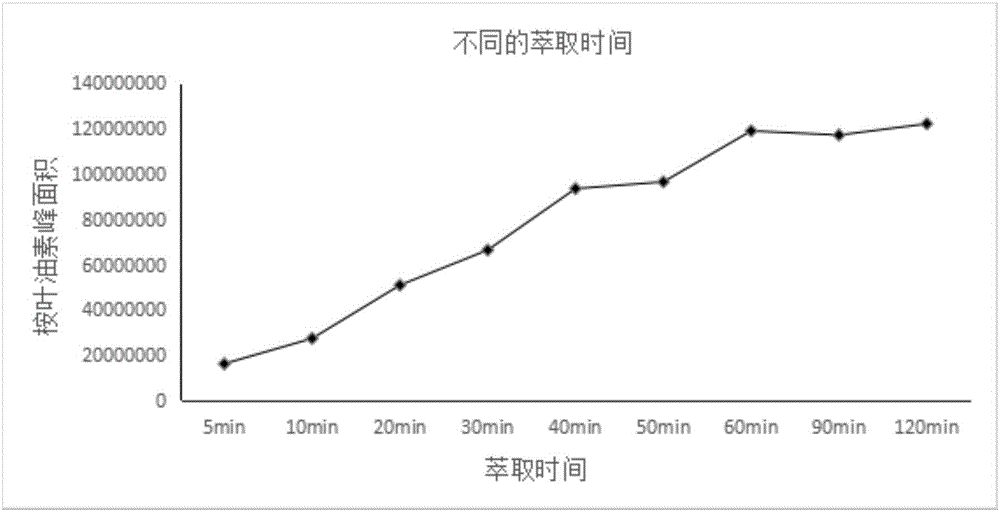
本发明在相同进样条件下,对环纹炭团菌菌株(Annulohypoxylon sp.FPYF3050)所产生挥发性物质的萃取时间进行优化筛选,分别采用5-120min等9种不同的萃取时间进行萃取,结果发现随着萃取时间的逐步升高,所检测到桉叶油素的产量逐渐提高;其中,当萃取时间为60min时,桉叶油素的产量达到最高,当萃取时间超过60min后,桉叶油素的产量不再增长并呈略微下降的趋势。因此,本发明的萃取时间最优选为60min。本发明通过对所分离的环纹炭团菌菌株的培养条件及挥发性产物的萃取时间进行优化,使所生产的桉叶油素量达到最高。
本发明技术方案与现有技术相比,具有以下有益效果:
本发明从海南尖峰岭樟科植物树枝中分离纯化得到一株环纹炭团菌菌株,该菌株的挥发性产物中含有桉叶油素,而且在培养6天时产生桉叶油素的浓度达到0.764ppmv。本发明所分离的环纹炭团菌菌株的桉叶油素产量高,该菌株能很好的降解利用纤维素基质,对于生物质能源转化利用将具有重要的应用前景。
附图说明
图1为环纹炭团菌菌株(Annulohypoxylon sp.FPYF3050)的特殊挥发性成分分析的质谱图;
图2为不同萃取时间下产生的桉叶油素的峰面积折线图;
图3为不同培养时间下1,8-cineole(桉叶油素)的产量变化;
图4为以As/Ai(标样面积/内标面积)为横坐标,Vs/Vi(标样体积/内标体积)为纵坐标绘制的标准曲线;
图5为环纹炭团菌菌株(Annulohypoxylon sp.FPYF3050)在杨树木屑培养下挥发性成分分析的质谱图。
具体实施方式
下面结合具体实施例来进一步描述本发明,本发明的优点和特点将会随着描述而更为清楚。但是应理解所述实施例仅是范例性的,不对本发明的范围构成任何限制。本领域技术人员应该理解的是,在不偏离本发明的精神和范围下可以对本发明技术方案的细节和形式进行修改或替换,但这些修改或替换均落入本发明的保护范围。
实施例1环纹炭团菌菌株(Annulohypoxylon sp.FPYF3050)的分离及鉴定
1、材料与方法
1.1菌株来源
海南尖峰岭樟科植物树枝。
1.2菌株的分离与鉴定
将采集到的树枝表皮去掉,剪成2mm2大小的组织块,用2%次氯酸钠和75%的乙醇对组织进行表面消毒,将已消毒的组织块放入无菌水中清洗后接种到提前准备好的水琼脂培养基中;将分离得到的菌株在PDA培养基上进行纯化培养,纯化后的菌株进行菌种保藏;将长有菌丝的培养基切成5mm2的小块,然后放入经过三次高压灭菌的盛有无菌水的冷藏管中,密封,放入4℃保存。
用改进后的CTAB法提取得到菌株的DNA:将培养基上的菌丝刮下来放入无菌的1.5mL离心管中放入-20℃冷藏,然后在拿出来解冻,反复冻融3-5次;用真菌通用引物ITS1/4(引物序列见White T J,Bruns T,Lee S,et al.Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics[J].PCR Protocols:a Guide to Methods and Applications,1990,18:315-322.)、EF1-983F/EF1-2218R(Rehner S A,Buckley E.A Beauveria phylogeny inferred from nuclear ITS and EF1-alpha sequences:evidence for cryptic diversification and links to Cordyceps teleomorphs.[J].Mycologia,2005,97(1):84-98.)、β-tubulin(O'Donnell K,Cigelnik E.Two divergent intragenomic rDNA ITS2types within a monophyletic lineage of the FungusFusariumAre nonorthologous[J].Molecular phylogenetics and evolution,1997,7(1):103-116.)、Actin-512F/783R(Glass N L,Donaldson G C.Development of primer sets designed for use with the PCR to amplify conserved genes from filamentous ascomycetes[J].Applied and Environmental Microbiology,1995,61(4):1323-1330.)4对引物来进行PCR扩增,将PCR产物送到测序公司测序;利用测序后得到的序列构建系统发育树,确定菌株的分类地位。
1.3挥发性产物定性分析
将菌种接种到PDA培养基上,每个菌种重复三次;放在恒温培养箱里,培养时间为5-10天。
GC-MS检测挥发性气体,用HP-5MS型毛细管柱(涂层:(5%苯基)-甲基聚硅氧烷,30.0m×0.25mm,涂层厚度:0.25μm)来分离挥发性气体,氮气为载气。毛细管柱升温程序如下:33℃维持2min,再以7℃/min的速率升温至220℃维持7min。质谱扫描速率为:5.0000scans/s。质谱范围41-560amu(原子质量单位,atomic mass unit)。通过比较质谱仪中NIST MS Search 2.0数据库来鉴定挥发性物质。
萃取步骤:萃取头老化(气相法),老化的温度分别为柱温150℃,后进样口250℃,前检测器200℃,老化时间10min;萃取:用电钻在培养皿的侧面打孔,放在支架上,将老化后的萃取针平行插入,将萃取头调出,萃取时间为40min;进样:当离子元温度为150℃,压力为70时就可以进样,将萃取头调回,从顶空瓶中取出,插入进样孔中,然后将萃取头调出,停留大概40s后拔出萃取头;将分析的结果保存。
1.4定量分析
1.4.1菌株培养
用打孔器取同心圆上的菌块(直径为0.5mm),接种在有10ml PDA(sigma)培养基9cm的培养皿中,在黑暗条件下25℃下培养5天。
1.4.2GC-FID定量分析参数设置
Agilent 7980GC-FID用HP-5MS型毛细管柱(涂层:(5%苯基)-甲基聚硅氧烷,30.0m×0.25mm,涂层厚度:0.25μm)来分离挥发性气体。汽化温度220℃恒压20psi,不分流。柱温35℃,保持2min,7℃/min升到220℃,保持7min;FID检测器温度250℃,H2:O2为40:400mL/min。
1.4.3标准曲线绘制
配置标样1,8-cineole(相对分子质量154.24g/mol,密度为0.9267g/ml)和内标linalool(相对分子质量154.25g/mol,密度为0.87g/ml)的混合液,用正己烷稀释成5个不同浓度,但内标浓度不变,如下表1。用GC-FID做标准曲线,取混合液,进样1μL,每个样重复三次。将实验得出每个样中的峰面积取均值,以As/Ai为横坐标,Vs/Vi为纵坐标绘制标准曲线,并计算相对校正因子F。
表1 待测混合液的稀释浓度
1.4.4测定样品中1,8-cineole(桉叶油素)的含量
用电钻在有样品菌株的培养皿侧面打孔,取浓度为0.0005μL/μL的linalool 1μL注射进培养皿中,用封口膜封好口,将加入内标的培养皿放入25℃恒温培养箱中1h,然后用纤维萃取头(50/30μm DVB/CAR/PDMS,Supelco)在室温下萃取60min,进样1min。每个菌株三个重复。根据绘制的标准曲线计算样品中1,8-cineole的含量。
2、实验结果
2.1分类地位鉴定
由于菌株不产生孢子,因此只能通过分子手段确定其分类地位。通过4个基因位点的PCR序列在NCBI中blast的结果如表2所示,确定了菌株的OTU种,为Annulohypoxylon。本发明将分离的菌株命名为环纹炭团菌菌株FPYF3050(Annulohypoxylon sp.FPYF3050)。
表2 测序结果
2.2挥发性成分定性分析
2.2.1定性分析
通过GC-MS分析了环纹炭团菌菌株FPYF3050的特殊挥发性成分,从质谱图(图1)中可以看到4种有效成分如表3,其中8.01和9.89这两个保留时间的成分也存在空白对照中。
表3 有效挥发性成分
注:*表示该成分在空白对照中有存在。
本发明将分离的环纹炭团菌菌株FPYF3050(Annulohypoxylon sp.FPYF3050),提交中国微生物菌种保藏管理委员会普通微生物中心进行保藏,其微生物保藏编号为:CGMCC No.12771。
2.2.2最优萃取时间
在相同的进样条件下,分别通过5min、10min、20min、30min、40min、50min、60min、90min、120min 9种不同的萃取时间进行了最优萃取时间筛选,结果见图2。
从图2的实验结果可见,分别采用5min、10min、20min、30min、40min、50min、60min、90min以及120min这9种不同的萃取时间进行萃取,随着萃取时间的逐步升高,所检测到的桉叶油素的产量逐渐提高,其中,经比较得出最优且适合的萃取时间为60min。
2.2.3不同培养时间下桉叶油素的产量变化
通过在最优的萃取时间检测了环纹炭团菌菌株FPYF3050在1到10天培养下1,8-cineole(桉叶油素)的产量变化,结果显示菌株的培养时间在120h和168h之间,1,8-cineole的产量达到最高,如图3所示。
2.3挥发性成分定量分析
2.3.1环纹炭团菌菌株FPYF3050产生气体的体积
培养皿的直径为8.4cm,高为1.1cm,PDA培养基占用的体积为10mL,计算得到除菌丝及培养基外剩余的空间体积约为50mL。
2.3.2标准曲线和相对校正因子的计算
通过GC-FID检测得到标样和内标的面积,已知加入标样和内标的质量,以As/Ai(标样面积/内标面积)为横坐标,Vs/Vi(标样体积/内标体积)为纵坐标绘制标准曲线,如图4所示。
R称为线性相关系数,R值为0.9995表示X和Y之间的线性相关程度为99.95%,说明该线性关系可以来对样品中的桉叶油素定量。
F校正因子计算公式为F=(Ai*Vs)/(As*Vi),本次检测中F值为0.85。
2.3.3菌株产生的1,8-cineole(桉叶油素)的含量
根据GC-FID中得到的线性回归方程和质量相对校正因子,通过线性回归方程得到质量再与相对校正因子相乘得到环纹炭团菌菌株FPYF3050在生长6天时产生的1,8-cineole(桉叶油素)的质量,再根据已知气体占用的体积计算得到环纹炭团菌菌株FPYF3050产生1,8-cineole的浓度为0.764ppmv。
试验例1环纹炭团菌菌株在农林废弃物培养下产生桉叶油素
本发明分别在5种农林废弃物,包括:玉米秸秆、小麦秸秆、杨树木屑、水稻秸秆和松树木屑等天然木质纤维上接种所述的环纹炭团菌菌株(Annulohypoxylon sp.FPYF3050,微生物保藏编号为:CGMCC No.12771),通过GC-MS分析,最优的天然木质纤维为杨树木屑(图5),本发明所分离的环纹炭团菌菌株在杨树木屑培养基上能够快速生长、桉叶油素产量高。
- 还没有人留言评论。精彩留言会获得点赞!