与水稻抗性淀粉相关的蛋白SSIIIa及其编码基因与应用的制作方法
本发明涉及一种蛋白的功能及其编码基因与应用,具体的涉及一种与水稻抗性淀粉相关的蛋白及其编码基因与应用
背景技术:
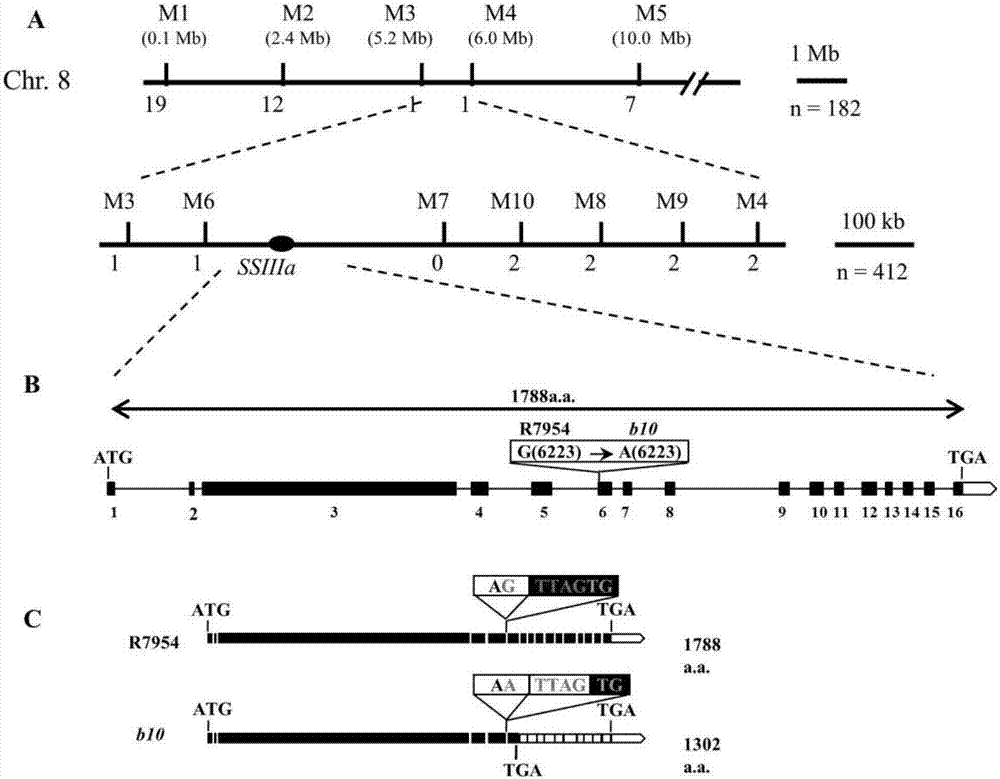
:抗性淀粉(resistantstarch)又称抗酶解淀粉,在人的小肠中不能被酶解,但在人的胃肠道结肠中可以与挥发性脂肪酸起发酵反应的一类淀粉结构。其本身仍然是淀粉,化学结构不同于纤维,但其性质类似溶解性纤维。这种淀粉较其他淀粉难降解,在体内消化缓慢,被吸收和进入血液都较缓慢。我们的食物中比例最大的组分是碳水化合物,碳水化合物又称多糖,人们食用碳水化合物后要在体内被胃酸及酶消化分解为单糖——葡萄糖以后才能吸收并进入血液,含有抗性淀粉食物由于消化吸收慢,食用后不致使血糖升高过快,即可以调节血糖水平,因此成为一种功能性淀粉,特别适宜糖尿病患者食用,有助于糖尿病人维持正常的血糖浓度,而患者食用抗性淀粉后不容易饥饿,减少饥饿感。抗性淀粉存在于某些天然食品中,如马铃薯、香蕉、大米等都含有抗性淀粉。每人每天摄入约20克的抗性淀粉就可产生显著保健功能,通常饮食谱摄入不足10克。世界上一半以上的人口以稻米为主食,普通熟米饭中抗性淀粉含量少于3%,栽培稻通过人工诱变,获得了米饭抗性淀粉含量高于10%的水稻品系。如果主食稻米含有足够的抗性淀粉,通过主食摄入功能食物,非常容易实现日常健康防御。所以水稻抗性淀粉合成的分子遗传机制的阐明与应用,实现优质抗性淀粉水稻的创造与生产应用,具有重大社会意义与商业价值潜力。现有技术中关于控制抗性淀粉合成的分子遗传机制尚不明确,关于控制抗性淀粉合成的相关蛋白的编码基因,严重制约了抗性淀粉在优质抗性淀粉水稻的创造与生产应用。技术实现要素:本发明提供了一种与植物抗性淀粉合成相关的蛋白,所述与植物抗性淀粉合成相关的蛋白是具有如下a)或b)的氨基酸序列的蛋白质:a)由序列表中seqidno:1所示的氨基酸序列组成的蛋白质;b)将序列表中seqidno:1的氨基酸序列经过一个或几个氨基酸的取代和/或缺失和/或添加,且与植物抗性淀粉含量相关的由a)衍生的蛋白质。本发明还提供了一种与植物抗性淀粉合成相关的蛋白的编码基因,所述编码基因编码为所述与植物抗性淀粉合成相关的蛋白。上述方案中优选的是,所述编码基因为如下a)或b)或c)的基因:a)其核苷酸序列如序列表中seqidno:2的自5′末端第1-14463位所示的dna分子;b)在严格条件下与a)所述的核苷酸序列杂交且编码所述与植物抗性淀粉合成相关的蛋白的dna分子;c)与a)所述的核苷酸序列具有90%以上的同源性且编码所述与植物抗性淀粉合成相关的蛋白的基因。以上任一方案中优选的是,所述编码基因为如下a)或b)或c)的基因:a)其核苷酸序列是序列表中的seqidno:3所示的dna分子;b)在严格条件下与a)所述的核苷酸序列杂交且编码所述与植物抗性淀粉合成相关的蛋白的dna分子;c)与a)所述的核苷酸序列具有90%以上的同源性且编码所述与植物抗性淀粉合成相关的蛋白的基因。本发明还提供了一种用于表达与植物抗性淀粉合成相关蛋白的表达盒,含有上述任一项中的与植物抗性淀粉合成相关的蛋白的编码基因。以上任一方案中优选的是,所述表达盒中所述编码基因的5’和/或3’端具有poly-arg、poly-his、flag、strep-tagii和c-myc中至少一种标签的编码基因。以上任一方案中优选的是,所述表达盒中所述编码基因的转录起始核苷酸前加上增强型、组成型、组织特异型或诱导型启动子中的一种或几种。以上任一方案中优选的是,所述表达盒中所述启动子为花椰菜花叶病毒(camv)35s启动子或泛素(ubiquitin)基因启动子(pubi)。以上任一方案中优选的是,所述表达盒还含有增强子,所述增强子为翻译增强子或转录增强子,所述增强子与编码序列的阅读框相同。以上任一方案中优选的是,所述增强子的区域是atg起始密码子或邻界区域起始密码子。以上任一方案中优选的是,表达盒的翻译起始区域来自转录起始区域或结构基因。以上任一方案中优选的是,所述表达盒还包含鉴定和/或筛选基因,所述鉴定和/或筛选基因包括以下基因的一种或几种:可产生颜色变化的酶和/或发光化合物的基因;具有抗性的抗生素标记物基因;抗化学试剂标记基因。以上任一方案中优选的是,所述可产生颜色变化的酶和/或发光化合物的基因为gus基因、gfp基因和萤光素酶基因中的一种或几种。以上任一方案中优选的是,所述具有抗性的抗生素标记物基因为庆大霉素标记物基因或卡那霉素标记物基因。以上任一方案中优选的是,所述抗化学试剂标记基因为抗除莠剂基因。本发明还提供了用于扩增与植物抗性淀粉合成相关的蛋白编码基因的引物对,所述引物对可用于扩增上述任一项与植物抗性淀粉合成相关蛋白的编码基因的全长或其任一段片段。本发明还提供了一种用于表达与植物抗性淀粉合成相关蛋白的重组表达载体,含有上述任一项与植物抗性淀粉合成相关蛋白的编码基因。本发明还提供了一种用于表达与植物抗性淀粉合成相关蛋白的重组表达载体,含有上述任一项所述用于表达与植物抗性淀粉合成相关蛋白的表达盒的基因。以上任一方案中优选的是,所述重组表达载体为在pcambia1300的多克隆位点间插入上述任一项与植物抗性淀粉合成相关蛋白的编码基因得到的重组表达载体。以上任一方案中优选的是,所述重组表达载体为在pcambia3301、pcambia1300、pbi121、pbin19、pcambia2301、pcambia1301-ubin或其它衍生植物表达载体中的一种载体的多克隆位点中插入上述任一项与植物抗性淀粉合成相关蛋白的编码基因得到的重组表达载体。本发明还提供了与植物抗性淀粉合成相关蛋白的编码基因在制备抗性淀粉合成相关的转基因植物中的应用,所述抗性淀粉合成相关的转基因植物含有上述任一项与植物抗性淀粉合成相关蛋白的编码基因。以上任一方案中优选的是,所述植物是双子叶植物或单子叶植物。以上任一方案中优选的是,所述单子叶植物是水稻。以上任一方案中优选的是,所述植物是高抗性水稻品系b10。本发明提供了一种培育含有上述任一项与植物抗性淀粉合成相关蛋白的编码基因的转基因植物的方法,包括将上述任一项与植物抗性淀粉合成相关蛋白的编码基因转入目的植物中以得到转基因植物的步骤。以上任一方案中优选的是,上述任一项与植物抗性淀粉合成相关蛋白的编码基因通过上述任一项重组表达载体转入所述目的植物。以上任一方案中优选的是,所述重组表达载体通过常规生物学方法转化到植物细胞或组织中。以上任一方案中优选的是,所述生物学方法通过以下方法完成转化:ti质粒介导的转化、ri质粒介导的转化、植物病毒载体介导的转化、直接dna转化、显微注射转化、电导转化或农杆菌介导的转化中的一种方法。以上任一方案中优选的是,所述植物是双子叶植株或单子叶植株。以上任一方案中优选的是,所述单子叶植物是水稻。以上任一方案中优选的是,所述植物是高抗性淀粉水稻品系b10。本发明还提供了一种培育转基因植物的方法,包括将干扰载体导入目的植物中以得到转基因植物的步骤,所述干扰载体是将序列表中seqidno:4所示的核苷酸序列和序列表中seqidno:5所示的核苷酸序列依次插入重组载体。以上任一方案中优选的是,所述干扰载体是将序列表中seqidno:4所示的核苷酸序列和序列表中seqidno:5所示的核苷酸序列依次插入ptck303载体的bamhi和kpni位点以及speⅰ和saci位点之间得到的重组载体。以上任一方案中优选的是,所述目的植物为双子叶植株或单子叶植株。以上任一方案中优选的是,所述目的植物为水稻。以上任一方案中优选的是,所述目的植物为常规籼稻品种r7954。以上任一方案中优选的是,seqidno:4和seqidno:5所示的核苷酸序列经全基因组比对分析确认在水稻基因组中无其它同源序列。本发明还提供了一种含有与植物抗性淀粉合成相关蛋白编码基因的重组菌,所述重组菌含有上述任一项与植物抗性淀粉合成相关蛋白的编码基因。本发明还提供了一种含有与植物抗性淀粉合成相关蛋白编码基因的转基因细胞系,所述转基因细胞系含有上述任一项与植物抗性淀粉合成相关蛋白的编码基因。本发明的目的是提供一种与植物抗性淀粉合成相关的蛋白及其编码基因。本发明所提供的与抗性淀粉合成相关的蛋白,名称为ssiiia(solublestarchsynthase),来源于水稻(oryzasatival.),是如下1)或2)的蛋白质:1)由序列表中seqidno:1所示的氨基酸序列组成的蛋白质;2)将序列表中seqidno:1的氨基酸序列经过一个或几个氨基酸的取代和/或缺失和/或添加与抗性淀粉合成相关的由1)衍生的蛋白质。为了使1)中的rsⅰ便于纯化,可在由序列表中seqno:1所示的氨基酸序列组成的蛋白质的氨基末端或羧基末端连接上如表1所示的标签。表1标签的序列上述2)中的ssiiia可人工合成,也可先合成其编码基因,再进行生物表达得到。上述2)中的ssiiia的编码基因可通过将序列表中seqidno:2自5′末端第1972位到第12795位碱基所示的dna序列中缺失或添加一个或几个氨基酸残基的密码子,和/或进行一个或几个碱基对的错义突变,和/或在其5′端和/或3′端连上表1所示的标签的编码序列得到。本发明还提供了上述与植物抗性淀粉相关蛋白的编码基因(命名为ssiiia基因)。在本发明的一实施例中,提供了如下a)或b)或c)的编码基因的基因:a)其核苷酸序列如序列表中seqidno.2的自5′末端第1-14463位所示的dna分子;b)在严格条件下与a)所述的核苷酸序列杂交且编码所述与植物抗性淀粉合成相关的蛋白的dna分子;c)与a)所述的核苷酸序列具有90%以上的同源性且编码所述与植物抗性淀粉合成相关的蛋白的基因。上述严格条件可为用0.1×sspe(或0.1×ssc),0.1%sds的溶液,在dna或者rna杂交实验中65℃下杂交并洗膜。在本发明的另一实施例中,提供了如下a)或b)或c)的编码基因:a)其核苷酸序列是序列表中的seqidno:3所示的dna分子;b)在严格条件下与a)所述的核苷酸序列杂交且编码所述与植物抗性淀粉合成相关的蛋白的dna分子;c)与a)所述的核苷酸序列具有90%以上的同源性且编码所述与植物抗性淀粉合成相关的蛋白的基因。序列表中的seqidno:3由5626个碱基组成,其开放阅读框架(orf)为自5′末端第1位到第5367位碱基,编码具有序列表中seqidno:1的氨基酸序列的ssiiia蛋白。上述严格条件可为用0.1×sspe(或0.1×ssc),0.1%sds的溶液,在dna或者rna杂交实验中65℃下杂交并洗膜。本发明提供了扩增上述ssiiia基因全长或其任一片段的引物对。本发明还提供了含有上述与植物抗性淀粉相关蛋白的编码基因的表达盒、重组载体、转基因细胞系和重组菌。可利用现有的植物表达载体构建含有ssiiia基因的重组表达载体。所述植物表达载体是双元农杆菌载体或可用于植物微弹轰击的载体,包括pcambia3301、pcambia1300、pbi121、pbin19、pcambia2301、pcambia1301-ubin或其它衍生植物表达载体中的一种。使用ssiiia基因构建重组表达载体时,可在其转录起始核苷酸前加上任何一种增强型、组成型、组织特异型或诱导型启动子,如花椰菜花叶病毒(camv)35s启动子、泛素(ubiquitin)基因启动子(pubi)等,它们可单独使用或与其它的植物启动子结合使用;此外,使用本发明的基因构建植物表达载体时,还可使用增强子,包括翻译增强子或转录增强子,这些增强子区域可以是atg起始密码子或邻界区域起始密码子等,但必需与编码序列的阅读框相同,以保证整个序列的正确翻译。所述翻译控制信号和起始密码子的来源是广泛的,可以是天然的,也可以是合成的。翻译起始区域可以来自转录起始区域或结构基因。为了便于对转基因植物细胞或植物进行鉴定及筛选,可对所用植物表达载体进行加工,如加入在植物中表达可产生颜色变化的酶或发光化合物的基因(gus基因、gfp基因、萤光素酶基因等)、具有抗性的抗生素标记物(庆大霉素标记物、卡那霉素标记物等)或是抗化学试剂标记基因(如抗除莠剂基因)等。所述重组表达载体具体可为在植物表达载体pcambia1300的多克隆位点间插入上述与抗性淀粉含量相关蛋白的编码基因得到的重组表达载体。本发明的另一个目的是提供一种培育转基因植物的方法。本发明所提供的培育转基因植物的方法,是将上述与抗性淀粉相关蛋白的编码基因ssiiia或基因组dna导入高抗性淀粉植物中,得到转基因植物;所述转基因植物与所述目的植物相比,抗性淀粉含量下降。所述与植物抗性淀粉含量相关蛋白的编码基因ssiiia是通过上述重组表达载体导入目的植物中的。携带有本发明的与植物抗性淀粉相关蛋白编码基因ssiiia的植物表达载体可通过ti质粒、ri质粒、植物病毒载体、直接dna转化、显微注射、电导、农杆菌介导等常规生物学方法转化到植物细胞或组织中。被转化的植物宿主(目的植物)为双子叶植物或单子叶植株,优选是水稻,更优选是高抗性淀粉水稻品系b10。本发明的又一目的在于提供一种培育转基因植物的方法。该方法是将干扰载体导入目的植物中,得到转基因植物;所述转基因植物与所述目的植物相比,抗性淀粉含量增加;所述干扰载体是将序列表中seqidno:4所示的核苷酸序列和序列表中seqidno:5所示的核苷酸序列依次插入ptck303载体的bamhi和kpni位点以及spei和saci位点之间得到的重组载体。该目的植物可以是双子叶植物或单子叶植株,优选是水稻,所述水稻优选是r7954。seqidno:4是seqidno:3第2325到2836bp片段。seqidno:5是seqidno:4的反向互补序列。seqidno:4和seqidno:5经全基因组比对分析确认在水稻基因组中无其它同源序列。seqidno:6为将序列表中seqidno:1的氨基酸序列经过一个或几个氨基酸的取代和/或缺失和/或添加,且与植物抗性淀粉含量相关的由seqidno:1所示的氨基酸序列组成的蛋白质所衍生的蛋白质,为与植物抗性淀粉合成相关的蛋白序列日本晴(nipponbare)的第二个转录本。seqidno:7为与序列表中seqidno:2的自5′末端第1-14463位所示的dna分子的核苷酸序列具有90%以上的同源性且编码与植物抗性淀粉合成相关的蛋白的基因,为rpbio-226gdna。在严格条件下与序列表中seqidno:2的自5′末端第1-14463位所示的dna分子所述的核苷酸序列杂交且编码与植物抗性淀粉合成相关的蛋白的dna分子为序列表中seqidno:2的自5′末端第1-14463位所示的dna分子核苷酸序列的互补链。seqidno:8为与序列表中的seqidno:3所示的dna分子的核苷酸序列具有90%以上的同源性且编码与植物抗性淀粉合成相关的蛋白的基因,为蛋白序列np的第二个转录本(r7954)。在严格条件下与序列表中的seqidno:3所示的dna分子所述的核苷酸序列杂交且编码与植物抗性淀粉合成相关的蛋白的dna分子为序列表中的seqidno:3所述的核苷酸序列的互补链。本发明根据qtl定位结果,对附近区域进行候选基因预测并在野生型r7954(公众可以从浙江大学获得,在文献jagricfoodchem2006,54(2)523-528.starchpropertiesofmutantricehighinresistantstarch中有公开)和高抗性淀粉材料b10间进行测序比对。结果发现,在高抗性淀粉材料中,基因ssiiia(loc_os08g09230)在第5个内含子的3’剪接位点ag突变成aa,该突变可能影响了ssiiia基因mrna剪接。深入分析发现,突变后第5内含子的原3’剪接位点后移到下一个最近的ag,形成新的剪接位点,这种剪接方式造成4个碱基的缺失,形成移码突变,导致翻译提前终止。来源于中花11(zh11)公众可以从华中农业大学国家植物基因研究中心nationalcenterofplantgeneresearchhuazhongagriculturaluniversity获得,在ricemutantdatabase(rmd)(http://signal.salk.edu/cgi-bin/ricege?job=text&type=tdna&query=rmd_04z11ix53)有公开)和dongjin(在t-dnainsertionalmutagenesisforfunctionalgenomicsinrice,theplantjournal200022(6):516-570有信息公开)t-dna插入突变体库中的ssiiiat-dna插入突变体,其抗性淀粉含量显著上升。综合以上信息,该基因确定为候选基因。该候选基因在ricegenomeannotationproject数据库内有对应的全长cdna序列。现已分离克隆了该控制胚乳抗性淀粉含量的基因,并且通过转基因功能互补实验验证了该基因的功能。实验证明本发明具有有益的技术效果:将本发明保护的基因在水稻中过量表达后,抗性淀粉含量下降;而将本发明保护的基因在水稻中失活或降低活性后,抗性淀粉含量升高,说明该基因可控制水稻胚乳抗性淀粉含量。因此,ssiiia基因为分子标记辅助育种及利用基因工程的方法培育高抗性淀粉含量的水稻品种,提供了有力的手段,具有重要的理论意义和巨大的应用潜力。附图说明图1水稻高抗性淀粉品系b10和常规籼稻品种r7954表型,图1a是r7954和b10的抗性淀粉含量比较,t检验,双星代表极显著差异;图1b是r7954和b10的糙米外观;图1c是胚乳淀粉颗粒的扫描电子显微镜观察。图2ssiiia基因的图位克隆,图2a是利用bc2f2进行qtl分析和定位图;标记下面的数字代表重组的个体;图2b是本发明克隆的ssiiia基因的结构示意图,黑色方框代表外显子,中间横线代表内含子。方框上面的碱基变化代表在b10材料中所发生的碱基突变。括号内的数字代表发生变化的碱基的位置,黑色方框下面的数字代表外显子序号。a.a.表示氨基酸残基。图2c是ssiiiacdna突变序列示意图,a.a.表示氨基酸残基。图3ssiiiacaps标记图示基因型和携带不同ssiiia等位基因单株的抗性淀粉含量,图3a是不同ssiiia等位基因的图示基因型;图3b是r7954/b10f2分离群体中携带不同ssiiia等位基因单株中抗性淀粉含量比较,tukey检验,图上不同字母表示存在显著差异;图3c是中花11/b10f2分离群体中携带ssiiiassiiia基因型单株中抗性淀粉含量,tukey检验,图上不同字母表示存在显著差异。图4中花11和dongjint-dna插入突变体库中ssiiiat-dna插入突变体图示基因型,图4a是ssiiiat-dna插入突变体中t-dna插入位置图示,黑色方框代表外显子,中间横线代表内含子。箭头代表引物结合位置和扩增方向,a.a.表示氨基酸残基。图4b是中花11来源ssiiiat-dna插入突变体基因型分析示意图;图4c是dongjin来源ssiiiat-dna插入突变体基因型分析示意图。图5ssiiiat-dna插入突变体表型分析示意图,图5a来源于中花11背景的ssiiiat-dna插入突变体抗性淀粉含量比较,tukey检验,图上不同字母表示存在显著差异;图5b来源于dongjin背景的ssiiiat-dna插入突变体抗性淀粉含量比较,tukey检验,图上不同字母表示存在显著差异;图5cssiiiat-dna插入突变体糙米外观和淀粉粒电子扫描图片。图6ssiiia:gssiiia载体图谱及不同载体转基因水稻表型及蛋白表达量分析,图6agssiii基因图谱;图6b通过rt-pcr检测ssiiia的表达量;图6c通过wester-blot检测ssiiia的表达量;图6d转基因苗胚乳中抗性淀粉含量。tukey检验,图上不同字母表示存在显著差异。图7转基因植物糙米外观和淀粉粒电子扫描图片。具体实施方式下面结合具体实施例对本发明作进一步说明,但本发明并不限于以下实施例。下述实施例中,如无特殊说明,均为常规方法。下述实施例中水稻是按照如下方法栽培得到的:(1)水稻材料的田间栽培:水稻种子在常温下水中浸种2天后,移入37℃培养间催芽48小时,然后将露白的种子播种在苗床上进行育秧,到4叶期时将水稻秧苗移栽入水田。实施例1、基因及其功能的确定将水稻(oryzasatival.)高抗性水稻品系b10的种子以及常规籼稻品种r7954的种子分别按照上述田间栽培方法进行栽培,植株形态如图6d所示。取叶片进行dna提取。水稻基因组dna的提取:采用改进的ctab方法(mouz,hey,daiy,etal.deficiencyinfattyacidsynthaseleadstoprematurecelldeathanddramaticalterationsinplantmorphology.theplantcell.2000,12,405-418.)从水稻叶片中提取基因组dna。取20mg水稻叶片,放入2mlpvc离心管中,加入6mm钢珠1枚,经液氮冷冻,迅速取出放入振荡研磨仪,在11000转/分下震动60秒,然后加入buffer提取dna,获得的dna沉淀溶解于100μlmqh2o中。按照如下步骤进行克隆:1、ssiiia基因的初步定位。利用b10和粳稻常规品种中花11构建f2分离群体,随机选择182个单株,分析单株基因型和抗性淀粉含量。将抗性淀粉基因初步定位于第8染色体短臂上0.8mb区间范围内,进一步扩大群体至412个单株,最终将抗性淀粉基因定位到456kb区间范围内,注释含有76个蛋白编码基因,可溶性淀粉合酶基因ssiiia(loc_os08g09230)位于该区间内,我们将淀粉合酶基因ssiiia作为抗性淀粉的候选基因。2、候选基因的鉴定和序列分析测序结果表明与野生型r7954相比,突变体b10中ssiiia存在单碱基变化。突变体b10中ssiiia在6223bp处由野生型的g突变成a(图2a)。野生型全基因序列分析表明,ssiiia由16个外显子和15内含子组成(图2a)。与野生型r7954相比突变体b10中ssiiia在第五内含子的3′剪接位点ag中g发生了转换,突变成a。该剪切位点发生突变可能会影响mrna的剪接。为了确定该剪接位点发生突变是否会影响mrna的剪接,我们分别提取r7954和b10花后10天幼穗中的rna,并反转录成cdna,通过pcr扩增后进行序列测定。cdna序列分析结果表明,在突变体b10中ssiiia基因的mrna剪接发生了变化,第五内含子的原3′剪接位点后移到下一个最近的ag形成新的剪接位点,这种剪接方式造成4个碱基的缺失(图2b),形成移码突变,并使翻译提前终止,形成1302个氨基酸(aa)的截短多肽,而正常的多肽应为1788个氨基酸(aa)的多肽(图2b)。根据野生型r7954和突变体b10之间突变位点设计ssiiiacaps标记,并鉴定r7954(ssiiiassiiia)/b10(ssiiiassiiia)、中花11(ssiiiassiiia)/b10(ssiiiassiiia)f2分离群体基因型,结果显示ssiiia位点携带b10(ssiiiassiiia)等位基因的单株抗性淀粉含量明显升高。同时,来源于中花11和dongjint-dna插入突变体库的ssiiiat-dna插入突变体抗性淀粉含量明显上升。综合以上信息,该基因确定为候选基因。实施例2、转基因植物的获得及其检测一、转基因植物的获得1、重组表达载体的构建1)基因的克隆利用表2中的gssiiia-1f/gssiiia-1r引物组合和gssiiia-2f/gssiiia-2r引物组合,从日本晴bac文库中扩增出了包含ssiiia基因的dna预备片段。将预备片段通过sali酶切、回收和连接,再通过kpni和sbfi酶切并进行回收,得到包含全长ssiiia的最终基因组dna片段,测序表明,其核苷酸序列如序列表中seqidno:2自5’端所示。seqidno:2所示的基因组dna中,第1972位到2073位为第1个外显子,第3019位到3082位为第2个外显子,第3169位到6402位为第3个外显子,第6586到6802位为第4个外显子,第7336位到7604位为第5个外显子,第8197位到8374位为第6个外显子,第8400位到8607位为第7个外显子,第9034位到9142位为第8个外显子,第10503位到10604位为第9个外显子,第10869位到11041位为第10个外显子,第11165位到11291位为第11个外显子,第11533位到11717位为第12个外显子,第11825位到11954位为第13个外显子,第12034位到12146位为第14个外显子,第12312位到12434位为15个外显子,第12663位到12795位为第16个外显子。seqidno:2第1972bp到12795bp所示的基因组dna对应的cdna的核苷酸序列如序列表中seqidno:3所示。seqidno:3由5626个碱基组成,其开放阅读框架(orf)为自5′末端第1位到第5367位碱基,编码具有序列表中seqidno:1的氨基酸序列的ssiiia蛋白。表2引物序列引物名称引物序列(5’-3’)gssiiia-1faaaggtacccgcatgcttcaccgccgctcgtctgssiiia-1rgcttcctcccgttctctgatctcgtggagssiiia-2fctgggtttttgctgacgggccacctgssiiia-2raaacctgcaggtcacggctcagatcgacgagtagacccagssiiia1f引物的5’端加kpni酶切位点,gssiiia2r引物的5’端加sbfi酶切位点。2)构建表达载体将步骤1)得到的包含全长ssiiia基因的最终基因组dna片段插入载体pcambia1300(购自cambia公司)的kpni和sbfi酶切位点之间,得到重组表达载体ssiiia:gssiiia(图6a),经验证载体构建正确。2、转基因植物的获得将质粒ssiiia:gssiiia通过电击的方法转入农杆菌(agrobacteriumtumefaciens)株系eha105(公众可从中国科学院遗传与发育生物学研究所获得,记载过该材料的非专利文献是linh,wangr,qianq,etal.dwarf27,aniron-containingproteinrequiredforthebiosynthesisofstrigolactones,regulatesricetillerbudoutgrowth.plantcell2009,21,1512-1525.)中,筛选得到含有重组质粒ssiiia:gssiiia的重组农杆菌菌株。将含有点突变基因ssiiia的材料b10的成熟种子脱壳灭菌,接种到诱导愈伤的培养基中,暗培养2周后,从盾片处生长出愈伤组织,挑选生长旺盛,颜色浅黄,比较紧实的胚性愈伤组织,用作转化的受体。用含有重组质粒ssiiia:gssiiia的重组农杆菌菌株侵染b10愈伤组织,在黑暗处25℃培养2天后,在含有40mg/l潮霉素的选择培养基上筛选抗性愈伤和转基因植株。将潮霉素抗性植株在阴凉处炼苗,后移栽到水田中,获得的转基因植株为t0代。收获t0代植株的种子,按照上述田间栽培的方法进行栽培,并通过常规分子检测,获得转ssiiia:gssiiia的t1代转基因植株。二、转基因植物的抗性淀粉含量检测1、转基因植物的抗性淀粉含量测定对转ssiiia:gssiiia的t1代转基因植株、b10、r7954对照植株和同一株系内假阳性单株对照进行抗性淀粉含量的统计,每种材料统计5株纯合阳性单株。结果如图6(图6中假阳性单株对照与b10对照表型一致,图中省略)所示,转ssiiia:gssiiia的t1代转基因植株与b10对照植株以及假阳性单株对照相比,其抗性淀粉含量降低(平均从5.69%降到1.76%)。2、通过western-blot检测ssiiia基因的蛋白表达量将his-ssiiia(ssiiia基因片段扩增引物见表3,核苷酸序列见序列表中seqidno:3的自5’端第1294-2016位所示)在蛋白表达菌株rosettade3(购自北京全式金公司)中重组表达后经过ni-ntaspinkits(购自qiagen公司)亲和纯化后对兔子进行免疫,制备多克隆抗体。抗原对应序列表中seqidno:1的432-672位氨基酸,经全基因组比对分析确认在水稻基因组中无其它蛋白同源序列。制备的多克隆抗体在使用proteina/g(购自thermoscientific公司)柱料进行亲和纯化后使用。利用强变性蛋白提取液(记载过该配方的非专利文献是croftsn,abeb,aiharas,etal.lackofstarchsynthaseiiiaandhighexpressionofgranule-boundstarchsynthaseisynergisticallyincreasetheapparentamylosecontentinriceendosperm.plantscience2012,193–194,62–69.)提取转基因植株和对照r7954、b10植株的植物总蛋白,总蛋白稀释40倍后用anti-ssiiia1:2000杂交检测。利用actin基因(act11,购自abmart公司)作为内参,结果显示转基因植株中ssiiia蛋白表达量增加(图6b)。表3引物序列引物名称引物序列(5’-3’)ssiiiaantifgaattcgaggttgatttgtttggaaatgcttcassiiiaantiraagcttcatgttttgctcaggtaaaccagc实施例3、转基因植物的获得及其检测一、转基因植物的获得1、全长cds的获得利用r7954花后15天的种子的cdna文库为模板,分别用表4中的引物对ssiiiaoe-1f/ssiiiaoe-1r和引物对ssiiiaoe-2f/ssiiiaoe-2r进行pcr扩增,扩增出的片段通过sali酶切,回收、连接后得到的片段进行测序,序列如序列表中seqidno:3。表4引物序列引物名称引物序列(5’-3’)ssiiiaoe-1faaaggtaccatggagatggctctccggcctcaaassiiiaoe-1rgcatgaaaatcttgtcgaccattgttgtssiiiaoe-2facaacaatggtcgacaagattttcatgcssiiiaoe-2raaacctaggctaaatcaagtattcataattaaaactgssiiiaoe-1f引物的5’端加kpni酶切位点,ssiiiaoe-2r引物的5’端加avrii酶切位点。2、超表达载体的构建将步骤1)得到的包含全长ssiiiacds片段经过中间载体t-vector克隆后插入带有ubiquitin启动子的载体ptck303(公众可从中国科学院遗传与发育生物学研究所获得,记载过该材料的非专利文献是wangz,chenc,xuy,etal.apracticalvectorforefficientknockdownofgeneexpressioninrice(oryzasatival.).plantmol.biol.rep.2004,22,409-417.)的kpni和saci酶切位点之间,得到超表达载体pubi:cssiiia,经验证载体构建正确。3、转基因植物的获得将质粒pubi:cssiiia通过电击的方法转入农杆菌(agrobacteriumtumefaciens)株系eha105中,筛选得到含有重组质粒pubi:cssiiia的重组农杆菌菌株。将含有点突变基因ssiiia的材料b10的成熟种子脱壳灭菌,接种到诱导愈伤的培养基中,暗培养2周后,从盾片处生长出愈伤组织,挑选生长旺盛,颜色浅黄,比较紧实的胚性愈伤组织,用作转化的受体。用含有重组质粒pubi:cssiiia的重组农杆菌菌株侵染b10愈伤组织,在黑暗处25℃培养2天后,在含有40mg/l潮霉素的选择培养基上筛选抗性愈伤和转基因植株。将潮霉素抗性植株在阴凉处炼苗,后移栽到水田中,获得的转基因植株为t0代。收获t0代植株的种子,按照上述田间栽培的方法进行栽培,并通过常规分子检测,获得转pubi:cssiiia的t1代转基因植株。二、转基因植物的检测1、转基因植物的抗性淀粉含量测定对转pubi:cssiiia的t1代转基因植株、b10、r7954对照植株和同一株系内假阳性单株对照进行抗性淀粉含量的统计,每种材料统计5株纯合阳性单株。结果如图6(图6中假阳性单株对照与b10对照表型一致,图中省略)所示,转pubi:cssiiia的t1代转基因植株与b10对照植株以及假阳性单株对照相比,其抗性淀粉含量降低(平均从5.69%降到1.56%)。2、通过western-blot检测ssiiia基因的蛋白表达量利用强变性蛋白提取液提取转基因植株和对照r7954、b10植株的植物总蛋白,总蛋白稀释40倍后用anti-ssiiia1:2000杂交检测。利用actin基因(act11,购自abmart公司)作为内参,结果显示转基因植株中ssiiia蛋白表达量增加(图6b)。实施例4、转基因植物的获得及其检测一、转基因植物的获得1、干扰片段的获得利用日本晴花后15天的种子的cdna文库为模板,用表5中的引物对ssiiiarnaif/ssiiiarnair进行pcr扩增,获得的产物进行测序。扩增得到的基因片段的核苷酸序列如序列表中seqidno:4和seqidno:5。表5引物序列ssiiiarnaif引物5'端同时加saci和bamhi接头,ssiiiarnair引物5'端同时加speⅰ和kpni接头。seqidno:4是seqidno:3第2325bp到2836bp片段,seqidno:5是seqidno:4的反向互补序列。seqidno:4和seqidno:5经全基因组比对分析确认在水稻基因组中无其它同源序列。2、干扰载体的构建将引物对ssiiiarnaif/ssiiiarnair扩增得到的部分产物用bamhi和kpni进行酶切,插入带有ubiquitin启动子的载体ptck303的bamhi和kpni位点,得到载体1;再将剩余的扩增产物用spei和saci进行酶切,插入到载体1的speⅰ和saci位点,得到重组表达载体ssiiiarnai(即干扰载体ssiiiarnai),插入片段表达后形成发夹结构。3、转基因植物的获得将干扰载体ssiiiarnai通过电击的方法转入农杆菌(agrobacteriumtumefaciens)株系eha105中,筛选得到含有干扰载体ssiiiarnai的重组农杆菌菌株。将野生型r7954的成熟种子脱壳灭菌,接种到诱导愈伤的培养基中,培养2周后,从盾片处生长出愈伤组织,挑选生长旺盛,颜色浅黄,比较紧实的胚性愈伤组织,用作转化的受体。用含有干扰载体ssiiiarnai的重组农杆菌菌株侵染r7954水稻愈伤组织。在黑暗处25℃培养2天后,在含有40mg/l潮霉素的选择培养基上筛选抗性愈伤和转基因植株。将潮霉素抗性植株在阴凉处炼苗,后移栽到水田中,获得的转基因植株为t0代,将t0代收的转基因种子进行种植,得到转ssiiiarnai的t1代转基因植株。二、转基因植物的检测1、转基因植物的抗性淀粉含量测定对转ssiiiarnai的t1代转基因植株、b10、r7954对照植株和同一株系内假阳性单株对照进行抗性淀粉含量的统计,每种材料统计5株纯合阳性单株。结果如图6(图6中假阳性单株对照与r7954对照表型一致,图中省略)所示,转ssiiiarnai的t1代转基因植株与r7954对照植株以及假阳性单株对照相比,其抗性淀粉含量升高(平均从1.74%上升到5.29%)。2、通过western-blot检测ssiiia基因的蛋白表达量利用强变性蛋白提取液提取转基因植株和对照r7954、b10植株的植物总蛋白,总蛋白稀释40倍后用anti-ssiiia1:2000杂交检测。利用actin基因(act11,购自abmart公司)作为内参,结果显示转基因植株中ssiiia表达量下降(图6b)。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1