无铜催化点击化学模块分子及其在药剂中的应用的制作方法
本发明涉及化学与制剂领域。具体涉及无铜催化点击反应模块分子的制备以及其在药物递送载体的构建和表面多功能修饰中的应用。
背景技术:
“点击化学”是有机化学中一类以温和高效著称的反应的总称,由2001年诺贝尔化学奖获得者、美国化学家Sharpless首次提出,近十几年来发展迅速,在许多领域都有广泛的应用,因其反应条件温和,选择性强以及可以在水相中反应等优点,近年来在医药领域受到越来越多的关注。
其中,以铜离子催化叠氮和末端炔进行Huisgen 1,3-偶极环加成是点击化学中的经典反应,且反应生成的三氮唑具有很好的化学稳定性,因而是一种常用的化学修饰方法。如发明人课题组在前期的研究中,基于铜催化的点击化学反应和层层组装的物理作用,提出了“协同组装”的策略(JACS,2015,137(18):6000-6010)。这种组装手段既避免了单一的化学修饰或物理组装存在的弊端,又同时提高了载体的稳定性和安全性,是一种安全高效的组装手段。但是,由于点击反应过程中引入了铜离子作为催化剂,残留铜离子的生理毒性会导致DNA的降解和蛋白质的变性,在很大程度上限制了该“协同组装”策略在医药领域的进一步发展。
为了进一步拓展“协同组装”策略在载体表面多功能修饰的应用,增加其临床应用的可能性,应用无铜催化的点击化学反应作为化学组装的工具将是一种切实可行的解决办法。无铜催化的点击反应是发生在环辛炔基团与叠氮基团之间,因此,制备两种可应用于递药载体系统的构建和表面修饰的点击反应模块分子是解决以上问题的关键。
技术实现要素:
本发明公开了一类氮杂二苯并环辛炔衍生物(I)、(II)、(III),
其中,R1代表:
R2、R5、R6各自独立的代表:
R2代表
R5代表
R6代表
R代表-(CH2)x-CH3,x=7-12、-(CH2)8-CH=CH-(CH2)8-CH3或-(CH2)8-CH=CH-CH2-CH=CH-(CH2)5-CH3;
R3代表-(CH2)x-CH3,x=7-19、-(CH2)8-CH=CH-(CH2)8-CH3或-(CH2)8-CH=CH-CH2-CH=CH-(CH2)5-CH3;
n=1或2。
氮杂二苯并环辛炔是以5-二苯并环庚烯酮为起始原料,经过肟化、贝克曼重排、酰胺还原、保护、加成、脱溴、脱保护等合成反应得到了最终产物氮杂二苯并环辛炔(ADIBO)。
合成环辛炔磷脂类衍生物使用的原料是ADIBO和合成磷脂。使用的合成磷脂包括亲水端为乙醇胺的二肉豆蔻酰基磷脂酰乙醇胺(DMPE)、二棕榈酰磷脂酰乙醇胺(DPPE)、二硬脂酰基磷脂酰乙醇胺(DSPE)、二油酰磷脂酰乙醇胺(DOPE)等。
合成环辛炔胆固醇使用的原料是ADIBO和胆固醇。
合成的环辛炔类脂类衍生物是一类全合成的材料。该材料由谷氨酸(或天冬氨酸)—赖氨酸(或甘氨酸、苯丙氨酸,组氨酸、精氨酸、丙氨酸,缬氨酸,亮氨酸,异亮氨酸,色氨酸,蛋氨酸,脯氨酸;丝氨酸,苏氨酸,天冬酰胺,谷氨酰胺,酪氨酸)与氮杂二苯并环辛炔组成亲水头基,由双链烷烃(正癸醇—正二十醇,油醇,亚油醇)作为疏水尾(结构式II);
或由赖氨酸(或甘氨酸、苯丙氨酸,组氨酸、精氨酸、丙氨酸,缬氨酸,亮氨酸,异亮氨酸,色氨酸,蛋氨酸,脯氨酸;丝氨酸,苏氨酸,天冬酰胺,谷氨酰胺,酪氨酸)与氮杂二苯并环辛炔组成亲水头基,由单链烷烃(正癸醇—正二十醇,油醇,亚油醇)作为疏水尾(结构式Ⅲ)。
本发明公开了一种药物脂质体,含有药物和脂质体基质,还含有作为修饰剂的本发明的氮杂二苯并环辛炔衍生物,该修饰剂插入到药物脂质体的脂质双分子层中,环辛炔基端位于脂质体表面,药物在脂质体中间。见图1中b。
本发明还公开了一类功能化的叠氮衍生物,该叠氮衍生物由小分子酸、透明质酸、聚乙二醇、聚乙烯吡咯烷酮链、奥曲肽、叶酸、转铁蛋白、细胞穿膜肽、荧光标记物Alexa Fluor、花青染料、香豆素6、荧光素、罗丹明、别藻蓝蛋白或色霉素叠氮化而得。部分衍生物结构如下:
优选将小分子酸、聚乙二醇、奥曲肽等进行叠氮化衍生。
一种功能型药物脂质体,由前述脂质体中修饰剂中的环辛炔基与上述任一叠氮衍生物通过化学键链接。其中修饰剂氮杂二苯并环辛炔衍生物中的环辛炔基与上述叠氮衍生物的叠氮基之间进行无铜催化的点击反应,在药物脂质体表面形成化学键。见图1中c。
本发明还基于合成的两类无铜催化点击反应的模块分子,公开了一种药物脂质体。本发明的环辛炔衍生物作为脂质体的修饰剂,可以与脂质体基质共同制备表面修饰有环辛炔基团的脂质体,并与基因治疗药物或化疗药物制备成药物脂质体。叠氮化衍生物则通过叠氮和环辛炔间张力推动的叠氮-炔环加成反应(SPAAC)修饰到药物脂质体的表面,从而提高药物和载体系统的体内外稳定性、赋予载体靶向性、促进细胞对载体的摄取以及实现载体可视监测等多种功能。
本发明的药物脂质体,其中修饰剂与磷脂的重量比优选1:1-1:10。
修饰剂与叠氮化衍生物重量比优选1:1-1:20。
药物与空白脂质体的重量比优选1:5-1:20。
药物优选自坦西莫斯、喜树碱类、紫杉醇、多西紫杉醇、藤黄酸、环孢素A、足叶乙苷、替尼泊甙、依托泊甙、长春酰胺、尼莫地平、硝苯地平、尼群地平、阿霉素、柔红霉素、丝裂霉素、甲氨喋呤、冬凌草素、三尖杉酯碱、高三尖杉酯碱、灯盏花素、银杏内酯、水飞蓟素、靛玉红、质粒DNA、寡核苷酸或siRNA。
本发明首先将环辛炔衍生物和脂质体基质通过薄膜分散法形成稳定的脂质体;再利用物理作用高效荷载基因治疗药物或化疗药物,进而形成稳定的药物脂质体;最后,通过无铜催化的点击化学反应,将具有不同功能的叠氮化衍生物按要求,通过化学键的形成修饰到药物脂质体表面。此方法避免了重金属铜离子的毒性,克服了有铜催化带来的DNA降解、蛋白质变性等缺点。在保证高效稳定载药的同时,获得多种预期功能;实现安全、稳定、高效的多功能药物递送系统的构建。示意图见图1。
本发明中环辛炔修饰剂的加入对阳离子载体基因药物包覆能力没有影响,见实施例11。PEG可以在阳离子载体表面形成水化层,克服其正电性带来的毒性,同时提高载体在循环系统中滞留时间。因而采用叠氮PEG与载体表面的环辛炔点击后,可以赋予纳米载体长循环功能;奥曲肽(Oct)是由8个氨基酸构成的环状多肽,是天然生长抑素的人工合成类似物,与生长抑素受体(SSTRs)有较强亲和力。SSTRs在乳腺、肾、结肠、卵巢以及脑膜等部位起源的肿瘤中都有过度表达,是一种重要的肿瘤表面标志物以及潜在的肿瘤治疗靶标。因而采用叠氮奥曲肽与载体表面的环辛炔点击后,使其能在SSTRs高度表达的肿瘤部位高效聚集,赋予纳米载体靶向功能。环辛炔修饰的载药阳离子脂质体可以同时完成两种叠氮模块分子的点击,见实施例13。化学组装过程中,载体中的siRNA没有被置换和破坏,见实施例14。表面带正电荷的纳米粒与细胞膜相互作用增强,有利于细胞摄取纳米粒;但带正电荷的纳米粒很快与血液中的蛋白质相互作用,使其在血循环中聚集被快速清除,难以到达靶部位。因而采用叠氮负电性酸与正电性载体表面的环辛炔点击后,可以完成电荷反转型纳米载体的构建,使纳米载体在血循环中保持惰性,在实体瘤中通过渗透增强和滞留效应(EPR)富集纳米粒,进而被肿瘤组织的弱酸性活化,表面转变为正电荷,增强与细胞膜的相互作用,提高细胞摄取和药物疗效,见实施例15。
本发明的点击反应模块分子可以分别用下列方法制备:
环辛炔磷脂衍生物
a.将ADIBO溶解于氯仿中,滴加三乙胺,室温反应1~3h后加入丁二酸酐,室温反应过夜。反应完成后,稀盐酸洗涤两次,饱和食盐水洗涤一次,无水硫酸钠干燥,浓缩。二氯甲烷/甲醇柱层析分离得到羧基端的ADIBO-COOH。
ADIBO-COOH的合成反应式1:
b.将ADIBO-COOH和N-羟基琥珀酰亚胺(NHS)溶解于氯仿中,搅拌一段时间后加入二环己基碳二亚胺(DCC),室温搅拌过夜。反应完成后,抽滤,滤液旋干。二氯甲烷/甲醇柱层析分离得到ADIBO的活化酯ADIBO-NHS。
ADIBO-NHS的合成反应式2:
c.将磷脂溶解于二氯甲烷(或氯仿,或乙酸乙酯)中,滴加三乙胺后室温搅拌一段时间后,加入ADIBO-NHS,搅拌过夜。二氯甲烷/甲醇柱层析分离得到环辛炔磷脂衍生物。
环辛炔磷脂衍生物的合成反应式3:
环辛炔胆固醇衍生物
a.将胆固醇与丁二酸酐溶于吡啶中,90℃回流10~24h,冷却至室温,加入稀盐酸,产生白色沉淀,过滤,滤饼水洗,然后用乙酸乙酯溶解,二氯甲烷/甲醇柱层析分离得到胆固醇琥珀酸单酯。
胆固醇琥珀酸单酯的合成反应式4:
b.将胆固醇琥珀酸单酯溶于二氯甲烷(或氯仿,或乙酸乙酯)中,室温搅拌,加入1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDCI)、1-羟基苯并三唑(HOBt)和三乙胺,1~3h后加入ADIBO,室温搅拌过夜,反应结束后用水洗,浓缩至干,二氯甲烷/甲醇柱层析分离得到环辛炔胆固醇衍生物。
环辛炔胆固醇衍生物的合成反应式5:
环辛炔类脂衍生物
a.将单羧基氨基酸或二元羧基氨基酸和对甲苯磺酸溶于甲苯中,回流1h~3h。加入脂肪醇,回流5h~15h。冷却至室温,减压蒸馏去除甲苯。用二氯甲烷(或三氯甲烷,或乙酸乙酯)溶解后,5%~15%碳酸氢钠溶液(或碳酸钠,或碳酸钾)、水洗涤,有机层用无水硫酸钠(或无水硫酸镁)干燥后浓缩,甲醇(或乙醇,或丙酮)重结晶,得到脂肪醇-二元羧基氨基酸(6)或脂肪醇-单羧基氨基酸(7),反应式如下:
脂肪醇-二元羧基氨基酸的合成反应式6:
脂肪醇-单羧基氨基酸的合成反应式7:
b.将叔丁氧羰基保护的单羧基氨基酸,N,N-二环己基碳二亚胺(DCC);N-羟基丁二酰亚胺(NHS)溶于N,N-二甲基甲酰胺(DMF)(或氯仿)中,室温搅拌1h~3h;将6或7和三乙胺溶于DMF(或氯仿)中,室温搅拌1h~3h后,加入上述混合溶液中,室温搅拌10h~24h。反应结束后,反应液加入水中,二氯甲烷(或氯仿,或乙酸乙酯)萃取产物,浓缩二氯甲烷层(或氯仿,或乙酸乙酯);乙酸乙酯(或丙酮)溶解,除去析出的DCU,重复此操作,直至DCU完全去除。甲醇(或乙醇,或丙酮)重结晶,得到脂肪醇-二元羧基氨基酸-单羧酸氨基酸(含保护基)(8)或脂肪醇-单羧基氨基酸-单羧酸氨基酸(含保护基)(9)。
脂肪醇-二元羧基氨基酸-单羧酸氨基酸(含保护基)的合成反应式8:
脂肪醇-单羧基氨基酸-单羧酸氨基酸(含保护基)的合成反应式9:
c.将8或9溶解在三氟醋酸和二氯甲烷混合溶液中,室温搅拌0.5h~4h;反应结束后,加入5%~15%碳酸氢钠溶液(或碳酸钠,或碳酸钾)调pH值至中性,收集有机层,无水硫酸钠(或无水硫酸镁)干燥后浓缩有机层,二氯甲烷/甲醇柱层析,得到脂肪醇-二元羧基氨基酸-单羧基氨基酸(10)或脂肪醇-单羧基氨基酸-单羧基氨基酸(11)。
脂肪醇-二元羧基氨基酸-单羧基氨基酸的合成反应式10:
脂肪醇-单羧基氨基酸-单羧基氨基酸的合成反应式11:
d.将10或11溶解于二氯甲烷(或氯仿,或乙酸乙酯)中,滴加三乙胺后室温搅拌10~30min后,加入ADIBO-NHS,搅拌过夜。稀盐酸洗涤后用二氯甲烷(或氯仿,或乙酸乙酯)萃取产物,浓缩二氯甲烷层(或氯仿,或乙酸乙酯),二氯甲烷/甲醇柱层析分离得到环辛炔衍生化的脂肪醇-二元羧基氨基酸-单羧基氨基酸(12)或脂肪醇-单羧基氨基酸-单羧基氨基酸(13)。
脂肪醇-二元羧基氨基酸-二元羧基氨基酸-环辛炔的合成反应式12:
脂肪醇-二元羧基氨基酸-单羧基氨基酸-环辛炔的合成反应式13:
叠氮小分子酸
将3-溴丙酸(或溴丁酸、溴戊酸、溴己酸等)和叠氮化钠溶解于乙腈中,90℃回流3~6h。反应完成后,旋干溶剂。加入乙酸乙酯。稀盐酸洗涤后用二氯甲烷(或氯仿,或乙酸乙酯)萃取产物,浓缩二氯甲烷层(或氯仿,或乙酸乙酯),得到叠氮丙酸(或叠氮丁酸、叠氮戊酸、叠氮己酸等)。
叠氮小分子酸的合成反应式14:
叠氮奥曲肽
a.将3-氯-1-丙醇与叠氮钠溶于水中,90℃搅拌20~24h,乙醚萃取产物,浓缩有机层,得到3-叠氮-1-丙醇。将3-叠氮-1-丙醇与戴斯马丁氧化剂(Dess-Martin Periodinane,DMP)。溶于二氯甲烷(或氯仿,或乙酸乙酯)中,室温,搅拌1~4h,过滤,滤液浓缩,柱层析纯化得到3-叠氮丙醛。
3-叠氮丙醛的合成反应式15:
b.将醋酸奥曲肽溶于醋酸-醋酸钠缓冲液中,加入氰基硼氢化钠,4℃搅拌,加入3-叠氮丙醛,反应10~15h,冻干得到叠氮奥曲肽。
叠氮奥曲肽的合成反应式16:
叠氮PEG
a.将mPEG2000溶于二氯甲烷(或氯仿,或乙酸乙酯)中,加入戴斯-马丁氧化剂,室温搅拌1~4h,过滤,滤液浓缩,硅胶柱层析纯化得到mPEG-乙醛。将mPEG-乙醛溶于甲醇中,加入2-羟乙基肼,室温搅拌过夜,浓缩至干,加少量甲醇溶解,滴加无水乙醚,产生白色沉淀,过滤,真空干燥,得到mPEG-hyd-ol。
mPEG-hyd-ol的合成反应式17:
b.将2-((2-叠氮乙基)氨基甲酰)苯甲酸(N3-HHPA)溶于二氯甲烷(或氯仿,或乙酸乙酯)中,加入1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDCI)和4-二甲氨基吡啶(DMAP),冰浴搅拌1~5h,加入mPEG-hyd-ol,室温搅拌过夜,浓缩,柱层析纯化,得到叠氮PEG。
叠氮PEG的合成反应式18:
附图说明
图1是本发明的物理-化学协同组装的药物递送系统
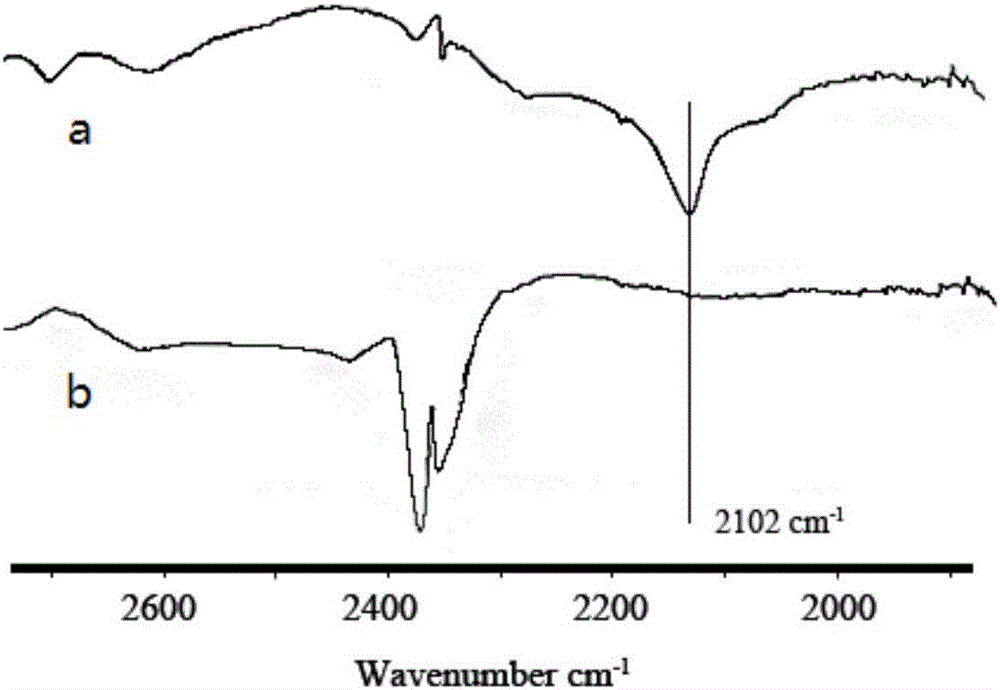
图2是点击反应前后空白纳米载体的红外图谱
图3是环辛炔修饰剂的加入对阳离子脂质体siRNA包载的影响
图4是点击反应前后叠氮化奥曲肽的高效液相色谱图
图5是点击反应前后载药纳米复合物的红外图谱
图6是点击反应对阳离子脂质体siRNA包覆的影响
图7是肿瘤细胞对点击后载药纳米复合物的摄取
具体实施方式
实施例1
氮杂二苯并环辛炔化二硬脂酰基磷脂酰乙醇胺的制备
将220mg氮杂二苯并环辛炔(ADIBO)溶解于15mL氯仿中,滴加0.2mL三乙胺,室温反应0.5h。加入105mg丁二酸酐,室温反应过夜。反应完成后,稀盐酸洗涤两次,饱和食盐水洗涤一次,无水硫酸钠干燥,浓缩有机层。二氯甲烷/甲醇柱层析,得到黄色油状物(ADIBO-COOH,224mg,74.7%)。将124mg ADIBO-COOH和37.9mg N-羟基琥珀酰亚胺(NHS)溶解于5mL氯仿中,加入60.3mg二环己基碳二亚胺(DCC),室温搅拌过夜。反应完成后,抽滤,除去产生的全称(DCU)沉淀,滤液旋干。二氯甲烷/甲醇柱层析,得到淡黄色固体(ADIBO-NHS,101mg,64.7%)。将74.8mg二硬脂酰基磷脂酰乙醇胺(DSPE)溶解于4mL氯仿中,滴加30.36mg三乙胺。室温搅拌1h后,加入47.34mg ADIBO-NHS,搅拌过夜。二氯甲烷/甲醇柱层析,得到白色固体(氮杂二苯并环辛炔化二硬脂酰基磷脂酰乙醇胺,72mg,72.1%)。
1H-NMR(CDCl3,300MHz,δppm):0.88(t,6H,CH3),1.29(m,52H,CH2),1.49,1.39(m,4H,CH2),1.68(m,4H,COCH2CH2),2.25(m,4H,CH2-O),2.46(m,4H,CH2CH2),2.6(m,2H,CHCO),3.47(m,2H,CH2-NH),3.48(m,2H,CH2CH2-NH),3.80,3.65(m,2H,CH2-O),3.93,3.86(m,2H,CH2),4.32,4.08(m,2H,CH2),5.20-5.16(m,1H,CH2-N),6.84(m,1H,CH2-N),7.40-7.27(m,7H,CH),7.67-7.65(m,7H,CH).
实施例2
氮杂二苯并环辛炔化胆固醇的制备
将5g胆固醇与1.55g丁二酸酐溶于90mL吡啶中,90℃回流24h,冷却至室温,加入稀盐酸(pH 1.0,100mL),产生白色沉淀,过滤,滤饼水洗后用乙酸乙酯溶复溶,二氯甲烷/甲醇柱层析,得到白色固体(胆固醇琥珀酸单酯,5.24g,85.3%)。将100mg胆固醇琥珀酸单酯溶于10mL氯仿中,室温搅拌,加入65mg 1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDCI)、46mg 1-羟基苯并三唑(HOBt)和150μL三乙胺,1h后加入62.5mg ADIBO,室温搅拌过夜,反应结束后用水洗(10mL×3),浓缩有机层,二氯甲烷/甲醇柱层析,得到淡黄色固体(氮杂二苯并环辛炔胆固醇,64mg,40.3%)。
1H-NMR(DMSO,300MHz,δppm):1.93-0.64(m,44H,CH2&COCH2CH2N),2.45-2.20(m,5H,COCH2CH2CO&COCH2CH2N),3.2-2.8(m,2H,COCH2CH2N),3.69(d,1H,CH2-N),4.36(m,1H,CHOCO),5.11(d,1H,CH2-N),5.36(d,1H,C=CH),7.45-7.07(m,7H,CH),7.72-7.65(d,1H,CH).
实施例3
氮杂二苯并环辛炔化赖氨酸-谷氨酸-十四醇的制备
将2.9g谷氨酸和2.22g对甲苯磺酸(TsOH)溶于50mL甲苯中,回流1h。加入5g正十四醇回流12h。反应结束后,减压蒸馏去除甲苯。浓缩物用35mL甲醇重结晶,将得到的白色粉末状固体溶解于适量二氯甲烷,用5%碳酸氢钠水溶液洗涤(10mL×2),再用适量的饱和食盐水洗涤,无水硫酸钠干燥,蒸除溶剂,得白色粉末状固体(十四醇-谷氨酸,TA2-Glu,3.42g,53.4%)。将3.6g N-α-(叔丁氧羰基)-N-ε-苄氧羰基-L-赖氨酸(Boc-Lys(Z)-OH);2.9g1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDCI);2.04g1-羟基苯并三氮唑(HOBt)溶于40mL氯仿中,室温搅拌3h;将5.1gTA2-Glu和3.9mL三乙胺溶于30mL氯仿中,室温搅拌1h后,加入上述混合溶液中,室温搅拌12h。反应结束后,反应液用水洗涤(50mL×2),再用适量饱和食盐水洗涤,浓缩有机层,二氯甲烷/甲醇柱层析,得到白色固体(十四醇-谷氨酸-N-α-(叔丁氧羰基)-N-ε-苄氧羰基-L-赖氨酸,TA2-Glu-(Boc)Lys(Z),2.75g,32.2%)。将2.75g TA2-Glu-(Boc)Lys(Z)溶解于55mL四氢呋喃和5.5mL无水甲醇的混合溶剂中,加入10%钯碳(Pt/C,275mg),氢气环境下,室温反应3h。反应完成后,抽滤除去钯碳,蒸去溶剂后,二氯甲烷/甲醇柱层析,得到透明蜡状固体(十四醇-谷氨酸-Nα-(叔丁氧羰基)-L-赖氨酸,TA2-Glu-(Boc)Lys,690mg,29.5%)。将690mg TA2-Glu-(Boc)Lys溶解于15mL氯仿中,滴加272mg三乙胺。室温搅拌5min后,加入425.3mg ADIBO-NHS,搅拌过夜。反应结束后,反应液用水洗涤(30mL×2),再用适量饱和食盐水洗涤,蒸去溶剂后,二氯甲烷/甲醇柱层析,得到黄色固体(十四醇-谷氨酸-Nα-(叔丁氧羰基)-L-赖氨酸-氮杂二苯并环辛炔,TA2-Glu-(Boc)Lys-ADIBO,336mg,33.2%)。将336mgTA2-Glu-(Boc)Lys-ADIBO溶解于17mL饱和HCl的乙酸乙酯溶液,0℃搅拌12h。反应完成后,使用5%碳酸氢钠溶液调节pH至7-8,乙酸乙酯萃取(30mL×3),合并有机层。二氯甲烷/甲醇柱层析,得到淡黄色固体(十四醇-谷氨酸-赖氨酸-氮杂二苯并环辛炔,TA2-Glu-Lys-ADIBO,82mg,26.9%)。
1H-NMR(CDCl3,300MHz,δppm):0.88(t,6H,CH3),1.26(m,42H,CH2),1.43(m,4H,CH2),1.63(m,4H,CH2),2.01,1.83(m,2H,CH2CH2NHCO),2.18(m,2H,CH2CHCO),2.19(m,2H,CH2CH2COO),2.39(m,2H,CH2COO),2.51(s,4H,NHCOCH2CH2CONH),2.72(m,2H,CH2CON),3.24(m,2H,CH2NHCO),3.42(m,1H,NHCHCO),3.50(m,CH2CH2NH),4.09(m,4H,CH2OCO),4.57(m,1H,NH),5.20-5.16(m,1H,CH2-N),6.84(m,1H,CH2-N),7.36-7.01(m,8H,CH),8.0(m,1H,NH).
实施例4
叠氮丙酸的制备
将0.77g3-溴丙酸溶解于4mL无水DMF中,加入0.65g叠氮化钠,100℃回流4h。
反应完成后,加入30mL水,用乙酸乙酯萃取多次,合并有机层。二氯甲烷/甲醇柱层析,得到棕黄色油状物(叠氮丙酸,419mg,72.4%)。
1H-NMR(CDCl3,300MHz,δppm):3.60(t,2HCH2-N3),2.66(t,2H,CH2-COOH).
实施例5
叠氮奥曲肽的制备
将3.2g3-氯-1-丙醇与6.5g叠氮钠溶于100mL水中,90℃搅拌20h,乙醚萃取(100mL×5),无水硫酸钠干燥,浓缩得到淡黄色油状物(3-叠氮-1-丙醇,71.4%)。将0.5g3-叠氮-1-丙醇与3.15g戴斯马丁氧化剂溶于50mL二氯甲烷中,室温,搅拌1h,过滤,滤液浓缩,二氯甲烷/甲醇柱层析,得到黄色油状物(3-叠氮丙炔,34.2%)。将20mg醋酸奥曲肽溶于20mL pH5.0醋酸-醋酸钠缓冲液(0.1mM)中,加入25mg氰基硼氢化钠,4℃搅拌下加入5mg3-叠氮丙炔,维持4℃反应10h,冻干得到白色粉末(叠氮奥曲肽)。
制备得到的叠氮奥曲肽通过高效液相色谱、高分辨质谱和圆二色谱表征。
实施例6
叠氮PEG的制备
将2gmPEG2000溶于20mL二氯甲烷中,加入840mg戴斯-马丁氧化剂,室温搅拌1h,过滤,滤液浓缩,二氯甲烷/甲醇柱层析,得到淡黄色固体(mPEG-乙醛,93.2%)。将400mg PEG-乙醛溶于30mL甲醇中,加入5μL 2-羟乙基肼,室温搅拌过夜,浓缩至干,加少量甲醇溶解,在冰浴中加入无水乙醚,产生白色沉淀,过滤,真空干燥,得到淡黄色固体(mPEG-hyd-ol,91.5%)。将48mg N3-HHPA(叠氮六氢苯酐)溶于10mL氯仿中,加入76mg EDCI和5mg DMAP,冰浴搅拌2h,加入400mg mPEG-hyd-ol,室温搅拌过夜,浓缩,二氯甲烷/甲醇柱层析,得黄色固体(叠氮PEG,92.3%)。
1H-NMR(CDCl3,300MHz,δppm):2.77-0.58(m,10H,cyclohexane),2.11-1.75(m,2H,N3CH2),3.30-3.22(m,2H,N-NHCH2),3.38-3.30(m,2H,CONHCH2),3.46(s,3H,OCH3),3.55(m,OCH2CH2O(PEG)),4.28-4.05(m,2H,COOCH2),5.22(d,2H,OCH2-CH=N),7.19(t,1H,CH=N).
实施例7
取市售SPC 8mg,阳离子脂质10mg,胆固醇8mg,加入氮杂二苯并环辛炔化赖氨酸-谷氨酸-十四醇22mg,溶于3ml氯仿与2ml甲醇的混合有机溶剂中。旋转蒸发5min除去有机溶剂,真空干燥过夜。加入5ml水,在37℃下水合30min。探头超声10-30min。得到的脂质体溶液定依次过0.8μm,0.45μm,0.22μm滤膜,得到含ADIBO-Lys-Glu-TA2的空白阳离子脂质体ADL-1。以相同的流程,制备不含环辛炔的阳离子脂质体(CL-1)作为对照。处方为市售SPC 30mg,阳离子脂质10mg,胆固醇8mg。粒径电位测定结果如表1所示。结果表明,氮杂二苯并环辛炔化赖氨酸-谷氨酸-十四醇的加入不会影响阳离子脂质体本身的大小和表面电性。
表1空白阳离子脂质体的性质
实施例8
取市售SPC 15mg,阳离子脂质15mg,加入氮杂二苯并环辛炔化胆固醇12mg,溶于3ml氯仿与2ml甲醇的混合有机溶剂中。旋转蒸发5min除去有机溶剂,真空干燥过夜。加入5ml水,在37℃下水合30min。探头超声10-30min。得到的脂质体溶液定依次过0.8μm,0.45μm,0.22μm滤膜,得到含ADIBO-chol的空白阳离子脂质体ADL-2。以相同的流程,制备不含环辛炔的阳离子脂质体(CL-2)作为对照。处方为市售SPC 15mg,阳离子脂质15mg,胆固醇12mg。粒径电位测定结果如表2所示。结果表明,氮杂二苯并环辛炔化胆固醇的加入不会影响阳离子脂质体本身的大小和表面电性。
表2 空白阳离子脂质体的性质
实施例9
取市售SPC 8mg,阳离子脂质10mg,加入氮杂二苯并环辛炔化二硬脂酰基磷脂酰乙醇胺8mg,氮杂二苯并环辛炔化胆固醇12mg,溶于3ml氯仿与2ml甲醇的混合有机溶剂中。旋转蒸发5min除去有机溶剂,真空干燥过夜。加入5ml水,在37℃下水合30min。探头超声10-30min。得到的脂质体溶液定依次过0.8μm,0.45μm,0.22μm滤膜,得到含ADIBO-DSPE和ADIBO-chol的空白阳离子脂质体ADL-3。以相同的流程,制备不含环辛炔的阳离子脂质体(CL-3)作为对照。处方为市售SPC 16mg,阳离子脂质10mg,胆固醇12mg。粒径电位测定结果如表3所示。结果表明,氮杂二苯并环辛炔化二硬脂酰基磷脂酰乙醇胺和氮杂二苯并环辛炔化胆固醇的加入不会影响阳离子脂质体本身的大小和表面电性。
表3 空白阳离子脂质体的性质
实施例10
取465μL实施例7的环辛炔修饰的空白脂质体ADL-1置于西林瓶中,加入338μL叠氮化PEG的水溶液(1mg/mL,N3:ADIBO=0.15:1),室温孵育1h。将上述制剂冻干,扫描红外吸收谱图,如图2。结果显示,点击反应后,叠氮化PEG中的2100cm-1处特征峰消失,说明点击反应的发生。
实施例11
将实施例8中的两种空白阳离子脂质体,按照不同的氮磷比(N/P=0.5,1,2,3,4)与siRNA进行混合,涡旋10s,室温放置30min,即得包载siRNA的环辛炔修饰的纳米复合物,进行凝胶阻滞电泳实验,紫外灯下观察,结果显示,当N/P大于等于3时,阳离子脂质体可以将siRNA完全包覆,见图3。
实施例12
根据实施例11,当N/P大于等于3时,siRNA可以被稳定地包覆。所以本实施例选取N/P等于4的比例。取180μLsiRNA(浓度0.5μg/μL)和200μL实施例8中的空白阳离子脂质体ADL-2,分别以1mL纯水稀释,混合,室温静置20min,得包载siRNA的环辛炔修饰的脂质体AD-CC-1。粒径电位测定结果如表4所示。结果表明,包载负电性的siRNA后,粒径略微有所增加,由于静电吸附后抵消了部分正电荷,电位略微降低。说明,siRNA可以成功装载到环辛炔修饰的脂质体中。
表4 包载siRNA前后阳离子脂质体的性质
实施例13
向实施例12制备的包载siRNA的环辛炔修饰的脂质体AD-CC-1同时加入70μL叠氮化奥曲肽溶液(0.5mg/mL,N3:ADIBO=0.05)与140μL叠氮化PEG溶液(1mg/mL,N3:ADIBO=0.1),室温搅拌过夜,得到点击修饰奥曲肽与PEG的包载siRNA的纳米复合物AD-CC-PEG/Oct-1。取100μL上述制剂,加入1%Triton X-100溶液将脂质体破乳,涡旋5min,置于离心机中离心(12000rpm,10min),然后取上清液进样,HPLC测定N3-Oct浓度,如图4。结果表明,与对照组相比,制剂中游离叠氮化奥曲肽峰消失,说明加入的N3-Oct完全连接到了载体表面。其余制剂冻干,扫描红外吸收谱图。如图5。结果表明,与对照组相比,叠氮基团的峰信号消失,说明N3-PEG点击反应完全发生。综合以上结果可以显示,包载siRNA的环辛炔修饰的脂质体AD-CC-1可以同时完成N3-Oct与N3-PEG的点击反应。
实施例14
取36μL siRNA(浓度0.5μg/μL)和40μL实施例8中的空白阳离子脂质体ADL-2,分别以200μL纯水稀释,混合,室温静置20min,得包载siRNA的环辛炔修饰的脂质体AD-CC-2。平行制备两份上述AD-CC-2,其中一份同时加入70μL叠氮化奥曲肽溶液(0.5mg/mL,N3:ADIBO=0.05)与140μL叠氮化PEG溶液(1mg/mL,N3:ADIBO=0.1),室温搅拌过夜,得制剂AD-CC-PEG/Oct-2并进行琼脂糖电泳。紫外灯下观察,如图6。结果显示,在N/P=4时,本发明制备的环辛炔修饰的阳离子脂质体可以有效地包覆siRNA,并且在进行无铜催化的点击反应之后,siRNA仍然稳定地包覆在载体中,没有发生泄漏。
实施例15
取20μL siRNA(浓度为0.5μg/μL)和13μL实施例9中的空白阳离子脂质体ADL-3,分别以400μL纯水稀释,混合均匀后,室温静置30min,然后加入32μL叠氮丙酸(0.5mg/mL,N3:ADIBO=0.5:1),补充体积至900μL。取上述液体各450μL,用pH 7.4和pH 6.5的缓冲盐分别稀释至2mL,测定其电位粒径。粒径电位测定结果(如表4所示)。结果显示,本发明制备的环辛炔修饰的阳离子脂质体与叠氮丙酸进行无铜催化的点击反应之后,可以完成电荷反转,即在中性情况下表面电荷为负,弱酸性情况下表面电荷为正。
表4 载有siRNA的阳离子脂质体点击叠氮丙酸后的性质
实施例16
取对数生长期的肝癌细胞Bel-7402和宫颈癌细胞Hela以1×105个/孔分别接种于24孔板和激光共聚焦小皿中,完全培养液37℃培养48h。将实施例13中点击叠氮丙酸后的载药脂质体分别在pH7.4、pH6.5条件下与肝癌细胞Bel-7402和宫颈癌细胞Hela进行孵育。3h后,通过流式细胞仪定量观察pH值对两种肿瘤细胞摄取纳米复合物的影响,如图7所示。结果显示,在偏酸性情况下,脂质体表面的电荷由负转化为正,从而使肿瘤细胞对脂质体的摄取增加。
- 还没有人留言评论。精彩留言会获得点赞!