一种用于马铃薯茎段体胚高效再生及遗传转化的培养基及方法与流程
本发明涉及植物基因工程技术领域,尤其涉及一种用于马铃薯茎段体胚高效再生及遗传转化的培养基及方法。
背景技术:
马铃薯属同源四倍体,一般利用块茎无性繁殖,品种间的遗传基础狭窄且缺乏优良基因,常规育种难以迅速培育出满足生产所需的高抗病、高淀粉等专用型品种。近年来生物技术育种逐渐被应用到马铃薯遗传改良中,其中的基因工程技术以其高效、快速、目的性强等优点为品种改良提供了新途径。
无论是基因功能的验证还是通过基因工程改良品种都需要将目的基因转入受体基因组中,比较常用的是农杆菌侵染法。转化效率的高低在很大程度上取决于外植体的再生效率和农杆菌侵染条件,因此建立高效再生体系并探寻最佳转化条件,对于获得马铃薯转基因材料至关重要。马铃薯试管苗的叶片、茎段、试管薯以及微型薯都可用作外植体,但再生效率差异大,并且不同品种具有较大的基因型差异。王红梅等用四个品种的试管薯为外植体使用培养基MS+1.0mg L-1IAA+0.5mg L-1 6-BA+2mg L-1ZT+0.2mg L-1GA3,均能诱导芽再生,但不同品种间表现出明显差异,最高为38.64%,最低为2.85%,不能满足用于遗传转化至少要有80%以上再生率的要求,此外在研究中试图用其它细胞分裂素替代较贵的玉米素ZT(Sigma)但均未成功。已报道的较为成功的转基因体系包括以鄂马铃薯3号、甘农薯2号、川芋10号的试管薯或微型薯切片为外植体建立,通过农杆菌侵染法获得转基因材料。由于再生效率具有较大的基因型差异,所以这些品种所用的激素配比和转化效率不同,分别是0.5mg/L 6-BA+2.0mg/L ZT+1.0mg/L IAA+0.2mg/LGA3,再生培养需60d以上,转化率40%以上;3.0~4.0mg/L ZT+1.0mg/L IAA,再生培养需45d以上,转化率50%以上;2.5mg/L 6-BA+0.25mg/L 2,4-D+0.25mg/L IAA,再生培养需60d以上。
植物组织培养要经脱分化产生愈伤,然后再经分化形成完整植株。分化过程有两种不同途径,一为器官发生途径,即由愈伤产生不定芽、不定根的过程。且芽和根是独立形成,它们之间没有共同的维管束联系。另一种是体细胞胚胎发生途径,即愈伤表面或内部的细胞经历类似于受精细胞分化形成合子胚的过程而形成了胚状体(又称体细胞胚),它的形成过程中也会有球形胚、心形胚、子叶形胚等不同发育阶段。一般认为器官发生途径起源于多个细胞,而体细胞发生途径只起源于一个细胞,长成的植株遗传组成稳定且一致,不存在嵌合现象。转化外源基因效率的高低与受体的再生效率相关,高的再生效率是获得转基因材料的重要保证。研究表明胚性细胞系的再生效率高,分裂能力强更易于接受外源基因且由于是单细胞起源可避免形成嵌合体,获得真正的转基因植株。
现有的马铃薯试管薯或微型薯遗传转化体系能获得个别品种的转基因株系,但诱导试管薯和微型薯需要时间长,存在污染风险,所需人工以及激素玉米素的成本高;不能明确再生途径是否是体细胞胚胎途径,可能存在遗传组成不一致的嵌合问题。
因此,有必要提供一种高效快速、成本低、用于马铃薯茎段体胚的高效再生及遗传转化的激素配比以及方法。
技术实现要素:
本发明的目的之一在于提供一种用于马铃薯茎段体胚的高效再生及遗传转化的培养基,该培养基中的激素配比为:1.0mg/L 6-BA+0.2mg/L TDZ+0.05mg/L 2,4-D+0.1mg/L GA3。
较佳地,所述培养基包括预/共培养基、固体筛选培养基及液体筛选培养基;所述预/共培养基的组成为:MS+1.0mg/L 6-BA+0.2mg/L TDZ+0.05mg/L 2,4-D+0.1mg/L GA3+3%蔗糖+0.6%琼脂;所述固体筛选培养基的组成为:MS+1.0mg/L 6-BA+0.2mg/L TDZ+0.05mg/L 2,4-D+0.1mg/L GA3+3%蔗糖+0.6%琼脂+50mg/L Kan+100mg/L Cef+250mg/L Car;所述液体筛选培养基的组成为:MS+1.0mg/L 6-BA+0.2mg/L TDZ+0.05mg/L 2,4-D+0.1mg/L GA3+3%蔗糖+50mg/L Kan+200mg/L Cef+500mg/L Car。
本发明的另一目的在于提供一种用于马铃薯茎段体胚高效再生及遗传转化的方法,使用如上所述的培养基,所述方法包括:
(1)预培养,剪取马铃薯试管苗茎段,去除腋芽并剪成0.5~1cm作为外植体接种在一预/共培养基中预培养2~4d;
(2)农杆菌侵染和共培养,将所述茎段于一农杆菌菌液中侵染3~5min,用无菌水清洗后移至无菌滤纸上去掉多余水分,再接入垫有2~3层无菌滤纸的预/共培养基中,24℃黑暗共培养36h;
(3)筛选培养,共培养后将所述茎段放入含100mg/L Cef的无菌水中清洗3~4遍,吸掉多余水分后转入一固体筛选培养基中培养7d~14d,去除因农杆菌而过度生长的致死、污染和完全白化外植体,然后换入液体筛选培养基中继续培养,培养20d~40d后阳性愈伤可分化出大量芽;
(4)生根培养,剪下分化出的芽接入一生根筛选培养基中培养10d。
较佳地,所述步骤(1)前还包括马铃薯试管苗扩繁的步骤:剪取带1~2个腋芽的马铃薯试管苗茎段接入含MS+3%蔗糖+0.6%琼脂的培养基中,调节pH为5.9~6.0,16h光/8h暗,光强为60μmol m-2s-1,温度为22±1℃,繁殖系数为3~4倍,每隔10d~14d剪接扩繁1次。
较佳地,所述步骤(2)前还包括制备农杆菌菌液的步骤:挑取含目的基因AtGAPC2(拟南芥胞质三磷酸甘油醛脱氢酶基因,由CaMV35S启动子驱动表达,以Kan作为筛选标记)的农杆菌GV3101单菌落,接种至液体YEB中过夜培养,然后按1:200的比例稀释菌液于液体YEB中,培养至OD600=0.3~0.4,取摇好的菌液于4000rpm下离心5min然后去上清,再加入等量的液体MS重悬菌体备用。
较佳地,所述YEB含50mg/L Kan、100mg/L Rif及25mg/L Gen。
较佳地,所述生根筛选培养基含MS、3%蔗糖、0.6%琼脂、50mg/L Kan、100mg/L Cef及250mg/L Car。
较佳地,所述步骤(4)之后还包括PCR检测阳性率的步骤:采用CTAB法提取生根筛选培养基培养后能正常长根的株系的叶片基因组DNA,PCR扩增反应后采用琼脂糖凝胶电泳法检测目的条带,确性阳性株系。
较佳地,PCR扩增目的基因AtGAPC2的引物序列为:
P1:5’TCTAGA-ATGGCTGACAAGAAGATCAGAAT3’,
P2:5’CCCGGG-TTAGGCCTTTGACATGTGAACG3’。
较佳地,PCR扩增反应体系含有8μL ddH2O,10μL 2×Mix,0.5μL P1(10μM),0.5μL P2(10μM),以及1.0μL DNA模板。
较佳地,PCR扩增反应条件为:94℃预变性5min;94℃变性30s,58℃退火30s,72℃延伸60s,30个循环;72℃延伸10min。
与现有技术相比,本发明以取材广泛易得的马铃薯试管苗茎段为外植体,周期短,不含玉米素、成本低;调节激素配比,获得以体细胞胚胎发生途径形成的再生株系遗传稳定,不存在嵌合体问题;采用固体筛选培养基和液体筛选培养基结合的培养方式提高了选择效率和再生速率。通过上述优势建立适用于马铃薯茎段体细胞胚胎途径的高效再生及遗传转化体系,可获得90%~100%的芽分化效率,只需30d左右的筛选时间就能获得转基因株系,便于快速获得转基因马铃薯植株用于基因功能研究和遗传改良。
附图说明
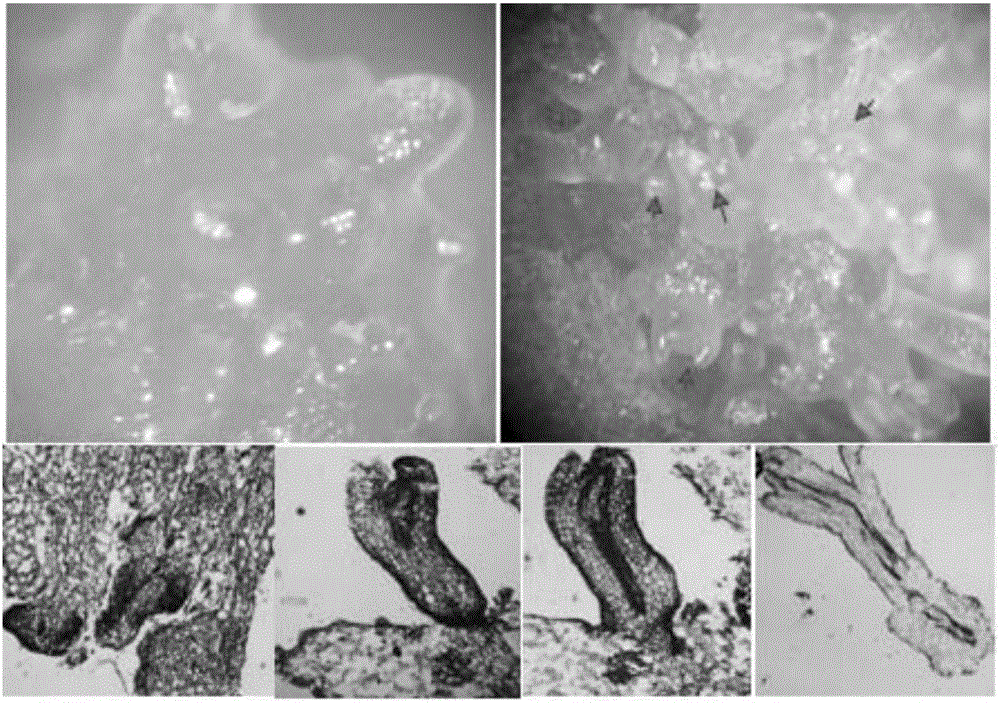
图1为本发明通过体视镜检和石蜡切片确认的体胚发生途径的再生过程。
图2为本发明液体培养20d后的芽分化情况。
图3为本发明体胚发生途径的再生株系的遗传稳定性检测。
图4展示了抗性芽分化、转基因株系生根筛选及PCR检测。
具体实施方式
下面将参考附图阐述本发明几个不同的最佳实施例。
马铃薯试管苗扩繁
剪取带1~2个腋芽的马铃薯试管苗茎段接入含MS+3%蔗糖+0.6%琼脂的培养基中,调节pH为5.9~6.0,16h光/8h暗循环培养,光强为60μmol m-2s-1,温度为22±1℃,繁殖系数为3~4倍,每隔10d~14d剪接扩繁1次。
现有技术中,诱导试管薯约需60d~90d,而在网棚中获得微型薯约需90d,费时费人工,且收获的微型薯还需用升汞消毒灭菌,既存在环境污染问题又存在材料污染风险;本发明以马铃薯试管苗茎段作外植体在短时间内即可获得大量材料,且可直接用于后续操作,无污染风险。
培养基中的激素配比
用于马铃薯茎段体胚的高效再生及遗传转化的培养基,建立该培养基中的激素配比方法:
剪取马铃薯试管苗茎段,去除腋芽并剪成0.5~1cm接种在诱导培养基上,诱导培养基设置4种激素配比,如下表1所示,对比再生效率(芽分化率),获得最佳激素配比1.0mg/L 6-BA+0.2mg/L TDZ+0.05mg/L 2,4-D+0.1mg/L GA3,其芽分化率为90%~100%,35d开始长芽(表2)。如图1所示,通过体视镜检和石蜡切片确认其体胚再生途径。换用液体培养后,可在20d左右获得大量再生株系(图2)。用SCOT标记对再生植株进行遗传稳定性检测,没有检测到明显的差异条带,表明通过该途径获得的植株遗传性较为稳定(图3)。
因此,确定培养基中的激素配比为:1.0mg/L 6-BA+0.2mg/L TDZ+0.05mg/L2,4-D+0.1mg/L GA3。
表1培养基中的激素配比(mg L-1)
表2不同激素配比对马铃薯试管苗茎段外植体分化的影响
注:均为固体培养,愈伤率(%)=(形成愈伤的外植体数/接种外植体数)×100%,芽分化率(%)=(分化芽的愈伤数/形成愈伤的外植体数)×100%
制作培养基
激素包括有:6-苄基腺嘌呤(6-BA)、噻苯隆(TDZ)、2、4-二氯苯氧乙酸(2,4-D)、赤霉素(GA3)。
抗生素包括有:卡那霉素(Kan)、庆大霉素(Gen)、利福平(Rif)、头孢霉素(Cef)、羧苄青霉素(Car)。
除用甲醇溶解的Rif外,其余都需经0.22μm滤膜过滤灭菌于-20℃保存备用。MS培养基灭菌后,待降至60℃左右加入相应的激素和抗生素,从而制得如下各培养基。
培养基包括预/共培养基、固体筛选培养基、液体筛选培养基及生根筛选培养基。
所述预/共培养基的组成为:MS+1.0mg/L 6-BA+0.2mg/L TDZ+0.05mg/L 2,4-D+0.1mg/L GA3+3%蔗糖+0.6%琼脂。
所述固体筛选培养基的组成为:MS+1.0mg/L 6-BA+0.2mg/L TDZ+0.05mg/L 2,4-D+0.1mg/L GA3+3%蔗糖+0.6%琼脂+50mg/L Kan+100mg/L Cef+250mg/L Car。
所述液体筛选培养基的组成为:MS+1.0mg/L 6-BA+0.2mg/L TDZ+0.05mg/L 2,4-D+0.1mg/L GA3+3%蔗糖+50mg/L Kan+200mg/L Cef+500mg/L Car。
所述生根筛选培养基的组成为:MS+3%蔗糖+0.6%琼脂+50mg/L Kan+100mg/L Cef+250mg/L Car。
预培养
剪取马铃薯试管苗茎段,去除腋芽并剪成0.5~1cm作为外植体接种在一预/共培养基中预培养2d~4d,50个/皿。
现有技术中,若用试管薯或微型薯作为外植体则还需在培养7d~14d切去从芽眼中长出的非再生芽,以防对块茎分化的干扰。
制备农杆菌菌液
挑选含目的基因AtGAPC2(拟南芥胞质三磷酸甘油醛脱氢酶基因,由CaMV35S启动子驱动表达,以Kan作为筛选标记)的农杆菌GV3101单菌落,接种至液体YEB中过夜培养,然后按1:200的比例稀释菌液于液体YEB中,培养至最佳浓度,取摇好的菌液于4000rpm下离心5min然后去上清,再加入等量的液体MS重悬菌体备用。所述YEB含50mg/L Kan、100mg/L Rif及25mg/L Gen。
农杆菌侵染和共培养
将预培养3d后的所述茎段集中于三角瓶中倒入农杆菌菌液侵染3~5min,用无菌水清洗2遍后移至无菌滤纸上去掉多余水分,再接入垫有2~3层无菌滤纸的预/共培养基中,24℃黑暗共培养一定时间,30个/皿。
现有技术中,农杆菌菌液侵染10min后直接接入共培养基,本方案缩短侵染时间并水洗除去多余菌体,加垫滤纸都是为了有效防止茎段上附着大量农杆菌过量繁殖而将愈伤杀死,导致转化效率偏低。
确定最佳菌液浓度和共培养时间
按照上述方法制备三个浓度的农杆菌菌液,分别为OD600=0.1~0.2,OD600=0.3~0.4及OD600=0.5~0.6。
按照上述方法使用不同浓度的农杆菌菌液侵染茎段,然后共培养,共培养的时间设置36h和60h两个处理。
不同菌液浓度和不同共培养时间对茎段转化效率的影响如表3所示,从表中可知,OD600=0.3~0.4、共培养时间为36h时的转化效率最高。
表3菌液浓度和共培养时间对转化效率的影响
实施例一:
用于马铃薯茎段体胚高效再生及遗传转化的方法包括:
(1)预培养,剪取川芋10号马铃薯试管苗茎段,去除腋芽并剪成0.5~1cm作为外植体接种在一预/共培养基中预培养3d;
(2)农杆菌侵染和共培养,预培养3d后将茎段集中于三角瓶中并导入OD600=0.3~0.4的农杆菌菌液侵染3min,用无菌水清洗2遍后移至无菌滤纸上去掉多余水分,再接入垫有2层无菌滤纸的预/共培养基中,24℃黑暗共培养36h;
(3)筛选培养,共培养后将茎段放入含100mg/L Cef的无菌水中清洗3~4遍,吸掉多余水分后转入固体筛选培养基中培养,16h光/8h暗循环,光强为60μmol·m-2·s-1,温度为22±1℃,培养7d后去除因农杆菌而过度生长的致死、污染和完全白化外植体,然后换入液体筛选培养基中继续培养,转速100rpm,培养约20d后可见大量芽形成,转化率达51.20%,如表4所示。液体筛选培养基与固体筛选培养基相比,Cef和Car的量加倍了,可更好地抑菌,液体培养基没有加入琼脂,其它不变。改用液体筛选培养基,一是外植体上部接触不到固体筛选培养基,导致抗生素的选择压力不均衡会产生假阳性植株,而改用液体培养能克服这一问题;二是可增强营养物质吸收效率、加快分化生长,便于短期获得大量转基因株系。
(4)生根培养,剪下分化出的芽接入生根筛选培养基中培养,约7-10d后长出根系,如图4所示,再将这些材料在普通MS培养基中扩繁。
(5)PCR检测阳性率,采用CTAB法提取生根筛选培养基培养后能正常生根的株系的叶片基因组DNA,PCR扩增反应后采用琼脂糖凝胶电泳法检测目的条带约1017bp(如图4所示)。检测61株,56株有条带,阳性率为91.8%(表4)。
具体地,PCR扩增目的基因AtGAPC2的引物序列为:
P1:5’TCTAGA-ATGGCTGACAAGAAGATCAGAAT3’,
P2:5’CCCGGG-TTAGGCCTTTGACATGTGAACG3’。
PCR扩增反应体系含有8μL ddH2O,10μL 2×Mix,0.5μL P1(10μM),0.5μL P2(10μM),以及1.0μL DNA模板。
PCR扩增反应条件为:94℃预变性5min;94℃变性30s,58℃退火30s,72℃延伸60s,30个循环;72℃延伸10min。
琼脂糖凝胶电泳法具体为:称1g琼脂糖加100mL TAE缓冲液,微波炉溶胶后再加入5μL Gel Red染料,混匀倒入模具中制胶,凝固后放入电泳槽中,加TAE缓冲液。取4μL上述PCR扩增反应后的产物点入胶块的胶孔中,接通电源在120V下电泳20min。取出胶块,在凝胶呈像仪下观察是否有目的条带。
实施例二
(1)预培养,剪取米拉马铃薯试管苗茎段,去除腋芽并剪成0.5~1cm作为外植体接种在一预/共培养基中预培养3d;
(2)农杆菌侵染和共培养,预培养3d后将茎段集中于三角瓶中并导入OD600=0.3~0.4的农杆菌菌液侵染5min,用无菌水清洗2遍后移至无菌滤纸上去掉多余水分,再接入垫有3层无菌滤纸的预/共培养基中,24℃黑暗共培养36h;
(3)筛选培养,共培养后将茎段放入含100mg/L Cef的无菌水中清洗4遍,吸掉多余水分后转入固体筛选培养基中培养,16h光/8h暗循环,光强为60μmol·m-2·s-1,温度为22±1℃,培养14d后去除因农杆菌而过度生长的致死、污染和完全白化外植体,然后换入液体筛选培养基中继续培养,转速100rpm,培养约40d后可见芽形成,转化率达28.67%,如表4所示。
(4)生根培养,剪下分化出的芽接入生根筛选培养基中培养,约7-10d后长出根系。
(5)PCR检测阳性率,采用CTAB法提取生根筛选培养基培养后正常生根的株系的叶片基因组DNA,PCR扩增反应后采用琼脂糖凝胶电泳法检测目的条带,检测48株,45株有条带,阳性率为93.75%。
实施例三
(1)预培养,剪取川芋早马铃薯试管苗茎段,去除腋芽并剪成0.5~1cm作为外植体接种在一预/共培养基中预培养3d;
(2)农杆菌侵染和共培养,预培养3d后将茎段集中于三角瓶中并导入OD600=0.3~0.4的农杆菌菌液侵染4min,用无菌水清洗2遍后移至无菌滤纸上去掉多余水分,再接入垫有3层无菌滤纸的预/共培养基中,24℃黑暗共培养36h;
(3)筛选培养,共培养后将茎段放入含100mg/L Cef的无菌水中清洗4遍,吸掉多余水分后转入固体筛选培养基中培养,16h光/8h暗循环,光强为60μmol·m-2·s-1,温度为22±1℃,培养10d后去除因农杆菌而过度生长的致死、污染和完全白化外植体,然后换入液体筛选培养基中继续培养,转速100rpm,培养32d后可见大量芽形成,转化率达40.00%,如表4所示。
(4)生根培养,剪下分化出的芽接入一生根筛选培养基中培养,约7-10d后长出根系。
(5)PCR检测阳性率,采用CTAB法提取生根筛选培养基培养后能正常生根的株系的叶片基因组DNA,PCR扩增反应后采用琼脂糖凝胶电泳法检测目的条带,检测40株,38株有条带,阳性率为95.0%。
表4不同马铃薯品种的转化效率
现有技术相比,本发明以取材广泛易得的马铃薯试管苗茎段为外植体,周期短,不含玉米素、成本低;调节激素配比,获得以体细胞胚胎发生途径形成的再生株系遗传稳定,不存在嵌合体问题;采用固体筛选培养基和液体筛选培养基结合的培养方式提高了选择效率和再生速率。通过上述优势建立适用于马铃薯茎段体细胞胚胎途径的高效再生及遗传转化体系,可获得90%~100%的芽分化效率,只需30d左右的筛选时间就能获得转基因株系,便于快速获得转基因马铃薯植株用于基因功能研究和遗传改良。
以上所揭露的仅为本发明的较佳实施例而已,当然不能以此来限定本发明之权利范围,因此依本发明申请专利范围所作的等同变化,仍属本发明所涵盖的范围。
申请人:四川农业大学。
发明名称:一种用于马铃薯茎段体胚高效再生及遗传转化的培养基及方法。
序列特征:PCR扩增目的基因AtGAPC2的引物序列P1、P2。
序列描述:
P1: 5’ TCTAGA-ATGGCTGACAAGAAGATCAGAAT3’,
P2: 5’ CCCGGG-TTAGGCCTTTGACATGTGAACG3’。
- 还没有人留言评论。精彩留言会获得点赞!