一种番茄PSY1基因的CRISPR‑Cas9体系构建及其应用的制作方法
本发明属于基因工程和基因遗传修饰领域,具体地说,涉及一种番茄PSY 1基因的CRISPR-Cas9体系构建及其应用。
背景技术:
番茄(Solanum lycopersicum Mill),又名西红柿、洋柿子、番柿、六月柿、毛腊果等,属茄科番茄属,原产于南美洲。目前番茄是世界上栽培最广、消费量最大的蔬菜作物,也是我国主栽蔬菜种类之一。番茄红素是植物合成的一种天然类胡萝卜素,它广泛存在于番茄、辣椒、胡萝卜、南瓜等蔬菜中。其在番茄中的含量最高,每100g鲜重含量为0.2-20mg。番茄红素是胡萝卜素的异构体,通过异戊二烯代谢途径合成,可在环化酶的作用下转变成δ-胡萝卜素、γ-胡萝卜素、α-胡萝卜素、β-胡萝卜素、叶黄素、玉米黄素、紫黄质、新黄素等类胡萝卜素。八氢番茄红素合成酶(phytoene synthase,PSY)是植物类胡萝卜素生物合成途径中促进番茄红素合成的上游关键酶,催化两分子的牻牛儿基牻牛儿基焦磷酸(geranylgerany pyrophosphate,GGPP)缩合形成八氢番茄红素,PSY基因最早在番茄中分离鉴定,目前已从番茄中分离得到2个编码基因,PSY 1和PSY 2(Kato,2004)。
CRISPR(Clustered regularly interspaced short palindromic repeats)是广泛存在于细菌和古细菌基因组中的特殊DNA重复序列,其序列由一个前导区(Leader)、多个短而高度保守的重复序列区(Repeat)和多个间隔区(Spacer)组成。Leader 一般位于CRISPR 上游,是富含AT、长度为300-500bp的区域,被认为是CRISPR的启动子序列。Repeat 长度为21-48bp,由于含有回文序列,可形成发卡结构。重复序列之间被长度为26-72bp的Spacer隔开。Spacer区域由俘获的外源DNA组成,类似免疫记忆,当含有同样序列的外源DNA入侵时,可被细菌机体识别,并进行剪切使之表达沉默,达到保护自身安全的目的。Cas(CRISPR associated)蛋白存在于CRISPR位点附近,是一种双链DNA核酸酶,能在向导RNA(small guide RNA,sgRNA)引导下对靶位点进行切割。特异的Cas蛋白会识别外源性的遗传物质中具有原型间隔序列毗邻区(protospacer adjacent motifs,PAM)的DNA片段,通过Cas蛋白将PAM 5’端的DNA(即protospacer)加工成短的DNA片段,插入到其CRISPR序列的重复序列之间,最终使得细菌通过spacer序列识别并且随后靶向这些外来原件进行切除。CRISPR-Cas系统赋予原核细胞针对外源DNA特异性免疫,这种特异性是由间隔序列决定的。目前已经发现3种类型的CRISPR-Cas系统,根据Cas位点基因组织源性的不同,这3种类型又可进一步分成10种亚型,针对不同的干扰可表达不同的蛋白复合物。其中,II型系统组成最为简单,只需要1个Cas9蛋白就可切割DNA双链。Cas9 内切酶在sgRNA分子的引导下对特定位点的DNA进行切割,形成双链DNA缺口,然后细胞会借助同源重组机制(homologous recombination,HR)或者非同源末端连接机制(non-homologous end joining,NHEJ)对断裂的DNA进行修复。如果细胞通过HR机制进行修复,会用另外一段DNA片段填补断裂的DNA缺口,因而会引入一段新的遗传信息。CRISPR技术不仅是基因功能研究的利器,而且可用于基因编辑以改良农作物,建立基因病动物模型和进行基因治疗。这项技术被Science评为2013年十大科学进展之一,并将其功能总结为“Genetic Microsurgery for the Masses”。
目前,该技术已经成功应用于大肠杆菌、肺炎双球菌、酿酒酵母、斑马鱼、小鼠细胞、小鼠、人类多种细胞系、果蝇、线虫、大鼠、水稻、小麦、拟南芥以及本生烟中,但是CRISPR-Cas9体系在番茄研究上仍是一片空白。
技术实现要素:
本发明的目的是提供番茄PSY 1基因的CRISPR-Cas9体系构建及其应用。
本发明是采用如下技术方案实现的:一种番茄PSY 1基因的CRISPR-Cas9体系构建,该方法包括以下步骤:
(1)根据番茄PSY 1基因的cDNA保守序列设计sgRNA的DNA序列,该sgRNA位于番茄PSY 1基因第一个外显子上,中间具有一个酶切位点Sty I,如SEQ ID NO. 1所示;
(2)设计用于扩增sgRNA的番茄PSY 1基因目标区的引物组合,其上、下游引物核苷酸序列如SEQ ID NO. 2和SEQ ID NO. 3所示;
(3)利用引物进行sgRNA扩增,并纯化扩增产物;
(4)将纯化后的sgRNA扩增产物与pICSL01009:: AtU6p和pICH47751连接,得到含有特异性靶向番茄PSY 1基因sgRNA的CRISPR-Cas9 Level 1载体;
(5)将步骤(4)的产物再与pICH47732:NPT II、pICH47742:cas 9、pICH41766和pAGM4723连接,得到含有特异性靶向番茄PSY 1基因sgRNA的CRISPR-Cas9 Level 2载体。
所述的番茄PSY 1基因的CRISPR-Cas9体系在制备番茄PSY 1基因突变的转基因番茄中的应用。
所述的番茄PSY 1基因的CRISPR-Cas9体系在制备黄色果实的转基因番茄中的应用。
所述的番茄PSY 1基因的CRISPR-Cas9体系在制备番茄PSY 1基因突变的转基因番茄中的应用,将CRISPR-Cas9体系转化农杆菌后,用于检测CRISPR-Cas9-PSY 1基因突变的引物组合,其上、下游引物核苷酸序列如SEQ ID NO. 5和SEQ ID NO. 6所示。
本发明首先根据番茄PSY 1基因的cDNA保守序列设计sgRNA的DNA序列,该sgRNA位于PSY 1第一个外显子上,中间具有一个酶切位点,为Sty I,根据PSY 1基因第一个外显子的DNA序列设计了sgRNA引物,接着构建了含有该sgRNA的CRISPR-Cas9载体,可以对PSY 1进行基因编辑,引起该基因发生移码突变,实现PSY 1基因的沉默,致使功能部分或全部缺失。为了进一步验证本发明所述的效果,将含有该sgRNA的CRISPR-Cas9载体转化农杆菌,再用含有CRISPR-Cas9载体的农杆菌转化番茄子叶,利用PCR和测序技术,成功检测到发生碱基缺失的转基因植株,其PSY 1基因功能缺失。
本发明有助于研究该基因参与番茄果实成熟过程中的作用,进一步了解番茄果实成熟的分子机理,可用于制备PSY 1基因缺失的转基因番茄,对未来培育耐贮运番茄新品种有重要作用。
附图说明
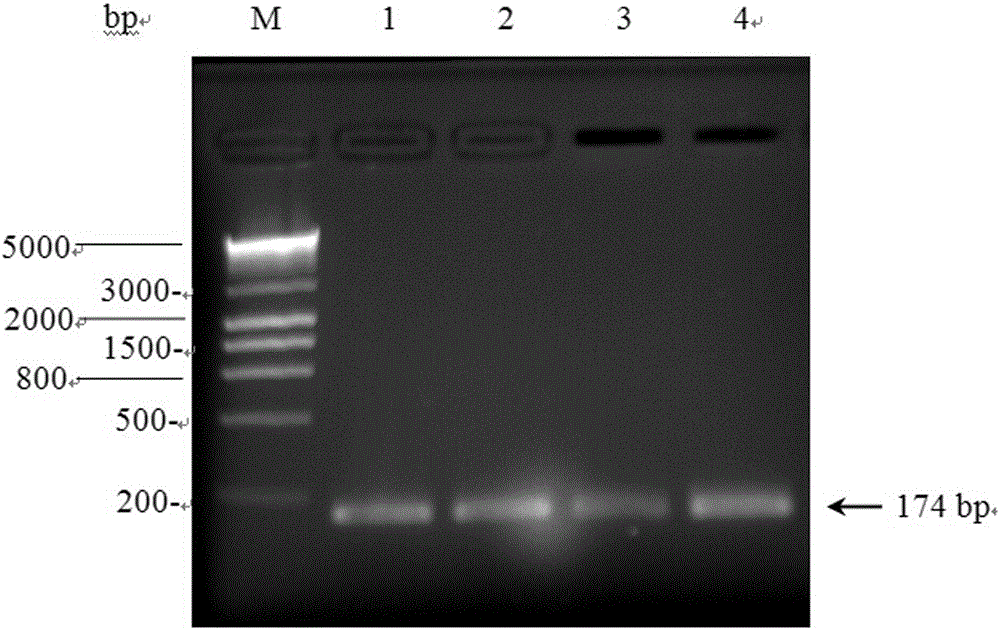
图1为sgRNA扩增产物的琼脂糖凝胶电泳图;
图2为sgRNA的CRISPR-Cas9 Level 1载体菌液的扩增产物的琼脂糖凝胶电泳图;
图3为sgRNA的CRISPR-Cas9 Level 2载体菌液的扩增产物的琼脂糖凝胶电泳图;
图4为农杆菌菌液的特异引物扩增产物的琼脂糖凝胶电泳图;
图5为转基因植株的特异引物扩增产物的琼脂糖凝胶电泳图;
图6为突变株与野生型DNA目标区域的序列比对图;
图7为突变株的序列图谱;
图8为突变株番茄果实照片;
上述图1至图5中,M:Marker;1、2、3、4:同一样品的不同重复。
具体实施方式
以下实施例用于说明本发明,但不用来限制本发明的范围。在不背离本发明精神和实质的情况下,对本发明方法、步骤或条件所作的修改或替换,均属于本发明的范围。
若未特别指明,实施中所用的材料、生物化学试剂均为常规市售试剂,实施例中所用的技术手段为本领域技术人员熟知常规手段。
实施例1:番茄PSY 1基因CRISPR-Cas9的sgRNA设计
1、寻找PAM(proto adjacent motif)基序
在PSY 1基因序列第1外显子区寻找PAM基序,即NGG。
2、确定sgRNA序列
在PAM位置5’端20 bp的一段序列即为sgRNA序列,一般番茄CRISPR-Cas9中使用U6启动子来转录sgRNA,因此优先NGG的5’端20位的碱基为G,即G(N)19NGG。番茄PSY 1基因第1外显子区的sgRNA序列如SEQ ID NO. 1所示。
3、sgRNA引物合成
序列分别如SEQ ID NO. 2和SEQ ID NO. 3所示。
4、sgRNA扩增反应体系
将合成的引物,分别加去离子水,使其浓度为10 μM,然后配制sgRNA扩增反应体系如下:
5、sgRNA扩增反应条件
6、产物检测
用2%琼脂糖凝胶来检测sgRNA PCR扩增产物,大小为174 bp,如图1所示。
实施例2:番茄PSY 1基因sgRNA连接到CRISPR-Cas9 Level 1载体上
1、sgRNA扩增产物纯化
采用GenElutTM PCR Clean-Up Kit(SIGMA)进行PCR产物纯化。
2、CRISPR-Cas9 Level 1连接反应体系
3、CRISPR-Cas9 Level 1连接反应条件
4、将连接产物转化到大肠杆菌中
取40 μL大肠杆菌DH5α(DH8142)感受态细胞与5 μL Level 1连接产物混匀,冰浴15 min,之后42℃水浴45 s,再冰浴5 min。然后加600 μL LB培养基,37℃振荡培养1.5 h。吸取100 μL培养液均匀涂到LB平板(含100 mg·L-1 Xgal和100 mg·L-1 Carbenicilin)上,37℃培养过夜。
5、挑选单克隆摇菌
在LB平板上挑选白色单克隆到10 mL LB培养基中(含100 mg·L-1 Carbenicilin),37℃培养过夜。用特异性引物进行菌液PCR鉴定,上、下游引物序列如SEQ ID NO. 2和SEQ ID NO. 3所示。PCR程序:98℃,30 s;94℃,10 s;60℃,30 s;72℃,30 s;35个循环;72℃,2 min;4℃,hold。
PCR反应体系:
然后用2%琼脂糖凝胶来检测目的PCR产物,正确的目的片段为174 bp,如图2所示,提取阳性菌液的质粒DNA,测序。
6、质粒连接确认
分析比对测序结果,检测是否成功将双链sgRNA连接到U6-sgRNA载体上,结果如SEQ ID NO. 4所示。结果说明PSY 1-sgRNA连接到U6-sgRNA载体上,得到含有特异性靶向番茄PSY 1基因sgRNA的CRISPR-Cas9 Level 1载体。
实施例3番茄PSY 1基因sgRNA连接到CRISPR-Cas9 Level 2载体上
1、CRISPR-Cas9 Level 2 连接反应体系
2、CRISPR-Cas9 Level 2 连接反应条件
3、将连接产物转化到大肠杆菌中
取40 μL大肠杆菌DH5α(DH8142)感受态细胞与5 μL Level 2连接产物混匀,冰浴15 min,之后42℃水浴45 s,再冰浴5 min。然后加600 μL LB培养基,37℃振荡培养2 h。吸取100 μL培养液均匀涂到LB平板(含100 mg·L-1 Kanamycin)上,37℃培养过夜。
4、挑选单克隆摇菌
在LB平板上挑取白色单克隆到10 mL LB培养基中(含100 mg·L-1 Kanamycin),37℃培养过夜。用特异性菌液PCR引物进行PCR鉴定,上、下游引物序列如SEQ ID NO. 2和SEQ ID NO. 3所示。PCR程序:98℃,30 s;94℃,10 s;60℃,30 s;72℃,30 s;35个循环;72℃,2 min;4℃,Hold。
PCR体系:
然后用2%琼脂糖凝胶来检测目的PCR产物,正确的目的片段为174 bp左右,如图3所示。挑选3个阳性菌液,测序。
5、质粒连接确认
分析比对测序结果,检测是否成功将双链sgRNA连接到Cas9载体上。结果说明 CRISPR-Cas9 Level 2载体包括NPT II、Cas 9、sgRNA和L3E,且均没有发生碱基突变部分,得到含有特异性靶向番茄PSY 1基因sgRNA的CRISPR-Cas9 Level 2载体。
实施例4:番茄CRISPR-Cas9-PSY 1 Level 2载体转化农杆菌
1、高浓度CRISPR-Cas9-PSY 1 Level 2质粒的提取
摇菌10 mL(LB+Kanamycin),使其OD600约为1.5左右,然后依据PuriLink Quick Plasmid DNA Miniprep Kits(Invitrogen)提取实施例3制得的连接了PSY 1-sgRNA的CRISPR-Cas9质粒,使最终质粒浓度大于100 ng·μL-1。
2、将Level 2质粒转化到农杆菌中
取40 μL农杆菌EHA105感受态细胞与2 μL Level 2质粒DNA混匀,并转移到预冷的电转杯中,在电转仪上进行转化(2.5V,400Ω,25μFD)。之后立即加入1 mL预冷的LB培养基,转移到1 mL离心管中,28℃振荡培养3 h。吸取100 μL培养液涂LB平板(含100 mg·L-1 Kanamycin),28℃培养过夜。
3、挑选单克隆摇菌
在LB平板上挑取白色单克隆到10 mL LB培养基中(含100 mg·L-1 Kanamycin),28℃培养过夜。
4、转化确认
用特异性引物进行菌液PCR鉴定,上、下游引物序列如SEQ ID NO. 5 和SEQ ID NO. 6所示。PCR程序:98℃,30 s;94℃,10 s;60℃,30 s;72℃,30 s;35个循环;72℃,2 min;4℃,Hold。
PCR体系:
然后用2%琼脂糖凝胶来检测目的PCR产物,正确的目的片段为1800 bp左右,如图4所示。
5、农杆菌保存
菌液与50%的甘油混合,-80℃保存。
实施例5 :CRISPR-Cas9-PSY 1 农杆菌转化番茄子叶
1、外植体准备
以番茄野生型AC++种子为材料进行种子表面消毒。
(1)(50%乙醇:50%水)中浸泡种子10 mins;
(2)饱和磷酸三钠溶液中浸泡种子20 mins,在超净工作台上用灭菌的蒸馏水冲洗种子5次;
(3)在(50%次氯酸钠:50%水)中浸泡种子10 mins。用1 L灭菌的蒸馏水冲洗种子。
在MSR3培养基上播种,密度为3粒·cm-2。发芽培养环境条件:26℃,光照长度16 h·d-1。播种后10-12 d(发芽后5-6 d),在第1片真叶长出前取子叶进行预培养。为了减少损伤,先将子叶在水中浸泡,然后用锋利的适当切去子叶的尖部和基部。将切好的子叶放在3C5ZR的培养上26℃暗培养24 h。
MSR3培养基:
R3 vitamins:
3C5ZR培养基:
2、农杆菌活化
取-80℃保存的农杆菌10 μL,添加10 mL新鲜的LB培养基,28℃振荡培养2 d。检测农杆菌浓度,并用MS培养基调整农杆菌浓度OD值至0.2。
3、转化番茄子叶
将预培养的子叶放入农杆菌液中浸泡15 mins后,用滤纸吸去多余的菌液,再放回到原来的3C5ZR培养基上26℃暗培养2 d。
4、选择性培养
将子叶转移到添加有80 mg·L-1 Kanamycin和500 mg·L-1 Carbenicilin的3C5ZR培养基中培养。环境条件:26℃,光照长度18 h·d-1 。确保子叶切口端与培养基接触。每3-4 w转移一次子叶至新鲜的培养基中。
5、生根培养
当有小植株从愈伤组织中长出时,转移至添加有0.87 mg·L-1 IAA、80 mg·L-1 Kanamycin和500 mg·L-1 Carbenicilin的MSR3培养基中生根培养。
6、驯化移栽
将生根良好的瓶苗小心从培养基中取出,栽植到基质中,并套上干净的塑料袋保持湿度。3 d后逐渐在塑料袋开孔放风,使植株适应外界环境。
实施例6:突变检测
1、基因组DNA的提取
利用DNeasy Plant Mini Kit(QIAGEN)提取野生型和转基因植株的基因组DNA,并检测浓度(一般需大于50 ng·μL-1),用来后续实验检测。
2、PCR特异性扩增目的片段
以提取的基因组DNA为底物,用特异性的检测引物(如SEQ ID NO. 7和SEQ ID NO. 8所示)进行PCR扩增。
PCR扩增反应体系
PCR扩增反应条件
然后用2%的琼脂糖凝胶进行检测,目的片段约为830 bp左右,如图5所示。
3、PCR产物纯化
采用GenElutTM PCR Clean-Up Kit(SIGMA)进行PCR产物纯化。
4、测序
吸取15 μL纯化的PCR产物送公司(Eurofins MWG Operon)测序。测序引物如SEQ ID NO. 7所示。
5、序列比对
利用DNAMAN软件将测序的结果与野生型进行比对,分析确定目的区间的突变情况,如图6、7所示。该质粒载体可以在番茄子叶中发挥功能来切割PSY 1,从而引起突变。其中在PSY 1基因第1外显子区的目标序列发生1个碱基缺失致使该基因功能丧失。
6、表型性状鉴定
正常管理遗传转化植株,待其果实成熟时,观察果皮颜色,如图8所示,在PSY 1基因第1外显子区的目标序列发生1个碱基缺失的转化植株,果皮颜色表现为黄色,图中下方果实为黄色。
虽然,上文中已经用一般性说明、具体实施方式及试验,对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
序列表
〈110〉山西省农业科学院蔬菜研究所
〈120〉一种番茄PSY 1基因的CRISPR-Cas9体系构建及其应用
〈160〉8
〈210〉1
〈211〉20
〈212〉DNA
〈213〉人工序列
〈220〉
〈223〉sgRNA
〈400〉1
GGCAGGCAGC CTTGGTGAAG 20
〈210〉 2
〈211〉 56
〈212〉DNA
〈213〉人工序列
〈220〉
〈223〉用于扩增sgRNA的上游引物
〈400〉2
TGTGGTCTCA ATTGGCAGGC AGCCTTGGTG AAGGTTTTAG AGCTAGAAAT AGCAAG 56
〈210〉3
〈211〉31
〈212〉DNA
〈213〉人工序列
〈220〉
〈223〉用于扩增sgRNA的下游引物
〈400〉3
TGTGGTCTCA AGCGTAATGC CAACTTTGTA C 31
〈210〉4
〈211〉256
〈212〉DNA
〈213〉人工序列
〈220〉
〈223〉含有特异性靶向番茄PSY 1基因sgRNA的CRISPR-Cas9 Level 1载体
〈400〉4
GAAGACAAAC TAGAATTCGA GCTCGGAGTG ATCAAAAGTC CCACATCGAT CAGGTGATAT ATAGCAGCTT AGTTTATATA ATGATAGAGT CGACATAGCG ATTGGCAGGC AGCCTTGGTG AAGGTTTTAG AGCTAGAAAT AGCAAGTTAA AATAAGGCTA GTCCGTTATC AACTTGAAAA AGTGGCACCG AGTCGGTGCT TTTTTTCTAG ACCCAGCTTT CTTGTACAAA GTTGGCATTA CGCTTTACTT GTCTTC
256
〈210〉5
〈211〉20
〈212〉DNA
〈213〉人工序列
〈220〉
〈223〉用于扩增CRISPR-Cas9-PSY 1的上游引物
〈400〉5
GAAATTTAGA TTGAAGCTGG 20
〈210〉6
〈211〉20
〈212〉DNA
〈213〉人工序列
〈220〉
〈223〉用于扩增CRISPR-Cas9-PSY 1基因突变的下游引物
〈400〉6
GTGTTTTCAA CTGGGTGTTC 20
〈210〉7
〈211〉20
〈212〉DNA
〈213〉人工序列
〈220〉
〈223〉用于检测PSY 1基因突变的上游引物
〈400〉7
TTGGTTTGCC TGTCTGTGGT 20
〈210〉8
〈211〉20
〈212〉DNA
〈213〉人工序列
〈220〉
〈223〉用于检测PSY 1基因突变的下游引物
〈400〉8
TGTGTTTGTG CGCGTAACTG 20
- 还没有人留言评论。精彩留言会获得点赞!