一种双齿围沙蚕抗凝血肽的制备方法与流程
本发明涉及一种活性肽的制备方法,特别涉及一种双齿围沙蚕抗凝血肽的制备方法。
背景技术:
血栓形成是缺血性心脏病、缺血性中风及静脉栓塞常见的病理学基础,严重危害人类健康且近年来还有渐增之势。抑制血小板的聚集与释放、抑制凝血酶系统、激活抗凝血酶及纤溶酶系统均可抑制血栓的形成。血栓的形成是缺血性心脑血管疾病及血栓栓塞性疾病的主要病理过程,与疾病的发生、发展密切相关。因此,抑制血小板聚集、抑制血栓的形成对心脑血管系统疾病及其他血栓栓塞性疾病的防治均有重要意义。
双齿围沙蚕(Perinereis aibuhitensis)隶属于动物界,环节动物门,多毛纲,游行多毛目,沙蚕科,俗称海蜈蚣,与陆地生物蚯蚓具有很近的亲缘关系。从蚯蚓体内获得的蚯激酶已被证明能够有效溶解血栓,改善微循环,加强心、脑血管侧支循环,蚯激酶的成功开发使科研工作者将目光转向沙蚕。通过酶解的方法从沙蚕体内提取抗凝血成分以抑制体内血栓,未见报道。
技术实现要素:
本发明的目的在于提供一种双齿围沙蚕抗凝血肽的制备方法,安全性好,反应条件温和,过程控制容易,所得双齿围沙蚕抗凝血肽纯度高,抗凝血活性好,具有抗血栓作用,具有较好的医学应用价值。
本发明解决其技术问题所采用的技术方案是:
一种双齿围沙蚕抗凝血肽的制备方法,步骤如下:
(1)样品预处理:新鲜双齿围沙蚕经预处理后得组织匀浆;
(2)酶解:按照每克组织匀浆加3mL纯净水的配比,将组织匀浆与纯净水混匀,调节pH=10,加入碱性蛋白酶酶解后得酶解液;
(3)超滤:酶解液灭活,离心,取上清液,经超滤获得分子量小于3kd的活性组分;
(4)阴离子交换层析:分子量小于3kd的活性组分经DEAE-Sepharose FastFlow阴离子交换层析,梯度洗脱,于280nm波长下检测,收集所得洗脱峰,冷冻干燥,筛选抗凝血活性最高的洗脱峰作为阴离子交换层析产物用于下一步分离纯化;
(5)葡聚糖凝胶G25层析:将抗凝血活性最高的阴离子交换层析产物采用葡聚糖凝胶G25层析继续分离纯化,蒸馏水洗脱,于280nm波长下检测,收集所得洗脱峰,冷冻干燥后作为葡聚糖凝胶G25层析产物;
(6)反相高效液相色谱分离纯化:对葡聚糖凝胶G25层析产物采用反相高效液相色谱法分离纯化,最终获得双齿围沙蚕抗凝血肽。
本发明首次通过酶解的方法从沙蚕体内提取抗凝血成分,获得具有抗凝血活性的沙蚕寡肽,具有抗血栓作用,具有较好的医学应用价值。
作为优选,步骤(1)样品预处理具体为:将新鲜双齿围沙蚕用清水清洗干净,沥干后称重,组织捣碎机匀浆,加匀浆3倍体积的预冷的磷酸盐缓冲液,4℃静置2h以上,离心,收集上清,上清液用医用脱脂棉过滤。
作为优选,所述磷酸盐缓冲液的浓度为0.02mol/L,pH 7.0。
作为优选,步骤(2)按照每克组织匀浆加1500U的加酶量加入碱性蛋白酶,45℃酶解5小时得酶解液。
作为优选,步骤(4)洗脱的流速为1.5mL/min,预先用pH7.4,0.02mol/LTris-HCl平衡缓冲液充分平衡DEAE柱3-5个柱体积,然后上样。
作为优选,步骤(5)的蒸馏水的洗脱速度为1.1mL/min。
本发明的有益效果是:安全性好,反应条件温和,过程控制容易,所得双齿围沙蚕抗凝血肽纯度高,抗凝血活性好,具有抗血栓作用,具有较好的医学应用价值。
附图说明
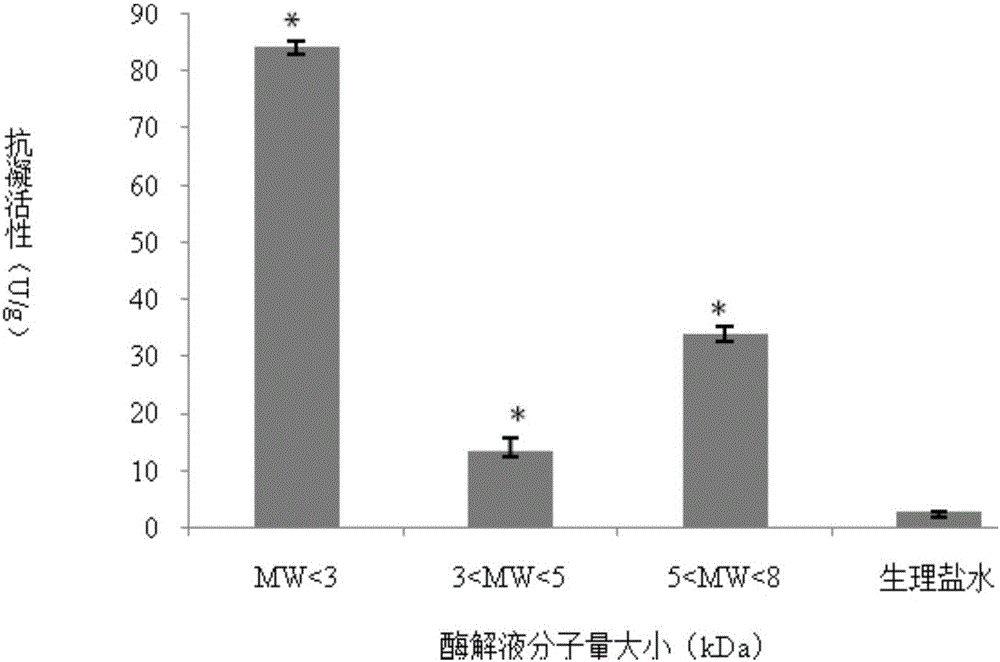
图1不同酶解液的超滤截留组分抗凝活性的比较(注:与生理盐水相比,*P<0.05)。
图2 DEAE-Sepharose FF离子交换层析洗脱曲线。
图3离子交换层析洗脱峰抗凝血活性的比较(注:与生理盐水相比,,*P<0.05)。
图4 Sephadex G-25洗脱曲线。
图5反相高效液相分离纯化图。
图6 PAAP的化学结构式。
图7 PAAP对大鼠TXB2的影响*:与正常组相比,p<0.05Δ:与模型组相比,P<0.05。
图8 PAAP对大鼠6-keto-PGF1α的影响*:与正常组相比,p<0.05Δ:与模型组相比,P<0.05。
图9 PAAP对大鼠T-PA的影响*:与正常组相比,p<0.05Δ:与模型组相比,P<0.05。
图10 PAAP对大鼠PAI-1的影响*:与正常组相比,p<0.05Δ:与模型组相比,P<0.05。
图11 PAAP对大鼠t-pa/PAI-1的影响*:与正常组相比,p<0.05Δ:与模型组相比,P<0.05。
图12 PAAP对大鼠PLG的影响*:与正常组相比,p<0.05Δ:与模型组相比,P<0.05。
图13 PAAP对大鼠AT-Ⅲ的影响*:与正常组相比,p<0.05Δ:与模型组相比,P<0.05。
图14 PAAP对大鼠PC的影响*:与正常组相比,p<0.05Δ:与模型组相比,P<0.05。
具体实施方式
下面通过具体实施例,对本发明的技术方案作进一步的具体说明。
本发明中,若非特指,所采用的原料和设备等均可从市场购得或是本领域常用的。下述实施例中的方法,如无特别说明,均为本领域的常规方法。
双齿围沙蚕抗凝血肽(Anticoagulant Peptides from Perinereis aibuhitensis,PAAP)。
实施例:
1 材料与方法
1.1 动物、材料与试剂
健康雄性清洁级ICR小鼠,体质量(20±2)g;健康雄性清洁级SD大鼠,体质量(140±10)g,购于浙江省医学科学院,动物生产许可证号:SCXK(浙)2014-0001。
双齿围沙蚕购买自浙江舟山朱家尖,并由浙江海洋大学赵盛龙教授进行种类鉴定。
胰蛋白酶、碱性蛋白酶、中性蛋白酶、木瓜蛋白酶、胃蛋白酶中国亚太恒信公司;纤维蛋白原、凝血酶、角叉菜胶、ADP美国sigma公司;阿司匹林林肠溶片拜耳医药保健有限公司;其余试剂均为国产分析纯。
1.2 仪器与设备
Cogent u Scale超滤系统默克密理博;ApurifierUPC100快速蛋白液相色谱系统GE Healthcare;ALPHA1-4冷冻干燥机德国Christ公司;Agilent-1260高效液相色谱仪美国安捷伦公司;752FC紫外分光光度计上海光谱仪器有限公司;CF16RXII日立低温离心机日本日立公司;LG-PABER-1半自动凝血分析仪北京世帝科学仪器有限公司。
1.3 方法
1.3.1 样品的制备
1.3.1.1 原料制备
将新鲜双齿围沙蚕用清水清洗干净,沥干后称重,高速组织捣碎机匀浆,加3倍体积的预冷的磷酸盐缓冲液(0.02mol/L PBS,pH 7.0),4℃静置2h以上。8000r/m in离心15min,收集上清。上清液用医用脱脂棉过滤出去脂肪组织及其它不溶物得组织匀浆,分装,-20℃冻存备用,此为PAAP原料。
1.3.1.2 最佳酶种选择
将组织匀浆按湿重3倍加水。选用碱性蛋白酶、中性蛋白酶、胃蛋白酶、木瓜蛋白酶、胰蛋白酶作供选酶,按照蛋白酶各自的最适作用温度和pH值(见表1),加酶量1500U/g,反应5h,料液比1:3,酶解PAAP原料。依据抗凝活性筛选出最佳酶种。酶解完毕后,100℃灭酶10min,过滤后冷冻干燥,备用。
表1 不同酶的最适温度和pH
1.3.1.3 抗凝血活性的测定
依据《中国药典》2010版,具体方法为:精密取样品粉末(过三号筛)1g,精密加入0.9%氯化钠溶液5mL,充分搅拌,浸提30分钟,并时时振摇,10000r/min离心,精密量取上清液100μL,置试管(8mm×38mm)中,加入含0.5%牛纤维蛋白原的Tris-HCl缓冲液200μL,摇匀,置水浴中(37℃士0.5℃)温浸5分钟,滴加12U/mL的凝血酶溶液(每1分钟滴加1次,每次5μL,边滴加边轻轻摇匀)至凝固,按照下列公式计算抗凝血活性:
式中:U为抗凝血活性U/g;C1为凝血酶浓度U/ml;C2为样品液浓度g/mL;V1为消耗凝血酶体积μL;V2为样品液体积μL。
1.3.2 PAAP的分离纯化
1.3.2.1 超滤分离
取最佳酶种在最优酶解条件下酶解的上清液,用截留分子量分别为8kDa、5kDa、3kDa的超滤膜进行超滤,将各分子段超滤酶解液冷冻干燥后进行抗凝血活性测定,筛选出对抗凝血活性最高分子段的超滤组分冻干备用。
1.3.2.2 DEAE-Sepharose FF离子交换层析分离纯化
上柱样品:经过超滤系统得到的抗凝血活性最优组分,过滤后上样。洗脱过程:流速1.5mL/min,预先用pH7.4,0.02M Tris-HCl平衡缓冲液充分平衡DEAE柱3-5个柱体积,然后上样,上样后用平衡缓冲液将穿透峰洗到接近基线,采用线性梯度洗脱方式洗脱,即使用0.02M Tris-HCl缓冲液且其中的NaCl浓度由0-1M的线性梯度上升方法,按峰收集流出液的液体。检测波长为280nm,将各个洗脱峰冻干后备用。
1.3.2.3 葡聚糖凝胶G-25层析分离纯化
上柱样品:经过离子交换层析得到的抗凝血活性最优组分,用蒸馏水配制为0.1g/ml,过滤后上样。洗脱过程:以蒸馏水作为洗脱液,将凝胶柱进行平衡洗脱;调节恒流泵流速为1.1mL/min,每管收集3.5min,收集各峰的洗脱液,280nm下检测其吸光度。将各个洗脱峰冻干后备用。
1.3.2.4 高效液相纯化
上样样品为经G-25层析得到的样品,运用反向高效液相色谱法纯化,条件如下:系统为Agilent 1260HPLC;色谱柱为Zorbax SB-C18(4.6×250mm,5μm);进样体积为100μL;平衡缓冲液为0.06%TFA(A液);洗脱缓冲液为含0.05%TFA的乙腈(B液);洗脱梯度为0%–0%B液洗脱4分钟,0%-100%B液洗脱25分钟,100%-100%B液;洗脱时间6分钟;流速为0.8ml/min;紫外检测波长280nm。
1.3.2.5 目标肽的氨基酸序列测定
采用N末端降解检测方法,氨基酸测序仪进行测定。
1.3.2.6 PAAP的抗凝活性测定
方法同1.3.1.3
1.3.3 PAAP的急性毒理学实验
1.3.3.1 预实验
雄性ICR小鼠4只,体重20±2g,24h禁食不禁水,PAAP用纯水配成最大浓度550mg/mL(不堵塞过滤器为准),按0.2ml/10g BW灌胃7d,每天一次。观察小鼠日常行为、精神状态及死亡率。
1.3.3.2 最大给药剂量实验
雄性ICR小鼠9只,体重20±2g,24h禁食不禁水,对照组(纯水) 和PAAP低剂量组(5.5g/kg BW)、高剂量组(11g/kg BW),每组3只,按照预试验方法操作,观察小鼠日常行为,7d后称重处死,解剖观察。
1.3.4 PAAP对小鼠尾部血栓形成的影响
1.3.4.1 小鼠分组及造模
40只雄性ICR小鼠随机分为5组,每组8只,分别为模型组、阿司匹林阳性对照组、PAAP低剂量组(50mg/kg)、中剂量(100mg/kg)、高剂量组(200mg/kg)。小鼠预防性灌胃给药14d,模型组给予等量生理盐水,造模前24h禁食不禁水,在第14d末,给药1h后参考文献方法造模[1],腹腔注射0.2%角叉菜胶(由生理盐水配制),15℃室温过夜。72h后眼球取血,血液迅速装入混有109mmol/l枸橼酸纳(9:1)抗凝管,3000r/min离心10min,-80℃保存备用。
1.3.4.2 小鼠血栓长度的计算
用游标卡尺分别在注射角叉菜胶24h、48h、72h测定小鼠的尾部血栓总长及为形成血栓的长度,小鼠血栓形成长度=小鼠尾部总长-未形成血栓长度。
1.3.4.3 指标测定
半自动血凝仪检测APTT、TT、PT、FIB,按试剂盒说明书操作。
1.3.4.4 数据处理
ˉ
实验数据使用SPSS 19.0统计软件分析处理,实验结果以x±s表示,且以P<0.05表示差异有显著性。
1.3.5 PAAP对大鼠颈动脉血栓形成的影响
1.3.5.1 大鼠颈动脉血栓模型的建立
雄性SD大鼠40只,随机分为5组,每组8只,分别为模型组、阿司匹林阳性对照组、PAAP低剂量组(50mg/kg)、中剂量(100mg/kg)、高剂量组(200mg/kg)。预防性灌胃给药14d,模型组给予等量生理盐水,造模前24h禁食不禁水,于末次给药1h后,腹腔注射10%水合氯醛麻醉,参照Kurz法[10]改良制作颈总动脉血栓模型,灭菌器材沿颈中线纵向切开颈部皮肤,钝性分离左侧颈动脉1cm,在颈动脉与周围组织间放一塑料保鲜膜,用于保护血管周围组织,将吸有35%FeCl3溶液20μL的滤纸片(1cm*1cm)环形包裹颈动脉,假手术组用等量生理盐水滤纸包裹,30min后去除滤纸片。分离右侧颈动脉穿线备用。去除纸片90min后,右侧颈动脉采血,转入装有抗凝剂的采血管中,3000r/min离心15min,取上层血浆,-80℃冷冻保存备用。
1.3.5.2 血栓质量及其抑制率
大鼠取血后,精确截取滤纸环抱处血管,吸干血管中残留血液,电子天平称其质量,取出血栓后再称血管质量,前后相剪即为1cm血管段内血栓质量。按以下公式计算各组抑制率:
抑制率=[(模型组测定值-实验组测定值)÷模型组测定值]×100%。
1.3.5.3 指标测定
6-酮-前列腺素Flα(6-Keto-PGFlα)、大鼠血栓素B2(txb2)、抗凝血酶Ⅲ(ATⅢ)、蛋白C(PC)、组织型纤溶酶原活化剂(T-PA)、纤溶酶原(PLG)、纤溶酶原激活物抑制因子-1(PAI-1)应用酶联免疫法按试剂盒说明书操作。
1.3.5.4 数据处理
实验数据使用SPSS 19.0统计软件分析处理,实验结果以表示,且以P<0.05表示差异有显著性。
1.3.6 对大鼠体内血小板聚集率的影响
雄性SD大鼠40只,随机分为5组,每组8只,分别为对照组、阿司匹林阳性组、PAAP低剂量组(50mg/kg)、中剂量(100mg/kg)、高剂量组(200mg/kg)。预防性灌胃给药14d,模型组给予等量生理盐水,造模前24h禁食不禁水,于末次给药1h后,腹腔注射10%水合氯醛麻醉,腹主动脉取血。转入装有抗凝剂(枸橼酸纳1:9)的采血管中,1000r/10min离心,取上清为PRP(富血小板血浆)。余下血液3500r/15min继续离心,取上清即为PPP(贫血小板血浆)。使用半自动凝血仪测定血小板聚集率。
实验数据使用SPSS 19.0统计软件分析处理,实验结果以表示,且以P<0.05表示差异有显著性。
2 结果与分析
2.1 最佳酶种的选择
五种蛋白酶酶解液的抗凝活性比较见下表,在各自最适酶解条件下,碱性蛋白酶的酶解效果最好,抗凝活性达到了69±2.3U/g,胃蛋白酶次之。故选定碱性蛋白酶为本实验最佳酶种。酶解在其最适条件下完成,即料液比为1:3,pH值为10.0,加酶量为1500U/g,温度为45.0℃,酶解时间是5h。
表2 五种蛋白酶酶解液的抗凝活性
2.2 PAAP的分离纯化
2.2.1 超滤分离
取各个不同分子段冻干样品测定抗凝活性,结果如图1所示。分子量在<3kDa的酶解液抗凝活性最高,为84.0±2.3u/g。故选定<3kDa分子段酶解液进行下步分离纯化。
2.2.2 DEAE-Sepharose FF离子交换层析分离
取分子量<3kDa的酶解液进一步分离纯化,于280nm处出现三个峰,即峰1、峰2、峰3,见图2,收集各峰组分,冷冻干燥后测定抗凝血活性。结果如图3所示,峰3具有最高的抗凝血活性,为900±51U/g。故选择峰3进行下一步分离纯化。
2.2.3 Sephadex G-25层析分离
取2.2.2中峰3冻干样品进行G25层析分离,280nm处检测吸光值,结果如图4所示,为一单峰,收集此峰冻干备用。
2.2.4 反相高效液相分离纯化及氨基酸序列测定
G-25洗脱峰经RP-HPLC色谱柱洗脱纯化,得到1个单峰,如图5所示,收集此峰,并将其命名为PAAP。经检测该目标肽的氨基酸序列为Pro-Val-Glu-Arg-Lys(SEQ ID No.1),分子量为627.7Da。化学结构式见图6。
2.2.5 PAAP的抗凝血活性
经测定,PAAP的抗凝血活性为1320±20.3U/g。
2.3 急性毒理学实验结果
通过预实验及最大给药量实验,测得PAAP的最大给药量为11.0g/kg.d。实验中各组小鼠活动正常,精神状态良好且未出现死亡及异常情况。解剖后发现,心、肺、肝、肾、胃和肠等器官肉眼观察均无异常。实验期间,PAAP实验各组体重和对照组相比较,高剂量组体重涨幅相对明显,有统计学意义(P<0.05,见表3)。提示该样品使用安全,基本无毒。
表3 急性毒理学实验小鼠体重变化
注:*与对照组相比,p<0.05。
2.4 PAAP对体内血栓的影响
2.4.1 PAAP对不同时间角叉菜胶诱导小鼠黑尾长度的影响
小鼠注射角叉菜胶后,各组均形成明显黑尾,随着时间的延长,各组的黑尾长度均有不同程度的缩短。造模24h时,高、中剂量组与模型对照组差异显著,黑尾长度明显较短(p<0.05)。48h及72h时,PAAP各组均与模型对照组有显著差异(p<0.05)。阿司匹林各组与模型组差异不显著(p>0.05)。表4结果表明PAAP可有效减轻小鼠尾部血栓的形成,不但可以抑制血栓发展,同时对已形成的血栓有一定的溶解作用,且有量效关系。
表4 实验小鼠造模24、48和72h黑尾长度
*与模型组比p<0.05,有显著性差异。
2.4.2 PAAP对FeCl3诱导颈动脉血栓的影响
阿司匹林组与PAAP组均可减轻血栓重量。与模型组相比,PAAP中、高剂量大鼠的血栓质量显著减轻(p<0.05)。与阿司匹林组相比,PAAP高剂量大鼠的血栓质量也有所减轻(表5)。表明沙蚕能够降低血栓重量且有量效关系。
表5 PAAP对FeCl3诱导的大鼠颈动脉血栓生成量的影响
*与模型组比p<0.05,有显著性差异。
2.5 PAAP对ADP诱导的体内血小板聚集率的影响
大鼠应用阿司匹林后,与正常对照组相比,对ADP诱导的血小板聚集有非常显著的抑制作用(p<0.05)。PAAP各剂量组对ADP诱导的血小板聚集具有明显的抑制作用(p<0.05),而且随着给药剂量的增加,抑制作用逐渐增强(表6)。
表6 PAAP对ADP诱导大鼠体内血小板聚集的影响
*与模型组比p<0.05,有显著性差异。
2.6 双齿围沙蚕多肽对小鼠凝血时间及FIB的影响
采用凝血仪测定双齿围沙蚕多肽对小鼠血浆APTT、TT、PT、FIB的影响,表7结果显示,与模型组相比,双齿围沙蚕多肽低、中、高剂量组均能显著延长APTT,并呈一定的剂量依赖关系。双齿围沙蚕多肽低、中、高剂量能延长TT、PT,但差异不显著。与模型组相比,高剂量组显著降低FIB含量,低、中剂量组降低FIB含量,但差异不显著。本实验结果表明,双齿围沙蚕多肽能显著延长小鼠APTT,降低FIB含量。
表7 PAAP对小鼠APTT、TT、PT及FIB的影响
*与模型组比p<0.05,有显著性差异。
2.7 各组大鼠血浆中TXB2、6-keto-PGF1α含量的变化
如图7、图8所示,与正常对照组比较,模型组血浆TXB2含量升高(P<0.05),而6-keto-PGF1,含量降低(P<0.05)。阳性药物组TXB2浓度低于模型组(P<0.05)而6-keto-PGF1α较模型组升高(P<0.05)。与模型组比较,PAAP各组均能显著降低TXB2(P<0.05)并同时升高6-keto-PGF1α(P<0.05)。
2.8 各组大鼠血浆中T-PA、PAI-1、PLG含量
如图9-12所示,与正常对照组组比较,模型t-PA活性降低(P<0.05),PAI-1活性升高(P>0.05),t-PA/PAI-1比值降低(P<0.05),PLG活性升高(P<0.05),提示模型组纤溶活性降低。与模型组比较,阿司匹林组t-PA活性、PAI-1活性、PLG活性及t-PA/PAI-1比值无变化(P>0.05),与模型组比较,不同剂量的双齿围沙蚕多肽组t-PA活性均升高(P<0.05),同时PAI-1和PLG活性降低(P<0.05);t-PA/PAI-1比值升高(P<0.05)。
2.9 各组大鼠血浆中AT-Ⅲ、PC含量
如图13-14所示,与正常对照组比较,模型组的ATⅢ、PC的含量均明显降低(P<0.05),提示模型组抗凝系统活性降低。与模型组相比,阿司匹林组ATⅢ、PC的含量无明显变化(P>0.05)。与模型组比较,双齿围沙蚕多肽各组的ATⅢ含量降低(P>0.05)而PC含量升高(P>0.05)
3 讨论
本研究以碱性蛋白酶、中性蛋白酶、胃蛋白酶、木瓜蛋白酶和胰蛋白酶作为供选酶酶解双齿围沙蚕,以体外抗凝活性为检测指标,筛选出最优酶种(碱性蛋白酶)对沙蚕进行酶解,在此酶解基础上进行进一步分离纯化。首先,酶解液经超滤截留具有最高抗凝活性的分子段(<3kDa),接着利用DEAE-SepharoseFF离子交换层析筛选出活性最高组分(峰3)并利用凝胶过滤对峰3进行纯化获得单一峰,收集此峰并利用反相高效液相进行分离纯化。最后,将纯化后的样品进行氨基酸序列测定,其氨基酸序列为Pro-Val-Glu-Arg-Lys并将该寡肽命名为PAAP。
角叉菜胶是从红藻类海草中提炼出来的亲水性胶体,是一种较强的致炎因子]可用于制备多种组织炎症模型。胡三觉等[1]发现可用其制作小鼠尾部血栓形成模型,此种静脉血栓形成是由局部炎症与内皮细胞的损坏所引起的混合型血栓,可依据皮肤颜色的显著变化,从体表直接测量血栓的形成范围与程度,观察其发展全过程具有简便、直观、无创伤等优点。实验中发现,注射角叉菜胶后期部分小鼠会出现断尾现象,为准确测量黑尾长度,在实验过程中选择测量未形成血栓的部份,再已尾部总长度减去这部分长度,即为小鼠的黑尾长度。PAAP能够显著降低小鼠尾部形成的血栓长度,对角叉菜胶所致的小鼠尾部血栓具有一定的抑制作用。
Lockyer[2]等发现利用FeCl3外敷可使血管内膜损伤,胶原暴露,引起血小板黏附、聚集和释放活化等,导致内源性凝血系统激活,在动脉损伤的区域形成复合性血栓,与人类血栓性疾病的发病机制相似且制作方法简单、容易控制、重复性好[3],因而在国内外研究中被广泛使用[4-7],本发明选用此模型来评价PAAP抑制血栓形成的作用。本研究结果显示,PAAP各剂量组均能延长FeCl3诱导的大鼠颈总动脉血栓形成时间,表明PAAP具有抑制动脉血栓形成的作用。
血小板聚集诱导剂主要包括二磷酸腺苷(ADP)、凝血酶、胶原、血栓烷A2(TXA2)、肾上腺素和血清素等。各种诱导剂诱导血小板活化的能力不尽相同,凝血酶、胶原和TXA2都是强诱导剂,ADP属中等强度的血小板聚集诱导剂,其诱导的血小板活化的信号通路是血小板聚集过程中最为重要的信号通路,因此本实验选择ADP诱导的血小板聚集进行研究。结果显示,PAAP能够有效的抑制由ADP诱导的大鼠血小板聚集。
综上所述,本发明使用碱性蛋白酶酶解双齿围沙蚕,经分离纯化后,所获得的寡肽(PAAP)的抗凝活性达到1320±20.3U/g。急性毒性实验显示,PAAP的最大给药量为11.0g/kg.d,实验中未出现小鼠异常及死亡现象,提示该样品使用安全。PAAP可明显抑制角叉菜胶诱导的小鼠尾部血栓及Fecl3引起的大鼠颈动脉血栓,同时对ADP诱导的血小板聚集也具有抑制作用。PAAP的抗血栓机制可能与降低TXB2、PAI-1、PLG、FIB,升高6-keto-PGF1α、T-PA、t-pa/PAI-1有关。
参考文献:
[1]胡三觉,田巧莲,一种新的体内血栓形成动物模型[J].医学争鸣,1993(01):69-69.
[2]Lockyer S,Kambayashi J.Demonstration of flow and plateletdependency in a ferric chloride-induced model of thrombosis[J].
CardiovascPharmacol,1999,33(5):718-725.
[3]郭朝锋.三氯化铁动物血栓模型方法学及其应用研究进展[J].中华实用诊断与治疗杂志,2010,24(6):537-539.
[4]Justin D.Barr,Anil K.Chauhan,Gilbert V.Schaeffer,Jessica K.Hansen,David G.Motto.Red blood cells mediate the onset of thrombosis in the ferric chloride murine model[J].Blood,2013,121(18):3733-41.
[5]Eckly A,Hechler B,Freund M,et al.Mechanisms underlying FeCl3-induced arterial thrombosis[J].Journal of Thrombosis and Haemostasis,2011,9(4):779-789.
[6]Xian X,Yu D,Ling Z,et al.Enhanced atherothrombotic formation after oxidative injury by FeCl3,to the common carotid artery in severe combined hyperlipidemic mice[J].Biochemical and Biophysical Research Communications,2009,385(4):563-569.
[7]聂牧,王云,郭守东,等.板栗多糖抗动脉血栓形成的作用[J].食品科学,2015,36(11):187-190。
以上所述的实施例只是本发明的一种较佳的方案,并非对本发明作任何形式上的限制,在不超出权利要求所记载的技术方案的前提下还有其它的变体及改型。
SEQUENCE LISTING
<110> 浙江海洋大学
<120> 一种双齿围沙蚕抗凝血肽的制备方法
<130> 2016.11
<160> 1
<170> PatentIn version 3.3
<210> 1
<211> 5
<212> PRT
<213> 双齿围沙蚕
<400> 1
Pro Val Glu Arg Lys
1 5
- 还没有人留言评论。精彩留言会获得点赞!