一种可自组装成水凝胶的肿瘤杀伤性多肽及其应用的制作方法
本发明涉及抗肿瘤领域,更特别地,涉及一种可自组装成水凝胶的肿瘤杀伤性多肽。
背景技术:
实体瘤(如脑胶质瘤、肝癌、软组织肉瘤等)是临床上常见的原发性恶性肿瘤,大多数实体瘤呈侵润性和膨胀性生长,所以手术不易切除。目前这类恶性肿瘤的治疗仍是世界公认的难题,临床上最常用的治疗手段主要有:手术治疗、化学治疗、放射治疗及综合治疗,但均未能获得令人满意的疗效。面临的主要问题有两点:①肿瘤组织与正常脑组织边界不清,难以进行真正意义上的手术全切除和精确放疗,残留肿瘤组织成为局部复发的根源;②化疗药物需要剂量大,而肿瘤局部药物浓度低,导致疗效差,全身毒副作用明显,患者无法耐受。
随着材料科学和生物医学的发展,使用生物材料作为药物载体负载化疗药物如紫杉醇、顺铂和阿霉素等,实现肿瘤的局部靶向给药治疗实体恶性肿瘤已经取得了可喜的进展,这种方法不仅可以增强药物的靶向性和缓释性,还可以降低化疗药物的全身毒性。格立得植入剂(Gliadel wafer,美国Guilford公司)是全球第一个治疗脑胶质瘤的载药可降解聚合物,Gliadel wafer直径1.45cm、厚约1mm,每片含192.3mg聚苯丙生20(polifeprosan 20)和7.7mg卡莫司汀。美国食品和药物管理局(Food and Drug Administration,FDA)批准其适应证是新诊断为恶性胶质瘤患者的手术和放疗辅助药物,也可作为多形性胶质母细胞瘤复发患者的手术辅助用药。2008年,美国癌症中心联盟(National Comprehensive Cancer Network,NCCN)已将Gliadel Wafer列为治疗恶性胶质瘤的建议处理方式之一。但最近多中心临床研究发现,Gliadel wafer治疗恶性脑胶质瘤失败的病例中,高达80%的复发部位仍在瘤床局部,此外,还存在感染、脑脊液漏等不良反应。Gliadel wafer有以下两个方面可以改进:①Gliadel Wafer呈规则体,无法完全贴附到术后不规则的肿瘤残腔表面;②多聚体聚苯丙生20仅单纯的作为一种药物缓释载体,而本身并无生物学活性。
多肽水凝胶是由自组装多肽分子在特殊条件触发下形成的凝胶材料。多肽分子溶解于水后,能自发聚集形成Beta片层架构,Ca2+、Mg2+和H+等阳离子可以促进多肽分子自组装,形成具有网状结构的纳米纤维,外观呈凝胶状。这种材料可以直接注射到体内形成凝胶,生物相容性好,降解产物为氨基酸,不产生免疫反应和炎症反应,且无细胞毒性。目前,RADA-16是最常用的自组装多肽材料之一,将功能肽片段(如IKVAV)通过固相合成法连接到RADA-16分子中,多肽分子自组装后,凝胶材料能具有与功能肽片段相同的生物学活性,但有以下缺点:1)自身没有抗肿瘤活性;2)RADA-16可以形成凝胶,但是如果携载的功能肽片段氨基酸序列过长(比如蜂毒肽melittin:GIGAVLKVLTTGLPALISWIKRKRQQ),功能肽片段会扰乱RADA-16自发聚集形成Beta片层架构,而无法自组装成凝胶。
随着纳米科技的快速发展,肿瘤光学治疗如光热治疗在肿瘤治疗的应用中得到了快速发展。光热治疗是通过激光照射具有光吸收能力的物质从而产生热量杀死肿瘤细胞。吲哚青绿(ICG)是FDA批准应用于临床的药物,在光热治疗中也发挥巨大作用。但是ICG在水溶液中的不稳定性及在体内的快速清除限制了它的应用。
因此,研制出一种安全、生物相容性好、可降解的、具有抗肿瘤活性的载药材料,联合光热治疗恶性肿瘤,将具有广阔的临床应用前景。
技术实现要素:
为解决以上问题,本发明提供了一种可自组装成水凝胶的肿瘤杀伤性多肽,其包括C端的自组装结构域和N端的杀伤结构域,所述自组装结构域和所述杀伤结构域通过柔性结构域连接,所述自组装结构域的序列为(RADA)7-9。
在将自组装结构域的RADA单元加长为28肽(即,7次重复)至36肽(即,9次重复)时,出乎意料地,所得到的自组装结构域可与一些可杀伤细胞的杀伤性多肽连接,既不影响其自组装成水凝胶的功能,又赋予了其自身对肿瘤的杀伤能力。
优选地,所述杀伤结构域为选自KLA、蜂毒肽中的一种或多种组合,所述KLA序列为KLAKLAKKLAKLAK,所述蜂毒肽的序列为GIGAVLKVLTTGLPALISWIKRKRQQ。
优选地,所述柔性结构域为GG。
本发明还公开了上述可自组装成水凝胶的肿瘤杀伤性多肽在制备缓释药剂中的应用。
本发明还公开了一种抗肿瘤水凝胶缓释药剂,其由上述可自组装成水凝胶的肿瘤杀伤性多肽搭载抗肿瘤药物得到。
优选地,所述所述抗肿瘤药物为吲哚青绿、多柔比星、化疗药物、肿瘤疫苗
本发明还公开了上述抗肿瘤水凝胶缓释药剂的制备方法,其包括以下步骤:
S1:将配制所述可自组装成水凝胶的肿瘤杀伤性多肽的水溶液和所述抗肿瘤药物的水溶液;
S2:将所述可自组装成水凝胶的肿瘤杀伤性多肽的水溶液与所述抗肿瘤药物的水溶液混合,得到混合溶液;
S3:将所述混合溶液放置于低温下形成水凝胶,即得到所述抗肿瘤水凝胶缓释药剂。
优选地,所述混合溶液中所述可自组装成水凝胶的肿瘤杀伤性多肽的浓度为10-30mg/mL。
优选地,将所述混合溶液于4℃下放置2小时形成水凝胶。
本发明还具有以下优点:
①对RADA-16进行改良后,活性肽片段KLA及melittin不会干扰凝胶形成,设计获得的RADA-KLA和RADA-melittin均可以自组装形成自身具有抗肿瘤活性的凝胶材料;
②可以通过反复多次通过局部注射直接将缓释药剂植入到瘤体内或术后残腔内,不需要行开放手术暴露肿瘤,减少感染、出血等并发症,减少患者身体及经济负担。
③缓释药剂在体液触发下形成凝胶,可以完全适形填充术后残腔,充分发挥材料及药物的抗肿瘤作用,进一步减少复发;
④降解产物为氨基酸,不产生免疫反应和炎症反应;
⑤粘弹性好,与脑及脊髓组织有相近的压缩模量,尤其适用于中枢神经系统肿瘤;
⑥制备工艺简单,便于规模化生产;
⑦可负载并缓慢释放装载的活性分子(ICG或DOX),有助于维持活性分子在体内的稳定性,通过在植入局部缓慢释放活性分子,持续发挥协同杀伤肿瘤的同时,减少对其余脏器的损伤;
⑧功能可扩展:自组装多肽材料可负载化疗药物直接杀伤肿瘤,也可以负载肿瘤抗原蛋白、肿瘤裂解物、小分子干扰RNA、肿瘤分子靶向药物或者肿瘤RNA作为肿瘤纳米疫苗使用。
附图说明
图1为可自组装成水凝胶的肿瘤杀伤性多肽的结构示意图;
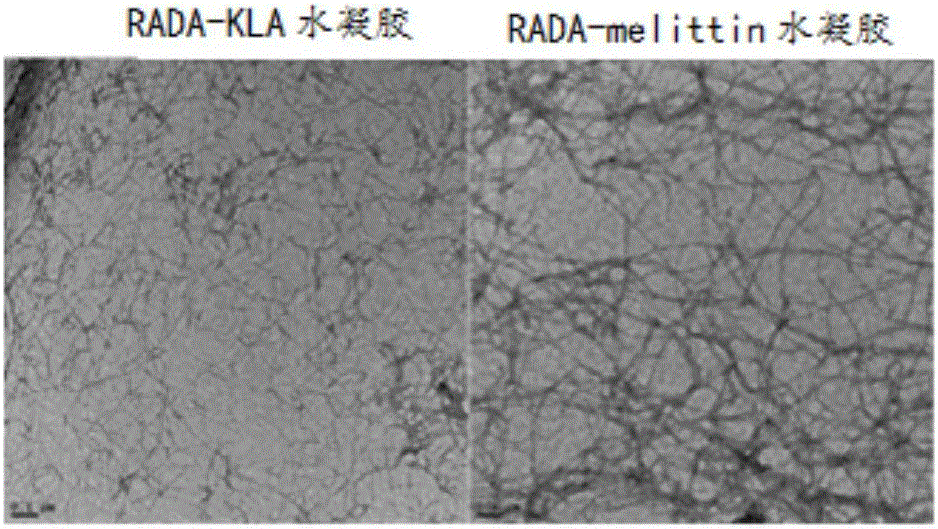
图2为KLA-RADA水凝胶和Melittin-RADA水凝胶的电镜图;
图3为RADA-melittin水凝胶与单独melittin的释放时间统计图;
图4为采用PI和DAPI双染研究KRI水凝胶和MRI水凝胶的体外肿瘤细胞杀伤能力。C6细胞接种在KRI水凝胶、MRI水凝胶、RADA16、PBS液中,培养24小时后,RADA16与PBS液中细胞生长良好,KRI水凝胶、MRI水凝胶组中可见大量肿瘤细胞凋亡(红色);
图5为采用MTT实验定量研究RADA-melittin水凝胶的体外肿瘤细胞杀伤能力统计图;
图6为MRI水凝胶的体外光热效应图;
图7为MRI凝胶装载ICG植入鼠体内后的荧光成像图;
图8为MRI凝胶装载ICG植入鼠体内后得到的各器官和肿瘤的荧光成像图;
图9为接种RADA-KLA+ICG、RADA16、PBS第2天,进行激光照射过程中肿瘤内的温度统计图;
图10为将RADA-KLA-ICG、RADA16、PBS随机注射至小鼠肿瘤瘤体中后进行激光照射和不进行激光照射处理过程中瘤体的体积统计图;
图11为上述处理后瘤体的重量统计图;
图12肿瘤组织的HE染色照片。
具体实施方式
以下结合实例对本发明的原理和特征进行描述,所举实例只用于解释本发明,并非用于限定本发明的范围。
发明人在实验过程中试验了包括RADA16肽在内多种水凝胶材料,结果都发现不适合搭载杀伤性多肽。发明人尝试增加RADA单元的数目。出乎意料地,当RADA单元的数目增加到7-9(即,RADA28肽-RADA36肽)时,可在所得到的肽序列的N端连接杀伤性多肽,并且仍然能形成水凝胶,并且所述水凝胶能够搭载抗肿瘤药物。在下文中,我们将以RADA32肽为例来制备本发明的一些实施例,所述可自组装成水凝胶的肿瘤杀伤性多肽的结构如图1所示。
1.RADA-KLA和RADA-melittin的合成
实验中所需的多肽分子均采用自动多肽合成仪合成,并通过高效液相色谱纯化,用质谱仪、氨基酸及多肽分析仪检测其纯度和序列。RADA-KLA的序列为AcN-RADARADARADARADARADARADARADARADAGGKLAKLAKKLAKLAK-NH2(SEQ ID NO:1),合成得到的纯度大于98%,分子量为4986.64 Da,RADA-melittin的序列为AcN-RADARADARADARADARADARADARADARADAGGGIGAVLKVLTTGLPALISWIKRKRQ-NH2(SEQ ID NO:2),纯度大于98%,分子量为6310.11 Da。
2.构建RADA-KLA水凝胶和RADA-melittin水凝胶
取10mg无菌RADA-KLA和RADA-melittin粉末分别溶解于500微升无菌三蒸水中,获得无色透明RADA-KLA多肽溶液和RADA-melittin多肽溶液,向溶液中分别加入500微升的1.8%NaCl溶液,将该混合液置于4℃下放置2小时。RADA-KLA多肽分子和RADA-melittin多肽分子可在盐离子触发下形成β-折叠结构,最终自组装为纤维纳米凝胶,KLA和melittin活性多肽暴露在纤维表面,水凝胶表面的电镜图如图2所示。
3.构建KLA-RADA-ICG(KRI)、Melittin-RADA-ICG(MRI)和Melittin-RADA-DOX(MRD)水凝胶
取20mg无菌RADA-KLA粉末溶解于500微升无菌三蒸水中,获得质量体积比为2%的RADA-KLA或RADA-melittin溶液,配置1mg/ml的ICG溶液(溶解于1.8%NaCl溶液中)。将2%RADA-KLA和RADA-melittin溶液分别与ICG溶液等体积混合后,获得1%多肽浓度的KLA-RADA-ICG(KRI)或Melittin-RADA-ICG(MRI)复合体,将该混合液置于4℃下放置2小时即可形成凝胶。
取20mg无菌Melittin-RADA粉末溶解于500微升无菌三蒸水中,获得质量体积比为2%的RADA-melittin溶液,配置20mg/ml的DOX溶液(溶解于1.8%NaCl溶液中)。将2%RADA-KLA或RADA-melittin溶液与ICG溶液等体积混合后,获得1%多肽浓度的Melittin-RADA-DOX(MRD)复合体(含DOX浓度为10mg/ml),将该混合液置于4℃下放置2小时即可形成Melittin-RADA-DOX(MRD)水凝胶。
4.RADA-melittin水凝胶的缓释性
分别将1mL的RADA-melittin水凝胶、1mL的melittin溶液放入截留分子量为25kD的透析袋中。将透析袋置于盛有500mL溶液(0.9%NaCl,pH=7.4)的烧杯中,在常温下以磁力棒搅拌(200转/分钟)。在48小时内,分别在不同的时间点取透析袋中的样本(2μL)进行检测,多肽浓度采用BCA法。在48小时透析过程中,透析液共换液8次,总体积为4L。如图3所示,RADA-melittin组较单独melittin组具有缓慢释放的特性。
5.MRI水凝胶和KRI水凝胶的细胞杀伤能力
在PI和DAPI荧光双染实验中,在24孔板中预先加入不同体积的MRI水凝胶(或KRI水凝胶)、RADA水凝胶、PBS溶液,凝胶直接铺满孔板表面。随后在以上每个孔板中加入2×104个细胞,孵育24小时。去掉培养基后,用PBS清洗细胞二次,随后在孔板中加入钙黄绿素(calcein-AM,2μL/mL)和碘化丙啶(PI,3μL/mL)染色30秒,接着用PBS清洗细胞两次,最后采用荧光显微镜对细胞进行荧光观察,红色代表凋亡和坏死的肿瘤细胞,绿色代表正常细胞。如图4所见,单独的PBS和RADA水凝胶处理组为观察到红色细胞,而MRI水凝胶组几乎全部为红色斑点,说明MRI水凝胶组能完全杀死C6细胞。而KRI水凝胶组能观察到部分红色和部分绿色细胞,证明KRI水凝胶对C6细胞也能起到较强的杀伤作用。
MTT实验定量检测MRI水凝胶的细胞杀伤能力:在96孔板中预先加入不同体积的MRI水凝胶、RADA水凝胶、PBS溶液,凝胶直接铺满孔板表面。随后在以上每个孔板中加入5×103个细胞,孵育24小时。去掉培养基后,用PBS清洗细胞三次,随后采用MTT法对存活的细胞进行分析检测。如图5所示,RADA水凝胶对细胞的增殖有部分促进作用,而随着体积的增加,MRI水凝胶对C6细胞的杀伤逐渐增强,加入50μL的MRI水凝胶时细胞杀伤率达到98%,充分证明了MRI水凝胶对肿瘤细胞的较强杀伤能力。
6.MRI水凝胶的光热小英
取20μL的MRI水凝胶、RADA水凝胶和PBS溶液,分别加入到直径为10cm的细胞培养皿中,形成直径约为1cm的圆形水滴。采用808nm的近红外激光器以2W/cm2的功率对以上液滴照射3min,每隔30秒记录一次温度变化。如图6所示,在激光照射处理下,RADA水凝胶和PBS溶液未出现明显温度变化,而MRI水凝胶则出现了较大幅度的温度上升,MRI水凝胶中心区域温度接近80℃,证明其具有较强的光热转换能力。
7.MRI水凝胶的在体内对ICG的缓释和保护作用
建立裸鼠皮下移植瘤:以每只鼠1×106个C6细胞的接种量种植于裸鼠皮下,待肿瘤体积达到约100mm3(大约10天)时注射50μL的MRI水凝胶和RADA水凝胶。
将MRI水凝胶和浓度为0.5mg/mlICG溶液分别注射至裸鼠皮下瘤体中,在注射后24h利用小动物荧光成像系统检测肿瘤部位的荧光信号,结果发现单独ICG组降解很快,到24h时荧光信号非常弱。而MRI水凝胶组能明显维持较强的ICG荧光信号,且主要蓄积在肿瘤部分(图7和8)。该实验结果证实MRI水凝胶可以保护并缓释ICG,为ICG的光热治疗提供基础,同时减少ICG在正常组织的分布。
8.MRI水凝胶和KRI水凝胶的抗癌动物实验
建立裸鼠皮下移植瘤:以每只鼠1×106个C6细胞的接种量种植于裸鼠皮下,待肿瘤体积达到约100mm3(大约10天)时分别注射75μL的MRI水凝胶、KRI水凝胶、RADA水凝胶,以及PBS,并分别做激光照射的对照组。第2天开始激光照射并同时记录照射过程中肿瘤部分温度变化情况,第3天拍照观察肿瘤情况。分别于激光照射后第2、4、6、8、10天测量肿瘤大小。MRI水凝胶和KRI水凝胶的功能验证分两次独立动物实验分别开展。
激光照射能明显提高KRI水凝胶组的瘤内温度,温度升高最高值达22℃(图9),而其它处理组温度上升值均在10℃以内。激光照射后第2天可见KRI水凝胶组肿瘤部分开始结痂,提示KRI水凝胶具备活体光热效应。
经过MRI水凝胶联合激光照射处理的小鼠,肿瘤体积一直保持在较低的水平(图10),在第10天时也仅只有1只小鼠存在较小的肿瘤。MRI水凝胶联合激光照射处理组肿瘤体积小于IRADA-ICG(RI)水凝胶联合激光照射处理组,两组的肿瘤在体积上和重量上均有显著性差异(图11)。由HE组织染色(图12)可以看出,相比较PBS处理组,单独的MRI水凝胶处理组能明显引起肿瘤细胞的凋亡和坏死,以及小核免疫细胞的聚集,提示MRI水凝胶能促进体内肿瘤细胞的凋亡和坏死。
9.Melittin-RADA-DOX水凝胶的抗癌动物实验
除了装载ICG以外,RADA-Melittin水凝胶也可以装载肿瘤化疗药物,比如DOX。建立C57BL/6皮下移植瘤:以每只鼠5×106个小鼠黑色素瘤B16细胞的接种量种植于C57BL/6皮下,待肿瘤生长约10天时分别注射50μL的Melittin-RADA-DOX水凝胶、RADA-Melittin水凝胶、以及PBS,于药物注射后第10天取下肿瘤进行拍照。Melittin-RADA-DOX水凝胶组相较于PBS和RADA-Melittin水凝胶组,其肿瘤体积明显缩小,充分证明了Melittin和DOX具有协同促进抑制肿瘤的功效。
以上所述仅为本发明的较佳实施例,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
序列表
<110> 华中科技大学同济医学院附属协和医院
<120> 一种可自组装成水凝胶的肿瘤杀伤性多肽及其应用
<130> 1
<160> 2
<170> PatentIn version 3.5
<210> 1
<211> 48
<212> PRT
<213> 人工序列
<400> 1
Arg Ala Asp Ala Arg Ala Asp Ala Arg Ala Asp Ala Arg Ala Asp Ala
1 5 10 15
Arg Ala Asp Ala Arg Ala Asp Ala Arg Ala Asp Ala Arg Ala Asp Ala
20 25 30
Gly Gly Lys Leu Ala Lys Leu Ala Lys Lys Leu Ala Lys Leu Ala Lys
35 40 45
<210> 2
<211> 59
<212> PRT
<213> 人工序列
<400> 2
Arg Ala Asp Ala Arg Ala Asp Ala Arg Ala Asp Ala Arg Ala Asp Ala
1 5 10 15
Arg Ala Asp Ala Arg Ala Asp Ala Arg Ala Asp Ala Arg Ala Asp Ala
20 25 30
Gly Gly Gly Ile Gly Ala Val Leu Lys Val Leu Thr Thr Gly Leu Pro
35 40 45
Ala Leu Ile Ser Trp Ile Lys Arg Lys Arg Gln
50 55
- 还没有人留言评论。精彩留言会获得点赞!