抗体依赖性细胞介导的细胞毒性(ADCC)增强的奥法木抗体的制作方法
本发明属于基因工程领域,涉及一个通过改变已上市的奥法木(Ofatumumab,Arzerra)单抗的糖链组成,获得抗体依赖性细胞介导的细胞毒性显著性增强的抗体。本发明还涵盖了该抗体的制备方法及其在治疗肿瘤,尤其是CD20高表达的慢性淋巴瘤,非霍奇金氏淋巴瘤和弥漫性大B细胞淋巴瘤中的应用。
背景技术:
CD20(亦称为人B淋巴细胞限制性分化抗原)是前B细胞核成熟的B淋巴细胞上的疏水性跨膜蛋白(Valentine et al.,J.Bio.Chem.,1989,V264:11282-7)。研究发现,超过90%的非霍奇金氏淋巴瘤患者、慢性淋巴瘤患者及大B细胞淋巴瘤患者B细胞表面高度表达CD20分子(Anderson et al.,Blood,1984,V63:1424-33),但造血干细胞、原B细胞、正常浆细胞及其它组织中并未发现前述特征(Tedder et al.,Immunology,1985,V135:973-9)。基于此特征,Biogen公司于1997年上市了特异性针对CD20的人鼠嵌合型抗体Rituxan(Rituximab),用于治疗慢性淋巴瘤、非霍奇金氏淋巴瘤等,并在临床上成为治疗的金标准。Genmab公司随后在2009年上市了针对CD20大小环区域的全人抗体-奥法木单抗(ofatumumab),该抗体的补体依赖性细胞毒性(CDC)远高于Rituxan,已被FDA批准用于慢性B细胞淋巴瘤的一线治疗,目前该品种正在进行非霍奇金氏淋巴瘤一线治疗的临床研究。
目前抗体依赖性细胞介导的细胞毒性(ADCC)增强的第三代抗CD20单抗Gavyza(obinutuzumab)已在与Rituxan头对头的临床试验中显示出压倒性的临床优势,证实了ADCC活性在以CD20为靶点的抗体治疗中占据非常核心的地位。Herter等对奥法木单抗(ofatumumab)与Rituxan开展的头对头对比研究表明,奥法木单抗在体外和动物体内的各项活性指标均不逊于Rituxan,且其补体依赖性细胞毒性(CDC)远高于Rituxan(Herter et al.,Mol.Cancer.Ther.2013;12:2031-42)。因此,进一步改善奥法木单抗的抗体依赖性细胞介导的细胞毒性,将赋予其更重要的临床意义。
技术实现要素:
基于ADCC活性在CD20抗体临床治疗中的突出作用,及奥法木单抗在ADCC活性的提升空间及可能性,本发明通过改变奥法木(ofatumumab)单抗的糖链组成提升其生物学活性,获得一个具有更高生物学活性的新抗体。其抗肿瘤活性的提升在本发明中已通过细胞水平的体外试验及动物水平的体内药效试验证实。
同时,优选CHO表达系统替代NS0表达系统,从而降低或消除NS0系统表达奥法木单抗时含有的Di-α1,3GalGal糖修饰的组分,使本发明单抗具有更低的免疫原性;
本发明的另一个目的是提供上述单抗的制备方法及其在抗肿瘤药物中的应用。
本发明是通过下列技术措施实现的:
一个通过改变奥法木(ofatumumab)单抗的糖链组成提升其生物学活性的抗体及其制备方法。
根据所述抗体,其特征在于:其一级氨基酸序列与奥法木(ofatumumab)单抗一级氨基酸序列一致,但其在表达过程中修饰抗体的糖链与修饰奥法木单抗糖链不同,使其生物学活性较奥法木抗体显著增强。
根据所述抗体,其特征在于:通过降低修饰抗体的糖链中岩藻糖含量,增强抗体依赖性细胞介导的细胞毒性。
根据所述抗体,其特征在于:由碳水化合物所组成的修饰抗体的糖链中,具岩藻糖的糖链占修饰抗体的总糖链的质量百分比不高于20%。
根据所述抗体,其特征进一步在于:由碳水化合物所组成的修饰抗体的糖链中,具岩藻糖的糖链占修饰抗体的总糖链的质量百分比不高于5%。
根据所述抗体,其特征进一步在于:由碳水化合物所组成的修饰抗体的糖链中,不含岩藻糖。
根据所述抗体,其特征在于由真核宿主细胞在添加了L-岩藻糖类似物的培养基中翻译表达。
根据所述岩藻糖类似物,优选5-炔基-L-岩藻糖、2-脱氧-2-氟-L-岩藻糖以及他们相应的过酰化衍生物。
根据所述岩藻糖类似物,优选2-脱氧-2-氟-L-岩藻糖以及相应的过酰化衍生物。
根据所述岩藻糖类似物,优选2F-Peracetyl-Fucose。
根据所述宿主细胞,优选NS0细胞系、SP2/0细胞系及CHO细胞系。
根据所述宿主细胞,优选CHO细胞系。
一种组合物,所述组合物包含上述抗体。
所述的抗体及其制备方法在制备抗肿瘤药物的应用。
所述的抗肿瘤药物及其应用,优选慢性淋巴瘤,非霍奇金氏淋巴瘤和弥漫性大B细胞淋巴瘤。
以下主要提供本发明的主要步骤:
通过降低或去除岩藻糖提升目的单抗ADCC活性的主要技术是集中在细胞基因水平层面上进行改造,如Biowa公司的POTELLIGENT(R)技术和罗氏的GlycoMAb技术。本发明突破性的通过调节细胞的代谢途径而实现了降低或去除目的单抗中岩藻糖含量,如培养过程中添加岩藻糖类似物,通过工艺控制对修饰抗体的糖链组成进行调节,达到了显著性提升单抗ADCC活性的目的。
抗体在哺乳动物细胞中需要以GDP-fucose为底物,通过岩藻糖转移酶进行α-1,6fucose修饰,细胞内GDP-fucose可以通过利用葡萄糖从头(合成)途径或者利用游离的岩藻糖从补救途径生成。胞内的GDP-fucose水平会对从头(合成)途径的酶(如GMD)产生反馈抑制,或者抑制岩藻糖转移酶的活性,从而影响核心岩藻糖修饰。通过在培养过程中添加岩藻糖类似物,如2F-Peracetyl-Fucose(简称2F),形成GDP-2F-fucose,抑制正常的GDP-fucose的合成,并且抑制岩藻糖转移酶活性,从而获得低岩藻糖含量的糖链抗体,该抗体较奥法木单抗具有更高的ADCC活性。同时,该法较通过基因工程化改造细胞(如格黎卡特生物技术股份公司申请专利方法,CN02818173.5)更加便捷,抗体产量也显著增加。
本发明的有益效果
本发明主要的优点:获得的抗体保持与奥法木单抗相似的安全性同时,获得更高的ADCC活性,这种改变在临床上将有益的降低因患者对抗体发生治疗性抵制的几率。基于本发明所制备的单抗,在临床的药效及安全性方面都显著高于现有的奥法木单抗,具有显著的先进性,也符合我国生物医药开发方面的引进、消化再吸收的开发理念,降低了药物开发的风险。
附图说明
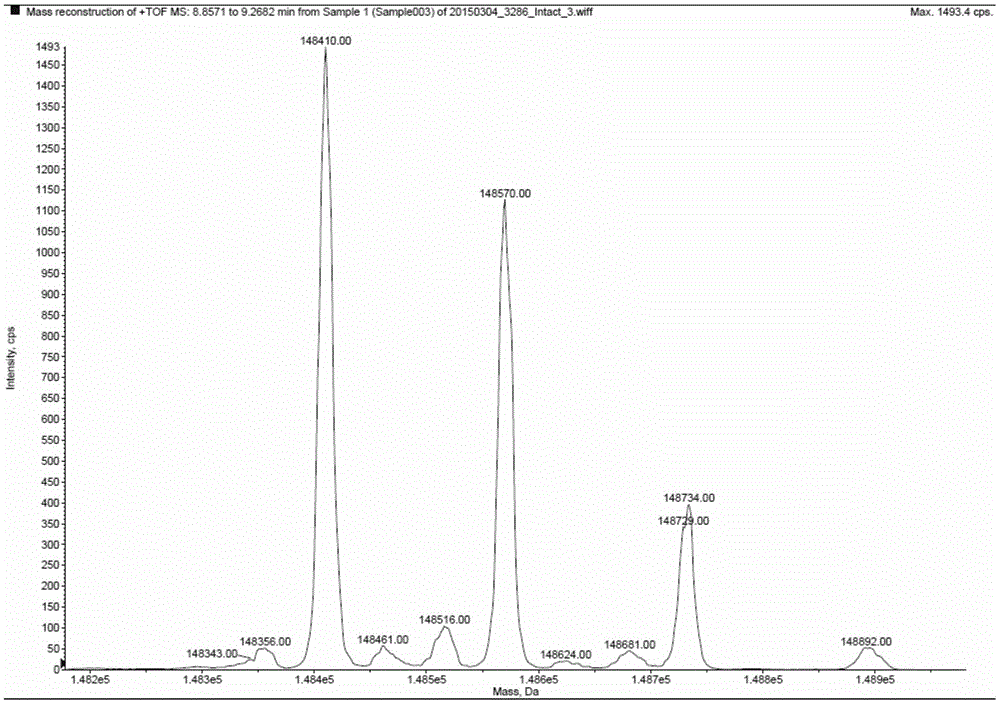
图12F-Peracetyl-Fucose处理的抗体ADCC提升单抗的MS图谱。
图25-Alkynyl-Fucose处理的抗体的MS图谱
图3CHO表达的奥法木单抗MS图谱。
图4原研奥法木单抗MS图谱。
图5抗体修饰糖链的示意图。
图6奥法木单抗通过修饰糖链ADCC活性改变前后其动物体内抑瘤效果比较
具体实施方式
下面结合具体实施例对本发明作进一步阐述,但不限制本发明。在此,我们证明了本发明中制备的抗体与奥法木单抗相比:通过降低抗体中修饰糖链的岩藻糖含量,获得较奥法木单抗具有更高的ADCC活性的抗体,在体内出示了更强的抗肿瘤活性。
实施例1用不同岩藻糖类似物制备岩藻糖敲除的抗体
在本发明中,基于稳定表达奥法木单抗的CHO(DG44)来源的细胞株ET-4-66(其筛选过程参见于鹏展等,对蒙古人和高加索人种低免疫原性的抗CD20的人抗体,申请号CN201410003725.6,其全部内容在此文引作参考),通过调控岩藻糖在其细胞中的代谢过程,获得低岩藻糖含量的糖链抗体。
复苏:从液氮罐中取存有ET-4-66工作细胞的冻存管一支(装量1.5ml),37℃水浴化冻,立即将种子液转入含有20-30mL CD FortiCHO培养基的125mL摇瓶中。将摇瓶放置于CO2培养箱中,37℃,8%CO2,130rpm培养。
接种:取对数生长期的细胞按照0.8-1.2×106cells/mL细胞密度接种于125mL摇瓶中,培养体积30mL,在培养基中分别添加200μM、100μM、50μM的2F-Peracetyl-Fucose和5-Alkynyl-L-fucose,培养至4-5×106cells/mL密度时,按0.8-1.2×106cells/mL重新接种于含上述岩藻糖类似物的新鲜培养基中连续培养9天,培养上清经亲和层析纯化得到藻糖敲除的抗体,与奥法木单抗进行糖及活性的比较研究。
实施例2高ADCC活性抗体制备
复苏:从液氮罐中取存有ET-4-66工作细胞的冻存管一支(装量1.5ml),37℃水浴化冻,立即将种子液转入含有20-30mL FortiCHO(添加MTX500nM)培养基的125mL摇瓶中。将摇瓶放置于CO2培养箱中,37℃,8%CO2,130rpm培养2-3天。
摇瓶扩种:当细胞密度增加至1.5-3.5×106cells/mL时,对细胞进行扩种。操作时根据需要,补充适量的新鲜FortiCHO培养基,扩种后细胞的密度在0.4-0.6×106cells/mL。根据细胞液体积更换摇瓶,培养体积不超过摇瓶总体积的1/3。。N-1代开始添加50μM的2F-Peracetyl-Fucose培养(N指生产用的细胞培养代次),用于反应器实验。
以0.8-1.2×106cells/mL细胞密度接种,根据实验方案中(见表1)设计的补料策略和培养条件进行添加和控制,反应器参数控制如下:
工作体积:起始1.2L培养基
温度:控制在36.5℃
pH:设定7.0±0.05,分别用CO2和0.5M NaHCO3PID反馈控制
DO:设定40%(以空气中氧气为100%),用氧气PID反馈控制
转速:控制80-250rpm,起始转速80rpm,接种后1hr,转速提高至150rpm,第5天转速提高200rpm,若sparger通气量超过100ml/min,转速可提高至250rpm。
气体控制:Overlay压缩空气40-150ml/min
Sparger CO2PID反馈控制pH设定上限300ml/min
O2 PID反馈控制DO设定上限300ml/min
每天取样,观察细胞生长状态,计算活细胞数量和细胞活率,用Nova进行生化分析,并移取大于1ml样品在1000rpm,3min条件下离心,取上清-80℃保存。
当细胞活率低于70%,或者活细胞数是峰值的一半时,停止培养收获细胞,离心留取上清纯化。纯化主要步骤包括深层过滤、亲和层析、酸孵育灭活、阳离子交换层析、阴离子交换层析、纳滤及超滤步骤。纯化后的ADCC提升抗体进行动物体内药效实验
实施例3本发明所述抗体的糖型分析
糖型的解析主要基于ESI-QTOF对抗体重链以结合形式存在的糖链进行分析,图1至图3是基于QSTAR XL(AB Sciex)质谱仪分别对岩藻糖敲除的单抗和原研品奥法木单抗的测试糖谱。2F-Peracetyl-Fucose处理的抗体(图1)、5-Alkynyl-L-fucose处理的抗 体(图2)、CHO表达的奥法木单抗(图3)与原研奥法木单抗(图4)其MS图谱具体解析见表2。
从表2的MASS结果可知,相比于奥法木原研品和未处理抗体,培养过程中通过添加2F-Peracetyl-Fucose和5-Alkynyl-L-fucose完全改变了抗体的修饰糖链。在质谱图上表现为各主要信号峰的分子量为在原研品的主要峰型基础上,都减去了292Da的分子量(2个岩藻糖残基分子量)。通过确证,确定皆脱掉了2个岩藻糖(由于单抗是2个相同重链通过链间二硫键连结在一起),所以培养过程中,添加2F-Peracetyl-Fucose和5-Alkynyl-L-fucose均能有效移除岩藻糖。
实施例4本发明所述抗体ADCC活性的比较分析
ADCC效应测定是基于工程化改造的NK细胞进行,测定抗体对Wil2-s细胞的杀伤。
Wil2-s靶细胞准备:取处于对数生长期的靶细胞Wil2-s,1000rpm,离心5分钟,用RPMI 1640(#11835)洗涤一次,调整细胞浓度为5×105/ml,在96孔圆底板中(除了效应细胞自发荧光对照孔和空白背景对照孔外)每孔加入50μl;
用RPMI1640将原研药或其他待检测样品稀释至1μg/ml,然后做5倍梯度稀释,稀释9个点,另外增加一个不含抗体的空白点;96孔板每孔加入50μl与靶细胞混合,每个浓度做2个复孔;
96孔板在37℃,5%CO2孵育30分钟;
NK-92MI/CD16a效应细胞:取对数生长期的效应细胞NK-92MI/CD16a,1000rpm,离心5分钟,用RPMI 1640洗涤一次,调整细胞浓度为5×105/ml,在96孔圆底板中(除了靶细胞自发荧光对照孔和靶细胞最大裂解对照孔外)每孔加入100μl;
96孔板在37℃,5%CO2孵育4小时;
用CytoTox-ONE试剂盒检测荧光信号:
a)96孔板孵育结束后放置室温,平衡20~30分钟;所有检测试剂均先平衡至室温;
b)靶细胞最大裂解孔内每孔加入4μl裂解液;
c)96孔板1000rpm,离心5分钟;
d)取上清100μl,移至96孔黑板(#3904);
e)每孔加入100μl反应底物,室温放置10分钟;
f)每孔加入50μl反应终止液,混合均匀。
在酶标仪SpectraMax M5记录Fluorescence Ex560nm/Em590nm信号。
数据处理:
a)所有值应先减去空白对照组值;按下面公式计算杀伤率ADCC%=[(实验组-靶细胞自发释放组-效应细胞自发释放组)/(靶细胞最大释放组-靶细胞自发释放组)]×100%
b)X轴数据为log转换的原研药的质量浓度(ng/ml),Y轴数据为ADCC%。
c)用GraphPad Prism 5作非线性回归,使用4参数公式f(x)=B+(A-B)/(1+10^((C-x)*D))拟合获得测试样品杀死Wil2-s细胞的回归曲线。计算EC50,R2等。
从表3可以看出,通过添加岩藻糖替代物2F-Peracetyl-Fucose和5-Alkynyl-L-fucose,改变细胞株的代谢流,从而制备出高ADCC活性的抗体,该抗体的ADCC活性(EC50为0.1718~0.3372ng/mL)与罗氏新批准的ADCC提升的Gazyva单抗相似(EC50为0.3836ng/mL),远高于原研奥法木单抗和CHO表达得奥法木单抗的ADCC活性(EC50分别为2.718ng/mL和3.097ng/mL)。从而支持了本专利中所述:通过添加岩藻糖类似物调控细胞的代谢,从而获得低岩藻糖含量的抗体。
实施例5本发明所述抗体体内活性的评价
BALB/cA-nude裸小鼠,6-7周,♀,裸小鼠皮下接种人B细胞淋巴瘤Daudi细胞,待肿瘤生长至100-150mm3后,将动物随机分组(D0)。给药剂量和给药方案见表4。每周测2-3次瘤体积,称鼠重,记录数据。肿瘤体积(V)计算公式为:
V=1/2×a×b2其中a、b分别表示长、宽。
T/C(%)=(T-T0)/(C-C0)×100%其中T、C为实验结束时的肿瘤体积;T0、C0为实验开始时的肿瘤体积。
给药方案及实验结果见表4及图6。奥法木单抗、ADCC提升单抗(3mg/kg,IV,每周2次,共4次)明显抑制CD20阳性B细胞淋巴瘤Daudi裸小鼠皮下移植瘤的生长,抑瘤率分别为84%和95%,奥法木单抗组有2/6肿瘤部分消退;ADCC提升抗体组有2/6肿瘤部分消退和1/6肿瘤完全消退;对照药物Gazyva相同剂量和方案对Daudi的抑瘤率为89%,有1/6肿瘤部分消退和1/6肿瘤完全消退;另一个参比药物美罗华(30mg/kg,IV,每周2次,共4次)对Daudi的抑瘤率为109%,有1/6肿瘤部分消退和2/6肿瘤完全 消退。荷瘤小鼠对以上药物均能很好耐受,没有体重减轻等症状发生。ADCC提升抗体对Daudi的疗效强于奥法木,与Gazyva相似。
表1 2F应用于3L反应器性能测试实验设计
备注:葡萄糖控制>2.5g/L;
EFC:第3天开始每天按初始工作体积在线补加3%(V/V),补加总量为33-36%;
Tyr:第7天添加1/500(V/V),第13天添加1/1000(V/V);
Cys:第7天添加1/100(V/V),第13天添加1/200(V/V);
表2 奥法木单抗与ADCC提升样品的MS信号峰解析
表3.细胞水平测定的ADCC结果
表4.各抗体对人B细胞淋巴瘤Daudi裸小鼠皮下移植瘤的疗效。
注:D0:第一次给药时间;P值指与溶剂相比;采用Student’s t检验。实验开始时小鼠数目:溶剂组n=12,治疗组n=6。
- 还没有人留言评论。精彩留言会获得点赞!