一种创制耐热芥蓝种质的方法与流程
本发明属于芥蓝育种技术领域,具体地,涉及一种创制耐热芥蓝种质的方法。
背景技术:
芥蓝(Brassica oleracea var.alboglabra Bailey)为十字花科芸薹属蔬菜作物,起源于中国(瓦维洛夫,1935),原产中国南部(中国科学院华南植物研究所,1956),最早对芥蓝进行分类研究的Bailey (1922)所用的研究材料就来自广州。芥蓝为华南地区的特产蔬菜之一,具有色泽翠绿、质地脆嫩和营养丰富的特征。近年来,已经被我国北方很多地区引种,并取得了成功,是中国优质创汇蔬菜之一。但芥蓝耐高温的能力比较差,一般都是在秋冬季栽培,早春可以栽培,初夏之际由于温度比较高,虽然在高温下也能生长,但产量低、品质变差。如果通过基因工程方法,创制耐热芥蓝种质,进而选育出耐高温的芥蓝新品种,则在高温条件下也能种植,可大大提高芥蓝栽培的经济效益。
高温胁迫是一种常见的非生物胁迫,植物在适应高温的过程中,进化出了一套严密的耐高温调控网络。多蛋白桥接因子1(Multi-protein Bridging Factor 1, MBF1)是一个高度保守的转录共激活子,该基因家族中的MBF1c是一个关键的耐热性调节因子,它在提高植物抗高温胁迫方面的能力尤为突出,在该基因的控制之下存在着一个紧密协调的热应激反应网络,包括海藻糖,水杨酸和乙烯信号转导途径,因此,可以通过超表达芥蓝BaMBF1c,创制耐热的芥蓝种质。
技术实现要素:
本发明针对现有技术的不足,提供了一种创制耐热芥蓝的方法,该方法通过构建含有BaMBF1c的重组载体,以及芥蓝的遗传转化,可以获得耐热性增强的芥蓝种质,对芥蓝新品种的选育有重要价值。
本发明的上述目的是通过以下技术方案予以实现的。
一种创制耐热芥蓝种质的方法,包括如下步骤:
S1. 构建含有如SEQ ID NO:1所示MBF1c基因的重组超表达载体;
S2. 将S1得到的重组超表达载体转化农杆菌,得到重组农杆菌;
S3. 用重组农杆菌转染芥蓝外植体,经培养获得转化植株,筛选得到耐热芥蓝。
S1所述MBF1c基因的DNA序列如SEQ ID NO:1所示,开放阅读框长(ORF)447bp。
进一步地,所述超表达载体的构建方法为:
S11. 利用超表达引物扩增得到MBF1c基因的ORF全长;
S12. 将S11克隆的片段连接到pBE-GFP载体,制得MBF1c基因的重组超表达载体。
进一步地,所述引物如SEQ ID NO:3~4所示,分别为:
MBF1-yxb –F: CGCGGGCCCGGGATCCATGCCGAGCAGAT;
MBF1-yxb –R: GGCGACCGGTGGATCCTTGACATGTTT。
进一步地,所述连接方法采用infusion技术。
进一步地,在农杆菌转染芥蓝外植体前,将所述芥蓝外植体放入分化培养基中,于25℃黑暗预培养2d。
进一步地,所述农杆菌转染芥蓝外植体后培养步骤如下:
S31. 外植体侵染后接种至分化培养基中,在25±1℃条件下恒温黑暗培养2d;
S32. 抑菌培养:接种于抑菌培养基中25 ℃培养3~5d;
S33. 筛选培养:接种于卡那霉素筛选培养基上,每两周继代一次,继代2~3次,直到只有少许外植体能在筛选培养基上长出抗性芽,而大部分外植体在含卡那霉素的筛选培养基上褪绿,变黄白化为止;
S34. 生根培养:当分化的不定芽伸长至1.5~2.5 cm时,将其自基部切下,接种于生根培养基中诱导其生根,炼苗2~3 d,移栽获得抗性芥蓝苗。
上述分化培养基、抑菌培养基、筛选培养基、生根培养基采用芥蓝组培领域常见的培养基即可。
进一步地,所述重组农杆菌转染芥蓝外植体时的OD600为0.4~0.8,转染时间为9min。
进一步地,所述卡那霉素浓度为10mg/L。
进一步地,所述芥蓝外植体为无菌带柄子叶和下胚轴。
进一步地,所述无菌带柄子叶和下胚轴获得方法为:将芥蓝种子经75%酒精、2%次氯酸钠消毒后,用无菌水浸泡,倒去无菌水,吸去种子表面的水分,在25~28℃黑暗条件下培养2d,然后把种子取出放到25℃、光照2000 lx 14 h/d培养条件下培养,待芥蓝小苗子叶展平时切下子叶和下胚轴即可。
与现有技术相比,本发明有益效果在于:提供了一种创制耐热芥蓝种质的方法,该方法通过构建含有耐热相关转录辅激活因子MBF1c的重组载体,创制出耐热性增强的材料,对芥蓝新品种的选育有重要价值。本发明经过2~3代筛选,获得抗性芥蓝,T0代转基因阳性率达47.1%。
附图说明
图1为BaMBF1c组织特异性分析。
图2为热胁迫后BaMBF1c的表达分析。
图3为重组质粒酶切检测图。
图4为BaMBF1c-pBE转化农杆菌杆菌EHA105后菌落PCR检测。
图5为BaMBF1c的遗传转化。
图6为T0代转化苗PCR检测。
图7为T0代转化苗RT-PCR检测。
具体实施例
实施例1 矮脚香菇芥蓝DNA的提取及BaMBF1c克隆
以25号矮脚香菇芥蓝叶片为材料,用改良的CTAB法提取DNA,步骤如下:
(1)取0.2~0.5g材料,加液氮磨成粉,将磨好的材料转入2mL的离心管中,加1mL含0.1%巯基乙醇(V/V)预热的2% CTAB提取液,充分混匀,置于65℃水浴45 min,期间不断摇动;
(2)10000rpm离心5min;
(3)冷却至室温,取上清液,加入等体积的苯酚/氯仿/异戊醇(25:24:1),轻轻摇动至溶液成乳化状,10000rpm离心5min;
(4)取上清液,重复步聚(3)1次;
(5)取上清液,加入2/3体积的异丙醇,-20℃放置30 min;
(6)10000 rpm离心5 min,弃上清液,70%乙醇清洗沉淀2~3次;
(7)加入200 µLTE溶解沉淀,加入1/10体积NaAC(3mol/L)和2倍体积无水乙醇,-30℃放1 h;
(8)12000 rpm 离心5 min,弃上清液,沉淀用70%乙醇洗2~3次,室温干燥沉淀;
(9)用60 µL灭菌双蒸水溶解沉淀,得到所需的DNA样品,-30℃保存;
(10)取1 µLDNA样品稀释至50倍,在Biophotometer核酸蛋白测定仪上测定OD260/OD280和OD260/OD230值,记录结果,判断DNA的浓度和纯度;
(11)取2 µL所提的DNA样品,用1.0%的凝胶,电泳检测DNA质量和浓度。
BaMBF1c DNA全长克隆
已知拟南芥AtMBF1c基因序列,甘蓝基因组测序已经完成,且与芥蓝基因组相似性很高,可以通过同源比对,在甘蓝基因组数据中调取MBF1c基因序列,并在在其开放阅读框两端设计特异PCR引物,以芥蓝DNA为模板,扩增出相应片段,连T载体后,挑取单克隆测序,获得BaMBF1c基因的核苷酸序列如SEQ ID NO:1 所示,其编码的氨基酸序列如SEQ ID NO:2 所示。
MBF1c全长扩增引物:
MBF1c全长(711bp)-up TCGAACTCTCCAGAAACTCGT
MBF1c全长(711bp)-dw CGTTTGCCAGATACGATGT
扩增的反应体系为:
DNA 模板1 μL,10×cDNA PCR buffer 2.5 μL,dNTP Mix(2.5 m mol /L)2 μL,上游引物 1 μL,下游引物(10 μmol/L)1.0 μL,Taq酶 0.25 μL,ddH2O 17.25 μL,总体积25.0 μL。
PCR 扩增程序为:94℃预变性3 min;94℃变性30 s,55℃退火30 s,72℃延伸40min,35个循环后再72℃延伸5 min。
实施例2 BaMBF1c表达分析
采用半定量PCR和qRT-PCR的方法进行表达分析。
芥蓝荧光内参引物
Tublin-F: CTTCTTTCGTGCTCATTTTGCC
Tublin-R: CCATTCCCTCGTCTCCACTTCT
MBF1c荧光特异引物
MBF1c YG1-UP :GTTAACGCGGCTCTCAGAAG
MBF1c YG1-DW :TCCTCCAGCTTCTTCGTGTT
1.BaMBF1c组织特异性表达分析
田间取样,抽薹后,未开花前,分别取38号芥蓝(中花芥蓝)的老叶、成熟叶、嫩叶、叶脉、叶柄、第一二节薹、第三四节薹、花薹外皮、花蕾、老根、嫩根,提RNA反转为cDNA后做qRT-PCR,每个反应设3次重复,以tublin为内参,取三个生物重复。结果(图1)表明,老根的BaMBF1c表达量最大,其次是叶脉,嫩根中表达量相对较低,其他组织表达量相差不大。
2.热胁迫对BaMBF1c表达的影响
用25号矮脚香菇芥蓝作材料,苗期4-6片真叶时,37℃分别处理0h、0.5h、1h、2h、4h、8h后,取叶片提RNA反转为cDNA后做qRT-PCR和半定量PCR,取三个生物重复,每个反应设3次重复,以tublin为内参。结果见图2,结果表明BaMBF1c在热胁迫后表达量急剧上升,随后呈下降趋势,随着处理时间的增加又呈现上升趋势,表明与耐热密切相关。
qRT-PCR反应体系如下:cDNA模板 1.0 μL、10 μL 2×SYBR GreenI MIX、10 μmol L-1正向引物0.2 μL、10 μmol L-1反向引物 0.2 μL,加水至总体积达到20 μL。
PCR程序:94℃ 2 min;94℃ 10 s,55℃ 20 s,72℃ 35 s,40个循环;产物用融解曲线分析, BIO-RAD 公司的IQ5软件收集数据。各基因在不同材料之间的相对表达量用CT值的2-△△CT法处理获得(Livak et al,2001)。
半定量PCR反应体系如下:cDNA模板 1.0 μL、2×Taq Mix(Vazyme)10 μL,10 μmol L-1正向引物0.2 μL、10 μmol L-1反向引物 0.2 μL,加水至总体积达到20 μL。
PCR程序:94℃ 2 min;94℃ 30 s,55℃ 30 s,72℃ 15 s,Tublin 26个循环;MBF1c 28个循环。
实施例3 构建BaMBF1c超表达载体
1.BaMBF1c超表达片段的克隆
根据实施例1中BaMBF1c基因全长的测序结果,在其ORF区两端设计引物,上游引物从起始密码子开始,下游引物5’端除去终止密码子及其前一个碱基,并在两端添加16个碱基的pBE-GFP载体的同源臂,pBE-GFP载体通过BamH I单酶切线性化,扩增的目的片段为475bp。
(1)特异引物:
MBF1-yxb –F CGCGGGCCCGGGATCCATGCCGAGCAGAT
MBF1-yxb -R GGCGACCGGTGGATCCTTGACATGTTT
(2)扩增体系:
质粒DNA模板 1.0 μL、2×Taq Mix(Vazyme)10 μL,10 μmol L-1正向引物0.5 μL、10 μmol L-1反向引物 0.5μL,加水至总体积达到50 μL。
(3)反应条件
94℃,3 min;94℃,30s,55℃,30s,72℃,30s,30个循环。
PCR产物用DNA凝胶回收试剂盒回收,-20℃保存备用。
2.pBE-GFP载体的线性化
采用碱裂解法提取大肠杆菌中的pBE-GFP空质粒,然后用BamH I单酶切pBE-GFP空质粒,37℃酶切过夜。酶切体系如下:10×buffer(K)2μL,质粒DNA 10 μL,BamH I1μL,加ddH2O至20 μL,混匀。
3.pBE-GFP空质粒和目的片段的连接
取酶切好的质粒和目的片段,利用Takara的in-Fusion酶进行连接。连接反应体系如下:in-Fusion酶2 μL,目的片段2μL,质粒载体1μL,加ddH2O 至10μL,混匀。50℃连接15min,在PCR仪中进行。
4.连接产物转化大肠杆菌
创制DH5α感受态细胞,将连接产物转化DH5α感受态,Km 100mg/L LB平板37℃培养过夜。第二天挑取单菌落用含Km 100 mg/L LB液体37℃摇菌过夜,菌液提取质粒。质粒用BamH I酶切检测(图3),酶切条带正确的送公司测序。插入正确片段的载体命名为pBE-GFP-BaMBF1c。
5.重组质粒转化农杆菌
(1)转化农杆菌感受态细胞
1)取新鲜创制的或-70℃保存的200μL农杆菌感受态细胞,置冰上,完全解冻后轻轻将细胞悬浮;
2)加入5μL CaMS1 pFGC5941-B质粒混匀后冰上放置30 min;
3)将离心管放入液氮中速冻5 min,37℃水浴中热激1 min,迅速将转至冰上,冰浴2 min;
4)加入1 mL YEP液体培养基,28℃振荡培养1 h;
5)4000 rpm离心5 min,留100 μL YEP培养液悬浮细胞;
6)将菌液涂布于含有Km 100 mg/L+Str 100 mg/L 的YEP平板上,28 ℃培养24-48 h。
(2)重组子鉴定
挑取长出的农杆菌菌落进行菌落PCR检测,能够扩增出目的片段(图4),说明植物表达载体已成功转入农杆菌中,-80℃保存备用于芥蓝的遗传转化。
实施例4 农杆菌介导的pBE-GFP-BaMBF1c转化芥蓝
(1)无菌芥兰外植体的获得
首先挑选饱满、粒大的芥蓝种子用无菌水冲洗2-3次,去除杂质,然后用75%酒精消毒90s,无菌水冲洗2~3遍,然后用2%次氯酸钠溶液消毒9 min(期间不断摇动),用无菌水洗3次,再用无菌水浸泡5 min,最后倒去无菌水,用灭菌滤纸吸去种子表面残留水分,播种在1/2 MS培养基中,置于人工培养室培养。25~28℃黑暗条件下培养, 2d即可以观察到下胚轴冒出,然后把种子取出放到温度27℃左右、光照2000 lx 14 h/d培养条件下培养,待芥蓝小苗子叶展平时即可制取外植体,从种子播种到可以创制外植体大约需要5d左右。
(2)预培养
培养基为MS+2.0mg/L 6-BA+0.05 mg/L NAA+7.0 mg/L 硝酸银+30%蔗糖+0.6%琼脂(PH5.8);外植体分别为下胚轴(约1cm)和带柄子叶;暗培养2d。
(3)农杆菌侵染及共培养
侵染前4d取出保存于-80℃的超低温冰箱中的含有表达载体的农杆菌,于YEP固体培养基上(Str 100 mg/L,Km 100 mg/L)划平板,28℃恒温培养24~48h。挑取单菌落置于10mL含Str 100mg/L、Km 100mg/L和AS 200mg/L的YEP液体培养基中,28℃下200rpm振荡过夜,次日转至50mL YEP液体培养基中,继续培养至OD600为0.4~0.8。
芥蓝外植体预培养2d后,在超净工作台上用准备好的农杆菌菌液浸染9min,期间不时摇动,然后放于经高温高压灭菌的滤纸上吹至半干,再接种到芥蓝共培养培养基中,培养基配方为MS+2.0mg/L 6-BA+0.05 mg/L NAA+7.0 mg/L 硝酸银+30%蔗糖+0.6%琼脂+ 100um/L AS(PH5.8)每瓶接种30个左右的外植体,并在(25±1)℃条件下恒温黑暗培养2~d。
(4)抑菌培养
将共培养2d芥蓝外植体接种于抑菌培养基中,培养基配方为MS+2.0mg/L 6-BA+0.05 mg/L NAA+7.0 mg/L 硝酸银+30%蔗糖+0.6%琼脂+ 300mg/L cef(PH5.8),光下培养,下胚轴抑菌培养5d,子叶抑菌培养3d(光照14h/d);
(5)筛选培养
外植体抑菌培养之后,接种于筛选培养基上,培养基配方为MS+2.0mg/L 6-BA+0.05 mg/L NAA+7.0 mg/L 硝酸银+30%蔗糖+ 0.6%琼脂+ 300mg/L cef +10mg/L Ka(PH5.8),光下培养15d(光照14h/d),每两周继代一次,继代2~3次。直到只有少许外植体能在筛选培养基上长出抗性芽,而大部分外植体在含卡那霉素的筛选培养基上褪绿,变黄白化为止。
(6)生根培养
当分化的不定芽伸长至1.5左右cm时,将其自基部切下,接种于生根培养基中诱导其生根,培养基配方为1/2MS+0.2 mg/L NAA +30%蔗糖+0.6%琼脂(PH5.8)。
(7)炼苗:当根的条数大于5条,长度大于1.5cm,且幼苗高度大于4cm时,打开瓶盖,注意在瓶口罩上一次性塑料手套,25度恒温箱中炼苗。
(8)移栽:炼苗2-3d后,移栽至营养钵或者花盆中,注意将根上的培养基充分洗净,刚移出的苗子注意覆盖塑料薄膜,每天掀开透气2h,至长出新叶后即可置于室外培养,如图5所示。
实施例5 BaMBF1c超表达芥蓝的分子生物学鉴定
1. T0代转基因植株的PCR检测
(1)引物序列
根据目的基因和GFP基因设计引物序列:
PBE-GFP-F:TCCTAACCAGGCCGTACTTG;
PBE-GFP-R:TCACTTGATGCCGTCTTCTG。
(2)PCR扩增反应体系
DNA 模板1 μL,10×DNA PCR buffer 2.5 μL,dNTP Mix(2.5 mmol/L)2 μL,上游引物(10μmol/L)1 μL,下游引物(10μmol/L)1 μL,rTaq酶 0.25 μL,ddH2O 17.25 μL,总体积25.0 μL。
(3)PCR扩增反应程序
94℃预变性5 min;94℃变性30 s,55℃退火30 s,72℃延伸30 s,30个循环。
(4)PCR阳性率及转化率数据统计方法
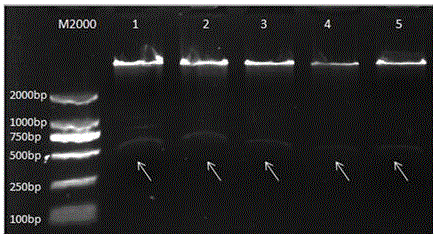
提取实施例4转化植株的基因组DNA,用Pbe-GFP基因的特异引物对51株转BaMBF1c基因的抗性芥蓝苗进行PCR检测,阳性植株能够扩增出约为570bp的目的条带(图6),阳性苗一共24株,PCR阳性率为47.1%,初步证明超表达载体已经转入芥蓝。
2. T0代转基因植株的RT-PCR检测
(1)引物序列
根据GFP基因设计引物序列:
GFP-F:TAAACGGCCACAAGTTCAGC;
GFP-R:CTGGGTGCTCAGTAGTGGTT 。
(2)PCR扩增反应体系
cDNA 模板1 μL,10×DNA PCR buffer 2.5 μL,dNTP Mix(2.5 mmol/L)2 μL,上游引物(10μmol/L)1 μL,下游引物(10μmol/L)1 μL,rTaq酶 0.25 μL,ddH2O 17.25 μL,总体积25.0 μL。
(3)PCR扩增反应程序
94℃预变性5 min;94℃变性30 s,55℃退火30 s,72℃延伸30 s,30个循环。
选取3株PCR检测阳性苗提取总RNA,反转录为cDNA做模板,用GFP基因的特异引物进行RT-PCR检测,阳性植株能够扩增出约为550bp的目的条带(图7),三株阳性苗都能检测到GFP基因的表达,说明MBF1c-GFP融合基因已经转入芥蓝植株内,并且能够正常表达。
SEQUENCE LISTING
<110> 华南农业大学
<120> 一种制备耐热芥蓝品种的方法
<130> 1613341ZBTX037-D
<160> 14
<170> PatentIn version 3.5
<210> 1
<211> 707
<212> DNA
<213> 人工序列
<400> 1
tcgaactctc cagaaactcg tctccttata taaagacctc tcctcccagc gacgccttca 60
tcgttctcaa tttcagaaac ttatcattat tatcatctct ctgagacatc aagttttaaa 120
caacagcgac gatgccgagc agatacccag gagccgtgac gcaagactgg gagccagtgg 180
tgctccacaa aactaagcca aagagccaag acctccgtaa tcccaaggcg gttaacgcgg 240
ctctcagaag cggcttagcg gttcagacgg tgaagaaatt cgacgccggt tcgaacaaga 300
aggggaaatc gacggctgtg ccggtgatca acacgaagaa gctggaggaa gagacggagc 360
cgtcggcgat ggatagggtg aaagcggagg tgaggctagc gatacagaaa gctcggttgg 420
agaagaagat gtcacaagcg gatctagcga aacagatcaa cgagcggaca caggtggttc 480
aagaatacga aaacgggaaa gctgttccta accaggccgt acttgccaag attgagaagg 540
ttctaggtgt taaactcagg ggtaaacatg tcaaataatt caaaacgatg ccgtctctgg 600
tttcgttctt ccttcttttg ggtgcacatc ttcctattct caatcttatg aatataaata 660
ataacgcttt tggcttcgta ttcaaacgac atcgtatctg gcaaacg 707
<210> 2
<211> 148
<212> PRT
<213> 人工序列
<400> 2
Met Pro Ser Arg Tyr Pro Gly Ala Val Thr Gln Asp Trp Glu Pro Val
1 5 10 15
Val Leu His Lys Thr Lys Pro Lys Ser Gln Asp Leu Arg Asn Pro Lys
20 25 30
Ala Val Asn Ala Ala Leu Arg Ser Gly Leu Ala Val Gln Thr Val Lys
35 40 45
Lys Phe Asp Ala Gly Ser Asn Lys Lys Gly Lys Ser Thr Ala Val Pro
50 55 60
Val Ile Asn Thr Lys Lys Leu Glu Glu Glu Thr Glu Pro Ser Ala Met
65 70 75 80
Asp Arg Val Lys Ala Glu Val Arg Leu Ala Ile Gln Lys Ala Arg Leu
85 90 95
Glu Lys Lys Met Ser Gln Ala Asp Leu Ala Lys Gln Ile Asn Glu Arg
100 105 110
Thr Gln Val Val Gln Glu Tyr Glu Asn Gly Lys Ala Val Pro Asn Gln
115 120 125
Ala Val Leu Ala Lys Ile Glu Lys Val Leu Gly Val Lys Leu Arg Gly
130 135 140
Lys His Val Lys
145
<210> 3
<211> 21
<212> DNA
<213> 人工序列
<400> 3
tcgaactctc cagaaactcg t 21
<210> 4
<211> 19
<212> DNA
<213> 人工序列
<400> 4
cgtttgccag atacgatgt 19
<210> 5
<211> 29
<212> DNA
<213> 人工序列
<400> 5
cgcgggcccg ggatccatgc cgagcagat 20
<210> 6
<211> 27
<212> DNA
<213> 人工序列
<400> 6
ggcgaccggt ggatccttga catgttt 27
<210> 7
<211> 20
<212> DNA
<213> 人工序列
<400> 7
gttaacgcgg ctctcagaag 20
<210> 8
<211> 20
<212> DNA
<213> 人工序列
<400> 8
tcctccagct tcttcgtgtt 20
<210> 9
<211> 22
<212> DNA
<213> 人工序列
<400> 9
cttctttcgt gctcattttg cc 22
<210> 10
<211> 22
<212> DNA
<213> 人工序列
<400> 10
ccattccctc gtctccactt ct 22
<210> 11
<211> 20
<212> DNA
<213> 人工序列
<400> 11
tcctaaccag gccgtacttg 20
<210> 12
<211> 20
<212> DNA
<213> 人工序列
<400> 12
tcacttgatg ccgtcttctg 20
<210> 13
<211> 20
<212> DNA
<213> 人工序列
<400> 13
taaacggcca caagttcagc 20
<210> 14
<211> 20
<212> DNA
<213> 人工序列
<400> 14
ctgggtgctc agtagtggtt 20
- 还没有人留言评论。精彩留言会获得点赞!