共转FPS和DBR2基因提高青蒿素含量的方法及制备的青蒿与流程
本发明涉及基因工程技术领域,特别是一种采用两个关键酶基因FPS和DBR2共转化的青蒿及其制备方法,该青蒿具有提高的青蒿素含量。
背景技术:
青蒿(Artemisia annua L.)是菊科蒿属的一年生草本植物。其地上部分所提取的含有过氧桥的倍半萜内酯化合物——青蒿素,是目前应用最广泛,疗效最好的抗疟疾药物,特别是对脑型疟疾和抗氯喹疟疾更加有效。目前,青蒿素联合疗法(ACTs)是世界卫生组织推荐的最有效的治疗疟疾的方法。但其青蒿素在植物青蒿中的含量很低,尚无法完全满足全球的市场需求。青蒿具有分泌型腺毛(glandular trichomes)和非分泌型腺毛(non-glandular trichomes)。在青蒿叶片的近轴面和远轴面、茎秆、花上都大量存在分泌型腺毛,这里是大量次生代谢物的合成和累积场所,青蒿素也被认为合成和储存于此处。
目前,青蒿素的主要来源是从植物青蒿中提取获得,作为青蒿中重要的一种植物次生代谢产物,其在青蒿中的含量非常低,大约为青蒿叶片干重的0.1%-1%,且青蒿素含量与青蒿品种、季节、生长环境、生长时期等密切相关。极低的生物含量与极大的市场需求,导致青蒿素价格居高不下。
虽然目前通过合成生物学化学半合成青蒿素获得较大突破,将青蒿素生物合成途径中的多步关键酶基因导入酵母基因组,成功在酵母中获得高产量的青蒿酸,青蒿酸再在体外经过化学方法合成获得青蒿素,该方法在实验室阶段获得成功,但是通过酵母发酵半合成前期设备成本较大,维护较难,且产量有限,不能完全满足市场需求。因此通过杂交育种,分子育种,基因工程育种等生物技术手段提高植物青蒿中青蒿素含量的方法仍然具有很大的竞争力和应用价值。
因此,本领域的技术人员致力于开发一种基因工程方法,打破青蒿素生物合成限速瓶颈,从而获得青蒿素高产的青蒿植株,为规模化生产青蒿素提供一条新途径。
技术实现要素:
有鉴于现有技术的上述缺陷,本发明所要解决的技术问题是提供一种提高青蒿中青蒿素含量的方法及青蒿植株。
为实现上述目的,本发明的一方面提供了一种提高青蒿中青蒿素含量的方法,在一个具体实施方式中,该方法将法尼基焦磷酸合酶FPS基因和青蒿醛Δ11(13)双键还原酶DBR2基因共转化青蒿。
进一步地,FPS基因的序列如SEQ ID No.1所示,DBR2基因的序列如SEQ ID No.2所示。
进一步地,该方法包括步骤:
1)采用基因克隆方法获得FPS基因和DBR2基因;
2)将所述FPS基因和DBR2基因连接于表达调控序列,形成含FPS基因和DBR2基因的植物双元表达载体;
3)将所述含FPS基因和DBR2基因的植物双元表达载体转化根癌农杆菌,获得用于转化青蒿的含FPS基因和DBR2基因的植物双元表达载体的根癌农杆菌菌株;
4)将含FPS基因和DBR2基因的植物双元表达载体的根癌农杆菌菌株转化青蒿,获得转基因青蒿植株。
进一步地,步骤2)中,含FPS基因和DBR2基因的植物双元表达载体的构建包括如下步骤:分别将FPS基因和DBR2基因连接到中间载体上,经过双酶切后将FPS基因和DBR2基因分别连入表达载体上,获得CaMV 35S-FPS-nos和CaMV 35S-DBR2-nos表达盒;通过无缝克隆技术将CaMV 35S-FPS-nos和CaMV 35S-DBR2-nos表达盒连入另一表达载体中,获得所述植物双元表达载体。
优选地,中间载体为pMD18T,表达载体为pCAMBIA1304,另一表达载体为pCAMBIA2300。
进一步地,步骤3)中,采用冻融法将上述植物双元表达载体转化根癌农杆菌。
进一步地,步骤4)中,根癌农杆菌菌株转化青蒿,包括外植体培养;根癌农杆菌菌株与外植体的共培养;抗性再生植株的筛选。其中外植体培养中,当青蒿无菌苗长至1.8-2.2cm时,剪取无菌苗叶片外植体。
进一步地,该方法还包括步骤5),对获得的转基因青蒿中的青蒿素含量进行高效液相色谱-蒸发光散射检测器测定,获得青蒿素含量提高的转基因青蒿植株。
优选地,高效液相色谱-蒸发光散射检测器测定包括:色谱柱C-18反相硅胶柱,流动相为甲醇:水,其中,甲醇:水的体积比为60:40,柱温30℃,流速1.0mL/min,进样量20μL,蒸发光散射检测器漂移管温度40℃,载气压力5bar。
本发明的另一方面提供了一种青蒿素含量提高的青蒿,该青蒿中共转化有FPS基因和DBR2基因。
本发明采用基因工程手段,将FPS基因和DBR2基因共转化青蒿,增强了青蒿的代谢途径,打破青蒿素生物合成限速瓶颈,从而获得青蒿素高产的青蒿植株,为规模化生产青蒿素提供一条新途径。
以下将结合附图对本发明的构思、具体结构及产生的技术效果作进一步说明,以充分地了解本发明的目的、特征和效果。
附图说明
图1本发明的一个较佳实施中的双元表达载体p2300:FPS+DBR2的载体结构示意图;
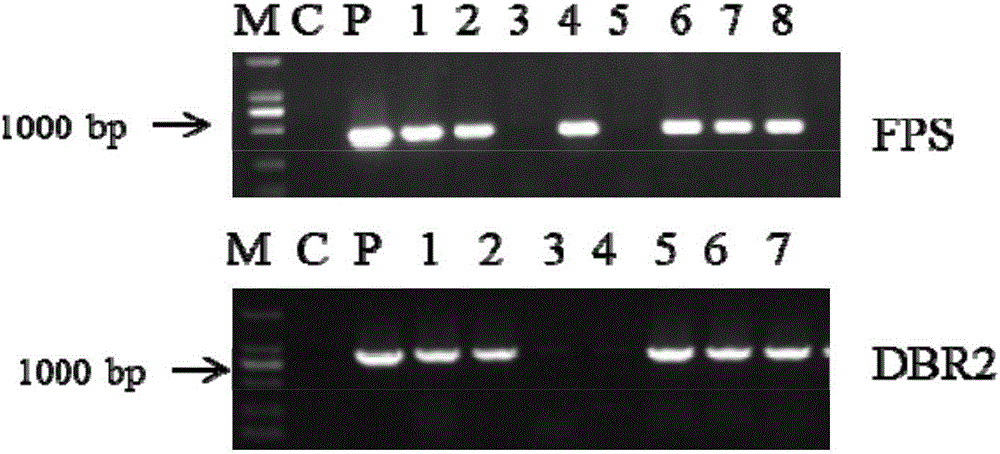
图2本发明的一个较佳实施中的独立的转基因青蒿株系中目的基因PCR检测结果图;其中,M为DL 2000DNA marker,C为空白对照;P为质粒;1-8或1-7为样品;
图3本发明的一个较佳实施的青蒿中青蒿素含量检测结果图。
具体实施方式
下列实施例中未注明具体条件的实验方法,通常按照常规条件,例如Sambrook等分子克隆:实验室手册(New York:Cold Spring Harbor Laboratory Press,1989)中所述的条件,或按照制造厂商所建议的条件。
实施例1、青蒿FPS和DBR2基因的克隆
法尼基焦磷酸合酶(FPS)是催化IPP,DMAPP缩合生成FPP的关键酶,FPP是植物中各类萜类物质的共同前体,也是青蒿素的前体物质。DBR2酶将青蒿醛催化成二氢青蒿醛。
1.青蒿基因组总RNA的提取
取青蒿叶片组织,置于液氮中研碎,加入盛有裂解液的1.5mL Eppendorf(EP)离心管中,充分振荡后,按照TIANGEN试剂盒的说明书抽提总RNA。用琼脂糖凝胶电泳鉴定总RNA质量,然后在分光光度计上测定RNA浓度与纯度。
2.青蒿FPS和DBR2基因的克隆
以所提取的总RNA为模板,在PowerScript反转录酶的作用下合成cDNA;根据所述青蒿FPS基因的编码序列(SEQ ID No.1所示),和DBR2基因的编码序列(SEQ ID No.2所示),分别设计扩增出完整的编码框的上下游引物(FPS-SpeI-FP:GGACTAGTATGAGTAGTACCGATCTGAAATC,FPS-BstEII-RP:GGGTTACCCTACTTTTGCCTCTTGTAAATT,DBR2-SpeI-FP:GGACTAGTATGTCTGAAAAACCAACCTTG,DBR2-BstEII-RP:GGGTTACCCTAGAGGAGTGACCCTTTG),并在上游和下游引物分别引入限制性内切酶位点SpeI和BstEII,以便构建表达载体。本领域技术人员可知,扩增引物可以根据情况有所变化,限制性内切酶位点也可以根据后续适用载体的不同而有所变化。
通过PCR从总cDNA中扩增FPS和DBR2基因并测序。DNA测序由上海美吉生物医药科技有限公司完成。测序结果表明,所克隆的序列与GenBank中所报道的青蒿FPS基因的编码序列(SEQ ID No.1所示)和DBR2基因的编码序列(SEQ ID No.2所示)的编码序列一致。
实施例2、含FPS和DBR2基因的植物表达载体的构建
1、中间载体pMD18T-FPS、pMD18T-DBR2的构建
选用pMD18T载体(Takara,Dalian)作为克隆载体,构建中间载体pMD18T-FPS、pMD18T-DBR2。具体地,通过使用高保真酶分别扩增FPS、DBR2基因全长,引物序列如表1所示。同时在FPS、DBR2基因两侧分别引入SpeI和BstEII酶切位点。将带有酶切位点的全长基因通过T4连接酶连接到pMD18T载体上,测序由上海美吉生物医药科技有限公司完成。
2、植物基因表达盒CaMV 35S-FPS-nos、CaMV 35S-DBR2-nos的构建
以pCAMBIA1304为表达载体,将FPS、DBR2分别连入其对应的酶切位点位置。具体地,分别用SpeI和BstEII双酶切中间载体pMD18T-FPS、pMD18T-DBR2以及表达载体pCAMBIA1304,纯化FPS、DBR2片段以及pCAMBIA1304大片段。连接后转化大肠杆菌感受态,挑取单克隆,做PCR菌液检测单克隆,阳性单克隆送测序。测序由上海美吉生物医药科技有限公司完成。此方法可获得FPS、DBR2的基因表达盒:CaMV 35S-FPS-nos、CaMV 35S-DBR2-nos。
3、植物双元表达载体pCAMBIA2300+FPS+DBR2的构建
将以上构建的CaMV 35S-FPS-nos、CaMV 35S-DBR2-nos表达盒依次连接于表达载体pCAMBIA2300中即可得到植物双元表达载体pCAMBIA2300+FPS+DBR2。具体地,应用无缝克隆技术将CaMV 35S-FPS-nos、CaMV 35S-DBR2-nos表达盒连入pCAMBIA2300的EcoRI和PstI酶切位点,转化大肠杆菌感受态,测序。引物序列如表1所示,测序由上海美吉生物医药科技有限公司完成。构建的双元表达载体示意图如图1所示。
表1 PCR引物
表2 PCR的反应体系
本实施例将青蒿素生物合成途径关键酶基因FPS和DBR2可操作性连接于表达调控序列,形成FPS和DBR2基因的植物表达载体,该表达载体可用于通过代谢工程策略来提高青蒿中青蒿素的含量。
实施例3、根癌农杆菌介导FPS和DBR2基因遗传转化青蒿获得转基因植株
1.含FPS和DBR2基因植物表达载体根癌农杆菌工程菌的获得
将实施例2中含FPS和DBR2的植物表达载体采用冻融法转入根癌农杆菌(如EHA105,为市场有公开出售的生物材料,可以从澳大利亚CAMBIA公司购得,菌株编号为Gambar 1),并进行PCR验证,验证结果如图2所示。结果表明,含FPS和DBR2的植物表达载体已成功转入到根癌农杆菌菌株中。
在采用冻融法将植物表达载体转入根癌农杆菌中时,在冰浴融化的农杆菌感受态细胞中加入植物表达载体后,先在42℃水浴30秒,然后转到37℃水浴5分钟,能更将转化率提高大约25%。
2.根癌农杆菌介导FPS和DBR2基因转化青蒿
2.1.外植体的预培养
青蒿种子用75%乙醇浸泡1min,再用20%NaClO浸泡10min,无菌水冲洗3-4次,用无菌吸水纸吸干表面水分,接种于无激素的MS(Murashige and Skoog,1962)固体培养基中,25℃、16h/8h(光/暗)光照培养,即可获得青蒿无菌苗。待苗长至2cm左右后,剪取无菌苗叶片外植体用于转化。
2.2.农杆菌与外植体的共培养
将所述的叶片外植体,转到共培养培养基(1/2MS+AS 100μmol/L)中,滴加含活化好的所述含FPS和DBR2的植物表达载体的根癌农杆菌工程菌的1/2MS悬液,使外植体与菌液充分接触,28℃暗培养3天。以滴加在不带有目的基因的根癌农杆菌的1/2MS液体培养基悬液的叶片外植体为对照。
2.3.抗性再生植株的筛选
将所述的共培养3d的青蒿外植体转入到发芽筛选培养基(MS+6-BA 0.5mg/L+NAA 0.05mg/L+Kan 50mg/L+Cb 500mg/L)上于25℃、16h/8h光照培养,每两周继代培养一次,经过2-3次继代后即可获得Kan抗性丛生芽。将生长良好的抗性丛生芽剪下转入生根培养基(1/2MS+Cb 125mg/L)上培养至生根,从而获得Kan抗性再生青蒿植株。
在2.2步骤农杆菌与外植体的共培养中,意外的发现当在活化好的含FPS和DBR2的植物表达载体的根癌农杆菌工程菌的1/2MS悬液中加入2%的PEG2000,再与外植体充分接触共培养时,能得到更多的Kan抗性再生青蒿植株,相对于不添加PEG2000的共培养获得的Kan抗性再生青蒿植株多约20%。
3.转基因青蒿植株的PCR检测
根据目的基因所在表达盒上游的35S启动子区域和FPS、DBR2分别设计正向引物设计(35SF:GACGTAAGGGATGACGCACAATCCC)和反向引物(FPSR:CAGGGTTGCCCTCTGCGTGTATG,DBR2R:AGCTAGTCTTGACCCTAATTTAAATTG)对目的基因进行检测。结果表明,利用所设计的PCR特异引物,能扩增出特异DNA片段。而以非转化青蒿基因组DNA为模板时,没有扩增出任何片段。
本实施例将所述的植物表达载体转化根癌农杆菌,获得用于转化青蒿的含FPS和DBR2植物表达载体的根癌农杆菌菌株,利用所构建的根癌农杆菌菌株转化青蒿,获得经PCR检测的转基因青蒿植株。
实施例4、利用HPLC测定转基因青蒿中青蒿素含量
1.HPLC条件及系统适用性以及标准溶液的配制
HPLC:采用water alliance 2695系统,使用Waters C18柱,青蒿素测定流动相使用甲醇:水体积比60%:40%;柱温为30℃,流速为1.0mL/min;ELSD检测系统为water alliance 2420,蒸发光散射检测器漂移管温度为40℃,放大系数为7,载气压力5bar;青蒿素出峰时间为7min左右。青蒿素进样体积为20uL。根据标准品的浓度和峰面积计算出样品中的青蒿素含量,再除以青蒿粉末干重,从而计算出青蒿素占样品干重的含量。精密称取青蒿素标准品(Sigma公司)2.0mg用1mL甲醇完全溶解,得到2mg/mL青蒿素标准品溶液,保存于-20℃备用。
2.样品的制备
选取4株青蒿植株,在青蒿植株的上、中和下部共取新鲜的青蒿叶片,于45℃烘箱中烘至恒重。然后从烘干的枝条上敲下叶片,磨成粉末。称取约0.1g干粉于2mL Eppendorf管中,加入2mL甲醇,用40W超声波处理30min,5000rpm离心10min,取上清用0.22μm滤膜过滤,即可用于HPLC测定。
本发明中共转化FPS和DBR2基因显著提高了青蒿中青蒿素的含量,结果如图3所示。共转化FPS和DBR2基因青蒿中青蒿素的含量最高可达到26.8mg/g DW,是非转化普通青蒿(mg/g DW)的3.36倍。
本实施例采用高效液相色谱-蒸发光散射检测器HPLC-ELSA法测定了转基因青蒿中青蒿素含量,采用共转化FPS和DBR2基因的代谢工程策略获得了青蒿素高产的青蒿植株,为规模化生产青蒿素提供了一种理想方法。
以上详细描述了本发明的较佳具体实施例。应当理解,本领域的普通技术无需创造性劳动就可以根据本发明的构思作出诸多修改和变化。因此,凡本技术领域中技术人员依本发明的构思在现有技术的基础上通过逻辑分析、推理或者有限的实验可以得到的技术方案,皆应在由权利要求书所确定的保护范围内。
序列表
<110> 上海交通大学
<120> 共转FPS和DBR2基因提高青蒿素含量的方法及制备的青蒿
<160> 13
<170> PatentIn version 3.5
<210> 1
<211> 1032
<212> DNA
<213> 青蒿(Artemisia annua L.)
<400> 1
atgagtagca tcgatctgaa atccaagttt ttaaaagtgt atgatacact taaatcagag 60
cttattaacg atcccgcctt cgaattcgac gatgattccc gtcaatggat tgaaaagatg 120
cttgactaca acatacctgg aggaaagctg aaccggggat tatctgttgt cgacagttat 180
cagcttctta aaggaggaga actgtctgat gacgagattt ttctttcatc tgcccttggt 240
tggtgtattg aatggcttca agcatacttt cttgtgcttg atgatataat ggacgagtct 300
catacacgca gagggcaacc ctgttggttt agattactca aggttggtat gattgctgcg 360
aacgatggaa ttcttcttcg caaccatgtc ccaagaattc ttaagaaaca tttccgtgga 420
aagccttact atgaggatct tgtggacctg ttcaacgagg ttgaattcca aacagcctct 480
ggtcagatga ttgatttgat cactacactt gttggagaga aagatctctc gaagtattca 540
ttgtctattc accgccgaat tgttcaatac aaaacagctt actactcatt ttaccttcca 600
gttgcctgtg cactccttat gtttggagag gatcttgaca agcacgttga agtgaagaac 660
atgctcgttg aaatgggtac ctattttcaa gttcaggacg attatctaga ctgttttggt 720
gctcccgagg tgattggaaa gattggaact gatattgaag actttaagtg ctcctggtta 780
gttgtcaagg cattggaact cgccaatgag gaacaaaaga aagtcctaca tgagaactat 840
gggaaaaagg accccgcgtc tgttgctaaa gtgaaggaag tataccacac tctcaatctt 900
caggctgtat tcgaagatta cgaggccaca agttacaaga agcttatcac atcgattgaa 960
aatcgcccaa gcaaagcagt ccaagcggtg ctgaaatctt tcttgggtaa aatctacaag 1020
aggcaaaagt ag 1032
<210> 2
<211> 1164
<212> DNA
<213> 青蒿(Artemisia annua L.)
<400> 2
atgtctgaaa aaccaacctt gttttctgcc tacaagatgg gcaagttcaa tctttctcac 60
agggtggtgt tagctcctat gactcggtgt cgggcaataa acgctatacc gaacgaagcg 120
cttgtcgaat attatcggca aagatcaact gctggtggct ttcttattac cgaggggact 180
atgatctctc cttcttctgc cgggtttccg cacgtaccgg gtatttttac taaggaacaa 240
gtcgagggtt ggaaaaaagt ggttgatgca gctcacaaag aaggggctgt gatattttgt 300
caattgtggc atgttggtag agcatcccat caagtgtacc aacccggtgg tgctgcgcca 360
atatcatcaa caagcaagcc catttcaaag aagtgggaaa tattattgcc agatgcaacc 420
tatggcacgt atcctgagcc ccgtccattg gcagccaatg aaatactaga ggtggttgaa 480
gactatcgcg ttgcagctat taatgctatt gaagcaggtt ttgatggcat tgaaatacat 540
ggagcacatg gttatctact tgaccagttc atgaaagatg gcataaatga cagaacggac 600
gaatatggtg ggtcattaga aaaccgctgc aaattcatac tgcaagtagt gcaagcggta 660
tctgcagcca ttggtacaga ccgagttggt attagaatct cccctgcaat cgatcacaca 720
gatgctatgg actctgatcc acgaagccta ggccttgcag taattgaaag actcaacaaa 780
ctacaattta aattagggtc aagactagct tatcttcatg taactcaacc acgttacacg 840
gctgatggtc atggtcaaac agaagcggga gccaatggaa gtgaggagga agtagctcag 900
ttgatgaaaa catggagagg agcttatgtg ggaactttta tatgctgcgg tggttacact 960
agagaacttg ggttacaagc tgtggctcaa ggggatgctg atttggtcgc ttttggtcgt 1020
tattttgtct cgaatcctga ccttgtttta agacttaagc tcaacgcacc tttaaatagg 1080
tatgacagag ctacttttta tacccatgat cctgtcgttg ggtacacgga ttacccttct 1140
cttgacaaag ggtcactcct ctag 1164
<210> 3
<211> 31
<212> DNA
<213> 人工序列
<220>
<223> FPS-SpeI-FP
<400> 3
ggactagtat gagtagtacc gatctgaaat c 31
<210> 4
<211> 30
<212> DNA
<213> 人工序列
<220>
<223> FPS-BstEII-RP
<400> 4
gggttaccct acttttgcct cttgtaaatt 30
<210> 5
<211> 29
<212> DNA
<213> 人工序列
<220>
<223> DBR2-SpeI-FP
<400> 5
ggactagtat gtctgaaaaa ccaaccttg 29
<210> 6
<211> 27
<212> DNA
<213> 人工序列
<220>
<223> DBR2-BstEII-RP
<400> 6
gggttaccct agaggagtga ccctttg 27
<210> 7
<211> 39
<212> DNA
<213> 人工序列
<220>
<223> FPS-cassette-FP
<400> 7
tatgaccatg attacgaatt catgagtagt accgatctg 39
<210> 8
<211> 39
<212> DNA
<213> 人工序列
<220>
<223> FPS-cassette-RP
<400> 8
ccgggtaccg agctcgaatt cctacttttg cctcttgta 39
<210> 9
<211> 41
<212> DNA
<213> 人工序列
<220>
<223> DBR2-cassette-FP
<400> 9
gatcctctag agtcgacctg cagatgtctg aaaaaccaac c 41
<210> 10
<211> 40
<212> DNA
<213> 人工序列
<220>
<223> DBR2-cassette-RP
<400> 10
gtgccaagct tgcatgcctg cagctagagg agtgaccctt 40
<210> 11
<211> 25
<212> DNA
<213> 人工序列
<220>
<223> 35SF
<400> 11
gacgtaaggg atgacgcaca atccc 25
<210> 12
<211> 23
<212> DNA
<213> 人工序列
<220>
<223> FPSR
<400> 12
cagggttgcc ctctgcgtgt atg 23
<210> 13
<211> 27
<212> DNA
<213> 人工序列
<220>
<223> DBR2R
<400> 13
agctagtctt gaccctaatt taaattg 27
- 还没有人留言评论。精彩留言会获得点赞!