苯丙素类和苯丙素类衍生物的生物合成的制作方法
发明背景
本文中公开的发明总体上涉及遗传工程领域。特别地,本文中公开的发明提供了用于生物合成产生苯丙素类(phenylpropanoid)和苯丙素类衍生物(例如查耳酮和茋)的方法。
相关技术说明
苯丙素类是植物中由酚类氨基酸前体生物合成产生的多样的酚类化合物家族。苯丙素类及其衍生物具有期望的应用,例如在食品和卫生保健工业中具有期望的应用。
一种示例性苯丙素类衍生物是柚皮素,该化合物也是下游苯丙素类衍生物产生中的中间体。柚皮素具有以下化学结构:
柚皮素在植物中天然产生,并且还在遗传改造成具有类黄酮生物合成途径组分的细胞中生物合成(参见例如,koopman等,(2012)microbialcellfactories2012,11:155)。例如,将改造成产生香豆酰coa的细胞进一步改造成具有表达将香豆酰coa转化成柚皮素的蛋白质的重组基因。
另一种示例性苯丙素类衍生物是茋类白藜芦醇,其也是产生其他下游苯丙素类衍生物中的中间体。白藜芦醇具有以下化学结构:
白藜芦醇也使用香豆酰coa前体分子产生。
一般来说,茋(包括白藜芦醇)和查耳酮在植物和酵母中通过苯丙素类途径产生,如图1中所示的反应举例说明的并且如u.s.2008/0286844中所述的,其通过引用整体并入本文。
在酵母中,起始代谢物是丙二酰coa和苯丙氨酸或酪氨酸。氨基酸l-苯丙氨酸通过l-苯丙氨酸解氨酶(phenylalanineammonialyase,pal)的非氧化脱氨被转化成反式-肉桂酸。接着,反式-肉桂酸通过肉桂酸-4-羟化酶(cinnamate-4-hydroxylase,c4h)、细胞色素p450单加氧酶并联合nadph:细胞色素p450还原酶(cytochromep450reductase,cpr)在对位被羟基化成4-香豆酸(4-羟基肉桂酸)。或者,氨基酸l-酪氨酸通过酪氨酸解氨酶(tyrosineammonialyase,tal)直接转化成4-香豆酸。来自任一途径的4-香豆酸随后通过4-香豆酸-coa连接酶(4-coumarate-coaligase,4cl)的作用被激活成4-香豆酰coa。在苯丙素类途径中,4-香豆酰coa代表由其衍生苯丙素类衍生物(包括查耳酮和茋)的关键分支点。茋通过也称为白藜芦醇合酶(resveratrolsynthase,rs)的茋合酶(stilbenesynthase,sts)合成,所述酶催化4-香豆酰coa的苯丙烷单元与丙二酰coa缩合,使得形成白藜芦醇。反之,查耳酮通过4-香豆酰coa的苯丙烷单元与丙二酰coa的缩合和查耳酮合酶(chalconesynthase,chs)合成,使得形成四羟基查耳酮。
当前产生柚皮素、白藜芦醇和其他苯丙素类衍生物的方法由于竞争苯丙素类(例如香豆酰coa)作为底物的途径而受到限制。例如,改造成产生柚皮素的细胞还通过未知的机制产生根皮酸(参见例如,koopman等,(2012)microbialcellfactories2012,11:155)。根皮酸是苯丙素类途径的一种副产物。其是一种二氢-苯丙素类,由苯丙素类(例如,对香豆酰coa)转化成二氢苯丙素类(例如,对二氢香豆酰coa)。然而,负责产生二氢苯丙素类(并降低柚皮素产生)的酶目前尚不知晓。
将l-苯丙氨酸转化成氨和反式-肉桂酸的苯丙氨酸解氨酶(pal)以及将l-酪氨酸转化成对香豆酸的酪氨酸解氨酶(tal)二者都是芳族氨基酸裂解酶家族的成员。芳族氨基酸裂解酶家族的第三成员是将组氨酸转化成反式-尿刊酸的组氨酸解氨酶(histidineammonialyase,hal)。大部分的解氨酶对苯丙氨酸和酪氨酸二者都具有亲和力,其中对苯丙氨酸具有较强的优先性。这些酶称为pal/tal。watts,k.t.等(2006)鉴定了负责底物特异性的单活性位点残基,并且报道在类球红细菌(rhodobactersphaeroides)tal中用phe替换活性位点残基his89将其底物选择性从酪氨酸转变成苯丙氨酸(watts,k.t.等(2006)chemistry&biology13,1317-1326)。
一般来说,与tal相比,pal是活性更高的酶并且因此已被优先用于在酵母菌株(例如酿酒酵母(saccharomycescerevisiae))中产生苯丙素类(参见例如u.s.专利no.8,895,287)。然而,发现并在产生苯丙素类和苯丙素类衍生物的菌株(例如酿酒酵母(s.cerevisiae))中引入活性的特异性tal可使得显著提高通过苯丙素类途径的碳通量,并且因此提高苯丙素类或苯丙素类衍生物(包括查耳酮和茋)的产生。
已报道了通过使用pal和tal二者来表达异源苯丙素类途径(参见koopman,f.等,2012,microbialcellfactories,11:155)。koopman,f.等(2012)(同上)使用来自荚膜红细菌(rhodobactercapsulatus)的tal(rctal)。然而,甚至在去调节芳族氨基酸的合成从而增加可利用酪氨酸之后,rctal仍表现出非常差的活性并且因此不能够在工业应用中使用。因此,仍然需要在酵母中表达产生高产率苯丙素类或苯丙素类衍生物的活性特异性tal。
发明概述
针对上述背景,本发明相对于现有技术提供了某些优点和进步。
尽管本文中公开的本发明不限于特定的优点或功能,但是本文中公开的发明提供了一种重组宿主,其包含编码酪氨酸解氨酶(tal)多肽的重组基因,其中所述宿主能够产生苯丙素类化合物或苯丙素类衍生物化合物,并且其中所述tal多肽使用酪氨酸作为优选底物。
本发明还提供了产生苯丙素类化合物或苯丙素类衍生物化合物的方法,其包括在其中表达重组基因的条件下,在培养基中培养如本文中所述的重组宿主,其中苯丙素类化合物或苯丙素类衍生物化合物通过所述重组宿主合成。
在一些方面,编码tal多肽的基因编码具有seqidno:31所示的氨基酸序列的多肽。
在一些方面,编码tal多肽的基因编码与seqidno:31所示的氨基酸序列具有至少65%同一性的多肽。
在一些方面,编码tal多肽的基因在重组宿主中过表达。
在一些方面,与不包含编码tal多肽的基因的重组宿主相比,包含tal基因的重组宿主能够产生产率提高的苯丙素类化合物或苯丙素类衍生物化合物。
在一些方面,与不包含编码tal多肽的基因的重组宿主相比,包含tal基因的重组宿主产生产率提高的苯丙素类化合物或苯丙素类衍生物化合物。
在一些方面,与不包含编码所述tal多肽的基因的重组宿主相比,包含tal基因的重组宿主产生产率提高的以下一种或更多种:(1)白藜芦醇和(2)香豆酸。
在本文中公开的重组宿主或方法的一些方面,所述重组宿主还包含编码以下的重组基因:
(a)茋合酶(sts)多肽;或
(b)查耳酮合酶(chs)多肽。
在本文中公开的重组宿主或方法的一些方面,所述重组宿主还包含以下一种或更多种:
(a)编码l-苯丙氨酸解氨酶(pal)多肽的基因;
(b)编码肉桂酸-4-羟化酶(c4h)多肽的基因;
(c)编码nadph:细胞色素p450还原酶多肽的基因;
(d)编码4-香豆酸-coa连接酶(4cl)多肽的基因;或
(e)编码查耳酮异构酶(chi)多肽的基因,
其中所述基因中至少一种是重组基因。
在本文中公开的重组宿主或方法的一些方面,所述苯丙素类化合物是香豆酸。
在本文中公开的重组宿主或方法的一些方面,所述苯丙素类衍生物化合物是茋类化合物或查耳酮化合物。
在本文中公开的重组宿主或方法的一些方面,茋是白藜芦醇或白藜芦醇衍生物。
在本文中公开的重组宿主或方法的一些方面,查耳酮是柚皮素或柚皮素衍生物。
在本文中公开的重组宿主或方法的一些方面,所述重组宿主包含微生物,所述微生物是酵母细胞、植物细胞、哺乳动物细胞、昆虫细胞、真菌细胞或细菌细胞。
在本文中公开的重组宿主或方法的一些方面,所述细菌细胞包含埃希氏菌属细菌(escherichiabacteria)细胞、乳杆菌属细菌(lactobacillusbacteria)细胞、乳球菌属细菌(lactococcusbacteria)细胞、棒状杆菌属细菌(cornebacteriumbacteria)细胞、醋杆菌属细菌(acetobacterbacteria)细胞、不动杆菌属细菌(acinetobacterbacteria)细胞或假单胞菌属细菌(pseudomonasbacterial)细胞。
在本文中公开的重组宿主或方法的一些方面,所述酵母细胞是来自以下的细胞:酿酒酵母、粟酒裂殖酵母(schizosaccharomycespombe)、解脂耶氏酵母(yarrowialipolytica)、光滑念珠菌(candidaglabrata)、棉阿舒囊霉(ashbyagossypii)、产朊假丝酵母(cyberlindnerajadinii)、巴斯德毕赤酵母(pichiapastoris)、乳酸克鲁维酵母(kluyveromyceslactis)、多形汉逊酵母(hansenulapolymorpha)、博伊丁假丝酵母(candidaboidinii)、arxulaadeninivorans、红发夫酵母(xanthophyllomycesdendrorhous)或白色念珠菌(candidaalbicans)物种。
在本文中公开的重组宿主或方法的一些方面,所述酵母细胞是酵母菌(saccharomycete)。
在本文中公开的重组宿主或方法的一些方面,所述酵母细胞是来自酿酒酵母物种的细胞。
在一些方面,本文中公开的方法还包括从培养基中回收苯丙素类化合物或苯丙素类衍生物化合物。
在一些方面,本文中公开的方法还包括从培养基中分离苯丙素类化合物或苯丙素类衍生物化合物。
根据以下详细描述结合所附权利要求书一起将更加充分地理解这些以及其他特征和优点。
附图简要说明
当结合附图阅读时可最佳地理解以下详细描述,在附图中:
图1示出了从对香豆酰coa到不同苯丙素类衍生物的苯丙素类途径分支。示出了该途径的两个分支,其中示例性的苯丙素类衍生物通过两种iii型pks酶产生:查耳酮合酶(chs)和茋合酶(sts)。还示出了通过还原酶的作用产生二氢苯丙素类衍生物的分支。其他酶缩写为:苯丙氨酸裂解酶(pal或tal);肉桂酸-4-羟化酶(c4h),其需要还原酶(cpr)活性;4-香豆酰coa连接酶(4cl);以及查耳酮异构酶(chi)。
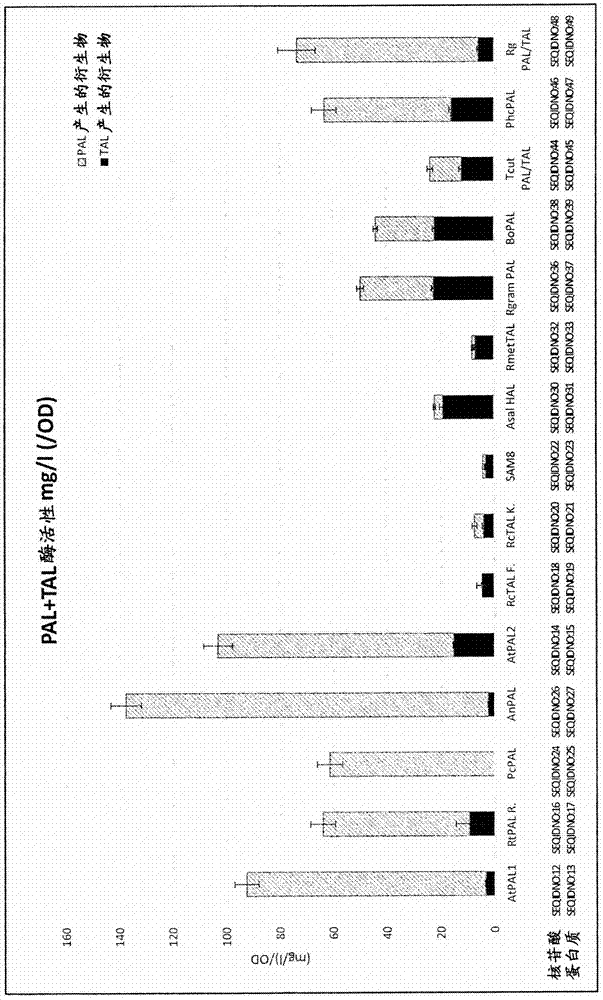
图2通过由肉桂酸(作为pal活性的结果)或香豆酸(作为tal活性的结果)衍生的苯丙素类途径产物的生产示出了15种不同酶的pal和tal活性。
图3示出了过表达asaltal的白藜芦醇产生酵母菌株和包含实现白藜芦醇产生的所有必需基因的直接亲本白藜芦醇产生酵母菌株(对照)中白藜芦醇和次级代谢物的生产。次级代谢物可能是由于起始代谢物丙二酰coa、苯丙氨酸和/或酪氨酸被转化成中间体(例如香豆酸)和副产物(例如根皮酸)而不是白藜芦醇产生。
发明详述
本文中引用的所有出版物、专利和专利申请均出于所有目的而在此明确地通过引用并入。
由于很多苯丙素类衍生物尤其可用作药物化合物,因此需要用于其产生的高效方法。例如,查耳酮柚皮素和茋类白藜芦醇可用于控制血糖水平以及改善人健康的其他潜在用途。
因此,本文中提供了可用于生物合成苯丙素类衍生物(包括查耳酮和茋)的材料和方法。在某些实施方案中,本公开内容提供了用于生物合成柚皮素和其他查耳酮的重组宿主和方法。在一些替选实施方案中,本公开内容提供了用于生物合成白藜芦醇和其他茋的重组宿主和方法。
在详细描述所公开的方法和组合物之前,将对多个术语进行定义。除非上下文另外明确指出,否则本文中使用的没有数量词修饰的名词涵盖一个/种和/或更多个/种。例如,提到“核酸”是指一个/种或更多个/种核酸。
应注意,例如“优选”、“一般”和“通常”的术语在本文中不用于限制所要求保护发明的范围或暗指某些特征对于所要求保护发明的结构或功能是关键的、必要的或甚至重要的。相反,这些术语仅仅旨在突出可以或不可以用于本发明特定实施方案中的替选的或额外的特征。
出于描述和定义本发明的目的,应注意,术语“提高”、“较大”、“较高”和“较低”在本文中用于表示针对所述参照或对照的非定量比较、值、测量或其他表示。
出于描述和定义本发明的目的,应注意,例如“优选底物”和“主要底物”的术语在本文中是可互换的并且用于表示关于所述底物的非定量比较、值、测量或其他表示。
出于描述和定义本发明的目的,应注意,术语“基本的”和“基本上”在本文中用于表示可归因于任何定量比较、值、测量或其他表述的固有不确定程度。术语“基本的”和“基本上”在本文中还用于表示定量表示可与所述参照不同但不导致所讨论主题的基本功能改变的程度。
可以使用本领域技术人员公知的方法来构建本文中公开的遗传表达构建体和重组细胞。这些方法包括体外重组dna技术、合成技术、体内重组技术和聚合酶链式反应(pcr)技术。参见,例如maniatis等,1989,molecularcloning:alaboratorymanual,coldspringharborlaboratory,newyork;ausubel等,1989,currentprotocolsinmolecularbiology,greenepublishingassociatesandwileyinterscience,newyork;以及pcrprotocols:aguidetomethodsandapplications(innis等,1990,academicpress,sandiego,ca)中所述的技术。
本文中使用的术语“多核苷酸”、“核苷酸”、“寡核苷酸”和“核酸”可互换使用,是指包含dna、rna、其衍生物、或其组合的核酸。
本文中使用的术语“微生物”、“微生物宿主”、“微生物宿主细胞”、“重组宿主”、“宿主细胞”和“重组宿主细胞”可以互换使用。本文中使用的术语“重组宿主”旨在是指其基因组已增加至少一个dna序列的宿主。这样的dna序列包括但不限于不是天然存在的、在细胞中不正常转录成rna也不天然翻译成蛋白质(“表达的”)的基因或dna序列,以及期望引入宿主中的其他基因或dna序列。应理解,通常通过稳定引入一个或更多个重组基因来增加本文中所述重组宿主的基因组。一般来说,引入的dna最初并不存在于为该dna的接受者的宿主中,但是从给定宿主分离dna区段并随后将该dna的一个或更多个另外拷贝引入同一宿主中,例如以增强基因产物的产生或改变基因的表达模式在本公开内容的范围内。在一些情况下,引入的dna将通过例如同源重组或定点诱变修饰或甚至替代内源基因或dna序列。合适的重组宿主包括微生物。
本文中使用的术语“基因”是指由本文中公开的至少一个dna序列、编码本文中公开的氨基酸序列的任何dna序列、或与本文中公开的编码序列的互补物杂交的任何dna序列构成的多核苷酸单元。优选地,该术语包括编码区和非编码区,以及优选地正常基因表达所必需的所有序列,包括启动子、增强子以及其他调节序列。
本文中使用的术语“重组基因”是指引入到接受者宿主中的基因或dna序列,不管这样的宿主中是否可已存在相同或类似的基因或dna序列。在此背景下,“引入”或“增加”在本领域中是已知的,意指人工(handofman)引入或增加。因此,重组基因可以是来自另一物种的dna序列,或者可以是来源于或存在于相同物种但已通过重组方法整合到宿主中形成重组宿主的dna序列。应理解,引入宿主中的重组基因可以与正常存在于所转化宿主中的dna序列相同,并且被引入以提供该dna的一个或更多个另外拷贝从而允许过表达或修饰该dna的基因产物的表达。重组基因特别地由cdna编码。
本文中使用的术语“改造的生物合成途径”是指在如本文所述的重组宿主中发生并且在宿主中不天然存在的生物合成途径。在一些实施方案中,改造的生物合成途径包含由宿主天然产生的酶,其中在某些实施方案中,编码这些酶的基因的表达程度和量在重组宿主中改变;在一些实施方案中,在重组宿主中,这些酶表达不足,或者其表达消除。
本文中使用的术语“内源”基因是指来源于特定生物体、组织或细胞并且在其中产生或合成的基因。
本文中使用的术语“异源序列”和“异源编码序列”用于描述来源于除重组宿主之外的物种的序列。在一些实施方案中,重组宿主是酿酒酵母细胞,并且异源序列来源于除酿酒酵母之外的生物体。异源编码序列例如可以来自与表达异源序列的重组宿主不同的原核微生物、真核微生物、植物、动物、昆虫或真菌。在一些实施方案中,编码序列是宿主天然的序列。
应理解,由于遗传密码的简并性,很多核酸可以编码特定的多肽;即对于很多氨基酸,存在多于一个核苷酸三联体用作氨基酸的密码子。因此,可以使用用于特定微生物的合适密码子偏好表修饰给定多肽的编码序列中的密码子,使得在该微生物中获得最佳表达。核酸也可以被优化成对特定微生物优选的gc含量,和/或降低重复序列的数目。作为分离的核酸,这些经修饰序列可以作为纯化分子存在,并且可以并入载体或病毒中用于构建用于重组核酸构建体的模块。另外,可以修饰异源核酸以在相关微生物中提高表达或甚至最佳表达。因此,在本文中公开的方法和组合物的一些实施方案中,异源核酸已被密码子优化用于在相关微生物中表达。密码子优化可以通过本领域已知的常规方法进行(参见例如welch,m.,等(2011),methodsinenzymology498:43-66)。
查耳酮和茋合成
本文中使用的术语“查耳酮”和“查耳酮类(chalconoid)”是可互换的并且是指式(i)化合物的衍生物:
其中式(i)可以在一个或更多个合适的位置被取代。示例性的取代基包括但不限于卤素、氰基、硝基、c1-c6烷基、c1-c6卤代烷基、c1-c6羟基烷基、羟基、c1-c6烷氧基、巯基(thiol)、c1-c6烷硫基、氨基、c1-c6烷基氨基、二c1-c6烷基氨基、羧基、c1-c6烷氧基羰基、酰氨基和糖基。
本文中使用的术语“茋”和“茋类”是可互换的并且是指基于式(ii)化合物的化合物:
其中式(ii)可以在一个或更多个合适的位置被取代。示例性的取代基包括但不限于卤素、氰基、硝基、c1-c6烷基、c1-c6卤代烷基、c1-c6羟基烷基、羟基、c1-c6烷氧基、巯基、c1-c6烷硫基、氨基、c1-c6烷基氨基、二c1-c6烷基氨基、羧基、c1-c6烷氧基羰基、酰氨基和糖基。
本文中使用的术语“苯丙素类”是指基于3-苯基丙-2-烯酸酯(3-phenylprop-2-enoate)骨架的化合物。这样的化合物的实例包括但不限于肉桂酸、香豆酸、咖啡酸、阿魏酸、5-羟基阿魏酸、芥子酸、肉桂酰coa、对香豆酰coa等。
本文中使用的术语“苯丙素类衍生物”是指由苯丙素类衍生、合成或生物合成的任何化合物,即苯丙素类衍生物包括苯丙素类化合物为前体或中间体的任何化合物。苯丙素类衍生物的实例包括但不限于茋类化合物和查耳酮化合物。苯丙素类衍生物的具体实例包括但不限于柚皮素、白藜芦醇、赤松素、查耳酮和松属素。
本文中使用的术语“二氢苯丙素类”是指基于苯基丙酸酯骨架的化合物。这样的化合物的实例包括但不限于二氢肉桂酸、根皮酸、3,4--二羟基氢化肉桂酸、氢化阿魏酸、二氢香豆酰coa、二氢肉桂酰coa等。
本文中使用的术语“二氢苯丙素类衍生物”是指由二氢苯丙素类衍生、合成或生物合成的任何化合物;即二氢苯丙素类衍生物包括二氢苯丙素类化合物为前体或中间体的任何化合物。二氢苯丙素类衍生物的实例包括但不限于二氢茋类化合物和二氢查耳酮化合物。二氢苯丙素类衍生物的具体实例包括但不限于根皮素、根皮苷、二氢赤松素、二氢赤松素羧酸酯、3-o-甲基二氢赤松素羧酸酯、4-异戊二烯基-3-o-甲基二氢赤松素羧酸酯(amorfrutin1)、3-o-甲基二氢赤松素、4-异戊二烯基-3-o-甲基二氢赤松素(amorfrutin2)、5-羟基-半月苔酸和二氢白藜芦醇。
本文中使用的术语“苯丙素类途径”、“苯丙素类衍生物途径”、“苯丙素类衍生物合成途径”和“苯丙素类衍生物生物合成途径”是可互换的并且是指其中苯丙素类为前体或中间体的任何生物合成途径。
“任选的”或“任选地”意指随后描述的事件或情况可能发生或可能不发生,并且描述包括其中所述事件或情况发生的例子和其中所述事件或情况不发生的例子。
本文中使用的“表达降低”是指基因或蛋白质以低于该基因或蛋白质的天然表达的水平表达。例如,在一些实施方案中,通过降低编码还原酶的基因的蛋白质产物或表达量来降低该还原酶的活性。
基因表达的降低或消除(即,破坏)可以通过任何已知的方法来实现,所述方法包括插入、错义突变、移码突变、缺失、替换、或dna序列置换、或其任意组合。插入包括整个基因的插入,所述基因可以是任何来源的。基因表达的降低或消除可以例如包括改变或置换基因的启动子、增强子或剪接位点,从而导致部分或完全抑制正常基因产物的产生。在一些实施方案中,基因表达的降低或消除包括改变细胞或生物体中表达的蛋白质产物的总水平。在另一些实施方案中,基因的破坏包括降低或消除细胞或生物体中基因的蛋白质产物的活性。在本公开内容的一些实施方案中,破坏是其中不存在该基因的显著表达的无效化破坏。在一些实施方案中,宿主或生物体中基因的破坏发生在两条染色体中,在这种情况下,其是纯合破坏。在另一些实施方案中,宿主或生物体中基因的破坏仅发生在一条染色体中,另一条染色体拷贝保持完整,在这种情况下,其是杂合基因破坏。在另一些实施方案中,宿主或生物体中基因的每个拷贝被不同地破坏。
基因表达的降低或消除还可以包括基因敲除或敲减。“基因敲除”是指细胞或生物体中的一种或更多种基因的表达被消除。“基因敲减”是指细胞或生物体中的一种或更多种基因的水平降低但未完全消除。
在一些实施方案中,重组宿主还包含苯丙素类衍生物生物合成途径的一种或更多种多肽。在一些实施方案中,提供了在查耳酮、茋或其他苯丙素类衍生物的生物合成中催化形成中间体的重组基因。中间体尤其包含肉桂酸、肉桂酰coa、对香豆酸、对香豆酰coa、柚皮素和白藜芦醇。
在一些实施方案中,可以在所述微生物中表达、过表达或重组表达l-苯丙氨酸解氨酶(pal)多肽。在一些实施方案中,所述pal是来自植物或微生物的pal(ec4.3.1.5),所述植物属于以下属:拟南芥属(arabidopsis)、芸苔属(brassica)、柑桔属(citrus)、菜豆属(phaseolus)、松属(pinus)、杨属(populus)、茄属(solanum)、李属(prunus)、葡萄属(vitis)、玉蜀黍属(zea)、藿香属(agastache)、凤梨属(ananas)、天门冬属(asparagus)、布氏兰属(bromheadia)、刺竹属(bambusa)、甜菜属(beta)、桦木属(betula)、黄瓜属(cucumis)、山荼属(camellia)、辣椒属(capsicum)、决明属(cassia)、长春花属(catharanthus)、鹰嘴豆属(cicer)、西瓜属(citrullus)、咖啡属(coffea)、南瓜属(cucurbita)、狗牙根属(cynodon)、胡萝卜属(daucus)、石斛属(dendrobium)、石竹属(dianthus)、洋地黄属(digitalis)、薯蓣属(dioscorea)、桉属(eucalyptus)、原鸡属(gallus)、银杏属(ginkgo)、大豆属(glycine)、大麦属(hordeum)、向日葵属(helianthus)、番薯属(ipomoea)、莴苣属(lactuca)、紫草属(lithospermum)、莲属(lotus)、番茄属(lycopersicon)、苜蓿属(medicago)、苹果属(malus)、木薯属(manihot)、苜蓿属(medicago)、松叶菊属(mesembryanthemum)、烟草属(nicotiana)、齐墩果属(olea)、稻属(oryza)、豌豆属(pisum)、鳄梨属(persea)、欧芹属(petroselinum)、蝴蝶兰属(phalaenopsis)、毛竹属(phyllostachys)、小立碗藓属(physcomitrella)、云杉属(picea)、梨属(pyrus)、栎属(quercus)、萝卜属(raphanus)、地黄属(rehmannia)、悬钩子属(rubus)、高粱属(sorghum)、sphenostylis、繁缕属(stellaria)、柱花草属(stylosanthes)、小麦属(triticum)、三叶草属(trifolium)、小麦属(triticum)、越橘属(vaccinium)、豇豆属(vigna)或百日菊属(zinnia);所述微生物属于以下属:伞菌属(agaricus)、曲霉属(aspergillus)、黑粉菌属(ustilago)、红细菌属(rhodobacter)或红酵母属(rhodotorula)。参见,例如wo2006/089898,其已通过引用整体并入。在一些实施方案中,所述pal是拟南芥(arabidopsisthaliana)pal,例如拟南芥(a.thaliana)pal2(seqidno:15)。
在一些实施方案中,可以在所述微生物中表达、过表达或重组表达酪氨酸解氨酶(tal)多肽。在一些实施方案中,所述tal能够使用酪氨酸和苯丙氨酸二者作为底物。在一些实施方案中,所述tal不使用苯丙氨酸作为其主要或优选底物。在一些实施方案中,所述tal使用酪氨酸作为其主要或优选底物。在一些实施方案中,所述tal对苯丙氨酸的km高于其对酪氨酸的km,和/或所述tal对苯丙氨酸的kcat低于其对酪氨酸的kcat。在一些实施方案中,所述tal是来自属于红酵母属的酵母或属于红细菌属的细菌的tal(ec4.3.1.5)。参见,例如wo2006/089898,其已通过引用整体并入。在一些实施方案中,所述tal是荚膜红细菌tal,例如荚膜红细菌(r.capsulatus)tal(seqidno:1)。在一些实施方案中,所述tal是杀鲑气单胞菌(aeromonassalmonicida)tal,例如杀鲑气单胞菌杀鲑亚种a449(a.salmonicidasubsp.salmonicidaa449)(asal)tal(seqidno:31)。
在一些实施方案中,可以在所述微生物中表达、过表达或重组表达肉桂酸4-羟化酶(c4h)多肽。在一些实施方案中,所述c4h是来自植物或微生物的c4h(ec1.14.13.11),所述植物属于以下属:拟南芥属、柑桔属、菜豆属、松属、杨属、茄属、葡萄属、玉蜀黍属、阿米属(ammi)、海榄雌属(avicennia)、山荼属、喜树属(camptotheca)、长春花属(catharanthus)、大豆属、向日葵属、莲属、松叶菊属、小立碗藓属、芸香属(ruta)、甘蔗属(saccharum)或豇豆属,所述微生物属于曲霉属。参见,例如wo2006/089898,其已通过引用整体并入。参见,例如wo2006/089898,其已通过引用整体并入。在一些实施方案中,所述c4h是拟南芥c4h(seqidno:2)。
在一些实施方案中,可以在所述微生物中表达、过表达或重组表达4-香豆酸-coa连接酶(4cl)多肽。在一些实施方案中,所述4cl可以是来自植物、微生物或线虫的4cl(ec6.2.1.12),所述植物属于以下属:冷杉属(abies)、拟南芥属、芸苔属、柑桔属、落叶松属(larix)、菜豆属、松属、杨属、茄属、葡萄属、玉蜀黍属(例如玉米(z.mays))、藿香属、紫穗槐属(amorpha)、银杉属(cathaya)、雪松属(cedrus)、番红花属(crocus)、羊茅属(festuca)、大豆属、胡桃属(juglans)、油杉属(keteleeria)、紫草属(lithospermum)、黑麦草属(lolium)、莲属(lotus)、番茄属(lycopersicon)、苹果属、苜蓿属、松叶菊属、烟草属、长苞铁杉属(nothotsuga)、稻属、天竺葵属(pelargonium)、欧芹属、小立碗藓属、云杉属(picea)、李属、金钱松属(pseudolarix)、黄杉属(pseudotsuga)、蔷薇属(rosa)、悬钩子属(rubus)、禾属(ryza)、甘蔗属、碱蓬属(suaeda)、盐芥属(thellungiella)、小麦属或铁杉属(tsuga),所述微生物属于以下属:曲霉属、链孢霉属(neurospora)、耶氏酵母属(yarrowia)、球腔菌属(mycosphaerella)、分枝杆菌属(mycobacterium)、奈瑟氏菌属(neisseria)、链霉菌属(streptomyces)或红细菌属,所述线虫属于以下属:钩口属(ancylostoma)、隐杆线虫属(caenorhabditis)、血矛线虫属(haemonchus)、正蚓属(lumbricus)、meilodogyne、类圆线虫属(strongyloidus)或pristionchus。参见,例如wo2006/089898,其已通过引用整体并入。在一些实施方案中,所述4cl是拟南芥4cl,例如拟南芥4cl2(seqidno:3)。
在一些实施方案中,本公开内容提供了重组宿主,所述重组宿主被改造成表达催化由对香豆酰coa形成茋类的重组多肽。因此,在一些实施方案中,重组宿主还包含一个或更多个茋合酶基因。
在一些实施方案中,可以在所述微生物中表达、过表达或重组表达茋合酶(sts)多肽。在一些实施方案中,所述sts是来自属于以下属的植物的sts(ec2.3.1.95):花生属(arachis)、大黄属(rheum)、葡萄属、松属、piceea、百合属(lilium)、桉属、爬山虎属(parthenocissus)、白粉藤属(cissus)、蝴蝶百合属(calochortus)、蓼属(polygonum)、买麻藤属(gnetum)、木菠萝属(artocarpus)、假山毛榉属(nothofagus)、刺葵属(phoenix)、羊茅属(festuca)、苔草属(carex)、藜芦属(veratrum)羊蹄甲属(bauhinia)或老虎刺属(pterolobium)。参见,例如wo2006/089898,其已通过引用整体并入。在一些实施方案中,所述sts是华东葡萄(vitispseudoreticulata)sts(seqidno:4)。
在一些实施方案中,可以在所述微生物中表达、过表达或重组表达nadph:细胞色素p450还原酶(cpr)多肽。在一些实施方案中,所述cpr是来自以下植物的cpr(ec1.6.2.4):属于拟南芥属的植物,例如拟南芥;属于柑桔属的植物,例如甜橙(citrus×sinensis)或葡萄柚(citrus×paradisi);属于菜豆属的植物,例如菜豆(p.vulgaris);属于松属的植物,例如火炬松(p.taeda);属于杨属的植物,例如美洲黑杨(p.deltoides)、美洲山杨(r.tremuloides)或毛果杨(r.trichocarpa);属于茄属的植物,例如马铃薯(s.tuberosum);属于葡萄属的植物,例如葡萄(vitisvinifera);属于玉蜀黍属(例如玉米)或其他植物属的植物,所述其他植物属例如阿密属、海榄雌属、山荼属、喜树属、长春花属、大豆属、向日葵属、莲属、松叶菊属、小立碗藓属、芸香属、甘蔗属或豇豆属。参见,例如wo2006/089898,其已通过引用整体并入。在一些实施方案中,所述cpr是拟南芥cpr,例如拟南芥atr2(seqidno:5)。
在一些实施方案中,本公开内容提供了重组宿主,所述重组宿主被改造成表达催化形成苯丙素类衍生物(例如查耳酮和茋类)的重组多肽。
在一些实施方案中,可以在所述微生物中表达、过表达或重组表达查耳酮合酶(chs)多肽。在一些实施方案中,所述chs是大麦(hordeumvulgare)chs,例如大麦(h.vulgare)chs2(seqidno:7)。
在一些实施方案中,可以在所述微生物中表达、过表达或重组表达查耳酮异构酶(chi)多肽。在一些实施方案中,所述chi是矮牵牛(petuniahybrida)chi,例如矮牵牛(p.hybrida)chi1(seqidno:9)或矮牵牛chi2(seqidno:11)。
在另一方面,本公开内容提供了产生查耳酮或茋化合物的方法,其包括在其中表达重组基因的条件下,在培养基中培养本文中公开的重组宿主,并且其中所述化合物通过所述重组宿主合成。
在一些实施方案中,本公开内容的方法用于产生查耳酮化合物。在一些实施方案中,所述查耳酮化合物是柚皮素或柚皮素衍生物。除柚皮素之外,本文中公开的一些实施方案还可用于产生其他查耳酮,例如异甘草素(甘草素查耳酮)、紫铆因(紫铆素(butin)查耳酮)、松属素查耳酮、圣草酚查耳酮和高圣草酚查耳酮。
在一些实施方案中,本公开内容的方法用于产生茋类化合物。在一些实施方案中,茋化合物是白藜芦醇。除白藜芦醇之外,本公开内容的一些实施方案还可用于产生其他茋类,例如白皮杉醇、二氢白藜芦醇、白藜芦醇3-o-葡糖苷(云杉新苷、虎杖苷)、ε-葡萄素、δ-葡萄素和pallidol。
在一些实施方案中,产生查耳酮或茋化合物的方法还包括收获所述化合物。在一些实施方案中,产生查耳酮或茋化合物的方法还包括分离所述化合物。
功能同源物
上述多肽的功能同源物也可适合用于在如本文中提供的重组宿主中产生苯丙素类衍生物。功能同源物是与参照多肽具有序列相似性并且执行参照多肽的一种或更多种生物化学或生理功能的多肽。功能同源物和参照多肽可以是天然存在的多肽,并且序列相似性可以归因于趋同或趋异演化事件。因此,功能同源物有时在文献中被称为同源物、直系同源物或旁系同源物。天然存在的功能同源物的变体(例如由野生型编码序列的突变体编码的多肽)本身可以是功能同源物。还可以通过多肽的编码序列的定点诱变或通过组合来自不同天然存在多肽的编码序列的结构域(“结构域交换”)来产生功能同源物。用于修饰编码本文中所述的功能性多肽的基因的技术是已知的,并且尤其包括定向演化技术、定点诱变技术和随机诱变技术,并且可用于提高多肽的比活性、改变底物特异性、改变表达水平、改变亚细胞定位或以期望的方式修饰多肽-多肽相互作用。这样的经修饰多肽被认为是功能同源物。术语“功能同源物”有时应用于编码功能同源多肽的核酸。
可以通过分析核苷酸和多肽序列比对来鉴定功能同源物。例如,对核苷酸或多肽序列的数据库进行查询可以鉴定苯丙素类或苯丙素类衍生物生物合成途径多肽的同源物。序列分析可以涉及使用例如苯丙氨酸解氨酶、酪氨酸解氨酶、查耳酮异构酶或茋合酶氨基酸序列作为参照序列对非冗余数据库进行blast、交互blast或psi-blast分析。在一些情况下,由核苷酸序列推导氨基酸序列。数据库中具有大于40%序列同一性的那些多肽是用于进一步评价作为苯丙素类衍生物生物合成途径多肽的适合性的候选物。氨基酸序列相似性允许保守的氨基酸替换,例如一个疏水性残基替换成另一个疏水性残基,或一个极性残基替换成另一个极性残基。如果需要的话,可以对这样的候选物进行人工检查以缩小需进一步评价的候选物数量。可以通过选择那些显示为具有存在于苯丙素类衍生物生物合成途径多肽中的结构域(例如,保守的功能性结构域)的候选物来进行人工检查。
保守区可以通过定位苯丙素类衍生物生物合成途径多肽的一级氨基酸序列中的以下区域来鉴定,所述区域为重复序列、形成一些二级结构(例如螺旋和β片层)、建立带正电荷或带负电荷的结构域或者代表蛋白质基序或结构域。参见,例如pfam网站,其在万维网的sanger.ac.uk/software/pfam/和pfam.janelia.org/描述了多种蛋白质基序和结构域的共有序列。pfam数据库包括的信息在sonnhammer等,nucl.acidsres.,26:320-322(1998);sonnhammer等,proteins,28:405-420(1997);以及bateman等,nucl.acidsres.,27:260-262(1999)中进行了描述。保守区还可以通过比对来自紧密相关物种的相同或相关多肽的序列来确定。紧密相关物种优选地来自同一科。在一些实施方案中,来自两种不同物种的序列的比对足以鉴定这样的同源物。
通常来说,显示出至少约40%氨基酸序列同一性的多肽可用于鉴定保守区。相关多肽的保守区显示出至少45%氨基酸序列同一性(例如,至少50%、至少60%、至少70%、至少80%或至少90%氨基酸序列同一性)。在一些实施方案中,保守区显示出至少92%、94%、96%、98%或99%氨基酸序列同一性。
例如,适于在重组宿主中产生柚皮素的同源物包括查耳酮合酶和/或查耳酮异构酶基因的重组同源物。
修饰给定多肽(例如,如苯丙氨酸解氨酶、酪氨酸解氨酶、查耳酮合酶、查耳酮异构酶或茋合酶)的底物特异性的方法是本领域技术人员已知的,并且包括但不限于定点/合理诱变方法、随机定向演化方法和其中在酶的活性位点附近进行随机诱变/饱和技术的组合。例如,参见osmani等,2009,phytochemistry70:325-347。
候选序列的长度通常为参照序列的长度的80%至200%,例如参照序列长度的82%、85%、87%、89%、90%、93%、95%、97%、99%、100%、105%、110%、115%、120%、130%、140%、150%、160%、170%、180%、190%或200%。功能同源物多肽的长度通常为参照序列长度的95%至105%,例如参照序列长度的90%、93%、95%、97%、99%、100%、105%、110%、115%或120%,或之间的任何范围。任何候选核酸或多肽相对于参照核酸或多肽的%同一性可如下确定。使用计算机程序clustalw(1.83版,默认参数)将参照序列(例如,本文中所述的核酸序列或氨基酸序列)与一个或更多个候选序列比对,所述计算机程序允许核酸或多肽序列在其全长上进行比对(全局比对)。chenna等,2003,nucleicacidsres.31(13):3497-500。
clustalw计算参考与一个或更多个候选序列之间的最佳匹配,并将其比对,使得可以确定同一性、相似性和差异。可以在参照序列、候选序列或二者中插入一个或更多个残基的空位以最大化序列比对。对于核酸序列的快速成对比对,使用以下默认参数:字长:2;窗口大小:4;评分方法:%年龄;顶对角线数:4;以及空位罚分:5。对于核酸序列的多重比对,使用以下参数:空位开放罚分:10.0;空位延伸罚分:5.0;以及权重转换:是。对于蛋白质序列的快速成对比对,使用以下参数:字长:1;窗口大小:5;评分方法:%年龄;顶对角线数:5;空位罚分:3。对于蛋白质序列的多重比对,使用以下参数:权重矩阵:blosum;空位开放罚分:10.0;空位延伸罚分:0.05;亲水性空位:开;亲水性残基:gly、pro、ser、asn、asp、gln、glu、arg和lys;残基特异性空位罚分:开。clustalw输出是反映序列之间关系的序列比对。可以例如在万维网的baylorcollegeofmedicinesearchlauncher网站(searchlauncher.bcm.tmc.edu/multi-align/multi-align.html)和万维网的欧洲生物信息研究院(europeanbioinformaticsinstitute)网站(ebi.ac.uk/clustalw)运行clustalw。
为了确定候选核酸或氨基酸序列与参照序列的百分比同一性,使用clustalw比对序列,用比对中相同匹配的数目除以参照序列的长度,并将结果乘以100。应注意的是,百分比同一性值可以四舍五入到最接近的十分位。例如,78.11、78.12、78.13和78.14向下舍入至78.1,而78.15、78.16、78.17、78.18和78.19向上舍入至78.2。
应理解,功能同源物(例如,参与苯丙素类衍生物生物合成的酶的功能同源物)可以包含不参与由酶执行的酶活性的另外氨基酸。
重组核酸
编码本文中所述多肽的重组基因包含所述多肽的编码序列,其任选地在有义方向上与适于表达所述多肽的一个或更多个调节区有效连接。由于很多微生物能够从多顺反子mrna表达多种基因产物,因此如果需要的话,对于这些微生物可以在单调节区的控制下表达多种多肽。当调节区和编码序列被定位成使得调节区有效地用于调节该序列的转录或翻译时,认为编码序列和调节区是有效连接的。通常来说,编码序列的翻译阅读框的翻译起始位点位于单顺反子基因的调节区下游的1至约50个核苷酸。
在很多情况下,本文中所述多肽的编码序列在不同于重组宿主的物种中鉴定到,即是异源核酸。因此,如果重组宿主是微生物,则编码序列可以来自其他原核或真核微生物、来自植物或来自动物。然而,在一些情况下,编码序列是宿主天然的序列,并且被重新引入该生物体中。天然序列与天然存在序列的区别之处通常可在于:前者存在与外源核酸连接的非天然序列,例如重组核酸构建体中在天然序列侧翼的非天然调节序列。另外,稳定转化的外源核酸通常整合在除发现天然序列的位置之外的位置。“调节区”是指具有影响转录或翻译起始和速率以及转录或翻译产物的稳定性和/或移动性的核苷酸序列的核酸。调节区包括但不限于启动子序列、增强子序列、应答元件、蛋白质识别位点、诱导型元件、蛋白质结合序列、5′和3′非翻译区(utr)、转录起始位点、终止序列、多腺苷酸化序列、内含子、及其组合。调节区通常包含至少一个核心(基本)启动子。调节区还可以包含至少一个控制元件,例如增强子序列、上游元件或上游激活区(uar)。通过将调节区和编码序列定位成使得调节区有效地调节序列的转录或翻译使调节区与编码序列有效连接。例如,为了有效连接编码序列和启动子序列,通常将编码序列的翻译阅读框的翻译起始位点定位在启动子下游的1至约50个核苷酸。然而,调节区可以定位在翻译起始位点上游的多至约5,000个核苷酸,或者在转录起始位点上游的约2,000个核苷酸。
待包含的调节区的选择取决于数个因素,包括但不限于效率、可选择性、可诱导性、期望的表达水平和在某些培养阶段期间的优先表达。通过适当地选择并相对于编码序列定位调节区来调节编码序列的表达对于本领域技术人员而言是常规手段。应理解,可以存在多于一个调节区,例如内含子、增强子、上游激活区、转录终止子和诱导型元件。
重组宿主
可以使用重组宿主来表达用于苯丙素类衍生物产生的多肽,所述重组宿主包括哺乳动物、昆虫、植物和藻类细胞。多种原核生物和真核生物也适合用于构建本文中所述的重组微生物,例如革兰氏阴性细菌、酵母和真菌。首先分析选择用作苯丙素类衍生物产生菌株的物种和菌株以确定哪些产生基因相对于所述菌株是内源的以及哪些基因不存在。将在菌株中不存在内源对应物的基因有利地组装在一个或更多个重组构建体中,然后将所述构建体转化到菌株中以提供缺失的功能。
可以使用常规发酵方法来培养本文中提供的经构建和经遗传改造的微生物,所述常规发酵方法尤其包括恒化器、分批、补料分批培养、连续灌流发酵和连续灌流细胞培养。
本发明方法中使用的碳源包括可以被重组宿主代谢以促进苯丙素类衍生物生长和/或产生的任何分子。合适碳源的实例包括但不限于蔗糖(例如,如见于糖蜜中)、果糖、木糖、乙醇、甘油、葡萄糖、纤维素、淀粉、纤维二糖或其他含葡萄糖聚合物。在使用酵母作为宿主的一些实施方案中,例如,例如蔗糖、果糖、木糖、乙醇、甘油和葡萄糖的碳源是合适的。可以在整个培养期间向宿主生物体提供碳源,或者作为替代地,可以在其他能量来源(例如蛋白质)存在下培养生物体一段时间,然后仅在补料分批阶段期间提供碳源。
示例性的原核生物和真核生物物种在下文更详细地描述。然而,应理解,其他物种也可以是合适的。例如,合适的物种可以在以下属中:伞菌属、曲霉属、芽孢杆菌属(bacillus)、念珠菌属、棒状杆菌属、假囊酵母属(eremothecium)、埃希氏菌属、镰孢霉属(fusarium)/赤霉属(gibberella)、克鲁维酵母属(kluyveromyces)、硫磺菌属(laetiporus)、香菇属(lentinus)、红发夫酵母属(phaffia)、平革菌属(phanerochaete)、毕赤酵母属(pichia)、小立碗藓属、红酵母属、酵母属(saccharomyces)、裂殖酵母属(schizosaccharomyces)、痂圆孢属(sphaceloma)、红发夫酵母(xanthophyllomyces)或耶氏酵母属。来自这样的属的示例性物种包括虎皮香菇(lentinustigrinus)、硫磺菌(laetiporussulphureus)、黄孢原毛平革菌(phanerochaetechrysosporium)、巴斯德毕赤酵母、产朊假丝酵母、小立碗藓(physcomitrellapatens)、黏红酵母32(rhodoturulaglutinis32)、胶红酵母(rhodoturulamucilaginosa)、红发夫酵母ubv-ax(phaffiarhodozymaubv-ax)、红发夫酵母、藤仓镰孢菌(fusariumfufikuroi)/藤仓赤霉(gibberellafujikuroi)、产朊假丝酵母(candidautilis)、光滑念珠菌、白色念珠菌和解脂耶氏酵母。
在一些实施方案中,微生物可以是原核生物,例如大肠杆菌、酿酒酵母、类球红细菌、荚膜红细菌或圆红酵母(rhodotorulatoruloides)。
在一些实施方案中,微生物可以是子囊菌,例如藤仓赤霉、乳酸克鲁维酵母(kluyveromyceslactis)、粟酒裂殖酵母(schizosaccharomycespombe)、黑曲霉(aspergillusniger)、解脂耶氏酵母、棉阿舒囊霉或酿酒酵母。
在一些实施方案中,微生物可以是藻类细胞,例如三孢布拉霉菌(blakesleatrispora)、杜氏盐藻(dunaliellasalina)、雨生红球藻(haematococcuspluvialis)、小球藻(chlorellasp.)、裙带菜(undariapinnatifida)、马尾藻(sargassum)、海带(laminariajaponica)、scenedesmusalmeriensis物种。
在一些实施方案中,微生物可以是蓝细菌细胞,例如三孢布拉霉菌、杜氏盐藻、雨生红球藻、小球藻、裙带菜、马尾藻、海带、scenedesmusalmeriensis。
酵母属(saccharomycesspp.)
酵母是合成生物学中广泛使用的经典生物体,并且可以用作重组微生物平台。例如,存在可用于酿酒酵母的突变体文库、质粒、详细代谢计算机模型以及其他信息,从而允许对多个模块进行合理设计以提高产品产率。用于制备重组微生物的方法是已知的。
曲霉属(aspergillusspp.)
例如米曲菌(a.oryzae)、黑曲霉(a.niger)和酱油曲霉(a.sojae)的曲霉属物种是食品生产中广泛使用的微生物,并且也可以用作重组微生物平台。构巢曲菌(a.nidulans)、烟曲霉(a.fumigatus)、米曲菌、棒曲霉(a.clavatus)、黄曲霉(a.flavus)、黑曲霉和土曲霉(a.terreus)的基因组核苷酸序列是可获得的,从而允许对内源途径进行合理设计和修饰以提高通量并提高产品产率。已开发了用于曲霉属的代谢模型。一般来说,黑曲霉被培养用于多种食品成分(例如柠檬酸和葡糖酸)的工业生产,并且因此例如黑曲霉的物种通常适合用于生产苯丙素类衍生物。
大肠杆菌
大肠杆菌,合成生物学中另一种广泛使用的平台生物,也可以用作重组微生物平台。与酵母类似,存在可用于大肠杆菌的突变体文库、质粒、详细代谢计算机模型以及其他信息,从而允许对多个模块进行合理设计以提高产品产率。可使用与上文针对酵母所述的那些方法类似的方法来制备重组大肠杆菌微生物。
伞菌属、赤霉属和平革菌属
伞菌属、赤霉属和平革菌属可以是可用的,因为已知它们在培养物中产生大量的类异戊二烯。因此,用于生产大量苯丙素类衍生物的前体已由内源基因产生。
arxulaadeninivorans(blastobotrysadeninivorans)
arxulaadeninivorans是一种具有独特生物化学特征的二形性酵母(其在高至42℃的温度下类似于烘焙酵母作为芽殖酵母生长,高于该阈值时,其以丝状形式生长)。其可以在广泛种类的底物上生长并且可以同化硝酸盐。其已被成功地应用于生产可产生天然塑料的菌株或开发针对环境样品中雌激素的生物传感器。
解脂耶氏酵母
解脂耶氏酵母是一种二形性酵母(参见arxulaadeninivorans)并且属于半子囊菌(hemiascomycete)科。解脂耶氏酵母的整个基因组是已知的。耶氏酵母属物种是需氧的并且被认为是非致病性的。耶氏酵母高效地使用疏水性底物(例如,烷烃、脂肪酸、油)并且可以在糖上生长。其具有很高的工业应用潜力,并且是一种产油微生物。解脂耶氏酵母可以将脂质含量累积至其干细胞重量的约40%,是用于脂质累积和再活化的模型生物。参见例如nicaud,2012,yeast29(10):409-18;beopoulos等,2009,biohimie91(6):692-6;bankar等,2009,applmicrobiolbiotechnol.84(5):847-65。
红酵母属(rhodotorulasp.)
红酵母是一种单细胞的有色酵母。产油的红色酵母黏红酵母已被示出由粗甘油生产脂质和类胡萝卜素(saenge等,2011,processbiochemistry46(1):210-8)。圆红冬孢酵母菌株已被示出是用于改进生物质和脂质生产力的高效补料-分批发酵系统(li等,2007,enzymeandmicrobialtechnology41:312-7)。
圆红冬孢酵母(rhodosporidiumtoruloides)
圆红冬孢酵母是一种产油酵母并且可用于改造脂质产生途径(参见例如zhu等,2013,naturecommun.3:1112;ageitos等,2011,appliedmicrobiologyandbiotechnology90(4):1219-27)。
红细菌属(rhodobacterspp.)
红细菌可以用作重组微生物平台。与大肠杆菌类似,存在可用的突变体文库以及合适的质粒载体,从而允许对多个模块进行合理设计以提高产品产率。已在红细菌的膜状细菌物种中改造了类异戊二烯途径用于提高类胡萝卜素和coq10的生产。参见,美国专利公开no.20050003474和20040078846。可使用与上文针对大肠杆菌所述的那些方法类似的方法来制备重组红细菌微生物。
博伊丁假丝酵母
博伊丁假丝酵母是一种甲基营养型酵母(其可以在甲醇上生长)。类似于其他甲基营养型物种(例如多形汉逊酵母(hansenulapolymorpha)和巴斯德毕赤酵母),其提供用于生产异源蛋白的优异平台。已报道了所分泌外来蛋白的产率在多克范围内。最近,计算方法ipro预测了在实验上将博伊丁假丝酵母木糖还原酶的辅因子特异性从nadph转变为nadh的突变。
多形汉逊酵母(安格斯毕赤酵母(pichiaangusta))
多形汉逊酵母是另一种甲基营养型酵母(参见博伊丁假丝酵母)。其可进一步在广泛范围的其他底物上生长;其是耐热的并且可以同化硝酸盐(另参见乳酸克鲁维酵母)。其已被应用于生产乙型肝炎疫苗、胰岛素和用于治疗丙型肝炎的干扰素α-2a,还被应用于一系列技术酶。
乳酸克鲁维酵母
乳酸克鲁维酵母是一种常用于生产克菲尔(kefir)的酵母。其可以在数种糖上生长,最重要是在存在于乳和乳清中的乳糖上生长。其已被成功地应用于生产凝乳酶(通常存在于牛胃中的酶)来产生乳酪。生产以40,000l的规模在发酵罐中进行。
巴斯德毕赤酵母
巴斯德毕赤酵母是一种甲基营养型酵母(参见博伊丁假丝酵母和多形汉逊酵母)。其提供用于生产外来蛋白的高效平台。平台组分可作为试剂盒获得,并且其在学术界中广泛地用于生产蛋白质。已改造了可以生产复杂人-聚糖的菌株(酵母聚糖与见于人中的那些类似但不相同)。
小立碗藓属(physcomitrellaspp.)
苔藓小立碗藓(physcomitrellamosses)在悬浮培养物中生长时具有与酵母或其他真菌培养物类似的特征。该属正成为一种重要的细胞类型,用于生产在其他类型的细胞中难以产生的植物次级代谢物。
用于产生苯丙素类衍生物的方法
可以在产生苯丙素类衍生物的方法中使用本文中所述的重组宿主。
例如,所述方法可以包括在其中表达苯丙素类衍生物生物合成基因的条件下,在培养基中培养重组宿主。可以在补料分批或连续过程中培养重组宿主。通常来说,将重组宿主在限定温度下在发酵罐中培养期望的时间段。根据所述方法中使用的具体宿主,还可以存在和表达其他重组基因,例如苯丙氨酸解氨酶(pal)、酪氨酸解氨酶(tal)、肉桂酸4-羟化酶(c4h)、细胞色素p450还原酶(cpr)、4-香豆酸-coa连接酶(4cl)、茋合酶(sts)、查耳酮合酶(chs)或查耳酮异构酶(chi)。底物和中间体(例如苯丙氨酸、酪氨酸、肉桂酸、香豆酸、二氢肉桂酸或根皮酸)的水平可以通过从培养基中提取样品以根据公开的方法进行分析来确定。在一些实施方案中,培养基不包含来自外部来源的苯丙素类前体或中间体(即不向培养基中添加苯丙素类前体或中间体)。
本文中所述的基因可以使用多种已知启动子中的任一种在酵母中表达。过量产生苯丙素类的菌株是已知的,并且可以用作产生苯丙素类或苯丙素类衍生物中的受体分子。
在一些实施方案中,可以筛选酶的tal和/或pal活性。在一些实施方案中,用于筛选pal和tal活性的酶的对应dna序列被密码子优化用于在酿酒酵母中最佳表达。在一些实施方案中,将每种pal/tal酶与用于由肉桂酸(c4h-cpr、4cl、chs和chi)(以测量pal+tal活性)或由香豆酸(4cl、chs和chi)(以测量单独tal活性)产生柚皮素的所有必需基因一起克隆。在一些实施方案中,然后在单一步骤中将基因引入不产生苯丙素类或苯丙素类衍生物的酿酒酵母菌株(“非产生者酵母菌株”)中。
在一些实施方案中,将转化株接种在96深孔板中,并在30℃和400rpm下在500μlsc-ura培养基中孵育过夜。在一些实施方案中,将50μl过夜培养物接种到包含500μldelft培养基加4%w/v葡萄糖的新96深孔板中。在一些实施方案中,在相同条件下培养72小时后,测量od600以评估细胞生长,并采集样品以通过hplc如下测量肉桂酸、香豆酸、柚皮素和根皮酸。在一些实施方案中,在摇床上将培养物的样品(300μl)与96%etoh(300μl)混合并离心。在一些实施方案中,将上清液(100μl)用于hplc分析。在一些实施方案中,使用纯的化合物作为标准品进行测量。
在一些实施方案中,tal基因由seqidno:12、14、16、18、20、22、24、26、28、30、32、34、36、38、40、42、44、46或48中任一个的核苷酸序列编码。在一些实施方案中,tal多肽是seqidno:13、15、17、19、21、23、25、27、29、31、33、35、37、39、41、43、45、47或49中的任一种。在一些实施方案中,tal多肽来自杀鲑气单胞菌杀鲑亚种a449(asal)(seqidno:31)。在一些实施方案中,tal多肽与seqidno:31中的氨基酸序列具有至少50%同一性。在一些实施方案中,tal多肽与seqidno:31中的氨基酸序列具有至少65%同一性。在一些实施方案中,tal基因由seqidno:30的核苷酸序列编码。在一些实施方案中,tal基因与seqidno:30具有至少60%同一性。
在一些实施方案中,asal的tal活性与先前已知的来自牧草红酵母(rhodotorulagraminis)的tal(vanneli,j.等(2007),enzymeandmicrobialtechnology41,413-422)和来自绿竹(bambusaoldhamii)的pal4(hseih,l.等(2010),phytochemistry71)相当,而asal比这两种提及的tal具有远远更高的特异性(参见例如图2)。在一些实施方案中,asaltal还比先前报道的特异性tal具有更高的活性,所述先前报道的特异性tal如来自英膜红细菌的rctal(koopman,f.等(2012);kyndt,ja.等(2002),febsletters512,240-244)和来自西班牙糖丝菌(saccharothrixespanaensis)的sam8(berner,m.等(2006),jbacteriol.四月;188(7):2666-73)(参见例如图2)。在一些实施方案中,asaltal的活性超过先前报道的特异性tal的活性的五(5)倍,所述先前报道的特异性tal例如但不限于来自荚膜红细菌(r.capsulatus)的rctal和来自西班牙糖丝菌(s.espanaensis)的sam8。
在已将重组宿主在培养物中培养期望的时间段之后,然后可以使用本领域已知的多种技术从培养物中回收苯丙素类衍生物(例如柚皮素或白藜芦醇)。在一些实施方案中,可以添加透化剂以帮助原料进入宿主中,并且帮助产物从宿主释放。例如,可以将经培养微生物的粗制裂解物离心以获得上清液。然后,可以将得到的上清液施加到色谱柱(例如c-18柱),并用水洗涤除去亲水性化合物,之后用溶剂(例如甲醇)洗脱目的化合物。然后,可以根据本领域已知的方法通过制备型hplc进一步纯化化合物。
应理解,本文中讨论的不同基因和模块可以存在于两种或更多种重组宿主中而不是单一宿主中。当使用多种重组宿主时,可以将其在混合培养物中培养以产生苯丙素类衍生物。
或者,可以将两种或更多种宿主各自在单独的培养基中培养,并且可以将第一培养基的产品(例如柚皮素或白藜芦醇前体)引入第二培养基中以被转化成后续中间体或者最终产品,例如,如柚皮素。然后,回收由第二或最后宿主产生的产品。还应理解,在一些实施方案中,使用除培养基之外的营养源并利用除发酵罐之外的系统来培养重组宿主。
在一些实施方案中,通过在重组宿主中表达参与苯丙素类衍生物生物合成途径中的一种或更多种酶来在体内产生苯丙素类衍生物。例如,可以使用表达以下基因的柚皮素产生或白藜芦醇产生重组宿主来体内产生查耳酮化合物,例如柚皮素:编码一种或更多种拟南芥苯丙氨酸解氨酶(pal2)多肽的重组基因、编码大阿米芹(ammimajus)肉桂酸4-羟化酶(ch4)多肽的基因、编码拟南芥4-香豆酸-coa连接酶(4cl2)多肽的基因、编码大麦查耳酮合酶2(chs2)多肽的基因、编码细胞色素p450还原酶(cpr1)多肽的基因。
在一些实施方案中,通过在重组宿主中表达参与苯丙素类衍生物生物合成途径的一种或更多种酶来体内产生苯丙素类衍生物。例如,可以使用表达以下基因的柚皮素产生或白藜芦醇产生重组宿主来体内产生查耳酮化合物,例如柚皮素:编码一种或更多种杀鲑气单胞菌酪氨酸解氨酶(asaltal)多肽的重组基因、编码拟南芥4-香豆酸-coa连接酶(4cl2)多肽的基因、编码大麦查耳酮合酶2(chs2)多肽的基因、编码细胞色素p450还原酶(cpr1)多肽的基因。
作为另一个实例,可以使用其中编码酿酒酵母反式-2-烯酰coa还原酶多肽的一个或更多个基因表达不足或不表达并且表达以下基因的茋类(例如白藜芦醇)产生重组宿主来体内产生茋类化合物,例如白藜芦醇:编码一种或更多种拟南芥苯丙氨酸解氨酶(pal2)多肽的重组基因、编码大阿米芹肉桂酸4-羟化酶(ch4)多肽的基因、编码拟南芥4-香豆酸-coa连接酶(4cl2)多肽的基因和编码茋合酶(sts)多肽的基因。
作为另一个实例,可以使用其中编码酿酒酵母反式-2-烯酰coa还原酶多肽的一个或更多个基因表达不足或不表达并且表达以下基因的茋类(例如白藜芦醇)产生重组宿主来体内产生茋类化合物,例如白藜芦醇:编码一种或更多种杀鲑气单胞菌酪氨酸解氨酶(asal_tal)多肽的重组基因、编码拟南芥4-香豆酸-coa连接酶(4cl2)多肽的基因和编码茋合酶(sts)多肽的基因。
在一些实施方案中,通过使期望化合物的前体与参与苯丙素类衍生物生物合成途径的一种或更多种酶在体外接触来产生苯丙素类衍生物。例如,使酪氨酸与酪氨酸解氨酶、4-香豆酸-coa连接酶和查耳酮合酶多肽接触可以使得在体外产生柚皮素或柚皮素衍生物化合物。在一些实施方案中,通过使上游柚皮素前体与参与柚皮素途径的一种或更多种酶在体外接触来产生柚皮素前体。
在一些实施方案中,通过生物转化产生苯丙素类衍生物前体。为了发生生物转化,表达参与苯丙素类衍生物生物合成途径的一种或更多种酶的重组宿主摄取并修饰细胞中的苯丙素类衍生物前体;在体内修饰之后,苯丙素类衍生物保留在细胞中和/或被分泌到培养基中。例如,表达编码酪氨酸解氨酶、4-香豆酸-coa连接酶和查耳酮合酶多肽的基因的重组宿主可在细胞中摄取酪氨酸并将其转化为柚皮素;在体内转化之后,柚皮素化合物被分泌到培养基中。
在一些实施方案中,将本文中公开的苯丙素类衍生物分离并纯化至均质(例如至少90%、92%、94%、96%或98%纯)。在另一些实施方案中,苯丙素类衍生物作为提取物从重组宿主或体外产生方法分离。在这方面,苯丙素类衍生物可以分离,但不必然纯化至均质。期望地,产生的苯丙素类衍生物的量可以为约1mg/l至约20,000mg/l或更高。例如,可以产生约1至约100mg/l、约30至约100mg/l、约50至约200mg/l、约100至约500mg/l、约100至约1,000mg/l、约250至约5,000mg/l、约1,000至约15,000mg/l或约2,000至约10,000mg/l的苯丙素类衍生物。一般来说,培养时间越长将使得产品的量越大。因此,可以将重组微生物培养1天至7天、1天至5天、3天至5天、约3天、约4天或约5天。
在一些实施方案中,用含有来自杀鲑气单胞菌的tal基因(asaltal,seqidno:31)的质粒转化不具有tal活性的白藜芦醇产生酵母菌株。在一些实施方案中,质粒允许tal基因在整个酵母基因组存在的ty1区处多重整合。在一些实施方案中,tal基因在强启动子ppgk1的控制之下并且实现该基因的过表达。
在一些实施方案中,将其中过表达tal基因的所得菌株与含有实现白藜芦醇产生的所有必需基因的直接亲本菌株(对照)进行比较。在一些实施方案中,在将指定菌株在基本培养基中培养3天之后测量白藜芦醇和途径中间体(香豆酸和根皮酸)的水平。在一些实施方案中,通过将乙醇与发酵样品混合至终浓度为50体积%并以3222×g离心5分钟进行化合物的提取。
在一些实施方案中,在其中相对于对照亲本菌株过表达杀鲑气单胞菌(asal)tal的子代菌株中,白藜芦醇滴度提高至少25%。在一些实施方案中,白藜芦醇滴度提高25%为白藜芦醇产量增加约375mg/l。在一些实施方案中,在其中相对于对照亲本菌株过表达asaltal的子代菌株中,香豆酸累积提高2.5倍。在一些实施方案中,当与对照亲本菌株比较时,香豆酸累积提高2.5倍为增加约108mg/l。在一些实施方案中,在具有并且过表达asaltal的新菌株中,测量为白藜芦醇和主要副产物之和的潜在白藜芦醇通量提高26.2%。
实施例
下面的实施例是对本文中公开的具体实施方案及其各种用途的举例说明。其仅仅是出于解释目的而提出,并不被认为是限制性的。
实施例1:tal酶的筛选
筛选pal/tal酶的pal和tal活性。核苷酸和氨基酸序列在本文中鉴定为seqidno:12至49。
将每个核苷酸序列密码子优化成用于在酿酒酵母中最佳表达。将每种pal/tal酶与用于由肉桂酸(c4h-cpr、4cl、chs和chi)(以测量pal和tal活性)或香豆酸(4cl、chs和chi)(以测量单独tal活性)产生柚皮素的所有必需基因一起克隆。然后,在单一步骤中将基因引入不产生苯丙素类或苯丙素类衍生物的酿酒酵母菌株(“非产生者酵母菌株”)中。
将转化株接种在96深孔板中,并在30℃和400rpm下在500μlsc-ura培养基中孵育过夜。随后,将50μl过夜培养物接种到包含500μldelft培养基加4%w/v葡萄糖的新96深孔板中。在相同条件下培养72小时后,测量od600以评估细胞生长,并采集样品以通过hplc如下测量肉桂酸、香豆酸、柚皮素和根皮酸。在摇床上将培养物的样品(300μl)与96%etoh(300μl)混合并离心。将上清液(100μl)用于hplc分析。使用纯化合物作为标准品进行测量。根皮素由于峰与肉桂酸重叠而不能测量。
图2显示,与来自牧草红酵母的tal((seqidno:36和37)(vanneli,j.等(2007),enzymeandmicrobialtechnology41,413-422)和来自绿竹的pal4(seqidno:38和39)(hseih,l.等(2010),phytochemistry71)相比,来自杀鲑气单胞菌杀鲑亚种a449的tal(asal)(seqidno:30和31)对作为底物的酪氨酸具有远远更高的特异性。图2还显示,asaltal具有超过来自荚膜红细菌的rctal(seqidno:20和21)(koopman,f.等(2012);kyndt,ja.等(2002),febsletters512,240-244)和来自西班牙糖丝菌的sam8(seqidno:22和23)(berner,m.等(2006),jbacteriol.四月;188(7):2666-73)二者5倍的活性。
实施例2:过表达杀鲑气单胞菌tal(seqidno:30和31)的白藜芦醇产生菌株中的白藜芦醇产生
用含有来自杀鲑气单胞菌的tal基因(asaltal,seqidno:30和31)的质粒转化不具有tal活性的白藜芦醇产生酵母菌株。质粒允许tal基因在整个酵母基因组存在的ty1区处多重整合。tal基因在强启动子ppgk1的控制之下并且实现该基因的过表达。
将其中过表达tal基因的所得菌株与含有实现白藜芦醇产生的所有必需基因的直接亲本菌株(对照)进行比较。
在将指定菌株在基本培养基中培养3天之后测量白藜芦醇和途径中间体(香豆酸和根皮酸)的水平。通过将乙醇与发酵样品混合至终浓度为50体积%并以3222×g离心5分钟进行化合物的提取。
结果显示,在其中过表达杀鲑气单胞菌tal的子代菌株中,白藜芦醇滴度提高25%(增加约375mg/l)。另外,当与对照亲本菌株比较时,显示香豆酸累积提高2.5倍(增加约108mg/l)。总之,在具有并且过表达asaltal的新菌株中,测量为白藜芦醇和主要副产物之和的潜在白藜芦醇通量提高26.2%(图3)。
序列
尽管已参照本发明的一些具体实施方案详细描述了本发明,但是明显的是,可进行修改和改变而不偏离所附权利要求书中限定的本发明范围。更特别地,尽管本发明的一些方面在本文中被鉴定为特别有利的,但是应构想,本发明并不必然局限于本发明的这些具体方面。
- 还没有人留言评论。精彩留言会获得点赞!