用于降解不溶性和可溶性草酸的高效草酸降解酶的制作方法
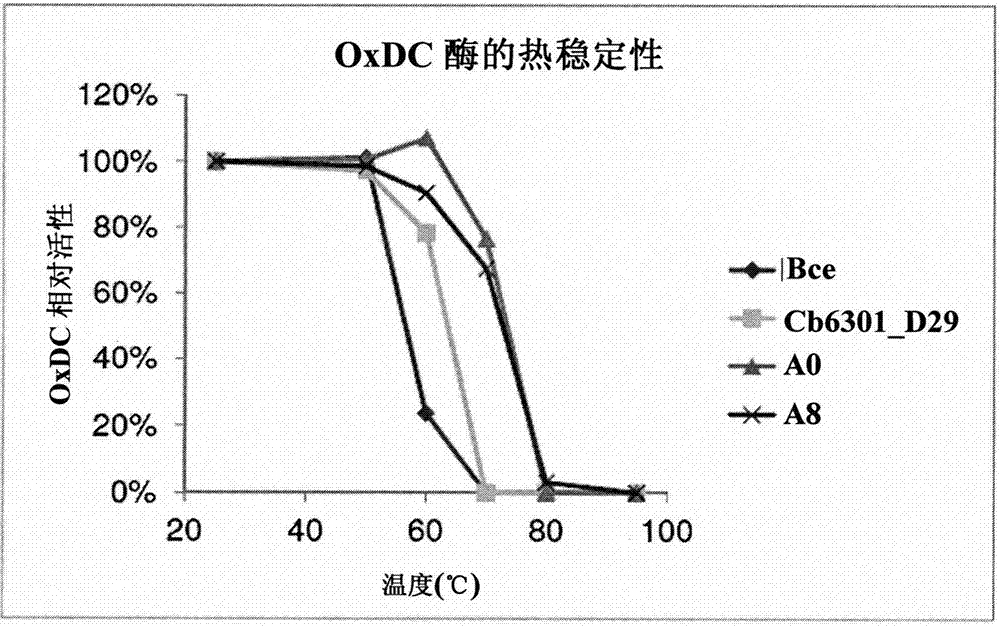
发明领域本发明涉及催化性高效草酸降解酶(草酸脱羧酶,oxdc)。本发明解决了有效降解不溶性和可溶性草酸钙的问题,其中,与先前的发现和报道的相比,oxdc酶对草酸盐具有更高的亲和性(km是以微摩尔与毫摩尔的比值计)。本发明还提供了证据证明为什么一些oxdc酶在,例如ph值1.5-5.0的酸性条件下,更加稳定和更具活性,并且给出不稳定性的原因是由于蛋白质的四级结构丢失造成。本发明还提供了证据证明包入三聚体的第一草酸脱羧酶。本发明还涉及从食品(例如面粉、面包、罐装蔬菜、馅饼等)和饮料(例如茶、啤酒、果汁等)中降低草酸盐(又名草酸)的浓度和/或完全去除草酸,从而减少从日常食品中摄入的草酸。这实质上建立了一系列低草酸与无草酸的食品和饮料,这些食品和饮料可以帮助人们更好地管理与草酸相关的疾病的状况和/或者让健康的人群具有更富营养的饮食(草酸被认为是一种抗营养素)。本发明进一步涉及用来使所述酶固定化的方法,这既为了将酶在趋于高温时进行稳定,同时也可以对相同的酶进行重新利用来处理多个批次的食品和饮料(即,实现所述酶的循环利用)。本发明进一步涉及用于对所述酶进行配方的方法,这既为了稳定所述酶,同时也可以通过新配方来准备所处的ph环境。本发明进一步涉及对所述酶和所述配方在用于治疗、工业、生物技术、化学、物理或其他相关应用领域、特别是治疗制剂(如医药制剂和营养品制剂)的酶颗粒的制备中的使用。本发明还包括含有未按配方配制或按配方配制的高效酶的医药和食品组合物。本发明进一步涉及所述酶作为食品加工助剂、食品添加剂、工业或其他相关应用领域的使用。本发明包括所述酶在食品制造过程中的使用。本发明还包括所述酶在工业生产过程(制浆和造纸、化学等)中的使用。本发明还涉及这些组合物在治疗有需要的主体的方法中的使用,其中,所述方法包括服用包含一种或多种所述高效酶或者所述一种或多种按配方配制的酶的药物或营养组合物。
背景技术:
:草酸盐是一种小有机二羧酸的盐。其具有两个酸离解常数点:ph1.25和4.14。因此,在ph值降低的情况下,更多的草酸盐将以单质子化或草酸存在,并且与例如钙这样的二价反荷离子的亲和力降低,从而导致溶解度增加。不溶性草酸盐是指草酸盐离子(c2o42+)通过离子相互作用而强束缚于例如钙(ca2+)这样的反荷离子上。由于草酸盐是一种弱有机酸,其溶解度在很大程度上取决于ph值。酸的酸离解常数等于酸及其相应碱以同等量存在时的ph值。草酸是二羧酸(两个酸基),因此,其具有两个酸离解常数点:ph1.25和ph4.14。因此,随着ph值的降低,草酸盐会以单质子化(hc2o41-)或草酸的形式存在,并且与钙的亲和性降低,从而导致溶解度增加。草酸盐是哺乳动物的代谢终产物。草酸盐也可以通过饮食摄入,因为它通常存在于植物中,主要存在于树叶、坚果、果实和树皮中。因此,哺乳动物具有两种草酸盐的来源:内源性(源于身体的新陈代谢)或外源性(源于饮食)。草酸盐在胃中就开始吸收,并在小肠达到最大吸收量。研究显示草酸盐摄入后20分钟,草酸盐尿排泄率即刻上升,并且在摄入后40分钟和180分钟时,排泄物具有两个明显的峰值。支持在胃中吸收的说法是在胃切除术患者中未检测到第一个草酸盐吸收的峰值。12由于胃中上皮组织的紧密连接3,因此,最大吸收量发生在小肠,这可能受到以下事实的影响:胃中的草酸盐转运可能仅限于跨细胞转运(通过上皮细胞),而不是在细胞间转运(在细胞之间)。身体无法降解或代谢草酸盐;因此主要通过肾脏排泄。当草酸盐未被充分去除时,草酸盐水平会积聚在血液中,并集中在尿液中,从而导致高草酸尿症(尿中草酸盐含量升高),并且在严重的情况下引发草酸过多症(组织中沉积草酸盐),从而造成组织损伤。发明概述本文所述的发明涉及高催化效率的草酸降解酶(草酸脱羧酶,oxdc)及其在降解可溶性草酸盐和不溶性草酸盐中的使用,其中所述酶被发现具有比在先所公开的高的多的对草酸盐的亲和性(km以微摩尔与毫摩尔的比值计)。本发明还提供证据证明保持自由基不抑制oxdc酶的方法,例如用谷氨酸和添加维生素代替340位的残基(cb6301,图10)。本发明还提供了证据证明为什么一些oxdc酶在例如ph值1.5-5.0的酸性条件下更加稳定和更具活性,以及由于蛋白质的四级结构丢失而造成的不稳定性。本发明还提供了天然包进三聚体的第一oxdc的证据以及其包进三聚体的原因。cb6301在三聚体界面处具有最小量的离子电荷残基和最大量的氢键残基。由于离子相互作用的数量减少以及氢键结合数量增加,cb6301在本质上将更加稳定。天然包入三聚体的酶(cb6301、cb6312和cb6803)在ph1.5的极端酸性条件下具有增强的稳定性和活性。人们发现剩余包入六聚体的酶主要通过六聚体界面处的离子相互作用作为六聚体结合在一起。另外,这些酶在三聚体界面处还具有较高的离子相互作用。较高的离子相互作用使酶在酸性ph(特别是ph3.0以下)下具有较差的稳定性。而造成稳定性下降的原因是由于在酸性ph条件下天冬氨酸(酸离解常数=3.65)和谷氨酸(酸离解常数=4.25)的质子化作用。在这些氨基酸被质子化时,oxdc的蛋白质四级结构解离,从而导致酶的解折叠以及接下来的活性丧失(不可逆事件)。六聚体和三聚体界面处较高的离子相互作用会让这些界面在酸性ph条件下易于解离。本发明还描述了重组表达这些酶的方式,这些酶的配方以及药物、特膳食品或由所述按配方配制或未按配方配制的酶制备的医疗食品组合物。本发明的另一个实施例是这些组合物在药物、特膳食品的使用或医疗食品等治疗目的中的使用。本发明还描述了这些酶在食品加工中从食品(即面包、面粉、罐装蔬菜)、饮料(即啤酒、茶、果汁)以及工业生产过程(即纸浆和纸,化学品)中降解草酸盐的使用。本发明的一个实施方案是重组表达的酶和固定化这些酶以便于回收和/或再利用。本发明的另一个实施例是这些固定化组合物在食品加工中的使用。本发明的另一个实施方案是这些固定化组合物在工业应用中的使用。其他实施例涉及草酸降解酶的固定化,从而为了所期望的应用对所述降解酶进行循环和再利用。所述固定化描述了所述酶如何能够在趋热时增加稳定性。本发明描述了草酸降解酶以及其它ph敏感型酶的配方,以使当ph敏感型酶被置于非最适宜ph的环境下时降低活性的损失。即使处于非最适宜ph的条件下,这种新配方仍可通过维持有助于活性的酶周围的微环境而保持活性。本发明的一个进一步实施例是使用这些制备的组合物用于治疗和预防疾病,特别是与草酸相关的疾病。附图说明图1.oxdc亚基单位排列。oxdc包入成三聚体的二聚物,从而形成六聚体。三聚体亚基a与亚基b和c都相互作用。六聚体亚基a与六聚体界面上的亚基d以及三聚体界面上的b和c相互作用。图2.三种oxdc酶的热稳定性:杨树菇(“a0”和“a8”)、蜡状芽孢杆菌(“bce”)和细长聚球蓝细菌(“cb6301_d29”)。如示例4所描述的,通过将所有活性结果正规化至25℃的活性来计算oxdc的相对活性。图3.两种oxdc酶的ph稳定性:蜡状芽孢杆菌(“bce”)和细长聚球蓝细菌(“cb6301_d29”)。如示例5所描述的,通过将所有活性结果正规化至25℃的活性来计算oxdc的相对活性。图4.如示例6中所描述的,在含有不同含量钙的9种不同食品中,“a0”中oxdc在ph2到ph7.5下的草酸盐降解。草酸盐的降解百分比是指在时间t=0时全部(不溶性+可溶性)起始草酸盐的百分比。图5.如示例7中所描述的,在各种ph和培养时间下“cb6301_d29”重组酶的oxdc活性。一个单位(u)被定义为每分钟降解1微摩尔的草酸盐。图6.如示例7中所描述的,在各种ph和培养时间下“bce”重组酶的oxdc活性。一个单位(u)被定义为每分钟降解1微摩尔的草酸盐。图7.如示例7中所述,在各种ph值下,bce、bpu、bam、bcl、cb6301、cb6803、a8和yvrkoxdc重组酶的oxdc活性。图8.如示例8所描述的,在ph1.5的酸性条件相对于最酸性ph值的条件下,六聚体界面处的净离子电荷,其中bce、bpu、bam、bcl、cb6301、cb6803、a8和yvrkoxdc重组酶显示出草酸盐降解活性。两个亚基之间界面处的氨基酸或电荷的数目。例如,根据图1可知,将是亚基a和d之间的界面。oxdc酶形成三聚体的二聚物,因此,一个oxdc六聚体具有三个界面。因此,y轴应该乘以3,得到整个六聚体结构之间的总电荷。根据图1,在亚基a和d、b和e、及c和f之间具有三个六聚体界面。图9.如示例8中所描述的,在中性条件相对于最酸性ph值条件下,三聚体界面处的净离子电荷,其中,bce、bpu、bam、bcl、cb6301、cb6803、a8和yvrkoxdc重组酶显示出草酸盐降解活性。两个亚基(根据图1为a和b)之间界面处的净离子电荷。oxdc酶形成三聚体的二聚物。如图1所显示的,各三聚体在a和b、b和c、及c和a之间具有三个界面。图10.使用muscle3.8的clustal多重序列比对完成cb6301、a8、bcl、bce、bpu、bam和yvrkoxdc酶的部分多重氨基酸序列比对。如示例8中所描述的,加有下划线的区域是六聚体界面处的氨基酸。如示例8中所描述的,粗体和下划线的残基位于三聚体界面处。以粗体突出显示的残基对于维持cb6301、cb6803和cb6312的草酸盐降解活性十分重要。图11.如示例8所描述的,cb6301、bce和yvrk酶在不同ph下的天然-page凝胶。图12.如示例9中所描述的,与不同化学物质在40℃时孵育6天后的“bce”的oxdc活性。一个单位(u)被定义为每分钟降解1微摩尔的草酸盐。图13.如示例9中所述,与不同化学物质在40℃时孵育6天后的“cb6301_d29”的oxdc活性。一个单位(u)被定义为每分钟降解1微摩尔的草酸盐。图14.cb6301_d29oxdc的酶动力学:如示例10中所述规定的每草酸盐浓度(mm)的反应速率(v0)。图15.a8的酶动力学作为ph值的函数:km按照示例10所述进行计算。图16.根据示例11,未按配方配制的bce酶(实心条)和按配方配制的bce(空心条)在ph值下的相对活性百分比。图17.1小时内降解的草酸盐百分比:根据示例11的未按配方配制的bce酶(黑色圆圈)和按配方配制的bce(白色圆圈)。图18.如示例12中所描述的,在低草酸摄食周期(lod)、高草酸摄食周期(hod)以及兼有小剂量a0的高草酸摄食周期内每肌酸酐的平均草酸盐。误差条表示sem(p值=0.00001,t临界值=5%=1.81246)。图19.如示例12所述,在低草酸摄食周期(lod)、高草酸摄食周期(hod)以及兼有小剂量ox1-cy(cb6301)的高草酸摄食周期(cyl)内每肌酸酐的平均草酸盐。误差条表示sem(p值=0.00064,t临界值=5%=1.81246)。图20.如示例12所描述的,在低草酸摄食周期(lod)、高草酸摄食周期(hod)以及兼有小剂量ox1-bc(bce)的高草酸摄食周期(bcl)内每肌酸酐的平均草酸盐。误差条表示sem(p值=0.05188,t临界值=5%=1.81246)。图21.如示例12中所描述的,在低草酸摄食周期(lod)、高草酸摄食周期(hod)以及兼有小剂量yvrk的高草酸摄食周期(yvrk)内每肌酸酐的平均草酸盐。误差条表示sem(尿液中草酸盐无显著降低)。图22.每个草酸盐-钙反应所产生的甲酸盐的百分比:等摩尔条件下标准化的钙反应(草酸盐∶钙=1∶1)。如示例13中所描述的,在未掺水的条件下以1/2x稀释度和1/4x的稀释度测试bce。图23.每个草酸盐-钙反应所产生的甲酸盐的百分比:等摩尔条件下标准化的钙反应(草酸盐∶钙=1∶1)。如示例13中所描述的,在未掺水的条件下,以1/5x、1/10x和1/20x的稀释度测试cb6301。图24.每个草酸盐-钙产生的甲酸盐的百分比:等摩尔条件下标准化的钙反应(草酸盐∶钙=1∶1)。如示例13中所描述的,在未掺水的条件下,以1/2x和1/4x的稀释度测试yvrk。定义本发明中使用的所有词汇旨在具有本领域通常情况下所赋予的含义。为了清楚起见,下面还对一些词汇进行了定义。草酸降解酶:“草酸降解酶”一词应理解为能够减少草酸盐的任意酶。所述酶应催化一个将草酸盐本身转化为产物的反应,而不仅仅是在草酸盐还原途径中起作用。按照所述定义,草酸降解酶包括草酸脱羧酶、草酸氧化酶和草酰辅酶a脱羧酶。“草酸盐”一词包括草酸及其任何盐。辅因子:“辅因子”一词应被理解为酶活性所必需的非酶促化合物,例如,包括nad+、nadp+、fad、coa、atp和adp。酶作用物:“酶作用物”一词应被理解为酶催化反应的迁入化合物。对于由草酸降解酶催化的反应,其应指的是草酸盐。亚基:酶亚基是与其他酶分子组合(或“共同组合”)形成酶复合物的单一酶分子。oxdc通常由六个亚基组成,从而形成六聚体(三聚体的二聚物)。有关动画描述,请参阅图1。然而,本文所述的cb6301、cb6803和cb6312由三个亚基、三聚体天然合成。酶的或催化的效率:酶在催化一个反应中的所显现的效率。定义为kcat/km,并以单位:转化/m/s进行描述。转化是指将酶作用物转化为反应产物。草酸相关疾病和/或草酸相关失衡:“草酸相关疾病和/或草酸相关失衡”一词应被理解为由全身草酸水平失衡引起的疾病,包括原发性高草酸尿症、高草酸尿症、吸收性高草酸尿症、肠原性尿草酸过多、特发性草酸钙肾结石病(尿结石症)、外阴痛、与终末期肾病相关的草酸病、心脏传导障碍、炎症性肠病、克罗恩氏病、溃疡性结肠炎、以及由胃肠道手术、减肥外科手术(肥胖症手术)、和/或抗生素治疗所引起的/与之相关的病症/情况。ph不敏感酶:ph不敏感酶被定义为按配方配制的酶,其在特定的ph下表现出比未按配方配制的酶更高的活性;从而,使它们相比于未按配方配制的酶对周围的ph值更不敏感。微环境:微环境在本文中定义为与活性酶接触和/或最接近的环境。在某些实施例中,微环境即在颗粒的边界内;因此它从粒子的外表面开始到达相同粒子的核心。由于本发明还考虑纳米级粒子,因此,据了解微环境也指微粒或纳米粒子内的环境。与包围微环境的周边环境相比,本文所述的微环境被认为是与按配方配制的活性酶最接近的环境。“周边环境”一词被认为是围绕微环境的环境。对于酶与颗粒结合的实施例而言,其在与活性酶相关联的颗粒的边界之外。ph活性分布:在不同的ph条件下测定未按配方配制的酶活性,并将这些酶相互作图(即x轴表示ph值,y轴表示活性)时得到的分布即为酶的ph活性分布。有效ph活性分布被定义为在不同的ph条件下测定未按配方配制的酶活性,并将这些酶相互作图(即x轴表示ph值,y轴表示活性)时得到的ph活性分布。因此,有效的ph活性分布没有描述未按配方配制的酶的特征,但显示当按配方配制的酶被置于不同周边环境中时检测到的活性。有效的ph活性分布的ph值描述了周边环境的ph值,而不是微环境。ph活性化合物:ph活性化合物是对其所在环境的ph值具有直接或间接影响的化合物。蛋白质四级结构:蛋白质四级结构是多重亚基复合物中多个折叠蛋白质亚基的数量和排列。它包括从简单二聚物到大型同源寡聚体的组织以及具有数量限定或可变亚基的复合物。六聚体界面:在所述六聚体的界面上,来自一个亚基的氨基酸与来自第二个亚基的残基相互作用。这些相互作用可以由氢键、离子和/或疏水的相互作用构成。在有oxdc的情况下,离子相互作用对维持六聚体结构所做出的贡献最大。六聚体界面上的残基以图8中所示的多重序列比对标出。如本发明所描述的,六聚体界面将由在两个亚基之间发生的相互作用组成。例如,在亚基a和d之间。还有两个额外的六聚体界面在亚基b和e以及亚基c和f之间。有关动画描述请参见图1。整个六聚体界面:整个六聚体界面是在所有三个六聚体界面处相互作用的氨基酸的总数和类型。由于oxdc包入具有六个相同亚基的六聚体,从而具有三个单独的六聚体界面;因此,通过将六聚体界面乘以三来计算整个六聚体界面。这些相互作用可以由氢键、离子和/或疏水性组成。在存在oxdc的情况下,参与的相互作用主要是以离子形式。六聚体界面上的残基以图8中所示的多重序列比对标出。有关动画描述请参阅图1。整个六聚体的界面是a和d、b和e、及c和f之间相互作用的总和。三聚体的界面:在三聚体的界面上,来自一个亚基的氨基酸与来自第二个亚基的残基相互作用。这些相互作用可以由氢键、离子和/或疏水的相互作用构成。在oxdc存在的情况下,离子和氢键相互作用对维持三聚体结构所做出的贡献最大。三聚体界面处的残基用下划线和黑体标注在图8所示的多重序列比对中。如本发明所描述的,三聚体界面将由两个亚基之间发生的相互作用组成。例如,在亚基a和b之间。还有两个另外的三聚体界面在亚基b和c以及亚基c和a之间。有关动画描述请参见图1。整个三聚体界面:整个三聚体界面是所有三个三聚体界面处相互作用的氨基酸的总数和类型。由于cb6301、cb6803和cb6312与三个相同的亚基包入三聚体,从而具有三个单独的三聚体界面;因此,通过将三聚体界面乘以三来计算整个三聚体界面。这些相互作用可以由氢键、离子和/或疏水性组成。在oxdc存在的情况下,参与的相互作用主要是离子键结合和氢键结合。三聚体界面处的残基用下划线和黑体标注在图8所示的多重序列比对中。有关动画描述请参阅图1。整个三聚体的界面是a和b、b和c、及c和a之间相互作用的总和。净离子电荷:离子净电荷是在确定的ph条件下两个相互作用的亚基之间的六聚体或三聚体界面上的总体电荷。它可以在所有天冬氨酸和谷氨酸被质子化(酸性ph值)或中性ph值条件下计算,其中这些残基是离子性的。关于oxdc,大多数同系物包入三聚体的二聚物。因此,三个亚基与另外三个亚基相互作用,参见图1的描述。在cb6301存在的情况下,如表4和图9所示,-3的离子净电荷仅对应于三个亚基相互作用中的一个。如果考虑到整个三聚体分子,则总净离子电荷将是-3x3=-9。稳定性:当草酸盐降解活性为控制条件的80-125%时,酶则被定义为在特定条件(ph值、温度等)下具有稳定性。酶命名法:yvrk=来自枯草芽孢杆菌的草酸脱羧酶cb6301=来自细长聚球藻6301的草酸脱羧酶cb6301_d29=来自细长聚球藻6301的草酸脱羧酶,其中在n-末端的前29个氨基酸已被去除cb6803=来自细长聚球藻6803的草酸脱羧酶bce=来自蜡状芽孢杆菌的草酸脱羧酶bc1=来自克劳氏芽孢杆菌的草酸盐脱羧酶bam=来自解淀粉芽孢杆菌的草酸脱羧酶a8/a0=来自杨树菇的草酸脱羧酶bpu=来自短小芽孢杆菌的草酸脱羧酶发明详述概述具有两种类型的高草酸尿症,即原发性高草酸尿症(ph)和继发性高草酸尿症(sh)。原发性高草酸尿症(ph)是乙醛酸代谢的先天性缺陷,其发病率为百万分之0.1-0.2。原发性高草酸尿症分为三种类型:i、ii和iii型,其中i型由肝特异性过氧化物酶体丙氨酸/乙醛酸转氨酶(agt)的活性不足或缺乏引起,并且每24小时尿液中的草酸盐含量约为88-352毫克(相当于每24小时1-4毫摩尔)。ii型原发性高草酸尿症(ph)是由乙醛酸还原酶/羟基丙酮酸还原酶(grhpr)活性不足或缺失造成,并且,每24小时尿液中的草酸盐含量约为88-176毫克(相当于每24小时1-2毫摩尔)。iii型原发性高草酸尿症(ph)是一种新发现的先天性缺陷,同时也表现出严重的高草酸尿症,每24小时尿液中的草酸排泄量>0.8毫摩尔。如果发生慢性或终末期肾功能衰竭(esrf),在i和ii型原发性高草酸尿症(ph)的任一种状态下,患者可以产生大于100μmol/l的血浆草酸浓度。原发性高草酸尿症(ph)患者血液中caox的过渡饱和会导致全身性的草酸过多症:caox晶体沉积在多个器官,包括肾脏、甲状腺、心肌、骨骼、皮肤、血管和眼睛中。如果不治疗,全身性草酸过多症最终会导致终末期肾功能衰竭(esrf)和死亡。尚未有批准的疗法来治疗或预防i-iii型原发性高草酸尿症(ph)。目前推荐的治疗方案的重点只能放在通过补充镁、柠檬酸盐和正磷酸盐以及鼓励每24小时至少2l的排尿量来增加草酸钙沉积物的溶解度。吡哆醇是缺乏agt的辅因子,并且对降低尿中草酸水平的i型原发性高草酸尿症(ph)有积极作用。不幸的是,目前唯一的治疗方法是联合肾脏和肝脏移植;然而,许多移植的器官即使在移植后也会通过一致的血浆草酸水平排斥或受损。继发性高草酸尿症包括草酸盐相关病症,例如,但不局限于,高草酸尿症、吸收性高草酸尿症、肠原性高草酸尿症、特发性草酸钙肾结石病(尿石症)、外阴痛、与终末期肾病相关的草酸病、心脏传导障碍,炎症性肠病、克罗恩氏病、溃疡性结肠炎、以及由胃肠道手术、减肥手术(包括肥胖症手术)和/或抗生素治疗引起的/与之相关的病症和情况。尿石症(肾/泌尿系结石病)是高草酸尿症的常见结果,也是世界各地的主要健康问题。肾结石形成的风险围绕着许多尚未完全了解的因素。在西方国家,肾脏或泌尿系结石病多达12%,其中约70%由草酸钙或草酸钙(caox)加磷酸钙组成。这种疾病的发生是由于肾脏和尿液中草酸含量增加所致,这是人类最常见的高草酸血症,称为肠原性高草酸尿症。caox肾结石的形成非常普遍,有证据表明,尿液中的草酸浓度的略有升高可能是特发性caox尿石症亚组患者的重要因素。4有人认为其部分原因与人们普遍认为结石形成人群的平均尿钙水平高于正常人群有关。结石患者的高钙尿症发病率比正常人高5-10倍,并且高钙尿症人群草酸钙的相对过饱和度高于其他人群。5正常尿液中钙与草酸盐的比例为5∶1;因此,由于钙具有较高的可用性,因此,少量增加的草酸盐将对所产生的可能的结晶状物产生很大的影响。在正常的尿量范围内,草酸盐的微小变化对caox过饱和度的影响大于钙的变化对其的影响。许多结石复发人群的尿液化学不同于健康人群,并且在结石人群中评估尿液化学时,证明含草酸盐尿液和草酸钙的过饱和度可以通过控制代谢饮食来控制。这有力支持了饮食在作为含草酸盐尿液和草酸钙过饱和度的决定因素中的关键作用。8钙与草酸盐比例的重要性也尤为明显。随着控制的代谢饮食中的钙含量下降,尿液中的草酸盐趋于增加,这表明可吸收的更多。zellweger范围疾病(zsd)的特征在于过氧化物酶体合成不足导致的过氧化物酶体功能的普遍丧失,并且这些患者具有高发病率(83%)的高草酸尿症。虽然zsd患者草酸盐合成的机制尚不清楚,但一些zsd患者含草酸盐尿液水平与原发性高草酸尿症(ph)患者相当。慢性肾功能衰竭和慢性血液透析的esrf患者由于其肾衰竭并发症而不能充分消除草酸盐,因此可能发生高草酸尿症。另外,维生素c通常作为血液透析抗氧化剂静脉内注射,随后在人体内代谢为草酸盐。这些患者的血浆草酸盐浓度介于30与90μmol/l之间。仅在美国,2006年就有34.5万名血液透析患者。人体内的草酸盐平较复杂,至今尚未完全了解。草酸盐主要通过肾脏排泄,而人体的另一种排泄方式是通过肠道排泄。已经显示草酸盐可以作为另一种排泄途径分泌到肠道中以减轻肾脏负担。因此,肠道中的草酸盐流量可以在尿结石病的发展中起着重要作用。6已经证明,通过溶质相关载体(slc)转运体,特别是slc26系列转运体完成草酸盐的转运。78该基因家族对已证明具有草酸盐亲和力并在肠道中找到的转运体编码(slc26a1(sat1),scl26a2(dtdst),slc26a3(dra),slc26a6(pat1或cfex),slc26a7,和scl26a9)。草酸盐食品:各类食品均含有草酸盐。众所周知,如菠菜、食用大黄和坚果等食品均含有高浓度的草酸盐。然而,许多其他的食品和饮料,如甜菜、巧克力、草莓、麦麸和茶中的草酸盐也很高。其他含草酸盐的食品包括但不局限于:豆类、葡萄柚、橘子、洋葱、甜菜、土豆、生菜、李子、覆盆子、菠萝、猕猴桃、羽衣甘蓝和西红柿(见表1)。医生对草酸钙肾结石患者最常见的建议是遵守低草酸盐饮食。但是,由于食品中草酸盐的含量受到植物生长环境、气候、季节和原产地的影响,因此保持低草酸盐的饮食经常不受节食者的控制。低草酸盐饮食经常与其他更严重的疾病(如糖尿病)相矛盾,这使得患者难以实现低草酸盐饮食。表1:食物中草酸盐的含量(示例)食品名称总草酸盐(毫克)/100克芝麻籽3800食用大黄1235嫩菠菜1063杏仁粉面粉519红薯354甘薯278麦麸面粉269特别k麦片189好时牛奶巧克力107红茶78草酸盐生物利用度:草酸盐的生物利用度取决于草酸盐的溶解度。在可溶形式中,草酸盐以草酸(低ph值)或草酸盐离子(缺少强亲和性反荷离子)形式存在。因此,直接影响草酸盐溶解度和生物利用度的主要因素是高亲和力的反荷离子(钙、铁和某种程度上的镁),并且产生间接影响的包括磷酸盐(结合钙)、脂肪(高ph值)和肌醇六磷酸盐(结合钙)。9因此,随着ph值的降低,草酸盐会以单质子化(hc2o41-)或草酸(h2c2o4)的形式存在,并且与钙的亲和力降低,从而导致溶解度增加。不溶性草酸盐是指与反荷离子结合,即以盐形式存在的所有c2o42-草酸盐,并且它们通过降低ph值进行溶解。钙是胃肠(gi)道中草酸盐不溶解的主要因素。建议成年人日常摄入钙的量为每天约1000毫克。对于成年人来说,大部分(72%)钙通过乳制品供应。如上所述,随着ph值变得更酸,草酸盐的量也即增加。jaeger和robertson提出了可在不同浓度的钙和ph条件下获得草酸盐的浓度,并证明在ph值为2和平均钙浓度为5mm(200mg/l)时,可溶性草酸盐浓度最高为0.49mm(43mg/l),这一浓度接近正常膳食中预定量的草酸盐。10因此,在正常成人膳食中钙和草酸盐的预期浓度下,大多数草酸盐在ph值为2的条件下是可溶的,因此其可被酸稳定酶吸收或降解。这一事实也得到了摄入20分钟后草酸盐排泄研究的支持,证明了草酸盐在胃中具有生物可利用性。随着钙和草酸盐比例的变化,草酸盐溶解度也随之变化;因此,以治疗为目的的草酸降解酶的两个最重要特征是低ph耐受性和酶催化或催化效率。草酸降解酶:目前,已有三类酶被确定为草酸盐降解物(1)草酸脱羧酶(oxdc,草酸盐羧酸分解酶,ec4.1.1.2),(2)草酸氧化酶(oxo,草酸盐:氧化还原酶,ec1.2.3.4)和(3)草酰辅酶a脱羧酶(草酰辅酶a羧酸分解酶,ec4.1.1.8)。oxdc在生成甲酸盐和二氧化碳的一步电子戒断反应中降解草酸(作为草酸盐)并且需要mn2+和o2以便于催化。在将草酸分解成两个co2分子之前,oxo酶被o2氧化,并生成h2o2。第三种酶存在于细菌中,并使用作为辅因子的焦磷酸硫胺将草酰辅酶a转化为甲酰辅酶a和二氧化碳。酶催化效率:酶可以是草酸盐的有效降解物,并且通常易于大批量生产。对于在胃肠道中酶是有效的草酸盐降解物,它需要具有抗蛋白酶性,耐ph值性以及高酶催化效率。本领域技术人员熟知酶催化效率通常被描述为kaat/km。km可被描述为酶作用物浓度,在该浓度下,酶显示出50%的反应速率。因此,km越低,表示酶在较低浓度的酶作用物下越快。kcat可被描述为催化反应速率,单位是每秒(每秒转化,即,酶作用物到产物的转化)。因此,kcat应尽可能高,并且速率kaat/km也应该高,从而可以描述在低酶作用物浓度下仍可快速降解酶作用物的酶。酶效率在体内草酸盐降解尤为重要。原因是草酸盐既可溶也可不溶(两种均以盐形式存在)。可溶性草酸盐可自由获得酶,但不溶性草酸盐则需要酶与反荷离子(如钙)的离子相互作用一较高下。可溶性和不可溶性物质处于恒定的平衡状态,见下面的方程式。随着钙与草酸盐的比例增高,将会有更多的草酸盐被束缚,而不能自由地获得酶(“可溶”)。当在下面的平衡中去除草酸盐时,钙与草酸盐的比例将增加,从而使得可获得的可溶性草酸盐的量进一步降低。草酸钙<->钙+草酸盐(可溶)更多的草酸钙可通过从方程式右侧去除可溶性草酸盐来溶解。平衡也受钙浓度的影响,所以在高钙浓度下,可溶性草酸盐的量也将会降低。因此,酶的km变得很重要,因为酶需要能够在酶作用物低浓度(少量的可溶性草酸盐)下具有高活性。11其在治疗环境下的重要性对于本领域技术人员是显而易见的,因为膳食钙是正常饮食的一部分并且有效地减少了有效的可溶性草酸盐的量。用于治疗目的或用于在高钙浓度环境中除去草酸盐的酶必须是高度有效的,即使当可溶性草酸盐的量非常低时也能够催化草酸盐降解反应。这就要求所述酶对其酶作用物具有高度亲和力,并且在其它方面要求其具有较高的kcat/km。酶的耐酸性:在生物技术的最新进展中,允许选择和制备肽和蛋白质等新的大分子化合物作为以治疗为目的的药物。这类化合物显示出强大的选择性治疗活性,然而,蛋白质的治疗活性高度取决于最佳环境因素,例如:ph值、温度及表面相互作用。如本领域技术人员所熟知的,某些大分子对酸性ph值具有较高的抗性,这对于天然酶结构本身是固有的。然而,许多酶中获取高活性的ph范围极其有限。例如,来自枯草芽孢杆菌(yvrk)或蜡状芽孢杆菌(bce)的oxdc酶分别在ph值4和2.5附近具有最佳活性;然而,在ph>7时酶完全失去活性。这降低了这些酶在中性或碱性ph值下用在体液或其他流体的可能性。酶在工业和生物技术工艺中的应用通常要求酶必须在非常特定的并且有时候完全非生理的条件下发挥功能,并且在许多情况下需要调整处理以适应所使用酶的特性。几个工业生产过程未来也将继续受益于重新进行工程设计的ph依赖特性的酶的应用(例如淀粉液化用于生产乙醇和高果糖糖浆(shaw,bott,&day,1999)、洗涤剂应用(ito等人,1998)以及染料漂白(cherry等人,1999)。因此,对于开发改变酶的ph依赖特性的实验和理论方法具有强烈的兴趣。在蛋白质工程和定向演化领域已经取得了进展,目前,可以使用合理的工程或基于筛选/选择的方法,对各种条件下的酶的性能进行常规优化。已经在致突变作用下改变了酶的特性和酶的ph活性分布。然而,已经证明这是一项非常艰巨的任务。尽管对酶结构-功能关系进行了几十年的研究,但在合理重新设计酶促ph活性分布方面的成功可能性仍然很小。有一些活性位点酸离解常数值已改变的实验示例,随即对ph-活性分布进行重新设计,但是这些转移是适度的,并且通常情况下,已使用比较性白质工程学策略找到至关重要的突变(即,突变是基于与拥有期望的ph活性分布的同源酶的比较引入)。二十年工作价值的结论是,活性位点中极特定的点突变可以改变酶活性的ph依赖性,但是除非这种特定的活性位点的点突变是已知的(例如来自对比研究),否则,利用合理的工程方法实现ph活性谱显著转变,而不使突变酶失活或活性显著降低的希望不大。另一方面,远距离点突变主要为突变酶提供野生型活性,但同时也产生非常小的ph活性谱转移(tynan-connolly&nielsen,2006)。蛋白质四级结构:大多数酶是多个多肽链的组合体。因此,蛋白质四级结构是指酶亚基彼此之间相对的数量和排列。关于oxdc,从文献中可知这种特定的酶天然包入六聚体,实质上是包入三聚体的二聚物。酶的固定化:最适宜的酶一经确定,该酶可配制用于更好的联合工艺。考虑范围最广的方法之一是酶的固定化。固定化可以实现:(1)具有高活性的高酶负荷,从而实现大体积生产率;(2)可控制反应的扩大;(3)由于生物催化剂容易回收和再利用,因此,可简化下游工序;(4)产品流从生物催化剂清除;(5)可实现连续操作(或者在流失和补充的基础上进行的批量操作)和工序自动化是可能的;和(6)可将酶作用物的抑制减到最小。除此之外,只要固定化的设计得当,其还可防止自溶作用或有机溶剂引起的变性,并且能够带来热稳定性、操作和存储稳定性。如果使用的酶价格昂贵,则对于经济可行性来说,固定化证明是关键因素。允许可连续重复利用的增强稳定性可实现高单位生产率,从而影响与生物催化剂相关的生产成本。一个典型的示例是固定化葡萄糖异构酶的产量,其在整个生物催化剂的使用寿命期间,允许每千克生物催化剂用于12,000-15,000千克干果产品高果糖玉米糖浆(含有42%果糖)。由于反应器对清洁的需求不高,因此,提升的热稳定性,在允许上述常规反应器操作的情况下,使微生物生长的风险降低到最小程度,从而可使微生物生长的风险降低,并且降低了对卫生的要求。酶的口服给药和剂型:在某些实施方案中,组合物可以根据待治疗的病症以多种方式单独给药或结合其他治疗同时或依次给药。典型的给药方式是口服给药,从而使得给药的组合物被输送到胃肠道。可以基于疾病或条件、期望的疗效以及所使用细胞的性质来选择给药途径。制备剂型的实际方法对于本领域技术人员来说是已知的或将是显而易见的。(参见remington的药物科学刊物,第20版,2000年出版。lippincott、williams和wilkins。)当给个体服用本文所述的组合物时,给药量优选为充分证明对受试者有益的“预防有效量”或“治疗有效量”。在治疗草酸盐相关疾病的情况下,治疗有效量就是降低受试者中的草酸盐和/或减轻疾病症状的量。口服给药是首选以及使用最广泛的给药途径。然而,由于其生物利用度低,因此,这种途径通常不适用于传输蛋白质等大分子。生物利用度的降低是由于其在胃肠道恶劣环境中固有的不稳定性以及低吸收性。因此,已用于改善口服传输蛋白质的生物利用度的技术是基于防止通过酸以及胃肠道内的降解或通过胃肠道的上皮层增加蛋白质渗透性的具体方法(k.park,kwon,和park,2011)。由于口服给药途径的困难较大,因此许多治疗性蛋白质经胃肠外给药。为了将不适减少到最低程度、改善患者的依从性,长期持续传输缓释剂型的蛋白质药物令人期待。使用最广泛的用于长期传输蛋白质药物的方法是蛋白质药物以由可生物降解聚合物制成的微球体注射给药。美国食品和药物管理局已经批准了许多产品中的可生物降解和/或生物相容性聚合物。在合成聚合物家族中,聚酯已被广泛吸引和研究。其具有吸引力的特点包括易于通过酯链水解而降解,在某些情况下降解产物通过代谢途径被吸收,并且可能改变结构以影响降解速率。生物可降解和生物相容性聚酯的示例是聚(羟基乙酸)和聚(乳酸)及其聚(乳酸-共-羟基乙)酸(plga)等一系列共聚物。plga已作为控制蛋白质和肽传输的载体进行广泛研究(ding和schwendeman,2008)、(cohen,yoshioka,melissa,hwang,和langer,1991)、(gupta,singh,和o’hagan,1998)、(vandeweert,hennink,和jiskoot,2000)、(schwendeman,2002),从而产生了几种市售的注射用品(okada,doken,ogawa,和toguchi,1994)、(ogawa,okada,heya,和shimamoto,1989)、(johnson等人,1996),并具有良好的安全记录(chasin和langer,1990)。plga降解为乳酸和羟基乙酸单体,随后以co2和水的形式通过克雷布斯循环在体内消除。生物可降解和生物相容聚酯或共聚酯的其它示例为:聚(原酸酯)、聚己酸内酯和聚(富马酸丙二醇酯)。聚富马酸丙二醇酯是一种可生物降解的不饱和线性聚酯。降解产物是丙二醇、聚(丙烯酸-共-富马酸)和富马酸。当在复合材料中时,降解时间取决于聚合物的结构以及其他组分(temenoff和mikos,2000)。生物可降解聚合物与在控制药物传输应用的另一个示例是聚酐类(brem等人,1995)。聚酐类通过酐链的水解而降解,而且,降解产物无毒,并且产生最小的炎症反应(gunatillake和adhikari,2003)。通过选择合适的二酸单体,可以简单地通过改变聚合物主键中的结构来改变降解速率。例如,聚(癸二酸)迅速降解(在盐水中约54天),而聚(1,6-双(对羧基苯氧基))己烷的降解时间大约为一年。因此,这些不同数量单体的组合将产生针对具体应用自定义设计的降解特性的聚合物(temenoff和mikos,2000)。生物可降解聚合物的其他示例为聚(乙烯磺酸)和聚(丙烯酸)。众所周知,plga中存在不同水平的水溶性酸性杂质,这会影响其固态稳定性、药物包封效率以及药物释放反应(yamamoto,okada,yasuaki,和miyagawa,1993)。而且,普通情况下认为脂肪族聚酯微球体的降解机理是水解机理,酯主键在体液等含水环境中经历水解,并且在plga存在的情况下,聚合物最终降解为乳酸和羟基乙酸单体,从而降低了当前环境的ph值(freitas,merkle,和gander,2005)、(fu,pack,klibanov,和langer,2000)、(zhu,mallery,和schwendeman,2000)。这在本领域已经被视为包封蛋白质稳定性的问题。vert和同事基于乳酸和羟基乙酸聚合物对装置的水解降解的尺寸依赖性进行了广泛的研究。能够调节丙交酯/乙交酯均聚物和共聚物微球的水解降解行为的因素包括但不限于:水渗透性和溶解度(亲水性/疏水性)、化学组成、水解机理(非催化、自催化、酶催化)、添加剂(酸性、碱性、单体、溶剂、药物)、形态(晶体状、非晶形)、装置或颗粒尺寸(尺寸、形状、表面积-体积比)、基体孔隙率、玻璃化转变温度(玻璃状、橡胶状)、分子量和分子量分布、理化因子(离子交换、离子强度、ph值)和制备工艺的性质(离子交换、离子强度、ph值)、灭菌以及植入部位(anderson和shive,1997)、(t.g.park,1995)、(s.m.li,garreau,和vert,1990)、(grizzi,garreau,li,和vert,1995)、(t.g.park,1995)。这些因素中的一些也与上述其它类型聚合物的水解降解行为有关,并且所涉及的因素在下面进一步说明。添加剂通过其酸性或碱性以及加载量均可影响降解速率。maulding等人进行了有关加速硫哒嗪叔胺化合物降解的报道。催化归因于氨基的亲核性质(maulding等人,1986)。因此,碱性化合物可以催化酯链的断裂,从而加速聚合物的降解。另一方面,适量的碱性化合物可中和羧(基)端基,从而降低酸诱导的降解速率。所使用的均聚物或共聚物的结晶度可以对降解速率起到重要作用。动物的长期研究表明,与半结晶样品相比,植入非晶态结构的样本会导致植入物的分子量降低;因此,认为非结晶组分出现降解,而发生的部分原因要归自催化降解行为(pistner等人,1994)。微球体的孔隙率起主要作用,因为它可以增强低聚物和羧基链末端的可促进自催化降解的低分子量降解产物的扩散(shive和anderson,1997)。由较低聚合物浓度的溶液制成的微球体通常具有内部多孔的结构(yang,2001),这可能导致酸性降解产物通过聚合物基体更高有效的扩散,并由此促进其释放(liu和schwendeman,2012)。单体的分子量分布也可以影响自催化过程,因为大分子量或大范围的分子量分布具有更多的可用于自催化的羧酸端基。已经表明,降解产物不仅是单体;在plga薄膜中,培养3周后的水溶性酸的主要成分是羟基乙酸、乳酸和乳酰乳酸,以及假定为乳酸四聚体的一种未知聚合物(ding和schwendeman,2004)。酸含量在三周后急剧增加,这是由于聚合物降解导致的酸不断积累、由这些自催化聚酯水解的酸引起的降解速率加快(pearce和schaefgen,1992)。乙醇酸的线型二聚物不稳定并迅速水解成羟基乙酸,而乳酰乳酸可以在更长的一段时间内保持完整。此外,已经观察到羟基乙酸的释放比乳酸快3-4倍(marcato,paganetto,ferrara,和cecchin,1996)、(giunchedi,conti,scalia,和conte,1998)。当聚合物的丙交酯含量从50%增加到100%(plga相对于pla为50∶50)时,可通过富含丙交酯的共聚物和均聚物下降的降解速率观察到相应的单体酸降低,并加以说明(tamada和langer,1993)、(shih,waldron,和zentner,1996)。此外,plga中共同掺入mg(oh)2、mgco3和znco3等抗酸剂有力地抑制酸敏感性蛋白质结构的损失和聚集超过一个月(zhu等,2000);(zhu和schwendeman,2000)、(jiang和schwendeman,2008)、(kang和schwendeman,2002)。近年来,利用共焦扫描显微镜和ph敏感探针借助ph绘图,plga微球内的微气候ph值在更大范围内分布的监测已经得到改善(sansdrap和moes,1997)、(ding和schwendeman,2008)。此外,已经为plga薄膜建立了预测微环境的基本模型(liu和schwendeman,2012),并且其将被证明对预测其他结构也是有益的。实施例的进一步说明蛋白质四级结构:本发明以发明人对用于降解受试者、工业生产工艺和/或食品工艺中草酸盐的新型组合物的开发追求为基础。oxdc的活性已经对七种细菌种群中发现的酶和一种细菌种群cb6301的许多变体进行了评估。另外,活性已经从一种真菌物种杨树菇(a8/a0)中得到评估。活性已经根据示例1中概述的工序进行了测试。如图5-7所示,许多这些同系物中的oxdc活性稳定,并至少在ph1.5(cb6301、cb6312和cb6803)、ph2.0(a8和bcl)、ph2.5(bce)、ph3.0(bam)和ph3.5(yvrk和bpu)下具有活性。cb6301、cb6312和cb6803显示出自胃蛋白酶至ph值为1.5条件下的全面保护。由于这些酶的蛋白质四级结构是三聚体,因此,cb6301、cb6312和cb6803在ph值1.5下具有活性和稳定性。三聚体界面处离子相互作用的数量较低、以及氢键相互作用的数量增加,造成了三聚体蛋白质四级结构对ph值变化抗性的增加。这三种酶是酶的草酸脱羧酶家族中第一种被发现可以天然包入三聚体的酶。由于六聚体界面处的氨基酸组成,所有剩余的酶包入六聚体,如表4所示。将六聚体结合在一起的相互作用主要是离子间的相互作用,即,来自谷氨酸和天冬氨酸的负电荷与来自赖氨酸和精氨酸的正电荷相互作用。在对天冬氨酸(pka3.65)和谷氨酸(pka4.25)进行质子化时,在酸性条件下,oxdc的蛋白质四级结构解离,从而导致酶的解折叠以及随后的活性丧失(不可逆事件),见图11。yvrk和bpu分别比bam和bce含有更多的谷氨酸,参见表4,从而使得谷氨酸的pka成为蛋白质四级结构解离的关键驱动因素;因此,成为yvrk和bpu仅在ph3.5的条件下具有活性和稳定性的原因。天然包入六聚体的酶不仅在六聚体界面处具有较高数量的离子相互作用,而且在三聚体界面处也具有较高数量的离子相互作用。每个亚基的离子相互作用的组合数量如下:cb6301:25bcl:29a8:32bce:32bam:44yvrk:45bpu:47总离子相互作用的数量与酸性ph稳定性之间存在直接相关性,其中cb6301的量最小,但稳定性最高,而bpu的量最大,但稳定性最低。由于活性位点非常接近亚基界面,因此,本身是六聚体的酶需要具有六聚体的活性蛋白质四级结构。在六聚体界面(6个亚基中2个之间的相互作用)上具有大于10个离子氨基酸残基(d、e、r和k)的酶仅在ph3.0以上的条件下具有活性,参见表4。在六聚体界面上具有5-9个离子残基(d、e、r和k)的酶(6个亚基中的2个之间的相互作用)仅在ph2.0以上显示活性,并且少于5个离子残基酶(6个残基的2个之间的相互作用)在ph2.0以下显示活性。其还与六聚体界面处的总阳离子净电荷有关,这仅归因于界面中精氨酸和赖氨酸残基的数量,原因是所有的天冬氨酸和谷氨酸均被质子化。这些结果显示出以下必然趋势:1)带有+8及以上的总净离子电荷的酶只有在ph3.0以上(6个亚基中的2个之间的电荷)具有草酸盐降解活性。2)带有+4到+7的总净离子电荷的酶在ph2.0以上(6个亚基中的2个之间的电荷)具有草酸盐降解活性。3)带有小于+4的总净离子电荷的酶在ph2.0以下(6个亚基中的2个之间的电荷)具有草酸盐降解活性。在大多数(如果不是全部的话)天冬氨酸和谷氨酸被质子化的ph条件下,六聚体界面具有总正净电荷。总正电荷的量随着赖氨酸和精氨酸氨基酸残基的数量而增加。由于随着酸的质子化和降低的ph值,产生较大的总正净电荷,因此,在六聚体界面处具有较大比例的离子残基的酶在ph值变化方面比具有较少离子残基的酶更敏感。实际上,图7显示出在所有天冬氨酸和谷氨酸均被质子化的ph值条件下,总净离子电荷与证明yvrk、bam、bpu、bcl、cb6301、a8/a0和bce酶具有草酸盐降解活性的最酸性ph条件下的总净离子电荷直接相关。事实上,r2值与大量的数据显示出大于0.95的强相关性。应当注意,一个界面处的氨基酸或电荷的数量位于两个亚基之间,例如亚基a和d,参见图1。oxdc酶形成三聚体的二聚物;因此,一个oxdc六聚体具有三个界面。因此,为了计算“整个六聚体界面”之间的总电荷,应将上面提到的离子电荷乘以3。不仅在六聚体界面内,而且在所有界面(六聚体和三聚体)内都具有直接相关性。例如,最低酸稳定性的酶(bam、bce和bpu)在六聚体和三聚体界面上都具有大于44个离子氨基酸。bel、bce和a8有29-32个离子氨基酸,cb6301有25个。尽管bcl、bce、a8和cb6301离子相互作用的数量减少,但是它们仍具有大量的氢键相互作用。这些氢键相互作用增加界面处的稳定性,并使界面不易发生酸变性。因此,基于任何待发现的oxdc的氨基酸序列或者已经使用以下临界值发现的氨基酸序列,我们可以预测所述酶是三聚体还是六聚体,以及该酶的酸稳定性。该信息还提供了改变酶的特征的序列修饰策略,即ph活性分布。例如,配备了这些知识,本领域技术人员可以确定对改变稳定性和ph分布的酶进行修饰的位置。所述临界值的定义如下:六聚体和三聚体界面上一个亚基的总带电氨基酸:1)>39:则所述酶将是六聚体,并且仅在ph3.0条件下以上显示活性2)介于29-39之间:则所述酶将是六聚体,并且仅在ph2.0及以上条件下显示活性3)<29:则酶将是三聚体,并且仅在低于ph2.0及以上时显示活性六聚体界面上一个亚基的总带电氨基酸:1)>10:则所述酶将是六聚体,并且仅在ph3.0条件下以上显示活性2)介于5-9之间:则所述酶将是六聚体,并且仅在ph2.0及以上条件下显示活性3)<5:则酶将是三聚体,并且仅在低于ph2.0及以上时显示活性整个六聚体界面上总精氨酸和赖氨酸:1)>22:则所述酶将是六聚体,且仅在ph3.0及以上时才显示活性2)10-21:则该酶将是一个六聚体,且仅在ph2.0及以上时才显示活性3)9或更少:酶将是三聚体,且仅在ph2.0以下及以上时显示活性催化效率:本发明的某些实施例涉及高催化效率的草酸降解酶。它们的高催化效率使得它们有可能与钙和草酸盐之间的强离子相互作用竞争,从而,即使在周围高浓度的钙离子条件下,也会降解草酸盐。催化效率是酶氨基酸序列和结构所固有的,并且通常情况下,以kcat和km测量。公开了新型酶即使在剂型不存在的情况下也同样具有高效催化性和稳定性。催化效率介于871-77000转换/m/s之间,见表5。即使在酸性ph条件下,如ph介于1.5-5.0之间(cb6301、cb6312和cb6803),酶也是高度稳定的。a8、cb6301、cb6312、cb6803和bce等酶类对草酸盐的亲和性比以前发现/报道的要强得多。与km为8.4mm的yvrk酶相比,这些酶的km值为0.08-0.5mm。事实上,当使用不溶性草酸盐监测草酸盐降解时,与yvrk酶相比,cb6301和bce在降解可溶性草酸盐和不溶性草酸盐方面更有效,参见图22-24。这些酶对草酸盐具有如此高的亲和性,使得它们在与钙的竞争中胜出,因此可以降解整个草酸盐,而不仅是可溶性部分。这些体外结果在比格犬研究中得到证实,其中使用相同数量的草酸盐降解单元评估a8、cb6301、bce和yvrk。结果表明,a8和cb6301酶能够分别使尿液中的草酸盐含量降低60%和40%,参见图18-21。bce使尿液中草酸盐含量减少了24%,yvrk酶未显示尿液中草酸盐含量显著减少(图18-21)。单质子化的草酸盐(pka=3.81和pka=1.25)与活性位点内的未质子化的谷氨酸结合。与被破坏的活性位点(例如被破坏的六聚体的活性位点)中的同等残基相比,未被破坏的活性位点中非质子化的谷氨酸更能保持不被质子化。因此,当ph值从6大致降到3时,与未质子化的草酸盐相比,单质子化草酸盐所占比例将被最大化。因此,这将增加草酸盐与未被破坏的活性位点的结合,从而导致较低的km和较高的催化效率,参见图15。谷氨酸也需要保持非被质子化,因此将pka改为较低的值,并且由于发生在疏水性环境(例如未被破坏的活性位点)中,因此,将保持残基非质子化,从而增强结合。由于yvrk酶的结构在ph低于3.5时不稳定,因此,必须在ph4.0时确定km,其中可得到较少的单质子化草酸盐,从而进一步得出km值为8.4mm。然而,cb6301、a8/a0、bce等酶可以得到在更酸性条件(ph3.0以下)下测定的km值。在这些更酸性的ph条件下,可得到较大比例的单质子化草酸盐,从而进一步得到小于1mm的km值。此外,这些酸稳定酶还在活性位点周围提供稳定的结构,使得谷氨酸在更酸性条件下保持非质子化状态。稳定性:大多数检测的酶是稳定的,并且在超过60℃的温度下显示oxdc活性,参见图1。这个属性对于预测稳定性非常有帮助。因此,本发明包括这些高催化效率、ph和热稳定的草酸降解酶。因此,所述的高度催化的酶具有可在蛋白酶、酸和温度表现出高度稳定性的结构。例如,口服给药时,这种稳定的分布降低了丧失活性的风险。这种稳定且具有高催化效率的酶不需要稳定的剂型也可在人的胃中等恶劣的环境下保持高活性。在本发明的另一个实施例中,使用含有葡萄糖、果糖、海藻糖、葡萄糖或乳糖等糖类的简单制剂来配制酶。然后,可使用通常情况下已知的方法(包括喷雾或冷冻干燥方法)来干燥酶。cb6301、cb6803和cb6312均具有少量的草酸氧化酶活性,而该活性可产生对这些特定酶有害的自由基。这些自由基的产生导致了作为时间函数的活性丧失。我们发现,如果将位置340上的异亮氨酸残基(图10中以粗体突出显示)突变为谷氨酸,则该自由基的形成不会导致草酸盐降解活性的丧失。另外,我们发现将邻苯二胺、对苯二酚和抗坏血酸等维生素引入酶溶液中可使酶保持更长时间的活性。酶修饰1.)酸性条件下的ph活性分布:为了设计具有酸性活性分布的酶,在六聚体界面中的离子氨基酸可以用极性或疏水残基取代和/或可以截断酶以去除在n末端的10-30个第一氨基酸。此外,三聚体界面将被设计为具有大约10-14(d/e)和8-11(r/k)个氨基酸,具有3+/-的变异性。根据晶体结构,这些离子氨基酸将被定位和设计成彼此相互作用以及与形成氢键的极性氨基酸相互作用。这将使天冬氨酸和谷氨酸不易受酸性条件的影响。实施例包括修饰以涵盖该标准的酶。2.)持续的ph活性作为时间的函数:cb6301、cb6312和cb6803的重要结构特征为氨基酸340具有疏水性。由于自由基的形成,从而出现作为时间的函数丧失活性的酶。如果氨基酸340突变为谷氨酸,则该酶作为时间的函数保持充分的活性;因此,该酶是稳定的,不易受到自由基的抑制。因此,这个残基会突变成谷氨酸以保持持续的活性。因此,实施例涉及cb6301、cb6312和cb63803,其中残基340被谷氨酸取代。3.)广泛的ph活性分布:为了设计具有酸性活性特征的酶,六聚体界面中的离子氨基酸可以由约4-5(d/e)和4-5(r/k)个氨基酸+/-2个氨基酸组成。根据晶体结构,这些离子氨基酸将被定位和设计成彼此相互作用以及与形成氢键的极性氨基酸相互作用。这将使天冬氨酸和谷氨酸不易受酸性条件的影响。根据某些实施例,设计酶以在六聚体界面处具有所述的氨基酸。此外,三聚体界面将被设计为具有大约16个(d/e)和7个(r/k)氨基酸(+/-5个氨基酸)。同样,根据晶体结构,这些离子氨基酸将被定位和设计成彼此相互作用以及与形成氢键的极性氨基酸相互作用。这将使天冬氨酸和谷氨酸不易受酸性条件的影响。某些实施方案涉及经修饰以在三聚体界面处包含所述氨基酸残基含量的酶。4.)低km/高催化效率:为了获得具有低km/高催化效率的酶,将采用与上面第3点中所述相同的策略(“广泛的ph活性分布”)。重组表达:本文所述的酶可使用具有与seqidno:s1-47、多种表达系统和宿主细胞的序列至少85%、至少90%、至少95%,至少97%或至少99%序列一致性的任何序列重组表达,其中许多是市售的并且是本领域技术人员公知的,或者可以是自定义配制的。可以改变原始序列以提高表达,如密码子优化,或者包括方便下游工序的序列,如包含分泌物序列。此外,本领域技术人员可以设想基因序列的变更。宿主菌株将用合适的载体转化,其中编码将对用于酶的基因表达的启动子进行编码。所表达的基因序列还可以包含对下游有用的序列进行编码,例如亲和纯化中使用的亲和标记物等。重组酶可以在众多蛋白质表达领域的技术人员熟知的宿主中表达,包括但不局限于:大肠杆菌、乳杆菌属、芽孢杆菌属、曲霉属等对于酶的重组生产,宿主应包含以含有酶或蛋白质或其功能片段的质粒、载体、噬菌粒或转录或表达组件形式存在的构建体。有多种构建体可供使用,包括以单个或多个复制维护的结构。用于重组表达的许多重组表达系统、组分和试剂均可在市场上购买,例如可购自invitrogen公司(美国加利福尼亚州carlsbad市);u.s.biological公司(美国马萨诸塞州swampscott市);bdbiosciencespharmingen公司(美国加利福尼亚州圣地亚哥市);novagen公司(美国威斯康星州麦迪逊市);stratagene公司(美国加利福尼亚州lajolla市);和deutschesammlungvonmikroorganismenandzellkulturen公司(dsmz)(德国braunschweigh市)。包括构成型和/或诱导型启动子在内的异源启动子可随意控制蛋白质的重组表达。t7或其他启动子均适合于宿主,并且被本领域技术人员所熟知。所述酶或蛋白质的重组核酸序列可以包括用于表达所述蛋白质以外目的的核酸,包括但不限于纯化目的、折叠目的等。这些示例包括:分泌物序列、信号序列、链接剂、表达控制元素、亲和标记物等。由这些核酸序列产生的氨基酸在蛋白质表达之后可以或不可以去除。以上提及的所有构建体可以用于表达将在本文所述的方法中使用的酶和蛋白质。如上所述,用选定的表达系统转化/转染宿主细胞。将使用本领域技术人员已知的方法培养细胞,包括摇瓶中的液体培养物、生物反应器和发酵罐以及平板中的固体培养物等。在使用本文所述的方法之前,蛋白质可以从天然或重组来源中纯化。纯化可以包括通过声波降解法、法式滤压壶、玻璃珠或其他物理溶解的方式或化学细胞裂解的方式从宿主细胞中提取,并通过沉淀、离心或色谱步骤或本领域技术人员已知的其它手段进行分离。视情况,可以采用浓缩步骤,例如通过透析、渗滤、切向流过滤(tff)、层析聚焦色谱分析法和/或与缓冲液更换相关的步骤。固定化:具有热稳定性的oxdc酶,具有广泛的ph活性分布,km小于1mm,并且在广泛的ph范围内保持稳定,是理想的固定化候选者。因此,a8酶是理想的候选者,因为其具有大约77摄氏度的热溶解温度,在ph2.0-6.0的条件下具有活性并且在ph2.0-11.0条件下保持稳定。固定化可实现:(1)具有高活性的高酶负荷;(2)控制反应的扩大;(3)易回收和再利用;(4)不含生物催化剂的产品;(5)连续操作(或者在流失和补充的基础上进行的批量操作)和工序自动化是可能的;和(6)可将酶作用物的抑制减到最小。除此之外,只要固定化的设计得当,其还可防止自溶作用或有机溶剂引起的变性,并且能够带来热稳定性、操作和存储稳定性。固定化可以证明在经济可行性方面至关重要。允许可连续重复利用的增强稳定性可实现高单位生产率,从而影响与生物催化剂相关的生产成本。由于反应器对清洁的需求不高,因此,提升的热稳定性,在允许上述常规反应器操作的情况下,从而可使微生物生长的风险降低,并且降低了对卫生条件的要求。食品草酸盐降解:为了评估来自杨树菇(a0)的oxdc酶降解人类食物中的草酸盐的效力,根据包装上的说明,将几种常规西方膳食(预制“精益美食”膳食)在微波炉中煮熟、同质化并在a0酶的草酸盐降解活性筛选中用作基质。表3列出了最终反应混合物中评估的膳食和近似的钙浓度。进行这些实验以证明口服使用oxdc酶的有效性,以从正在人体胃内消化的饮食中去除草酸盐。如图4所示,来自a0的oxdc可以在酸性ph下比在碱性ph下降解更多的草酸盐,并且在具有更低的钙的含量膳食中降解。在具有极低钙水平(<1mmca2+)的膳食中,大约90%的草酸盐在60分钟内从ph2降至5。在低钙水平(<3mmca2+)的膳食中,在ph2至4之间的60分钟内,大于70%的草酸盐被降解。在含有中等水平的钙(3-5mmca2+)的膳食中,a0oxdc酶在ph2至3的条件下于60分钟内可以降解总草酸盐的60-80%,并且在ph4下可以降解50%。在高钙食物(>5mmca2+)中,在ph2和3下,酶在60分钟内降解总草酸盐的40-60%。降解百分比的减少可归因于草酸盐在中等至高钙含量膳食中降低的溶解度。不同于yvrk(km=8.4mm),a0对草酸盐(km=0.08mm)具有高亲和性,从而使得a0在降解人胃内低草酸盐含量方面更具能力。为了使oxdc酶有效地降解人胃内的草酸盐,所述酶需要配合所进食的人胃(ph1.0-4.5)和小于1.0mmkm的ph分布。因此,cb6301、cb6312和cb6803是理想的候选者以及口服降低草酸盐的a0/a8和bce酶。众所周知,草酸盐会导致人体健康出现问题,例如,酸化食物、使膳食钙不可用、引起化学灼伤、牙齿损伤、导致尿路结石和肾结石。因此,提供草酸盐含量低或无草酸盐的食物是有益的,因为这样可以让易于产生草酸盐相关状况和症状的人们避免食用草酸盐。这将导致个人增强对食品和饮料的健康价值观。在食品加工业中,酶在许多不同的生产阶段被广泛使用;因此,将oxdc酶包括在内是可行的。事实上,为了证明oxdc酶在降解单个食品中草酸盐的有效性,对几种食品进行了评估。这些食物为即饮茶、啤酒和果汁。然而,可以设想在众多食品类型的食物加工中使用oxdc酶,例如:罐头食品(蔬菜、水果和汤)、巧克力、面粉、香料加工。在这些饮料中添加cb6301oxdc酶致使可将大部分饮料中的草酸盐完全去除。草酸盐还原的范围介于75-100%之间。进行这些实验来证明在食品加工中使用oxdc酶的有用性。此外,显示上述从膳食内容物中去除草酸盐的结果证明,酶不仅在饮料制造中有效,而且在更复杂的食品制造工艺和基质中,例如罐头食品、汤类、面粉、巧克力、香料加工等也很有效。如示例9和图10-11所示,没有测试完全抑制酶活性的分子。针对抑制oxdc活性的潜在性选择这些分子。这表明,oxdc酶可用于一系列广泛的食物中,并有效去除草酸盐。配方:由于掺入了ph活性化合物,因此,本发明所述的新配方相对于周围的ph值产生直接围绕酶且发生改变的微环境ph值。这种改变使得微环境的ph值不同于次最佳环境,并且相对于各自的酶是最佳的。因此,微环境下的ph值落于相应酶的最佳ph值范围内。例如,在ph值约为1.5-4.5条件下,具有高活性的游离酸稳定酶在ph6(如果有的话)时将具有低活性。然而,通过在酶周围创造ph约为1.5-4.5微环境,即使周转的ph为6,仍可保持高活性。因此,使配制的酶在更宽范围的不同ph值下更具活性,受到ph活性分布的限制更少,并且对周围ph值更不敏感。可以通过形成酶催化反应产物来测量和监测配制的酶在次最佳ph下保持的高活性。所配制酶的有效ph活性分布在本文中定义为根据本发明配制的酶相对于最佳ph条件维持≥20%活性的环境(周围)ph的范围。本发明人惊奇地发现,本发明所述的剂型在周围ph条件下保持示例酶、芽孢杆菌草酸脱羧酶(oxdc)的活性,而在该ph条件下,未配制的示例酶在ph7.0附近及以上从未观察到活性。作为本发明具体应用的一个示例,本发明描述了yvrk、bce或a8的配方;然而,这些示例不应该限制本发明的范围。本领域技术人员明确了本发明可以应用于任何酶,其实际应用于代表未配制酶的次最佳ph值的作用位点,其相对于各自未配制酶的最适ph值更具酸性或碱性。根据某些特定实施例,提供了不同于周围环境ph值的微环境ph值。在一个实施例中,与周围的ph值相比,该ph值降低了。对其微环境具有酸化作用并且不降低酶活性的任何化合物均可用于此目的。此外,根据本发明,应该认识到,在使用具有这种效果的化合物的条件下,通过从较低的周围ph值升高ph来调节微环境ph值,将在比周围ph值更高的ph值条件下保持酶活性。为了进一步描述本发明,将使用中性或碱性的周围环境的示例,并且使用酸性的微环境ph值。可以通过许多手段(包括但不局限于:添加、生成、降解、反应和/或作为杂质)将在制剂中表现出酸化作用的酸性物质引入到制剂中。因此,可以将酸性物质以单独化合物的形式添加到制剂中。酸性物质也可以是作为制剂一部分的任何化合物的化学反应或降解的结果。此外,酸性物质可以看作是用于配制作为制剂一部分的单独化合物的方法的结果,从而,被当成原始材料的杂质。在最终制剂中导致酸化作用的所有情况均被认为是本发明的一部分。所得到的降解产物或转化或反应产物可以具有单体或聚合物的结构,该结构具有对所配制酶的周围环境进行酸化的共同特征。将所述制剂的酸性物质在微环境中释放、包含、浓缩、研制、生成、溶解和/或悬浮,并由此产生局部ph条件,在该条件下,当制剂放置在可获得酶作用物的次最佳ph值的环境时,其有益于所述酶的活性。所述制剂化合物的酸化作用可能是瞬间的,或者随着时间的推移而发展。例如,如果所述酸化化合物是来自制剂原料的杂质,则在配制时酸化作用可能是瞬间的;然而,如果酸化作用是由于降解产物引起的,则该作用可能随着时间的推移而发展。时间的长短取决于诸多因素,包括但不局限于原材料的类型、环境和制剂添加剂,并且时间跨度可能介于几周到几个月或几年之后的瞬间酸化与显著酸化之间。本领域技术人员熟知酸化化合物及其作用,但是本文在未限制本发明范围的情况下给出这些化合物的示例。对微环境具有酸化作用的酸化化合物包括但不限于:有机酸、无机酸、酸性侧链和酸性官能团。可以在制剂中使用的小有机酸的示例包括但不局限于:l-酒石酸、柠檬酸、富马酸、甲苯磺酸、马来酸、己二酸、dl-苹果酸、琥珀酸、l-天冬氨酸和谷氨酸。酸性侧链和官能团的示例包括但不限于:羧基、酚基、铵离子等等。有许多类型的聚合物,它们可生成酸性降解产物。这样的聚合物和降解产物可以收录在酶制剂的实施例中以调节微环境的ph值。这些聚合物对于本领域技术人员来说是公知的,并且本发明在不限制本发明范围的情况下提供示例。生成酸性降解产物的聚合物的示例包括但不限于:聚(羟基乙酸)(pga)、聚(右旋乳酸)(pla)、聚(左旋乳酸)、聚(肌乳酸)、聚(乳酸-共-羟基乙)(plga)、聚(原酸酯)、聚己酸内酯等聚脂类和聚酐类。另一个示例是聚(乙烯磺酸)、聚(丙烯酸)和聚(富马酸丙二醇酯)。已经开发了几种不同类型的聚(原酸酯)。每种设计都有其内在的区别并且具有特定的性质,例如,形成合适的烷二醇和γ-丁内酯的i型聚(原酸酯)。内酯容易水解形成γ-羟基丁酸。所述酸影响微环境的ph值并加速聚合物的进一步降解。可生物降解的聚合物聚酐类通过其酸酐链的水解而降解。聚酐类的示例,包括但不局限于那些由己二酸、富马酸、庚二酸、辛二酸、壬二酸、十二烷二酸、十二烷二甲酸、间苯二甲酸、对苯二甲酸、对-羧基苯氧基乙酸、5-(对-羧基苯氧基)戊酸、8-(对-羧基苯氧基)辛酸,辛二酸、蓖麻油酸马来酸、蓖麻油酸琥珀酸盐、12-羟基硬脂酸琥珀酸盐、辛酸、月桂酸、肉豆蔻酸、硬脂酸、油酸、脂肪酸酯化的蓖麻油酸和/或甲基丙烯酸化癸二酸等组成的聚酐。所述聚合物类和/或聚(乙烯乙二醇)或酰亚胺的诸多共聚物也可用于本发明中。在很多情况下,共聚物能够提供有利于微环境形成的特性。以下段落进一步说明了这些特征。所指的共聚物由乳酸和羟基乙酸制成。两个主要系列是(i)la/ga和(dl)la/ga的系列。如下面进一步的说明,组合物可能是不同的。可以通过选择聚合物、选择嵌段共聚物或共聚物、选择单体和单体类相互之间的比例、单体亲水性和疏水性、单体分子量,聚合物端基、单体类的比例以及某些情况下聚合物的结晶速率来调整聚合物的性质和降解速率(brunner,mader,和gopferich,1999)、(s.li,1999)、(gopferich和tessmar,2002)。因此,可以从相同的分子结构单元或单体获得大量不同的特征,并且本发明的范围不应限于任何特定的组合或不同单体的比例。此外,微环境ph值的改变也可以通过上述聚合物中的杂质来实现。这些杂质可以是上述聚合物的降解产物,或者源于所述聚合物的生产。杂质的特性取决于原始材料及其制造或制备方法,但是举例来说,这些杂质可以包括但不局限于:乳酸、葡(萄)糖酸、乳酰乳酸以及乳酸的低聚物等酸性低聚物。除了一种或多种酶、一种或多种聚合物材料和一种或多种酸化化合物之外,所述颗粒还可以包含一种或多种添加剂,例如,用于酶的缓冲剂、增溶剂、稳定剂、防腐剂、维生素或辅因子或一种或多种药学上可接受的赋形剂,例如,填充剂、填充剂、稀释剂、载体等。添加剂可以是保护酶免受高温、脱水和贮积的任何分子,例如糖类、氨基酸、表面活性剂、盐等。添加剂也可以是通过影响聚合物的降解速率以及由此产生酸性环境的速率而对酸化产生间接影响的任何分子。例如,水合速度率与外部水交换的速率对某些聚合物的降解速率均产生影响;因此,掺入水合添加剂可以随时间的推移而改变降解速率并由此改变酸性环境。聚合物降解和随后的微环境ph值的变化也受初始微环境ph值的影响,因为在酸性ph条件下自催化断链加速(witschi和doelker,1998);因此,可以通过掺入富马酸和琥珀酸等游离有机酸来调节降解速率。例如,可通过考虑它们的溶解度来调节这些酸的保有率。这些能够加速降解过程的添加剂被称为降解促进剂,并且可以控制所述制剂的降解。另外,掺入聚合物中的酶本身也可以对聚合物的降解速率产生影响。这已经通过掺入2%牛血清白蛋白以及制剂组分加快的降解速率的结果得到证实。酸化化合物、聚合物和添加剂可以与酶一起包封,并且由聚合物网络包覆。该聚合物网络可以由降解为酸化化合物的相同聚合物制成,或者由单独的聚合物制成。此类聚合物包括但不限于人造或天然聚合物,包括但不限于:i)多聚糖:藻酸盐,包括藻酸、海藻酸钠、海藻酸钾、海藻酸铵、海藻酸钙、海藻酸丙烷-1,2-二醇酯等藻酸盐、阿拉伯胶、角叉菜胶、壳聚糖及其衍生物、硫酸软骨素、葡聚糖衍生物、肝素、透明质酸、果胶、菊粉、纤维素或纤维素衍生物,包括甲基纤维素、羧甲基纤维素、羧甲基纤维素钠、羟丙基纤维素、羟丙基甲基纤维素、乙基甲基纤维素等或其组合;ii)粘多糖类;iii)包括刺槐豆胶、瓜尔胶、黄蓍胶、琼脂、阿拉伯胶、黄原胶、刺梧桐胶、他拉胶、结冷胶等或其组合在内的胶;iv)胶凝剂或溶胀剂,包括水解胶体和水凝胶剂,如琼脂、角叉菜胶、明胶、聚乙烯吡咯烷酮等或其组合;v)其他如蛋白质和聚酰胺:胶原蛋白、白蛋白、鱼精蛋白、精胺和合成聚合物,包括:聚丙烯酸、多聚磷酸、三聚磷酸、聚左旋乳酸,聚肌乳酸,聚右旋乳酸、聚(羟基乙酸)、聚(乙烯醇)、聚(乳酸共羟基乙酸)、聚(原酸酯)、聚己酸内酯、富马酸丙二醇酯、聚酸酐等或其组合;以及丙烯酸树脂合物,包括但不局限于l-100、l-100-55、rs、rl或共聚物或混合物及上述的组合。可以添加到制剂中或用于封装配制的酶和伴随物的其它聚合物材料可以是生物聚合物或合成聚合物。生物聚合物的示例包括但不限于:蛋白质、多糖、粘多糖、肝素、硫酸肝素、类肝素衍生物、硫酸皮肤素、戊聚糖多硫酸脂、硫酸软骨素、纤维素、琼脂糖、几丁质、角叉菜胶、亚油酸和尿囊素、交联胶原蛋白、纤连蛋白、层粘连蛋白、弹性蛋白、交联弹性蛋白、胶原蛋白、明胶、透明质酸、海藻酸壳聚糖、葡聚糖、甲基纤维素、聚赖氨酸和天然橡胶。在本发明中形成聚合物基质的制剂中,设计这些基质使得小的水溶性分子可以进入和离开聚合物基质,这些分子包括但不限于草酸盐、草酸、甲酸盐,甲酸、二氧化碳、氧气和酶辅因子等。这些基质可以具有诸多形状,包括但不限于颗粒状、片状、块状或薄膜状。此外,本发明的聚合物基质基本上不会将酶释放到环境中。换句话说,酶在最佳的微环境中保持一段时间则可降解环境中足够量的酶作用物,并且上述酶作用物的水平也相应下降。在聚合物基质内,聚合物材料既可以作为酸化物质的发生剂,也可以作为酶的保护和保持载体,同时可以使基质扩散或以其他方式被运送到组合物中,从而在原位降解。所有功能不必归于上述聚合物,而可以是含有不同聚合物颗粒的共同特征。在一个实施例中,本发明使用可生物降解的组分,其产生的降解产物不会造成对生物组织或流体的刺激或损伤;从而,确保了在人或动物等生物体系中的安全应用。此外,本发明考虑了一个确保与目标应用或传输位点高相容性制剂的设计,以此加强所配制的ph不敏感性酶的有益效果。例如,预定用于在胃肠道中传输的颗粒也可以具有粘膜粘附特性。优选地,它们具有粘膜粘附特性但不被吸收。这类最终颗粒将是微米级的,因此不太可能被吸收。粘膜粘附特性将通过涂覆带有阳离子电荷的聚合物或带有附加氨基的共聚物获得(bivas-benita,romeijn,junginger,和borchard,2004),后者也表现出异常短的降解时间,再一次表明通过创造性的聚合物合成改性降解特性,从而降低微环境的酸化率的机会。可以以相同的方式设计用于静脉注射传输的微米颗粒或纳米颗粒以减少任何免疫应答。这样的设计对于本领域技术人员来说是公知的,并且可能涉及颗粒的聚乙二醇化。颗粒形成:本发明的其他方法涉及通过产生微米颗粒或纳米颗粒来配制各自酶的方法。针对所配制酶的持续且对ph不敏感的活性,考虑颗粒形成(结合制备颗粒和所用特定聚合物或共聚物的特定方法的使用)来保护酶以及产生适合ph的局部微环境。本发明考虑了上述酶(一种或多种)、聚合物材料、酸化物质和其它添加剂的颗粒形成。如本文所用,颗粒形成是指酶与聚合物或共聚物溶液以及其他物质的结合以确保局部合适的ph并且根据需要稳定蛋白质以形成包含活性酶、聚合物或共聚物、酸化剂、稳定剂、维生素以及其它上述添加剂的小颗粒。这种形成活性酶颗粒的方法增加了颗粒中活性酶的量,并且当用于疾病治疗或预防方案时能够提高含有所述颗粒剂型的功效。颗粒形成还可以帮助保护酶免受蛋白酶的消化。颗粒形成有很多方法,例如凝聚、相位分离、聚合、喷雾干燥、静电方法以及空气悬浮方法等。喷雾干燥是在20世纪30年代开发的机械微胶囊化方法,并且是制备本发明实施例中活性酶颗粒的其中一个适宜方法。在这种方法中,将酶、聚合物、酸化物质和添加剂分散或溶解在水性介质、溶剂介质或乳液中,并通过装在合适喷雾干燥装置中的喷嘴进行分散或溶解。也可能与其他方法有关系,但前提是酶的活性未被严重降低(相对于最大活性保持至少20%的活性)。根据某些实施例,制备包含将酶、酸化化合物和添加剂结合在聚合物材料中的组合物。本领域技术人员可以找到适于配制和用于制备本发明组合物的其它方法。通过将酶掺入聚合物材料中,从而使酶获得一定的保护,并与主要受上述酸化化合物影响的局部ph环境隔离。生成的所配制酶的组合物以微米或纳米尺寸的离散单元出现。在不限制本发明的范围的情况下,微米或纳米尺寸的离散单元将被简单地称为“颗粒”。然而,许多不同的形状、形式、设计和结构对为ph敏感性酶提供合适的微环境可能是显而易见的,因此在本文中予以考虑。颗粒可以通过已知的方法形成,优选方法为通过喷雾干燥形成。在形成包含一种或多种酶、一种或多种聚合物材料和一种或多种酸化剂或酸化聚合物以及一种或多种添加剂的颗粒之后,可以进一步处理所述颗粒,例如通过干燥、冷冻干燥或冻干法。虽然冷冻干燥不会形成颗粒,但是,它可以干燥已经形成的包含酶和聚合物材料的颗粒。这类颗粒可以处于悬浮、分散或乳化状态,随即处于冷冻干燥的条件下。冷冻干燥避免加热酶并使干燥过程适用于热敏感蛋白质。可以省去冷冻干燥或其他方法(例如涂布),并且只可以使用喷雾干燥来形成所述的颗粒。然后,可以将这类颗粒以下述方法配制成口服药物或食品制剂,例如通过与填充剂混合和将颗粒填入小袋、加入胶囊中、压成片剂、加入咀嚼片中、加入快速溶解或口服溶解片剂中,或加入液体、糖浆剂,酏剂或食品中。颗粒的形态和大小将对水合作用、酸的保留、酶作用物移入颗粒以及粘膜粘附特性有很大的影响;因此,由喷雾气流、进料速率、溶剂和浓度等喷雾干燥参数产生的形态将对所配制酶的最终ph活性分布具有很大的影响。众所周知,诸如喷雾干燥进料粘度、密度、表面张力和雾化条件的其他参数均可以影响液滴粒度并因此影响最终粒度。因此,喷雾干燥过程参数以及进料特性的复杂组合将对所配制酶的最终ph活性分布产生影响,并且应该认为对改变制造工艺以改变所配制酶的ph活性分布是显而易见的。由于暴露于有害试剂、溶剂,温度,设备等,上文所述的一些方法可能会造成酶活性丧失的风险。可通过引入本领域技术人员公知的蛋白质稳定化合物来降低有害条件的影响。在一些情况下,可将聚合物材料施加到颗粒上(例如作为包衣)以增加颗粒的储存稳定性或抑制酶的降解。合适的包衣材料是允许含有酶作用物和/或反应产物的含水组合物扩散进入本发明的颗粒或以其他方式进入和流出本发明颗粒的材料。如上所述,所述酶作用物进入本发明的颗粒组合物中,从而发生酶降解。因此,可以应用导致扩散涂层或其它可渗透涂层(例如含有基本上为水溶性的成孔物质的涂层)的包衣材料。合适的包衣材料的示例包括但不限于考虑作为聚合物材料的材料。可以选择不同于用作聚合物材料的包衣材料,但是所述聚合物材料和包衣材料也可以是相同的。涂料的具体示例是成膜剂,例如,聚乙烯吡咯烷酮、羟丙基甲基纤维素(hpmc)、羟乙基纤维素、羟丙基纤维素、聚葡萄糖、麦芽糖糊精或包括壳聚糖、藻酸盐和透明质酸在内的其他多糖。上述颗粒除含有草酸盐还原酶、聚合物、酸化化合物和添加剂外,还可含有其它颗粒。这些内在化颗粒可以含有其他酶、聚合物、酸化物质和/或添加剂。因此,本发明考虑了本文所述内容的几层实体。实施例可涉及使用将酶以活性形式传输至特定环境的药物或其他组合物中的最终未包衣或包衣颗粒。这些环境可以是生物、环境、工业的和/或化学环境。特别地,作为示例,该方法可用于喷雾干燥或以其他方式制备来自枯草芽孢杆菌、蜡样芽孢杆菌或茶树茹的oxdc颗粒,并且这些颗粒可以用于降解人类或动物的胃、肠或血管系统中的草酸盐。因此,本发明还提供了通过施用配制的蛋白质或包含它们的药物组合物来治疗和预防草酸盐相关疾病的方法。组合物:根据某些实施例,公开了包含如上所述颗粒的组合物。这些颗粒包含一种或多种高催化效率的草酸盐还原酶、一种或多种聚合物材料、酸化物质和/或添加剂。该组合物还可以含有包括其它酶、聚合物、酸化物质和/或添加剂在内的其他颗粒。本发明的组合物还可以包含一种或多种可以改善酶活性的附加因子。这些附加因子可以是草酰coa、mgcl2,和/或二磷酸硫胺(维生素b1的活化形式)、其他维生素或ph缓冲化合物。合成物实施例可以包含如上所述的一种类型的颗粒或不同类型和含量的颗粒。合成物的颗粒可以单独或一起以口服或静脉注射的剂型提供。根据特定的实施例,在合成物中提供配制的高催化效率的ph不敏感活性酶,并按照有效剂量给药。有效剂量即为显著降低草酸盐含量以呈现有益临床结果的量。与施用所述合成物前的当前草酸盐的量相比,有效剂量包括降低一部分当前草酸盐的草酸盐还原酶活性的酶活力单位的量或开始降低草酸盐的量或保持个体中草酸盐的下降量的草酸盐还原酶活性的酶活力单位的水平。可用于单一剂量合成物中的草酸盐还原酶活性的活性单位的数量通常介于约0.001单位至约20,000单位的范围内,并且所有范围均包含在其中。酶的单位定义为37℃下每分钟将降解1微摩尔草酸盐的酶的量。为了将如上所述的颗粒传输至人或动物,可将所述颗粒配制成用于给药的合适剂型。剂型取决于给药途径。对于oxdc酶,合适的给药途径是口服或静脉注射给药,这取决于靶向的疾病状况,两种类型的合成物将在本文中说明。合成物作为口服药物、营养食品、特殊膳食用食品或医药食品制剂提供,其可以被输送到口腔、嘴、口腔贴片、胃或以小袋、胶囊、片剂、咀嚼片、速溶片剂、口服溶解片剂、粉末剂、颗粒剂、丸剂、液体、糖浆、酏剂、缓释液、速释片剂或药物和食品领域技术人员已知的其它口服剂型附着到胃粘膜。在摄取食物之前或摄入食物之后,伴随食物传输所述合成物。口服制剂视情况可以包含缓冲能力。例如,合成物可以包含缓冲化合物,该化合物一旦摄取合成物就调节合成物的ph值,并由此调节胃等周围环境。此类缓冲化合物可以是乙酸盐、柠檬酸盐、磷酸盐或其他缓冲化合物。施用的合成物通常为粉剂等固体形式或小袋、胶囊或片剂等固体剂型(例如通过本领域技术人员熟知的方法将颗粒进一步加工成合适的剂型)。为此,可以加入合适的药学上可接受的赋形剂,例如填充剂、粘合剂、崩解剂、着色剂、调味剂、ph调节剂、稳定剂等。此外,还可以加入一种或多种的治疗和/或预防物质,和/或其他酶、辅因子、维生素、酶作用物、辅酶类、矿物质以及其他有助于还原草酸盐的试剂。合适的药学上可接受的赋形剂的示例包括:糊精、麦芽糖糊精、右旋糖、果糖、葡萄糖、乳糖、包括羧甲基纤维素钙、羧甲基纤维素钠、羟丙基纤维素、羟丙基甲基纤维素(hpmc)、微晶纤维素(例如各种等级的)在内的纤维素衍生物、淀粉或改性淀粉(例如马铃薯淀粉、玉米淀粉、米淀粉、预糊化淀粉)、聚醋酸乙烯酯、聚乙烯吡咯烷酮、琼脂、海藻酸钠、交联羧甲基纤维素钠、磷酸氢钙、磷酸钙(例如碱式磷酸钙、磷酸氢钙)、硫酸钙、羧烷基纤维素、葡萄糖结合剂、磷酸氢钙、明胶、阿拉伯树胶、羟丙基纤维素、羟丙基甲基纤维素、甲基纤维素、聚乙二醇、聚环氧乙烷以及滑石粉、硬脂酸镁、硬脂酸钙、硬脂酸、氢化植物油等润滑剂。包含有其他酶、聚合物、辅因子、维生素、辅酶、酸化物质或添加剂的颗粒的合成物可以与包含草酸盐还原酶的颗粒合成物同时施用、相继施用,之前或之后施用。包含含有其它酶、辅因子、辅酶、酸化物质或添加剂的颗粒的组合物可以与包含含草酸盐还原酶的颗粒的合成物组合以形成单一给药剂量以此在作用位点提供有效量的草酸盐。如上所述的口服合成物,在消耗食物后发现的条件下,或在蛋白酶存在的条件下,减少整个胃肠道的可溶性草酸盐的量。设计本发明的特定合成物以减少人和其他动物胃肠道中的草酸盐。合成物减少胃肠道中,特别是在肠道中的草酸盐,并且防止外源性草酸盐(例如来自食物)进入体循环,并且产生合适的跨上皮梯度以促进草酸盐从血液分泌到肠道中,从而减少胃肠道以及全身的草酸盐。根据特定的实施例,提供适合用于降低人或动物中草酸盐水平的合成物。它们还可以适用于治疗或预防与草酸盐相关的病症,包括但不限于高草酸尿症、吸收性高草酸尿症、肠源性高草酸过多症、原发性高草酸尿症、特发性草酸钙肾结石病(尿石症)、外阴痛,与终末期肾脏相关的草酸病疾病、心脏传导障碍、炎症性肠病、克罗恩氏病、溃疡性结肠炎,以及经历胃肠道手术和减肥手术(肥胖症手术)的患者,和/或已经接受抗生素治疗的患者。本发明的实施例涉及分别通过施用本文传授导的合成物的治疗有效量或预防有效量来治疗和预防人和动物中的草酸盐相关病症。治疗有效量是在诊断为草酸盐相关病症的受试者中减少草酸盐的量。预防有效量为提供给处于危险、具有初步症状,或先前患有草酸盐相关病症受试者的量。本发明的草酸盐降解颗粒或合成物的实施例可以以期望的量施用,例如足以将人体组织或流体中的草酸盐水平有效降低至已经显示具有有益临床效果的量。可以通过血液、血清、血浆或尿液或其他体液、组织和器官中发现的草酸盐水平的下降来表示草酸盐吸收的下降。颗粒与合成物的使用-治疗方法:根据进一步的实施例,公开了涉及向人或动物的肠道提供颗粒合成物的方法,例如,提供能够减少胃和肠道中的草酸盐从而减少从胃肠道吸收草酸盐的合成物,以及创建一个合适的有利于草酸从血液分泌到肠道的跨上皮梯度。颗粒制剂及合成物能够进一步保护草酸盐还原酶免受胃中对酶有损伤环境的影响。在其他实施例中,提供了涉及在食品加工过程中将一种或多种oxdc酶添加到食物和饮料中的方法,由此通过降低或去除食物衍生的草酸盐减少尿液中的草酸盐。因此,在一个具体的实施例中,涉及一种在足以减少食物或饮料中存在的草酸盐的条件和用量下,使食物或饮料与本文传授的草酸盐还原酶接触的方法。本发明的颗粒与合成物适用于减少体内草酸盐的吸收以及减少体内内生草酸盐水平的方法,并用于治疗或预防草酸盐相关病症,包括但不限于高草酸尿症、吸收性高草酸尿症、肠源性高草酸过多症、原发性高草酸尿症、特发性草酸钙肾结石病(尿石症)、外阴痛,与终末期肾脏相关的草酸病疾病、心脏传导障碍、炎症性肠病、克罗恩氏病、溃疡性结肠炎,以及经历胃肠道手术和减肥手术(肥胖症手术)的患者,和/或已经接受抗生素治疗的患者。根据某些实施例,提供了涉及施用能够减少食物、胃和/或肠道中草酸盐的合成物的方法,以通过减少食物源中的草酸盐来避免人或动物身体吸收草酸盐。向肠道提供活性草酸盐还原酶的方法是在聚合物材料中以口服药物的剂型提供草酸盐还原酶,所述聚合物材料能够保持所述酶具有合适的微环境ph值。本发明的某些方法包括施用一种实施例的合成物,该合成物能够在生物组织、器官和流体中常见的ph下,通过一种或多种草酸盐降解酶来降解草酸盐。某些方法实施例涉及施用一种能够还原血液中的草酸盐以降低该流体中的草酸盐水平以及源自该流体的血浆、血清和尿液中草酸盐水平的合成物。草酸盐吸收的下降可以通过向胃肠道或血流提供草酸盐降解酶,从而降低吸收的饮食草酸盐以及内源性产生的草酸盐的浓度实现。除了吸收途径外,在人体胃肠道中已经确定了草酸盐分泌途径。合成物实施例还在降解自循环系统分泌到肠道中的草酸盐,从而实现个体中草酸盐负荷的总体降低方面有用。草酸盐吸收的下降可以通过在食物加工期间提供草酸盐降解酶并因此降低可用的膳食草酸盐的吸收浓度实现。在人或动物中降低草酸盐的方法可包括对受试者、人或动物施用有效量的组合物,从而降低存在局部或全身的草酸盐,而所述组合物包含一种或多种草酸盐还原酶或在本发明颗粒合成物中具有草酸盐还原活性的片段。可以在受试者的任何组织或体液环境中测定减少量。体液包括身体的分泌物,例如鼻子或胃分泌物、唾液、血液、血清、尿液、食糜或消化物质、组织液,以及由人或动物产生的其他流体或半固体材料。例如,可以将草酸盐还原酶颗粒合成物以口服形式给予人或动物,并且草酸盐还原酶的活性降低了存在于人或动物肠道中的草酸盐。当保持在本发明局部微环境ph值条件下时,本发明的颗粒合成物可以混合在液体、食物或其它膳食材料中,并提供给人或动物,使得颗粒的草酸盐还原酶活性在肠道环境中有效。本发明的颗粒合成物也可以与其中发现草酸盐的食品或其他材料混合,并且颗粒的草酸盐还原酶活性降低了存在食品或其它材料中的草酸盐。用于减少人或动物吸收草酸盐以及治疗和预防草酸盐相关病症的其他方法涉及给予包含含有有效量的活性草酸盐还原酶颗粒的合成物。与施用所述合成物前的当前草酸盐的量相比,有效剂量包括降低一部分当前草酸盐的草酸盐还原酶活性的酶活力单位的量或开始降低存在饮食或受试者组织或体液中草酸盐的量或保持受试者草酸盐的下降量的草酸盐还原酶活性的酶活力单位的水平。在治疗方法中,至少每日为受试者经口服或静脉注射施用有效量的本文所传授的颗粒组合物一次,如果必要的话,给药可以是一天或几天,或一周,或者一个月,或者几年或者一直持续患者一生。这种治疗可以继续保持受试者中所需的草酸盐水平。本发明包括的所有专利、专利申请和参考文献均通过全文引用明确地编入。当然,应当理解的是,前述内容仅涉及本发明的示例性实施例,并且在不脱离本发明公开内容所阐述的精神和范围的情况下,可以在其中进行许多修改或替换。尽管在此提供了本发明的示例性实施例,但是本发明不限于这些实施例。可向本领域技术人员提出许多修改或变更的建议。作为本发明优选应用的示例,本文描述了yvrk、bce、a8或cb6301的制剂;然而,这些示例不应该限制本发明的范围。通过本文包含的为便于理解而提供的示例进一步阐述本发明。示例性实施例不应被解释为对其范围施加限制。相反,应充分理解,在阅读了本文的说明后,建议本领域的技术人员在不脱离本发明的精神和/或所附权利要求范围的情况下对其他实施例、修改形式和等同形式进行变更。示例示例1:活性测试:监测酶作用物(草酸盐)的去除和产物(甲酸盐)的形成以确定酶的草酸盐降解活性。活性测试在ph值为3的50mm柠檬酸盐或磷酸盐缓冲溶液中或ph为4的含有10mm草酸根离子(c2o42-)的缓冲溶液中进行。为了确定酶的ph活性分布,使用柠檬酸盐和磷酸盐缓冲液(50mm)的组合确定ph自1.5至8.0时的酶活性。将测试样品加入到预热的反应缓冲液中,并在37℃下以每分钟1100转的振荡培养一段规定时间点(t)。反应在t±5秒以10%的酸与反应混合物的速率使用2.5nh2so4淬灭。过滤淬灭的反应混合物,并使用等度离子排斥hplc方法分析甲酸盐浓度。比活性定义为每分钟降解的μmol草酸盐和mg的蛋白质。hplc方法:将淬灭的反应混合物过滤,并在配备有购自phenomenex公司的rezextmroa-有机酸h+(8%),lc柱(300×7.8mm)的agilent1100系列hplc系统上进行分析。注射体积为40μl,流动相为5mmh2so4(等度),流速每分钟0.6ml,柱温40℃。在每批中分析草酸和甲酸的标准以起草标准曲线。每次注射之间的运行时间为20分钟,草酸和甲酸分别在8分钟和16分钟进行洗脱,在波长210nm处检测。示例2:oxdc酶的氨基酸序列序列id号:1草酸脱羧酶[蜡样芽胞杆菌,bce]mkkrtvneagrnvpqpirsdgagaidsgprnvmrdiqnpnmlvppitdaglvpnlkfsfsdtsmilkqggwsreitarelpvsttiagvnmsltaggvrelhwhkeaewaymllgraritavdqngrnfiadvgpgdlwyfppgiphsiqglehcefllvfddghfsdlstlaisdwfahtpkevlsanfgvpesvfrslpsdqvyiyqgevpgslesqevqspkgevpltfkhellkqkpvktpggsvrivdstnfpisktiaaalvevepggmrelhwhpnndewqyyltgearmtvflgngtartfdyragdvgyvpfatghyiqntgtetlwflemfrsnrfedvslnqwmaltpkeivesnihvgpqvmdslrkekwpvvkypgfsyspksde序列id号:2草酸脱羧酶[细长聚球藻,cb6301]全长天然序列12序列id号:3草酸脱羧酶[细长聚球藻,cb6301]-d29序列13mqtqtwrslsnvvwgkdlpafsypfsktplvdydggvtkqvgtynfpvskgmagvymtlkpgairelhwhanaaewayviegrtrvtltnpdgqvqiadvdqgglwyfprgwghsiegigpgtakfllvfndgtfsegatfsitdwlshtpiswvqqnfgwsqdeveklpkkqvyisrynpevkpldktqsrnpkvsrivlpythnllaekprtsqagntlklasakefpasfnmagallrlepgamrqlhwhpnadewqyvlngsmdlavfasegkasmsrlqkgdvgyvpkgyghalrnssdqpldvlivfndgdyqsidlndwimsnpntvlddvfqlspqlldklpkeseiliprs序列id号:4草酸脱羧酶[细长聚球藻,cb6301]-d10序列14mlgvitcfvligsfclpslaqtqtwrslsnvvwgkdlpafsypfsktplvdydggvtkqvgtynfpvskgmagvymtlkpgairelhwhanaaewayviegrtrvtltnpdgqvqiadvdqgglwyfprgwghsiegigpgtakfllvfndgtfsegatfsitdwlshtpiswvqqnfgwsqdeveklpkkqvyisrynpevkpldktqsrnpkvsrivlpythnllaekprtsqagntlklasakefpasfnmagallrlepgamrqlhwhpnadewqyvlngsmdlavfasegkasmsrlqkgdvgyvpkgyghalrnssdqpldvlivfndgdyqsidlndwimsnpntvlddvfqlspqlldklpkeseiliprs序列id号:5草酸脱羧酶[蜡样芽孢杆菌,bce][细长聚球藻,cb6301]-融合序列15序列id号:6草酸脱羧酶[细长聚球藻,cb6301]-d20序列16mgsfclpslaqtqtwrslsnvvwgkdlpafsypfsktplvdydggvtkqvgtynfpvskgmagvymtlkpgairelhwhanaaewayviegrtrvtltnpdgqvqiadvdqgglwyfprgwghsiegigpgtakfllvfndgtfsegatfsitdwlshtpiswvqqnfgwsqdeveklpkkqvyisrynpevkpldktqsrnpkvsrivlpythnllaekprtsqagntlklasakefpasfnmagallrlepgamrqlhwhpnadewqyvlngsmdlavfasegkasmsrlqkgdvgyvpkgyghalrnssdqpldvlivfndgdyqsidlndwimsnpntvlddvfqlspqlldklpkeseiliprs序列id号:7草酸脱羧酶[细长聚球藻,cb6301]序列id号:6c5n17序列id号:8草酸脱羧酶[细长聚球蓝细菌,cb6301]序列id号:6c5s17序列id号:9草酸脱羧酶[细长聚球藻,cb6301]序列id号:6c5a17序列id号:10草酸脱羧酶[细长聚球藻,cb6301]“环状突变”序列id号:2g167n,a168s,s171q,i172l17序列id号:11草酸脱羧酶[细长聚球藻,cb6301]序列id号:2i340e17序列id号:12草酸脱羧酶[细长聚球藻,cb6301]序列id号:2i340e,g167n,a168s,s171q,i172l17序列id号:13草酸脱羧酶[细长聚球藻,cb6301]序列id号:2i340a序列id号:14草酸脱羧酶[细长聚球藻,cb6301]序列id号:2i340c17序列id号:15草酸脱羧酶[细长聚球藻,cb6301]序列id号:2i340d17序列id号:16草酸脱羧酶[细长聚球藻,cb6301]序列id号:2i340e17序列id号:17草酸脱羧酶[细长聚球藻,cb6301]序列id号:2i340f17序列id号:18草酸脱羧酶[细长聚球藻,cb6301]序列id号:2i340g17序列id号:19草酸脱羧酶[细长聚球藻,cb6301]序列id号:2i340h17序列id号:20草酸脱羧酶[细长聚球藻,cb6301]序列id号:2i340k17序列id号:21草酸脱羧酶[细长聚球藻,cb6301]序列id号:2i340l17序列id号:22草酸脱羧酶[细长聚球藻cb6301]序列id号:2i340m17序列id号:23草酸脱羧酶[细长聚球藻,cb6301]序列id号:2i340n17序列id号:24草酸脱羧酶[细长聚球藻,cb6301]序列id号:2i340p17序列id号:25草酸脱羧酶[细长聚球藻,cb6301]序列id号:2i340q17序列id号:26草酸脱羧酶[细长聚球藻,cb6301]序列id号:2i340r17序列id号:27草酸脱羧酶[细长聚球藻,cb6301]序列id号:2i340s17序列id号:28草酸脱羧酶[细长聚球藻,cb6301]序列id号:2i340t17序列id号:29草酸脱羧酶[细长聚球藻,cb6301]序列id号:2i340v17序列id号:30草酸脱羧酶[细长聚球藻,cb6301]序列id号:2i340w17序列id号:31草酸脱羧酶[细长聚球藻,cb6301]序列id号:2i340y17序列id号:32草酸脱羧酶[细长聚球藻,cb6301]序列id号:2v291y17序列id号:33草酸脱羧酶[细长聚球藻,cb6301]序列id号:2l312y17序列id号:34草酸脱羧酶[细长聚球藻cb6301]序列id号:2v338p17序列id号:35草酸脱羧酶[细长聚球藻,cb6301]序列id号:2v291y,l312y17序列id号:36草酸脱羧酶[细长聚球藻,cb6301]序列id号:2v291y,v338f17序列id号:37草酸脱羧酶[细长聚球藻,cb6301]序列id号:2l312y,v338f17序列id号:38草酸脱羧酶[细长聚球藻,cb6301]序列id号:2v291y,l312y,v338f17序列id号:39草酸脱羧酶[细长聚球藻,cb6301]序列id号:2e194k,v291y,l312y,v338f17序列id号:40草酸脱羧酶[伸长聚球藻]“6803”mvnsvigwlrrrfllvglsvllitflgiftptiaqseqwrslsnvvwgkdlpaftyafsktplvlydggttkqvgtynfpvskgmagvymslepgairelhwhanaaewayvmegrtritltspegkveiadvdkgglwyfprgwghsiegigpdtakfllvfndgtfsegatfsvtdwlshtpiawveenlgwtaaqvaqlpkkqvyissygpasgplasatpqgqtakievphthnllgqqplvslggnelrlasakefpgsfnmtgalihlepgamrqlhwhpnadewqyvldgemdltvfasegkasvsrlqqgdvgyvpkgyghairnssqkpldivvvfndgdyqsidlstwlasnpssvlgntfqispeltkklpvqdtifslptqp序列id号:40草酸脱羧酶[伸长聚球藻]“6312”maslsrlfkpysqlfskfrlfliclvllligsscwllpalsqssqwhslsgvvwgkdlpafsypfhqtpltlydggttkqvgtynfpvskgmagvymtlepgairelhwhanaaewayvisgrtritltspdgnvqiadvdqgglwyfprgwghsieglgpgtakfilvfndgtfsegatfsitdwvshmpiswvqdalgltatqvqglpnkqvyisrrppapgplattqprnpniprlevthvhdiaaqpffavedqntillasnkefpasfnmaggiihlepgairqphwhpnadewqyildgemeltvfasegkasistlktgdvgyipkgyghalrnpshkpmdvllvfdageyesieltgwiasnpdsvvgntfqvpanllsrlprqkklfarpgk序列id号:41草酸盐脱羧酶[克劳氏芽胞杆菌]“bcl”mkrgdnvkplkgnpnipqpiradgaggvdrgprnlmrdlqnpnilvppetdrglipnlrfsfsdahmqlnhggwsreitqrdlpiattlagvnmsltpggvrelhwhkqaewsymllgharitavdqngrnfiadvgpgdlwyfppgiphsiqglddgcefllvfddgmfsdlstlslsdwmahtpkdvlsanfgvpesvfatipteqvyiyqdevpgplqsqqinspygavpqtfkhellkqpplvtpggsvrivdsrnfpvsktiaaalvevepgamremhwhpnndewqyyltgqarmtvftgngvartfdyragdvgyvpfatghyiqntgnesvwflemfksdrfedvslnqwlaltptelvqhnihvdskftnklrkekwpvvkypti序列id号:42草酸脱羧酶[杨树菇]“a0”/“a8”misvasctialllssvafaapapssaassivvsatssstvssapvsvssflpttsiaaatpssiavalsstatvpfidlnpngplwdpsvsgvpqaergslgatimgptdvdttkanpdllappttdhgsvdnakwafslshnrlqtggwareqnigampiatemasvnmrlepgairelhwhktaewayvlkgntqvtavdqngknfigtvgpgdlwyfppgiphslqatgddpegsefilvfdsgafsedstflltdwmshvpvevlaknfqtdisafaripaeelyifpaavppdsqqdptspegtvpnpftfalskvppmqlsggtakivdsttftvskaiaaaevtiepgairelhwhptqdewsffiegrarmtifaaqsnartfdyqagdigyvpatmghyvenignttvryleifntavfedislsnwlaltppelvkahlgfddatmahlakvkpivvgpa序列id号:43草酸脱羧酶[杨树菇]“a0”/“a8d-18”mapapssaassivvsatssstvssapvsvssflpttsiaaatpssiavalsstatvpfidlnpngplwdpsvsgvpqaergslgatimgptdvdttkanpdllappttdhgsvdnakwafslshnrlqtggwareqnigampiatemasvnmrlepgairelhwhktafwayvlkgntqvtavdqngknfigtvgpgdlwyfppgiphslqatgddpegsefilvfdsgafsedstflltdwmshvpvevlaknfqtdisafaripaeelyifpaavppdsqqdptspegtvpnpftfalskvppmqlsggtakivdsttftvskaiaaaevtiepgairelhwhptqdewsffiegrarmtifaaqsnartfdyqagdigyvpatmghyvenignttvryleifntavfedislsnwlaltppelvkahlgfddatmahlakvkpivvgpa序列id号:44草酸脱羧酶[解淀粉芽胞杆菌]“bam”mskenncnipqpirgdkgatvtiprnlerdrqnpdmltppetdhgtvdnmkfsfsdvhnrlekggyarevtvrelpisenlasvnmrlkpgairelhwhkeaewaymltgkarvtivdeqgrsfiddvkegdlwyfpsglphsiqalkegcefllvfddgsfsenstfqvtdwlahtpldviasnfgvsekdlaglpgkekyifeepvpgklkddivegpngevpypftyrlldegptaetdggkvyiadstnfkvsktiasalvvvepgamrelhwhpnthewqyyisgkgrmtvfasdghartfnyqagdvgyvpfamghyvenlgdeplvfleifkddhyadvslnqwlamlpekfvqqhldlgkdftdilskekhpvvkkkc序列id号:45草酸脱羧酶[短小芽胞杆菌]“bpu”msekqngvpqpirgekgatvkiprnlerdrqnpdmltppetdhgtvpnmkysfsdthnrlekggyarevtvrelpiskslasvnmrlkpgairelhwhkeaewaymiygearitsvdaegrnftedvtegdlwyfpsglphsiqalepgaefllvfddgsfsenstfqvtdwlahtpeevvlqnfgmtkeqfeklpekekyifqkgipgslecdkvktgqgevpnsfkyellkqepitssggqvwiadstnfkasktiasalvkvdpgairelhwhpntdewqyfisgkarmtvfasdghartfnyqagdvgyvpfamghyventgdeplyfleifksdhyadislnqwlavtpkqlildhldqgeeflklldtekhpviaapkked序列id号:46草酸脱羧酶[肉毒梭状芽胞杆菌]myiqnqyqnlcnllmsgcipqpirdgagatdigprdilrdlenpdmlvppstdtglipnlkfsfsdtnmtirpggwsreitvrelpiattmagvnmrltpggvrevhwhqqsewsymlkgsaritavddrgrnfiadigpgdlwffpplfphsiqgleegceflllfddgnfsdlrtfslseffahypkdvlaanfgvtkncfnclpegqvyiyqdtipgpleseaiespygtipqsykhsllaqkpmttpggsvriadtsnfpvakttaaalveikpggmreihwhpndefqyfltgqsrmtvfadtgasrtfdyragdvgyvptgyghyvqnignetvwfleafrsdrfksislsqmmaitpqqliasnlnvgpgflnalsrskfqcsvgpcfhqtecsd序列id号:47草酸脱羧酶[枯草芽孢杆菌,yvrk]mkkqndipqpirgdkgatvkiprnierdrqnpdmlvppetdhgtvsnmkfsfsdthnrlekggyarevtvrelpisenlasvnmrlkpgairelhwhkeaewaymiygsarvtivdekgrsfiddvgegdlwyfpsglphsiqaleegaefllvfddgsfsenstfqltdwlahtpkeviaanfgvtkeeisnlpgkekyifenqlpgslkddivegpngevpypftyrlleqepieseggkvyiadstnfkvsktiasalvtvepgamrelhwhpnthewqyyisgkarmtvfasdghartfnyqagdvgyvpfamghyvenigdeplvfleifkddhyadvslnqwlamlpetfvqahldlgkdftdvlskekhpvvkkkcskoxdc每个亚基具有两个活性位点,在cb6301的全长序列中,对活性至关重要的残基如下所示:97-hwhxxxxe-104h-143280-hwhxxxxe-287h-326为了保持变体的活性,以红色突出显示的残基应该是100%保存。只要修饰酶具有至少85%、90%、95%或99%的天然氨基酸序列,就可以修饰酶的其它区域,从而以相似类型的氨基酸取代氨基酸,或修饰如上所述能够影响酶性质的区域。示例3:表达、发酵和酶的提取:通过发酵杨树菇(“a0”)生成oxdc-a0,通过将ph值降低至3.0,并加入mncl2诱导oxdc-a0至最终浓度为5mm。大部分oxdc蛋白质存在于真菌细胞内,通过离心获得。颗粒在ph3条件下重新悬浮于50mm的磷酸盐缓冲液中并均质化,所得的混合物用于测试。通过发酵杨树菇(“a8”)生成oxdc-a8,通过将ph值降低至3.0,并加入mncl2诱导oxdc-a0至最终浓度为5mm。大部分oxdc蛋白质存在于培养上清液中,并通过离心从细胞中分离出来。通过硫酸铵沉淀和切向流过滤(tff)将上清液中的蛋白质纯化和浓缩。最终的蛋白质溶液在ph3下的50mm柠檬酸盐缓冲液中。在构建的大肠杆菌菌株中重组表达所有酶和变体(包括a8)。将全长基因插入到pcoldiv或potipr或pet载体的ndei和bamhi位点之间,并将经过序列验证的质粒转化到大肠杆菌origami或bw25113或bl21的感受态细胞中,以构建表达细胞系。在分批补料发酵中进行蛋白质表达,并根据表2中列出的诱导条件进行诱导。收集细胞,并通过均质化或超声处理裂解细胞。在ph5的50mm柠檬酸盐缓冲液中洗涤后,将蛋白质溶解在ph9.5的50mm精氨酸缓冲液中。表2:不同表达结构的诱导条件。所有的酶均以可溶形式表达。酶在该过程中没有结晶,对以下示例中酶的所有评估均来自可溶形式的酶。示例4:热稳定性:如示例3所述获得的、溶液中来自四种不同的源生物(a0、a8、bce和cb6301_d29)的oxdc酶在25-95℃的不同温度下孵育20分钟。在20分钟的孵育结束时,根据酶活性检测的描述,测试每种样品剩余的草酸盐降解活性。在25℃(环境温度)下孵育的样品的活性被认为是100%。如图1所示,从真菌a0和a8提取的oxdc酶被确定为比来自细菌源的酶bce和cb6301_d29更稳定。示例5:ph稳定性:如示例3所述可知,溶液中来自两种不同的源生物(bce和cb6301_d29)的oxdc酶在1-13不同的ph值下孵育120分钟。在120分钟的孵育结束时,根据酶活性检测的描述,测试每种样品剩余的草酸盐降解活性。认为在25℃(环境温度)下孵育的样品的活性是100%。如图3所示,cb6301_d29酶比bce酶更稳定,与bce酶3.0到10的的稳定性范围相比,cb6301_d29酶的稳定性范围为2.5到11。如示例8中所述,在六聚体和三聚体界面处离子残基的数量和组成决定了蛋白质四级结构的稳定性。cb6301缺乏包入六聚体的必要的残基;因此,与bce酶(六聚体)不同,cb6301是一个三聚体。此外,cb6301在三聚体界面处具有最小量的离子电荷残基,并且具有最大量的氢键残基。由于离子相互作用的数量减少以及氢键结合数量增加,cb6301在本质上将更加稳定。因此,作为三聚体的cb6301在酸性条件下与其他包入六聚体的酶相比具有增强的ph稳定性。本身是六聚体的酶满足条件:六聚体的蛋白质四级结构具有活性。示例6:模拟的胃环境下不同餐食中草酸盐的降解(模拟人胃内的餐食含量):为了评估来自杨树菇(a0)的oxdc酶降解人类食物中草酸盐的效力,根据包装上的说明,将几种常规西方膳食(预先做好的“精益美食”餐)在微波炉中煮熟,均质化并在a0酶的草酸盐降解活性的筛选中作为基质。表3列出了最终反应混合物中评估的膳食和近似的钙浓度。从膳食成分的说明(标签)中估算钙浓度。鲜货快递公司生产的新鲜未煮熟的菠菜以30g/l的量添加到每餐中来提供草酸盐,产生约3mm草酸盐的最终浓度。表3:评估人类食物及其钙浓度*菠菜(按照鲜货快递公司的内容说明)和餐食(按精益美食的内容说明)中钙的总每日营养摄入百分比。**使用方程[ca](mm)=(ca的每日营养摄入百分比)*1000/40计算。钙每日营养摄入量是1000毫克,钙的分子量是每摩尔40克。所有的食物均是按照精益美食的指导烹制,由料理机将其切成小块。将食物与50mm柠檬酸中的400ml合并(最终浓度为20mm),并且通过去离子(di)水将最终体积调节至800ml。通过加入6nhcl和/或10mnaoh将食品混合物的ph值调节至2.0、3.0、4.0、5.0、6.0和7.5。对于每个反应,将0.8ml的上述食物混合物、0.1ml的30g/l胃蛋白酶(最终浓度3g/l)和0.1ml的800u/loxdc(最终为80u/l)混合在一起,并在37℃下发生反应,以每分钟1000转振荡60分钟。然后,加入0.1ml的2.5nh2so4淬灭(终止)。通过离子排斥hplc方法分析剩余的草酸盐和生成的甲酸盐浓度,参见示例1。使用下面的公式计算草酸盐降解百分率:草酸盐降解百分率=甲酸盐浓度/(草酸盐浓度+甲酸盐浓度)×100%只食用菠菜(不用餐)用来作为低钙对照。作为阴性对照(无酶),将0.1ml的50mm柠檬酸代替oxdc溶液加入到每个反应中。如图4所示,来自a0的oxdc可以在酸性ph下比在更为碱性的ph下降解更多的草酸盐,并且在具有更低水平的钙的膳食中降解。在具有极低钙水平(<1mmca2+)的膳食中,当ph值介于2与5之间时,在60分钟内,90%以上的总草酸盐被降解。在低钙水平(<3mmca2+)的膳食中,当ph值介于2与4之间时,在60分钟内,70%以上的总草酸盐被降解。在含有中等水平的钙(3-5mmca2+)的膳食中,a0oxdc酶在ph2至3的条件下于60分钟内可以降解总草酸盐的60-80%,并且在ph4下可以降解50%。在高钙食物(>5mmca2+)中,在ph2和3的条件下,所述酶在60分钟内降解总草酸盐的40-60%。降解百分比的降低可归因于草酸盐在含有中等至高钙量的膳食中溶解度的降低。不同于yvrk(km=8.4mm),a0对草酸盐(km=0.08mm)具有高亲和性,这更能让a0在人胃内降解低水平的草酸盐。为了使oxdc酶有效地降解人胃内的草酸盐,该酶需要匹配进食的人胃(ph1.0-4.5)并小于1.0mm的km的ph分布。因此,cb6301、cb6803、cb6312和bcl、以及a0/a8和bce是理想的候选。示例7:oxdc酶的ph值和时间分布:按照示例1中所述测试示例3中所述获得的bce和cb6301的oxdc酶的活性,但是测试的反应中的ph范围为1.5至7.0。在37℃下分别反应5分钟、10分钟、20分钟和40分钟后,如示例1所述终止该反应。如示例1所述,通过hplc测定所生成的甲酸盐浓度并计算oxdc酶的活性。如图5和图6所示,cb6301_d29在ph值为1.5与4.5的范围内具有活性,ph范围比bce(ph2.4至4.5)更宽。然而,bce在这些条件下可保持很长一段时间的活性。图7中显示了许多oxdc酶的ph活性分布。这些酶均具有独特的ph活性分布,只有四种酶,即,a8/a0、cb6301、cb6803、cb6312和bcl在ph2.0或更低时具有活性。cb6301,cb6803和cb6312均具有少量的草酸氧化酶活性,其产生对这些特定酶有害的自由基。产生的这些自由基导致作为时间函数的活性的丧失。我们发现,如果将位置340上的异亮氨酸残基(图10中以粗体突出显示)突变为谷氨酸,则该自由基的形成不会导致草酸降解活性的丧失。另外,我们发现将邻苯二胺、对苯二酚和抗坏血酸等维生素引入酶溶液中可使酶的活性保持更长时间。如实施例8中所述,六聚体界面处的离子残基的数量和组成决定了蛋白质四级结构的稳定性。cb6301、cb6312和cb6803缺少大部分这样的残基;因此,与其他酶不同,这些酶天然地包入三聚体。与六聚体相比,三聚体提高了ph稳定性,特别是在ph低于2.0时稳定性更高。由于三聚体界面处较低数量的离子相互作用,并且氢键相互作用的数量增加造成了三聚体蛋白质四级结构对ph值变化抗性的增强。本身是六聚体的酶需要六聚体的蛋白质四级结构具有活性。在示例8中规定的六聚体界面上具有大于10个离子氨基酸残基(d、e、r和k)的酶仅在ph3.0以上的条件下具有活性。在六聚体界面具有5-9个离子残基(d、e、r和k)的酶只在ph2.0以上具活性并且少于5个离子残基的酶在ph2.0以下显示活性。这对应于六聚体界面处(所有天冬氨酸和谷氨酸已被质子化的ph)的总离子净电荷:1)总净离子电荷为+8或更高的酶仅在ph3.0以上具有草酸盐降解活性。2)总离子电荷为+4至+7的酶在ph2.0以上时具有草酸盐降解活性。3)总离子电荷小于+4的酶在ph2.0以下时表现出草酸盐降解活性。天然包入六聚体的酶不仅在六聚体界面处具有较高数量的离子相互作用,而且在三聚体界面处也具有较高数量的离子相互作用。每个亚基的离子相互作用的组合数量如下:cb6301:25bcl:29a8:32bce:32bam:44yvrk:45bpu:47总离子相互作用的数量与酸性ph稳定性之间存在直接相关性,其中cb6301的量最小时,稳定性最高,而bpu的量最大时,稳定性最低。最低酸稳定性的酶(bam、bce和bpu)在六聚体和三聚体界面上均具有44个以上的离子氨基酸。bcl、bce和a8有29-32个离子氨基酸,cb6301有25个。尽管bcl、bce、a8和cb6301离子相互作用的数量减少,但是它们仍具有大量的氢键相互作用。这些氢键相互作用增加界面处的稳定性,并使界面不易发生酸变性。根据以上信息,可以提供从多种酶中选择酶的筛选方法,其中所选择的酶符合一个或多个上述标准。示例8:蛋白质四级结构:1.氨基酸序列分析通过分析晶体结构和氨基酸序列,确定某些oxdc酶在酸性环境下稳定性增强的原因取决于六聚体和三聚体界面处的离子相互作用的数量和组成。六聚体界面的氨基酸以下划线形式标注在图10所示的多重序列比对中。此外,在图10中发现的多序列比对中,三聚体界面处的氨基酸以下划线标出,并以粗体显示。除了cb6301、cb6312和cb6803以外,所有已知的oxdc酶都是六聚体。当环境变得更酸时,六聚体界面处具有较大比例的离子相互作用(d、e、k和r氨基酸)的酶会失去它们的蛋白质四级结构。同样,六聚体和三聚体界面上具有更多离子相互作用的酶在酸性条件下更容易失去蛋白质四级结构。例如,bam、yvrk和bpu由于蛋白质四级结构的解离而在ph3.0及以下时无活性。这种蛋白质四级结构的丧失是不可逆的,并且在六聚体/三聚体解离后,所述酶不再具有草酸盐降解活性。这归因于六聚体和三聚体界面处天冬氨酸和谷氨酸的质子化;因此,破坏了将这些界面保持在一起的离子相互作用。天冬氨酸和谷氨酸分别具有3.65和4.25的酸离解常数,如果周围环境主要是疏水性的,则其可以下降约0.5-1.0个ph单位。相反,由于缺乏形成六聚体所需的离子相互作用,因此,cb6301不形成六聚体结构,并且是合理的。因此,cb6301包入三聚体,并在降至ph1.5的更酸性条件下具有活性。尽管比yvrk、bam和bpu酶弱得多,但是,bcl和bce酶仍形成六聚体结构。这是由于较少的离子相互作用将界面结构保持在一起。由于较少的离子相互作用使酸性ph稳定性增强并保留活性,因此,在这个趋势下,bcl和bce分别在ph值下降至2.0和2.5时具有活性。例如,最低酸稳定性的酶(bam、bce和bpu)在六聚体和三聚体界面上均具有44个以上的离子氨基酸。bcl、bce和a8具有29-32个离子氨基酸,cb6301具有25个。尽管bcl、bce、a8和cb6301离子相互作用的数量减少,但是它们仍具有大量的氢键相互作用。这些氢键相互作用增加界面处的稳定性,并使界面不易发生酸变性。本身是六聚体的酶需要六聚体的蛋白质四级结构具有活性。六聚体界面上具有大于10个离子残基(d、e、r和k)的酶(6个亚基中的2个之间的相互作用)仅在ph3.0以上有活性。在六聚体界面上具有5-9个离子残基(d、e、r和k)的酶(6个亚基中的2个之间的相互作用)仅在ph2.0以上显示活性并且少于5个离子残基的酶(6个残基的2个之间的相互作用)在ph2.0以下显示活性。这对应于六聚体界面处的总离子净电荷(所有天冬氨酸和谷氨酸已被质子化的ph)。这些结果显示出下列必然趋势:1)携带+8及以上的总净离子电荷的酶只有在ph3.0以上(6个亚基中的2个之间的电荷)具有草酸盐降解活性。2)携带+4至+7的总离子电荷的酶具有高于ph2.0的草酸盐降解活性(6个亚基中的2个之间的电荷)。3)携带小于+4的总净离子电荷的酶在ph2.0以下(6个亚基中的2个之间的电荷)具有草酸盐降解活性。在大多数(如果不是全部的话)天冬氨酸和谷氨酸被质子化的ph条件下,六聚体界面具有总正净电荷。与具有较少离子残基的酶相比,六聚体界面处具有较大比例离子残基的酶对ph的变化更敏感。实际上,图7显示出在所有天冬氨酸和谷氨酸均被质子化的ph值条件下的总净离子电荷与证明yvrk、bam、bpu、bcl、cb6301、a8/a0和bce酶具有活性的最酸性ph条件下的总净离子电荷直接相关。事实上,r2值与大量的数据显示出大于0.95的强相关性。根据以上信息,可以提供从多种酶中选择酶的筛选方法,其中所选择的酶符合一个或多个上述标准。表4:六聚体与畴界氨基酸的分析和活性aa=氨基酸*两个亚基之间的一个界面处的氨基酸或电荷的数量。oxdc酶形成三聚体的二聚物;因此,一个oxdc六聚体具有三个界面。因此,表4中的所有值应乘以3。^总净离子电荷等于在所有谷氨酸和天冬氨酸被质子化的ph下赖氨酸和精氨酸残基的总数.1离子电荷是在中性ph条件下该三聚体界面上的总电荷。2.体积排阻色谱sec-hplc用于监测二聚物/聚合物的形成。绘制用于sec-hplc的分子量标准曲线。首先在hplc级h2o中重建凝胶过滤分子量标准品至浓度为20mg/ml,然后根据供应商的推荐在50mm精氨酸缓冲液中稀释。为了测定oxdc的分子量,使用绘制的标准曲线,将酶分别在50mm精氨酸缓冲液中稀释至2mg/ml、1mg/ml和0.5mg/ml的浓度。分子量标准品如下:●右旋糖酐蓝:1毫克/毫升●甲状腺球蛋白:5mg/ml●铁蛋白:0.3mg/ml●醛缩酶:4mg/ml●伴清蛋白:3mg/ml●卵清蛋白:4mg/ml根据供应商建议绘制校准曲线:1.使用下面的方程计算分配系数(kav):kav=(ve-vo)/(vc-vo)其中ve=洗脱体积,vc=几何柱体积,vo=柱体空隙体积。柱体空隙体积定义为右旋糖酐蓝标准品的洗脱体积。几何柱体积计算公式如下:vc=r2×π×l其中r是柱的半径,l是柱的长度。2.分配系数以对数(mw)绘图。sec结果显示yvrk酶是一种低聚体,即六聚体,其保留时间为8.8分钟。没有附加峰值对应于高阶聚合或降解。同样,bce也是一种低聚六聚体,其保留时间为8.7分钟。但是,cb6301是一种三聚体,其保留时间为9.6分钟。这些结果均证实了上一节“氨基酸序列分析”以及下节(非变性聚丙烯酰胺凝胶电泳分析)中提出的假设。3.非变性聚丙烯酰胺凝胶电泳分析非变性聚丙烯酰胺凝胶电泳基于分子量和pl的组合分离酶。因此,如果oxdc出现解离,将导致凝胶迁移,这意味着酶带将进一步进入凝胶。图9显示了cb6301、bce和yvrk在不同ph下的非变性聚丙烯酰胺凝胶电泳。为了制备测试样品,将20μl的cb6301分别在ph1.5、2.0、2.5、3.0、3.5和4.0下加入到1980μl的缓冲液中,涡漩混合。将40μl的yvrk分别在ph1.5、2.0、2.5、3.0、3.5和4.0下加入到1960μl的缓冲液中,涡漩混合。将50μl的bee分别在ph1.5、2.0、2.5、3.0、3.5和4.0下加入到450μl的缓冲液中,涡漩混合。上述所有样品的浓度均为1mg/ml。同时,还制备浓度为2mg/ml的样品并将其装载在凝胶上。上述溶液在37℃下以每分钟300转培养。然后将15μl的每种溶液与5种15μl的样品缓冲液混合。取20μl的每种样品加入到各自的凝胶孔中。10%非变性聚丙烯酰胺凝胶电泳凝胶在100伏电压下运行75分钟。注:在装载到凝胶上之前测量每种样品的ph值。ph实际测量值见图11的图例。根据非变性聚丙烯酰胺凝胶电泳(图11),在评估的所有ph,即,1.40-2.52(无凝胶迁移)下,cb6301oxdc酶仍保持为三聚体(由sec和质谱分析法证实)。yvrk酶在ph4.07(由sec和质谱分析法证实)下以六聚体形式存在,在ph3.6下以六聚体和三聚体/二聚体/单体的混合物(呈现为一个更宽的条带)形式存在,以及在ph3.02-3.05下以三聚体/二聚体/单体(以一个更宽的条带呈现)的混合物形式存在,其通过凝胶迁移测定。最后,在评估的所有ph值,即1.57-2.27下,bce酶是三聚体/二聚体/单体混合物(发现条带在泳道中更加扩散),然而,在ph2.57下,所述酶是六聚体。这些结果提供了一个令人信服的证据,即oxdc酶的ph分布直接与蛋白质四级结构的解离有关。例如,cb6301酶在介于1.5与5.0之间的ph下显示出活性(在所有ph条件下为三聚体),yvrk酶在ph3.5-5.5下显示出活性(在这些ph下为六聚体),而bce酶在ph2.4-4.5下显示出活性(在这些ph下为六聚体)。一旦yvrk酶的ph下降到ph3.5以下并且bce酶下降到2.4以下,则蛋白质四级结构解离,随后致使活性完全丧失。四级去折叠过程和活性的丧失是不可逆转的。示例9:oxdc在40℃的不同化学物质存在下的稳定性:将终浓度为2mm的几种不同的化学制品添加到如示例3获得的bce或cb6301_d29纯化的oxdc酶溶液中。充分混合后,将这些在ph9.5的50mm精氨酸中的混合物在40℃不摇动(静置)下温育6天。在未添加化学制品的条件下,酶本身在40℃和4℃下作为对照物进行温育。根据示例1中所述的程序,在ph3下测试酶活性,反应时间分别为8分钟、17分钟、41分钟和106分钟。如图12所示,当在40℃下温育时,bce的酶活性增加了一倍以上。此外,在硫酸镁存在的情况下,活性增加近20%,并且在与bce酶在40℃下的对照样品相比时,在znso4或edta的存在下活性显著降低。如图13所示,与bce酶不同的是,在40℃下温育后,cb6301_d29的酶活性基本不变。在硫酸镁或硫酸锰的存在下,活性增加超过80%。然而,它们在反应过程中仍然表现出活性丧失。示例10:酶动力学:测量来自四种酶,即bce、bcl、cb6301_d29和a8的oxdc的酶动力学,并与已知的yvrk的动力学数据进行比较。制备草酸盐(0.024-12.5mm)的具有不同浓度的反应缓冲液(100mm柠檬酸盐缓冲液,ph3)。在四个独立的ph值下测量a8酶:即,5.0、4.0、3.5和3.0。这些缓冲液被用于通过监测草酸盐降解和甲酸盐生成来测试不同oxdc酶的草酸盐降解酶活性。向草酸盐反应缓冲液中加入oxdc酶开始反应,并在37℃下以每分钟1100转振荡温育5分钟。加入2.5nh2so4终止反应,并如示例1中所述通过hplc分析甲酸酯的含量。不含有草酸盐的反应计为阴性对照。使用与示例1中所述相同的程序,测定酶作用物浓度在0.024-12.5mm之间的最初5分钟期间的初始反应速率。cb6301_d29在不同草酸盐浓度下的初始反应速率如图14所示。为了测定动力学参数kcat和km,在不同酶作用物浓度[s]下的反应速率v0拟合kaleidagraph软件中的米氏方程:v0=kcat*[e]t*[s]/(km+[s])其中:·v0是通过hplc测定的短时间(5min)反应期间的初始反应速率。·kcat是酶的转换数,·km是米歇利斯常数,·[e]t是oxdc酶的总浓度,·[s]是酶作用物,即草酸盐的初始浓度。所述结果在表5中进行比较。ph3.0下的bce、bcl、cb6301_d29和a8(分别为0.32mm、0.2mm和0.08mm)酶的km远远低于ph4.2下的yvrk酶,这表明它们对酶作用物,即草酸盐具有更强的亲和性。较低的km也表明相比于yvrk酶,bce、bcl、cb6301和a8酶能够有效地将草酸盐降解到更低的水平。我们试图测定ph3.0下yvrk酶的km,但是现在这种酶在该ph下的确显示出任何活性。事实上,yvrk酶在ph3.3以下显示的活性不显著/持续,这就限制了其作为酶从人类胃环境中去除草酸盐的用途,由此可知所进食胃的ph值介于ph1.0-4.5之间。a8酶的km分别在四个ph值,5.0、4.0、3.5和3.0下测定。如图15中显示的,酶的km随着ph的酸性增加而降低。单膦酸盐草酸盐(酸离解常数=3.81和酸离解常数=1.25)结合到活性位点内未质子化的谷氨酸。与被破坏的活性位点(例如被破坏的六聚体的活性位点)中的同等残基相比,未被破坏的活性位点中非质子化的谷氨酸更能保持不被质子化。因此,当ph从6降低到大约3时,与未质子化草酸盐相比,单膦酸盐草酸盐的比例将被最大化。因此,这将增加草酸盐与未被破坏的活性位点的结合,从而导致较低的km和较高的催化效率。表5:比较不同oxdc酶的酶动力学常数。·来源:ellenw.moomaw等,生物化学。2009;48(26):6116-6125.示例11:创建酶理想的ph微气候的干燥和制剂:冷冻干燥:bce酶在去离子水中的5%w/v海藻糖制剂中冷冻干燥。开始时,搁板温度和压力分别为-30℃和50-150毫托。18小时后,温度上升(每分钟0.1℃)至4℃,并保持至处理结束。乳状液:将带有酸性封端的聚(丙交酯-共-乙醇酸交酯)plga(丙交酯∶乙醇酸交酯85∶15,mn85,000-100,000)以21%w/v的速率溶解在二氯甲烷中。将冻干的oxdc以1.3%w/v的速率与plga溶液混合,并使用手握式组织匀浆机以每分钟约18,000转混合30秒。在均质化之后立即加入1.5ml的2%聚乙烯醇溶液(mw9,000-1,0000),并将样品涡旋30秒。将得到的乳液滴加到100ml的0.5%聚乙烯醇溶液中并搅拌14小时。通过离心收集得到的微珠,然后,重悬在di水中重复洗涤,最后,离心收集。最后一次洗涤后,使用5ml的di水重悬所述微珠。在喷雾干燥之前将微珠储存在4℃的温度下。喷雾干燥:珠悬浮液(3ml)与rl30d丙烯酸树脂(1.9ml)和海藻糖(0.5g)混合,加入di水直至总体积为100ml。喷雾干燥在buchib-191中进行,入口温度和出口温度分别为100℃和约58-65℃。进料速率设定为10%(约每分钟2ml),气体喷射(n2)流量和压力分别为每分钟20升和每平方英寸70磅。干粉的产率为68%(g)。活性测试:按照示例1中所述测定活性,在使用柠檬酸盐和磷酸盐缓冲液时,将反应ph分别设定为4、5、6、7、7.3和7.8。如图13和14所示,当用plga配制bce酶时,由于在ph中性环境(ph6、7、7.3和8)中观察到草酸盐降解活性,从而实现了酸性微气候。未配制的bce酶在这些ph值下不具有活性。因此,已经实现了微气候的ph值,从而使bce酶在颗粒内保持活性。示例12:比格犬原理循证研究:给6只比格犬给予高草酸盐的饮食(每天2.73mmol草酸盐)来诱导高草酸尿症。高草酸尿症立即出现,每24小时平均动物排泄0.8mmol的草酸盐。在高草酸盐饮食(每天2餐)大约48小时后,该水平稳定。每餐连同酶通过口服形式(灌胃)评估该高草酸比格猎犬模型中四种不同的酶。酶在ph9.5的50mm精氨酸中是可溶形式的,在灌胃之前,酶与载体以酶溶液和载体约6∶96的比例混合。使用的载体是柠檬酸,ph值为3。将尿液收集到含有硫酸的容器中,以确保始终保持尿液的酸性ph值。使用来自trinitybiotech的草酸盐测定试剂盒(5910d)在12小时的尿液样本中测量尿液中的草酸盐,使用stanbio公司的直接肌酸酐liquicolor程序0421测定尿液中的肌酸酐。在给药之前,对八只动物(比格犬)的胃中ph和分配进行预筛选研究。分配研究是基于在ph2.0-4.5范围内的处于进食状态胃的ph进行(类似于人类进食状态)。选择6只动物进行研究,并通过口服灌胃或通过在不含草酸盐食物中混合,以不同剂量施用bce、yvrk、a0、cb6301_d29。结果:所有的动物均随着高草酸盐饮食而具有高草酸尿症,从每24小时排泄0.16mmol草酸盐的基准草酸盐排泄量增加到每24小时排泄0.8mmol草酸盐(高草酸盐饮食阶段)。在整个研究中,总肌酸酐排泄量为每24小时平均约2mmol。在以口服灌胃形式定量给药到载体后,a0、cb6301_d29和bce测试物品表现出尿中草酸盐显著降低。a0和cb6301_d29表现出按照一只动物(高:85%)的平均尿草酸含量最高降低60%和40%,见图18-19。bce显示平均降低了23%,动物之间的差异更大,见图20。yvrk酶没有显示出显著的降低,参见图21。这些结果表明,只有具有跨酸条件(例如ph1.5-4.5)的ph活性分布的酶才能在体内有效。例如,与bce(ph2.4-4.5,24%)和yvrk(ph3.5-5.5,未显著降低)相比,具有大约1.5-5.0的ph分布的a0/a8和cb6301显示尿中草酸盐显著降低。在柠檬酸载体中施用测试物品的结果会比与不含草酸盐的饮食混合的结果更好(结果在此未显示)。在研究测量中,在餐后的第一个小时期间,胃的ph值平均在ph4附近(结果未在本文中示出);然而,所有的动物表现出极高的和极低的ph峰值。示例13:不溶性草酸盐降解三种oxdc酶,bce、yvrk和cb6301,在各自ph活性最大值(bce在ph3.0下测试,cb6301在ph2.5下测试和yvrk在ph4.0下测试)下以草酸盐与钙的不同摩尔比评估草酸盐降解活性。按照示例1中所述进行活性反应,但是,包括钙离子以获得如下的草酸盐与钙的摩尔比,1∶1、1∶2、1∶3、1∶4、1∶5。生成的甲酸盐的百分比等于草酸盐的降解量,并且按照1∶1的条件归一化,然后,针对图22(bce)、图23(cb6301)和图24(yvrk)中的草酸盐∶钙的比例绘图。进行各自的稀释(bce-未掺水,1/2x、1/4x;cb6301-1/5、1/10、1/20;yvrk-未掺水,1/2x、1/4x)以在相同的总蛋白浓度下进行比较;因此,加入的三种酶的水平相当于样品中每mg总蛋白质。酶溶液的纯度是可比较的(85%)。cb6301在降解不溶性草酸盐方面更为有效,然后是bce或yvrk(图22-24)(在ca与所探究的ox的所有比例下生成更多的甲酸盐)。这可以归因于cb6301酶具有比bce酶或yvrk酶更低的km和更高的催化效率。yvrk酶是在降解不溶性草酸盐方面效率最低的的酶。这可能与两个因素有关:(1)yvrk酶具有高的km(mm水平)和低的催化效率,和(2)ph活性分布不利于溶解不溶性草酸盐。不溶性草酸盐在酸性条件下变得更容易获得,在更酸性条件下可溶解更高水平的不溶性草酸盐。由于yvrk酶只在ph3.5及以上才有活性,所以酶在去除草酸盐(不管是可溶性草酸盐还是不溶性草酸盐)时均不起作用。示例14:不同食物中草酸盐的降解:为了评估oxdc酶在降解人类食品中草酸盐的有效性,对几种食品进行了评估。这些食物如下:1)即饮茶2)啤酒3)水果汁对于每个反应,将0.990ml的食物和0.010ml的80u/loxdc混合在一起,并使其在37℃下以每分钟1000转振荡60分钟。然后加入0.1ml的2.5nh2so4淬灭(终止)反应。通过离子排斥hplc方法分析剩余的草酸盐和生成的甲酸盐浓度,参见示例1。使用下面的公式计算草酸盐降解百分率:草酸盐降解百分率=甲酸盐浓度/(草酸盐浓度+甲酸盐浓度)×100%如表6所示,oxdc降解食品中大部分草酸盐。表6:食品和饮料中的草酸盐降解当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1