再生毛囊原基的集合体的制造方法、含毛囊组织薄片及含毛囊组织薄片的制造方法与流程
本发明涉及一种再生毛囊原基的集合体的制造方法、含毛囊组织薄片及含毛囊组织薄片的制造方法。
本申请主张基于2015年10月30日在日本申请的专利申请2015-214547号的优先权,将其内容援用于此。
背景技术:
为了建立足够用于临床应用的毛囊再生医疗,需要再生毛囊具有正常的组织结构,并且形成并生长具有适于移植部位的毛干的毛。包含毛等皮肤附属器的胚层性附属器官通常在胎儿期通过上皮细胞及间充质细胞的相互作用而形成。已知作为外胚层性附属器官之一的毛囊在个体的生命过程中反复生长及衰退(毛发循环),生长期中的毛球(hair bulb)部的再生通过与毛囊器官发生器相同的分子机制被诱导。并且,认为这种毛发循环中的毛球部的再生通过作为间充质细胞的毛乳头细胞被诱导。即,在生长期中,毛囊上皮干细胞通过作为间充质细胞的毛乳头细胞被分化诱导,由此毛球部得以再生。
一直以来,针对毛囊再生,尝试了基于间充质细胞(毛乳头细胞及真皮毛根鞘细胞)的取代的毛囊可变区域的再生、基于具有毛囊诱导能力的间充质细胞的毛囊新生、或基于上皮细胞及间充质细胞的毛囊的重建等。具体而言,可举出:通过在凝胶内划分来配置上皮细胞及间充质细胞这2种细胞集合体,由此构筑毛囊原基,插入化学纤维等导件之后,将其移植,由此使毛囊器官再生的方法(例如,参考专利文献1);利用对来源于躯体的多种细胞添加了Wnt信号活性剂的培养液来进行混合培养,由此形成原始的毛囊器官的方法(例如,参考专利文献2);制作在毛囊间充质细胞的细胞集块(球体)的外侧粘结有上皮细胞的人工毛球体的方法(例如,参考专利文献3)等。
以往技术文献
专利文献
专利文献1:国际公开第2012/108069号
专利文献2:日本特开2013-78344号公报
专利文献3:日本特开2003-70466号公报
技术实现要素:
发明要解决的技术课题
专利文献1~3中,制作上皮细胞及间充质细胞这2种细胞集合体并使它们融合,由此一个一个制作毛囊原基,再生数万根毛发时,制作效率及移植效率上存在问题。
本发明是鉴于上述情况而完成的,其提供一种简便地制造与哺乳动物的毛囊组织类似、规则且高密度的再生毛囊原基的集合体的方法。
用于解决技术课题的手段
本发明包含以下方式。
[1]一种再生毛囊原基的集合体的制造方法,其特征在于,具备如下工序,即,在由规则配置的微小凹部构成的微凹板播种间充质细胞及上皮细胞,并在供给氧的同时进行混合培养,由此形成毛囊原基。
[2]根据[1]所述的再生毛囊原基的集合体的制造方法,其中,所述微凹板由具有透氧性的材质构成。
[3]一种含毛囊组织薄片,其特征在于,含有包含间充质细胞及上皮细胞的毛囊原基及生物适应性水凝胶,所述毛囊原基规则地且以与哺乳动物的毛孔的密度相同的密度配置于所述生物适应性水凝胶上。
[4]根据[3]所述的含毛囊组织薄片,其中,所述毛囊原基还进行分化而形成毛囊。
[5]根据[3]或[4]所述的含毛囊组织薄片,其中,所述生物适应性水凝胶为凝胶化的细胞外基质成分。
[6]根据[5]所述的含毛囊组织薄片,其中,所述细胞外基质成分为胶原蛋白。
[7]根据[3]至[6]中任一项所述的含毛囊组织薄片,其中,所述毛囊原基的密度为20个/cm2以上且500个/cm2以下。
[8]一种含毛囊组织薄片的制造方法,其特征在于,具备:在由规则配置的微小凹部构成的微凹板播种间充质细胞及上皮细胞,并进行混合培养,由此形成毛囊原基的工序;及将形成于所述微小凹部内的毛囊原基转印于生物适应性水凝胶的工序。
[9]根据[8]所述的含毛囊组织薄片的制造方法,其中,所述微凹板中的所述微小凹部的密度为20个/cm2以上且500个/cm2以下。
发明效果
根据本发明,能够简便地获得规则且高密度的再生毛囊原基的集合体。
附图说明
图1是表示本实施方式中的含毛囊组织薄片的制造方法的一例的概略图。
图2A是表示实施例1中的微凹板的制作方法的概略图。
图2B是表示实施例1中的微凹板的整体、底面、底面的剖面的图像。
图3是表示用实施例1中的微凹板形成的毛囊原基向胶原蛋白凝胶的转印方法的概略图及表示用实施例1中的相位差显微镜拍摄工序[a]~[c]中的胶原蛋白凝胶的结果的图像。
图4是表示移植了试验例1中的含小鼠毛囊组织薄片的裸鼠的再生毛发的情况的图像。
图5A是表示利用相位差荧光显微镜,以明视场观察实施例2中的从开始培养起第1天的混合球体的结果的图像。
图5B是表示利用相位差荧光显微镜,以暗视场观察实施例2中的从开始培养起第1天及第3天的混合球体的结果的图像。
图5C中,“Microscope”是表示用DAPI(4’,6-diamidino-2-phenylindole)染色液,对实施例2中的从开始培养起第3天的混合球体中的核进行染色,利用相位差荧光显微镜以暗视场进行观察的结果的图像。“ALP”是表示对实施例2中的从开始培养起第3天的混合球体进行碱性磷酸酶(alkaline phosphatase;ALP)染色,利用相位差荧光显微镜以明视场进行观察的结果的图像。“SEM”是表示用4%低聚甲醛固定液将实施例2中的从开始培养起第3天的混合球体固定化,并且使其冷冻干燥之后,用扫描电子显微镜(ScanningElectron Microscope;SEM)进行观察的结果的图像。
图6A是表示将实施例2中的从培养开始起第3天的混合球体移植到裸鼠(ICR nu/nu小鼠、5周龄)的皮下,从移植起第14天的裸鼠的情况的图像。
图6B是表示将实施例2中的从培养开始起第3天的混合球体移植到裸鼠(ICR nu/nu小鼠、5周龄)的皮下,从移植起第21天的裸鼠的情况的图像。
图7A是表示将实施例2中的从培养开始起第3天的混合球体移植到裸鼠(ICR nu/nu小鼠、5周龄)的皮下,从移植起第18天的裸鼠的移植部周围的毛发的再生根数与所移植的混合球体的细胞数的关系的曲线图。
图7B是表示将实施例2中的从培养开始起第3天的混合球体移植到裸鼠(ICR nu/nu小鼠、5周龄)的皮下,从移植起第18天的裸鼠的毛囊组织的再生效率与所移植的混合球体的细胞数的关系的曲线图。
图8是表示将实施例2中的从培养开始起第3天的混合球体移植到裸鼠(ICR nu/nu小鼠、5周龄)的皮下,从移植起第18天、第30天、第42天、第57天的裸鼠的移植部的情况的图像。
图9是表示将试验例2中的从培养开始起第3天的混合球体移植到裸鼠(ICR nu/nu小鼠、5周龄)的皮下,制作从移植起第18天的裸鼠的移植部的组织切片并进行HE染色,对其利用相位差荧光显微镜以明视场进行观察的结果的图像,表示将试验例2中的从培养开始起第3天的混合球体移植到裸鼠(ICR nu/nu小鼠、5周龄)的皮下,制作从移植起第18天的裸鼠的移植部的组织切片,用小鼠Versican抗体进行免疫染色,并且对其利用相位差荧光显微镜以暗视场进行观察的结果的图像,及表示将试验例2中的从培养开始起第3天的混合球体移植到裸鼠(ICR nu/nu小鼠、5周龄)的皮下,制作从移植起第18天的裸鼠的移植部的组织切片,用小鼠CD34抗体进行免疫染色,并且对其利用相位差荧光显微镜以暗视场进行观察的结果的图像。
图10是表示以明视场及暗视场观察试验例3中的从培养开始起第3天的用Oxychip或Non-oxychip培养的混合球体的结果的图像。
图11是表示制作试验例3中的从培养开始起第3天的混合球体的切片并进行HE染色,并且对其利用相位差荧光显微镜以明视场进行观察的结果的图像。
图12是表示将试验例3中的从培养开始起第3天的用Oxychip或Non-oxychip培养的混合球体移植到裸鼠(ICR nu/nu小鼠、5周龄)的皮下,从移植起第18天的裸鼠的移植部的情况的图像。
图13A是表示以暗视场观察实施例3中的从培养开始起第1天及第3天的用96孔板培养的各细胞数的混合球体的结果的图像。
图13B是表示以明视场观察实施例3中的从培养开始起第3天的用微凹板培养的4.0×103个细胞/孔的混合球体的结果的图像。
图13C是表示以暗视场观察实施例3中的从培养开始起第3天的用微凹板培养的4.0×103个细胞/孔的混合球体结果的图像。
图14A是表示将实施例3中的从培养开始起第3天的混合球体移植到裸鼠(ICR nu/nu小鼠、5周龄)的皮下,用肉眼观察从移植起第18天的裸鼠的移植部中的再生毛发的结果的图像。
图14B是表示将实施例3中的从培养开始起第3天的混合球体移植到裸鼠(ICR nu/nu小鼠、5周龄)的皮下,从移植起第18天的裸鼠的毛囊组织的再生效率与所移植的混合球体的细胞数的关系的曲线图。
图14C是表示将实施例3中的从培养开始起第3天的混合球体移植到裸鼠(ICR nu/nu小鼠、5周龄)的皮下,从移植起第18天的裸鼠的移植部周围的毛发的再生根数与所移植的混合球体的细胞数的关系的曲线图。
图15A是表示将试验例4中的从培养开始起第3天的混合球体移植到裸鼠(ICR nu/nu小鼠、5周龄)的皮下,制作从移植起第18天的裸鼠的移植部的组织切片并进行HE染色,并且对其利用相位差荧光显微镜以明视场进行观察的结果的图像。
图15B是表示将试验例4中的从培养开始起第3天的混合球体移植到裸鼠(ICR nu/nu小鼠、5周龄)的皮下,制作从移植起第18天的裸鼠的移植部的组织切片,用抗Nuclei抗体及Histofine小鼠染色试剂盒进行免疫染色,并且对其利用相位差荧光显微镜以明视场进行观察的结果的图像。
图15C是表示将试验例4中的从培养开始起第3天的混合球体移植到裸鼠(ICR nu/nu小鼠、5周龄)的皮下,用数字显微镜观察从移植起第18天的裸鼠的移植部的再生毛发的结果的图像。
具体实施方式
以下,根据需要参考附图,对本发明的实施方式进行详细说明。
<再生毛囊原基的集合体的制造方法>
一实施方式中,本发明提供一种再生毛囊原基的集合体的制造方法,其具备如下工序,即,在由规则配置的微小凹部构成的微凹板播种间充质细胞及上皮细胞,并在供给氧的同时进行混合培养,由此形成毛囊原基。
根据本实施方式的制造方法,通过将间充质细胞及上皮细胞的混合细胞集块(以下,还称作“混合球体”)的结构保持为高密度,能够有效地形成毛囊原基,并能够简便地获得规则且高密度的再生毛囊原基的集合体。
本说明书中,“间充质细胞”表示来源于间充质组织的细胞或培养该细胞而获得的细胞。例如,可举出毛乳头细胞、真皮毛根鞘细胞、发生期的皮肤间充质细胞、从多能细胞(例如,胚胎干细胞(ES)、胚胎生殖细胞(EG)、人工多能干细胞(iPS)等)衍生的毛囊间充质细胞等。
本说明书中,“上皮细胞”表示来源于上皮组织的细胞及培养该细胞而获得的细胞。例如,凸出区域的外毛根鞘最外层细胞、毛发基质基部的上皮细胞、从多能细胞(例如,胚胎干细胞(ES)、胚胎生殖细胞(EG)、人工多能干细胞(iPS)等)衍生的毛囊上皮细胞等。
作为细胞的来源,优选为来源于动物的细胞,更优选为来源于脊椎动物的细胞,尤其优选为来源于人的细胞。
本说明书中,“毛囊原基”表示成为毛囊的根源的组织,由上述间充质细胞及上述上皮细胞构成。作为形成毛囊原基的流程,首先,上皮细胞肥厚而陷入到间充质细胞侧,由此包住间充质性细胞的细胞集块(球体)。接着,包住间充质性细胞的球体的上皮性细胞形成毛发基质原基,间充质性细胞的球体形成具有毛诱导能力的毛乳头,由此形成由毛发基质原基及毛乳头等构成的毛囊原基。该毛囊原基中,毛乳头细胞向毛发基质细胞提供增殖因子,诱导毛发基质细胞的分化,所分化的细胞能够形成毛。
本说明书中,“毛囊”表示表皮以筒状进入内侧的部分且产生毛的皮肤的附属器官。
本说明书中,“再生毛囊原基”表示例如通过本实施方式的制造方法等制作的毛囊原基。
本说明书中,“再生毛囊原基的集合体”表示多个上述再生毛囊原基聚集的状态。通过本实施方式的制造方法,能够简便地获得多个上述毛囊原基以与哺乳动物的毛孔的密度相同的密度规则地排列的再生毛囊原基的集合体。并且,再生毛囊原基的集合体中,毛囊原基可分化而形成毛囊。
以往,通过以高密度且规则的排列培养间充质细胞的球体之后,播种上皮细胞,覆盖间充质细胞的球体的周围的方法,获得了高密度且规则排列的再生毛囊原基的集合体。
相对于此,本发明人通过一起播种间充质细胞及上皮细胞的悬浮液,并利用本实施方式的制造方法进行共培养,首次成功实现简便地获得多个毛囊原基以与哺乳动物的毛孔的密度相同的密度规则地排列的再生毛囊原基的集合体。
本说明书中,规则表示毛囊原基以等间隔配置的状态,和哺乳动物的皮肤上的毛孔与毛孔的间隔相同的程度即可。并且,关于与哺乳动物的毛孔的密度相同的密度,具体而言,优选为20个/cm2以上且500个/cm2以下,更优选为50个/cm2以上且250个/cm2以下,进一步优选为100个/cm2以上且200个/cm2以下。通过密度在上述范围,能够再生更准确地重现正常的毛囊组织的配置的毛囊组织。
[微凹板]
在形成毛囊原基时使用的微凹板优选规则地配置有多个微小凹部。微凹板可使用市售的微凹板,也可通过后述的实施例1的方法等制作。并且,微凹板中的微小凹部的密度优选为20个/cm2以上且500个/cm2以下,更优选为50个/cm2以上且250个/cm2以下,进一步优选为100个/cm2以上且200个/cm2以下。通过密度在上述范围,能够以毛囊原基以与哺乳动物的毛孔的密度相同的密度配置的状态进行培养。如后述,通过原样保持该规则的配置且高密度的毛囊原基的配置的同时将其移植到受试动物的毛囊缺损部,能够再生更准确地重现正常的毛囊组织的配置的毛囊组织。
并且,对于微小凹部的开口形状,并无特别限制。例如,可以是圆形状、四边形、六边形、线状等,其中,从是接近毛孔的形状这一观点考虑,优选为圆形状。
对于微小凹部的开口部的直径及深度,只要是能够容纳并培养混合球体的大小,则并无特别限定,对于直径,可以是与哺乳动物的毛孔相同的大小,例如,可以是20μm以上且1mm以下。并且,对于深度,从移植含毛囊组织薄片之后向受试动物的皮肤固定的观点考虑,优选为1mm以下。
所获得的毛囊原基的配置及大小依赖于微凹板的微小凹部的开口形状、直径及深度等,因此结合受试动物的种类、所移植的部位等,适当制备微凹板的微小凹部即可。
微凹板的材质只要是适于细胞培养的材质即可,并无特别限定。例如,可举出透明的玻璃、聚合物材料等。其中,优选为具有透氧性的聚合物材料,更具体而言,可举出氟树脂、硅酮橡胶(例如,聚二甲基硅氧烷(poly(dimethylsiloxane):PDMS)等)等。可单独使用这些材质,也可组合来使用。
本说明书中,“透氧性”表示使分子状的氧透过,使其到达微凹板的微小凹部内的性质。作为具体地氧透过率,可以是约100cm3/m2·24hr·atm以上且5000cm3/m2·24hr·atm以下,可以是约1100cm3/m2·24hr·atm以上且3000cm3/m2·24hr·atm以下,可以是约1250cm3/m2·24hr·atm以上且2750cm3/m2·24hr·atm以下。另外,“24hr”表示24小时,“atm”表示气压,上述单位表示在1气压的环境下在24小时内透过的氧的每1m2的容量。通过使用由氧透过率在上述范围的材质构成的微凹板,能够对混合球体供给充分量的氧,并且能够形成毛囊原基。
[毛囊原基形成工序]
首先,将间充质细胞及上皮细胞播种在上述微凹板。接着,在供给氧的同时进行混合培养,由此形成毛囊原基。此时,所播种的细胞越多,毛囊原基的形成效率越高,毛囊原基的大小也变越大,但所播种的细胞数根据微凹板的微小凹部的大小适当调整即可。培养时间可以是1天以上且5天以下(优先为3天),培养温度可以是25℃以上且低于40℃(优选为37℃)。
作为在供给氧的同时进行培养的方法,可举出在对微凹板直接吹送氧等来供给的同时进行培养的方法、或使用由具有透氧性的材质构成的微凹板来进行培养的方法等。
作为混合球体中形成毛囊原基的流程,首先,上皮细胞肥厚而陷入到间充质细胞侧,由此包住间充质性细胞的球体。接着,包住间充质性细胞的球体的上皮性细胞形成毛发基质原基,间充质性细胞的球体形成具有毛诱导能力的毛乳头,由此形成由毛发基质原基及毛乳头等构成的毛囊原基。该毛囊原基中,毛乳头细胞对毛发基质细胞提供增殖因子,诱导毛发基质细胞的分化,所分化的细胞能够形成毛。而且,本实施方式的制造方法中,毛囊原基可分化而形成毛囊。
在共培养混合球体时使用的培养基并无特别限定,只要是包含细胞的生存增殖所需的成分(无机盐、碳水化合物、激素、必需氨基酸、非必需氨基酸、维生素)等的基本培养基即可。例如,可举出DMEM、Minimum Essential Medium(MEM)、RPMI-1640、Basal Medium Eagle(BME)、Dulbecco’s Modified Eagle’s Medium:Nutrient Mixture F-12(DMEM/F-12)、Glasgow Minimum Essential Medium(Glasgow MEM)等。
<含毛囊组织薄片>
一实施方式中,本发明提供一种含毛囊组织薄片,其含有包含间充质细胞及上皮细胞的毛囊原基及生物适应性水凝胶,所述毛囊原基规则地且以与哺乳动物的毛孔的密度相同的密度配置于所述生物适应性水凝胶上。
根据本实施方式的含毛囊组织薄片,能够简便地再生规则且高密度的毛囊组织。
本实施方式中,间充质细胞及上皮细胞可举出与上述的间充质细胞及上皮细胞相同的细胞。并且,本实施方式中,含毛囊组织薄片中,上述毛囊原基可分化而形成毛囊。
本说明书中,“生物适应性水凝胶”表示具有对生物体的适应性的凝胶且高分子通过化学键连接形成网格结构,在该网格结构保有大量的水的物质。更具体而言,是指对来源于天然物的高分子或合成高分子的人工原材料导入交联来使其凝胶化的物质。
作为来源于天然物的高分子,可举出凝胶化的细胞外基质成分等。作为凝胶化的细胞外基质成分,例如,胶原蛋白(I型、II型、III型、V型、XI型等)、由小鼠EHS肿瘤提取物(包含IV型胶原蛋白、层连蛋白、硫酸类肝素蛋白多糖等)重构的基底膜成分(商品名:Matrigel)、纤维蛋白、氨基聚糖、透明质酸、蛋白聚糖等。作为其他来源于天然物的高分子,还能够使用明胶、琼脂、琼脂糖等。能够选择各个最适于凝胶化的盐等成分、其浓度、pH等来制作水凝胶。并且,也可组合这些原料。
并且,作为合成高分子,可举出聚丙烯酰胺、聚乙烯醇、甲基纤维素、聚氧乙烯、聚(II-羟乙基甲基丙烯酸酯)/聚己酸内酯(poly(II-hydroxyethylmethacrylate)/polycaprolactone)等。并且,还能够利用2种以上的这些高分子来制作水凝胶。
其中,生物适应性水凝胶优选为来源于天然物的高分子,更优选为凝胶化的细胞外基质成分,进一步优选为胶原蛋白(尤其是I型胶原蛋白)。通过含有胶原蛋白,成为更接近皮肤的组成,能够实现高毛囊再生效率。
本实施方式中,优选上述毛囊原基规则地且以与哺乳动物的毛孔的密度相同的密度配置于上述生物适应性水凝胶上。规则表示毛囊原基以等间隔配置的状态,和哺乳动物的皮肤上的毛孔与毛孔的间隔相同程度即可。并且,关于与哺乳动物的毛孔的密度相同的密度,具体而言,优选为20个/cm2以上且500个/cm2以下,更优选为50个/cm2以上且250个/cm2以下,进一步优选为100个/cm2以上且200个/cm2以下。通过密度在上述范围,能够再生更准确地重现正常的毛囊组织的配置的毛囊组织。
<含毛囊组织薄片的制造方法>
一实施方式中,本发明提供一种含毛囊组织薄片的制造方法,其具备:在由规则配置的微小凹部构成的微凹板播种间充质细胞及上皮细胞,进行混合培养,由此形成毛囊原基的工序;及将形成于所述微小凹部内的毛囊原基转印于生物适应性水凝胶的工序。
根据本实施方式的制造方法,能够简便地获得规则且高密度的含毛囊组织薄片。
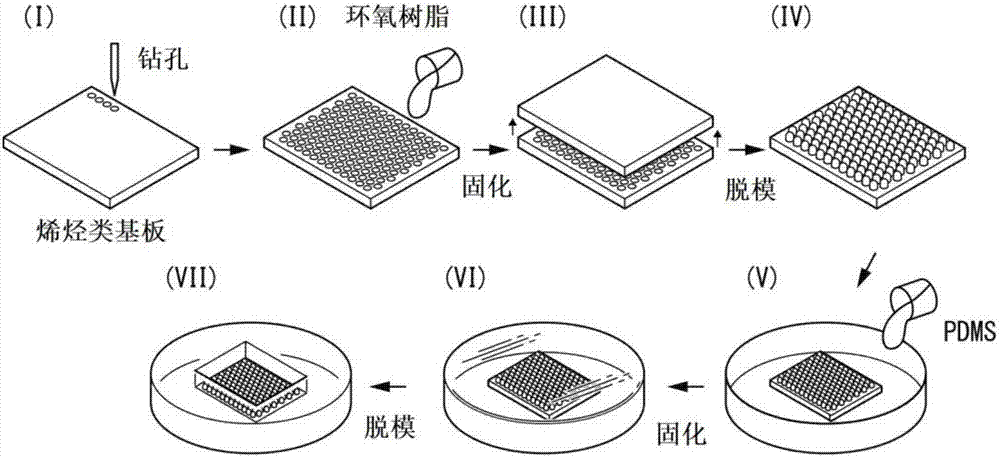
图1是表示本实施方式中的含毛囊组织薄片的制造方法的一例的概略图。以下,参考图1,对本实施方式中的含毛囊组织薄片的制造方法进行详细说明。
[微凹板]
如上所述,在制造含毛囊组织薄片时使用的微凹板3优选为规则地配置有多个微小凹部4的微凹板。微凹板3可使用市售的微凹板,也可通过后述的实施例1的方法等制作。并且,微凹板3中的微小凹部4的密度优选为20个/cm2以上且500个/cm2以下,更优选为50个/cm2以上且250个/cm2以下,进一步优选为100个/cm2以上且200个/cm2以下。通过密度在上述范围,能够获得以与哺乳动物的毛孔的密度相同的密度配置有毛囊原基的含毛囊组织薄片。
并且,对于微小凹部的开口形状,并无特别限定。例如,可举出与上述形状相同的形状,其中,从接近毛孔的形状观点考虑,优选为圆形状。
对于微小凹部的开口部的直径及深度,只要是能够容纳并培养间充质细胞1及上皮细胞2的混合球体的大小,则并无特别限定,对于直径,可以是与哺乳动物的毛孔相同程度的大小,例如,可以是20μm以上且1mm以下。并且,对于深度,从移植含毛囊组织薄片之后的向受试动物的皮肤的固定的观点考虑,可以为1mm以下。
所获得的含毛囊组织薄片中的毛囊原基的配置及大小依赖于微凹板3的微小凹部4的开口形状、直径及深度等,因此结合受试动物的种类、所移植的部位等,适当制备微凹板3的微小凹部4即可。
微凹板的材质只要是适于细胞培养的材质即可,并无特别限定。例如,可举出透明的玻璃、聚合物材料等。其中,优选为透氧性高的聚合物材料,更具体而言,可举出氟树脂、硅酮橡胶(例如,聚二甲基硅氧烷(poly(dimethyl siloxane):PDMS)等)等。
可单独使用这些材质,也可组合来使用。
[毛囊原基形成工序]
与上述<再生毛囊原基的集合体的制造方法>相同地,首先,将间充质细胞1及上皮细胞2的混合球体播种在微凹板3,并进行混合培养,由此形成毛囊原基。此时,所播种的细胞越多,毛囊原基的形成效率越高,毛囊原基的大小也变越大,但所播种的细胞数根据微凹板3的微小凹部4的大小适当调整即可。培养时间可以是1天以上且5天以下(优先为3天),培养温度可以是25℃以上且低于40℃(优选为37℃)。
在间充质细胞1及上皮细胞2的混合球体中形成毛囊原基的流程如上所述。而且,本实施方式的制造方法中,毛囊原基可分化而形成毛囊。
本实施方式的制造方法中,间充质细胞1可举出与上述间充质细胞相同的细胞。并且,上皮细胞可举出与上述上皮细胞相同的细胞。
作为细胞的来源,优选为来源于动物的细胞,更优选为来源于脊椎动物的细胞,尤其优选为来源于人的细胞。
在共培养间充质细胞1及上皮细胞2的混合球体时使用的培养基并无特别限定,可举出与上述培养基相同的培养基。
[转印工序]
接着,去除培养基,添加包含生物适应性水凝胶的溶液来使生物适应性水凝胶凝胶化。溶液中的生物适应性水凝胶的浓度能够根据所需要的凝胶的硬度适当调整。并且,对于用于使其凝胶化的时间,也能够根据所需要的凝胶的硬度适当调整。对于使其凝胶化的温度等条件,并无特别限定,例如可举出在37℃的CO2培养器内培养的方法等。
接着,通过从微凹板取下包含毛囊原基的凝胶化的生物适应性水凝胶,获得含毛囊组织薄片。
本实施方式的制造方法中,生物适应性水凝胶可举出与上述的生物适应性水凝胶相同的水凝胶。其中,生物适应性水凝胶优选为来源于天然物的高分子,更优选为凝胶化的细胞外基质成分,进一步优选为胶原蛋白(尤其是I型胶原蛋白)。通过使用胶原蛋白,成为更接近皮肤的组成,能够实现高毛囊再生效率。
包含生物适应性水凝胶的溶液可含有Ham’s Nutrient Mixtures F-10或Ham’s Nutrient Mixtures F-12等无血清培养基、或生物适应性水凝胶重构用缓冲液(例如,由氢氧化钠、碳酸氢钠、HEPES-Buffer构成的缓冲液等)等。
本实施方式的制造方法中,使生物适应性水凝胶凝胶化时,为了加强凝胶的强度,可使其内含支撑体。
作为支撑体的材质,只要是能够在移植之后促进毛囊原基的上皮细胞侧的部分与受试动物侧的上皮细胞的连结的材质,并无特别限定。例如,能够举出通过尼龙等聚合物或合成或天然的活体能够吸收的聚合物制作的纤维、不锈钢等金属纤维、碳纤维及玻璃纤维等化学纤维、以及天然的动物纤维(来源于活体的毛发等)或植物纤维等,更具体而言,能够举出尼龙线或不锈钢线等。支撑体的直径及长度能够根据成为再生对象的部分适当设计。直径例如可以是5μm以上100μm且以下,也可以是20μm以上且50μm以下。并且,长度例如可以是1mm以上且10mm以下,也可以是4mm以上且6mm以下。
<再生毛囊原基的集合体的移植方法>
一实施方式中,本发明提供一种再生毛囊原基的集合体的移植方法,其具备:在由规则配置的微小凹部构成的微凹板播种间充质细胞及上皮细胞,并进行混合培养,由此形成毛囊原基的工序;及保持所述微小凹部的规则的配置的同时将所述毛囊原基移植到受试动物的毛囊缺损部的工序。
根据本实施方式的移植方法,能够简便地再生规则且高密度的毛囊组织。
[毛囊原基形成工序]
与上述<再生毛囊原基的集合体的制造方法>相同地,将间充质细胞及上皮细胞的混合球体播种到微凹板,并进行混合培养,由此形成毛囊原基。
[移植工序]
例如,用具有作为与上述微小凹部相同的规则的配置的多个芯片、针头或喷嘴的多吸液管吸引在规则配置的微小凹部内形成的毛囊原基。接着,对受试动物的毛囊缺损部,以规则的配置的状态原样移植毛囊原基。通过保持规则的配置,能够再生更准确地重现正常的毛囊组织的配置的毛囊组织。多吸液管可以是手动的多吸液管也可以是全自动的多吸液管。
本说明书中,关于“多吸液管”,只要在前端具有多个芯片、针头或喷嘴,以与上述微小凹部相同的规则的配置具备芯片、针头或喷嘴,并能够吸引及排出由间充质细胞及上皮细胞构成的毛发原基,则并无特别限定。材质只要不是对细胞有害的材质,则并无特别限定,并且,安装于多吸液管的芯片、针头或喷嘴的前端的口径只要是能够插入到微凹板的微小凹部的程度的大小,则并无特别限定。
<含毛囊组织薄片的移植方法>
本实施方式的含毛囊组织薄片能够通过本领域技术人员公知的方法移植到成为对象的部位。例如,能够使用利用Shapiro式毛发移植术或Choi式毛发移植设备的植毛、利用气压的Inplanta等进行移植。Shapiro式毛发移植术是在用微型手术刀等对移植部位制造出移植创口之后,利用镊子进行移植的方法。
本实施方式的含毛囊组织薄片的大小考虑受检动物(包含人或非人动物的各种哺乳动物,优选为人)的年龄、性别、症状、治疗部位、治疗时间等而适当调节。
并且,作为移植深度,能够根据成为再生对象的部位适当变更。例如,可以是0.05mm以上且5mm以下,可以是0.1mm以上且1mm以下,可以是0.3mm以上且0.5mm以下。并且,作为所移植的部位,优选移植到受试动物的真皮层内,进一步优选设为比毛囊形成时及之后的毛发生长效率优异的真皮及皮下组织的边界面更靠上方。并且,若以毛囊原基的上皮细胞成分的上端部露出于移植创口上端部的方式调节移植深度,则还能够提高与受试动物的上皮细胞的连续性,因此优选。
本实施方式的含毛囊组织薄片中,可通过皮肤接合用胶带或固定带、缝合等,固定含毛囊组织薄片与移植对象部位。
本实施方式的含毛囊组织薄片中,内含上述支撑体时,移植再生器官原基之后不久,在确保受试动物的上皮细胞与毛囊原基的靠上皮细胞的一侧的连续性之后,能够从移植部位拔出。能够根据移植后的状态适当设定,但例如优选在移植后3天至7天内从移植部位拔出。
或者,还能够搁置支撑体,直至其自然地从移植部位脱落。关于活体吸收性的材料的支撑体,自然地从移植部位脱落或能够将其搁置直至被分解或吸收。
并且,本实施方式的含毛囊组织薄片中,内含上述支撑体时,毛囊原基的来源于上皮细胞的细胞沿着支撑体伸长。由此,能够提高移植后的受试动物侧的上皮细胞与毛囊原基的上皮细胞侧的连续性。尤其,支撑体维持在比移植部位的表皮更靠外侧时,受试动物侧的上皮细胞沿着支撑体向移植部位的内侧伸长,以排出异物,因此能够进一步提高连续性。而且,能够促进向目标方向的毛囊形成。其结果,能够提高来自毛囊原基的毛发生长率,并且还能够控制毛发生长方向。
<毛囊组织的再生治疗方法>
并且,本发明的一方面提供一种用于治疗由疾病或事故等引起的表皮的缺损或脱毛等毛发缺损部位的再生毛囊原基的集合体。
并且,本发明的一方面提供一种用于治疗由疾病或事故等引起的表皮的缺损或脱毛等毛发缺损部位的含毛囊组织薄片。
并且,本发明的一方面提供一种用于制造用于治疗由疾病或事故等引起的表皮的缺损或脱毛等毛发缺损部位的再生毛囊原基的集合体的方法。
并且,本发明的一方面提供一种用于制造用于治疗由疾病或事故等引起的表皮的缺损或脱毛等毛发缺损部位的含毛囊组织薄片的方法。
并且,本发明的一方面提供一种包含治疗有效的量的再生毛囊原基的集合体的药物组合物。
并且,本发明的一方面提供一种包含治疗有效的量的含毛囊组织薄片的药物组合物。
并且,本发明的一方面提供一种包含所述药物组合物的毛囊再生治疗剂。
并且,本发明的一方面提供上述再生毛囊原基的集合体在制造包含所述药物组合物的毛囊再生治疗剂方面的使用。
并且,本发明的一方面提供上述含毛囊阻止薄片在制造包含所述药物组合物的毛囊再生治疗剂方面的使用。
并且,本发明的一方面提供一种治疗由疾病或事故等引起的表皮的缺损或脱毛等毛发缺损部位的方法,其包含将有效量的上述再生毛囊原基的集合体移植到需要治疗的患者的步骤。
并且,本发明的一方面提供一种治疗由疾病或事故等引起的表皮的缺损或脱毛等毛发缺损部位的方法,其包含将有效量的上述含毛囊组织薄片移植到需要治疗的患者的步骤。
本说明书中,作为包含能够再生的毛囊组织的组织,只要是欲使毛囊再生、进而使毛发再生的身体表皮,则并无特别限定,例如可举出头皮等。
并且,作为能够适用的疾病,是伴随脱毛的任意疾病,例如,雄激素性脱发症(Androgenetic Alopecia:AGA)、女性雄激素源性脱发症(Female And rogenetic Alopecia:FAGA)、产后脱发症、弥漫性脱发症、脂溢性脱发症、糠疹性脱毛症(alopecia pityroides)、牵引性脱发症、代谢异常性脱发症、压迫性脱发症、斑秃、神经性脱发症、拔毛症、全身性脱毛症、症状性脱发症等,但并不限定于这些。
作为治疗对象,并无特别限定,可举出包含人或非人动物的哺乳动物,优选为人。
实施例
以下,举出实施例,对本发明进行更详细的说明,但本发明并不限定于这些实施例。
[实施例1]含小鼠毛囊组织薄片的制作
(1)微凹板的制作
微凹板的制作方法的概略图示于图2A。具体而言,利用CAD软件(V Carve Pro 6.5),用计算机设计了所制作的微凹板的图案。接着,利用切削机,按所设计的图案切削烯烃类基板,由此制作了具有图案的凹模(工序(I))。对该凹模注入环氧树脂(水晶树脂:NISSIN RESIN Co.,Ltd.制)(工序(II)),使其固化1天之后(工序(III))脱模,由此形成了具有图案的凸模(工序(IV))。接着,将所形成的凸模固定于6cm盘底面,注入聚二甲基硅氧烷(PDMS)(工序(V)),并固化(工序(VI))。接着,通过脱模制作了在PDMS形成有规则的图案的微凹板(工序(VII))。另外,结合日本人的头发的平均毛囊密度来制作了微凹板的图案设计。将所制作的微凹板示于图2B。形成了在高度1cm、2×2cm见方的容器的底面,以约100孔/cm2的密度配置有直径约1mm、高度500μm的孔的容器。
(2)毛囊原基的形成
从胎龄18天的C57BL/6小鼠采集了上皮细胞及间充质细胞。接着,在已进行泊洛沙姆处理的微凹板添加1mL(1×104个细胞/孔)的所采集的上皮细胞及间充质细胞的细胞混合悬浮液,并培养了3天。培养基使用了以1:1混合的达尔伯克改良依格尔培养基(Dulbecco’s Modified Eagle Medium;DMEM)(含有10%胎牛血清(Fetal Bovine Serum;FBS)、1%青霉素/链霉素(P/S))与HuMedia-KG2培养基(KURABO INDUSTRIES LTD.制)的培养基(以下,还称作“DMEM-KG2混合培养基”)。每天进行培养基更换。
(3)向胶原蛋白凝胶的转印
微凹板形成的毛囊原基向胶原蛋白凝胶的转印方法的概略图示于图3(A)。从形成有毛囊原基的微凹板(工序[a])除去培养基,添加1mL在4℃下冷却30分钟的胶原蛋白凝胶溶液(Nitta Gelatin Inc.制),将无菌纱布作为支撑体而内含在凝胶内(工序[b])。接着,用跷跷板式搅拌器搅拌的同时,在4℃下经50分钟,使凝胶平整。接着,在CO2培养器中,在37℃下静置40分钟。而且,添加DMEM-KG2混合培养基,在CO2培养器中,在37℃下静置了1小时。接着,挑起容器的一端来剥离凝胶,由此在保持毛囊原基的规则的配置的状态下转印于胶原蛋白凝胶,从而制作了含小鼠毛囊组织薄片(工序[c])。用相位差显微镜观察工序[a]~[c]中的胶原蛋白凝胶的结果示于图3(B)。图3(B)中,黑色箭头表示毛囊原基。
[试验例1]通过移植而再生的毛囊组织的评价试验
(1)含小鼠毛囊组织薄片的移植
在裸鼠(ICR nu/nu小鼠、5周龄)的皮肤上制作了移植创口。接着,结合移植部,修剪在实施例1中制作的含小鼠毛囊组织薄片,并插入到裸鼠的皮肤中。从移植起14天后的再生毛发的情况示于图4。
(2)结果与考察
从移植部确认到毛发生长,毛发规则地以1~3mm间距生长。而且,将所移植的毛囊原基固定于组织内,并且反复了毛发循环(毛发生长→脱毛→毛发生长)。
从以上情况,确认所移植的含小鼠毛囊组织薄片形成了正常的毛囊。
[实施例2]小鼠再生毛囊原基的制作与移植
(1)微凹板的制作
利用与实施例1(1)相同的方法制作了微凹板。
(2)再生毛囊原基的制作
从妊娠小鼠(C57BL/6jjcl、妊娠第2周)采集1.5×107个细胞的间充质细胞与1.5×106个细胞的上皮细胞。接着,向1ml包含间充质细胞的悬浮液中添加5μL的Vybrant(注册商标)细胞标记溶液(Molecular probes公司制),培养20分钟,对细胞进行了染色。接着,进行离心分离,去除上清液之后,添加DMEM-KG2混合培养基,以表1所示的细胞密度将间充质细胞及上皮细胞播种到微凹板。
[表1]
(显微镜观察)
在从培养开始起第1、2、3天,用相位差荧光显微镜观察培养中的间充质细胞及上皮细胞的混合细胞集块(以下,还称作“混合球体”)。
以明视场进行的从培养开始起第1天的细胞的观察结果示于图5A,以暗视场进行的从培养开始起第1天及第3天的观察结果示于图5B。
(DAPI染色)
从培养开始起第1、2、3天的混合球体在4%低聚甲醛固定液中浸渍1小时来固定。接着,添加DAPI(4’,6-diamidino-2-phenylindole)染色液(WAKO Corportion Limited.制),温育10分钟来对核进行染色。利用相位差荧光显微镜观察了所染色的混合球体。以暗视场进行的从培养开始起第3天的观察结果示于图5C(是记载为“Microscope”的图像)。图5C中,Nuclei表示通过DAPI染色为蓝色的核,Dermal表示通过Vybrant(注册商标)细胞标记溶液染色为红色的间充质细胞。
(ALP染色)
从培养开始起第1、2、3天的混合球体在柠檬酸丙酮固定液中浸渍30秒来固定。接着,添加固蓝(Fast blue)RR盐(Sigma Corportion制)与萘酚AS-BS(Sigma Corportion制)的混合液,温育30分钟来对碱性磷酸酶(alkaline phosphatase;ALP)进行染色。利用相位差荧光显微镜观察所染色的混合球体。将以明视场进行的从培养开始起第3天的观察结果示于图5C(是记载为“ALP”的图像)。
(SEM观察)
将从培养开始起第1、2、3天的混合球体在4%低聚甲醛固定液中浸渍1小时来固定。接着,添加乙醇并使其脱水之后,取代为叔丁醇。接着,使其冷冻干燥之后,用扫描电子显微镜(Scanning Electron Microscope;SEM)进行了观察。将从培养开始起第3天的观察结果示于图5C(是记载为“SEM”的图像)。
(3)小鼠皮下移植
将从培养开始起第3天的混合球体直接注入到裸鼠(ICR nu/nu小鼠、5周龄)的皮下来移植。将从移植起第14天的裸鼠的情况示于图6A,将第21天的裸鼠情况示于图6B。并且,将表示从移植起第18天的裸鼠的移植部周围的毛发的再生根数(参考图7A)与再生效率(=毛发生长部/移植部×100(%))(参考图7B)的曲线图示于图7A及图7B。而且,将从移植起第18天、第30天、第42天、第57天的裸鼠的移植部的情况示于图8。图8中,D18表示从移植起第18天,D30表示从移植起第30天,D42表示从移植起第42天,D57表示从移植起第57天。
(4)结果与考察
从图5A及图5B确认到,在从培养开始起第1天,以红色荧光表示的间充质细胞以覆盖上皮细胞的方式局部存在化,在从培养开始起第3天,上皮细胞与间充质细胞分别分离,形成了各自重叠的毛囊原基结构。
从图5C确认到,在从培养开始起第1天,混合球体分别形成上皮-间充质的2极化的结构,形成细胞数变得越少,2个球越密合的结构。并且,从ALP染色的结果得知,与细胞数无关地,间充质细胞被染色为紫色。
从以上内容,获得了以下启示,即,构成混合球体的间充质细胞分化成毛乳头细胞,并且开始毛囊形成及毛干新生。并且,示出此次制作的混合球体具有毛干新生能力,形成了“再生能力高的毛乳头”。
从图6A明确可知,在所有的混合球体中形成了像痣一样的发黑的部分,呈现出细胞数越大,该形成效率越高,其大小也越大的趋势。
从图6B确认到,在移植后第21天,观察到从发黑的部分生长出了毛发。
从图7A及图7B确认到,存在以下趋势,即,越是细胞数大的移植体,从移植部生出的根数越多,再生效率高。
图8示出从所移植的混合球体生长出毛发的毛反复毛发循环。并且,确认到毛发循环以与生物体大致相同的3星期左右反复。
[试验例2]小鼠再生毛囊的评价试验
(1)再生毛囊的染色
为了确认所制作的混合球体是否形成了具有与生物体相同的结构的毛囊,通过冷冻切片的免疫组织化学染色,对在毛囊上皮干细胞特异地显现的CD34与由毛乳头细胞产生的Versican进行了染色。以下,对具体的染色方法进行说明。
(切片的制作)
将利用与实施例2(2)相同的方法制作的混合球体,利用与实施例2(3)相同的方法移植到裸鼠。切除了移植后第18天的裸鼠的移植部的皮肤。接着,在20%甲醛(WAKO Corportion Limited.制)浸渍1天,由此进行了组织的固定。接着,在10%、20%、30%蔗糖溶液(稀释WAKO Corportion Limite d.制的蔗糖来制备的溶液)分别各浸渍了1小时。对蔗糖取代的切片静静地注入冷冻组织切片制作用包埋剂(Optimal Cutting Temperature Compound:O.C.T Compound)(Sakura Finetek Japan Co.,Ltd.制),由此封入了混合球体。接着,利用低温切片机(cryomicrotome)剪切为微小的厚度。将所剪切的切片垂直地按压于载玻片来进行了转印。
(苏木精-曙红(Hematoxylin-Eosin:HE)染色)
对所获得的载玻片,滴加1mL的二甲苯并静置30分钟之后,去除了溶液。接着,滴加1mL的二甲苯,再重复了1次相同操作。接着,滴加1mL的100%乙醇并静置5分钟之后,去除了溶液。接着,滴加1mL的100%乙醇,再重复了1次相同的操作。接着,滴加1mL的90%乙醇溶液并静置5分钟之后,去除了溶液。接着,滴加1mL的70%乙醇溶液并静置5分钟之后,去除了溶液。接着,滴加1mL的蒸馏水并静置3分钟之后,去除了蒸馏水。接着,滴加1mL的迈耶·苏木素染色液并静置3分钟之后,去除了溶液。接着,在流水中浸渍13分钟来冲洗。接着,滴加1mL的曙红Y并静置4分钟之后,去除了溶液。接着,滴加1mL的90%乙醇溶液并静置1分钟之后,去除了溶液。接着,滴加1mL的100%乙醇溶液并静置1分钟之后,去除了溶液。接着,滴加1mL的100%乙醇并静置5分钟之后,去除了溶液。接着,滴加1mL的100%乙醇,再重复了1次相同的操作。接着,滴加1mL的二甲苯并静置5分钟之后,去除了溶液。最后,滴加1mL的二甲苯,再重复了1次相同的操作。载玻片干燥之后,留下少量的Mount Quick(密封剂),缓慢盖上微盖玻片,以避免气泡进入,由此进行了密封。将用相位差荧光显微镜(Olympus Corporation制、IX-71)观察的结果示于图9的(A)。
(免疫抗体染色)
在所获得的载玻片,滴加1mL的PBS并静置5分钟之后,去除了溶液(清洗)。接着,滴加1mL的PBS,再重复1次相同操作,并清洗。接着,滴加200μL的含5%脱脂乳的Dulbecco-磷酸缓冲盐水(Dulbecco’s Phosphate-Buffered Saline:D-PBS)并静置30分钟,进行了粘连。接着,将用D-PBS稀释成20μg/mL的对大鼠免疫的小鼠CD34抗体(Abcam plc.制)或对兔子免疫的小鼠Versican抗体(millipore公司制)作为一抗,在载玻片上滴加1mL,在4℃下温育一夜。接着,滴加1mL的含有0.1%Tween-20的PBS(PBS-T)并静置10分钟之后,去除了溶液(清洗)。重复了2次相同操作,并进行了清洗。将用D-PBS稀释成20μg/mL的兔抗鼠IgG抗体(Thermo Fisher Scientific Inc.制)或山羊抗兔IgG抗体作为二抗,对载玻片滴加200μL,用铝箔覆盖,在常温下温育1小时。接着,滴加1mL的含0.1%Tween-20的PBS-T并静置10分之后,去除了溶液(清洗)。重复了2次相同操作,并进行了清洗。接着,将用PBS稀释成10ng/mL的DAPI(4’,6-Diamidino-2-phenylindole)溶液对载玻片滴加200μL,并温育9分钟,由此进行了核染色。接着,滴加1mL的PBS并静置5分钟之后,去除了溶液(清洗)。接着,滴加1mL的PBS,再重复了1次相同操作,并进行了清洗。载玻片干燥之后,留下少量的Mount Quick(密封剂),缓慢覆盖微盖玻片,以避免气泡进入,由此进行了密封。将用相位差荧光显微镜(Olympus Corporation制、IX-71)观察的结果示于图9(B)(小鼠Versican抗体)及图9(C)(小鼠CD34抗体)。图9(C)中,凸出区域是存在生成毛的“毛囊干细胞”与生成色素的“色素干细胞”的部分,是负责向毛乳头发出毛发生长指令的部分。
(2)结果与考察
从图9(A)确认到,在没有毛囊的裸鼠的皮下新形成了毛组织。
从图9(B)及图9(C)确认到,Versican显现在毛球部,CD34显现在凸出区域,在与实际的毛囊相同的位置存在毛的干细胞组。
从以上内容,获得了混合球体能够再生与生物体相同的毛囊的启发。
[试验例3]利用透氧性及非透氧性微凹板的毛囊形成确认试验
通过对在实施例1(1)中制作的高透氧性的微凹板(以下,还称作“Oxyc hip”。)与以丙烯酸覆盖在实施例1(1)中制作的微凹板周围的非透氧性的微凹板(以下,还称作“Non-oxychip”)中形成的混合球体进行比较,分析了培养中的氧供给对毛囊形成带来的影响。以下,示出具体的试验方法。
(1)微凹板的制作
利用与实施例1(1)相同的方法制作了微凹板。还准备了在所制作的微凹板内,用丙烯酸覆盖周围来使氧不透过微凹板(Non-oxychip)。
(2)毛囊原基的制作
利用与实施例1(2)相同的方法,在Oxychip添加1mL(1×104cells/孔)的上皮细胞及间充质细胞的细胞混合悬浮液,并培养了3天。对于Non-oxychip,也同样播种细胞混合液,并培养了3天。
(显微镜观察)
利用与实施例2(2)相同的方法,对培养中的混合球体,在从培养开始起第1、2、3天利用相位差荧光显微镜进行了观察。将以明视场及暗视场进行的从培养开始起第3天的观察结果示于图10。
(切片的制作)
利用与试验例2(1)(切片的制作)相同的方法制作了混合球体的切片。
(HE染色)
利用与试验例2(1)(HE染色)相同的方法,对切片进行了染色。将用相位差荧光显微镜(Olympus Corporation制、IX-71)观察的结果示于图11。
(3)小鼠皮下移植
将从培养开始起第3天的混合球体,利用与实施例2(3)相同的方法直接注入到裸鼠(ICR nu/nu小鼠、5周龄)的皮下来进行了移植。将从移植起第18天的裸鼠的情况示于图12。
(4)结果与考察
从图10确认到,在Oxychip培养的混合球体通过重构上皮-间充质结构形成毛囊原基结构。另一方面,在Non-oxychip培养的混合球体中未观察到上皮-间充质结构的重构,确认到混合球体崩坏。
从图11确认到,使用Oxychip时,与显微镜观察相同地形成了正常的毛囊原基。并且,确认到使用Non-oxychip时,混合球体崩坏,大多数细胞的核中并未染色。由此能够推断,由于氧耗竭产生了坏死。
从图12确认到,用Oxychip制作的毛囊原基在从移植起第18天形成了毛发,而用Non-oxychip制作的毛囊原基未能再生毛发。
[实施例3]利用人毛乳头细胞与小鼠上皮细胞的再生毛囊原基的制作与移植
(1)微凹板的制作
利用与实施例1(1)相同的方法制作了微凹板。
(2)再生毛囊原基的制作
从妊娠小鼠(C57BL/6jjcl、妊娠第2周)采集了1.5×106个上皮细胞。接着,向1ml包含人毛乳头细胞(PromoCell GmbH制)的悬浮液中添加5μL的Vybrant(注册商标)细胞标记溶液(Molecular probes公司制),并培养20分钟,从而对细胞进行了染色。接着,进行离心分离,去除上清液之后,添加人毛乳头细胞增殖培养基(Follicle Dermal Papilla Cell Growth Medium;DPCGM)(PromoCell GmbH制)与HuMedia-KG2的1:1混合培养基,以表1所示的细胞密度将人毛乳头细胞及小鼠上皮细胞播种到微凹板及96孔板。
[表2]
(显微镜观察)
对培养中的人毛乳头细胞及小鼠上皮细胞的混合细胞集块(以下,还称作“混合球体”),在从培养开始起第1、3天利用相位差荧光显微镜进行了观察。
将从培养开始起第1天及第3天的以暗视场进行的对用96孔板培养的各细胞数的混合球体的观察结果示于图13A,将第3天的以明视场进行的对用微凹板培养的4.0×103个细胞/孔的混合球体的观察结果示于图13B,将第3天的以暗视场进行的对用微凹板培养的4.0×103个细胞/孔的混合球体的观察结果示于图13C。
(3)小鼠皮下移植
在裸鼠(ICR nu/nu小鼠、5周龄)(从Oriental Yeast Co.,ltd.购入)的皮下用眼科用刀(Ophthalmic Lance)20G(Alcon Japan Ltd.制)打开移植孔,利用微型吸移管,分别移植了从培养开始起第3天的用96孔板培养的各细胞数的混合球体。将用肉眼观察各细胞数的混合球体的从移植起第18天的裸鼠的移植部的结果示于图14A。并且,将表示各细胞数的混合球体的从移植起第18天的裸鼠的移植部周围的毛发的再生效率(=毛发生长部/移植部×100(%))及再生根数的曲线图分别示于图14B及图14C。
(4)结果与考察
从图13A发现了如下趋势,即,在从培养开始起第1天,以红色荧光表示的人毛乳头细胞以覆盖上皮细胞的方式局部存在,形成1个混合球体之后,在从培养开始起第3天,在球体内相同种类的细胞彼此集合。
并且确认到,在1.0×103个细胞/孔以上且8.0×103个细胞/孔以下时,小鼠上皮细胞与人毛乳头细胞分别分离,形成了各自重叠的毛囊原基结构。
另一方面,在16×103个细胞/孔以上时,形成了在小鼠上皮细胞块的周围融合有多个人毛乳头细胞块的1个混合球体。
并且,从图13B及图13C,对于用微凹板培养的混合球体,与用96孔板培养的混合球体相同,也观察到了自发的毛囊原基结构的形成。
从图14A确认到,在移植后第18天,在移植了4.0×103个细胞/孔以上的细胞数的混合球体的移植部,观察到了毛发生长。
并且,从图14B及图14C确认到,在4.0×103个细胞/孔以上的细胞数的混合球体的移植体,平均再生效率及平均再生根数并不依赖于构成毛囊原基的细胞数,平均再生效率约为40%左右,并且,平均再生根数约为1~2根。
[试验例4]利用人毛乳头细胞的再生毛囊的评价试验
(1)再生毛囊的染色
为了确认利用人毛乳头细胞制作的混合球体是否形成了具有与生物体相同的结构的毛囊,利用抗Nuclei抗体(clone235-1)及Histofine小鼠染色试剂盒,通过冷冻切片的免疫组织化学染色进行了染色。以下,对具体的染色方法进行说明。
(HE染色用切片的制作)
将利用与实施例3(2)相同的方法制作的混合球体,利用与实施例3(3)相同的方法移植到裸鼠。切出移植后第18天的裸鼠的移植部的皮肤。接着,在Bouin固定液(苦味酸饱和水溶液15mL、20v/v%甲醛5mL、及冰醋酸1mL的混合溶液)中浸渍1天,由此进行了组织的固定。接着,在70、90、100v/v%乙醇、100v/v%乙醇及2-丁醇的1:1混合溶液、2-丁醇、2-丁醇及石蜡的1:1混合溶液、以及石蜡中分别浸渍1小时之后,制作了石蜡块。接着,用旋转式切片机剪切成微小的厚度,制作了石蜡切片。将所剪切的切片垂直按压于载玻片,由此进行了转印。
(HE染色)
利用与试验例2(1)(HE染色)相同的方法,对切片进行了染色。将用相位差荧光显微镜(Olympus Corporation制、IX-71)观察的结果示于图13A。
(免疫抗体染色用切片的制作)
将利用与实施例3(2)相同的方法制作的混合球体,利用与实施例3(3)相同的方法移植到裸鼠。切出移植后第18天的裸鼠的移植部的皮肤。接着,在10%甲醛(WAKO Corportion Limited.制)中浸渍1天,由此进行了组织的固定。接着,在70、90、100v/v%乙醇、100v/v%乙醇及2-丁醇的1:1混合溶液、2-丁醇、2-丁醇及石蜡的1:1混合溶液、以及石蜡中分别浸渍1小时之后,制作了石蜡块。接着,用旋转式切片机剪切为微小的厚度,制作了石蜡切片。将所剪切的切片垂直地按压于载玻片,由此进行了转印。
(免疫抗体染色)
对所获得的载玻片,利用抗Nuclei抗体(clone235-1)(millipore公司制)及Histofine小鼠染色试剂盒(NICHIREI CORPORATION.制),进行了来源于人的细胞的免疫染色。将利用相位差荧光显微镜(Olympus Corporation制、IX-71)观察的结果示于图15B。
(毛的角质层结构的观察)
为了确认毛的角质层结构,将利用扫描电子显微镜(Scanning Electron Microscope;SEM)观察移植4.0×103个细胞/孔的细胞数的混合球体之后第18天的裸鼠的移植部的结果示于图15C。
(2)结果与考察
从图15A及图15B确认到,移植部中形成有毛囊,并且,所形成的毛乳头由来源于人的细胞构成。
从图15C确认到具有角质层结构的毛的再生。
通过以上内容,示出了通过将利用人毛乳头细胞的毛囊原基移植到免疫缺陷小鼠,能够从小鼠皮下再生毛发。
产业上的可利用性
根据本发明,能够简便地获得规则且高密度的再生毛囊原基的集合体。
符号的说明:
1-间充质细胞,2-上皮细胞,3-微凹板,4-微小凹部,5-毛囊原基,6-培养基,7-生物适应性水凝胶,8-含毛囊组织薄片。
- 还没有人留言评论。精彩留言会获得点赞!