免疫调控的制作方法
本发明涉及能够积极调控炎性病症并可用于治疗或预防药物中的微生物。
背景技术:
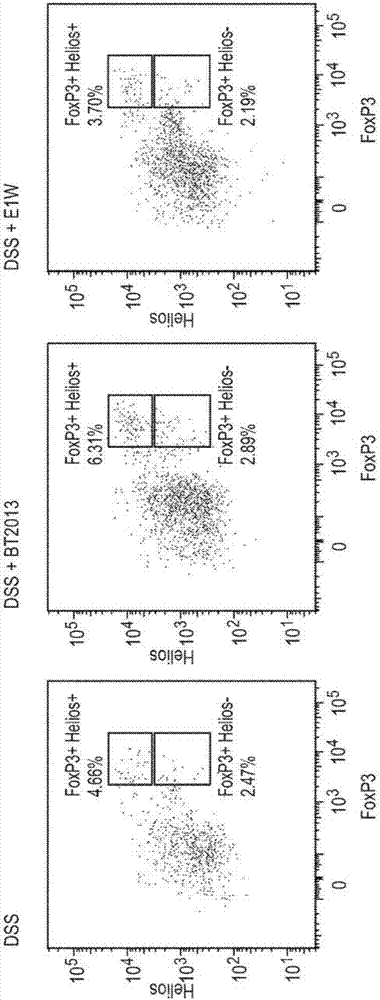
:多形拟杆菌(Bacteroidesthetaiotaomicron)在体外和体内都具有有效的抗炎作用(Kelly等人,Commensalanaerobicgutbacteriaattenuateinflammationbyregulatingnuclear-cytoplasmicshuttlingofPPAR-gammaandRelA.NatImmunol.2004Jan;5(1):104-12)。它调控NF-κB的分子信号转导途径(Kelly等人,Commensalanaerobicgutbacteriaattenuateinflammationbyregulatingnuclear-cytoplasmicshuttlingofPPAR-gammaandRelA.NatImmunol.2004Jan;5(1):104-12)。特别地,它阻止NF-κB的活性成分(RelA)与细胞核中关键基因的结合,从而阻止促炎症途径的激活(Kelly等人,Supra2004)。Gordon团队(美国华盛顿大学医学院)在2003年对多形拟杆菌的全基因组进行了测序和注释(Xu等人,Agenomicviewofthehuman-Bacteroidesthetaiotaomicronsymbiosis.Science.2003Mar28;299(5615):2074-6)。技术实现要素:本发明基于以下发现:多形拟杆菌(BT)的菌株对于炎性疾病具有令人惊奇的治疗效果。因此,BT的菌株可用作抵抗炎症和/或自身免疫性疾病和/或过敏性疾病的治疗性或预防性药物。根据本发明的第一方面,其涉及以NCIMB登录号42341保藏的多形拟杆菌(Bacteroidesthetaiotaomicron)或其衍生物。根据本发明的第二方面,涉及一种营养补充剂,其包含如权利要求1所定义的多形拟杆菌,以及营养学上可接受的赋形剂、载体或稀释剂。根据本发明的第三方面,涉及包含如权利要求1所定义的多形拟杆菌的饲料、食品、膳食补充剂或食品添加剂。根据本发明的第四方面,涉及如权利要求1所定义的多形拟杆菌,权利要求2或3所定义的组合物,权利要求4或5所定义的药物组合物,权利要求6或7所定义的营养补充剂,权利要求8或9所定义的饲料、食品、膳食补充剂或食品添加剂的应用,用于调控受试者的组织或器官的炎症。根据本发明的第五方面,涉及如权利要求1所定义的多形拟杆菌,权利要求2或3所定义的组合物,权利要求4或5所定义的药物组合物,权利要求6或7所定义的营养补充剂,权利要求8或9所定义的饲料、食品、膳食补充剂或食品添加剂的应用,用于治疗和/或预防受试者的病症;其中所述病症是炎性疾病和/或自身免疫性疾病。根据本发明的第六方面,涉及如权利要求1所定义的多形拟杆菌,权利要求2或3所定义的组合物,权利要求4或5所定义的药物组合物,权利要求6或7所定义的营养补充剂,权利要求8或9所定义的饲料、食品、膳食补充剂或食品添加剂的应用,用于减少对受试者结肠的破坏,优选所述受试者患有IBD。根据本发明的第七方面,涉及如权利要求1所定义的多形拟杆菌,权利要求2或3所定义的组合物,权利要求4或5所定义的药物组合物,权利要求6或7所定义的营养补充剂,权利要求8或9所定义的饲料、食品、膳食补充剂或食品添加剂的应用,用于降低受试者的一种或多种细胞中的一种或多种促炎基因的表达。根据本发明的第八方面,涉及如权利要求1所定义的多形拟杆菌,权利要求2或3所定义的组合物,权利要求4或5所定义的药物组合物,权利要求6或7所定义的营养补充剂,权利要求8或9所定义的饲料、食品、膳食补充剂或食品添加剂的应用,用于增加消化道或消化道的一部分中调控性T细胞(Treg)的百分比。根据本发明的第九方面,涉及根据权利要求4或5所述的药物组合物的制造方法,所述方法包括将所述多形拟杆菌与药学上可接受的赋形剂、载体或稀释剂混合,其中在所述方法中所述多形拟杆菌任选是被包封的。根据本发明的第十方面,涉及一种用于调控受试者中组织或器官的炎症的方法,其中所述方法包括向受试者施用如权利要求1所定义的多形拟杆菌,权利要求2或3所定义的组合物,权利要求4或5所定义的药物组合物,权利要求6或7所定义的营养补充剂,权利要求8或9所定义的饲料、食品、膳食补充剂或食品添加剂。根据本发明的第十一方面,涉及一种用于治疗和/或预防受试者的炎性疾病和/或自身免疫性疾病的方法,其中所述方法包括向受试者施用如权利要求1所定义的多形拟杆菌,权利要求2或3所定义的组合物,权利要求4或5所定义的药物组合物,权利要求6或7所定义的营养补充剂,权利要求8或9所定义的饲料、食品、膳食补充剂或食品添加剂。根据本发明的第十二方面,涉及一种用于减少对受试者结肠的破坏的方法,其中所述方法包括向受试者施用如权利要求1所定义的多形拟杆菌,权利要求2或3所定义的组合物,权利要求4或5所定义的药物组合物,权利要求6或7所定义的营养补充剂,权利要求8或9所定义的饲料、食品、膳食补充剂或食品添加剂,优选地,其中所述手术者患有IBD。根据本发明的第十三方面,涉及一种用于降低受试者的一种或多种细胞中的一种或多种促炎基因的表达的方法,其中所述方法包括向受试者施用如权利要求1所定义的多形拟杆菌,权利要求2或3所定义的组合物,权利要求4或5所定义的药物组合物,权利要求6或7所定义的营养补充剂,权利要求8或9所定义的饲料、食品、膳食补充剂或食品添加剂。根据本发明的第十四方面,涉及一种用于增加消化道或消化道的一部分中的调控性T细胞(Treg)百分比的方法,其中所述方法包括向受试者施用如权利要求1所定义的多形拟杆菌,权利要求2或3所定义的组合物,权利要求4或5所定义的药物组合物,权利要求6或7所定义的营养补充剂,权利要求8或9所定义的饲料、食品、膳食补充剂或食品添加剂。根据本发明的第十五方面,涉及如权利要求1所定义的多形拟杆菌,权利要求2或3所定义的组合物,权利要求4或5所定义的药物组合物,权利要求6或7所定义的营养补充剂,权利要求8或9所定义的饲料、食品、膳食补充剂或食品添加剂在制造用于调控受试者的组织或器官的炎症的药物中的应用。根据本发明的第十六方面,涉及如权利要求1所定义的多形拟杆菌,权利要求2或3所定义的组合物,权利要求4或5所定义的药物组合物,权利要求6或7所定义的营养补充剂,权利要求8或9所定义的饲料、食品、膳食补充剂或食品添加剂在制造用于治疗和/或预防受试者的炎性疾病和/或自身免疫性疾病的药物中的应用。根据本发明的第十七方面,涉及如权利要求1所定义的多形拟杆菌,权利要求2或3所定义的组合物,权利要求4或5所定义的药物组合物,权利要求6或7所定义的营养补充剂,权利要求8或9所定义的饲料、食品、膳食补充剂或食品添加剂在制造用于减少对受试者结肠的破坏的药物的应用,优选其中受试者患有IBD。根据本发明的第十八方面,涉及如权利要求1所定义的多形拟杆菌,权利要求2或3所定义的组合物,权利要求4或5所定义的药物组合物,权利要求6或7所定义的营养补充剂,权利要求8或9所定义的饲料、食品、膳食补充剂或食品添加剂在制造用于降低受试者的一种或多种细胞中的一种或多种促炎基因的表达的药物中的应用。根据本发明的第十九方面,涉及如权利要求1所定义的多形拟杆菌,权利要求2或3所定义的组合物,权利要求4或5所定义的药物组合物,权利要求6或7所定义的营养补充剂,权利要求8或9所定义的饲料、食品、膳食补充剂或食品添加剂在制造用于增加消化道或消化道的一部分中的调控性T细胞(Treg)的百分比的药物中的应用。附图简要说明参照附图对本发明进行描述,其中:图1示出了在DSS诱导的结肠炎模型中,通过用多形拟杆菌菌株BT2013使Treg细胞增大,从而减轻结肠炎;图2示出了在正常小鼠体内,多形拟杆菌菌株BT2013不影响Treg细胞,但影响Teff细胞;图3示出了使用DSS给药、每天摄入或不摄入多形拟杆菌的小鼠回肠(a)和盲肠(b)中,髓过氧化物酶(MPO)活性;图4示出了用DSS(a)或DSS和多形拟杆菌(b)给药的雌性C57Bl/6小鼠的升结肠的组织病理学;图5示出了DSS诱导的结肠炎期间,用多形拟杆菌菌株E1和BT2013定殖(colonised)的小鼠的升结肠的平均组织病理组织评分;图6示出了用多形拟杆菌菌株E1、E2和BT2013处理的小鼠的升结肠中促炎基因(IL-1β和IL-6)和抗炎基因(IL-10)的表达;图7示出了用PMA和培养基或细菌细胞E1、E2和BT2013孵育的Caco-2细胞中IL-8的表达。发明详述本发明基于以下发现:与对照BT菌株相比,BT菌株BT2013具有更强的抗炎作用。BT菌株BT2013已于2014年12月3日以登录号42341保藏于工业、食品和海洋细菌国家保藏中心(NCIMB),NCIMBLtd,FergusonBuilding,CraibstoneEstate,Bucksburn,Aberdeen,UK,AB219YA。该保藏是根据布达佩斯条约的规定进行的。该保藏由GT生物有限公司(LifeSciencesInnovationBuilding,Aberdeen,AB252ZS,Scotland)制作。GT生物有限公司随后更名为4D药物研究有限公司。衍生物本发明包括所保藏菌株的衍生物。术语“衍生物”包括来自原始但以某种方式(包括遗传水平)改良的子菌株(子代)或培养的菌株(亚克隆),而对其生物活性没有负面影响,即衍生菌株将具有至少与原始BT2013菌株相同的免疫调控活性。生物型SEQIDNO:1提供了菌株BT2013的基因组序列。还预期,作为保藏号为NCIMB42341的细菌的生物型的细菌菌株对于治疗或预防炎性疾病和/或自身免疫性疾病和/或过敏性疾病是有效的。生物型是具有相同或非常相似的生理和生化特征的紧密相关的菌株。在某些实施方案中,用于本发明的细菌菌株具有这样的16srRNA序列,其与以登录号NCIMB42341而保藏的细菌的16srRNA序列具有至少95%、96%、97%、98%、99%、99.5%或99.9%的同一性。或者,可以通过对以保藏号NCIMB42341保藏的细菌的其他核苷酸序列进行测序来鉴定作为保藏号NCIMB42341保藏并且适用于本发明的细菌的生物型的菌株。例如,基本上可以对全基因组进行测序,并且用于本发明的生物型菌株可以与以NCIMB42341保藏的菌株在全基因组的至少80%(即,占全基因组的至少85%、90%、95%或99%,或者全基因组)具有至少95%、96%、97%、98%、99%、99.5%或99.9%的序列同一性。用于鉴定生物型菌株的其他合适的序列可以包括hsp60或重复序列,例如BOX、ERIC、(GTG)5或REP(Masco等人(2003)SystematicandAppliedMicrobiology,26:557-563)。生物型菌株可以具有这样的序列,其与以保藏号NCIMB42341保藏的细菌的相应序列具有至少95%、96%、97%、98%、99%、99.5%或99.9%的序列同一性。在某些实施方案中,用于本发明的细菌菌株具有与SEQIDNO:1具有序列同一性的基因组。在优选的实施方案中,用于本发明的细菌菌株具有这样的基因组,该基因组与SEQIDNO:1在其序列的至少60%(例如至少65%、70%、75%、80%、85%、95%、96%、97%、98%、99%或100%)上具有至少90%序列同一性(例如至少92%、94%、95%、96%、97%、98%、99%或100%的序列同一性)。例如,用于本发明的细菌菌株可以具有这样的基因组,该基因组与SEQIDNO:1在其序列的70%上具有至少90%的序列同一性,或者与SEQIDNO:1在其序列的80%上具有至少90%的序列同一性,或者与SEQIDNO:1在其序列的90%上具有至少90%的序列同一性,或者与SEQIDNO:1在其序列的100%上具有至少90%的序列同一性,或者与SEQIDNO:1在其序列的70%上具有至少95%的序列同一性,或者与SEQIDNO:1在其序列的80%上具有至少95%的序列同一性,或者与SEQIDNO:1在其序列的90%上具有至少95%的序列同一性,或者与SEQIDNO:1在其序列的100%上具有至少95%的序列同一性,或者与SEQIDNO:1在其序列的70%上具有至少98%的序列同一性,或者与SEQIDNO:1在其序列的80%上具有至少98%的序列同一性,或者与SEQIDNO:1在其序列的90%上具有至少98%的序列同一性,或者与SEQIDNO:1在其序列的100%上具有至少98%的序列同一性。或者,可以通过使用以登录号NCIMB42341保藏和限制性片段分析和/或PCR分析,例如通过使用荧光扩增片段长度多态性(FAFLP)和重复DNA元件(rep)-PCR指纹图谱或蛋白质分析,或部分16S或23srDNA测序,从而鉴定作为以保藏号NCIMB42341保藏并且适用于本发明的细菌的生物型的菌株。在某些实施方案中,以登录号NCIMB42341保藏并适用于本发明使用的细菌的生物型的菌株是当通过扩增的核糖体DNA限制性分析进行分析(ARDRA)(例如当使用Sau3AI限制酶时(例如,示例性方法和指导参见例如等人(2011)J.Microbiol.Methods,87(1):10-6))时提供与保藏号为NCIMB42341的细菌相同模式的菌株。或者,生物型菌株被鉴定为与以登录号为NCIMB42341保藏的细菌具有相同的碳水化合物发酵模式的菌株。可以使用任何合适的方法或策略来鉴定作为以登录号NCIMB42341保藏并且可用于本发明的组合物和方法的细菌的生物型的细菌菌株。例如,具有与以登录号NCIMB42341保藏的细菌相似的生长模式、代谢类型和/或表面抗原的细菌菌株可用于本发明。生物型菌株将具有与NCIMB42341菌株相当的免疫调控活性。例如,生物型菌株将对DSS诱导的结肠炎模型具有可媲美的效果,并且对Treg水平、MPO酶活性、炎症相关基因表达和结肠组织病理学也具有与在功能分析中所示的效果相当的效果,其可以通过使用功能分析中所描述的方案进行确定。疾病多形拟杆菌菌株BT2013可用于治疗和/或预防受试者的病症,其中所述病症是炎性疾病和/或自身免疫性疾病。在一个实施方案中,该病症影响消化道、消化道的一段、肝脏、肝细胞、免疫细胞、上皮细胞、表皮细胞、神经元细胞、内皮细胞、成纤维细胞、胰腺和/或胰腺细胞(如胰岛)。消化道的段(即部分)的实例包括食管、胃和肠(例如小肠(例如十二指肠、空肠和回肠)和/或大肠(例如盲肠、升结肠、横结肠、降结肠和乙状结肠))。上皮细胞的实例包括肠上皮细胞。免疫细胞的实例包括树突细胞、单核细胞/巨噬细胞、T细胞和嗜中性粒细胞。在一个实施方案中,所述病症选自由以下疾病构成的组中:1.器官相关疾病,如肠易激综合征(IBS),包括克罗恩病和溃疡性结肠炎的炎性肠病、坏死性小肠结肠炎、慢性肠炎、乳糜泻、多发性硬化(脑)、I型糖尿病、古德帕斯丘综合征、桥本甲状腺炎、慢性活动肝炎、心肌症、葡萄膜炎和鼻炎。2.全身性疾病,如类风湿性关节炎、系统性红斑狼疮、硬皮病、牛皮癣、特应性皮炎、白癜风、多发性硬化、斑秃、结节病、多发性肌炎及其组合。在一个方面中,该病症影响肠道。在一个方面中,该疾病是炎性疾病。例如,该疾病是诸如克罗恩病的炎性肠病(IBD)。在一个方面中,该疾病是自身免疫性疾病。例如,该自身免疫性疾病选自由溃疡性结肠炎、慢性肠炎、类风湿性关节炎、牛皮癣、多发性硬化、I型糖尿病、过敏(包括乳糜泻)、特应性皮炎和鼻炎所构成的组中。受试者在一个实施方案中,受试者为单胃哺乳动物。单胃哺乳动物的实例包括家禽、人类、大鼠、猪、狗、猫、马和兔。在另一个实施方案中,受试者为哺乳动物,例如单胃哺乳动物。单胃哺乳动物的实例包括杂食动物(例如人类、大鼠和猪),食肉动物(例如狗和猫)和食草动物(例如马和兔)。优选地,受试者为人类。一方面,受试者具有选自由以下疾病构成的组中的疾病:炎性肠病(IBD)、结肠炎、类风湿性关节炎、牛皮癣、多发性硬化、I型糖尿病、乳糜泻、特应性皮炎、鼻炎、肠易激综合征(IBS)、溃疡性结肠炎、肠炎、克罗恩病、功能性消化不良、特应性疾病、坏死性小肠结肠炎、非酒精性脂肪性肝病、胃肠道感染以及它们的组合。例如,受试者患有IBD。调控/调节在本文中术语“调控”和“调节”可以互换使用。在一个实施方案中,多形拟杆菌菌株BT2013用于调控受试者体内细胞、组织或器官的炎症。在一个实施方案中,术语“调控”是指增加和/或诱导和/或促进和/或激活。在可替代实施方案中,术语“调控”是指减少和/或减少和/或抑制。在一个实施方案中,术语“调节”是指上调。在可替代实施例中,术语“调节”是指下调。在一个实施方案中,如本文所述的多形拟杆菌菌株BT2013减轻细胞、组织或器官的炎症。例如,减轻消化道、消化道(例如肠)段(即部分)、肝脏、肝细胞、上皮细胞、表皮细胞、神经元细胞、内皮细胞、成纤维细胞、胰腺和/或胰腺细胞(如胰岛)的炎症。在一个实例中,消化道或其一部分(例如肠)的炎症减轻。在另一个实例中,组织或器官的免疫细胞的炎症减轻。在另一个实例中,组织或器官的上皮细胞的炎症减轻。本文所用的术语“炎症”是指以下一种或多种:由于免疫系统的过度反应而引起的炎性过程从而所导致的细胞、组织或器官的发红、肿胀、疼痛、压痛、热和功能紊乱。在一个实施方案中,当与用本文所述的菌株BT2013在施用给受试者之前,受试者体内发炎的细胞数量相比较时,施用本文所述的多肽或多核苷酸或宿主细胞之后,受试者体内发炎细胞的数量低至少10%、20%、30%、40%或50%。在一个实施方案中,当与用本文所述的菌株BT2013在施用给受试者之前,受试者体内发炎的组织或器官的量相比较时,施用菌株BT2013之后,受试者体内发炎的组织或器官的量低至少10%、20%、30%、40%或50%。在一个实施方案中,菌株BT2013减轻组织或器官的上皮细胞的炎症。例如,上皮细胞是消化道或其一部分(如肠)的上皮细胞。不希望受理论束缚,菌株BT2013增加受试者中T细胞(如调节性T细胞,也称为Treg)的产生。Treg数量的这种增加可能会与驱动炎症、自身免疫和过敏/特应性病症的其他效应T细胞(也称Teffs)(如Th1、Th17和Th2)的作用发生斗争(combat)。在克罗恩病和溃疡性结肠炎中,Teff/Treg细胞平衡丧失。在一个实施方案中,增加受试者中T细胞的产生,使得当与用本文所述的菌株BT2013在施用给受试者之前,受试者体内T细胞的数量相比较时,施用本文所述的多肽或多核苷酸或宿主细胞之后,受试者体内T细胞的数量增多至少10%、20%、30%、40%或50%以上,或者超过100%。肠道屏障完整性在一个实施方案中,菌株BT2013用于改善受试者的肠道屏障完整性。本文所用的术语“改善肠道屏障完整性”是指当与施用本文所述的菌株BT2013之前,受试者体内从肠道扩散到其他细胞的微生物的数量和/或种类相比较时,在施用BT2013菌株之后,受试者体内从肠道扩散到其他细胞的微生物的数量和/或种类减少。在一个实施方案中,当与施用之前,受试者体内从肠道扩散到其他细胞的微生物的数量相比较时,施用BT2013菌株之后,受试者体内从肠道扩散到其他细胞的微生物的数量减少至少10%、20%、30%、40%或50%。在一个实施方案中,当与施用之前,受试者体内从肠道扩散到其他细胞的微生物的数量相比较时,施用BT2013菌株后,受试者体内从肠道扩散到其他细胞的微生物的数量减少至少5%、10%、15%或20%。肠道破坏在一个实施方案中,菌株BT2013用于减少对受试者(例如患有IBD的受试者)的肠道(例如大肠)的破坏。本文使用的术语“对受试者的肠道的破坏”是指对粘膜上皮的完整性的影响和/或对上皮中杯状细胞数量的影响和/或对浸润到固有层中的免疫细胞数量的影响。在一个实施方案中,菌株BT2013减少或防止对粘膜上皮的完整性的破坏和/或减少或防止上皮中杯状细胞数量的减少和/或减少或防止免疫细胞浸润到固有层中。在一个实施方案中,减少对粘膜上皮的完整性的破坏是当与施用之前,受试者体内从肠腔穿过肠细胞的细菌的数量相比较时,施用BT2013菌株后,受试者体内从肠腔穿过肠细胞的细菌的数量减少至少5%、10%、15%或20%。在一个实施方案中,上皮中杯状细胞数量的减少是当与施用之前,受试者体内上皮中杯状细的胞数量相比较时,施用BT2013菌株后,受试者体内上皮中杯状细胞数量减少至少2%、5%、10%、15%或20%。在一个实施方案中,免疫细胞浸入固有层中的减少是指在固定时间内(例如24小时),当与施用之前,受试者体内穿过固有层的免疫细胞(例如,T细胞)的数量相比较时,施用BT2013菌株后,受试者体内穿过固有层的免疫细胞(例如,T细胞)的数量减少至少5%、10%、15%、20%或30%。促炎基因和屏障完整性基因在一个实施方案中,菌株BT2013用于调节受试者的一种或多种细胞中的一种或多种促炎基因和/或一种或多种屏障完整性基因的表达。在一个实施方案中,术语“调节”是指上调一种或多种促炎基因的表达。在可替代实施方案中,术语“调节”是指下调一种或多种促炎基因的表达。在一个实施方案中,菌株BT2013下调受试者的一种或多种细胞中的一种或多种促炎基因的表达。本文所用的术语“促炎基因”是指当其表达时促进炎症的基因。促炎基因的实例包括编码但不限于IL1-β、IL4、IL5、IL6、IL8、IL12、IL13、IL17、IL21、IL22、IL23、IL27、IFN、CCL2、CCL3、CCL5、CCL20、CXCL5、CXCL10、CXCL12、CXCL13和TNF-α的基因。在一个实施方案中,促炎基因选自由IL1-β、IL6和IL8构成的组。在一个实施方案中,一种或多种促炎基因的表达水平(例如mRNA水平)降低(即下调),使得在与施用前的受试者体内的水平相比较时,施用菌株BT2013后,表达水平至少降低10%、20%、30%、40%或50%。本文所用的术语“屏障完整性基因”是指当其表达时在肠道屏障的功能中起作用的基因,所述作用例如为修复屏障和防止微生物穿过屏障。屏障完整性基因的实例包括编码Retnlg|Retnlb、Si、Defa24、Hsd11b2、Hsd17b2和Nr1d1|Thra的基因。在一个实施方案中,术语“调节”是指上调一个或多个屏障完整性基因的表达。在可替代实施方案中,术语“调节”是指下调一个或多个屏障完整性基因的表达。在一个实施方案中,菌株BT2013上调受试者的一个或多个细胞中的屏障完整性基因的表达。在一个实施方案中,屏障完整性基因选自由Retnlg|Retnlb、Si、Defa24、Hsd11b2、Hsd17b2和Nr1d1|Thra构成的组中。在一个实施方案中,一个或多个屏障完整性基因的表达水平(例如mRNA水平)增加(即上调),使得在与施用前的受试者体内的水平相比较时,施用菌株BT2013后,表达水平至少升高10%、20%、30%、40%或50%以上。消化道消化道的一部分包括食管、胃和肠(例如小肠(例如十二指肠、空肠和回肠)和/或大肠(例如盲肠、升结肠、横结肠、降结肠、乙状结肠))。在此,术语“大肠”可以与术语“结肠”互换使用。在一个实施方案中,菌株BT2013用于改善受试者的消化道健康。本文所用的术语“改善消化道健康”是指降低消化道或其一部分的炎症水平和/或改善肠道微生物群。在一个实施方案中,当与施用BT2013之前受试者的消化道中的炎症水平相比时,在施用菌株BT2013之后,消化道中的炎症水平降低至少10%、20%、30%、40%或50%。在一个实施方案中,菌株BT2013用于改善受试者的肠道微生物群。本文所用的术语“肠道微生物群”是指在宿主动物的消化道中寄存的微生物。这些微生物具有各种各样的代谢、结构、保护和其他有益功能。如本文所使用的,术语“改善肠道微生物群”是指增加存在于受试者(例如宿主)的肠道中的所需微生物的数量和/或种类,和/或改善所述所需微生物的活性代谢、结构性、保护性等有益功能。术语“改善肠道微生物群”还可以指减少存在于受试者(例如宿主)的肠道内的不期望的微生物的数量和/或种类,和/或降低所述不期望的微生物的活性代谢、结构性、保护性以及其他有益功能。在宿主的肠道中所需的微生物是具有保护和有益功能的那些微生物。厚壁菌和拟杆菌是宿主肠中所需微生物的实例。在宿主肠中不期望的微生物是这样的微生物,它们可能干扰肠道中具有保护和受益功能的所需微生物的代谢性、结构性、保护性和其他有益功能。另外或替代地,不期望的微生物是引起例如炎症和/或腹泻的微生物。大肠杆菌(E.coli)是宿主肠中不期望的微生物的实例。例如,当将BT2013菌株施用于受试者时,在患有炎性肠道疾病(IBD)的受试者肠道中可能发生肠道内所需的微生物(例如厚壁菌和拟杆菌)和不需要的微生物(如大肠杆菌:ETEC、EPEC、EIEC、EHEC和EAEC)之间的微生物平衡的变化。在一个实施方案中,存在于受试者(例如宿主)的肠道中的所需微生物(例如厚壁菌和拟杆菌)的数量增加,使得与施用菌株BT2013之前受试者体内的微生物数量相比,施用菌株BT2013之后,微生物的数量至少多10%、20%、30%、40%或50%,或者大于100%。另外或可替代地,存在于受试者(例如宿主)的肠道中的所需的微生物(例如厚壁菌和拟杆菌)的种类增加,使得与施用菌株BT2013之前受试者体内的微生物数量相比,施用菌株BT2013之后,微生物的种类至少多2%、5%、10%或15%。在一个实施方案中,存在于受试者(例如宿主)的肠道中的不期望的微生物(例如大肠杆菌ETEC、EPEC、EIEC、EHEC和EAEC)的数量减少,使得与施用菌株BT2013之前受试者体内的不期望的微生物的数量相比,施用菌株BT2013之后,不期望的微生物的数量至少减少10%、20%、30%、40%或50%。另外或可替代地,存在于受试者(例如宿主)的肠道中的不期望的微生物(例如大肠杆菌ETEC、EPEC、EIEC、EHEC和EAEC)的种类减少,使得与施用菌株BT2013之前受试者体内的不期望的微生物的种类相比,施用菌株BT2013之后,不期望的微生物的种类至少减少1%、2%、5%或10%。包封在一个实施方案中,多形拟杆菌菌株BT2013被包封。在另一个实施方案中,包含菌株BT2013的药物组合物被包封。在另一个实施方案中,包含菌株BT2013的营养补充剂被包封。在另一个实施方案中,如本文所述的饲料、食品、膳食补充剂或食品添加剂被包封。如本文所用的术语“包封的”是指通过物理分离来保护菌株BT2013免受不相容环境损害的手段,这样其可以被递送到靶标位点(例如肠)而免受降解或明显的降解,从而使得菌株BT2013能够作用于靶标位点。实例为有肠溶包衣的胶囊或具有肠道耐抗性的胶囊。。即使包封的目的是将菌株与其环境分离,但在实施所需作用的时候保护性包衣或外壳必须破裂。通常通过应用化学和物理刺激(例如压力、酶攻击、化学反应和物理崩解),使保护性包衣或外壳破裂。例如,包封保证了菌株可以位于肠道,从而微生物可以以有效地在靶位点中产生起效的量而被传递至靶位点(例如,肠道)。药物组合物在一个实施方案中,药物组合物包括菌株BT2013的微生物和任选的药学上可接受的赋形剂、载体或稀释剂。药物组合物可以为任意药物组合物。在一个方面中,药物组合物将以口服、肠内或直肠施用。例如所述组合物可以为适合食用的组合物。“适合食用的”是指被允许用于人类或动物消耗的物质。在人类医学和兽医中,药物组合物可以用于人类或动物应用。用于本文所述多种不同形式的药物组合物的合适的赋形剂的实例可以在“HandbookofPharmaceuticalExcipients,2ndEdition,(1994),EditedbyAWadeandPJWeller”中找到。用于治疗应用的可接受的载体或稀释剂是制药领域公知的,并且在例如Remington'sPharmaceuticalSciences,Mack出版公司(A.R.Gennaroedit.1985)中有所描述。合适的赋形剂的实例包括乳糖、淀粉、葡萄糖、甲基纤维素、硬脂酸镁、甘露醇、山梨醇等。合适的稀释剂的实例包括水、乙醇、甘油、丙二醇和甘油,以及它们的组合中的一种或多种可以根据预期的施应用径和标准的药学实践来挑选药用的载体、赋形剂或稀释剂的选择。药物组合物可以包含任何合适的粘结剂、润滑剂、悬浮剂、包衣剂、增溶剂作为载体、赋形剂或稀释剂,或者除了载体、赋形剂或稀释剂以外,可以包含任何合适的粘结剂、润滑剂、悬浮剂、包衣剂、增溶剂。合适的粘结剂的实例包括淀粉、明胶、天然糖(例如葡萄糖)、无水乳糖、自由流动的乳糖、β-乳糖、谷物甜味剂、天然和合成树胶(例如阿拉伯树胶、黄芪胶或海藻酸钠)、羧甲基纤维素和聚乙二醇。合适的润滑剂的实例包括油酸钠、硬脂酸钠、硬脂酸镁、苯甲酸钠、醋酸钠、氯化钠等。药物组合物中可以具有防腐剂、稳定剂、染料、甚至是风味剂。防腐剂的实例包括苯甲酸钠、山梨酸和对羟基苯甲酸的酯。此外,还可以使用抗氧化剂和悬浮剂。在一个方面中,菌株BT2013药物组合物的微生物被包封。取决于使用和/或施用方式和/或给药方式,药物可以是溶液形式或固体形式。如本文所用,术语“药物”涵盖用于人类医学和兽医中人和动物应用的药物。此外,本文所用的术语“药物”是指提供治疗和/或有益效果的任何物质。本文所用的术语“药物”不一定限于需要营销批准的物质,而是可以包括可用于化妆品、营养品、食品(例如饲料和饮料)、益生菌培养物、营养补充剂和自然疗法的物质。此外,本文所用的术语“药物”包括设计用于包含于动物饲料中的产品,例如家畜饲料和/或宠物食品。营养补充剂营养学上可接受的载体、稀释剂和赋形剂包括适用于人类或动物消耗的那些,以及在食品工业中作为标准品使用的那些。典型的营养学上可接受的载体、稀释剂和赋形剂是本领域的技术人员所熟悉的。在一个实施方案中,营养补充剂包含菌株BT2013的微生物或包含表达载体的宿主细胞,该表达载体包含所述多核苷酸序列;和营养学上可接受的赋形剂、载体或稀释剂。在一个实例中,菌株BT2013的微生物被包封。饲料/产品本发明的另一方面涉及包含菌株BT2013的微生物的饲料、食品、膳食补充剂和食品添加剂。如本文所用的术语“饲料”、“食品”、“食品添加剂”和“膳食补充剂”意将涵盖可以为固体、成胶状的或液体的所有消费品。术语“食品”广义地使用,并且涵盖人类食物以及动物食物(即饲料)。在一个方面中,食品是供人食用的。食品的实例包括每日产品(如牛奶、奶酪、含乳清蛋白的饮料、乳饮、乳酸菌饮料、酸奶、饮用酸奶)、烘焙产品、饮料和饮料粉末。“饲料”、“食品”、“食品添加剂”和“膳食补充剂”可以是溶液或固体的形式,这取决于使用和/或应用方式和/或施用方式。如本文所用,术语“膳食补充剂”包括这样的制剂,其是作为营养补充剂的食品或饲料,或者该制剂可以被添加到作为营养补充剂的食品或饲料中。在此使用的术语“膳食补充剂”还指可以在需要胶凝化、质感化、稳定化、悬浮、成膜和结构化的多种产品中以低水平使用的制剂,从而保持多汁和改善的口感,而没有增加粘度。合适的食品可以包括(例如)功能食品、食品组合物、宠物食品、家畜饲料、健康食品、饲料等。在一个方面中,食品为健康食品。如本文所用的术语“功能食品”是指不仅能够提供营养作用、而且还能够将其他的有利作用传递给消费者的食品。因此,功能食品为其中引入了多种成分或组分(例如本文所述那些)的普通食品,其中所述多种成分或组分除了纯的营养作用以外,还赋予该食品以特定的功能,例如医药或生理学益处。适用于本发明的特定的食品的实例包括奶类产品、即食甜点、利用(例如)奶或水再构建的粉末、巧克力牛奶饮品、麦芽饮品、即食食物(ready-to-eatdish)、用于人类的速食食物或饮品、或者代表了用于宠物或家畜的完全或部分饮食的食品组合物。在一个方面中,根据本发明的饲料、食品、膳食补充剂或食品添加剂旨在用于人类、宠物或家畜,例如单胃动物。所述饲料、食品、膳食补充剂或食品添加剂可以旨在用于选自由狗、猫、猪、马或家禽构成的组中的动物。在另一个实施方案中,食品、膳食补充剂或食品添加剂旨在用于成年物种,特别是成人。如本文所用,术语“奶类产品”是指脂肪含量不同的任何液体或半固体的奶或乳清类产品。奶类产品可以为(例如)牛奶、山羊奶、绵羊奶、脱脂乳、全脂奶、由奶粉和乳清(未经过任何加工)再结合的奶、或者加工产品(例如酸奶、凝乳(curdledmilk)、凝乳(curd)、酸乳、全脂酸乳、酪乳和其他酸乳产品)。其他重要的一类包括奶质饮料,例如乳清饮料、发酵乳、炼乳、婴幼儿奶;增香乳、冰激凌;含奶的食品,例如糖果。本发明的饲料、食品、膳食补充剂或食品添加剂可以是或可加入食品补充剂,在本文中还称为膳食补充剂或营养补充剂或食品添加剂。根据本发明的饲料、食品、膳食补充剂或食品添加剂还可以用于动物营养学(例如猪的营养学)中,特别是早期断奶时期和生长育肥期。预期所述饲料、食品、膳食补充剂或食品添加剂通过例如增加的饲料转化率而增强免疫功能、降低并预防感染疾病、有利地改变微生物群的组成并改善动物的生长和性能。在一个实施方案中,饲料、食品、膳食补充剂或食品添加剂被包封。活体生物治疗产品菌株BT2013的微生物可用于或作为活体生物治疗产品(LBP)使用。在一个方面,LBP是口服施用的代谢活性组合物,即活的和/或冻干的或非存活热灭活的(non-viableheat-killed)、照射的或裂解的细菌。LBP可能含有其他成分。LBP可以口服施用,即以片剂、胶囊或粉剂的形式施用。LBP可以另外包含其他细菌物种,例如细菌种R.hominis。封装的产品对于R.hominis是有利的,因为它是一种厌氧菌。可以包括其他成分(例如维生素C)作为除氧剂和底物(例如,这些成分改善了体内的定殖和存活)。或者,本发明的LBP可以作为食品或营养产品例如牛奶或乳清基发酵乳制品或作为药物产品口服施用。LBP中细菌的合适每日剂量为约1x103至约1x1012个菌落形成单位(CFU);例如约1x107至约1x1010CFU;在另一个实例中为约1x106至约1x1010CFU。一方面,相对于组合物的重量,LBP含有作为活性成分的细菌种类和/或细胞成分,其量为约1x106至1x1012CFU/g;例如约1x108至约1x1010CFU/g。通常,LBP任选地与至少一种合适的益生元化合物组合。益生元通常是不可消化的碳水化合物,例如寡糖或多糖或糖醇,其在上消化道中不能降解或吸收。已知的益生元包括商业产品如菊粉和低分子半乳糖。在一个方面,本说明书的LBP包括相对于总重量组合物为约1至约30重量%(例如5至20重量%)的益生元。碳水化合物可以选自由以下物质构成的组中:低聚果糖(或FOS)、短链果寡糖、菊粉、异麦芽低聚糖、果胶、低聚木糖(或XOS)、壳聚糖寡糖(或COS)、β葡聚糖、阿拉伯胶、改性和抗性淀粉、聚右旋糖、D-塔格糖、阿拉伯树胶纤维、角豆树、燕麦和柑橘纤维。一方面,益生元是短链低聚果糖(以下简称为FOS-c.c);所述FOSs-c.c为不可消化的碳水化合物,通常通过甜菜糖的转化而获得并包括与三个葡萄糖分子结合的蔗糖分子。施用本发明的药物组合物、营养补充剂、饲料、食品、膳食补充剂或食品添加剂可以适于经口、经直肠、经阴道、经肠外、肌内、腹膜内、动脉内、鞘内、支气管内、皮下、皮内、静脉内、鼻内、口腔或舌下施用途径。在一个方面中,本发明的药物组合物、营养补充剂、饲料、食品、膳食补充剂或食品添加剂适于经口、经直肠、经阴道、经肠外、鼻内、口腔或舌下施用途径。在另一个方面中,本发明的药物组合物、营养补充剂、饲料、食品、膳食补充剂或食品添加剂适用于经口施用。对于经口施用,特别的使用形式由压制片剂、丸剂、片剂、胶囊剂(gellule)、滴剂和胶囊组成。其他的施用形式包括由无菌或可灭菌溶液制得的溶液或乳液,其可以静脉注射、动脉注射、鞘内注射、皮下注射、皮内注射、腹膜内注射或肌内注射。本发明的药物组合物还可以为栓剂、阴道栓剂和悬浮液的形式。药物组合物、营养补充剂、饲料、食品、膳食补充剂或食品添加剂可以以单位剂型形式,即以包含单位剂量、多个单位剂量或亚单位剂量的独立部分的形式配制。剂量本领域的普通技术人员无需过度的试验而可以容易地确定向受试者施用的BT2013菌株的合适的剂量。通常,医生会确定对于单个患者而言最合适的实际剂量,这取决于多种因素,包括所采用的特定细菌菌株的活性、该菌株的代谢稳定性和作用时长、年龄、体重、总体健康状况、性别、饮食、施用方式和时间、排泄率、联合用药、特定条件的严格度、以及经历治疗的个体。本文所公开的剂量是一般案例的典型。当然可以有个别的案例,其中较高或较低的剂量是有利的,这也在本发明的范围之内。组合在一个方面,菌株BT2013的微生物与一种或多种其他活性剂组合施用。在这种情况下,菌株BT2013的微生物可以与一种或多种其他活性剂同时或依次施用。功能测定体内模型使用C57BL/6小鼠(6周龄)评估DSS诱导的结肠炎期间多形拟杆菌(B.thetaiotaomicron)菌株E1、E2和BT2013的治疗效果。在用DSS处理之前,将多形拟杆菌菌株之一定殖于小鼠内。使动物安乐死并进行肠组织取样。收集小肠,通过流式细胞术和髓过氧化物酶(MPO)的酶活性测定进行免疫分析。将结肠分为等份,转移到中性缓冲福尔马林(NBF;Sigma-Aldrich)中进行组织学分析或RNAlater(Ambion)中进行分子分析。进行小肠固有层T细胞群的流式细胞分析(图1和图2)。单独的DSS和多形拟杆菌治疗不影响CD3+CD4+CD8-群体的总百分比。受单独的DSS和多形拟杆菌影响的群体是Tregs(CD25+FoxP3+*和FR4hiCD25+*)和Teff细胞(FR4loCD25+*)(图1和图2)。与单独的DSS相比,用多形拟杆菌菌株BT2013处理的小鼠中Treg的百分比增加。菌株E1W对Treg似乎没有任何影响(图1)。BT2013在Treg中的作用仅在用BT2013与DSS共同处理的小鼠中才明显。该菌株对未处理的小鼠中的Treg没有影响,但是影响了Teff细胞群体(图2)。测定回肠和盲肠中MPO的酶活性(图3a和3b)。MPO是一种储存在嗜中性粒细胞中的促炎症酶。MPO用作炎症的指标,特别是嗜中性粒细胞的聚集和积累。与单独的DSS相比,来自多形拟杆菌/DSS处理的小鼠在回肠或盲肠组织样品中检测到的较低水平的MPO活性,指示嗜中性粒细胞聚集的减少并因此减少了炎症。进行结肠的组织学分析(图4和5以及表1)。组织病理学分级方案基于Berg等1996的标准,总结如下:0=浅隐窝(crypt),无或少数浸润性炎性细胞,完好无损上皮、杯状细胞出现充满粘蛋白,即没有病理学1=隐窝可能表现出轻微的上皮细胞增生,有些扩散浸润性炎性细胞可见于隐窝、腔内上皮之间似乎完好无损,杯状细胞可能会出现稍微耗尽的粘蛋白。2=隐窝出现较深,具有上皮性增生的明显证据,来自杯状细胞的粘蛋白消耗,浸润性炎性细胞明显在本质上可能是多灶性的,虽然在粘膜下层没有看到浸润。3=病变涉及较大面积的粘膜和/或更多频率高于2级。病变不涉及粘膜下层。腔内上皮细胞表现出小的侵蚀。病变不是透壁的4=隐窝上皮出现侵蚀。可能存在脓肿。腔内上皮细胞出现不规则,有时完全丧失。观察到透壁浸润,这通常与上皮细胞完全丧失进入管腔有关。DSA诱导的结肠炎导致的结肠破坏通过用多形拟杆菌菌株E1、E2和BT2013处理小鼠而显著降低。与单独用DSS处理的小鼠相比,用多形拟杆菌定殖的小鼠中,结肠炎症相关基因的表达减少。与菌株E2相比,菌株E1和BT2013大大降低了IL1B和IL6的炎症基因表达(图6)。表1TTEST对照BTE1BT2013BTE2DSS0.0000.0320.0410.089体外模型PMA暴露后,在多形拟杆菌(B.thetaiotaomicron)菌株E1、E2和BT2013存在下调节肠上皮细胞诱导的炎性基因白细胞介素-8的表达(图7)。菌株BT2013基因组测序使用NexteraXT文库对来自菌株BT2013的DNA样品在MiSeq(v2nano2x250bp)上进行测序,以便用测序接头进行快速片段化和标记,总共得到4605120个读长(read)(1115615927个碱基)。数据分析如下:a.使用bowtie2(2.2.2)映射到参考序列(NC_004663和NC_004703)b.使用VarScan(2.3.7)和SNVer(0.5.3)进行SNV和小d.InDel访问进行共有序列访问(call)以避免误报c.使用参考gff对变体进行注释d.使用pindel进行大型InDel访问(0.2.5a3)e.使用SOAPdenovo(2.04)进行未映射读长的从头组装(De-novoassembly)f.在NCBI数据库进行组装的重叠群(contig)的比对g.对样品的所有读长进行二次抽样至50%h.使用SOAPdenovo(2.04)进行子采样读长的从头组装使用bowtie2(2.2.2)将序列映射到参考序列(NC_004663和NC_004703)。使用VarScan(2.3.7)和SNVer(0.5.3)鉴定核苷酸变异和小的插入和/或缺失,以避免测序期间的假阳性,并使用参考序列注释变异。使用pindel(0.2.5a3)鉴定大的插入和缺失。未映射的读长使用SOAPdenovo(2.04)从头组装。将测序片段重新组装成针对NCBI核苷酸数据库的重叠群。样品的所有读长被采样为50%、然后使用SOAPdenovo(2.04)从头组装,以提供BT2013的从头序列组合的级联版本。序列SEQIDNO:1(BT2013的从头序列组合的连续版本)-参见电子序列表当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1