从假单胞菌PF-11培养物制备的防污组合物的制作方法
背景技术:
抗菌剂耐药性(Antimicrobial Resistance)
由于越来越多的细菌对抗菌剂的耐药性,以后十年治疗和预防细菌感染是世界范围内的主要的健康挑战(Kaplan 2004)。由于多药耐药性细菌,每年仅欧盟就有超过25000个患者死于感染,造成15亿€的社会总的直接成本(ECDC/EMA joint technical report 2009)。但是用于治疗人类病原体的抗生素也用在动物中治疗疾病,促进生长和提高饲料转化效率(FAO/OIE/WHO 2003)。结果,来自城市和农业来源的抗生素在土壤和水环境中持续存在,存在导致选择耐药性细菌的强大压力。于是在动物饲养厂和屠宰场中,在土壤和废水中,在城市和农业污水水域中发现了存在具有抗菌剂耐药性的细菌。已经显示大多数这些耐药性细菌将抗性基因传递给人类病原体(Martínez 2013)。因此,抗生素的连续使用和滥用强有力地促进了选择环境抗性菌株(environmental resistant strains),这能够将AMR机制传递给病原体菌株,并且导致断裂点(其中治疗用途中引入的任何新抗菌素将在短期内激发允许细菌对它的使用变得有抗性的机制的选择)。
新的可用抗生素流已经下降,在1990年代和这个世纪的第一个十年中更少的数量被批准(Boucher et al.2009)。因此,由于AMR细菌导致的感染负担和用以解决这个问题的新的抗生素的研发之间存在差距。这本质上归因于难以研发新的有效的抗生素,很容易被细菌克服,落实新的抗生素使用的监管困难和对制药工业来说抗生素的利润减少的事实(Livermore 2011;Payne etal.2007)。因此,研究工作应集中在研发具有原始的作用模式的新抗菌策略,这是有效的并且将不会培养AMR机制。
生物污染(Biofouling)
生物体能够粘附在大多数多元化环境的、自然的和人工合成的表面上并且在这些表面上生长。生物污染包括当暴露于水时由形成细菌或微藻粘附的条件膜的吸收的有机材料的积累引发的多层表面定居的自然过程,该自然过程导致生物膜形成(Abarzua et al.,Olsen et al.)。
需要用于减少抗菌剂耐药性和生物污染的新颖的方法和组合物。
杀真菌剂(Fungicides)
由微生物体产生的抗真菌化合物(比如抗生素)的利用已经被高度利用于研发新的活性化合物,强烈集中在药用化合物。
几种细菌已经被鉴定为本质上产生各种抗真菌的化合物和抗生物,包括酶、铁载体和多种多样的分子,比如氰化氢或乙烯。
作为寄生生物,真菌是常见的和重要的病原体,其不仅造成严重的作物损失和动物和人群体中的疾病而且还塑造天然生物群落的组成和结构。杀真菌剂可用于广泛系列的应用,从健康和兽医学应用到工业(像纸张制造期间的纸浆生产),和到家庭整洁。
在人类健康中,真菌感染表示组织被一种或多种真菌入侵。大多数真菌感染的发生归因于人类暴露在附近环境中的真菌源,比如空气、土壤或鸟类的粪便。由真菌感染造成的常见疾病包括指甲和趾甲真菌、脚癣(Athlete's foot)、股癣、头皮和头发感染、皮癣(ringworm)、真菌窦感染(fungal sinus infection)、须疮(barber's itch)以及其他。这样的疾病通常给患者造成疼痛、不舒服和社交尴尬。有时它甚至可造成永久损伤并且在一些情况下最终对某些患者(比如器官移植受者和HIV/AIDS携带者)是致命的。
植物也时常受到多种多样的病原真菌挑战。真菌控制是很重要的因为植物或部分植物上的真菌生长抑制叶子、果实或种子的产量和种植作物的总体质量。农业和园艺中大约25%的全部真菌性疾病是由白粉菌(powdery mildew)植物病原体造成的。由于农业和园艺栽培中真菌传播的巨大经济后果,广谱的杀真菌和抑制真菌产品已经被研发用于一般的和专门的应用。这样的例子是无机碳酸氢盐、碳酸盐化合物、卵磷脂和石灰的使用。但是,这些杀真菌和抑制真菌产品可能对环境有害并且可能污染比如地下水的区域。因此,需要一种提供一种方式控制真菌而不损害环境同时保护植物具有最少的植物性毒素副作用的生物解决方案。
杀昆虫剂(insecticides)
蚊传播的疾病每年影响全球接近7亿人口并且是多于一百万死亡的原因。控制蚊传播的疾病是世界卫生组织(WHO)的千年发展目标中的既定目标。此外,在欧洲,这样的疾病已经被欧洲疾病预防和控制中心认定为新兴的威胁。迄今为止,蚊子控制主要在杀昆虫剂应用上被接力,具有沉重的环境代价和增加的杀昆虫剂耐药性。
而且,对私房屋主、野餐者、园艺大师,和对农民和其他人(他们对农产品的投资经常由于昆虫损坏农作物被毁掉或减少)来说,许多昆虫广泛地被认为是害虫。尤其是在生长季节很短暂的区域,重大的昆虫破坏对种植户来说可能意味着损失全部收益和作物产量的明显减少。特定农产品的缺乏供给对食品加工者和,然后对粮食作物和由这些作物而来的产品的最终消费者来说一定导致更高的成本。
新颖的杀昆虫剂中的活性成分或创新策略是至关重要的并且正在被寻找,即基于从植物或细菌分离的天然产物,并且在两个主要领域(农业和健康)中起作用。
在农业中
杀害虫剂对农业生产力和食物供给的增长来说已经是主要贡献者。另一方面,由于人类、动物和环境副作用它也是担忧的来源。这个担忧本身已经在以下方面被证明:杀害虫剂应用和使用的政府监管增加,有机食品需求增加和人们中健康意识增加。合成有机化学品的广泛使用在过去数十年中已经导致许多长期环境问题。主要问题与环境中和尤其是水中杀害虫剂的积累有关。这些担心以及对杀害虫剂使用者的安全的担心在继续。全部这些事实表明生物杀害虫剂全球市场增长存在巨大空间。
由昆虫造成的破坏是在任何农作物物种生产率减少的最重要因素之一。总年经济损失达到大约US$177亿。杀害虫剂由于以下事实对作物保护效果不断减少:它更可能造成耐药性以及由于这些化学品的环境影响(比如溪流、河流或水道的污染)造成的损失。全部这些可变因素贡献估计全球每年US$1万亿的食物损失或浪费。
对于健康
蚊子是几个人类和/或动物病原体的疾病传播媒,造成疾病,比如疟疾、淋巴丝虫病和虫媒病毒病(arboviroses),像登革热、Zika、黄热病、基孔肯雅热(chikungunya)和西尼罗热(West Nile fever))。这些疾病造成高水平的死亡率和/或发病率,尤其是在亚热带和热带地区国家,在那里它们是最流行的,具有随之发生的社会和经济影响。控制蚊子传播的疾病在世界健康组织的千年发展目标(MDG)的计划中。而且,由于像全球化、人类迁移和气候变化的因素,和随之发生的地理蚊子疾病传播媒物种和/或病原体分布的扩张,这些疾病的一些正在传播和出现,举例来说,2007年意大利的基孔肯雅热,马德拉岛的登革热-2012年在葡萄牙和2010在法国或在温带地区再度出现,比如2010年希腊的疟疾。而且,随西尼罗热在1999引入US和基孔肯雅热在2013/14年引入加勒比海地区和巴西,连同登革热,现在存在最普遍的虫媒病毒蚊子传播的疾病跨越东和西半球。这些传染病的公众健康相关性是很高的,因为它们造成可导致显著的发病率和/或死亡率的发热综合征、严重的关节痛、脑膜脑炎或出血综合征。
疾病传播媒控制仍然是控制疾病传播媒传播的疾病中的根本性工具。虽然推荐综合疾病传播媒控制策略,疾病传播媒控制主要在杀昆虫剂应用上被接力。由于环境成本和杀昆虫剂耐药性的发展(集中的和/或中断的应用的结果,这些经常归因于非常高和不能负担得起的成本),正在寻找新的杀昆虫剂/剂型/策略,即基于植物或细菌产物的生物杀昆虫剂/剂型/策略。
生物杀害虫剂
在农业中和在人/动物疾病传播媒的控制中,在病虫害管理中使用来自细菌起源的代谢物一直在增长,因为它们不这么易于诱导耐药性的发展,并且通常比传统杀害虫剂更加能进行生物降解和环境友好。
当前用作生物杀昆虫剂(bio-insecticide)的主要生物杀害虫剂(bio-pesticide)来自细菌苏云金芽孢杆菌(Bacillus thuringiensis)(Bt),代表大约2%的总杀昆虫剂市场。在蚊子疾病传播媒控制中,正在使用的主要生物杀害虫剂是B.t.苏云金(Bti)和球形赖氨酸芽孢杆菌(Lysinbacillus sphaericus)(=球形芽孢杆菌)(Ls)。Bti和Ls呈现针对蚊子幼虫期的高特异性并且通过破坏中肠组织(midgut tissue)接着通过败血症(很可能不仅通过它们的互斥行为而且通过其它细菌物种造成的)杀死昆虫。在孢子形成时,Bti和Ls产生结晶包涵体(crystal inclusions),该结晶包涵体是由各种各样的叫做Cry或Cyt毒素的杀昆虫蛋白质形成的。这些毒素显示高选择活性谱,杀死窄范围的昆虫物种。它们的使用已经导致化学杀昆虫剂的使用的显著减少。
但是,对基于Bti和Ls的杀昆虫剂的可能的耐药性发展的报告正在出现。另一方面,害虫控制历史显示为了避免耐药性发展杀昆虫剂的轮流使用是可取的。
因此,联合农业害虫管理中采用的类似策略,新的灭微生物剂,或使用它们的方式是需要的并且还需研究,提供控制更多控制有害或疾病传播媒昆虫(比如蚊子)的解决方案。
海洋寄生虫(Marine parasites)
集约化养殖渔业通过寄生虫(像,海虱)伤害鱼遭受大量的经济损失。根据生产,感染这些海洋桡足类(marine copepods)在网栏(net-pen)中是很难避免的,并且在世界范围内的水产养殖业中是个严重的问题。该问题的重要性因地而异。在鲑鱼养殖产业中,海虱的控制对它的未来可持续发展是至关重要的。海虱感染影响它们的宿主的生长、繁殖和生存因为它们的摄食造成导致渗透问题的损伤和继发感染,并且,如果不处理,它们能达到对鱼非常不利或致命的水平。野生的和养殖的鲑鱼都可充当海虱的宿主。海虱可通过水移动并且从养殖鱼传递给野生鱼,反之亦然。养殖的和野生鱼之间的寄生虫的可能的相互和交叉感染正在引起很多担心。水产养殖业的目标是保证来自养殖渔业厂的海虱不对野生鱼类种群产生任何负面影响。
最近,养殖鱼上的海虱治疗包括生物治疗(濑鱼,清洁工鱼),药品治疗(口服治疗和沐浴治疗)和饲料中添加的化合物(additive in-feed compounds)。各种治疗可以联合。抗寄生虫药自从1980年代早期以来已被用于对抗感染,并且有机磷酸脂类从1980年代早期被使用直到在1990年代中期发展了耐药性。从那个时候,合成的拟除虫菊酯氯氰菊酯、溴氰菊酯和阿维菌素(avermectin)埃玛菌素(emamectin)几乎完全取代了有机磷酸脂类用于治疗海虱。但是最近,报道了几个利用这些拟除虫菊酯和埃玛菌素的治疗失败,并且检测到敏感性减少。现今,病虫害管理的策略依赖极少数的抗寄生虫药。
过氧化氢也用于从鱼上除去海虱。但是需要大量的过氧化氢,对鱼的有限的治疗活性和毒性没有使这成为理想的方法。过氧化氢不杀死海虱,所以,该寄生虫可能重新攻击鱼。
即使许多治疗是可用的,还没有建立可靠的方法。此外,已经记载了在受到频繁使用的区域中海虱对治疗的敏感性降低。交叉耐药性(Cross-resistance)也可能发生在相关化合物之间。当存在对特定治疗的耐药性证据时,应当注意避免使用相关化合物。耐药性潜能可通过执行正确的治疗程序,投予全推荐剂量和在可能的情况下通过交替使用不同的治疗方法被降低。所以,为了避免耐药性发展,有必要几个不同组的有效化合物用于治疗海虱感染。从而,长时间以来切身需要改进的有效对抗海虱感染并且对鱼、消费者和环境安全的控制鱼中海虱的手段。鉴定海虱感染管理中有用的化合物的看似显而易见的途径将会集中在已知的杀害虫剂上,比如杀昆虫剂或以前已经显示对海洋寄生虫有效的化合物。但是实验已经显示即使特定化合物对其他水生寄生虫有效并不表示该化合物对海虱感染有效。已经测试了用于鱼的大量的抗寄生虫药对抗海虱感染的它们的效果。熟知的例子是:吡喹酮和不同的苯并咪唑(芬苯咪唑(fenbendazole)、甲苯咪唑(mebendazole)、阿苯咪唑(albendazole)、氟苯咪唑(flubendazole)等等),它们是抗肠虫药(anti-helmintics)但是对海虱没有任何作用。噻嘧啶是另一个是抗肠虫药(抗线虫噻吩),对海虱没有任何作用。抗原生动物药,比如妥曲珠利(toltrazuril)和地克珠利(diclazuril)(抗球虫药)也对海虱没有作用。杆菌肽(bazitrazin)同样如此,其对肠原生动物有作用,但是对海虱没有作用。仅仅很有限数目的可用杀害虫剂对鱼寄生虫(像,海虱)显示了良好的功效。这些包括拟除虫菊酯,比如氯氰菊酯和溴氰菊酯。当已经在新的物种上测试了已知的抗寄生虫化合物时存在几种因素解释所经历的困难,比如不同种的寄生虫之间的较大基因型和表型多样性,较大的代谢差异和寄生虫占据非常不同的栖息地并且对宿主具有不同的传播和感染策略的事实。
治疗化学品对治疗寄生虫感染背后的原理是找到允许有效灭活寄生虫而不明显地影响宿主的治疗窗口。
技术实现要素:
本发明提供了一种制备细菌上清液的方法,包括培养假单胞菌环境菌株PF-11细胞;并且回收该上清液。
本发明还提供了一种减少表面上生物膜的量的方法,包括使该表面与假单胞菌菌株PF-11的上清液、上清液级分(supernatant fraction)、改良的上清液或改良的上清液级分;或包括假单胞菌菌株PF-11的上清液、上清液级分、改良的上清液或改良的上清液级分和一种或多种可接受的载体的组合物接触。
本发明还提供了一种减少表面上至少一种生物体的粘附的方法,包括使该表面与假单胞菌菌株PF-11培养物的上清液、上清液级分、改良的上清液或改良的上清液级分;或包括假单胞菌菌株PF-11培养物的上清液、上清液级分、改良的上清液或改良的上清液级分和一种或多种可接受的载体的组合物接触。
本发明还提供了一种减少表面上小面积污染(microfouling)和大面积污染(macrofouling)的方法,包括将使该表面与假单胞菌菌株PF-11培养物的上清液、上清液级分、改良的上清液或改良的上清液级分;或包括假单胞菌菌株PF-11培养物的上清液、上清液级分、改良的上清液或改良的上清液级分,和一种或多种可接受的载体的组合物接触。
本发明还提供了一种杀死或减少真菌或细菌细胞生长,或杀死或抑制昆虫或海洋桡足类发展的方法,包括使该真菌、细菌、昆虫或海洋桡足类与假单胞菌菌株PF-11培养物的上清液、上清液级分、改良的上清液或改良的上清液级分;或包括假单胞菌菌株PF-11培养物的上清液、上清液级分、改良的上清液或改良的上清液级分,和一种或多种可接受的载体的组合物接触。
本发明还提供了假单胞菌菌株PF-11的基本上纯的培养物。
本发明还提供了鉴别细菌是否能够产生一种或多种能够消化高分子量底物的胞外蛋白酶的方法,该方法包括i)将该细菌细胞放在补充有该高分子量底物的生长限制培养基中;ii)确定该细胞是否在补充有高分子量底物的生长限制培养基中生长;和iii)如果在步骤ii)中确定该细胞生长则鉴别该细菌为能够产生一种或多种能够消化该高分子量底物的胞外蛋白酶,并且如果在步骤ii)中确定该细胞没有生长则鉴别该细菌为不能够产生一种或多种能够消化该高分子量底物的胞外蛋白酶。
发明的详细描述
定义
除非另有定义,本文中使用的全部科技术语具有和本发明所属的技术领域的技术人员通常理解的相同的含义。
除非上下文另有说明或另有要求,如本文所使用的,每个下面的术语应具有下面阐述的定义。
一般定义
如本文所使用的,在数值或数值范围的情况下“大约”意思是引述的或要求保护的数值或数值范围的±10%,除非上下文需要多个限定范围。
如本文所使用的,“分泌蛋白质组(secretome)”意思是由细胞产生和分泌的有机分子和无机元素的全体。当生长条件被指明时,分泌蛋白质组是由细胞在这些生长条件下产生和分泌的有机分子和无机元素的全体。应理解该分泌蛋白质组可以在细胞上清液中回收。
如本文所使用的,“可操作地连接(operably linked)”是指并置(juxtaposition),其中成份被配置用以便执行它们的常规功能。例如,可操作地连接到编码序列的控制序列或启动子(promoters)能够影响编码序列的表达。
如本文所使用的,“假单胞菌菌株PF-11细胞”是指假单胞菌菌株PF-11细胞或任何它们的后代。假单胞菌菌株PF-11已经在2015年6月2日保藏在Leibniz-Institut DSMZ-Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH(DSMZ)(地址Inhoffenstr.7B 38124 Braunschweig),登记号DSM 32058。
如本文所使用的,微生物的“基本上纯的培养物”是其中少于培养物中活微生物(举例来说,细菌、真菌(包括酵母)、支原体或原生动物)细胞总数的大约40%(即,少于大约:35%;30%;25%;20%;15%;10%;5%;2%;1%;0.5%;0.25%;0.1%;0.01%;0.001%;0.0001%;或甚至更少)微生物是活微生物细胞(viable microbial cells)而不是微生物(microorganism)的培养物。
如本文所使用的,“富含”假单胞菌菌株PF-11细胞是指假单胞菌菌株PF-11细胞的浓度比任一自然界中发现的假单胞菌菌株PF-11细胞的浓度高。
本文所使用的,术语“疾病传播媒(vector)”是指能够将已经和它联系在一起的另一种多核苷酸片段或序列从一个位置(举例来说,宿主、系统)携带和转移到另一个位置的多核苷酸分子。该术语包括体内或体外表达系统的疾病传播媒。作为一个非限制性例子,疾病传播媒可以呈“质粒”形式,该质粒是指通常保持为游离体但是也可以与宿主基因组成为一体的圆形双链DNA环。
本发明的方面涉及生产包括一种或多种胞外蛋白酶的分泌蛋白质组,通过在有效产生该一种或多种胞外蛋白酶的条件下培养能够产生该一种或多种胞外蛋白酶的细胞,并且回收包括该一种或多种胞外蛋白酶的分泌蛋白质组。优选的待培养细胞是本发明的细胞。有效的培养条件包括,但不局限于,有效培养基、生物反应器、温度、pH和允许胞外蛋白酶产生的氧情况。有效培养基是指在其中培养细胞以产生一个或多种本发明的胞外蛋白酶的任何培养基。这样的培养基可以包括具有可同化的碳、氮和磷来源,和适当的盐、矿物质、金属和其他营养物(比如维生素)的含水培养基。在一些实施方案中,该培养基是缺乏或具有减少的可同化的碳、氮或磷来源的生长限制培养基(growth limited medium)。
本发明还提供本发明的细胞的上清液、改良的上清液、上清液级分、分泌蛋白质组、部分纯化的分泌蛋白质组和分泌蛋白质组级分。
培养基
用于本发明实施方式的细菌培养基的非限制性例子包括M9培养基、M9-NH4Cl-Vit B1培养基、M9-葡萄糖培养基、假单胞菌的基本培养基(Minimal Medium for Pseudomonas)和NB,并且描述在下面:
M9培养基:12.8g Na2HPO4,3g KH2PO4,0.5g NaCl,1g NH4Cl,1ml CaCl2 100mM,1ml MgSO4 1M,500μl Vit B1 1%/1L补充20ml葡萄糖20%(0)。
M9-NH4Cl-Vit B1或M9-N培养基:12.8g Na2HPO4,3g KH2PO4,0.5g NaCl,1ml CaCl2100mM,1ml MgSO4 1M/1L(0)。
M9-葡萄糖或M9-G:12.8g Na2HPO4,3g KH2PO4,0.5g NaCl,1ml CaCl2 100mM,1ml MgSO4 1M/1L(0)。
假单胞菌的基本培养基:1g K2HPO4,3g KH2PO4,5g NaCl,0.2g MgSO4.7H2O,3mg FeCl3/1L(Prijambada et al.1995)。
NB:1%蛋白胨,0.6%牛肉膏,1%NaCl(Gaby and Hadley 1957)。
缩写词
本文使用了下面的缩写词:
BSA-牛血清白蛋白;OD–光密度;MMP-假单胞菌的基本培养基;M9-N-M9-NH4Cl-Vit B1;M9-G-M9-葡萄糖。
实施方式
本发明提供了一种制备细菌上清液的方法,该方法包括培养假单胞菌环境菌株PF-11细胞;和回收该上清液。
在一个实施方式中,假单胞菌菌株PF-11细胞是在该细胞或该细胞的后代产生至少一种胞外蛋白酶的条件下培养的,并且该上清液包括至少一种胞外蛋白酶。
在一些实施方案中,该上清液是在培养的细胞的数目以指数速度增加时回收的。在其它实施方案中,该上清液是在培养的细胞的数目已经停止以指数速度增加之后回收的。在其它实施方案中,该细胞是在补充有葡萄糖的盐培养基中培养的。在其它实施方案中,该细胞是在补充有葡萄糖的M9培养基中培养的。在其它实施方案中,该细胞是在缺乏铵和硫胺素(thyamine)的培养基中培养的。在其它实施方案中,该细胞是在大约28、29、30、31或32℃的温度下培养的。
在一些实施方案中,该方法进一步涉及将该上清液或改良的上清液按大小分为大于10千道尔顿(kDa)成分级分;和按大小小于10千道尔顿(kDa)成分级分。
在一些实施方案中,该方法涉及从该上清液或其级分的一种或多种成份中分离至少一种胞外蛋白酶以:减少该上清液或其级分的盐浓度;减少该上清液或其级分的水含量;或对该上清液或其级分进行消毒,以便生产改良的上清液或其级分。
在一些实施方案中,该方法包括向该上清液、改良的上清液或其级分中添加一种或多种可接受的载体。
本发明还提供一种用于减少表面上生物膜的量的方法,包括使该表面与假单胞菌菌株PF-11的上清液、上清液级分、改良的上清液或改良的上清液级分;或包括假单胞菌菌株PF-11的上清液、上清液级分、改良的上清液或改良的上清液级分,和一种或多种可接受的载体的组合物接触。
在一些实施方案中,该生物膜是水生生物膜。在一些实施方案中,该水生生物膜是淡水生物膜;能够在池塘、湖泊、或河流环境中生长的淡水生物膜;海洋生物膜;或能够在淡水或咸水水族箱中生长的生物膜。
本发明还提供了一种减少表面上至少一种生物体的粘附的方法,该方法包括使该表面与假单胞菌菌株PF-11培养物的上清液、上清液级分、改良的上清液或改良的上清液级分;或包括假单胞菌菌株PF-11培养物的上清液、上清液级分、改良的上清液或改良的上清液级分,和一种或多种可接受的载体的组合物接触。
在一些实施方案中,该生物体是藻类、海胆、藤壶或苔藓虫孢子(bryozoan zooid)。
本发明还提供了一种减少表面上小面积污染或大面积污染的方法,包括将使该表面与假单胞菌菌株PF-11培养物的上清液、上清液级分、改良的上清液或改良的上清液级分;或包括假单胞菌菌株PF-11培养物的上清液、上清液级分、改良的上清液或改良的上清液级分,和一种或多种可接受的载体的组合物接触。
在一些实施方案中,该表面是玻璃、玻璃纤维、木材、橡胶、塑料、或金属。在其它实施方案中,该表面是水族箱、水池、浮标、码头或轮船或驳船的船体的表面。在其他实施方案中,该表面是渔网或其他放置在水中的网的表面。在其他实施方案中,该表面是绳。在其他实施方案中,该表面是墙壁或天花板结构的表面。
在一些实施方案中,包括假单胞菌菌株PF-11培养物的上清液、上清液级分、改良的上清液或改良的上清液级分,和一种或多种可接受的载体的组合物是油漆(paint)或透明涂料(transparent coating)。
本发明还提供了一种杀死或减少真菌生长的方法,该方法包括使该真菌与假单胞菌菌株PF-11培养物的上清液、上清液级分、改良的上清液或改良的上清液级分;或包括假单胞菌菌株PF-11培养物的上清液、上清液级分、改良的上清液或改良的上清液级分,和一种或多种可接受的载体的组合物接触。
本发明还提供了一种杀死或抑制昆虫发展的方法,该方法包括使该昆虫与假单胞菌菌株PF-11培养物的上清液、上清液级分、改良的上清液或改良的上清液级分;或包括假单胞菌菌株PF-11培养物的上清液、上清液级分、改良的上清液或改良的上清液级分,和一种或多种可接受的载体的组合物接触。
本发明还提供了一种杀死或抑制海洋桡足类发展的方法,该方法包括使该海洋桡足类与假单胞菌菌株PF-11培养物的上清液、上清液级分、改良的上清液或改良的上清液级分;或包括假单胞菌菌株PF-11培养物的上清液、上清液级分、改良的上清液或改良的上清液级分,和一种或多种可接受的载体的组合物接触。
本发明还提供了一种杀死或减少细菌细胞生长的方法,该方法包括使该细菌细胞与假单胞菌菌株PF-11培养物的上清液、上清液级分、改良的上清液或改良的上清液级分;或包括假单胞菌菌株PF-11培养物的上清液、上清液级分、改良的上清液或改良的上清液级分,和一种或多种可接受的载体的组合物接触。
在其他实施方案中,该上清液级分或改良的上清液级分包括按大小大于10kDa的假单胞菌菌株PF-11分泌蛋白质组的成分。在其他实施方案中,该上清液级分或改良的上清液级分包括按大小小于10kDa的假单胞菌菌株PF-11分泌蛋白质组的成分。在其他实施方案中,该细菌细胞不是假单胞菌属,铜绿假单胞菌或假单胞菌细菌。在其他实施方案中,该细菌细胞是葡萄球菌属(Pseudomonas spp.)、金黄色葡萄球菌或耐甲氧西林金黄色葡萄球菌(methicillin-resistant Staphylococcus aureus)细胞。在其他实施方案中,该细菌细胞是埃希氏杆菌属、大肠杆菌或大肠杆菌O157细胞。
本发明还提供了假单胞菌菌株PF-11的基本上纯的培养物。在一些实施方案中,基本上纯的培养物的细胞已经被改良以包括编码可操作地连接到启动子的报告多肽的外源抗性基因或外源多核苷酸。在一些实施方案中,基本上纯的培养物的细胞已经被基因改良,与相应的假单胞菌菌株PF-11细胞相比对抗生素化合物的敏感性增加。在一些实施方案中,基本上纯的培养物是其中少于培养物中活微生物细胞(viable microbial cells)总数目的大约40%、35%、30%、25%、20%、15%、10%、5%、2%、1%、0.5%、0.25%、0.1%、0.01%、0.001%、0.0001%,或甚至更少是非假单胞菌菌株PF-11细胞的活细胞的培养物。
本发明还提供了富集假单胞菌菌株PF-11的培养物。
本发明还提供了包括本文描述的任一实施方案的细胞、或上清液、改良的上清液或其级分和一种或多种可接受的载体的组合物。
在一些实施方案中,该组合物是防污或抗菌组合物,其包括本文描述的任一实施方案的细胞、或上清液、改良的上清液或其级分。在一些实施方案中,该组合物包括一种或多种可接受的载体。
本发明还提供了一种鉴别细菌是否能够产生一种或多种能够消化高分子量底物的胞外蛋白酶的方法,该方法包括i)将该细菌细胞放置在补充有该高分子量底物的生长限制培养基中;ii)确定该细菌是否在补充有该高分子量底物的生长限制培养基中生长;和iii)如果在步骤ii)中确定该细胞生长了则鉴别该细菌为能够产生一种或多种能够消化该高分子量底物的胞外蛋白酶,和如果在步骤ii)中确定该细胞没有生长则鉴别该细菌为不能够产生一种或多种能够消化该高分子量底物的胞外蛋白酶。
在一个实施方案中,如果在补充有该高分子量底物的生长限制培养基中细胞数目在至少0.5、1、3、4、5或1-24小时时间内增加至少1、5、10、100、1000或10,000倍则确定该细胞生长了。
在一个实施方案中,该生长限制培养基是盐培养基。在另一个实施方案中,该生长限制培养基是补充有葡萄糖的盐培养基。在另一个实施方案中,该生长限制培养基是补充有葡萄糖的M9培养基。在另一个实施方案中,该生长限制培养基缺乏铵和硫胺素。在另一个实施方案中,该生长限制培养基保持在大约28、29、30、31或32℃的温度下。在另一个实施方案中,该生长限制培养基是液体。在另一个实施方案中,该生长限制培养基包括糖。
在一个实施方案中,高分子量底物不能穿过细菌细胞的细胞壁或细胞膜。在另一个实施方案中,该高分子量底物必须可降解以便被内在化和用于细胞生长。在另一个实施方案中,该高分子量底物是明胶、酪蛋白、血红蛋白或牛血清白蛋白(BSA)。
在一个实施方案中,步骤i)的细菌细胞是从完全培养基得到的,该完全培养基被稀释成包括该高分子量底物的生长限制培养基。
本文描述的任何实施方案可以以符合本文公开的至少一个目标、目的和需要的任何方式与任何其他的实施方案联合,以及参考“一个实施方案(an embodiment)”、“一些实施方案”、“可替换实施方案”、“各种各样的实施方案”、“一个实施方案(one embodiment)”或等等未必互相排斥并且目的是指明与该实施方式有关的描述的特定的特征、结构或特性可以包含在至少一个实施方案中。
培养
培养细菌的方法对本领域技术人员来说将是已知的,并且不局限于本文描述的方法。例如,本发明的细胞可在传统发酵生物反应器、摇瓶、试管、微量滴定盘(microtiter dishes)和培养皿中培养。培养可在适合重组细胞的温度、pH和氧含量下进行。这样的培养条件在本领域技术人员的专业知识范围内。
从分泌蛋白质组的一个或多个成分或包括分泌蛋白质组的上清液分离胞外蛋白酶的非限制性方法包括透析、超滤、超速离心和色谱法(包括,但不局限于,非离子交换色谱、排阻色谱、膨胀床吸附(EBA)色谱分离、反相色谱、快速蛋白质液相色谱或亲和色谱)。
从培养基中除去细胞以回收包括分泌蛋白质组的上清液的方法的非限制性例子包括离心、过滤或沉降。减少上清液、改良的上清液或其级分的水含量的方法的非限制性例子包括蒸发、用低分子量薄膜透析或过滤、冷冻干燥、喷雾干燥和滚筒干燥。
本发明的组合物
本发明的组合物包括赋形剂,本文也称为“可接受的载体”。赋形剂可以是任何待处理的表面可忍受的材料。这样的赋形剂的例子包括水、盐水、林格氏溶液(Ringer's solution)、右旋糖溶液、汉克氏溶液(Hank's solution)和其他含水的生理平衡盐溶液非水载剂,比如不挥发性油、芝麻油、油酸乙酯或三酸甘油酯也可以被使用。其他有用的剂型包括含有粘度增加剂(比如羧甲基纤维素钠、山梨醇或左旋糖苷)的悬浮液。赋形剂也可包含少量的添加剂,比如增加等渗性和化学稳定性的物质。缓冲液的例子包括磷酸盐缓冲液、碳酸氢盐缓冲液和Tris缓冲液,同时防腐剂的例子包括硫柳汞(thimerosal)或邻甲苯酚、福尔马林和苄醇。赋形剂也可以用于增加组合物的半衰期,例如,但不局限于聚合物控释载剂、生物可降解植入物、脂质体、细菌、病毒、其他细胞、油类、酯类、和乙二醇。
在本发明的一些实施方案中,本发明的组合是涂料或者与涂料混合。在本发明的一些实施方案中,本发明的组合物是油漆(paint)或者与油漆混合。在一个实施方案中,该油漆是水基油漆。在其他实施方案中,该油漆是油基油漆。在其他实施方案中,该油漆是海船油漆。在其他实施方案中,该油漆不含有溶剂或稀释剂。涂料或油漆可以应用于本文公开的一个或多个表面,比如水族箱的玻璃、水池的内衬、水产养殖网或船体。
本发明的一个实施方案是能够将本发明的组合物缓慢释放入环境或表面的控释剂型。如本文所用的,控释剂型包括控释载剂中的本发明的组合物。合适的控释载剂包括,但不局限于,生物聚合物、其他聚合基质、胶囊、微胶囊、微粒、丸制剂(bolus preparations)、渗透泵、扩散装置、脂质体、脂质球(lipospheres)和穿皮给药系统。在一些实施方案中,控释剂型是生物可降解的(即,生物可消化的)。缓释组合物在流水中使用特别有用。剂型优选从大约1到大约12个月范围的时间段内释放。本发明的优选的控释剂型能够影响治疗优选至少大约1个月,更优选至少大约3个月,更加优选至少大约6个月,甚至更加优选至少大约9个月和甚至更加优选至少大约12个月。
在一个可替代实施方案中,组合物是干燥的组合物。更优选地,本发明的细胞的干提取物,比如本发明的上清液或分泌蛋白质组。液体组合物可以利用本领域已知的任何技术,但是不局限于冷冻干燥、喷雾干燥和滚筒干燥,进行干燥。干燥的组合物可用作涂料或油漆的添加物。
细胞改良(Modifications of cell)
在一个实施方案中,本发明的细胞已从它的自然发生的对应物改良。在一个实施方案中,该细胞与它的自然发生的对应物相比对抗生素是耐药性的,或具有增加的耐药性。在另一个实施方案中,该细胞与它的自然发生的对应物相比对抗生素不耐药性的或更不耐药。
本发明的方面涉及选择具有特定基因型改变的本发明的细胞的能力。在一些实施方案中,本发明的细胞包括允许对细胞进行选择的外源可选标记。
重组DNA技术中一个常见的选择策略包括遗传因子(质粒、病毒、转位子等等)中的克隆化基因或DNA序列,该遗传因子具有允许将含有该因子的宿主细胞(转化细胞)从不含有该因子的细胞分离的表型属性。特别有用的是提供生存选择的基因。因此,含有该遗传因子细胞的选择可方便地通过在含有有毒物质的培养基上生长细胞实现,在该培养基上只有表达“抗性基因”的转化株能够生存。在一些实施方案中,本发明的细胞包括外源基因,当该外源基因被表达时允许对细胞进行选择。允许对本发明的细胞进行选择的外源基因的非限制性例子包括抗生素抗性基因。提供病毒抗性、重金属抗性或多肽抗性的基因也是可用的。本领域技术人员将知道用于选择转化细胞的协议是基于表达编码抗性基因(比如转化宿主细胞中抗生素耐药性)的遗传因子(举例来说,克隆载体)(参见,举例来说,US 4,237,224;Ausubel,2000)。说明性的抗生素包括盘尼西林四环素、链霉素和磺胺类药物。在一些实施方案中,本发明的细胞包括整合进入它们的基因组的外源性抗性基因。
在一些实施方案中,本发明的细胞表达报告多肽。如本文所使用的,“报告多肽”是提供细胞中可辨认信号,或通过本领域已知的任何技术能够在细胞中明确检测到的多肽。报告多肽的例子包括,但不局限于链霉亲和素、β-半乳糖苷酶、表位标签(epitope tags)、荧光蛋白、发冷光蛋白(luminescent proteins)和发色酶(chromogenic enzymes)。
荧光蛋白对本领域技术人员来说是熟知的,包括,但不局限于GFP、AcGFP、EGFP、TagGFP、EBFP、EBFP2、Asurite、mCFP、mKeima-Red、Azami Green、YagYFP、YFP、Topaz、mCitrine、Kusabira Orange、mOrange、mKO、TagRFP、RFP、DsRed、DsRed2、mStrawberry、mRFP1、mCherry和mRaspberry。发冷光蛋白的例子包括但不局限于可催化发光反应的酶,比如荧光素酶。发色酶的例子包括但不局限于辣根过氧化物酶和碱性磷酸酶
表位标签的例子包括但不局限于V5-标签、Myc-标签、HA-标签、FLAG-标签、GST-标签和His-标签。额外的表位标签的例子描述在下面的参考文献中:Huang and Honda,CED:a conformational epitope database.BMC Immunology 7:7www.biomedcentral.com/1471-2172/7/7#B1.Retrieved February 16,2011(2006);和Walker and Rapley,Molecular biomethods handbook.Pg.467(Humana Press,2008)。这些参考文献以其全部特此通过援引并入本申请。
其他公开物或参考文献和实验细节的参考
本文提到的全部公开物和其他参考文献以其全部通过援引并入,犹如每个单个公开物或参考文献特别地和单个地被指明通过援引并入。本文引用的公开物和参考文献不认为是现有技术。
本发明将通用参考下面的实验细节被更好地理解,但是本领域技术人员很容易领会详细的具体实验仅仅是说明实验细节之后的权利要求书中限定的发明。
附图说明
图1A.细菌的分泌蛋白质组的抗菌效果。收集的上清液在非致病菌株铜绿假单胞菌ATCC27853上测试的生长抑制的潜能。
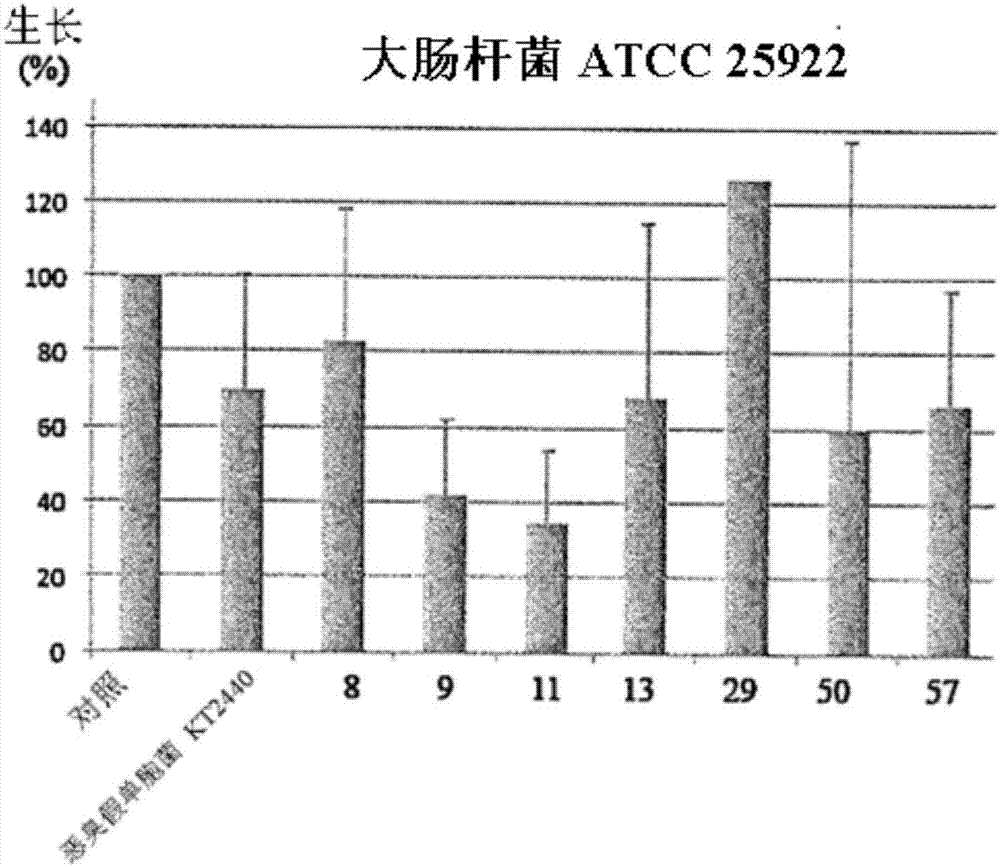
图1B.细菌的分泌蛋白质组的抗菌效果。收集的上清液在非致病菌株大肠杆菌ATCC25922上测试的生长抑制的潜能。
图1C.细菌的分泌蛋白质组的抗菌效果。收集的上清液在非致病菌株金黄色葡萄球菌NCTC8325上测试的生长抑制的潜能。
图2.PF-11的分泌蛋白质组的抗菌效果。PF-11的分泌蛋白质组的抗菌活性在参比菌株上测试(正如图1中)并且扩大至恶臭假单胞菌参比菌株KT2440和其它的恶臭假单胞菌环境隔离群。
图3A.PF-11的分泌蛋白质组级分的抗菌效果。分泌多肽和小分子的影响。测试这种级分对菌株铜绿假单胞菌ATCC27853、大肠杆菌ATCC25922、金黄葡萄球菌NCTC8325和恶臭假单胞菌参比菌株KT2440的生长的影响。
图3B.PF-11的分泌蛋白质组级分的抗菌活性。包括蛋白质的较大分子的效果。测试这种级分对菌株铜绿假单胞菌ATCC27853、大肠杆菌ATCC25922、金黄葡萄球菌NCTC8325和恶臭假单胞菌参比菌株KT2440的生长的影响。
图3C.PF-11的分泌蛋白质组级分的抗菌活性。煮沸的未加工的分泌蛋白质组的效果。测试这种级分对菌株铜绿假单胞菌ATCC27853、大肠杆菌ATCC25922、金黄葡萄球菌NCTC8325和恶臭假单胞菌参比菌株KT2440的生长的影响。
图4A.假单胞菌菌株分泌的肽的HPLC图谱。在M9培养基(对照)和恶臭假单胞菌参比菌株和指数期的PF-11分泌的肽之间的比较。该参比菌株具有最高浓度的最高蛋白质分子量,而菌株11在大小上与第一成分(the first contents)稍微地重合,但是大多数呈现了沿着数个kDa分布的多肽。
图4B.假单胞菌PF-11隔离群分泌的多肽的HPLC图谱。正如预期的,在SDS-PAGE之后,相比指数期,稳定期分泌蛋白质组具有明显较高的变异性和多肽含量水平。
图5.测定PF-11分泌蛋白质组的表面张力。
图6.PF-11分泌蛋白质组对大肠杆菌、金黄色葡萄球菌和铜绿假单胞菌参比菌株的粗提取物的降解酶活性的分析。
图7A.不同浓度的PF-11分泌蛋白质组对之前使用的大肠杆菌O157和耐甲氧西林金黄色葡萄球菌(methicilin-resistant S.aureus)(MRSA)ATCC 33591、剧毒的临床的致病隔离群和非致病大肠杆菌以及金黄色葡萄球菌的生长抑制分析。
图7B.不同浓度的PF-11分泌蛋白质组对之前使用的大肠杆菌O157和耐甲氧西林金黄色葡萄球菌(MRSA)ATCC 33591、剧毒的临床的致病隔离群和非致病大肠杆菌以及金黄色葡萄球菌的生长抑制分析。分离的PF-11分泌蛋白质组的多肽级分的效果。
图7C.不同浓度的PF-11分泌蛋白质组对之前使用的大肠杆菌O157和耐甲氧西林金黄色葡萄球菌(MRSA)ATCC 33591、剧毒的临床的致病隔离群和非致病大肠杆菌以及金黄色葡萄球菌的生长抑制分析。PF-11分泌蛋白质组的较大分子级分的效果。
图7D.不同浓度的PF-11分泌蛋白质组对之前使用的大肠杆菌O157和耐甲氧西林金黄色葡萄球菌(MRSA)ATCC 33591、剧毒的临床的致病隔离群和非致病大肠杆菌以及金黄色葡萄球菌的生长抑制实验。煮沸的PF-11的全部分泌蛋白质组的效果。
图8A.具有从参比菌株恶臭假单胞菌KT2440和七个选择的环境菌株(PF-08、PF-09、PF-11、PF-13、PF-29、PF-50和PF-57)提取的蛋白质谱的SDS-PAGE凝胶。在M9培养基中生长的稳定期细菌的细胞内总体的蛋白质属性。上样的试样相当于等量的总蛋白。
图8B.具有从参比菌株恶臭假单胞菌KT2440和七个选择的环境隔离群(PF-08、PF-09、PF-11、PF-13、PF-29、PF-50和PF-57)提取的蛋白质谱的SDS-PAGE凝胶。分泌蛋白质通过采用TCA/丙酮沉淀从在相同的生长条件下生长的相同的菌株的上清液回收。上样的试样对应于相等体积的收集的上清液,除了稀释1:8倍以避免过度上样的PF-11。泳道对照对应于未接种的生长培养基M9。
图8C.具有从参比菌株恶臭假单胞菌KT2440和七个选择的环境隔离群(PF-08、PF-09、PF-11、PF-13、PF-29、PF-50和PF-57)提取蛋白质谱的SDS-PAGE凝胶。沿着生长曲线从OD600nm 0,1到1,2(1,2对应于末期稳定期)由PF-11分泌到培养基中的蛋白质谱。施加到凝胶的试样分别对应于40、30、20、4和2ml上清液的培养物体积。M:分子量标记。
图9A.以等同于mg上清液中的总蛋白的μg蛋白酶测量的在指数期(11EXP)和稳定期(11STAT)的PF-11分泌蛋白质组的蛋白水解活性。
图9B.按照孵化温度(15、20、25、30、35、40和45℃)在生长的稳定期收集的PF-11分泌蛋白质组对酪蛋白的蛋白水解活性。数据以相对百分比提供,其中100%活性对应于每mg蛋白质115μg(参见表1)。
图9C.酶转换评价(Enzymatic turnover evaluation):在37℃过夜孵化之后PF-11稳定期分泌蛋白质组的蛋白水解活性(左图)
图9D.蛋白质转换评价:在37℃过夜孵化之前(泳道(lane)1)和之后(泳道2)PF-11分泌蛋白质组谱。在所有实验中深色的竖线代表了用至少3个单独的测量值的得出的标准偏差。
图10A.2D对角线SDS-PAGE凝胶被用来筛选PF-11分泌的蛋白质降解的最终的蛋白水解底物。来自大肠杆菌ATCC 25922的总的蛋白提取物被施加到SDS-PAGE凝胶并且与作为阴性对照的M9培养基和PF-11上清液一起在35℃孵化5h。在孵化之后进行第二方向(维度)电泳,在不存在蛋白质水解的条件下,呈现了连续的对角线带,正如在左边凝胶上看到的。箭头表示了第一方向移动的方向。
图10B.2D对角线SDS-PAGE凝胶被用来筛选PF-11分泌蛋白降解的最终的蛋白水解底物。与图10A相同,但是使用如上述描述的制备的海胆粘合剂印迹的蛋白质提取物。
图11.与M9培养基(对照)、PF-11和KT2440培养物和上清液(SN)一起孵化的海洋生物膜。在水族箱中储存的回收的皮氏培养皿被用于在18小时和40小时孵化之后测试附着的细菌和微藻的去除。
图12.与M9培养基(对照)、PF-11和KT2440培养物和用水晶紫染色的上清液(SN)一起孵化的海胆粘合剂印迹。最后两个载玻片显示不存在煮沸的PF-11上清液(煮沸的PF-11 SN)对生物胶的破坏的影响。
图13A.分别通过接种体水(O)、恶臭假单胞菌和铜绿假单胞菌参比菌株KT2440和NTC以及环境隔离群PF-11(阳性对照)和PF-29(阴性对照)归一化的百分比生长。在添加牛血清白蛋白的Nutrient Broth(NB+BSA)中的生长。
图13B.由分别通过接种体水(O)、恶臭假单胞菌和铜绿假单胞菌参比菌株KT2440和NTC以及环境隔离群PF-11(阳性对照)和PF-29(阴性对照)归一化的百分比生长。在添加明胶的Nutrient Broth(NB+明胶)中的生长。数值代表了两个测量值的平均值和误差线,各自标准偏差。
图14A.分别通过接种体水(O)、恶臭假单胞菌和铜绿假单胞菌参比菌株KT2440和NTC以及环境隔离群PF-11(阳性对照)和PF-29(阴性对照)归一化的百分比生长。在添加有牛血清白蛋白但没有氮源的M9(M9-N+BSA)中的生长。数值代表了两个测量值的平均值和误差线,各自标准偏差。
图14B.分别通过接种体水(O)、恶臭假单胞菌和铜绿假单胞菌参比菌株KT2440和NTC以及环境隔离群PF-11(阳性对照)和PF-29(阴性对照)归一化的百分比生长。在添加有明胶但没有氮源的M9(M9-N+明胶)中的生长。数值代表了两个测量值的平均值和误差线,各自标准偏差。
图14C.分别通过接种体水(O)、恶臭假单胞菌和铜绿假单胞菌参比菌株KT2440和NTC以及环境隔离群PF-11(阳性对照)和PF-29(阴性对照))归一化的百分比生长。在添加有牛血清白蛋白但没有碳源的M9(M9-G+BSA)中的生长。数值代表了两个测量值的平均值和误差线,各自标准偏差。
图14D.分别通过接种体水(O)、恶臭假单胞菌和铜绿假单胞菌参比菌株KT2440和NTC以及环境隔离群PF-11(阳性对照)和PF-29(阴性对照)归一化的百分比生长。在添加有明胶但没有碳源的M9(M9-G+明胶)中的生长。数值代表了两个测量值的平均值和误差线,各自标准偏差。
图14E.分别通过接种体水(O)、恶臭假单胞菌和铜绿假单胞菌参比菌株KT2440和NTC以及环境隔离群PF-11(阳性对照)和PF-29(阴性对照)归一化的百分比生长。在添加有牛血清白蛋白的假单胞菌基本培养基(PMM+BSA)中的生长。数值代表了两个测量值的平均值和误差线,各自标准偏差。
图14F.由分别通过接种体水(O)、恶臭假单胞菌和铜绿假单胞菌参比菌株KT2440和NTC以及环境隔离群PF-11(阳性对照)和PF-29(阴性对照)归一化的百分比生长。在添加有明胶的假单胞菌基本培养基(PMM+明胶)中的生长。数值代表了两个测量值的平均值和误差线,各自标准偏差。
图15.选择的隔离群细胞外蛋白质水解活性的直观观察。在暴露于M9完全培养基生长的培养物中15min、8小时、72小时和2个月之后,评估胶片(photofilms)的表面明胶层的降解。
图16A.来自参比菌株恶臭假单胞菌KT2440(1)和选择的环境隔离群PF-09、PF-11、PF-29以及参比菌株NTC的分泌蛋白质的SDS-PAGE蛋白质谱(protein profile)。分泌的蛋白质是通过采用TCA/丙酮的沉淀从上清液回收的。上样的试样对应于相等体积的收集的上清液-在凝胶的左手边表明了分子量标记。
图16B.明胶酶谱分析中的分泌的蛋白质的细胞外蛋白酶谱。
图17A.在与10mM PMSF和/或10mM EDTA抑制剂一起孵化试样之后,明胶酶谱分析中的铜绿假单胞菌NTC 27853参比菌株环境隔离群的分泌的蛋白质的细胞外蛋白酶谱。
图17B.在与10mM PMSF和/或10mM EDTA抑制剂一起孵化试样之后,明胶酶谱分析中假单胞菌PF-11环境隔离群的分泌的蛋白质的细胞外蛋白酶谱。
图18A.通过分类同源性(taxonomic homology)分组的PF-11分泌蛋白质组蛋白。
图18B.通过分子功能分组的PF-11分泌蛋白质组蛋白。
图18C.通过酶活性分组的PF-11分泌蛋白质组蛋白。
图19.在生长的中间指数期添加PF-11之后,在海洋液体培养基中海科贝特氏菌(Cobetia marina)的细菌生长曲线的演变。
图20.通过液体培养基微稀释法测试(broth microdilution tests),通过OD600nm和ppm(w/v)的PF-11浓度(对应于mg/L)测定的生长%测量的PF-11对2个海洋细菌生长(霍乱弧菌和创伤弧菌)的抗菌剂影响。
图21.PF-11防止细菌生物膜的形成,是通过水晶紫染色测定的附着细胞密度%测量的。PF-11浓度是ppm(w/v),对应于mg/L。
图22.PF-11对1个海洋(浮游生物(Tetraselmis suecica))和2个淡水(莱茵衣藻(Chlamydomonas reinhardtii)和月牙藻(Pseudokirchneriella subcapitata))微藻生长的除藻影响。PF-11浓度为g/L。
图23.小五斑按蚊幼虫(Anopheles atroparvus larvae)针对不同浓度的PF-11分泌蛋白质组的存活率分析。
图24.不同浓度的PF-11分泌蛋白质组针对海虱桡足类的存活率分析。
图25.不同浓度的PF-11分泌蛋白质组针对海虱幼虫的存活率分析。
实验细节
下面提供了实施例以便于更加完整的理解本发明。下列实施例阐明了做出本发明和实践本发明的典型方式。然而,本发明的范围不局限于在这些实施例中公开的具体实施方案,它仅仅用于说明的目的。
实施例1-菌株PF-11的分离、表征和保存
环境采样和细菌分离
在葡萄牙里斯本(Lisbon,Portugal)周围的塔霍(Tagus)河地区收集土壤和/泥试样。收集的原料(10g)用无菌水(50mL)均质。在混合物重力沉降之后,液体级分被回收了。然后,原料悬浮液(包括微生物)通过离心(12000g,5min)被收集了。产生的颗粒被重新悬浮在无菌水中。在LB(Luria Bertani)培养基中完成了初期生长。这些培养物被稀释了(10-2到10-9)并且在LA(LB+琼脂)或具有氨苄青霉素(ampicillin)(8μg/mL),阿莫西林(amoxicillin)(8μg/mL)或头孢噻肟(cefotaxime)(2μg/mL)的LA中被培养以选择耐药的或呈现减少的感受性的菌株。具有明显的大小或形态差异的菌落被选择了。每个选择的菌落遭受连续的培养皿通道(successive plate passage)(达到3次)以获得纯培养物。
分离的菌株的鉴定。
在具有环己酰亚胺的选择性的McConkey nr3培养基中进行革兰氏阴性菌株的检测。进行生物化学表征以确定广泛的菌株特征。TSI(三糖铁(Triple Sugar Iron))、氧化酶和过氧化氢酶实验推测发酵右旋糖、乳糖、蔗糖和硫化合物的能力和产生氧化酶和/或过氧化氢酶的能力(Hajna 1945)。根据先前的测定,市售表型鉴定系统(commercially available phenotypic identification system)被用于进行分离的革兰氏阴性细菌的准确鉴定。结合自动化系统和软件(BioMérieux),使用(API 20E和API ID32 GN)试纸提供具有精度≥99,5%的鉴定。分离的菌株PF-11被鉴定为恶臭假单胞菌(Pseudomonas putida),具有99,9%的精度。
MIC测定。
根据CLSI标准(CLSI,M02-A10;CLSI,M100-S21),通过琼脂稀释和纸片扩散法(disk diffusion),MICs(最低抑菌浓度)被测定了。简单地说,制备LA培养皿,补充待测试的抗生素的连续稀释以测定MIC。防止菌株生长的最低抗生素浓度被认为是MIC值。正如所推荐的,菌株大肠杆菌ATCC 25922被当作对照菌株。使用CLSI标准和通过EUCAST的抗性断裂点(resistance breakpoints)的参考值,测定菌株PF-11对青霉素、羟氨苄青霉素(amoxycillin)、头孢噻肟(cefotaxime)、头孢他啶(ceftazidime)、头孢甲氧噻吩(cefoxitine)、氨曲南(aztreonam)的耐药性。
PF-11菌株的保存。
以多个小份,菌株被保存在-80℃,使用补充20%甘油的(conservation medium)的LB培养基作为保存液。
实施例2-PF-11培养物生长,化合物制备,分泌的化合物的回收和表征
PF-11生长条件。
冷冻的细菌小份在LB琼脂培养基中在30℃过夜培养(16-18h)。然后一个菌落被用于移入无菌的包含补充葡萄糖的M9培养基的烧瓶中,在30℃,以120r.p.m.在细菌恒温摇床中生长16h。
从培养物中回收化合物。
细胞通过离心(14.000r.p.m.,4℃,15min)被移走以及上清液被收集了。采用具有0.22μm DURAPORE过滤器(Millex GP,Millipore,Ireland)的过滤装置,通过过滤上清液被灭菌了。通过在30℃在LA培养皿中孵化50μl上清液至少16h,无菌被应验了。
化合物的原始混合物的纯化。
上清液在-80℃冷冻并且通过冻干法脱水。然后它被重新悬浮在水中并且通过使用2kDa的切断,透析被进行以去除过量的盐。透析的混合物重新冻干并且作为粉末在-80℃保存。
鉴定存在于混合物中的蛋白质。
通过十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis)(12%SDS-PAGE)以微凝胶形式(mini-gel format)(来自Bio-Rad的7x7cm Tetra系统)分离分泌组蛋白质(Secretome proteins)。在每个泳道,20微克蛋白质被使用了。试样用MilliQ水稀释10倍并且与还原缓冲液(reduction buffer)(62.5mM Tris-HCl,pH 6.8,20%(v/v)甘油,2%(w/v)SDS,5%(v/v)b-巯基乙醇(b-mercaptoetanol))混合。在电泳之前,试样在100℃加热5min。蛋白质带用考马斯亮蓝R-250(Coomassie Brilliant Blue R-250)染色。
蛋白质带人工地从凝胶切离并且用MilliQ水洗涤并且用50%(v/v)乙腈,随后用100%乙腈褪色。半胱氨酸残基用10mM DTT还原以及用50mM碘乙酰胺烷基化。凝胶块在真空下通过离心干燥并且在4℃在消化缓冲液(digestion buffer)中再水化,该消化缓冲液包含50mM NH4HCO3和6.7ng.μL-1胰蛋白酶(改性的猪胰蛋白酶,蛋白质组级别,普洛麦格(Promega))。30min后,上清液被移走并且被丢弃以及20μL 50mM NH4HCO3被添加了。消化被允许在37℃过夜进行。在消化之后,剩余的上清液被移走并且在-20℃保存。
在分析之前,生成的多肽混合物用ZipTip C18(Millipore)脱盐,真空干燥并且在0.1%FA中重构。nano-LC–MS/MS设置如下。试样通过Finnigan Micro AS自动进样器注射并且通过使用Micro AS-Surveyor MS色谱系统以15μl/min的流速被负载到NanoEase trap column Symmetry 300TM,C18,5μm(Waters)上。多肽使用C18 PepMap 100,3μm毛细管柱(75μm,15cm)(Dionex,LC Packings),运行160min被分离,包括以0%B等度洗脱10min,具有线性梯度的三个连续步骤:从0%到15%B,10min,从15%到60%B,70min以及从60%到100%B,20min,然后以100%B等度洗脱(A=0.1%FA的H2O溶液,B=0.1%FA的CH3CN溶液)10min。用于多肽分离的110nl/min流速是由内部分离系统(in-house splitter system)提供的。柱子出口被连接到TriVersa NanoMate的LC耦合器,该耦合器连接到7T LTQ-FT Ultra。质谱仪以数据相关模式(datadependent mode)被操作。每次扫描中多达10个最强的离子被碎成碎片并且在线性离子阱中被发现了。通过设定电容为用于测定全扫描(survey full scan)的1百万计数和用于MS/MS实验的50,000计数,到FTICR池和线性阱中的离子输送被自动地控制用于分析仪的最佳性能。已经选择用于MS/MS的靶离子动态地被排除60s。通过使用Sequest和Mascot引擎用Proteome Discoverer软件v1.2(Thermo)进行数据库检索。采用的数据库是Swissprot和NCBInr。
Blast2GO程序被用于鉴定的蛋白质的功能分析,其由3个主要步骤组成:比对(blast)用以发现同源序列,基因图绘制(mapping)用以收集与比对匹配数(blast hits)相关的GO-术语(GO-terms)和注释用以将功能术语分配给来自基因图绘制中收集的GO术语池的查询序列。功能分配是基于GO数据库。鉴定的蛋白质的序列数据被上传为多个FASTA文件用于通过Blast2GO软件批次分析。使用blastp针对公开的Swissprot数据库进行比对步骤。其它参数被保持在默认值:1e-3的e值阈值和每个序列20个匹配数的恢复(a recovery of 20 hits per sequence)。再者,最小校准长度(hsp过滤器)被设定为33以避免具有小于100个核苷酸的匹配区的匹配数。QBlast-NCBI被设定为Blast模式。具有e-value-hit-filter 1.0E-6的注释配置(annotation configuration),55的annotation CutOff和5的GO weight已经被选择了。鉴定的蛋白质采用组合图的分析工具被分组在选择的GO类别的亚组(例如分子功能)中,用20的序列过滤以获得信息的紧凑表示。
质谱和同源检索分析显示了PF-11分泌蛋白质组包含至少171个蛋白质。鉴定的蛋白质的功能分析揭示了分泌蛋白质组蛋白质1)显示与来自假单胞菌属的蛋白质高同源性,更具体地说,铜绿假单胞菌(Pseudomonas aeruginosa)(图18A);2)36%分泌蛋白质组的蛋白质具有催化活性(图18B)以及3)这些之中,水解酶是分泌蛋白质组中最丰富的酶(图18C)。
实施例3-来自环境来源的抗菌剂
在先前的研究过程中,通过对抗生素的耐药性(Meireles 2013)收集的,具有较强的适应技能的环境恶臭假单胞菌(Pseudomonas putida)菌株的异类集合被用来筛选分泌的天然化合物对微生物生长控制的潜能。Meireles 2013的内容在此通过援引并入到本申请中。来自该集合的一组恶臭假单胞菌(P.putida)隔离群基于它的适应水平,抗生素耐药性和一般的适合性(数据没有显示)被选择了,并且目的在于收集多种菌株特征。。这些菌株的分泌蛋白质组(即它们分泌的分子)被收集并且首次测试对三个模式菌株种类大肠杆菌、金黄色葡萄球菌(Staphylococcus aureus)和铜绿假单胞菌的生长的影响。一个菌株PF-11显示了显著的抗菌潜能。接着这个初始设置被扩大到所有的恶臭假单胞菌(P.putida)菌株,分泌蛋白质组是从该恶臭假单胞菌菌株收集的。携带抗菌性质的化合物的初始表征被进行了,显示了可对它的影响作出贡献的多肽、酶和表面活性剂的存在。最后,为了测试PF-11分泌蛋白质组对致病菌株的影响以及评估未来应用于传染治疗的潜能,临床菌株MRSA(耐甲氧金黄色葡萄球菌(Methicillin resistant S.aureus))和剧毒的大肠杆菌O157的生长被分析了。因此,从环境中分离得到的恶臭假单胞菌PF-11被确定为抗菌化合物的较强的分泌细胞,该抗菌化合物作为抗生素在未来的应用方面具有丰富的潜能。
原料&方法
细菌环境隔离群和测试菌株
先前,65个环境恶臭假单胞菌的集合从土壤分离,宏观地(不用显微镜)选择,鉴定并且针对已获得的抗生素耐药性机理表征(Meireles 2013)。土壤和泥试样在葡萄牙里斯本地区的塔霍河附近的多个地点收集。在初步地表型分析之后,7个恶臭假单胞菌菌株(PF-8、PF-9、PF-11、PF-13、PF-29、PF-50、PF-57)(显示了主要的适应技能(快速生长,最低的营养需要量)和抗菌的多重耐药性特征)经选择用来筛选它们分泌的抗菌化合物。
细菌培养物生长条件
所有采用的菌株在M9培养基中接种之前在-80℃在5%甘油中保存并且在35℃在LA(Luria broth Agar)中过夜培养(16小时)。单个菌落在补充0.4%葡萄糖的液体M9基本培养基(50mM Na2HPO4,22mM KH2PO4,8.5mM NaCl,18.7mM NH4Cl,0.1mM CaCl2,1mM MgSO4,0.0005%硫胺素)中在35℃,120r.p.m.,接种1小时、2小时、4小时、6小时或24小时(后者被界定为稳定期)。
从细菌培养物制备上清液
正如之前描述的(Roy et al.),来自M9培养基中的细菌培养物的上清液被回收了并且通过过滤装置中的0.22μm尼龙过滤器(Millex GP,Millipore,Ireland)无菌过滤了。为了保证无菌,100μl每个上清液在35℃被孵化至少16小时。
对于抗菌实验,滤过的上清液被直接使用了;对于体外蛋白质水解实验,上清液在-50℃冻干并且被悬浮在水中以及相对于收集的上清液的原始体积浓缩20倍。
培养物粗蛋白提取和分离
菌株在指定条件下在LB中过夜生长。然后培养物以10000g离心10min以将细菌制成团块。蛋白质提取缓冲液被添加了并且被煮沸5分钟以溶解细胞。蛋白质在Nanodrop装置中定量(在280nm测量(Bio-Rad))以及被均质到最终的10μg/10μl。1:1体积的具有(Sigma)的蛋白质上样缓冲液和1%巯基乙醇直接在12.5%PAA凝胶中上样样品用于SDS-PAGE之前被添加。
从细菌培养物制备上清液
选择的细菌隔离群(bacterial isolates)在35℃培养16小时并且保存直至额外的48小时。菌落在35℃,120r.p.m.在Luria Bertani液体培养基(LB)或补充有葡萄糖的M9基本培养基中生长1、2、4、6或24小时(稳定期)。在培养物已经到达目标生长期之后,它们被保存用于后续使用或以10000g离心15min。上清液采用过滤装置中的0.2μm孔尼龙过滤器(Millex GP,Millipore,Ireland)过滤。为了保证无菌,1mL每个上清液在37℃孵化72h。当需要小部分时,过滤的上清液在具有10kDa截留的超过滤器管子中离心,以及上面级分在M9培养基中被重新溶解到相似的最终体积,避免级分浓度或缓冲组合物的变化。加热灭活的过滤的上清液通过在100℃沸水中孵化10分钟被获得以促使蛋白质变性。用在4℃静置1周或2周的任意直接描述的级分进行一些实验,以“丢失”蛋白水解活性同时保持多糖和表面活性剂性质不受影响并且分别评估它们以避免在分馏过程(fractioning procedures)中分子的非特定减少。针对每个实验,进行至少3个单独的重复。对于HPLC分析,过滤的上清液(200ml)在-20℃保存并且在-54℃冻干并且最后被重新悬浮在5ml重蒸馏水中;多肽级分通过10kDa截留过滤器(cut-off filter)分离使得多肽能够被分析。
细菌蛋白降解研究
200μg从大肠杆菌模式菌株提取的总蛋白以4到7μg/μl的最终浓度与上清液(各个的)混合并且在37℃孵化。为了抑制蛋白酶活性,4-甲脒基苯基甲烷磺酰基氟化物盐酸盐(4-amidinophenylmethanesulfonyl fluoride hydrochloride)以25μM的最终浓度被添加了。反应的内含物与上样染料(loading dye)混合(6倍)并且通过SDS-PAGE分离。接着是相同的步骤以测定在不同温度(具体地,从15到45℃,每隔5℃)下,稳定期11个隔离群分泌蛋白质组的活性的。这个步骤再次被用于评估在4℃随着保存时间的延长分泌蛋白质组的蛋白水解活性的丢失。针对每个实验,进行最少3个单独的重复。
培养物上清液中的蛋白质的检测
隔离群在指定条件下在Luria液体培养基中过夜生长之后,培养物以10000g离心15min以将细菌制成团块并且上清液被回收了以及通过0.2μm过滤器(Millipore)无菌滤过,正如先前所描述的(Roy et al.)。然后相等量的蛋白质被上样到毗连的孔中,通过SDS-PAGE以12.5%分离。
通过HPLC分离PF-11分泌的多肽
HPLC系统由LDC,Milton Roy,Consta Metric 1泵和Lichrosorb RP-18(Merck Hibar)柱(粒径5μm,长度–125mm,内径–4mm)组成。泵压力是60MPa。注射器是自动类型(Rheotype Gilson Abimed Model 231)。检测器具有荧光光谱仪(Shimadzu RF 535,γ激发–365mm以及γ发射–444nm)。流速是每分钟1mL,以及进样量是50μL。流动相是水/乙腈(75:25)。
标准溶液
AFM1、AFB1、AFB2、AFG1和AFG2是从Sigma-Aldrich(St.Louis,MO,USA)获得的。市售的AFM1储备溶液是1,000ng/mL。通过使用HPLC级乙腈/水稀释储备溶液1:40以提供约25ng/mL制备注入溶液(spike solution)。稀释的储备溶液,140μL被添加到70mL脱脂Hipp婴儿奶粉中。通过以1:500稀释法稀释2μg/L AFM1制作校准曲线。当不使用时,储备溶液被保存在4℃。
结果
先前通过抗生素选择(Meireles 2013)收集的环境恶臭假单胞菌隔离群的集合被用于筛选天然细菌工具的微生物生长控制潜能。在这些菌株中,一些隔离群显示了平均以上的适应潜能和细胞外分泌水平(数据没有显示)并且7个假单胞菌环境隔离群(PF-8、PF-9、PF-11、PF-13、PF-29、PF-50、PF-57)因此被选择并且进一步被研究。最初,这些选择的隔离群和对照菌株恶臭假单胞菌KT2440的细菌培养物的上清液在基本培养基中和生长的稳定期收集以评估它们的分泌蛋白质组的抗菌效果。收集的上清液的生长抑制潜能在人类传染病中涉及的3个广泛研究的细菌种类:大肠杆菌、金黄色葡萄球菌和铜绿假单胞菌上测试。3个非致病菌株(大肠杆菌ATCC25922,金黄色葡萄球菌NCTC8325和铜绿假单胞菌ATCC27853))在这个阶段被使用以评价分泌蛋白质组的抗菌效果。3个测试菌株在丰富培养基(rich medium)中生长并且以1:1体积与8个分泌蛋白质组和由基本生长培养基M9组成的对照一起孵化16h,其中上清液被回收了(图1A-C)。铜绿假单胞菌(P.aeruginosa)明显不受由7个隔离群或参考菌株恶臭假单胞菌KT24240分泌的化合物影响(图1A)。相反,大肠杆菌和金黄色葡萄球菌测试菌株很大程度地受由一些恶臭假单胞菌分泌蛋白质组影响。仅仅考虑到在不同的重复中一致的抑制效果,大肠杆菌生长被PF-9和PF-11的分泌蛋白质组抑制至少40%(图1B)。采用金黄色葡萄球菌生长抑制的测试显示了对分泌蛋白质组较大的敏感性,菌株PF-13、PF-29和PF-50的分泌蛋白质组使生长减少大于50%,尤其是,PF-11的分泌蛋白质组使金黄色葡萄球菌生长损伤90%(图1C)。考虑到菌株PF-11的蛋白质分泌组在大肠杆菌和金黄色葡萄球菌中显示了最广泛的生长抑制,它被选择用于进一步的分析。
如上,假单胞菌PF-11的分泌蛋白质组的细菌生长的影响被测试了,但是添加了早先使用的全部假单胞菌隔离群和参比菌株作为靶标。来自图2的数据清楚地显示了从PF-11菌株的培养基回收的分泌的化合物对所有的恶臭假单胞菌菌株具有很大程度的抑制影响,大约50%的生长抑制,显示了分泌的化合物对来自相同种类的细菌的反常影响。相反,当从稳定生长期的PF-11的培养物回收的培养物上清液对PF-11菌株本身测试时,生长被诱导20%(图2),显示了除了早期检测到的其它细菌的生长抑制因子之外,还存在对该菌株具有特异性的生长增强子。这些生长增强子(其对PF-11具有特异性)的存在意味着富集PF-11的基本上纯的培养物或培养物与它们的自然状态的细胞表现不同。相比在自然界中的PF-11细胞,富集PF-11的基本上纯的培养物或培养物证明了增加的生长。富集PF-11的基本上纯的培养物或培养物因此比PF-11细胞(当它们存在于自然界中时)更有效。例如,对于产生用在防污、抗菌或其它的应用的分泌化合物,基本上纯的或富集的培养物更有用。
在基本培养基M9中在生长的稳定期PF-11分泌的分泌蛋白质组被回收了并且通过使用10kDa排阻膜过滤器(exclusion membrane filters)分离。获得两种级分:一种含有分泌的多肽和小分子,第二种含有包括蛋白质的大分子。这些级分对先前使用的菌株的生长的影响被测试了。铜绿假单胞菌ATCC27853的生长仍然不受PF-11分泌蛋白质组的任何级分影响,正如预期的(图3A&图3B)。两种其它的革兰氏阴性菌株(恶臭假单胞菌KT2420和大肠杆菌ATCC25922)的生长很大程度地被完整的分泌蛋白质组损伤(50%)。然而,大肠杆菌生长仅仅被分泌的多肽级分稍微地减少(25%),同时它对恶臭假单胞菌没有显著的影响(图3A)。相反,包含蛋白质和大分子的级分普遍地保留了总的抗菌活性(针对这些两个菌株观察到的),即使有点减少(图3B)。显然,金黄色葡萄球菌NCTC 8325几乎完全被PF-11的完整的分泌蛋白质组抑制(90%)。来自图3A的数据显示了分泌蛋白质组的多肽级分再现了相同的抑制,表明了这种级分作为抗葡萄球菌化合物的主要来源。然而,该蛋白质级分(高于10kDa)也显示了高于50%抑制该菌株的生长的影响(图3B),表明了分泌蛋白质组中存在多个类型的抗葡萄球菌的分子。为了进一步表征PF-11上清液的活性,在煮沸(以使分子变性以及在其它效果中,破坏存在的任何酶活性)之后,它的抗菌影响被测试了。图3C中的数据显示了煮沸的分泌蛋白质组保留了之前在图2中观察到的抗菌影响。
为了表征分泌的多肽含量(peptidic content)(如上述在图3B中制备的),包含在生长的对数期的恶臭假单胞菌PF-11分泌蛋白质组中的原料的评估是通过HPLC进行的,采用恶臭假单胞菌KT2440作为参比菌株。参比菌株分泌的多肽谱呈现了较差的洗脱图,该洗脱图具有代表只有在洗脱的最初步骤看见的非常少的多肽的一些峰。相反,PF-11的分泌蛋白质组按照色谱法同样洗脱显示了明显多的多肽,尤其是,比菌株KT2440多很多的量(图4A)。PF-11分泌蛋白质组的这种多肽级分的更详细的HPLC分析(现在比较在生长的指数期和稳定期获得的提取物)显示了由该菌株分泌的多肽的错综复杂性(图4B)。再者,这些小分子的很强的累积在稳定的生长期是明显可检测的,显示了该多肽良好的稳定性并且确定菌株恶臭假单胞菌PF-11为杰出的多肽分泌菌株。
细菌多肽通常是具有表面活性剂性质的脂肽。因此,在生长的稳定期的PF-11的细菌培养物的表面张力被分析了并且与生长培养基和菌株KT2440比较(图5A)。相同体积的溶液被滴在塑料表面上以使得液滴的直径和它的高度可见(参见原料和方法)。单独生长培养基和菌株KT2440在沉积物(deposition)的直径和高度方面都显示了类似的特征。相反,从伴随的直径的增加(与对照相比翻倍)和高度的剧烈减小明显看出,PF-11培养物的液滴显示了表面接触面很明显的变大。具有培养的PF-11的培养基剧烈地减小了接触表面张力,表明了表面活性剂分子存在于培养基中。为了从细菌细胞的存在中除去任何人为的影响,采用菌株KT2440和PF-11的纯化的分泌蛋白质组重复实验(图5B)。之前采用细菌培养物获得的数据采用它们的分泌蛋白质组被证实了,显示了菌株PF-11主动地分泌表面活性剂分子到培养基中。
按大小高于10kDa的化合物的级分对多个测试的目标菌株显示了显著的的抗菌效果。即使煮沸提取的分泌蛋白质组也没有明显地改变它的性质,酶(即具有催化活性的蛋白质)的存在明显有助于它显示的抑制效果。因此,降解酶的存在是采用来自大肠杆菌、金黄色葡萄球菌和铜绿假单胞菌菌株的粗蛋白质提取物分析的,与指数和稳定生长期提取的PF-11的分泌蛋白质组,KT2440的分泌蛋白质组以及作为对照的水一起过夜孵化(图6)。与水一起孵化显示了在一夜之后在37℃没有外部效应的影响的靶蛋白模式。与KT2440的分泌蛋白质组一起孵化过夜之后的蛋白质谱引起顶部带(top bands)(对应于大蛋白质)模糊,表明了一些降解,但是在低水平。相反,即使是指数期收集的,具有相比稳定期浓度较低的化合物的PF-11的分泌蛋白质组也强烈地降解了所有的蛋白质提取物,正如以上观察的。这种分析显示了PF-11分泌蛋白质组中的分泌的降解酶的存在,其以突出的浓度和非常有效的活性,能够降解比如来自不同细菌的全部粗蛋白提取物的复杂的底物。
因此,假单胞菌PF-11的分泌蛋白质组在组成和活性方面非常丰富并且复杂,对革兰氏阴性菌株和革兰氏阳性菌株具有很强的抗菌影响。对于有关此类化合物的潜在应用的进一步研究来说,提取和浓缩分泌的分子并且继续进行它们的表征是有必要的。因此,分泌蛋白质组通过冻干浓缩,通过缓冲液交换脱盐并且被重新悬浮在水中。这种重构溶液在不同浓度(10X、4X和2X,1X的浓度相当于在PF-11培养物的上清液中的浓度)在之前被测试的大肠杆菌和金黄色葡萄球菌菌株上被评估,以评价化合物是否在这种纯化工艺之后保留它们的抗菌特性。再者,因为这些研究的一个目标可以是实施新的抗感染方法以及致病菌株具有不同于“模式”菌株的特征,两个致病菌株被用于测试纯化的由PF-11分泌的化合物。大肠杆菌O157和耐甲氧西林金黄色葡萄球菌(methicilin-resistant S.aureus)(MRSA)ATCC 33591是通常在官方的EU对照和监测中用作参比菌株的剧毒的临床的致病隔离群。首先,纯化的,脱盐的和浓缩的总分泌蛋白质组被用在采用这些4个菌株的生长抑制实验中(图7A)。如前,对于所有测试的菌株,PF-11分泌蛋白质组的强大的抗菌活性是很明显的。金黄色葡萄球菌菌株完全地由2X浓缩的提取液抑制。然而,随浓度变高(4X和10X),抑制效果减少了,但是高于80%的生长抑制仍然实现了。在PF-11分泌蛋白质组的存在下,两个大肠杆菌菌株表现类似,即使大肠杆菌O157也比大肠杆菌ATCC 25922对它的较低浓度的抗菌效果更具有抗性。不考虑这种区别,在10X的浓度,两个菌株生长被抑制90%。正如上述,重新悬浮的分泌蛋白质组的多肽级分被分离了并且它的抗菌效果被分析了。多肽在2X的浓度显示了对大肠杆菌菌株减少的影响(图7B)。然而,在4X浓度,两个菌株的生长受损50%以及在10X浓度完全的生长抑制实现了。至于多肽的抗葡萄球菌效果,在2X浓度,实现了约90%的抑制,在更高浓度,接近100%抑制。当分析包含按大小高于10kDA的分子的级分的抗菌效果时,用PF-11培养物的上清液对大肠杆菌25922观察到的的生长抑制被证实了(图7C),然而这种级分对致病大肠杆菌O157的生长没有显著的效果。令人惊奇地是,对于两个菌株,金黄色葡萄球菌生长强烈地受损了,具有超过80%的抑制,而利用上清液,仅仅约50%的抑制被实现了。使用这种相同的级分,但煮沸以改变分子结构的其它测试被进行了,结果非常类似于未煮沸的悬浮液(图7D)。
实施例4-PF-11分泌蛋白质组的防污效果
在先前研究的过程中通过凭借对抗生素的耐药性的主动选择,恶臭假单胞菌的环境菌株的异类的集合被收集了(Meireles 2013)。这组菌株被用来开采细胞外分泌潜能(extracellular secretory potential)以鉴定和表征由恶臭假单胞菌产生的蛋白酶。与恶臭假单胞菌KT2440(在生物修复应用(bioremediation applications)的背景下分离和研究的菌株)相比较,在来自该集合的所有其它细菌中假单胞菌PF-11作为具有潜在的生物技术相关性的有用的菌株出现了。被用于筛选这种环境菌株的选择步骤和它的作为防污剂分泌细菌的潜能的评估在本文描述了。很强蛋白水解效果在体外在粗细菌蛋白提取物和海洋生物粘合剂的降解中被显示了。再者,使用上清液或整个PF-11细菌培养物的体内实验明显地证明了在破坏海洋大面积污染和在降解由海胆产生的生物胶方面这种菌株的防污性能。
在其它的生物分子中,从环境分离的菌株假单胞菌PF-11因此能够分泌蛋白酶(在其他生物分子之中)的浓缩混合物,在小面积污染和大面积污染事件中能够强有力地促进防污效果。因此,来自天然来源的此类化合物对应用于海洋防污技术潜在地有用,比如添加到新的涂料或防护漆中的添加剂。
原料和方法
细菌隔离群
先前,65个环境恶臭假单胞菌的集合从土壤分离,宏观地选择,鉴定并且针对已获得的抗生素耐药性机理(Meireles 2013)表征。土壤和泥试样在葡萄牙里斯本地区的塔霍河附近的多个地点收集。在初步地表型分析之后,7个显示了主要的适应技能(快速生长,最低的营养需要量)和抗菌的多重耐药性属性的恶臭假单胞菌菌株经选择用来筛选它们的分泌行为。这种环境组被分析了且与恶臭假单胞菌KT2440(研究很成熟的参比菌株(Palleroni))比较。
细菌培养物生长条件
所有采用的菌株在M9接种之前在-80℃被保存在5%甘油中并且在35℃在LA(Luria broth Agar)中过夜(16小时)培养。单一菌落在补充有0.4%葡萄糖的液体M9基本培养基(50mM Na2HPO4,22mM KH2PO4,8.5mM NaCl,18.7mM NH4Cl,0.1mM CaCl2,1mM MgSO4,0.0005%硫胺素)中(Miller et al.)在35℃,120r.p.m.,生长1小时、2小时、4小时、6小时或24小时(后者被界定为稳定期)。在培养物到达理想的生长期之后,它们要么被收集用于直接使用,要么在10.000g离心至少15min以从从上清液收集的分泌的分子分离培养基中的大体积细胞(bulk cells)。
细菌细胞内蛋白质提取和分离
来自生长的指数期或稳定期的细菌细胞团块是通过在10.000g离心15min收集的。细菌被重新悬浮在蛋白质提取缓冲液(2%SDS,20mM Tris,2mM PMSF)(Sambrook et al.)中并且悬浮液被煮沸5分钟以诱导细胞溶解。蛋白质在Nanodrop装置(Thermo Fisher Scientific)中通过在280nm测量定量,以及均质到最终的10μg/10μl。在12.5%凝胶中上样试样用于SDS-PAGE之前,具有(Coomassie Brilliant )(Sigma)(0.03%)、甘油(30%)和β-硫基乙醇(10%)的1:1体积的蛋白质上样缓冲液被添加并且立即煮沸。
从细菌培养物制备上清液
来自M9培养基中的细菌培养物的上清液被回收了并且通过过滤装置中的0.22μm尼龙过滤器(Millex GP,Millipore,Ireland)无菌过滤,正如之前描述的(0)。为了保证无菌,100μl每个上清液在35℃被孵化至少16小时。对于防污实验,滤过的上清液被直接使用了;对于体外蛋白质水解分析,上清液在-50℃冻干并且悬浮在水中以及相对于收集的上清液的原始体积浓缩20倍。
分泌蛋白质TCA沉淀
通过使用三氯乙酸(TCA)和丙酮沉淀无菌过滤的蛋白质上清液。在4℃在丙酮中25%的TCA溶液以体积比1:3(通常8ml TCA用以沉淀25ml上清液)被添加到每个试样。在均质之后,混合物在冰上孵化15min,然后在10.000g,4℃离心10min。获得的团块用丙酮洗涤两次,通过分别悬浮在10ml和4ml中,接着在相同的条件下离心。干燥的最终沉淀物悬浮在40μl SDS蛋白质变性上样缓冲液(SDS protein denaturing loading buffer)(62.5mM Tris HCl pH 6.8,2%SDS,5%β-巯基乙醇,20%甘油,0,01%溴酚蓝)中,10μl SDS蛋白质变性上样缓冲液在12.5%SDS-PAGE凝胶中进行电泳。凝胶用考马斯亮蓝(Sigma)染色。施加到凝胶的沉淀的级分相当于6.5ml原始的细胞培养物悬浮液。
蛋白水解分析
为了评估恶臭假单胞菌分泌蛋白质组的水解蛋白含量,根据厂商的说明书,采用了荧光蛋白酶检测试剂盒(Fluorescent Protease Assay Kit)(Pierce)。简单地说,该分析涉及通过荧光共振能量转移(fluorescence resonance energy transfer)(FRET)评估试样中的蛋白酶活性的荧光素标记的底物(酪蛋白)的使用。这种重标记的完整的蛋白质底物的荧光性质在被蛋白酶消化时显著地变化,这导致蛋白质水解的可检测指示:随底物被消化为更小的荧光素标记的碎片(同转移荧光过程(homotransfer fluorescence process))总荧光信号增加了(起因于荧光猝灭的减少)。在具有标准的荧光素激发/发射滤波器(485/538nm)的0.5cm的光路石英吸收池中采用Fluorolog-3(Horiba Jobin Yvon)进行荧光性测量。对于校准,胰蛋白酶是选择的常规的蛋白酶。分泌蛋白质组试样在TBS(25mM Tris,0.15M NaCl,pH 7.2)中稀释100倍。胰蛋白酶标准样和酪蛋白溶液在相同的缓冲液中制备。所有的试样和标准样与底物一起在室温下孵化20min。蛋白质浓度是通过采用牛血清白蛋白(BSA)作为标准样(Bio-Rad)的Bradfor蛋白分析确定的。根据这种方法,评估所有分离的恶臭假单胞杆菌菌株的分泌蛋白质组,然而,仅仅进一步处理显示优于空白样的总荧光值的分泌蛋白质组。试样中蛋白酶浓度的评估是通过线性回归计算的,采用胰蛋白酶标准样,然后除以分析中使用的总蛋白量(μg蛋白酶/μg蛋白质)。为了评估温度对蛋白酶活性的影响,分泌蛋白质组试样在不同温度下(15到45℃,Δ5℃)与荧光素标记的酪蛋白一起孵化20min。获得的每mg蛋白质的μg蛋白酶活性的最高值被认为是最大活性(100%)以及比率被设置在所有的温度结果和该值之间。为了确保温度不影响荧光信号本身(除了标准样外),额外的对照是用荧光素标记的酪蛋白制成的,该荧光素标记的酪蛋白仅仅在缓冲液中在每个研究的温度被孵化。
用于筛选蛋白酶底物的2D-PAGE
细菌的参比菌株(大肠杆菌ATCC 25922)和海胆Paracentrotus lividus废弃的粘合剂印迹的细胞内蛋白质提取物被用作用于蛋白质水解实验的底物,正如所描述的(Nestler et al.)。如上(细菌的细胞内蛋白质提取和分离),大肠杆菌总蛋白被提取了。海胆粘合剂印迹(干重1mg)在4℃被悬浮在1mL 10%三氯乙酸,0.07%β-硫基乙醇(w/v)1h以沉淀蛋白质,然后用1mL冷的(-20℃)0.07%β-硫基乙醇(v/v)的丙酮溶液洗涤3次,并且最后真空干燥。获得的蛋白质团块在非还原条件下(2%SDS,20%甘油,在62.5mM Tris–HCl pH 6.8中)重新悬浮以及最终溶液在95℃加热5min。然后,通过使用SDS-PAGE,海胆粘合剂蛋白在12.5%聚丙烯酰胺凝胶中在第一维度(方向)分离。在分离之后,泳道被切离并且与M9培养基(作为阴性对照)和PF-11菌株上清液在35℃一起孵化5h。在12.5%聚丙烯酰胺凝胶的顶部,1D泳道用琼脂糖封闭以进行第二维度(方向)(其与第一维度垂直)电泳。因为在相同的条件下进行电泳,未消化的蛋白质出现在穿过凝胶的对角线线处;特定的蛋白酶切的产物应该在该线下方出现。
海洋生物膜破坏
为了在体外评估PF-11恶臭假单胞菌最终分离的上清液的抗小面积污染潜能,海洋生物膜在皮氏培养皿(Petri dishes)上形成,该皮氏培养皿放置在15℃具有33‰海水的开放式水箱(open-circuit tanks)内部,在“Vasco da Gama Aquarium”(Algés,Oeiras)。这些皮氏培养皿轻轻地用重蒸馏水洗涤3次以去除过量的盐和粘附不牢固的有机物质。剩余附着很强的物质(细菌和微藻)与不同的细胞底物和无菌的上清液一起在室温下孵化18和40小时以评估它们破坏来自玻璃基质的海洋小面积污染的能力。在孵化期之后,去除液体级分以及培养皿轻轻地用重蒸馏水洗涤以使得生物膜破坏看得见。所有的测试被进行至少3次。有代表性的图片被提供了。
海胆粘合剂印迹的体内降解
来自物种Paracentrotus lividus(Lamark 1816)的海胆是在葡萄牙西海岸(Estoril,Cascais)在落潮时被收集的。在收集之后,动物被运到“Vasco da Gama Aquarium”(Algés,Oeiras)并且被保存在15℃和33‰的开放式水箱中。含有人造海水(Crystal Sea,Marine Enterprises International,Baltimore,MD,USA)中的海胆的小的塑料水族箱(3L)被用于收集粘合剂物质。这些水族箱内部用可移走的玻璃板盖住,动物被允许附着到该玻璃板上。
在几个小时之后。这些覆盖有好几百印迹的玻璃板被移走了,用蒸馏水冲洗并且用一次性解剖刀划破用于蛋白质提取或直接用于去除实验(0)。为了在体外评估假单胞菌PF-11最终分离的上清液的海洋防污潜能,收集的海胆印迹与之前描述的细胞培养物和无菌的上清液一起孵化。在孵化之前,载玻片用重蒸馏水洗涤,用0.05%结晶紫染色并且再次洗涤以使得粘合剂印迹物质(0)可见。随后它们与待评估的溶液在35℃,~80r.p.m一起孵化18小时。最后载玻片按照相同的协议被洗涤和染色并且评价它们的从玻璃基板去除生物粘合剂的能力。
为了评价PF-11分泌蛋白质组作为海洋环境中无脊椎动物的防污剂的能力,由海胆管足分泌的粘合剂印迹被用作蛋白水解的底物。它们的粘附强度(每单位面积的力)被估测从0.09到0.54MPa(0et al.2005,Santos et al.2006),其与其它的海洋无脊椎动物(非永久粘合剂和永久粘合剂分别为0.1–0.5和0.5–1MPa(Smith 2006))比较,指示海胆的分泌的粘合剂作为牢固的非永久胶。
海胆分泌的粘合剂胶能够在含水环境中聚合,形成包含部分由蛋白质形成的化合物的复杂混合物的交错结构。因此,它对降解是非常稳定的并且具有抗性,正如之前所显示的(Santos et al.2005,Santos et al.2009)。
海胆被保存在15℃的海水水族箱中并且然后被放置在玻璃板上以施行粘附。由于它们的天生习性,海胆相继附着和离开,在玻璃上留下粘合剂印迹,该粘合剂印迹需要很强的变性和分解试剂使其溶解(Santos et al.2009)。还进行了对角线SDS-PAGE,第一维度分离从该粘合剂印迹提取的蛋白质,然后孵化凝胶泳道和PF-11上清液,并且最后对大肠杆菌蛋白提取物进行第二维度的电泳。
正如前述,具有从PF-11细胞培养物回收的上清液的孵化保证了蛋白质的全部降解。即使这种蛋白质提取物不是与来自大肠杆菌的全部细胞蛋白质提取物一样复杂,它包含预期对降解更具有挑战性的粘合剂蛋白,然而结果证实了由PF-11菌株分泌的蛋白质的有效蛋白水解活性并且更有助于增强它作为防污化合物分泌细胞的潜能(图10B)。
分泌蛋白质组分析
通过采用多个抗生素作为选择具有很强的适应性和生存潜能的菌株的筛选法,环境细菌隔离群的集合是从河滨城市海岸和农场土壤回收的。在聚集和鉴定的细菌中,作为突出的应变技能储主(reservoir of resilience skills)出现的Pseudomonaceas很可能与它们的快速复制率、对不同条件的多种适应性和已建立的对压力的抗性相关(Palleroni)。在该种族中,恶臭假单胞菌是最普遍存在的物种并且一组70个菌株被分离了,具有相当多的通常对β-内酰胺具有耐药性的菌株(未发表过的数据)。
为了筛选潜在的活性生物分子用于生物技术用途,7个环境分离的恶臭假单胞菌菌株(通常对β-内酰胺(尤其对第三代头孢菌素(cephalosporins)和碳青霉烯类(carbapenems))呈现了较高的耐药属性)被选择了,在基本矿物培养基(minimal mineral medium)中培养并且关于他们的分泌属性被评价了(Meireles 2013)。最初,总的细胞蛋白是从环境隔离群提取的并且与菌株恶臭假单胞菌KT2440(在生物修复研究的背景下广泛研究了)相比较(Nelson et al.)。
菌株KT2440来源于恶臭假单胞菌mt-2(基于它的作为生物修复工具的潜能和在适应不利的环境或对有毒的化合物的耐药潜能中的突出表现分离的菌株)(0 et al.)。因此,在生存技能方面相比来自相同物种的大多数菌株它的特征呈现了更多的多样性,从这个角度来说,它已经是非典型的恶臭假单胞菌菌株。SDS-PAGE凝胶分析显示了除了菌株PF-11之外,隔离群中大致类似的细胞内蛋白质分布模式(图8A),菌株PF-11具有类似于菌株KT2440的谱分布(分别为图8A中的泳道4和1)。同时,为了估计这些菌株的分泌潜能,分泌到培养基中的蛋白质通过采用TCA/丙酮沉积浓缩(在通过过滤去除细胞之后)并且按比例悬浮到初始培养基体积。
分泌蛋白质组谱是由SDS-PAGE类似地分析的(图8B)。不同于细胞内蛋白质级分,分泌的蛋白质谱不仅在组成上而且在数量上不同于隔离群。在菌株PF-11分泌行为中观察到最显著的区别。事实上,为了提供相同凝胶中的所有菌株的数据,回收的PF-11菌株的分泌蛋白质组必须被稀释8倍以避免过度上样。即使那样,正如图8B中所示的,相比其他的研究的菌株的分泌蛋白质组,它明显地是浓度更高的且更复杂的。
除了PF-11 8倍稀释的试样,在这种凝胶中上样的蛋白质相当于相同体积的在生长的稳定期的培养物上清液。考虑到事实:假单胞菌PF-11产生了如此高含量水平的分泌性蛋白,显示了较强的分泌潜能,它的分泌蛋白质组被选择用于进一步表征。由菌株PF-11分泌的蛋白质被收集了并且沿着生长曲线直观确定归因于生长条件的变量。按照在补充葡萄糖的M9基本培养基中的生长曲线,有可能验证由于培养物中细胞的增加,释放到培养基中的蛋白质随着时间的延长明显地积累,正如预期的(图8C)。针对所有筛选的菌株,分析大体积上清液(bulk supernatants)的蛋白水解活性。
过滤的上清液冻干以保持酶活性并且悬浮在水中,相当于原始上清液浓缩20倍。在所有测试的试样中,只有PF-11分泌蛋白质组(在生长的指数期或稳定期收集的)能够降解酪蛋白用于蛋白质水解活性的测定的底物(表1)。
表1
在由M9基本培养基中的恶臭假单胞菌参比菌株和隔离群菌株在稳定期(STAT)分泌的总蛋白的蛋白酶活性。数据还指示指数期(EXP)的PF-11细胞外蛋白酶。ND:无法检测。
在这种筛选中,PF-11明显地表现为具有反常的分泌潜能的菌株。在稳定期收集的分泌蛋白质组中能够预期到蛋白水解活性的增加。因为顺着生长曲线观察到上清液中总的分泌蛋白质的累积。然而,由在稳定期测量的全部的分泌蛋白质归一化的蛋白水解活性是每mg分泌蛋白质115μg蛋白酶,相当于当与指数期相比时增加几乎2倍,因此顺着生长曲线还显示了在分泌蛋白质中蛋白酶的富集(表1;图9A)。
在稳定期收集的分泌蛋白酶的蛋白水解活性的最佳温度从15到45℃被测量并且确定在35℃(图9B)。根据酪蛋白的蛋白质降解被测试的温度,活性被比较了且以百分比绘制。因为恶臭假单胞菌是正常在平均15到30℃温度范围内生存的环境菌株,能够预期到它的分泌蛋白质能够在宽的热范围内保持活性。正如在图9B中所示的,在低至15℃的温度,分泌蛋白酶相比在最佳温度35℃它的活性仍然保持它的蛋白水解活性的30%。
由于在热休克条件下加重的它们的细胞功能(Angilletta et al.),大多数细菌蛋白酶具有大约50-60℃的最佳温度。细胞外的细菌蛋白酶也已经显示具有类似的特征,即在杆菌属中,广泛地用于制备和纯化用于工业用途的蛋白酶(Watanabe et al.,Angilletta et al.)。在另一方面,海洋微生物通常产生冷适应的酶,如同由在中国分离的海洋细菌菌株产生的金属蛋白酶在30℃显示最大的活性(0 et al.)。
蛋白酶的任何工业应用要求这些酶具有较低的代谢转换(turnover)。为了评估这个,PF-11分泌的蛋白质在37℃过夜孵化以及该蛋白水解活性被测量了,证明了活性的减小大约25%(图9C)。再者,在过夜孵化之后的分泌蛋白质组蛋白质谱几乎没有改变,即使很可能由于自溶一些高分子量的成分减少了(图9D)。
从在指数期或稳定期中的PF-11培养物回收的上清液显示了对酪蛋白较强的蛋白水解作用。即使这很清楚地显示了这种分泌蛋白质组的高特异性蛋白水解活性,它仍然是单个底物的蛋白质降解。为了评估PF-11菌株分泌蛋白质组作为宽范围的靶向蛋白酶混合物的影响,总蛋白是从大肠杆菌菌株提取的并且用作底物。对角线SDS-PAGE凝胶分析(SDS-PAGE gel)被进行以使得通过PF-11分泌蛋白质组的大肠杆菌的蛋白质提取物的最终蛋白质水解可见(Nestler et al.)。
从大肠杆菌ATCC 25922收集的总蛋白在一维的SDS聚丙烯酰胺凝胶中分离并且接着凝胶泳道在37℃与PF-11活性上清液一起孵化5h。第二维度(也按大小分离分子)的移动清楚地显示了大肠杆菌蛋白质提取物的几乎完全降解(图10.A)。稀少的降解碎片仍然是可检测的,然而明显缺少对角线移动方式(与对照凝胶相反)证实了PF-11分泌蛋白质组的有效的宽范围的蛋白水解活性。此类结果暗示了这些分泌的蛋白酶能够充当防污剂,因为他们能够几乎完全地降解蛋白质的复杂溶液。
分泌蛋白质组的体外效果
为了在体外评估PF-11的分泌蛋白质组的防污效果,进行了两个实验。针对小面积污染和大面积污染测试防污作用,该小面积污染和大面积污染由沉积在玻璃皮氏培养皿(glass Petri dishes)或载玻片上的海洋细菌、微藻、海洋生物膜和海胆粘合剂印迹表示。
浸没在海洋中的物质成为微生物(主要是细菌)附接的位点。这些细菌中的很多产生了小块的有机碎屑粘附的粘性物质。然后微藻可以移植在该表面。细菌和它们的副产物结合碎屑和藻类群体组成普遍被称为“黏液膜”的物质。这种膜通常是出现在被淹没的表面上的污染的第一形式。
除烃海杆菌(Marinobacter hydrocarbonoclasticus)和海科贝特氏菌(Cobetia marina)是一贯地被记载为海洋生物污染(marine biofouling)的主要的最初移植者的绝对海洋细菌。这些细菌已经常规地被用作海洋防污测试中的指示剂以评估化合物针对生物污染的初始层(被称为小面积污染或更普遍地称为黏液)的防污能力。PF-11分泌蛋白质组对控制海科贝特氏菌的生长是高度有效的。在图19中呈现的数据代表了在多个浓度的PF-11分泌蛋白质组的存在下,在海洋环境中在最优条件下海科贝特氏菌的生长进程。描述的曲线清楚地显示了在低至8g/L和4g/L的PF-11分泌蛋白质组浓度下海科贝特氏菌(C.marina)的较强的生长抑制。在生长抑制测试(比如弧菌属(Vibrio spp),普遍地与海洋生物污染相关)中,PF-11分泌蛋白质组在低至470或234ppm(w/v)的浓度下还防止了多个其它的海洋细菌的生长(图20)。除了这些菌株,PF-11分泌蛋白质组还产生了针对细菌(革兰氏阴性的和革兰氏阳性的,即大肠杆菌、溶藻弧菌(Vibrio alginolyticus)、副溶血性弧菌(Vibrio parahaemolyticus)、霍乱弧菌(Vibrio cholerae)、创伤弧菌(Vibrio vulnificus)、海科贝特氏菌、除烃海杆菌(Marinobacter hydrocarbonoclasticus)、金黄色葡萄球菌、粪肠球菌(Enterococcus faecalis))等的有效抗菌活性。
因此,通常来说,PF-11分泌蛋白质组在细菌生物体的生长控制中是高度有效的。更具体地说,PF-11分泌蛋白质组具有针对形成海洋生物污染的初始层的细菌的防污能力。除了控制细菌本身的生长,PF-11分泌蛋白质组还在防止海洋细菌生物膜的形成(黏液的实际基本形成)中是有效的。在图21中提供的数据显示了PF-11对防止副溶血性弧菌和除烃海杆菌生物膜的影响,在PF-11分泌蛋白质组的浓度在500-2000ppm范围内实现的。
连同海洋细菌,PF-11分泌蛋白质组还产生有效的抗微藻活性,影响多个微藻物种(比如莱茵衣藻(Chlamydomonas reinhardtii)、月牙藻(Pseudokirchneriella subcapitata)和浮游生物(Tetraselmis suecica))的生长,这点在图22中可以观察到。测试的最敏感的物种是莱茵衣藻以及最耐药的物种是月牙藻。
除了防止单个细菌生物膜的形成且防止单个微藻的生长,正如以上所显示的,PF-11证实了有效地破坏了已经形成的混合的海洋生物膜,该海洋生物膜基本上是由海洋细菌藻类和微藻组成,该海洋细菌藻类和微藻是在无菌的玻璃皮氏培养皿中收集的,该培养皿在具有再循环的海水和稳定的海洋围隔生态系统(marine mesocosm)的大水族箱中浸8天。产生的污染的培养皿被洗涤以去除未附着的物质,不过保留主要由海洋细菌和微藻组成的小面积污染物质。然后生物膜与PF-11上清液以及培养物本身一起孵化,加上各自的对照,并且它们的影响在室温下18和40小时孵化之后评估了。当与分析的级分中的任意一者一起孵化时,初步洗涤未去除的结合不牢固的物质立即被去除了(<18小时)。然而,更加紧紧附着的海洋生物膜形成只有通过添加PF-11上清液或细胞培养物才能被去除(>18小时)(图11)。至于无脊椎动物污染,恶臭假单胞菌PF-11分泌蛋白质组在去除玻璃上的海胆粘合剂印迹中被测试了。培养物和从PF-11菌株的生长回收的上清液能够完全地破坏和去除由海胆在载玻片上留下的粘合剂印迹(图12)。相反,用作对照的上清液或培养物、无菌培养基或来自不同细菌(包括环境隔离的恶臭假单胞菌或KT2440菌株)分泌的物质均没有展示任何防污作用。因为蛋白质(比如蛋白酶)的酶活性取决于它们天然的三维结构的保持,通过使用煮沸的上清液(在100℃15min)平行地进行补充实验以评估在观察到的PF-11分泌蛋白质组的防污作用中的酶活性的相关性。(图12)该实验显示了天然蛋白(保持它们的酶活性)被要求去除海胆分泌的粘合剂。因此水解酶(比如之前发现的蛋白酶)对给予防污能力给由假单胞菌PF-11分泌的化合物是必不可少的。因此,这种环境隔离群分泌高价值的具有酶活性的化合物的混合,该混合可以有力地降解蛋白质,破坏细菌生物膜形成并且去除海洋生物胶粘剂。
实施例5-PF-11分泌蛋白质组的酶活性
在此描述的本工作的目的是评估来自PF-11和多个其它的隔离的菌株分泌的酶的蛋白水解活性。我们建立了一种方法,该方法基于想法:仅仅在添加到蛋白质或能源耗尽的培养基中的高分子量底物一些程度的蛋白质水解之后,菌株能够内化它们并使用它们用于生长。
原料和方法
细菌隔离群
在该研究之前,71个环境菌株的集合被分离,宏观地选择,鉴定以及表征针对已获得的抗生素耐药性机理(Meireles 2013)进行表征。在最终的隔离群选择的范围之外,92%是恶臭假单胞菌。它们中之一PF-11显示以高水平分泌蛋白酶。为了找到更多的细胞外的细菌蛋白酶有效的制造者,整个集合被提交给本文描述的筛选步骤。
测试的培养基和补充剂
文献中引用的用于这种类型的不同培养基被评估了,与普遍地用于培养基配制中的不同的蛋白质底物相关联或与相关的筛选有关。采用的培养基是:M9-12.8g Na2HPO4,3g KH2PO4,0.5g NaCl,1g NH4Cl,1ml CaCl2 100mM,1ml MgSO4 1M,补充有20ml葡萄糖20%的500μl Vit B1 1%/1L(Miller 1972),M9-NH4Cl-Vit B1或M9-N-12.8g Na2HPO4,3g KH2PO4,0.5g NaCl,1ml CaCl2 100mM,1ml MgSO4 1M/1L(Miller 1972),M9-葡萄糖或M9-G-12.8g Na2HPO4,3g KH2PO4,0.5g NaCl,1ml CaCl2 100mM,1ml MgSO4 1M/1L(Miller 1972),用于假单胞菌的基本培养基或MMP-1g K2HPO4,3g KH2PO4,5g NaCl,0.2g MgSO4.7H2O,3mg FeCl3/1L(Prij ambada,Negoro et al.1995)和NB-1%蛋白胨,0.6%浓缩牛肉汁,1%NaCl(Gaby and Hadley 1957),大多数被认为是任何补充剂的阳性对照培养基。测试的补充剂是:BSA 1%,血红蛋白1%,明胶1%,脱脂牛奶2%,酪蛋白1%,酸水解酪素(casaminoacids)1%也被认为是全部测试的培养基的阳性对照以及H2O用作阴性对照。
基本培养基和补充剂测试用于细胞外蛋白酶的检测
96孔微量滴定板被充满有100μl准备用于测试的培养基-补充剂对。每个隔离群的单个菌落在Bacto-Mueller Hinton培养基(Difco)中接种并且生长达到在600nm约1或2的吸光度。然后根据C1V1=C2V2公式,培养物仅仅在M9培养基盐中被稀释到OD600nm 0.04以及10μl被分配在每个微量滴定板孔中。该板仍然在35℃下孵化。在针对检测的时间点–18h,26h,72h–该板被捆绑搅拌并且在检测器中读取。生长是由试样相比空白溶液的OD测定的。用于这个初步测试的菌株是阴性对照菌株PF-29隔离群,阳性对照PF-11隔离群,参比菌株恶臭假单胞菌KT2440以及参比菌株铜绿假单胞菌NTC27853。
基本培养基液体生长过程
96孔微量滴定板被充满有100μl选择的培养基:M9-N+BSA,M9-G+BSA,M9-G+明胶,MMP+BSA,and MMP+明胶。每个隔离群的单个菌落在补充有葡萄糖的M9完全培养基中接种并且生长约21小时。然后培养物仅仅在1x M9盐中被稀释100倍;以及10μl此类溶液被分配在每个微量滴定板孔中。该板仍然在35℃孵化。在针对检测的时间点–21h和46h–该板被捆绑搅拌并且在检测器中读取。通过减去空白溶液的试样的OD测定生长。通过这种测试条件评估所有来自该集合的菌株–再次,PF-29隔离群用作阴性对照以及PF-11隔离群用作阳性对照。
胶片明胶清除工艺(Photo film gelatin clearance procedure)
每个选择的隔离群的单个菌落在蛋白胨-LB(Bacto-LB)(Difco)或M9培养基(0)中接种并且过夜生长。使用的胶片的碎片被添加到每个管子并且仍然在RT下孵化。该胶片在孵化的8min、12min、1小时、8小时、32小时和2个月(认为是所有的胶片明胶层被降解的时间,即未接种的培养基对照)从培养物中移走。在这些时间点,该胶片在重蒸馏水喷射下洗涤,风干且拍照。
从细菌培养物制备上清液
选择的细菌隔离群各个菌落在400ml补充有葡萄糖的M9基本培养基中在35℃,120r.p.m.接种持续24小时。培养物在10.000g离心15min以将细菌制成团块并且通过过滤装置,利用0.2μm DURAPORE低蛋白结合过滤器(low protein binding filters)(Millipore)过滤上清液,正如之前描述的(0)。回收的滤液在-20℃冷冻,在-52℃冻干并且浓缩20倍。蛋白质浓度是通过采用牛血清白蛋白(BSA)作为标准样(Bio-Rad)的Bradford蛋白分析确定的。
体外蛋白水解分析
根据制造商的说明书,荧光蛋白酶分析盒(Fluorescent Protease Assay Kit)(Pierce)被用于评估恶臭假单胞菌分泌蛋白质组的水解蛋白含量。简单地说,该分析涉及使用荧光素标记的底物(类似大多数蛋白酶的天然底物的酪蛋白),用于通过荧光共振能量转移(FRET)评估试样中的蛋白酶含量。在蛋白酶消化时底物的荧光性质改变,导致蛋白质水解的可检测指示。在具有标准的荧光素激发/发射滤波器(485/538nm)的0.5cm的光路石英吸收池中采用Fluorolog-3(Horiba Jobin Yvon)进行荧光性测量。对于校准,胰蛋白酶被用作标准样。分泌蛋白质组试样在TBS(25mM Tris,0.15M NaCl,pH 7.2)中被稀释100倍。所有的试样和标准样与底物一起在室温下孵化20min。蛋白质浓度是通过采用牛血清白蛋白(BSA)作为标准样(Bio-Rad)的Bradford蛋白分析确定的。试样中蛋白酶的定量是通过采用胰蛋白酶标准样的线性回归计算的并且接着通过除以通过在分析中使用的总蛋白量测定的活性归一化(μg蛋白酶/mg蛋白质)。
聚丙烯酰胺凝胶电泳
通过正如描述的十二烷基硫酸钠聚丙烯酰胺凝胶电泳(12%SDS-PAGE)(Lamy,et al.2010;da Costa et al.2011),简单地说,以微凝胶形式(来自Bio-Rad的7x7cm Tetra系统)分离蛋白质。蛋白质浓度是通过使用牛血清白蛋白作为标准样的Bradford蛋白质分析确定的。试样在还原缓冲液(62.5mM Tris-HCl,pH 6.8,20%(v/v)甘油,2%(w/v)SDS,5%(v/v)b-巯基乙醇(b-mercaptoetanol))中被稀释6倍。在电泳之前,试样在100℃加热5min。蛋白质带被考马斯亮蓝R-250染色。
用于蛋白酶检测的酶谱分析
正如之前描述的,酪蛋白和明胶酶谱分析被进行了( and Trafny 2005)。简单地说,12%SDS-聚丙烯酰胺凝胶(Laemmli 1970)与1%酪蛋白或明胶在4℃共聚合。在上样之前,非还原型上样缓冲液(62,5mM Tris,2%SDS,10%甘油,0.001%溴酚蓝)被添加到分泌蛋白质组试样中。电泳在4℃和100V进行直至溴苯酚染料到达凝胶的底部。在电泳之后,凝胶在2.5%(v/v)曲拉通(Triton)X-100中冲洗两次(每次30min)用于SDS去除,然后在去离子水中洗涤3次(每次5min)。接着凝胶在活化缓冲液(0.1M Tris-HCl,0.01M CaCl2,pH 8)中在37℃孵化用于酶复性和后来的蛋白水解活性。在考马斯亮蓝R-250中孵化1h之前,凝胶在去离子水中洗涤3次,每次5min。图像是通过ImageQuant LAS 500,GE Healthcare Life Sciences获得的。蛋白酶活性在蓝色背景下作为空白段(clear bands)是可见的。图像是通过GE Healthcare Life Sciences的ImageQuant LAS 500获得的。通过苯基甲基磺酰基氟化物(phenyl methyl sulfonyl fluoride)(PMSF)和EDTA,蛋白酶抑制被测定了,正如Bertolini和Rohovec描述的(Bertolini and Rohovec 1992)。
结果
我们的目标是评估和比较来自PF-11和多个其它隔离的菌株的分泌的酶的蛋白水解活性。为了那个目的,我们选择了3个基础培养基:用于假单胞菌科的M9基本培养基(Miller 1972),设计用于由(Prij ambada,Negoro et al.1995)描述的假单胞菌的与第一个只有稍微区别的基本培养基,以及被定义以鉴定铜绿假单胞菌的丰富培养基,Nutrient Broth;我们还采取第一个培养基,去除氮源(铵和硫胺素),指定它为M9-N,或去除糖/能量供给(葡萄糖),称它为M9-G(参见原料和方法)。NB(作为丰富培养基)应当并且已经允许所有菌株独立地任意生长(图13A-B),不论它们是否产生细胞外蛋白酶,任意其它的添加酸水解酪素(casaminoacids)或脱脂牛奶的测试培养基(数据未显示)也是这样,因为那些底物并不需要降解以被内化和用于生长。针对生长限制条件,所有其它的培养基被设计了,以便为了培养物生长强制补充的底物被降解并且记录光密度读数。由于历史原因,如同测量蛋白质水解的方法,我们使用作为补充剂的脱脂牛奶、酪蛋白和酸水解酪素(作为用于所有菌株生长的阳性对照),而且还有其它蛋白质,这些蛋白质已经被描述用于多个生物化学方法和蛋白酶制备评估,比如BSA、血红蛋白和明胶,全部蛋白质在裂解之前不应当在细胞中完成内在化(参见原料和方法)。H2O被用作阴性对照代替底物。
没有针对菌株更改和评估培养基和补充剂,PF-29作为阴性对照和PF-11作为阳性对照,以及最后针对恶臭假单胞菌KT2440和铜绿假单胞菌参比菌株,恶臭假单胞菌KT2440和铜绿假单胞菌参比菌株在未知试样的条件下被评估,虽然预期后者具有正响应,因为铜绿假单胞菌被描述为许多活性化合物的有效分泌细胞。
全部培养基的清除无法通过血红蛋白和酪蛋白的分解实现。在保留在它的光谱通路(spectroscopic path)的光线并且呈现它们自己的光学吸光度的同时,它们屏蔽了菌株的生长,因此,防止了它们作为蛋白质补充剂的使用(数据没有显示)。至于其它的测试选项,实现初始条件以及分析结果。培养基–蛋白质补充剂–M9-G+BSA,M9-G+明胶,M9-N+明胶,PPM+BSA和PPM+明胶–的多个组合符合推荐的用于选择产生蛋白酶的菌株标准(图14A-F)。有趣的是,虽然一些补充剂(和给定培养基一起)引起非特定生长,它们与其它的组合具有完美的区分能力,这点分别从M9-N和M9-G中的明胶看出(图14C和D)。
我们选择了2个参比菌株,铜绿假单胞菌NTC27853和恶臭假单胞菌KT2440,以及环境隔离群PF-29作为阴性对照,以更好地表征PF-11的分泌蛋白质组的活性。
大体积上清液的水解蛋白含量(proteolytic content)是通过对全部菌株的荧光素衰减(fluoresceine decay)分析的。对水解蛋白含量测定来说,仅仅PF-11分泌的蛋白质能够降解荧光酪蛋白底物。通过总的分泌蛋白归一化的蛋白酶浓度对PF-11来说是100μg/mg。PF-11菌株相比其他的菌株呈现了明显高的水解蛋白含量。作为细胞外蛋白酶产物的阴性对照,我们使用了PF-29菌株,该菌株之前被测试并且已知没有呈现细胞外的蛋白水解活性。
我们比较了PF-11以及参比菌株恶臭假单胞菌KT2440、隔离群PF-29(之前被鉴定为阴性对照)和隔离群PF-9和PF-22(之前被鉴定为潜在的蛋白酶的制造者)的蛋白水解活性。为此,在对细菌生长培养物孵化之后,通过视觉观察胶片的表面的明胶层的降解,我们进行了初步分析。PF-11细菌液体培养基显示了通过表面的快速清除显示的显著的蛋白水解活性(图15)。
根据分子学方法,我们通过酶谱法(用于研究包括Aer.Salmonicida的不同生物体的蛋白酶的灵敏且可靠的方法(Arnesen et al.1995;Gudmundsdo′ttir et al.2003))分析了菌株蛋白水解活性,并且已经进一步评估用作筛选步骤的又一个方法。所有测试的菌株被确定分泌蛋白质,这点可以通过它们的SDS PAGE蛋白质谱看出(图16A)。在明胶共聚合的SDSPAGE上获得的酶谱允许鉴定在测试的菌株中不同的带型(banding patterns)(图16B)。在评估的菌株(除了PF-11)中,只有菌株铜绿假单胞菌NTC27853展示了一个蛋白水解活性带。正如在水解蛋白含量的体外测定中观察到的,菌株PF-11呈现了对应于更高的蛋白水解活性的较强烈的带(more intense bands)。
SDS PAGE蛋白质谱呈现了从10到100kDa的蛋白质带并且较强烈的带不在高分子量区。然而,酶谱仅仅在高分子量区呈现了的蛋白水解活性。这个事实可能是由于一些在酶谱法研究需要的较低程度的变性条件下未离解的蛋白质-蛋白质复合物(Snoek-van Beurden and Von den Hoff 2005)。在细胞外蛋白酶制造者中存在的蛋白酶类型的进一步评估是通过通过PMSF选择性抑制丝氨酸蛋白酶和通过EDTA选择性抑制金属蛋白酶进行的。当采用10mM EDTA处理PF-11和NTC时,它们的蛋白水解活性相对于未处理的对照水平很大程度地被抑制了,然而10mM PMSF呈现了明显低的抑制效果(图17A和图17B)。因此,在那些分泌蛋白质组中仅仅约10%的蛋白酶活性是由于丝氨酸蛋白酶,而约50%是由于金属蛋白酶。
实施例6-PF-11分泌蛋白质组的杀真菌剂效果
原料和方法
根据CLSI标准(临床和实验室标准协会(Clinical and Laboratory Standards Institute))M27-A3(用于酵母的液体培养基稀释抗真菌药敏测试的参考方法(Reference Method for Broth Dilution Antifungal Susceptibility Testing of Yeasts);CLSI)和M38-A(用于丝状真菌的液体培养基稀释抗真菌药敏测试的参考方法(Reference Method for Broth Dilution Antifungal Susceptibility Testing of Filamentous fungi);CLSI)测定MICs(最低抑菌浓度)。使用的丝状真菌是黑曲霉(Aspergillus niger)、葡萄孢菌(Botrytis cinerea)、炭疽菌(Colletotrichum acutatum),盘长孢状刺盘孢(Colletotrichum gloeosporioides)和尖孢镰刀菌(Fusarium oxysporum)。黑曲霉是一种真菌且是曲霉属真菌(Aspergillus)属的最常见的物种之一。它导致一种疾病并且是食物的共同污染,该疾病被称为在某些水果和蔬菜(比如葡萄、杏子、洋葱和花生)上的黑莓。葡萄孢菌(Botrytis cinerea)是一种影响许多植物物种的ecrotrophic真菌,尽管它最著名的宿主可能是酿酒葡萄。在葡萄栽培中,它通常被认为是葡萄孢属群腐烂(botrytis bunch rot);在园艺学中,它通常被称作灰霉(grey mould)或灰霉病(gray mold)。该真菌引起对葡萄的两种不同类型的传染。炭疽菌是一种植物病原体。它是导致全球范围内羽扇豆物种的最具有破坏性的真菌病(炭疽病(anthracnose))的生物体。尖孢镰刀菌的致病病株具有非常宽范围的宿主并且包括从节肢动物到人类范围内的动物和包括一系列裸子植物和被子植物的植物。
使用的酵母是白色念珠菌(Candida albicans)和光滑念珠菌(Candida glabrata)。白色念珠菌是作为酵母和丝状细胞(filamentous cells)生长的二倍体真菌,并且是人类的机会口部和生殖感染以及念珠菌性甲癣(candidal onychomycosis)(甲板的感染)的致病因子(causal agent)。全身真菌感染(真菌血症(fungemias),包括通过白色念珠菌的全身真菌感染,已经作为免疫功能不全的患者(例如AIDS、癌症化疗、器官或或骨髓移植)的发病率和死亡率的重要原因出现的。
结果
PF-11分泌蛋白质组针对酵母和丝状真菌显示了抗真菌活性表2。这些结果表明了PF-11分泌
蛋白质组在其组成方面包含一个或多个对真菌有效的活性药剂,该活性药剂在所有其它相关的作为杀菌剂的应用中,PF-11分泌蛋白质组可被用于人类健康和食物作物。
表2
表2-PF-11分泌蛋白质组显示了针对酵母和丝状真菌的抗真菌活性。
实施例7-PF-11分泌蛋白质组的杀幼虫剂/杀昆虫剂效果
原料和方法
幼虫
较晚3rd幼虫龄期和/或较早4th幼虫龄期的蚊子希氏库蚊(Culex theileri)、小五斑按蚊(Anopheles atroparvus)和冈比亚按蚊(Anopheles gambiae)被使用了。蚊子群体被增加了以使得有效数量的蚊子产生足够数量的幼虫用于分析。
生物测定
通过连续稀释剂量被设计用来求0和100%死亡率的积分。在每个浓度250ml软化水中,没有食物供给,在昆虫饲养所控制的条件下,在25-27℃和12h光照:12h黑暗周期,采用25只幼虫进行该实验。在24h之后记录幼虫死亡率。仅仅软化水被用作阴性对照。按照评估蚊子杀幼虫剂的WHO国际指南进行实验。
结果
PF-11分泌蛋白质组可用于杀昆虫剂用途,因为它通过凭借它的作为化学/生物化合物的用途杀死或防止它们的发育展示出控制昆虫增殖的能力。我们已经观察到通过在变形为飞行的成虫之前,杀死在它们的水栖发育阶段的蚊幼虫的较低浓度的PF-11分泌蛋白质组的杀虫活性。PF-11分泌蛋白质组在24小时之后在3,9g/L的浓度呈现了100%的幼虫死亡率。
实施例8-分泌蛋白质组的抗海洋桡足类的效果
原料和方法
试验包括采用PF-11分泌蛋白质组孵化海虱(Lepeophtheirus salmonis salmonis)幼虫和桡足类用以评估幼虫和桡足类相比空白对照的存活率。次氯酸盐(NaOCl)(已知在70ppm 40min内杀死幼虫)被用作阳性对照。
幼虫
通过采用苯唑卡因(Benzocain)镇定浅澄色的海虱,采用镊子收获蛋串(egg strings)并且转移该串到放置在孵卵器的水浴中,获得幼虫。在孵卵器内部,在整个孵育期,水连续地被更换。当幼虫形成时,它们从孵卵器被移走并且用于生物分析。
桡足类(Copepodids)
桡足类是从来自海虱的蛋串形成的,如对幼虫的描述。
生物分析
含有虱子幼虫和桡足类的海水被放置在皮氏培养皿中以及PF-11分泌蛋白质组被添加到最终的模拟浓度(pretended concentration)。没有添加的化合物的海水中的幼虫和桡足类也被用于比较。阳性对照是在70ppm的NaOCl。检查幼虫和桡足类在一段时间内的存活率。进行幼虫存活率的评估且与空白对照的存活率对比。在整个实验中,在纯的海水对照和培养基空白对照中的存活率被监测并且比较以及保持相同。
结果
在一定浓度范围内使用的PF-11分泌蛋白质组比阳性对照70ppm NaOCl显示了针对海虱幼虫(图24)和桡足类(图25)大得多的活性,在20mins(NaOCl 100%有效的需要时间)之前杀死100%海虱幼虫和桡足类。这些结果表明了PF11分泌蛋白质组对海虱是有效的,因此显示了抗寄生的活性。
讨论
抗菌剂耐药性
对现今使用的几乎全部抗生素来说,抗菌剂耐药性的出现正迅速导致不久将没有可用于细菌感染的有效疗法的形势。任何新近引进的医学上使用的抗生素在少于一年内通过检测到抑制它的效果的细菌耐药性被克服。因此,寻找新的抗菌化合物必须结合需要找到将不在细菌中培养新的耐药机制和选择已经存在的耐药过程(resistance processes)的有效抗生素。
在控制细菌增殖的这个情况下,活性生物化合物的环境生物勘探对开发这样的新的天然工具来说是很有吸收力的策略。环境微生物一直处于变化的环境的压力下,这诱导主动选择必定拥有对对付外部改变和与邻近微生物竞争营养物的丰富系列的分子响应的高抗性细菌细胞。数百万年来细菌已经形成了战胜它们的竞争对手的工具,确保它们自身的生存并且通过抑制邻近微生物的生长或甚至消灭它们获取营养物。细菌是胞外分子的天然生产者,该胞外分子已经成功用于大多数不同的领域的应用(抗生素生产、生物化学过程、食品工业等等)中(Wilhelm et al.,Wu and Chen et al.,Liu and Li 2011,Pontes et al.)。
抗菌肽(AMP)对感染控制是极好的候选者,因为它们快速破坏细菌细胞膜,这赋予它们广谱的抗革兰氏阳性和革兰氏阴性菌种的活性。尤其是,虽然AMPs广泛分布在自然界中并且细菌已经暴露于这些分子数百万年了,但是广泛的耐药性还没有被报道(Fjell et al.2011)。考虑到对经典抗生素的细菌耐药性增加,AMPs的使用作为用于细菌感染的将来疗法的有价值的替代者脱颖而出。AMPs由全部生命物种产生并且代表内在免疫系统的关键成分,提供对抗入侵病原体(包括细菌、真菌和酵母(yeast))的快速作用武器(Boman,1995;Hancock et al.,2006;Selsted and Ouellette,2005;Zasloff,2002)。AMPs可快速穿透、渗透和破坏细胞膜(Ludtke et al.,1996;Pouny et al.,1992;Shai,2002)造成不可逆的细胞损伤,与常规抗生素明显不同,利用AMPs它们没有交叉耐药性(Vooturi et al.);它们作用的不可逆性降低了细胞耐药性出现的概率(Zasloff,2002)。真核AMPs通常是大范围的抗菌剂,但是大多数对细菌和真核细胞都有毒,使它们的直接使用无价值(Asthana 2004)。真核AMPs的高细胞毒性(high cytotoxycity)和低生物利用度迄今阻碍了临床应用,通常归因于多肽的蛋白质降解或它们的在功效必需的高浓度中发生的聚合(Giuliani 2008)。与此相反,由细菌产生的AMPs,比如脂肽或肽脂(peptidolipids),是有选择性的并且显示对动物毒性较低(Parisien 2008)。脂肽仅仅在细菌和真菌中产生,并且拥有强有力的抗菌活性以及表面活性剂性能。然而,天然脂肽是非细胞选择性的,因此也可对哺乳动物细胞有毒。尽管这样,达托霉素(这个家族中的一员)仅仅对革兰氏阳性细菌有活性并且最近被食品和药物管理局(FDA)批准用于治疗复杂的皮肤感染(Department of Health and Human Services,2003)。肽脂由于它们的破坏和除去植物病原体的能力也在调查研究中。利用它们的表面活性剂性能,它们能刺激细菌粘附和/或细菌从表面脱离,细菌生物膜形成和维持(O'Toole et al.,2000),和细菌运动性、细菌通信和营养物获取(Al-Tahhan et al.,2000;Garcia-Junco et al.,2001)。虽然已经研究了来自细菌来源的AMPs,具有有限的成功应用,但是转变这些方法的大多数尝试一直集中于真核AMPs。但是环境细菌对AMR过程和它们的大部分未被发现的品种的影响打开了新抗菌剂研究的机会之窗。
在实施例3中,在以前研究的过程中通过抗生素耐药性收集的(Meireles 2013),具有很强适应技能的环境恶臭假单胞菌菌株的异类集合被用于筛选用于微生物生长控制的潜在的分泌的天然化合物。重点放在分泌的分子上,因为它将导致化合物在各种温度和条件下更稳定,尤其是对于天然用于影响邻接竞争对手的生长的分子,具有由产生细菌的生存提供的功效证明。假单胞菌属通常普遍存在于环境中,并且在高污染区域中持久生存。此外,还进一步显示它们主动地分泌与细菌通讯有关的分子,像,群体感应通讯中的高丝氨酸内酯自体诱导物(Roy et al.)、不同类型的铁载体,像铜绿假单胞菌铁载体(pyoverdine)或绿脓青素(Nestler et al.),胞外多糖和几个不同的酶,包括胞外蛋白酶(Wilhelm et al.)。
环境恶臭假单胞菌隔离群的集合被用于筛选抗菌化合物分泌。一组七个隔离群和恶臭假单胞菌参考菌株的分泌蛋白质组被用于确定它们的抗菌活性。一些分泌蛋白质组显示了对细菌生长抑制的潜能,但是由菌株PF-11分泌的化合物显示了对其他细菌的生长防范产生了令人惊讶的和突出的影响(图1A-C)。但是,它呈现没有抑制铜绿假单胞菌(P.aeruginosa)(与恶臭假单胞菌非常相关的类型,也广泛地普遍存在并且以它的适应技能而出名)的生长。与此相反,确定了大肠杆菌和金黄色葡萄球菌(S.aureus)的生长的很强的生长抑制,显示了对革兰氏阴性和阳性菌株的都产生了影响。这些用做类型代表的参考菌株显示了很可能PF-11的分泌蛋白质组包含对对照致病大肠杆菌和金黄色葡萄球菌菌株敏感的化合物。其他恶臭假单胞菌菌株(包括隔离群和KT2440)的生长也强烈地受损了(图2)。
很明显,当对它们自身生长进行测试时,PF-11的分泌蛋白质组充当生长刺激剂,显示在特定菌株内部通讯中存在刺激该菌株复制的特定化合物。既不是其他恶臭假单胞菌菌株也不是铜绿假单胞菌显示了这样的行为,突出了PF-11菌株的独特性。这个细菌明显地呈现了成功的环境生存的特点,具有强烈地抑制竞争对手的工具和过度刺激它的兄弟姐妹的复制的优点。
通过分子大小排阻(molecule size exclusion)分离PF-11菌株的分泌蛋白质组产生了含有多肽和小化合物(大小小于10kDa)的级分和具有较大化合物(包括酶的蛋白质等等)的另一种级分。对任一级分来说,图3中的数据证实了不存在铜绿假单胞菌生长损害,而大肠杆菌和金黄色葡萄球菌(S.aureus)实质上受蛋白质级分抑制了。金黄色葡萄球菌强烈地受任一级分抑制,但是多肽级分明显具有更强的抗葡萄球菌效果。这些结果显示即使PF-11分泌蛋白质组抗菌特性,它由不同化合物或分子支持,并且显然影响不同的细菌。因此,该个分泌蛋白质组含有抑制细菌增殖并且能靶向不同的细菌类型的不同元素的混合物(以不同的结合或者甚至可以独立地)。所以,对抗菌剂应用来说,由菌株PF-11分泌的化合物显示了扩大的潜能,暗示了存在几个用于各种各样的应用的感兴趣的分子。
从组分角度常规表征PF-11分泌蛋白质组显示了存在多肽(以突出的浓度)(图4)、表面活性剂分子、最终是脂肽(图5)和降解的酶(图6)。全部这些种类的化合物都是由细菌在对恶臭假单胞菌KT2440的明显显著行为中大量地分泌的,并且从潜在的抗菌化合物角度证实了富集这个分泌蛋白质组。
为了清楚将来应用的路径,PF-11菌株的分泌蛋白质组被收集并且通过冷冻干燥(liophilization)浓缩,以便保持该化合物的生物活性。以前利用大肠杆菌和金黄色葡萄球菌得到的结果被验证了,并且对致病菌株大肠杆菌O157和甲氧西林耐药金黄色葡萄球菌(MRSA)ATCC33591的影响被确立了。抗菌化合物在这种分泌蛋白质组的不同的测试级分中被发现了,但是多肽级分含有对不同细菌具有更高抗菌影响的分子,很可能是抗菌肽,最后具有表面活性剂活性。
防污(Antifouling)
在海洋环境中,这样的小面积污染的初级阶段之后,大面积污染阶段最终发生,持续固定海藻、藤壶和其他海洋无脊椎动物,对入侵的人造结构(比如船体、水产养殖网箱、海水进水管或海上平台)造成功能和维护问题(Railkin et al.)。船体上的大面积污染增加摩擦阻力并且单独地是航运中耗油量增加21%的原因,同时大面积污染的影响可造成能量损失接近86%(Schultz et al.)。
现今,大约90%的世界贸易基于国际海运(International Chamber of Shipping)。海洋生物污染对国际海上运输成本的财务影响是相当大的,并且导致指数需要研究防污技术,在全球产业格局中估计每年US$4万亿(Dafforn et al.)。自从海上运输开始以来,生物污染对这个产业的竞争力的这样的沉重影响已经导致开发和实施防污方案。船体涂层目的在于减少腐蚀和防止生物粘附。
毒性化合物(比如铜和三丁基锡)已经被添加到这个过程中使用的油漆中,并且通过它们连续释放到周围海域中成功地防止了生物污染的形成(Yebra et al.)。但是,广泛使用这样的物质(尤其是,三丁基锡)导致它在环境中积累,由于它的非特异性和对海洋群体的最终毒性影响,产生了全世界的担忧(Thomaset al.)。结果,国际海事组织在2003年禁止使用基于三丁基锡的油漆,这造成了有效的防污方案的缺乏(International Maritime Organisation,London)。基于铜的油漆仍然在使用并且新的非毒性的基于硅树脂的涂料已经被开发和实施了,但是它们的使用受到很强的监管并且此外它们的有效性是减小的(Townsin et al.)。因此,可以理解新颖的和天然的防污化合物的研究一直在发展并且对控制生物增殖来说仍然是落实非毒性的和有效的方法的最有希望的途径,但是还没有商业上成功应用的方案(Dafforn et al.)。
因此,研究已经被驱使去鉴定对环境没有毒性影响,能够防止或破坏这些粘附结构体形成的酶(Leroy et al.,Pettitt et al.)。在降解或抗增殖化合物(对生物污染具有潜在影响)之中,蛋白酶的降解酶活性已被提议为是有希望的路径,因为被生物物种(从细菌到低等真核生物)利用的粘合胶的核心或分子本质上是蛋白质(Rawlings et al.)。已经显示蛋白酶的混合物抑制Ulva游动孢子、藤壶属须头虫介虫幼虫(Balanus amphitrite cyprid larvae)和总合草苔虫(Bugula neritina)的定居(Pettitt et al.,Dobretsovet al.),并且这样的活性被证实是由于粘合效力的减少,很可能通过基于肽的粘合化合物的降解(Aldred et al.)。此外,与蛋白酶有关的防污效果当这样的酶被并入水基油漆中时被确定了(Dobretsov et al.)。另外,蛋白质构成生物膜基质的重要部分并且蛋白酶可有效扰乱这些结构,如对假交替单胞菌属生物膜形成观察到的(Leroy et al.)。
活性生物化合物的环境生物勘探对开发新颖的生物技术工具来说是有吸引力的策略。细菌是已经成功地用于大多数不同领域中的应用(抗生素生产、生物化学过程、食品工业等等)的胞外分子的天然生产者(Wilhelm et al.,Pontes et al.)。已知环境肠杆菌科(尤其是假单胞菌科)分泌胞外蛋白酶进入周围介质中。这些分泌的蛋白酶对传染性策略来说有时是毒性贡献因素,像由铜绿假单胞菌产生的碱性蛋白酶和弹性蛋白酶(Liu 1974)但是也已经被用做抗炎剂,像由沙雷氏菌属(Serratia sp.)菌株E-15产生的金属蛋白酶(Nakahama et al.)。嗜水气单胞菌(机会人和鱼致病菌)被发现产生两种不同类型的胞外蛋白酶,温度稳定的金属蛋白酶和温度不稳定的丝氨酸蛋白酶(Leung et al.)。
环境菌株,尤其是当位于土壤表面或靠近河流岸边时,一直在不稳定环境的影响之下。有规律的日变化的温度、湿度、存在或缺乏光或营养物等等倾向于将选择压力强加给这些细菌,当考虑人为因素时增加。后者可以是从不同类型的缓慢连续污染(化学品、杀害虫剂、粪便污染的废水等等)到快速工业有毒物质排放。全部这些因素诱导主动选择高抗性的专门细菌细胞,和同时主动选择必定拥有对付如此种类巨多的外部压力的大量响应的细菌。如此苛刻的条件反映在环境菌株很成功地从不同来源和通过不同降解机理获取营养物,很成功地承受外部条件变化但是还对邻近微生物具有高竞争力(在生存的无声之战中使用可靠的武器)。在这些过程中涉及的机理和产生的生物分子是直接经受真实情境考验的数十亿年进化的结果,它们的功效由携带物种的生存所证明。因此,对筛选用于生物体的生物防除应用的分子来说,这样的群体成为优秀的储主。
恶臭假单胞菌(主要在土壤中发现的假单胞菌科)是能够化学异养胞外消化腐烂的物质的腐生性营养微生物。作为最充分适应环境的细菌之一,恶臭假单胞菌拥有一系列基因上附入的适应技能,允许不仅主动捕获周围营养物而且控制其他竞争对手(细菌和真菌),控制其他竞争对手是通过影响它们的生长(通过分泌有毒的或抗增殖的化合物)(Gjermansen et al.,Tsuru et al.)。
在实施例4中,进行选择以检测能够产生相关胞外化合物的环境假单胞菌菌株,该胞外化合物作为防污剂用于生物技术应用,是天然产生的并且对环境群体无毒。假单胞菌属菌株在环境中是普遍存在的并且在高污染区域持久生存(Madigan et al.)。进一步显示它们主动分泌与细菌通信有关的分子,像与群体感应有关的高丝氨酸内酯自体诱导物(Charlton et al.,Huang et al.)、不同类型的铁载体,像铜绿假单胞菌铁载体(pyoverdine)或绿脓青素(Meyer et al.),胞外多糖和几个不同的酶,包括胞外蛋白酶(Liu 1974)。当考虑生物技术应用时,收集分泌的生物分子的可行性显示了几个令人关注的优势。不仅促进了分析表征和使用所必需的它们的大量回收,而且分子通常被分泌到环境中,它们比细胞内分子原则上应更稳定并且因此对自发降解更有抗性。
在测试的菌株中,假单胞菌PF-11被确立为例外的蛋白酶分泌菌株,其产生能够降解酪蛋白,全部大肠杆菌蛋白提取物和海胆分泌的粘合剂的蛋白酶,或更可能是,蛋白酶的混合物。此外,检测到的活性在大的温度区间中保持相当的稳定并且呈现很低的转换率。这个蛋白水解活性依赖PF-11细胞培养物的上清液中存在的分泌蛋白酶。如上面描述的,蛋白酶一直被认为是用于防污涂料应用的良好候选酶。
另外,由这个菌株产生的上清液混合物和单独大批培养物都能够破坏附着到玻璃基片上的海洋生物膜和海胆粘合剂印迹。在很大程度上,这些效果可归因于使用的溶液中存在蛋白酶,因为天然结构的蛋白质的拆除足以废止任何破坏。的确,基于蛋白质的粘合剂结构,无论是海胆的还是存在于海洋生物膜中的不同微生物的粘合机制的,都构成蛋白质水解的理想靶标,和随后的污染破坏。但其他调控元素可与这个分泌的混合物结合并且联合在一起对粘合剂完整性产生如此强烈的影响。假单胞菌PF-11的分泌蛋白质组显然构成极其相关的潜在防污化合物的富有且复杂的混合物。
从环境分离的菌株假单胞菌PF-11能够分泌蛋白酶,很可能和其他化合物的浓缩混合物,该混合物在小面积污染和大面积污染事件中都强有力地促进防污效果。为了确定生物污染去除中涉及的主动参与者,表征这个分泌混合物的防污成分是必需的并且是这个研究的逻辑上的进行持续。它的感观潜力远远超过了检测到的蛋白水解活性。鉴定参与这个过程的分子将不仅使生物粘附的机制更清楚,而且必定有助于提供一系列新颖的环境友好的生物活性分子,尤其是在海洋生物污染消除策略中可能成为几个生物污染危害的部分解决方案。
蛋白酶
蛋白酶是执行其他蛋白质或寡肽的蛋白质水解的酶,水解连续氨基酸之间的肽键。在肽链内部通过肽链内切酶,亲核攻击发生(nucleophylic attack)可与特定氨基酸关联,或者在蛋白质末端,通过外肽酶,它可以是非特定的。因此底物部分分解为较短的链或寡肽,或完全释放它们的氨基酸构建结构(amino acidic building blocks)(Barrett 2001)。这些生物催化剂被界定为酸性的、中性的或碱性的,与它们发挥它们的活性的pH范围相一致(Gupta,Beg et al.2002)。根据它们的催化机制,底物专一性乃至蛋白质小分子抑制剂,蛋白酶还可以分为天冬酰胺肽裂解酶,或天冬氨酸、半胱氨酸、谷氨酸、丝氨酸、苏氨酸和金属蛋白或未知的催化类型的肽酶(Rawlings,Barrett et al.2012)。迄今为止,全部的最充分研究的是胞外细菌蛋白酶并且这些之中,是丝氨酸和金属蛋白酶(Wu et al.)。
对生物催化剂的世界范围内的需求在2013有望达到$7十亿。今天蛋白酶代表工业酶的主要组中的一个并且许多清洁剂稳定蛋白酶由于它们的广泛使用已经被分离和表征了(GCI 2009)。胞外细菌蛋白酶(EBP)在生物工程和工业背景下呈现几个独特的特征:它们被翻译为前肽,并且被细胞分泌(由于在生长培养基中变得天然可获取,避免了取得它们的非常规的方法以并且进一步允许培养物被维持同时回收感兴趣的化合物),并且进一步它们仅仅在细胞外变得有活性(因此在过度表达时没有形成毒性并且没有由于过度积累减少培养物生长和被维持的能力)。然后,酶的活化型是通过自加工(通过在成熟时断裂的分子内伴侣)(Kessler and Ohman 2004;Gao,Wang et al.2010)或由其他的充当它们的调控子的蛋白酶帮助(Kessler,Safrin et al.1998)实现的。除这些方面之外,胞外蛋白酶通常依赖该隔离群生长的环境呈现最佳的温度、pH(和pI)和离子强度,所以有可能使想要活性的筛选朝某一隔离群菌株变窄(根据它们的起源),因为有可能诱导在极端条件下培养物和蛋白质适应生长和发挥作用,创造朝某一环境、溶剂或温度的人为诱导的进化压力。而且,分泌的生物催化剂通常天然呈现有趣的热量、pH乃至盐稳定性,因为它们在细胞外是没有缓冲的(Wu and Chen et al.2011)。
但是,如果蛋白酶是普遍存在的,由于表达水平或由于下游加工要求和随后的生产成本,同样由于缺乏底物专一性,或溶剂稳定性/活性,它们中的大多数不是工业原料;这就要说到它们对用于它们预期用途的条件的(无)适应性(Gupta,Beg et al.2002)。虽然如此,自从1999以前以来细菌蛋白酶代表大多数工业蛋白酶产品,并且它们的市场只会增长(Godfrey and West 1996;Kumar and Takagi 1999)。
参考文献:
Abarzua,S.and S.Jakubowski,Biotechnological investigation for the prevention of biofouling I.Biological and biochemical principles for the prevention of biofouling..Marine Ecology Progress Series 1995.123:p.301-12.
Aldred,N.and A.S.Clare,The adhesive strategies of cyprids and development of barnacle-resistant marine coatings.Biofouling,2008.24(5):p.351-63.
Al-Tahhan,R.A.,et al.2000.Rhamnolipid-induced removal of lipopolysaccharide from Pseudomonas aeruginosa:effect on cell surface properties and interaction with hydrophobic substrates.Appl Environ Microbiol 66:3262-8.
Angilletta,M.J.,Jr.,R.B.Huey,and M.R.Frazier,Thermodynamic effects on organismal performance:is hotter better?Physiol Biochem Zool,2010.83(2):p.197-206.
Arnesen,J.A.et al.(1995),Partial purification and characterization of extracellular metalloproteases from Aeromonas salmonicida ssp.salmonicida.J Fish Dis 18,283–295.
Asthana,N.et al.(2004),Dissection of antibacterial and toxic activity of melittin:a leucine zipper motif plays a crucial role in determining its hemolytic activity but not antibacterial activity.J Biol Chem 279,55042–55050.
Barrett,A.(2001).Proteolytic enzymes:nomenclature and classification.In:Beynon R,Bond JS(eds)Proteolytic enzymes.A practical approach,2nd edn.Oxford University Press,Oxford."1-21.
Bertolini,J.M.,Rohovec,J.S.(1992)."Electrophoretic detection of proteases from different Flexibacter columnaris strains and assessment of their variability".Diseases of Aquatic Organisms12:121–128.
Boman,H.G.,Peptide antibiotics and their role in innate immunity.Annu Rev Immunol.1995;13:61-92.
Boucher,H.W.,G.H.Talbot,J.S.Bradley,et al.Bad bugs,no drugs:no ESKAPE!An update from the Infectious Diseases Society of America.Clin Infect Dis.2009;48:1–12.
Charlton,T.S.,et al.,A novel and sensitive method for the quantification of N-3-oxoacyl homoserine lactones using gas chromatography-mass spectrometry:application to a model bacterial biofilm.Environ Microbiol,2000.2(5):p.530-41.
da Costa,G.et al.(2011),Beyond genetic factors in familial amyloidotic polyneuropathy:protein glycation and the loss of fibrinogen's chaperone activity.PLoS One 6(10):e24850.
Dafforn,K.A.,J.A.Lewis,and E.L.Johnston,Antifouling strategies:history and regulation,ecological impacts and mitigation.Mar Pollut Bull,2011.62(3):p.453-65.
Department of Health and Human Services.Center for Drug Evaluation and Research Approval Package For:Application Number 21-572–Approval Letter(s).2003.
Dobretsov,S.,et al.,Novel antifoulants:inhibition of larval attachment by proteases.Mar Biotechnol(NY),2007.9(3):p.388-97.
ECDC/EMA j oint technical report.The bacterial challenge:time to react.(September 2009).
Fj ell,C.D.et al.,Designing antimicrobial peptides:form follows function.Nat Rev Drug Discov.2011 Dec 16;11(1):37-51.
FAO/OIE/WHO.Joint FAO/OIE/WHO Expert Workshop on Non-Human Antimicrobial Usage and Antimicrobial Res istance:Scientific asses sment–Draft Report.Geneva,December 1–5,2003.
Gaby,W.L.,C.Hadley,Practical laboratory test for the identification of Pseudomonas aeruginosa.J Bacteriol.1957 Sep;74(3):356-8.
Gao,X.,J.Wang,et al.(2010).Structural basis for the autoprocess ing of zinc metalloproteases in the thermolysin family.Proc Natl Acad Sci U S A 107(41):17569-17574.
Garcia-Junco,M.,E.De Olmedo,and J.J.Ortega-Calvo.2001.Bioavailability of solid and non-aqueous phase liquid(NAPL)-dissolved phenanthrene to the biosurfactant-producing bacterium Pseudomonas aeruginosa 19SJ.Environ Microbiol 3:561-9.
GCI,G.C.I.(2009).World Enzymes Market-Industry Study with Forecasts for 2013&2018.Freedonia.
Giuliani,A.et al.,Antimicrobial peptides:natural templates for synthetic membrane-active compounds.Cell Mol Life Sci.2008 Aug;65(16):2450-60.
Gjermansen,M.,et al.,Characterization of starvation-induced dispersion in Pseudomonas putida biofilms:genetic elements and molecular mechanisms.Mol Microbiol,2010.75(4):p.815-26.
Godfrey,T.and S.West(1996).Introduction to industrial enzymology.In:Godfrey,T.,West,S.(eds.)Industrial enzymology,2nd edn.MacMillan Press,London.1-8.
Gudmundsdottir S.,Subtyping of Salmonella enterica serovar typhimurium outbreak strains isolated from humans and animals in Iceland.J Clin Microbiol.2003 Oct;41(10):4833-5.
Gupta,R.,Q.K.Beg,et al.(2002).Bacterial alkaline proteases:molecular approaches and industrial applications.Appl Microbiol Biotechnol 59(1):15-32.
Hancock,R.E.et al.,Antimicrobial and host-defense peptides as new anti-infective therapeutic strategies.Nat Biotechnol.2006Dec;24(12):1551-7.
Haj na,A.A.,Triple-Sugar Iron Agar Medium for the Identification of the Intestinal Group of Bacteria.J Bacteriol.1945 May;49(5):516-7.Huang,Y.L.,et al.,Presence of acyl-homoserine lactone in subtidal biofilm and the implication in larval behavioral response in the polychaete Hydroides elegans.Microb Ecol,2007.54(2):p.384-92.
International Chamber of Shipping(ICS),ICS_ICS&ISF,2009,available at marisec.org/shippingfacts/home/,01/01/2012).
International convention on the control of harmful antifouling systems on ships.International Maritime Organisation,London.
Kaplan,W.et al.,Priority Medicines for Europe and the World,Geneva:World Health Organization(2004).
Kessler,E.and D.E.Ohman(2004).Pseudolysin.In:Barret,A.J.,Rawlings,N.D.(eds.)Handbook of proteolytic enzymes,vol.1,2nd edn.Elsevier,Amsterdam.401-409.
Kessler,E.,M.Safrin,et al.(1998).Elastase and the LasA protease of Pseudomonas aeruginosa are secreted with their propeptides.J Biol Chem 273(46):30225-30231.
Kumar,C.G.and H.Takagi(1999).Microbial alkaline proteases:from a bioindustrial viewpoint.Biotechnol Adv 17(7):561-594.
Laemmli,U.K.,Cleavage of structural proteins during the assembly of the head of bacteriophage T4.Nature.1970 Aug 15;227(5259):680-5.
Lamy E.,et al.,Changes in mouse whole saliva soluble proteome induced by tannin-enriched diet.Proteome Sci.2010 Dec 15;8:65.
Leroy,C.,et al.,Effects of commercial enzymes on the adhesion of a marine biofilm-forming bacterium.Biofouling,2008.24(1):p.11-22.
Leung,K.Y.and R.M.Stevenson,Characteristics and distribution of extracellular proteases from Aeromonas hydrophila.J.Gen.Microbiol.,1988.134:p.151-160.
Liu,M.and A.Li,(Quorum sens ing involved in the regulation of secondary metabolism in streptomycetes--a review).Wei Sheng Wu Xue Bao,2011.51(5):p.571-8.
Liu,P.V.,Extracellular toxins of Pseudomonas aeruginosa.J Infect Dis,1974.130 Suppl(0):p.S94-9.
Livermore,D.M.,British Society for Antimicrobial Chemotherapy Working Party on The Urgent Need:Regenerating Antibacterial Drug Discovery and Development.Discovery research:the scientific challenge of finding new antibiotics.J Antimicrob Chemother.2011;66:1941–1944.
Ludtke,S.J.et al.,Membrane pores induced by magainin.Biochemistry.1996 Oct29;35(43):13723-8.
Madigan,M.and J.Martinko,Brock Biology of Microorganisms(11th ed.),ed.M.a.M.Madigan,J.2005:Prentice Hall.
Martínez,JL.Antibiotics and antibiotic resistance genes in natural environments.Science.2008 Jul 18;321(5887):365-7.
McKerrow,J.H.,V.Bhargava,et al.(2000).A functional proteomics screen of proteases in colorectal carcinoma.Mol Med 6(5):450-460.
Meireles C,Costa G,Guinote I,Albuquerque T,Botelho A,Cordeiro C,Freire P.(2013)Pseudomonas putida are environmental reservoirs of antimicrobial resistance toβ-lactamic antibiotics.World J Microbiol Biotechnol.2013Jul;29(7):1317-25.
Meyer,J.M.,et al.,Siderophore typing,a powerful tool for the identification of fluorescent and nonfluorescent pseudomonads.Appl Environ Microbiol,2002.68(6):p.2745-53.
Miller,J.H.,Experiments in Molecular Genetics.Cold Spring Harbor Laboratory Press,Cold Spring Harbor,NY,1972.
Nakahama,K.,et al.,Cloning and sequencing of Serratia protease gene.Nucleic Acids Res,1986.14(14):p.5843-55.
Nakazawa,T.and T.Yokota,Benzoate metabolism in Pseudomonas putida(arvilla)mt-2:demonstration of two benzoate pathways.J Bacteriol,1973.115(1):p.262-7.
Nelson,K.E.,et al.,Complete genome sequence and comparative analysis of the metabolically versatile Pseudomonas putida KT2440.Environ Microbiol,2002.4(12):p.799-808.
Nestler,H.P.and A.Doseff,A two-dimensional,diagonal sodium dodecyl sulfate-polyacrylamide gel electrophoresis technique to screen for protease substrates in protein mixtures.Anal Biochem,1997.251(1):p.122-5. E.,E.A.Trafny.Secretion of proteases by Pseudomonas aeruginosa biofilms exposed to ciprofloxacin.Antimicrob Agents Chemother.2005 Aug;49(8):3281-8.
Olsen,S.M.,et al.,Enzyme-based antifouling coatings:a review.Biofouling,2007.23(5-6):p.369-83.
O'Toole,G.et al.2000.Biofilm formation as microbial development.Annu Rev Microbiol 54:49-79.
Palleroni,N.J.,The Pseudomonas story.Environ Microbiol,2010.12(6):p.1377-83.
Parisien,A.et al.(2008),Novel alternatives to antibiotics:bacteriophages,bacterial cell wall hydrolases,and antimicrobial peptides.Journal of Applied Microbiology,104:1–13.
Payne,D.J.,M.N.Gwynn,D.J.Holmes,D.L.Pompliano.Drugs for bad bugs:confronting the challenges of antibacterial discovery.Nat Rev Drug Discov.2007;6:29–40.
Pettitt,M.E.,et al.,Activity of commercial enzymes on settlement and adhesion of cypris larvae of the barnacle Balanus amphitrite,spores of the green alga Ulva linza,and the diatom Navicula perminuta.Biofouling,2004.20(6):p.299-311.
Pontes,D.S.,et al.,Lactococcus lactis as a live vector:heterologous protein production and DNA delivery systems.Protein Expr Purif,2011.79(2):p.165-75.
Pouny,Y.,et al.,Interaction of antimicrobial dermaseptin and its fluorescently labeled analogues with phospholipid membranes.Biochemistry.1992 Dec 15;31(49):12416-23.
Priest,F.G.,Synthes is and secretion of extracellular enzymes by bacilli.Microbiol Sci,1985.2(9):p.278-82.
Prij ambada,I.D.,et al.Emergence of nylon oligomer degradation enzymes in Pseudomonas aeruginosa PAO through experimental evolution.Appl Environ Microbiol.1995 May;61(5):2020-2.
Railkin,A.I.,Marine biofouling:colonization processes and defences.Boca Raton:CRC Press LLC,2004.
Rawlings,N.D.,F.R.Morton,and A.J.Barrett,MEROPS:the peptidase database.Nucleic Acids Res,2006.34(Database issue):p.D270-2.
Rawlings,N.D.,A.J.Barrett,et al.(2012)."MEROPS:the database of proteolytic enzymes,their substrates and inhibitors."Nucleic Acids Res 40(Database issue):D343-350.
Roy,K.,et al.,Adhes in degradation accelerates delivery of heat-labile toxin by enterotoxigenic Escherichia coli.J Biol Chem.286(34):p.29771-9.
Sambrook,J.,T.Maniatis,and E.F.Fritsch,Molecular Cloning:A Laboratory Manual,2nd Ed.Cold Spring Harbor Laboratory Press,Cold Spring Harbor,NY.,1989.
Santos,R.and P.Flammang,Morphology and tenacity of the tube foot disc of three common European sea urchin species:a comparative study.Biofouling,2006.22(3-4):p.187-200.
Santos,R.,et al.,Adhesion of echinoderm tube feet to rough surfaces.J Exp Biol,2005.208(Pt 13):p.2555-67.
Santos,R.,et al.,First ins ights into the biochemistry of tube foot adhesive from the sea urchin Paracentrotus lividus(Echinoidea,Echinodermata).Mar Biotechnol(NY),2009.11(6):p.686-98.
Selsted,M.E.,A.J.Ouellette.Mammalian defensins in the antimicrobial immune response.Nat Immunol.2005 Jun;6(6):551-7.
Schultz,M.P.,Effects of coating roughness and biofouling on ship res istance and powering.Biofouling,2007.23(5-6):p.331-41.
Shai,Y.,From innate immunity to de-novo designed antimicrobial peptides.Curr Pharm Des.2002;8(9):715-25.
Smith,A.M.,The biochemistry and mechanics of gastropod adhes ive gels.Biological adhes ives,ed.C.J.e.Smith AM.2006:Springer,Berlin.167-182.
Snoek-van Beurden P.A.,J.W.Von den Hoff.Zymographic techniques for the analysis of matrix metalloproteinases and their inhibitors.Biotechniques.2005 Jan;38(1):73-83.
Thomas,K.V.and S.Brooks,The environmental fate and effects of antifouling paint biocides.Biofouling.26(1):p.73-88.
Townsin,R.L.and C.D.Anderson,Fouling control coatings using low surface energy,foul reliese technology.Woodhead Publishing Limited,Cambridge.2009:p.693-708.
Tsuru,D.,(Microbial enzymes and their inhibitors).Yakugaku Zasshi,1993.113(10):p.683-97.
Vooturi,S.K.et al.,Synthetic membrane-targeted antibiotics.Curr Med Chem.2010;17(21):2292-300.
Wang,Y.,et al.,The chemical characteristics of marine low-termperature alkaline protease Transactions of Oceanology and Limnology,2004.1:p.8-15.
Watanabe,K.,J.Sakai,and K.Hayano,Bacterial extracellular protease activities in field soils under different fertilizer managements.Can J Microbiol,2003.49(5):p.305-12.
Wilhelm,S.,et al.,Autotransporters with GDSL passenger domains:molecular physiology and biotechnological applications.Chembiochem,2011.12(10):p.1476-85.
Wu,J.W.and X.L.Chen,Extracellular metalloproteases from bacteria.Appl Microbiol Biotechnol,2011.92(2):p.253-62.
Yebra,D.M.,S.Kiil,and K.Dam-Johansen,Antifouling technology—past,present and future steps towards efficient and environmentally friendly antifouling coatings.Progress in Organic Coatings,2004.50(2):p.75-104.
Zasloff,M.Innate immunity,antimicrobial peptides,and protection of the oral cavity.Lancet.2002 Oct 12;360(9340):1116-7.
- 还没有人留言评论。精彩留言会获得点赞!